









Preview text:
BÀI TẬP NHIỆT ĐỘNG HÓA HỌC
Câu 1: Một hệ kín chứa 50g khí Argon (MAr = 39,94 g/mol; giả sử cho khí là lý tưởng)
được dãn nở đẳng nhiệt thuận nghịch từ thể tích 5 lít tới thể tích 10 lít ở nhiệt độ 298K. Tính:
1/ Công hệ tiến hành (??)
2/ P dP của quá trình trên. c
(Tính áp suất theo công thức P = nRT/V = mRT/MV = 50.0.082.(273.15+298)/(39.94*V)
P1 tương ứng với V1 = 5 litre, P2 tương ứng với V2 = 10 litres. deltaP = P1 – P2)
Câu 2: Một vật bị đẩy đi một khoảng cách z theo phương tác dụng của lực được cho bởi
công thức Fz = az + b (với a=300N.m-1; b=500N). Tính công cần thiết để di chuyển vật từ z=0 đến z=10m.
Công thức tính công là gì ? Có phải là A = F.s ? F1 = 300.0 + 500 F2 = 300.10 + 500 F = F2 – F1 A = F.s = F.10
Câu 3: Cho 1mol khí lý tưởng ban đầu được chứa trong xylanh có thể tích 22,4l ở nhiệt
độ 273K. Áp suất bên ngoài tăng lên 1,5105Pa và khí bị nén đẳng nhiệt bất thuận nghịch
tới áp suất trên. Tìm giá trị lớn nhất và nhỏ nhất của công có thể có.
Câu 4: Tính khối lượng nước lỏng khi nâng nhiệt độ của nó từ 250C đến 1000C bằng
cách cho nó tiếp xúc với 100g hơi nước có nhiệt độ 1000C. Cho biết nhiệt hóa hơi của
nước Hvap = 539,55cal/g và nhiệt dung của nước lỏng là Cp=4,184J/g.K
Áp dụng luật bảo toàn năng lượng: nhiệt nước lỏng thu được = nhiệt hơi nước ngưng tụ.
Nhiệt nước lỏng thu được: m.Cp.deltaT = m.4,184.(100-25)
Nhiệt hơi nước truyền cho: mhơi.Hvap = 100.539,55= 53955 (cal) = 53955.4,18 = ? (Jun)
m.4,184.(100-25) = 53955.4,18 => Suy ra m (gam)
Câu 5: Tính U của quá trình khi cho 1mol khí Ar từ nhiệt độ T=298K, V=2lit đến T=373K và V=20lit
Câu 6: Một hệ chứa 1mol khí Ar (xem như lý tưởng) dãn nở đoạn nhiệt bất thuận nghịch
từ thể tích 5lit, nhiệt đô 373K tới thể tích 20lit ở áp suất bên ngoài Pext=1atm. Tìm nhiệt
độ cuối của hệ. Cho biết nhiệt dung đẳng tích của Ar là Cv=3nR/2 PV=nRT => V1/V2 = T1/T2
Câu 7: Tính H khi thay đổi trạng thái 1mol heli từ thể tích 5lit, nhiệt độ 298K tới thể
tích 10lit ở nhiệt độ 373K. Cho Cp=5R/2 và khí xem như lý tưởng.
Câu 8: Tính H và nhiệt q khi cho 2mol nước lỏng quá lạnh (supercooled liquid water) ở
nhiệt độ -150C chuyển bất thuận nghịch sang pha rắn ở cùng một nhiệt độ -150C. Cho biết
nhiệt dung của nước ở trạng thái lỏng Cp,l=75,48J/mol.K; nhiệt dung của nước ở trạng
thái rắn Cp,r=37,15J/mol.K. Nhiệt nóng chảy Hfus=120,2kJ
Câu 9: Người ta thực hiện phản ứng nhiệt nhôm để khử Fe2O3 với tỷ lệ mol của các
chất phản ứng trong nguyên liệu tương ứng với tỷ lệ của các hệ số tỷ lượng trong phương trình phản ứng.
a/ Hãy viết phương trình cân bằng của phản ứng nhiệt nhôm nói trên
b/ Tính Enthalpy tiêu chuẩn của phản ứng ở 298K ( 0 H ) , 298 r
c/ Xác định khối lượng nhôm cần thiết cho phản ứng để sinh ra một lượng nhiệt là 1000kJ
d/ Xác định khối lượng nhôm cần thiết để nhiệt phản ứng sinh ra đủ để cung cấp cho
quá trình chuyển hóa 40g nước đá ở -100C đến trạng thái hơi ở nhiệt độ 1200C
Các số liệu nhiệt động liên quan được cho ở bảng sau: Fe2O3 Al2O3 H2O Nước đá Nước lỏng Hơi nước 0 H ( . 1 kJ mol ) -46,9 -95,5 f ,298 C (J. 1 K . 1 g ) 2,03 4,18 2,01 p 0 H ( . 1 kJ mol ) 6,01 fuss 0 H ( . 1 kJ mol ) 40,7 vap a, Fe2O3+2Al = Al2O3 + 2Fe
b, deltaHo (phản ứng) = (deltaHo(Al2O3) + 2.deltaHo(Fe)) – (deltaHo(Fe2O3) +2.deltaHo(Al) = -95,5-(-46,9) = ….
(chú ý deltaH o cua don chat bang 0)
Câu 10: Tính nhiệt tạo thành của amoniac ở điều kiện áp suất chuẩn và nhiệt độ 298K ( 0 H
) từ nhiệt của các phản ứng sau: f ( NH ),298 3 0
2H O 2H O(l) H 2 2 2 1 0
4NH 3O 6H O(l) 2N H 3 2 2 2 2 với: H 0 5 71 68 , kJ; H 0 1 53 , 0 28 kJ 1 2
Câu 11: Tính sự thay đổi enthalpy khi AgCl được đốt nóng từ nhiệt độ 298K đến 1000K ở áp suất chuẩn ( 0 0 H
H ) và tính tổng enthalpy của AgCl ở 1000K. Cho biết ở 728K 1000 298
AgCl bị nóng chảy và Hnc = 13,21kJ/mol, và:
- Nhiệt dung của AgCl ở thể rắn cho bởi phương trình sau: 5 30 , 11 10 0 3 C , 62 26 18 , 4 10 T (J/mol.K) p(r ) 2 T
- Nhiệt dung của AgCl ở thể lỏng từ khoảng nhiệt độ 728K đến 1000K xem như
không đổi và bằng 66,99 J/mol.K.
- Nhiệt tạo thành AgCl ở điều kiện chuẩn: H 0 1 26 8 , kJ / mol f ( AgCl),298
Câu 12: Xác định sự thay đổi enthalpy C), nội năng (U), và entropy (S), khi cho 2,7
kg nước ở áp suất p1 = 1,0133105 Pa và nhiệt độ T1 = 293K hoá hơi ở p2= 0,5066105 Pa và T long long 3
2 = 373K. Cho biết C C 187 , 4 10 J / kg K .
, ẩn nhiệt hoá hơi bằng p V
Hvap = 2260,98103 J/kg. Giả sử rằng hơi nước nhận được ở trạng thái khí lý tưởng. ( M
18 g / mol; R 314 , 8 J / mol K . ) H O 2
Câu 13: Tính lượng nhiệt Q, biến thiên nội năng U, biến thiên entropy S và công W
của 100g nitơ ở 00C và 1atm khi:
1/ Dãn đẳng nhiệt đến thể tích 200 lit
2/ Tăng áp suất tới 1,5atm khi thể tích không đổi
3/ Dãn đẳng áp tới thể tích gấp đôi Cho biết:
Cv = 5 cal/mol.K; MN2 = 28 g/mol
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K
Trong hệ SI: R = 8,314J/mol.K = 1,987 cal/mol.K
Câu 14: Trong công nghiệp metanol được tổng hợp theo phản ứng sau: CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k) H 0 , kJ / mol -110,5 - -201,2 f ,298
S 0 , J / K m . ol 197,9 130,7 238,0 298
C0 , J / K m . ol 28,6 27,8 8,4 + 0,125T p 1/ Tính 0 G
của phản ứng ở nhiệt độ 298K. , 298 r
2/ Thiết lập phương trình 0 H f (T) . T
Câu 15: Cho 100g khí CO2 (xem như lý tưởng) ở 00C và 1atm . Tính nhiệt Q, công W,
biến thiên nội năng U, biến thiên enthalpy H, và biến thiên entropy S trong các quá trình sau:
1/ Dãn đẳng nhiệt tới thể tích 0,2m3
2/ Dãn đẳng áp tới thể tích 0,2m3
3/ Đun nóng đẳng tích tới áp suất bằng 2atm Cho biết : C 8 , 8 75 cal / mol K . ; M 44g / mol P,CO2 CO2
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K
Trong hệ SI: R = 8,314J/mol.K = 1,987 cal/mol.K
Câu 16: Tính H0 , U0 , A0 , G0 , và S0 ở điều kiện chuẩn và nhiệt độ 298K đối với
phản ứng sau: C2H2(k) + 2H2O(l) = CH3COOH(l) + H2(k)
Các số liệu nhiệt động của các chất như sau: C2H2 H2O(l) CH3COOH(l) H2 H 0
, kJ / mol 226,75 -285,84 -484,9 0 f ,298
S 0 , J / K m . ol 200,8 69,96 159,8 130,6 298 G0
, kJ / mol 209,25 -334,46 -576,64 0 f ,298
Câu 17: Phát biểu nguyên lý thứ II của nhiệt động học. Viết các biểu thức toán học của
nguên lý II của nhiệt động học.
Tính S, Ssurr, q, W và U đối với quá trình dãn nở đẳng nhiệt thuận nghịch
3mol khí Argon (cho lý tưởng) từ thể tích 100 lit tới thể tích 500 lít ở nhiệt độ 298K
Câu 18: (2,5 điểm)
Tính q, W, U, S, H, A, và G trong quá trình bay hơi 1mol nước ở áp suất
P = 0,15atm, nhiệt độ T = 326,6K. Cho biết:
- Thể tích pha hơi và pha lỏng tương ứng là 10,21 m3/kg và 0,0010137 m3/kg
- Nhiệt hoá hơi Hvap = 2370 J/g ( 1atm Pa 101325 )
Câu 19: Lưu huỳnh (S) và lưu huỳnh (S) đều cấu tạo từ các phân tử S8. Ở 368,3K tồn tại cân bằng sau: S S (1) a/ Tính 0
H của quá trình (1). Cho biết nhiệt tạo thành SO 298 2(k) từ S bằng 0 H -296,8k J/mol và từ S bằng 0 H -299,7k J/mol , 298 f (SO ) f SO 2 , 298 ( ) 2 b/ Tính 0
S của quá trình (1). Giả sử 0 H và 0 S
là hằng số đối với nhiệt độ. 298 Câu 20:
a/ Dựa vào biểu thức thống nhất của hai nguyên lý của nhiệt động học:
dU = TdS-PdV và hệ thức của hàm Helmholtz: dA = -PdV-SdT.
Hãy chứng minh đối với chất bất kỳ: U P T P V T T V
b/ Tính biến thiên entropy trong quá trình khuếch tán vào nhau của 28g N2 và 32g
O2, khi bỏ vách ngăn ngăn cách 2 buồng chứa khí có thể tích như nhau bằng 30 lít và có
cùng điều kiện về nhiệt độ và áp suất.
Câu 21: Cho phản ứng: 1 Ag +
Cl2 = AgCl ở áp suất P = 1atm và nhiệt độ T = 298K. 2 Tính 0 G
và cho biết phản ứng trên có tự xảy ra hay không? r ,298
Cho biết nhiệt tạo thành của AgCl, H 0 1 27 0 , 6 kJ 8 / mol f ( AgCl),298 và 0 S 07 , 96 J / mo . l K; 0 S 69 , 42 J / mo . l K; 0 S 223 0 , J / mo . l K; AgCl,298 Ag,298 Cl ,298 2
Câu 22: Cho 2 mol khí O2 và 1mol khí N2 trộn với nhau ở 298K. Áp suất của oxy và của
nitơ ban đầu bằng nhau và bằng i P i P
1,013105 Pa. Áp suất riêng phần của của O N 2 2
oxy và của nitơ trong hỗn hợp khí, lần lượt P 5 668 , 0 10 Pa; P 5 334 , 0 10 Pa. O N 2 2 Tính G , S , và H
đối với quá trình trộn lẫn hai khí. Câu 23:
Trong công nghiệp metanol được tổng hợp theo phản ứng sau: CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k) H 0 , kJ / mol -110,5 - -201,2 f ,298
S 0 , J / K m . ol 197,9 130,7 238,0 298
C0 , J / K m . ol 28,6 27,8 8,4 + 0.125T p a/ Tính 0 G
và K của phản ứng ở nhiệt độ 298K. , 298 r p
b/ Thiết lập phương trình 0 H f (T) . T Câu 24: Cho phản ứng sau: 1 3 NH (k) N (k) H (k) 3 2 2 2 2
a/ Tính độ phân ly của amôniac thành nitơ và hydrô ở nhiệt độ 473K, áp suất
chung của hệ lúc cân bằng là 1atm và 0,8atm.
b/ Có nhận xét gì về độ phân ly của NH3 khi thay đổi áp suất từ 1atm xuống còn
0,8atm. Rút ra kết luận chung.
Cho biết sự biến đổi enthalpy tự do chuẩn của phản ứng trên như sau: 0 G 43513 6 , 7 , 29 06T lg T 86 , 15 T (J / mol) T ,r Câu 25:
Cho SO2 phản ứng với O2 không khí ở 973oC có mặt chất xúc tác tạo thành SO3 theo phản ứng: 2SO2(k) + O2(k) 2SO3(k)
Khi cân bằng ở áp suất 1atm thu được hỗn hợp khí chứa: 0.25 mol SO2; 6.17 mol
O2; 12.30 mol SO3 và 81.28 mol N2. Tính:
a/ Hằng số cân bằng Kp ở 973oC.
b/ Thành phần ban đầu của hỗn hợp khí
c/ Tỉ lệ chuyển hóa SO2 thành SO3.
d/ Nếu trong hỗn hợp ban đầu không có N2, còn số mol SO2 và O2 vẫn giữ như cũ
thì tỉ lệ chuyền hóa là bao nhiêu? Ap suất của hệ khi cân bằng vẫn giữ là 1 atm. Câu 26:
Trong công nghiệp metanol được tổng hợp theo phản ứng sau: CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k) H 0 , kJ / mol -110,5 - -201,2 f ,298
S 0 , J / K m . ol 197,9 130,7 238,0 298
C0 , J / K m . ol 28,6 27,8 8,4 + 0,125T p a/ Tính 0 G
và K của phản ứng ở nhiệt độ 298K. , 298 r p
b/ Thiết lập phương trình 0 H f (T) . T Câu 27: Cho phản ứng sau: 1 3 NH (k) N (k) H (k) 3 2 2 2 2
a/ Tính độ phân ly của amôniac thành nitơ và hydrô ở nhiệt độ 473K, áp suất
chung của hệ lúc cân bằng là 1atm và 0,8atm.
b/ Có nhận xét gì về độ phân ly của NH3 khi thay đổi áp suất từ 1atm xuống còn
0,8atm. Rút ra kết luận chung.
Cho biết sự biến đổi enthalpy tự do chuẩn của phản ứng trên như sau: 0 G 43513 6 , 7 , 29 06T lg T 86 , 15 T
(J / mol) T ,r
Câu 28: Một hỗn hợp gồm 70% benzen (C6H6) và 30% toluen (C6H5CH3) (tính theo
phần khối lượng) tạo với nhau một dung dịch lý tưởng. Ở 300C áp suất hơi của benzen
bằng 120,2 mmHg và của toluen bằng 36,7 mmHg. Hãy xác định:
1/ Áp suất hơi riêng phần của từng cấu tử và áp suất hơi chung của dung dịch ở 300C
2/ Thành phần (theo phần mol) của các cấu tử trong pha hơi khi cân bằng với pha lỏng
3/ Vẽ đồ thị cân bằng lỏng hơi y - x của hệ đã cho (x, y nồng độ phần mol) Câu 29:
Một phương pháp điều chế HCl trong công nghiệp theo phản ứng sau: H 0 2(k) + Cl2(k) 2HCl(k) H , 184 42 kJ 298
1/ Tính số bậc tự do của cân bằng trong trường hợp tổng quát và trong trường hợp
phản ứng bắt đầu với số mol H2 bằng số mol Cl2
2/ Thiết lập phương trình 0 G
f (T) dựa vào bảng số liệu sau: T H2(k) Cl2(k) HCl(k) 0 S
(J / K.mol) 130,4 222,7 186,5 298 0
C (J / K.mol) 27,7 34,6 28,0 P
3/ Cho 0,01g H2 và 0,355g Cl2 vào bình chân không có dung tích không đổi ở
1000K và P = 1atm. Tính số mol HCl được tạo thành khi cân bằng.
Câu 30: Các chất A và B tạo thành một dung dịch lý tưởng. Có một dung dịch gồm 1
mol chất A và 2 mol chất B cân bằng với áp suất hơi của nó ở 500C dưới áp suất chung là
250mmHg. Nếu người ta thêm 1mol chất A vào dung dịch ở trên thì áp suất chung tăng
lên tới 300mmHg. Hãy xác định:
1/ Áp suất hơi bão hòa của A và B nguyên chất ở 500C
2/ Thành phần (theo phần mol) của các cấu tử trong pha hơi khi cân bằng với pha lỏng
3/ Vẽ đồ thị cân bằng lỏng hơi y - x của hệ đã cho (x, y nồng độ phần mol) Câu 31:
Cho phản ứng: COCl2(k) CO(k)+ Cl2(k)
1/ Tính số bậc tự do của hệ cân bằng
2/ Thiết lập phương trình 0 G
f (T) dựa vào bảng số liệu sau. Thừa nhận rằng H0 và T
S0 là hằng số đối với nhiệt độ: COCl2(k) CO(k) Cl2(k) 0 H (kJ / mol) -218,8 -110,5 - , 298 f 0 S
(J / K.mol) 283,4 197,6 223 298
3/ Nhiệt độ và áp suất ảnh hưởng đến cân bằng như thế nào?
4/ Tính độ phân ly của COCl2 ở 8000C và áp suất 1atm khi cân bằng được thiết lập Câu 32:
Cho phản ứng: CO(k) + H2O(k) = CO2(k) + H2(k)
Ở 9300C hằng số cân bằng của phản ứng trên bằng 1
1. Tính thành phần (%) của các chất ở trạng thái cân bằng khi cho 2mol CO tác dụng với 3 mol H2O
2. Thành phần hỗn hợp ở trạng thái ban đầu (%) phải bằng bao nhiêu để nhận
được 20% CO2 và 20% H2 ở trạng thái cân bằng
3. Thành phần hỗn hợp ở trạng thái cân bằng có thay đổi không khi thay đổi áp suất? Giải thích? Câu 33:
Điều chế HCl trong công nghiệp theo phản ứng sau: H 0 2(k) + Cl2(k) = 2HCl(k) H , 184 42 kJ , 298 r
1. Tính số bậc tự do của hệ trong trường hợp tổng quát và trong trường hợp phản
ứng bắt đầu với số mol H2 bằng số mol Cl2
2. Thiết lập phương trình 0 G
f (T) dựa vào bảng số liệu sau: T H2(k) Cl2(k) HCl(k) 0 S (J. 1 K . 1 mol ) 130,4 222,7 186,5 298 0 C (J. 1 K . 1 mol ) 27,7 34,6 28,0 P
3. Cho 0,01g H2 và 0,355g Cl2 vào bình chân không có dung tích không đổi ở
1000K và P = 1atm. Tính số mol HCl được tạo thành khi cân bằng.
Câu 34: Cho một lượng khí hydro vào bình chân không dung tích 4 lít sao cho áp suất
khí trong bình là 0,82atm ở 800K. Sau đó cho thêm 0,2 mol khí HI, xảy ra cân bằng sau: H2(k) + I2(k) 2HI(k)
Ở 800K hằng số cân bằng K = 37,2. Tính:
1. Áp suất chung của hệ khi cân bằng
2. Độ phân ly của HI
3. Áp suất riêng phần của mỗi khí trong hệ cân bằng.
Cho biết hằng số khí R = 0,082 lit.atm.mol-1.K-1; hệ SI: R = 8,314 J.mol-1.K-1
Câu 35: Benzen (C6H6) và toluen (C6H5CH3) tạo với nhau một dung dịch lý tưởng. Ở
300C áp suất hơi của benzen bằng 120,2 mmHg, của toluen bằng 36,7 mmHg. Hãy xác định:
1. Áp suất hơi riêng phần của từng cấu tử và áp suất hơi của dung dịch ở 300C
2. Thành phần của các cấu tử trong pha hơi khi cân bằng với pha lỏng
Nếu dung dịch được hình thành từ sự trộn 100g benzen với 100g toluen.
3. Vẽ đồ thị cân bằng lỏng hơi y - x của hệ (x, y nồng độ phần mol) Câu 36:
Cho SO2 phản ứng với O2 không khí ở 973oC có mặt chất xúc tác tạo thành SO3 theo phản ứng: 2SO2(k) + O2(k) = 2SO3(k)
Khi cân bằng ở áp suất 1atm thu được hỗn hợp khí chứa: 0.25 mol SO2; 6.17 mol
O2; 12.30 mol SO3 và 81.28 mol N2. Tính:
1. Hằng số cân bằng Kp ở 973oC.
2. Thành phần ban đầu của hỗn hợp khí
3. Tỉ lệ chuyển hóa SO2 thành SO3.
Câu 37: Ở 1atm nước sôi ở 1000C, nhiệt hóa hơi là 2249,25 (J/g), thể tích riêng của lỏng
là Vl = 1 (ml/g), của hơi là Vh = 1656 (ml/g). Xác định nhiệt độ sôi của nước ở 3 atm.
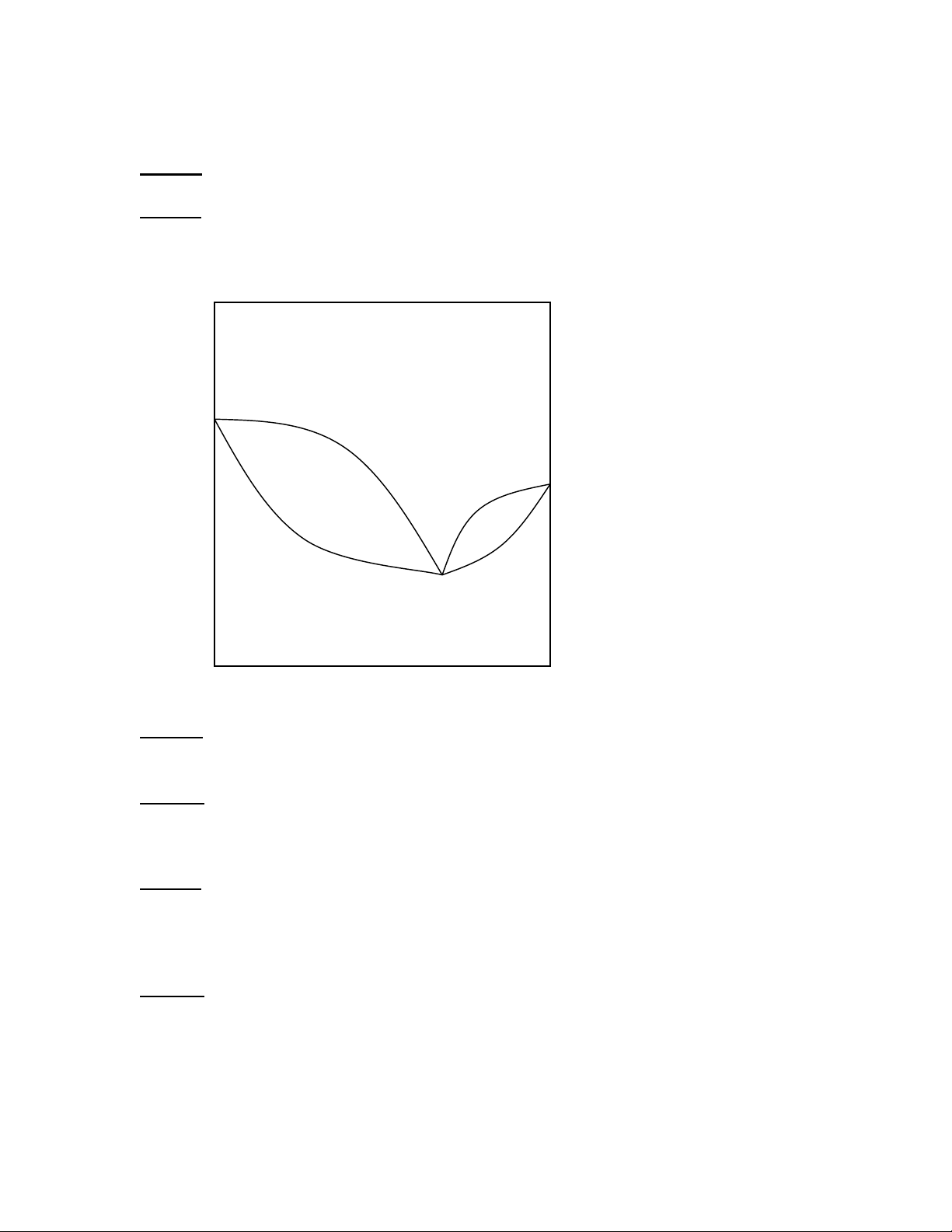
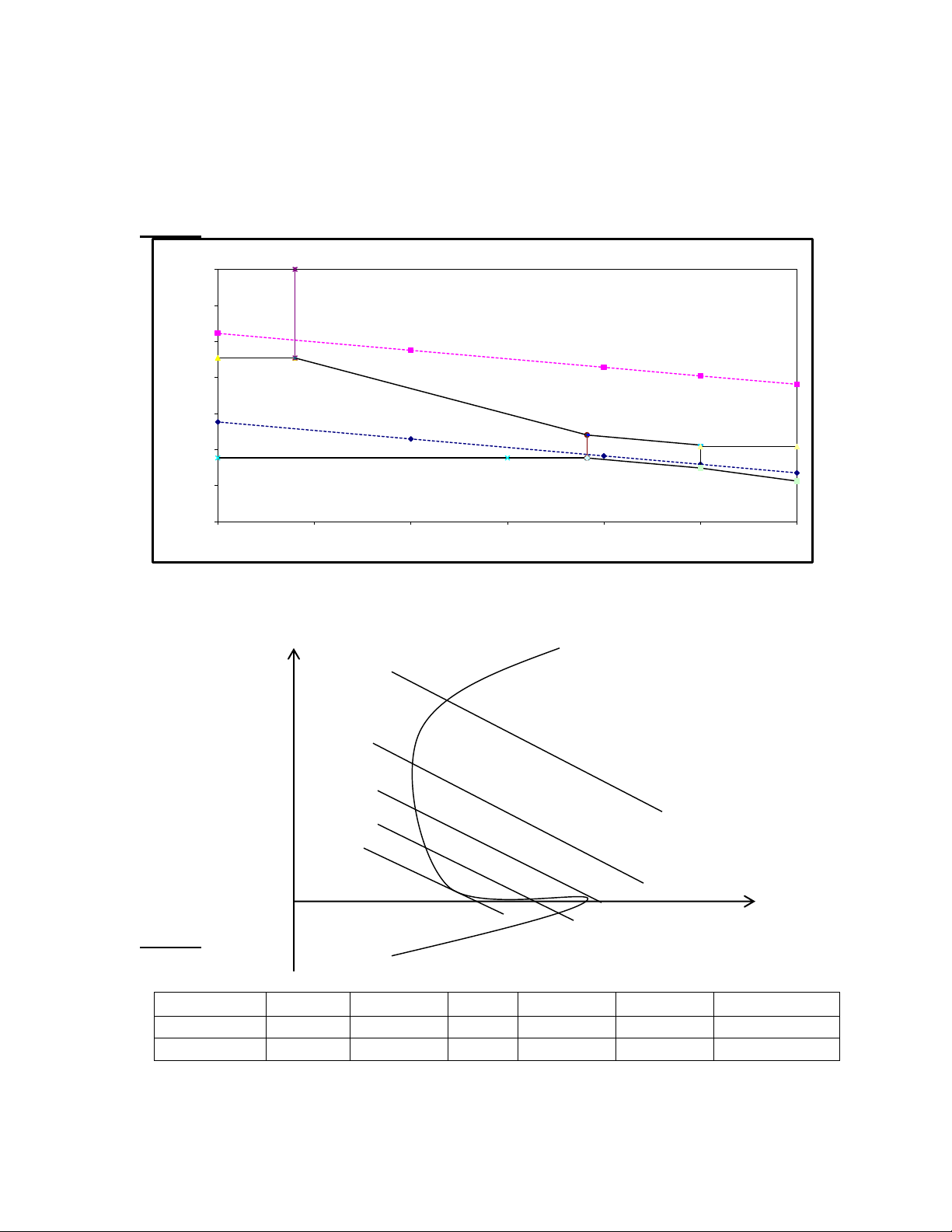
Câu 38: Từ đồ thị cân bằng lỏng – hơi ở dưới cho biết:
1/ Ý nghĩa của điểm K (nhiệt độ, thành phần của hỗn hợp)
2/ Trạng thái của hệ ở vùng trong đường cong A, B; vùng ngoài đường cong C, D? 0 t( C) D 1 A 2 B K C x
3/ Ý nghĩa của các đường cong 1, 2.
Câu 39: Xác định nhiệt độ bay hơi của nước ở 2atm nếu ở 1000C và 1atm nhiệt bay hơi
của nước bằng Hvap=2254,757 J/g. Cho biết thể tích của nước ở pha lỏng và pha hơi lần
lượt bằng V(l)=0,018 lít và V(g)=36,6 lít; khối lượng mol của nước bằng MH2O = 18g/mol
Câu 40: Một hỗn hợp 40% phenol trong nước phân thành hai lớp. Lớp thứ nhất chứa
70% phenol và 30% nước; lớp thứ hai chứa 8% phenol và 92% nước. Xác định số mol
của các chất trong mỗi lớp, nếu lượng hỗn hợp tổng cộng là 1kg.
Cho biết: MH2O = 18g/mol, Mphenol = 94g/mol
Câu 41: Áp suất hơi của axit xyanhydric HCN phụ thuộc vào nhiệt độ theo phương trình: lgP(mmHg) = 7,04 – 1237/T Tính:
a/ Nhiệt độ sôi ở điều kiện thường b/ Nhiệt hóa hơi
Câu 42: Một dung dịch lý tưởng ở 900C gồm toluen và xylen trong đó toluen chiếm
55,1% khối lượng; áp suất chung của hệ bằng 760mmHg. Tính:
a/ Áp suất riêng phần của toluen và xylen
b/ Nồng độ phần mol của toluen và xylen trong pha hơi cân bằng với với pha lỏng.
Cho biết áp suất hơi bão hòa của toluen ở 900C là 985mmHg. Trọng lượng phân tử của
toluen MT = 92kg/kmol và của xylen MX=106kg/kmol
BÀI TẬP ĐIỆN HÓA-ĂN MÒN Câu 1:
Có một chiếc pin như sau: Pt, H (P ) 1 ddHCl KCl Hg Cl , Hg 2 H bh 2 2 2
1/ Viết các phản ứng xảy ra trong pin (gồm phản ứng trên các cực và phản ứng tổng quát).
2/ Xác định pH. Cho biết sức điện động của pin ở 180C bằng 0.332 V và ở nhiệt
độ này thế của điện cực calomel bão hòa bằng 0.250 V. (R = 8.314 J/K.mol; F = 96500 C)
Câu 2: Trong số các kim loại sau đây, kim loại nào bị ăn mòn trong không khí ẩm có
pH=7 và nhiệt độ 250C : Fe, Cu, Pb, Ag? Cho biết thế điện cực chuẩn của kim loại tương
ứng bằng - 0.44; + 0.34; - 0.126; + 0.799 V. Cho biết áp suất riêng phần của oxy trong
không khí ẩm bằng 0.21 atm và E0 V 23 . 1
. Để kim loại bị ăn mòn, nồng độ của O / H O 2 2
nó không nhỏ hơn 10-6 mol/l.
Câu 3: Tính tốc độ ăn mòn của kẽm trong nước biển ở 250C. Cho biết thế ăn mòn bằng -
0.85 V, nồng độ Zn2+ bằng 10-6mol/l, thế điện cực chuẩn của kẽm bằng -0.76 V, hệ số
Tafel bằng 0.045 V và io,Zn = 10-2A/cm2.
Câu 4: Hai tấm sắt và thiếc tiếp xúc trực tiếp với nhau trong dung dịch có pH = 4, và đã
đuổi hết oxy hòa tan (PH2 = 1atm). Sắt và thiếc có bị ăn mòn trong dung dịch này không?
Tính sức điện động của pin? Chấp nhận rằng nồng độ ion tối thiểu để gây ăn mòn là 10-
6mol/l. Cho biết thế chuẩn của sắt và thiếc là - 0.44 và - 0.14 V.
Trường hợp có sự hòa tan oxy vào dung dịch (PO2 = 0.21 atm) thì sức điện động
của pin ăn mòn bằng bao nhiêu? Biết rằng E0 V 23 . 1 . O / H O 2 2
Câu 5: Thiết lập pin rồi tính sức điện động của nó (ở 250C), viết phản ứng xảy ra trong
pin và phản ứng tổng quát. từ các điện cực sau: Ag, AgBr Br (C 0 ) 34 . 0 E V 07 . 0 Br Fe3 C ( 2 0 E V 77 . 0 3 ), 1 . 0 Fe C ( 2 ) 02 . 0 Pt Fe Fe
Câu 6: Dựa vào sự đo ăn mòn sắt trong môi trường có pH = 3 ở 250C, không có sự hòa
tan oxy song lại bão hòa khí hydrô, ta thấy thế ăn mòn bằng -0.398 V.
1/ Hay tính tốc độ hòa tan sắt.
2/ Tính mật độ dòng trao đổi đối với phản ứng thoát hydrô trên sắt.
Cho biết thế điện cực chuẩn của sắt bằng -0.44 V; nồng độ Fe2+ bằng 0.02 mol/l;
mật độ dòng trao đổi của sắt bằng 9.10-7 A/cm2; R = 8.314 J/K.mol; F = 96500 C; hệ số
chuyển điện tích = 0.5. Câu 7:
Tính tốc độ ăn mòn đối với phản ứng xảy ra giữa một kim loại và một chất
khử cực biết rằng hiệu giữa hai điện thế Nernst tương ứng bằng 0.45 V, hệ số Tafel b b V 1 . 0
; mật độ dòng trao đổi của quá trình anốt và catốt bằng nhau và bằng 10-1 c a A/m2.
Câu 8: Khi tiến hành đo tốc độ ăn mòn của thép CT3 trong nước biển bằng phương pháp
ngoại suy Tafel người ta thu được phương trình biểu diễn đoạn thẳng trên nhánh anốt có dạng như sau:
Eanode = -0.4183 + 0.050logi (Eanode : Volt; i : mA/cm2). Hãy xác định:
1/ Hệ số chuyển điện tích thực nghiệm của quá trình anốt (thực nghiệm)
2/ Điện thế điện cực cân bằng của quá trình anốt ( cb EFe2 ). Biết trong quá trình / Fe
đo người ta sử dụng điện cực so sánh calomel bão hòa. Với 9 2 E 24 . 0 V;i 10 mA/ cm calomel 0,Fe Câu 9:
Có một chiếc pin như sau: Pt, H (P ) 1 ddHCl(a ) 15 . 0 KCl AgCl, Ag 2 H bh 2
1/ Viết các phản ứng xảy ra trên các điện cực và phản ứng tổng quát.
2/ Xác định sức điện động của pin ở 250C. Cho biết thế điện cực chuẩn của bạc- bạc clorua bằng 0.222 V. Câu 10:
Một tấm sắt có tổng diện tích 1000 cm2 được nhúng vào dung dịch muối
kẽm, đóng vai trò là catốt của bình điện phân (anốt của bình điện phân là một điện cực
trơ). Xác định bề bày của lớp kẽm bám vào catốt sau 25 phút biết mật độ dòng trung bình
bằng 2.5 A/dm2. Tỷ trọng của kẽm là 7.15 g/cm3, trọng lượng nguyên tử của kẽm là 65. Câu 11:
1/ Dựa vào tiêu chí nhiệt động lực nào để tiên đoán khả năng bị ăn mòn
hay bền vững của vật liệu bằng kim loại khi tiếp xúc với dung dịch? Viết phương trình
phản ứng cho phép tiên đoán một kim loại có bị ăn mòn khi tiếp xúc với dung dịch trong các trường hợp sau:
a/ H+ tham gia phản ứng catốt.
b/ Oxi tham gia phản ứng catốt
2/ Cho biết tại pH = 3 sắt có bị ăn mòn không (xét cả hai trường hợp trên)? Chấp
nhận ở điều kiện ăn mòn PH2=1atm, PO2 = 0.21atm, thế tiêu chuẩn của sắt bằng - 0.44 V, E0 V 23 . 1
, và nồng độ của Fe2+ bằng 10-6 mol/l. O / H O 2 2
3/ Tính sức điện động của pin ăn mòn trong cả hai trường hợp trên. Câu 12:
Viết các phản ứng xảy ra khi cho một tấm sắt vào trong dung dịch H2SO4
0.1M. Xác định tốc độ ăn mòn sắt trong dung dịch trên, tính theo các đơn vị sau: g/cm2.s; m/s; và mm/năm.
Cho biết mật độ dòng ăn mòn bằng 7.9410-4A/cm2, khối lượng riêng của sắt là 7.8g/cm3,
trọng lượng nguyên tử của sắt bằng 56. Câu 13:
1/ Dựa vào những tiêu chí nhiệt động lực học nào để tiên đoán khả năng
ăn mòn hay bền vững của vật liệu bằng kim loại khi tiếp xúc với dung dịch?
Hãy viết những phương trình cho phép tiên đoán một kim loại có thể bị ăn mòn
khi tiếp xúc với dung dịch trong các trường hợp sau:
a/ H+ tham gia phản ứng catốt.
b/ Oxi tham gia phản ứng catốt
2/ Dựa vào các tiêu chí nhiệt động ở trên hãy cho biết khả năng ăn mòn của thiết
(thế tiêu chuẩn bằng -0.136) trong dung dịch “nước” có pH = 7 và có sự hòa tan oxy ở
PO2 = 0.21 atm, chấp nhận thế chuẩn của oxy bằng +0.41V và nồng độ Sn2+ bằng 10-6 mol/l. Câu 14:
Tính cường độ dòng ăn mòn (Icorr) và điện thế ăn mòn (Ecorr) của một tấm
kẽm diện tích 9 cm2 tiếp xúc với một tấm sắt có diện tích 100 cm2, trong môi trường nước
ở 25oC. Cho biết mật độ dòng trao đổi bằng nhau và bằng 10-6 A/cm2, nồng độ các ion
bằng 10-6 mol/l và các thế chuẩn của kẽm và sắt tương ứng bằng -0.76 V và -0.44 V. Câu 15:
Khi nhúng một thanh kim loại vào dung dịch có pH = 5.5, điện thế bề mặt
của thanh kim loại đo được là -0.3 Volt (SHE). Thanh kim loại có bị ăn mòn trong dung
dịch trên hay không? Khi các trường hợp sau đây xảy ra:
1/ Dung dịch đã đuổi hết khí hòa tan (cho PH2 = 1atm)
2/ Dung dịch không đuổi khí (cho P 0 O2 = 0.21atm; E V 23 . 1 ) O / H O 2 2
3/ Tính sức điện động của pin ăn mòn. Câu 16:
Có một chiếc pin được viết sau: Sn Sn2 (a ) 35 . 0 Pb2 (a 0 , 0 0 ) 1 Pb
1/ Xác định dấu của các điện cực và viết các phản ứng xảy ra trên các điện cực và phản ứng tổng quát.
2/ Xác định sức điện động của pin ở 250C. Cho biết thế điện cực chuẩn của thiếc
và chì là -0,14V và -0,1265V. Câu 17:
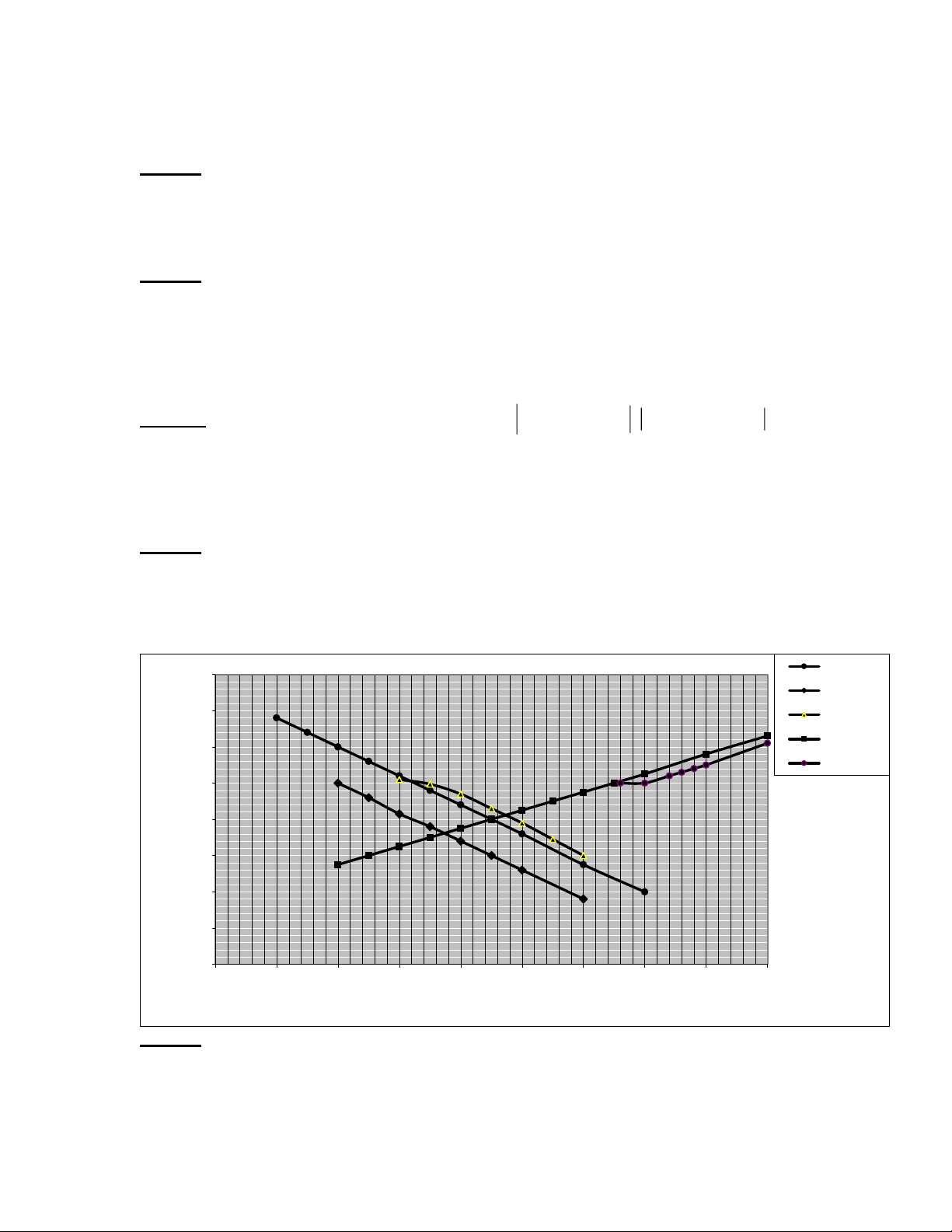
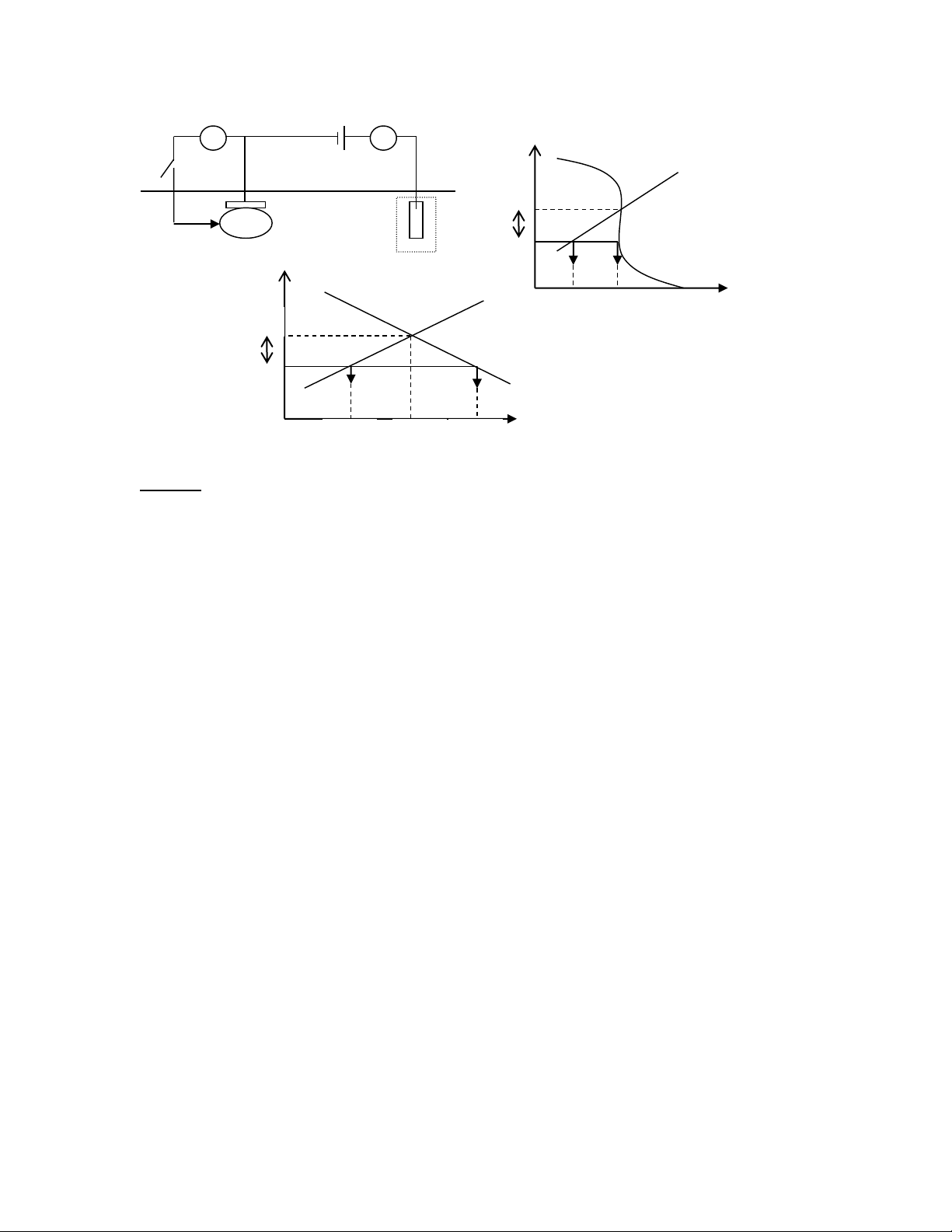
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của các điểm A, B, C, D.
2/ So sánh tốc độ ăn mòn của kim loại M trong dung dịch axit khi có mặt của chất oxy hoá trên.
3/ Xác định gần đúng điện thế ăn mòn và tốc độ ăn mòn của hệ )t ol Fe3+->Fe2+ v 0.6 ( E 2H+->H2 0.4 sum(ic) M->M+ 0.2 sum(ia) 0 -0.2 -0.4 -0.6 -0.8 -1 logi (mA/cm2) -9 -8 -7 -6 -5 -4 -3 -2 -1 0 Câu 18:
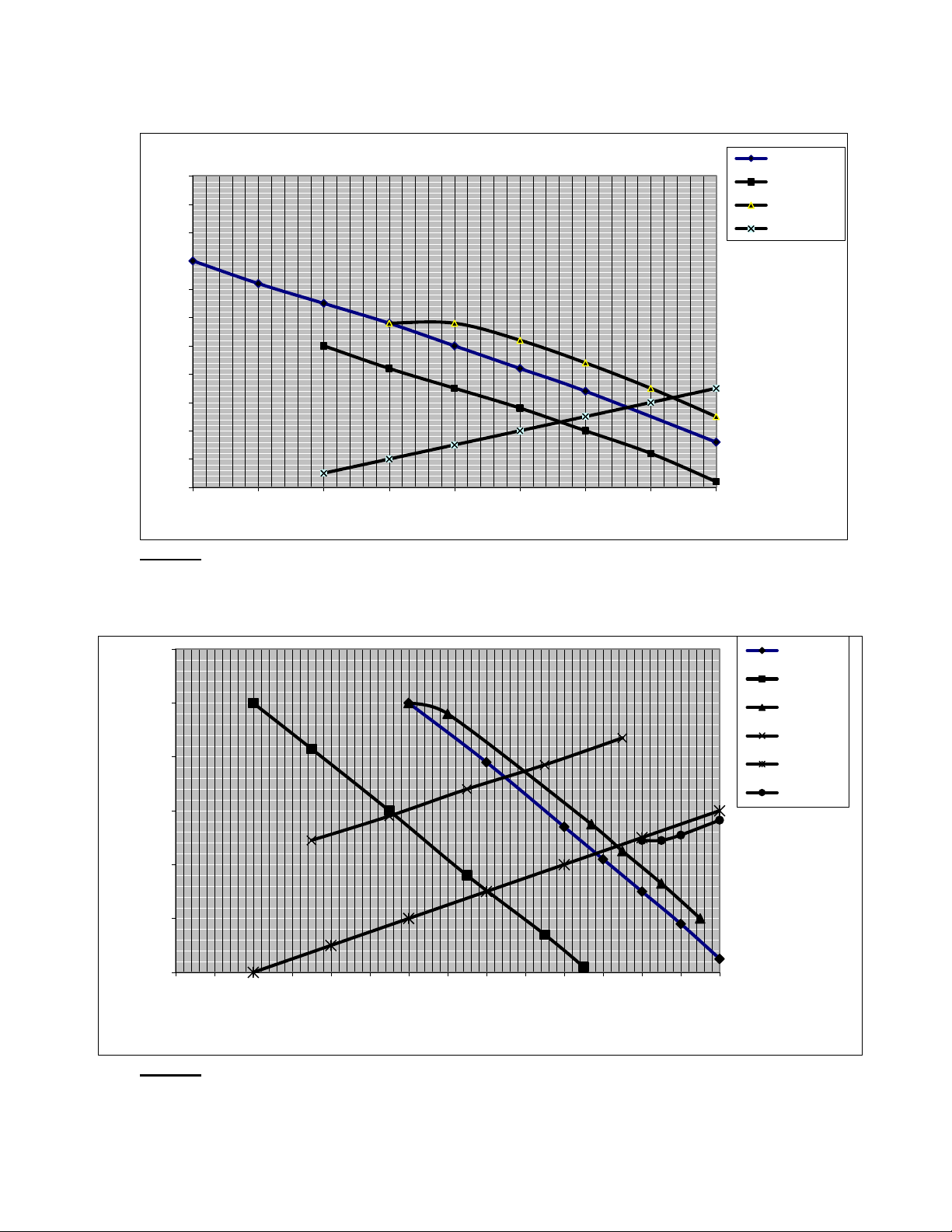
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của các điểm A, B, C.
2/ Nhận xét sự ảnh hưởng của chất oxy hoá đến tốc độ ăn mòn của Fe.
3/ Xác định gần đúng icorr,Fe trong dung dịch axit không có chất oxy hoá. )tl Fe3+-->Fe2+ 0.6 E(vo H+-->H2 0.5 sum(ic) 0.4 Fe-->Fe2+ 0.3 0.2 0.1 0 -0.1 -0.2 -0.3 -0.4 logi (A/cm2) -0.5 -8 -7.5 -7 -6.5 -6 -5.5 -5 -4.5 -4 Câu 19:
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của diểm A, B, C, D
2/ Xác định gần đúng tốc độ ăn mòn của kim loại M khi ghép đôi với kim loại N. t)l 0.2 o H+->H2(M) E(v H+->H2(N) 0 sum(ic) N->N+ -0.2 M->M+ sum(ia) -0.4 -0.6 -0.8 -1 logi (mA/cm2) -8 -7 -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 6
Câu 20: Dựa trên giản đồ E-pH của hệ Fe-H2O ở 250C và 1atm cho dưới đây:
1/ Hãy thiết lập phương trình đường (chỉ ra mối quan hê giữạ E-pH) của phản ứng:
Fe 2H O Fe OH (
) 2H e 2 2 2 Cho: C 2 C 3 C
10 6 mol / l;C 2 C ( )2 9 . 1 10 15; E 0 2 V 44 . 0 Fe Fe HFeO Fe OH Fe / Fe 2
2/ Ý nghĩa của giản đồ trên. Câu 21:
Dựa vào các đồ thị dưới đây hãy cho biết: ) V
Giaín âäö E-pH cuía hãû Fe-H2O ( E 2 2 1.5 Fe3+ 4 1 b 2 Fe(OH)3 0.5 7 Fe2+ 0 a 6 10 3 -0.5 1 Fe(OH)2 9 HFeO2- 5 Fe 8 -1 -1.5 2 4 6 8 10 12 14 pH
1/ Ý nghĩa các điểm A, B, C, D, E và X.
2/ So sánh sự ảnh hưởng của chất oxi hóa được thêm vào.
3/ Có nhận xét gì khi sử dụng chất oxy hóa để đưa kim loại vào trạng thái thụ động. E (V) 5 E 4 D 3 2 C 1 X B A logi Câu 22:
Cho hai hợp kim A và B (có khả năng thụ động) có các thông số điện hóa ở bảng sau: Ecorr(V) icorr(A/m2) a Epass(V)
ipass(A/m2) Equá thụ động(V) Hợp kim A -0.40 10-6 +0.25 0.0 10-5 +0.7 Hợp kim B -0.20 10-6.4 +0.25 +0.3 10-6 +1.2
1/ Vẽ đường cong phân cực của quá trình ăn mòn của hai hợp kim trên.
2/ Hợp kim nào sẽ dễ dàng được bảo vệ bằng phương pháp bảo vệ anốt hơn? Tại sao? Câu 23:
Hãy trình bày cơ chế hình thành màng oxyt nhôm (Al2O3) bằng phương pháp
anôt hoá; và cơ chế nhuộm màu màng nhôm. Muốn tăng chiều dày của màng oxyt nhôm
cần phải thay đổi các thông số kỹ thuật nào? Tại sao? Câu 24:
1/ Hãy vẽ đường cong phân cực đối với phản ứng ăn mòn kim loại Fe trong dung
dịch axit và tính điện thế ăn mòn (Ecorr) và tốc độ ăn mòn (icorr) từ đồ thị đã vẽ. Phản ứng: Fe = Fe2+ + 2e; E cb 2 V 45 . 0 ;i 2 10 7 A / cm2 ; V 25 . 0 a Fe / Fe 0,Fe / Fe 2H+ + 2e = H cb 6 2 2; E V 12 . 0 ;i 10 A / cm ; V 25 . 0 c H / H 0,H / H 2 2
2/ Sử dụng đồ thị trên cho biết tốc độ ăn mòn của kim loại Fe sẽ thay đổi như thế nào khi:
a/ Tăng nồng độ của ion H+.
b/ Làm giảm phản ứng hoà tan anốt. Câu 25:
Để bảo vệ một công trình bằng thép đặt dưới biển, người ta có thể sử dụng
phương pháp bảo vệ bằng protector (anod hi sinh). Những kim loại nào sau đây có thể
được dùng làm protector tốt nhất: Al; Zn; Cd; Ni ? Tại sao ? Hãy giải thích đối với các kim loại còn lại.
Cho biết điện thế điện cực chuẩn của các kim loại trên trong môi trường nước là: E 0 2 4 . 0 4 V 0 / SHE; E 0 3 6 . 1 6 V 0 / SHE; E 0 2 7 . 0 6 V 3 / SHE; Fe / Fe Al / Al Zn / Zn E 0 2 4 . 0 0 V 2 / SHE; E 0 2 2 . 0 3 V 0 / SHE Cd / Cd Ni / Ni Câu 26:
Dựa vào các dữ kiện sau để vẽ đồ thị E-logi của phản ứng ăn mòn sắt trong dung
dịch bảo hoà hydro và không chứa oxy, với pH=3.
* Đối với quá trình anốt: Fe = Fe2+ + 2e
Nồng độ của ion Fe2+ trong dung dịch: CFe2+=210-6 mol/l
Mật độ dòng trao đổi của Fe trong dung dịch trên: io,Fe=10-8 A/cm2
Điện thế điện cực chuẩn của Fe: E0 2 V 44 . 0 Fe / Fe
* Đối với quá trình catốt: 2H+ +2e = H2
Mật độ dòng trao đổi của ion H+ trong dung dịch trên: io,H2(Fe)=10-7 A/cm2
Cho biết hằng số Tafel trong tất cả các trường hợp bằng 0.25V.
1/ Hãy xác định điện thế ăn mòn (Ecorr) và tốc độ ăn mòn (icorr) của sắt.
2/ Mật độ dòng bảo vệ catốt phải bằng bao nhiêu để tốc độ ăn mòn của sắt bằng 0.
Rút ra kết luận gì cho trường hợp này? Câu 27:
Hãy trình bày cơ chế hình thành màng phốt phát trên kim loại đen bằng phương pháp
hóa học; Chiều dày và cấu trúc của màng phụ thuộc vào những thông số kỹ thuật nào? Câu 28:
1/ Hãy sử dụng các dữ kiện dưới đây để ve đường cong phân cực đối với phản
ứng ăn mòn kim loại Zn trong dung dịch axit loãng với pH=5; tính điện thế ăn mòn
(Ecorr) và tốc độ ăn mòn (icorr) của kẽm (bỏ qua các phản ứng khử phân cực khác). Phản ứng: Zn=Zn2++2e E 0 2 V 76 . 0 ;i 2 10 3 A / cm2 ; V 25 . 0 ;C 2 10 4 mol / l a Zn / Zn 0,Zn / Zn Zn 2H+ + 2e = H2 i 10 6
A/ cm2; V 25 . 0 0,H (Zn) c 2
2/ Sử dụng đồ thị trên cho biết tốc độ ăn mòn của kim loại Zn sẽ thay đổi như thế nào khi:
a/ Tăng nồng độ của ion H+.
b/ Giảm hệ số Tafel của phản ứng catốt. Câu 29:
1/ Hãy viết các phản ứng của quá trình ăn mòn thép trong nước sạch ở 25oC. Vẽ
minh hoạ các phản ứng đó lên đồ thị E-logi.
2/ Dựa trên cơ chế các phản ứng trên (hoặc trên đồ thị đã vẽ) hãy xác định tốc độ
ăn mòn của thanh thép đó. Cho biết màng sản phẩm hình thành Fe(OH)2 có chiều dày
0.05 cm; nồng độ oxy hòa tan trong nước là 0.2510-3mol/l; Hệ số khuyếch tán của oxy
trong nước là 210-5cm2/s. Câu 30:
1/ Hãy sử dụng các dữ kiện dưới đây để vẽ đường cong phân cực đối với phản
ứng ăn mòn kim loại M trong dung dịch axit; tính điện thế ăn mòn (Ecorr,M) và tốc độ ăn mòn (icorr,M) Phản ứng: M = M+ + e; Ecb V 7 . 0 ;i 10 8 A/ cm2 ; V 25 . 0 0,M a M / M 2H+ + 2e = H cb 6 2 2; E V 1 . 0 ;i 10 A / cm ; V 25 . 0 0,H ( M ) c H / H 2 2
2/ Sử dụng đồ thị trên, nhưng khi biết mật độ dòng giới hạn của phản ứng khử là
10-5 A/cm2. Hãy xác định lại điện thế ăn mòn (Ecorr,M) và tốc độ ăn mòn (icorr,M). Câu 31:
Sơ đồ hệ thống bảo vệ catod bằng dòng ngoài có thể lắp đặt như sau (hình 1a) và
sơ đồ đường cong phân cực khi bảo vệ kim loại trong môi trường axit không có oxy hòa
tan (hình 1b), và trong môi trường trung tính hay kiềm có oxy hòa tan (hình 1c) khi phân
cực catốt khoảng 120mV so với điện thế ăn mòn.
1/ Hãy cho biết tên đã được đánh số trong hình 1a
2/ Hãy xác định tốc độ ăn mòn của kim loại trước khi được bảo vệ và tốc độ ăn
mòn của kim loại sau khi đã áp đặt một mật độ dòng điện bằng nguồn ngoài (iađ) trong hai hình 1b và 1c
3/ Hãy giải thích tại sao trong môi trường axit sử dụng phương pháp bảo vệ catod
bằng dòng ngoài là không thực tế còn trong môi trường trung tính có oxy hòa tan là rất kinh tế. V A E(V) 4 Ecorr FeFe2+ + 2e 1 2 120mV 3 hình 1a 5 E(V) A/cm2 0,1 100 Ecorr FeFe2+ + 2e hình 1c 120mV 2H++2eH2 iađ hình 1b A/cm2 10-6 10-3 10-2 Câu 32:
Dựa vào sự đo ăn mòn sắt trong môi trường có pH = 3, ở 250C không có sự hòa
tan oxy song lại bão hòa khí hydro, ta thấy thế ăn mòn bằng -0.398 V, hệ số Tafel đối với
quá trình anốt a= 0,04 V, đối với quá trình catốt c=-0,12V
1/ Hãy tính tốc độ hòa tan sắt.
2/ Tính mật độ dòng trao đổi đối với phản ứng thoát hydrô trên sắt.
3/ Tính mật độ dòng bảo vệ catốt để cho tốc độ ăn mòn giảm tới 0.
Cho biết thế điện cực chuẩn của sắt bằng -0.44 V; hoạt độ Fe2+ bằng 0.02 mol/l;
mật độ dòng trao đổi của sắt bằng 9.10-7 A/cm2;




