















Preview text:
lOMoARcPSD|46342985 lOMoARcPSD|46342985
BÀI 1: KỸ THUẬT PHÒNG THÍ NGHIỆM....................................................................................3 I.
Giới thiệu:.................................................................................................................................3 1.
Các dụng cụ thủy tinh:........................................................................................................3 2.
Thiết bị trong phòng thí nghiệm:........................................................................................4 II.
Thực hành:...........................................................................................................................4 1. T
hí nghiệm 1: Sử dụng pipet .................................................................................................4 2. T
hí nghiệm 2: Sử dụng buret ................................................................................................4 3. T
hí nghiệm 3: Chuẩn độ oxy hóa – khử ................................................................................4 4. T
hí nghiệm 4: Pha loãng dung dịch ......................................................................................4 5. T
hí nghiệm 5: Kiểm tra nồng độ dung dịch axit đã pha loãng ..............................................5
BÀI 2: NHIỆT PHẢN ỨNG...............................................................................................................6 I.
Mục đích thí nghiệm:...............................................................................................................6 II.
Tiến hành thí nghiệm:..........................................................................................................6 1. T
hí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế ........................................................6 2. T
hí nghiệm 2: Hiệu ứng nhiệt của phản ứng trung hòa .........................................................7 3. T
hí nghiệm 3: Nhiệt hòa tan của ...........................................................................................7 4. T
hí nghiệm 4: Nhiệt hòa tan của ...........................................................................................8 III.
Trả lời câu hỏi:.....................................................................................................................8
BÀI 4: BẬC PHẢN ỨNG..................................................................................................................10 I.
Mục đích thí nghiệm:.............................................................................................................10 II.
Tiến hành thí nghiệm:.......................................................................................................10 1. X
ác định bậc phản ứng của Na 2 S 2 O
3 .................................................................................10 2. X
ác định bậc phản ứng của H 2 S
O 4 ....................................................................................12 III.
Trả lời câu hỏi:...................................................................................................................13
BÀI 8: PHÂN TÍCH THỂ TÍCH......................................................................................................15 I.
Mục đích thí nghiệm:.............................................................................................................15 II.
Tiến hành thí nghiệm:.......................................................................................................15 1. T
hí nghiệm 1: Xác định đường cong chuẩn độ HCl bằng NaOH ........................................15 2. T
hí nghiệm 2: Chuẩn độ axit mạnh – bazơ mạnh bằng chỉ thị phenolphtalein ....................16 3. T
hí nghiệm 3: Chuẩn độ axit mạnh – bazơ mạnh bằng chỉ thị metyl da cam ......................16 4. T
hí nghiệm 4: Chuẩn độ axit yếu -bazơ mạnh bằng chỉ thị phenolphtalein + metyl da cam 17 III. T
rả lời câu hỏi: . ..................................................................................................................17 1 lOMoARcPSD|46342985
BÀI 1: KỸ THUẬT PHÒNG THÍ NGHIỆM I. Giới thiệu:
1. Các dụng cụ thủy tinh:
a) Dụng cụ chứa hóa chất: cốc thủy tinh (becher). Mục đích: - Chứa đựng - Hòa tan Cách sử dụng: - Rửa sạch - Tráng nước cất - Tráng hóa chất
b) Dụng cụ phản ứng: bình tam giác (erlen), bình cầu. Mục đích: - Phản ứng - Chưng cất Cách sử dụng: - Rửa sạch - Tráng nước cất
c) Dụng cụ lấy hóa chất: ống đong, buret, pipet vạch, pipet bầu. Mục đích: -Xác định thể tích Cách sử dụng: - Rửa sạch - Tráng nước cất - Tráng hóa chất
d) Dụng cụ pha hóa chất: bình định mức. Mục đích: -Pha loãng dung dịch Cách sử dụng: 2 lOMoARcPSD|46342985 - Rửa sạch - Tráng nước cất
2. Thiết bị trong phòng thí nghiệm:
Cân kỹ thuật dùng để cân các khối lượng tương đối lớn (vài trăm g), khối
lượng nhỏ nhất mà cân kỹ thuật cân được khoảng 0,1g. II. Thực hành:
1. Thí nghiệm 1: Sử dụng pipet Cách sử dụng:
- Tay thuận cầm pipet
- Tay còn lại cầm quả bóp
- Dùng quả bóp hút hóa chất
- Chỉnh thể tích bằng ngón trỏ
Cách đọc thể tích đúng:
- Đặt mắt ngang với vạch cần đo, và mặt cong nhất của dung dịch
phải chạm đến vạch cần đo thì kết quả đo mới chính xác.
2. Thí nghiệm 2: Sử dụng buret Cách sử dụng:
- Cho hóa chất lên buret - Chỉnh bọt khí - Chỉnh về vạch 0
- Đóng, mở bằng tay trái
Cách đọc thể tích đúng:
- Đặt mắt ngang với vạch cần đo, và mặt cong nhất của dung dịch
phải chạm đến vạch cần đo thì kết quả đo mới chính xác.
3. Thí nghiệm 3: Chuẩn độ oxy hóa – khử -
4. Thí nghiệm 4: Pha loãng dung dịch 3 lOMoARcPSD|46342985 - Pha loãng L => L R=>L R+ =L=>L định mức
- Hút 10 ml HCL 1M +100ml ddA * LT: 1 x 10 = x 100
5. Thí nghiệm 5: Kiểm tra nồng độ dung dịch axit đã pha loãng
Dùng chất chỉ thị màu phenolphtalein để kiểm tra nồng độ dung dịch axit đã
pha loãng. Nếu tỉ lệ mol giữa NaOH và HCL là 1:1 thì khi nhỏ giọt chỉ thị dd
sẽ không đổi màu. Nếu nồng độ NaOH nhiều thì khi nhỏ giọt chỉ thị dd sẽ đổi màu. - NaOH + HCLNaCL + *LT: *TT: 0,1 x b = x 10
b = 10 => = 0,1: pha loãng + chuẩn độ đúng.
b 10 => 0,1: pha loãng hay chuẩn độ sai.
BÀI 2: NHIỆT PHẢN ỨNG 4 lOMoARcPSD|46342985 I.
Mục đích thí nghiệm:
- Trong thí nghiệm này, chúng ta sẽ đo hiệu ứng nhiệt của các phản ứng khác
nhau và kiểm tra lại định luật Hess. II.
Tiến hành thí nghiệm:
1. Thí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế Mô tả thí nghiệm:
- Lấy 50ml nước ở nhiệt độ phòng cho vào becher bên ngoài đo nhiệt độ .
- Lấy 50ml nước khoảng cho vào nhiệt lượng kế. Sau khoảng hai phút, đo nhiệt độ .
- Dùng phễu đổ nhanh 50ml nước ở nhiệt độ phòng vào 50ml nước nóng trong
nhiệt lượng kế. Sau khoảng hai phút, đo nhiệt độ . Công thức tính:
- Khi đó: nhiệt do nước nóng và becher tỏa ra = nhiệt nước lạnh hấp thụ => trong đó: m – khối lượng Nhiệt độ Lần 1 Lần 2 Lần 3 29,5 64 47 (cal/độ) 1,47
- Do giá trị có nghĩa trong khoảng , vì thế nếu trong quá trình đo nhiệt độ và
tính toán số liệu ngay từ lần 1 mà giá trị đã có nghĩa thì ta không cần tiến
hành đo lần 2 hay lần 3 nữa. Kết quả thu được: .
2. Thí nghiệm 2: Hiệu ứng nhiệt của phản ứng trung hòa HCl và NaOH 5 lOMoARcPSD|46342985 Mô tả thí nghiệm:
- Dùng buret lấy 25ml dung dịch NaOH 1M cho vào becher 100ml để bên ngoài. Đo nhiệt độ .
- Dùng buret lấy 25ml dung dịch HCl 1M cho vào trong nhiệt lượng kế. Đo nhiệt độ .
- Dùng phễu đổ nhanh becher chứa dung dịch NaOH vào HCl chứa trong
nhiệt lượng kế. Khuấy đều dung dịch trong nhiệt lượng kế. Đo nhiệt độ . Công thức tính: Nhiệt độ Lần 1 Lần 2 Lần 3 29 29 29 29 35 35 Q (cal) 308,82 308,82 (cal) 308,82 (cal/mol) -12352,8
- Nếu khoảng sai số khi đo nhiệt độ giữa lần 1 và lần 2 không quá 0,5 độ thì
chúng ta không cần thực hiện lần đo thứ 3 nữa. Kết quả thu được: ,
Kết luận: : Phản ứng trung hòa giữa HCl và NaOH là phản ứng tỏa nhiệt.
3. Thí nghiệm 3: Nhiệt hòa tan của khan Mô tả thí nghiệm:
- Cho vào nhiệt lượng kế 50ml nước. Đo nhiệt độ .
- Cân chính xác 4g khan. 6 lOMoARcPSD|46342985
- Cho nhanh 4g vừa cân vào nhiệt lương kế, khuấy đều cho tan hết. Đo nhiệt độ . Công thức tính: Lần 1 Lần 2 Lần 3 m 4 4 30 30 35,5 35 Q (cal) 305,085 277,35 (cal/mol) -12203,4 -11094 (cal) 291,218 (cal/mol) -11648,7
- Nếu khoảng sai số khi đo nhiệt độ giữa lần 1 và lần 2 không quá 0,5 độ thì
chúng ta không cần thực hiện lần đo thứ 3 nữa. Kết quả thu được: ,
Kết luận: : Phản ứng hòa tan khan là phản ứng tỏa nhiệt.
4. Thí nghiệm 4: Nhiệt hòa tan của Mô tả thí nghiệm: 7 lOMoARcPSD|46342985
- Làm tương tự mục 3 nhưng thay khan bằng . Cho nhiệt dung riêng của
dung dịch gần đúng là 1 cal/mol.độ. Lần 1 Lần 2 Lần 3 m 4 4 30 30 25,5 25 Q (cal) -249,615 -277,35 (cal/mol) 3328,2 3698 (cal) -263,483 (cal/mol) 3513,1
- Nếu khoảng sai số khi đo nhiệt độ giữa lần 1 và lần 2 không quá 0,5 độ thì
chúng ta không cần thực hiện lần đo thứ 3 nữa. Kết quả thu được: ,
Kết luận: : Phản ứng hòa tan là phản ứng thu nhiệt.
III. Trả lời câu hỏi:
1. của phản ứng HCl + NaOH NaCl + sẽ được tính theo số mol HCl hay NaOH
khi cho 25ml dung dịch HCl 2M tác dụng với 25ml dung dịch NaOH 1M? Tại sao? 8 lOMoARcPSD|46342985
- Ta sẽ tính theo số mol của dd NaOH. Vì khi tính số mol của dd HCl và
dd NaOH theo số liệu đề bài đã cho ta thấy (0.05 0.025), từ đó suy ra
dung dịch NaOH phản ứng hết hoàn toàn còn dung dịch HCl dư do đó ta
sẽ tính theo số mol của NaOH.
2. Nếu thay HCl 1M bằng 1M thì kết quả thí nghiệm 2 có thay đổi không?
- Kết quả thí nghiệm 2 sẽ không thổi đổi. Vì khi thay đổi HCl 1M bằng
1M thì bản chất của phản ứng vẫn không thay đổi do đây là phản ứng
trung hòa (phản ứng giữa axit và bazơ).
3. Tính bằng lý thuyết theo định luật Hess. So sánh với kết quả thí nghiệm. Hãy
xem 6 nguyên nhân có thể gây ra sai số trong thí nghiệm này:
- Mất nhiệt do nhiệt lượng kế. - Do nhiệt kế.
- Do dụng cụ đong thể tích hóa chất. - Do cân.
- Do sunfat đồng bị hút ẩm.
- Do lấy nhiệt dung riêng dung dịch sunfat đồng bằng 1 cal/mol.độ.
Theo em, sai số nào là quan trọng nhất? Còn nguyên nhân nào khác không? 9 lOMoARcPSD|46342985
BÀI 4: BẬC PHẢN ỨNG I.
Mục đích thí nghiệm:
- Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng.
- Xác định bậc của phản ứng phân hủy Na2S2O3 trong môi trường axit. II.
Tiến hành thí nghiệm:
1. Xác định bậc phản ứng của Na2S2O3
- Chuẩn bị 2 ống nghiệm chứa H2SO4 và 2 bình tam giác chứa Na2S2O3 và H2O theo bảng sau: Ống nghiệm Erlen TN V(ml) H2SO4 0,4M V(ml) Na2S2O3 0,1M V(ml) H2O 1 8 4 28 2 8 8 24 3 8 16 16
- Dùng pipet khắc vạch lấy axit trong ống nghiệm.
- Dùng buret cho H2O vào 2 bình tam giác trước. Sau đó tráng buret thứ 2 bằng
Na2S2O3 0,1M rồi tiếp tục dùng buret đó để cho Na2S2O3 vào các bình tam giác.
- Chuẩn bị đồng hồ bấm giây.
- Lần lượt cho phản ứng từng cặp ống nghiệm và bình tam giác như
sau: Đổ nhanh axit trong ống nghiệm vào bình tam giác. Bấm đồng hồ.
Lắc nhẹ bình tam giác cho đến khi thấy dung dịch vừa chuyển sang đục
thì bấm đồng hồ lần nữa và đọc . 10 lOMoARcPSD|46342985
- Làm 5 đợt thí nghiệm mỗi đợt 2 bình (sai số cho phép ) (Thí nghiệm 1,2,3,4,6).
Kết quả thu được:
Nồng độ ban đầu (M) TN Na2S2O3 H2SO4 1 0,01 0,08 101 101 101 2 0,02 0,08 53 53 53 3 0,04 0,08 26 26 26
Từ của TN1 và TN2 xác định m1 (tính mẫu): m1= == 0,93
Từ của TN2 và TN3 xác định m2: m2== = 1,03
Bậc phản ứng theo Na2S2O3 0,98
2. Xác định bậc phản ứng của H2SO4
- Chuẩn bị 2 ống nghiệm chứa H2SO4 và 2 bình tam giác chứa Na2S2O3 và H2O theo bảng sau: Ống nghiệm Erlen TN V(ml) H2SO4 0,4M V(ml) Na2S2O3 0,1M V(ml) H2O 4 4 8 28 5 8 8 24 6 16 8 16
- Dùng pipet khắc vạch lấy axit trong ống nghiệm. 11 lOMoARcPSD|46342985
- Dùng buret cho H2O vào 2 bình tam giác trước. Sau đó tráng buret thứ 2 bằng
Na2S2O3 0,1M rồi tiếp tục dùng buret đó để cho Na2S2O3 vào các bình tam giác.
- Chuẩn bị đồng hồ bấm giây.
- Lần lượt cho phản ứng từng cặp ống nghiệm và bình tam giác như
sau: Đổ nhanh axit trong ống nghiệm vào bình tam giác. Bấm đồng hồ
Lắc nhẹ bình tam giác cho đến khi thấy dung dịch vừa chuyển sang
đục thì bấm đồng hồ lần nữa và đọc .
- Làm 5 đợt thí nghiệm mỗi đợt 2 bình (sai số cho phép ) (Thí nghiệm 1,2,3,4,6).
Kết quả thu được:
Nồng độ ban đầu (M) TN Na2S2O3 H2SO4 4 0,02 0,04 54 54 54 5 0,02 0,08 53 53 53 6 0,02 0,16 46 46 46
Từ của TN1 và TN2 xác định n1 (tính mẫu): n1= = = 0,03
Từ của TN2 và TN3 xác định n2 : n2== = 0,2
Bậc phản ứng theo H2SO4 = = 0,115
III. Trả lời câu hỏi: 12 lOMoARcPSD|46342985
1. Trong TN trên nồng độ của Na2S2O3 (A) và của H2SO4 (B) đã ảnh hưởng
thế nào lên vận tốc phản ứng.Viết lại biểu thức tính tốc độ phản ứng. Xác
định bậc của phản ứng.
- Nồng độ của Na2S2O3 tỉ lệ thuận với tốc độ phản ứng.
- Nồng độ của H2SO4 không ảnh hưởng đến tốc độ phản ứng.
- Biểu thức tính tốc độ phản ứng v = k [Na2S2O3]m[H2SO4]n ; trong đó: m, n là
hằng số dương xác định bằng thực nghiệm.
- Theo thí nghiệm ta có: m=1 và n=0
=> Bậc phản ứng: m + n=1
2. Cơ chế của phản ứng trên có thể được viết lại như sau: H2SO4 + Na2S2O3 → Na2SO4 + H2S2O3 (1) H2S2O3 → H2SO3 + S↓ (2)
Dựa vào kết quả TN có thể kết luận phản ứng (1) hay (2) là phản ứng quyết định vận
tốc phản ứng tức là phản ứng xảy ra chậm nhất không? Tại sao? Lưu ý trong các TN
trên, lượng axit H2SO4 luôn luôn dư so với Na2S2O3.
- Phản ứng (1) là phản ứng trao đổi ion nên tốc độ phản ứng xảy ra nhanh.
- Phản ứng (2) xảy ra chậm hơn vì là phản ứng phân hủy.
- Phản ứng (2) quyết định tốc độ phản ứng và là phản ứng xảy ra chậm nhất
vì bậc của phản ứng là bậc của phản ứng (2).
3. Dựa trên cơ sở của phương pháp TN thì vận tốc xác định được trong các
TN trên được xem là vận tốc trung bình hay vận tốc tức thời?
- Dựa trên cơ sở của phương pháp thí nghiệm thì vận tốc xác định được trong
các thí nghiệm trên được xem là vận tốc tức thời vì vận tốc phản ứng được 13 lOMoARcPSD|46342985
xác định bằng tỉ số ∆C/∆t. Vì ∆C ≈ 0 (do lưu huỳnh thay đổi không đáng kể nên ∆C ≈ dC).
4. Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc phản ứng có thay đổi không? Tại sao?
- Bậc phản ứng không thay đổi vì bậc phản ứng chỉ phụ thuộc vào nhiệt độ và
bản chất của phản ứng mà không phụ thuộc vào quá trình tiến hành.
BÀI 8: PHÂN TÍCH THỂ TÍCH I.
Mục đích thí nghiệm:
- Dựa trên việc thiết lập đường cong chuẩn độ một axit mạnh bằng một bazơ
mạnh lựa chọn chất chỉ thị màu thích hợp cho phản ứng chuẩn độ axit HCL
bằng dung dịch NaOH chuẩn.
- Áp dụng chuẩn độ xác định nồng độ một axit yếu. II.
Tiến hành thí nghiệm:
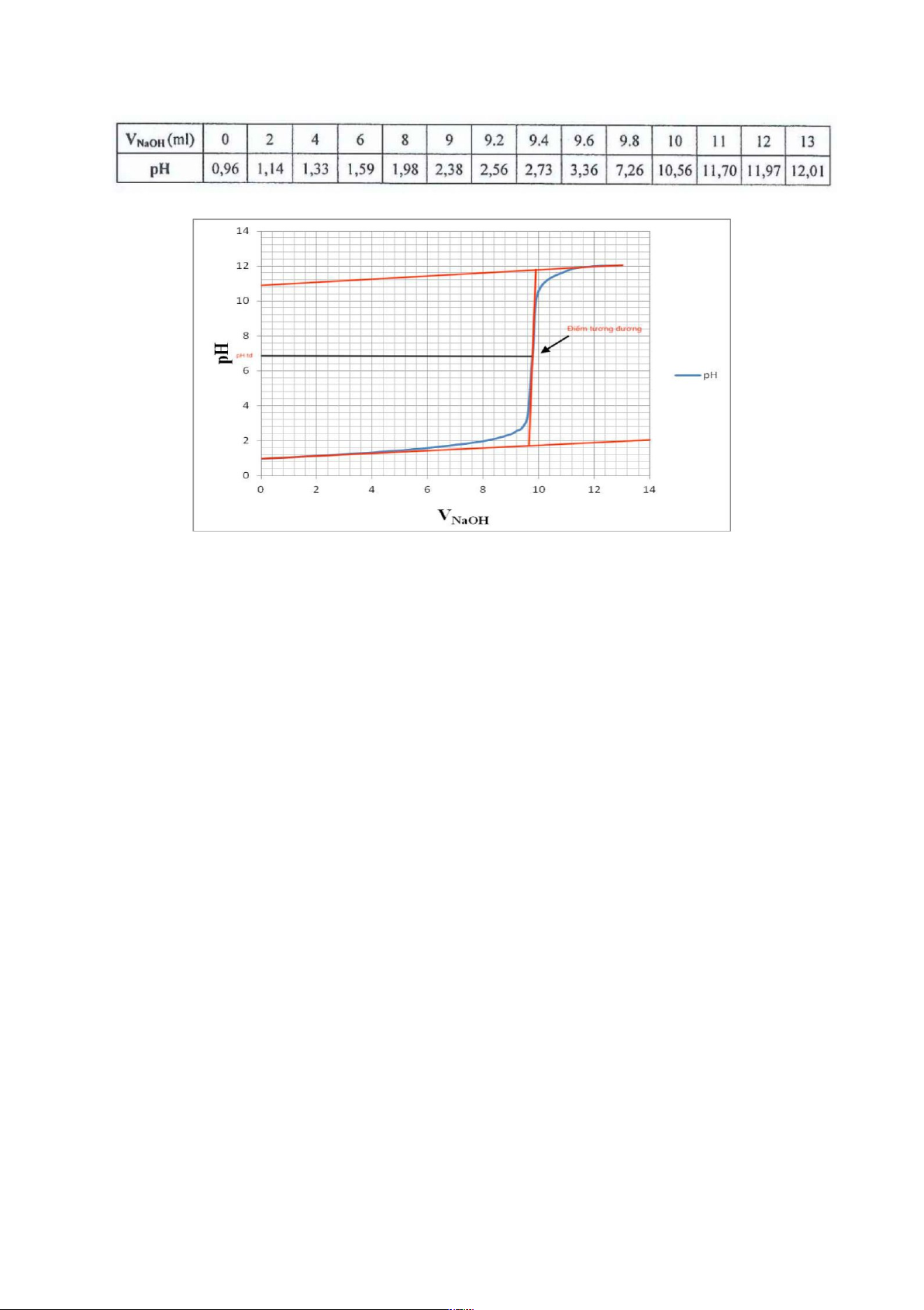
1. Thí nghiệm 1: Xác định đường cong chuẩn độ HCl bằng NaOH. 14 lOMoARcPSD|46342985 Xác định: Điểm pH tương đương: 7
Bước nhảy pH: từ pH 4,3 đến pH 9,7
Chất chỉ thị thích hợp: phenolphthalein
2. Thí nghiệm 2: Chuẩn độ axit mạnh – bazơ mạnh bằng chỉ thị phenolphtalein
- Cho dung dịch HCl chưa biết nồng độ vào bình tam giác, cho thêm nước, 2
giọt chỉ thị và dung dịch NaOH được cho lên Buret. Chuẩn độ (tay trái đóng
mở khoá Buret lên xuống, tay phải cầm bình tam giác xoay tròn) cho NaOH
chảy vào bình tam giác đến khi nào xuất hiện màu hồng nhạt bền thì dừng.
Giọt đầu tiên của NaOH rớt vào trong bình sẽ xuất hiện 1 đóm màu hồng
(NaOH phản ứng với phenolphtalein) . Lắc bình lên, màu hồng mất đi do
NaOH bị trung hoà bởi HCl bởi muối và nước. Nhỏ các giọt tiếp theo cho đến
khi dư 1 lượng nhỏ NaOH sẽ tạo ra màu hồng nhạt. 15 lOMoARcPSD|46342985 Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 9,2 0,1 0,092 0,00 2 10 9,2 0,1 0,092 0,00
CHCl = (VNaOH x CNaOH ) / VHCl = ( 9,2 x 0,1 ) / 10 =
0,092 Sai số = CHCl tb - CHCl lần 1 (2) = 0,092 – 0,092 =
0,00 Màu chỉ thị: từ không màu sang hồng nhạt
Kết luận: Phản ứng dùng để tính thể tích dung dịch NaOH cần thiết để trung hoà
lượng axit HCl trung dung dịch. Sau khi trung hoà hết, sẽ phản ứng với NaOH tạo màu hồng nhạt
3. Thí nghiệm 3: Chuẩn độ axit mạnh – bazơ mạnh bằng chỉ thị metyl da cam
Mô tả thí nghiệm: Như thí nghiệm 2 nhưng thay chất chỉ thị phenolphtalein bằng methyl da cam. Màu: từ đỏ sang vàng Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 9,2 0,1 0,092 0,00025 2 10 9,25 0,1 0,0925 0,00025
- Kết luận: metyl da cảm khi cho vào dung dịch sẽ tác dụng với axit chuyển
màu đỏ hồng. Khi chất chỉ thị tác dụng hết với axit HCl sẽ tiếp tục tác dụng với NaOH chuyển màu vàng
4. Thí nghiệm 4: Chuẩn độ axit yếu - bazơ mạnh bằng chỉ thị phenolphtalein + metyl da cam Mô tả thí nghiệm: -
Như thí nghiệm 2 nhưng chuẩn độ 2 chỉ thị để tìm ra chỉ thị thích hợp.
- Sau khi chuẩn độ xong, xây dựng đường cong chuẩn độ của phương trình 16 lOMoARcPSD|46342985 - chuẩn độ.
- Để lựa chọn chỉ thị cho phản ứng phải dựa vào giá trị pH của chỉ thị phải nằm
trong bước nhảy pH của phương trình chuẩn độ Màu chỉ thị:
- Phenol phtalein: từ đỏ về mất màu
- Metyl orange: từ đỏ về màu cam Lần Chất chỉ thị VNaOH (ml) CNaOH (N) C CH3COOH (N) 1 Phenol phtalein 10 5 0,1 0,05 2 10 10,5 0,1 0,105 Metyl orange 10 5 0,1 0,05 10 3,4 0,1 0,034
CCH3COOH = (VNaOH x CNaOH ) / VCH3COOH = ( 5 x 0,1 ) / 10 = 0,05 CMetyl orange tương tự
- Kết luận: Phenol phtalein chính xác hơn metyl orange vì axit axetic là axit
yếu nên điểm định mức lớn hơn 7 nên dùng phenol phtalein thì chính xác hơn metyl orange
III. Trả lời câu hỏi:
1. Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ có thay đổi hay không? Tại sao?
- Khi thay đổi nồng độ HCl và NaOH, đưòng cong chuẩn độ không thay đổi do
phương pháp chuẩn độ HCl bằng NaOH được xác định dựa trên phương trình: HCl + NaOHNaCl + H2O CHCl.VHCl = CNaOH.VNaOH 17 lOMoARcPSD|46342985
- Với VHCl và CNaOH cố định nên khi CHCl tăng hay giảm thì VNaOH cũng tăng
hay giảm theo. Từ đó ta suy ra, dù mo rộng ra hay thu hẹp lại thì đưòng
cong chuẩn độ không đổi.
- Tương tự đối với trưòng hợp thay đổi nồng độ NaOH.
2. Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 cho kết quả nào
chính xác hơn? Tại sao?
- Xác định nồng độ axit HCl trong thí nghiệm 2 cho kết quả chính xác
hơn. Vì phenolphtalein giúp ta xác định màu chính xác hơn, rõ ràng
hơn, do chuyển từ không màu sang hồng nhạt, dễ nhận thấy hơn từ màu đỏ sang da cam.
3. Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit axetic bằng
chỉ thị màu nào chính xác hơn? Tại sao?
- Phenol phtalein chính xác hơn metyl orange vì axit axetic là axit yếu nên
điểm định mức lớn hơn 7 nên dùng phenol phtalein thì chính xác hơn metyl
orange (bước nhảy 3,0 – 4,4 cách quá xa).
4. Trong phép phân tích thể tích, nếu đổi vị trí của NaOH và axit thì kết
quả có thay đổi không? Tại sao?
- Không thay đổi vì đây cũng chỉ là phản ứng cân bằng. 18




