






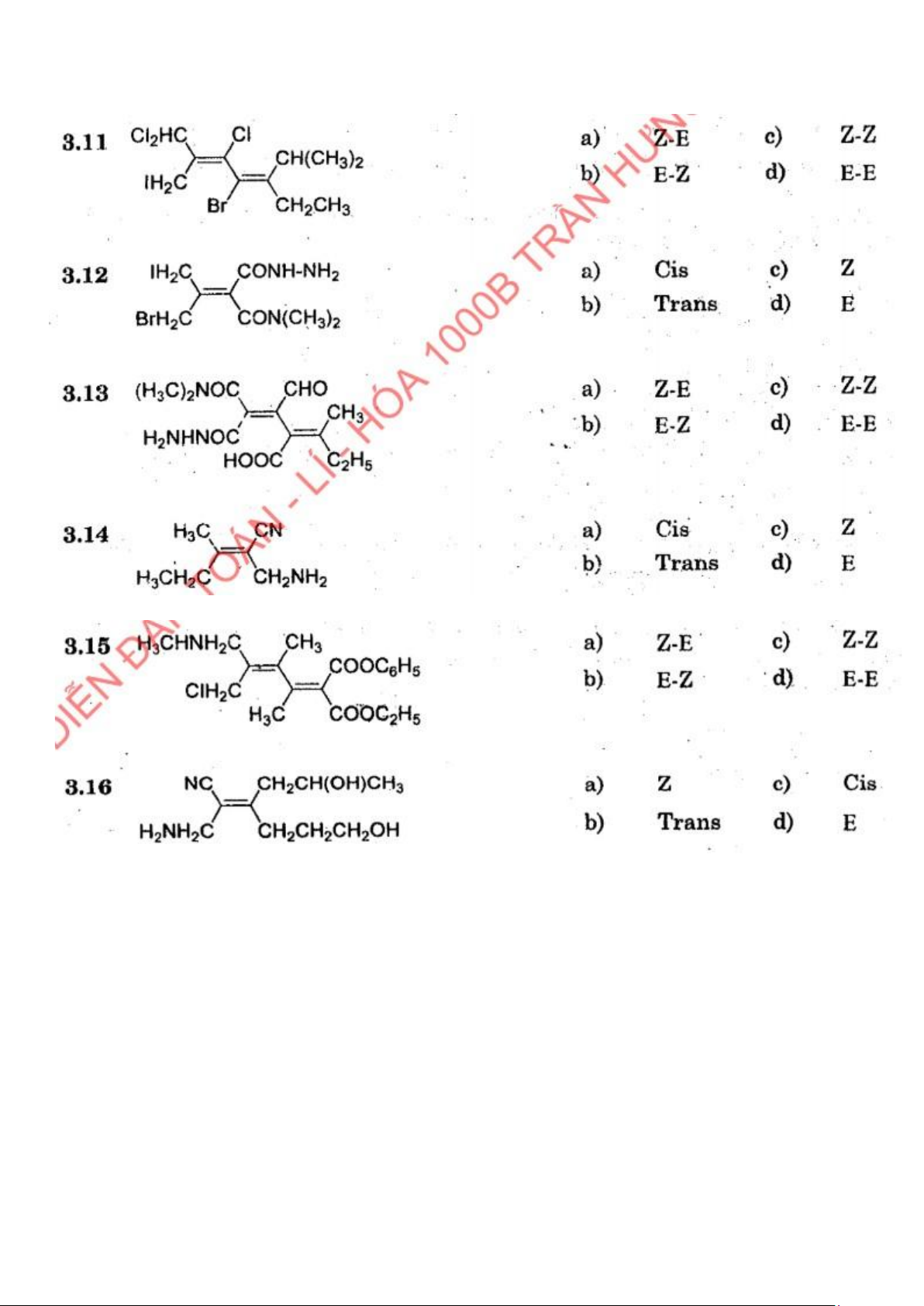
Preview text:
lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
BÀI TẬP TRẮC NGHIỆM ÔN TẬP HÓA ĐẠI CƯƠNG – HÓA HỮU CƠ
Sử dụng các dữ kiện sau để trả lời các câu hỏi 1,2,3 và 4: Ion NO+ hay còn có tên gọi là nitrosonium được tìm
thấy trong các hợp chất như NOBF4; NOClO4; NOHSO4; …ngoài ra ion này còn được tạo thành khi proton hóa
axit nitro (HONO+H+⇌NO++H2O). Câu 1: Sử dụng thuyết MO, cho biết cấu hình electron của ion NO+ là:
A. (σ2slk)2 (σ2s*)2 (π2pxlk)2 (π2pylk)2 (σ2z*)2
B. (σ2slk)2 (σ2s*)2 (π2pxlk)2 (π2pylk)2 (π2px*)1 (π2py*)1 C.
(σ2slk)2 (π2pxlk)2 (π2pylk)2 (π2px*)1 (π2py*)1(σ2s*)2 D. (σ2slk)2 (σ2s*)2 (π2pxlk)2 (π2pylk)2 (π2px*)1 (π2py*)1
Câu 2: So sánh độ dài các liên kết giữa N với O trong: NO; NO+; NO-.
A. NO > NO+ > NO-.
B. NO+ < NO < NO-.
C. NO> NO- > NO+.
D. NO-< NO < NO+.
E. NO- > NO+ > NO.
Câu 3: Trạng thái lai hóa của B; Cl; S trong các hợp chất muối với nitrosonium lần lượt là: A. sp3; sp2; sp2. B. sp3; sp; sp2. C. sp; sp2; sp3. D. sp3; sp3; sp3. E. sp2; sp3; sp2.
Câu 4: Nitrosonium (NO+) không đẳng electron với ion hay hợp chất nào dưới đây: A. O2. B. CN-. C. CO. D. N2. E. BN.
Câu 5: Cho các thông số về độ dài các liên kết và năng lượng liên kết của liên kết hidro(O-H°°°O) giữa các phân
tử nước với nhau (1) và giữa các phân tử axit cacboxylic (2) như sau: 2,8 Å; 2,5 Å và 30 kJ/mol; 25 kJ/mol. Các
thông số gán phù hợp là:
A. (1): 2,8 Å và 25 kJ/mol; B. (2): 2,5 Å và 30 kJ/mol. C. (1): 2,5 Å và 25 kJ/mol; D. (2): 2,8 Å và 30 kJ/mol.
Sử dụng dữ kiện sau để trả lời các câu hỏi 6,7: Electron cuối cùng trong nguyên tố A có các số lượng tử n=2;
ml=-1; ms=+1/2. Số electron độc thân của nguyên tố X ở trạng thái cơ bản thuộc phân lớp 4d hoặc 5s cũng bằng số
electron độc thân của A.
Câu 6: Có bao nhiêu nguyên tố X thỏa mãn dữ kiện trên? A. 3. B. 4. C. 5. D. 6. E. 7.
Câu 7: Cho rằng electron của ion He+ ở trạng thái kích thích có giá trị số lượng tử chính bằng số lượng tử phụ của
phân lớp chứa electron độc thân của nguyên tố X. Năng lượng electron này ở He+ bằng năng lượng electron ở
trạng thái cơ bản của nguyên tử H. Điện tích hạt nhân của nguyên tố X là: A. 37+. B. 39+. C. 47+. D. 49+. E. 53+. Câu 8: Ion C 2- 2-
2 tồn tại trong một số hợp chất như CaC2. So sánh năng lượng ion hóa thứ nhất (I1) của C2; C2 và C: A. C 2- 2- 2- 2- 2 > C2 > C. B. C2 > C2 > C. C. C > C2 > C2. D. C > C2 > C2 .
Câu 10: Cho các thông số sau đây. Hãy tính năng lượng mạng lưới tinh thể của KF (kJ/mol): A. -822 kJ/mol. B. -902 kJ/mol. C. -507 kJ/mol. D. -412 kJ/mol.
Câu 11: X là hidrocarbon mạch hở phân tử chỉ chứa liên kết đơn hoặc đôi. Phương trình nhiệt hóa học đốt cháy của X như sau: LK O=O H-O C-H C=O C=C C-C 1 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
ΔHo=-1852 kJ/mol. Trong đó n là số nguyên tử C và k Elk (kJ/mol) 498 467 413 799 611 414
là số liên kết đôi C=C trong X. Xác định tên của X biết rằng các năng lượng liên kết như sau: A.Metan B. Aceton C. Axit acetic. D. Propen.
Câu 12: Điện tích hiệu dụng của điện tử j nằm ở tầng 4s của Cu là: A. 3,7. B. 4,7 C.2,7 D. 5,7.
Câu 13: Trong các nhận định sau, số nhận định đúng là:
(1) CO2 và SO2 đều có cấu trúc thẳng hàng.
(2) BeCl2 và H2S có cùng cấu trúc dạng hình học phân tử.
(3) IF5 và PCl5 có cấu trúc lưỡng tháp tam giác.
(4) Cấu trúc của CH4, SF6, PCl5 đều là các hình đa diện đều.
(5) Moment lưỡng cực của NH3 lớn hơn NF3.
(6) Góc liên kết H-O-H trong H2O bé hơn góc H-N-H trong phân tử NH3. A. 4,5,6. B. 1,2,3. C. 1,2,4. D.3,4,5.
Câu 14: Trong lõi của mặt trời chứa một hàm lượng lớn nguyên tố sắt. Giả sử rẳng, ở nhiệt độ trong lõi mặt trời,
sắt bị ion hóa nhiều lần. Tính năng lượng ion hóa của ion một electron Fe25+: Cho R∞=10973731,57 (m-1), NA=6,023.1023. A. 8,87.105 (kJ/mol) B. 8,20.105 (kJ/mol) C. 1312,74 (kJ/mol) D. 41,17.105(kJ/mol).
Câu 15: Dựa vào mô hình VSEPR, dạng hình học của phân tử BrF3 là: A. Dạng chữ T. B. Tứ diện. C. Tam giác phẳng. D. Chóp tam giác.
Câu 16: Từ thực nghiệm, người ta đã ghi được vạch phổ của ion Be3+ có λ = 253,4 nm khi electron chuyển từ mức
n = 5 về trạng thái thấp hơn. Hãy xác định trạng thái mà electron sẽ chuyển tới: A. 2 B. 3 C.4. D.5.
Câu 17: Biết giá trị nhiệt động của các chất sau ở điều kiện chuẩn là : Cho các nhận định sau: Chất Fe O2 FeO
Fe2O3 Fe3O4 (1) Thế đẳng áp tạo thành FeO là ΔG 0 1= -58,634 ΔH0s(kcal.mol-1) 0 0 -63,7
-169,5 -266,9 kcal.mol-1. (2) Thế đẳng áp tạo thành Fe 0 2O3 ΔG2 = -149,952 kcal.mol-1 . S0 (cal.mol-1.K-1) 6,5 49,0 14,0 20,9 36,2 (3)
Thế đẳng áp tạo thành Fe 0 3O4 là ΔG3 = - 242,6726 kcal.mol-1.
(4) Oxit Fe3O4 bền hơn Fe2O3.
(5) Oxit Fe2O3 bền hơn FeO.
(6) Tính bền của các oxit tăng dần theo thứ tự: FeO → Fe2O3 → Fe3O4.
Số nhận định đúng là: A.3. B.4. C.5. D. 6.
Sử dụng dữ kiện sau để trả lời câu 18,19: Nescafe đã sản xuất thành công lon café-tự làm nóng. Để làm nóng
café, chỉ cần ấn nút (trên lon) để trộn nguyên liệu gồm 1 dung dịch KOH hoặc NaOH rất loãng và Canxi oxit. 210
mL café trong lon sẽ được hâm nóng đến khoảng 40oC. CaO + H2O → Ca(OH)2 (*)
Cho nhiệt hình thành chuẩn của Canxi hidroxit, canxi oxit và nước lần lượt là -1003, -635, -286 kJ/mol. 2 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
Câu 18: Hãy tính hiệu ứng nhiệt của phản ứng (*): A. -82 kJ/mol. B. -652 kJ/mol. C. -1352 kJ/mol. D. -1781 kJ/mol.
Câu 19: Giả sử nhiệt dung riêng của café là 4,18 J/K.g. nhiệt dung của vỏ lon là 18,81 J/K. hãy tính lượng nhiệt
cần cung cấp để làm nóng 210 mL café từ 0oC đến 40oC. Hãy tính lượng Canxi oxit cần để thực hiện nhiệm vụ này.
A. 21,00 g. B. 28,00 g. C. 56,00 g. D. 24,50 g.
Câu 20: Độ dài sóng λ của photon phát xạ khi electron từ quĩ đạo Bohr n = 5 sang quĩ đạo n = 2 có giá trị là: a.410 nm. b.434 nm. c.486nm. d. 565 nm.
Câu 21: So sánh bán kính các ion S2−, Cl−, K+, Ca2+:
A. rS2− > rCl− > rK+ > rCa2+. b. rS2− > rCl− > rCa2+ > rK+. c. rS2− < rCl− < rK+ < rCa2+. d. rS2− = rCl− > rK+ = rCa2+.
Câu 22: C (chu kỳ 2) và Si (chu kỳ 3) đều thuộc nhóm IVA, nhưng CO2 có nhiệt độ nóng chảy và sôi rất thấp, ở
điều kiện thường, chúng là các chất khí, còn SiO2 (thạch anh) là chất rắn có nhiệt độ nóng chảy rất cao (khoảng 1700oC) vì:
a. Si có nguyên tử khối cao hơn C nên lực liên kết Van der Waals giữa các phân tử SiO2 mạnh hơn giữa các
phân tử CO2, dẫn đến SiO2 có nhiệt độ nóng chảy cao hơn CO2
b. SiO2 là hợp chất ion, CO2 là hợp chất cộng hóa trị kết tinh trong mạng phân tử nên SiO2 có nhiệt độ nóng chảy cao hơn CO2
c. SiO2 và CO2 đều là các hợp chất cộng hóa trị, SiO2 kết tinh trong mạng nguyên tử (mạng cộng hóa trị, mạng
phối trí), còn CO2 kết tinh trong mạng phân tử nên SiO2 có nhiệt độ nóng chảy cao hơn CO2 d.
Cả 3 giải thích trên đều sai
Câu 23: Trong các chất Al2O3, CaO, KCl, CsCl, chất nào có năng lượng mạng tinh thể nhỏ nhất? a. Al2O3. b. CaO. c. KCl. d. CsCl.
Câu 24: Độ dài sóng của bức xạ do nguyên tử H phát ra tuân theo hệ thức:
1 = 1,097x107 12 − n122 n1
Với trạng thái đầu n = 3 và trạng thái cuối n = 1, bức xạ này ứng với sự chuyển electron:
a. Từ lớp 3 xuống lớp 1, bức xạ thuộc dãy Lyman.
b. Từ lớp 1 lên lớp 3, bức xạ thuộc dãy Lyman.
c. Từ lớp 3 xuống lớp 1, bức xạ thuộc dãy Balmer.
d. Từ lớp 1 lên lớp 3, bức xạ thuộc dãy Balmer.
Câu 25: Trong các hợp chất sau, H2, HCl, NH3, KCl, hợp chất nào chứa liên kết cộng hóa trị phân cực? a. H2 và NH3. b. HCl và KCl. c.NH3. d. HCl và NH3.
Câu 26: Trong các chất sau, chất nào có moment lưỡng cực bằng không? 3 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt a. CH4. b.H2O. c. HF. d. NH3.
Câu 27: Chlor gồm 2 đồng vị 35Cl chiếm 75% và 37Cl chiếm 25%. Khối lượng nguyên tử của Cl là: a. 34,5. b.35,5. c. 36,0. d. 72,0.
Câu 28: Hợp chất nào sau đây không thể tạo thành dung dịch đồng nhất với nước? a. CH3OH b. CH3COOH c. HOCH2CH2OH d. CCl4
Câu 29: Công thức electron của N + 2 là:
a. 1s2 *1s2 2s2 *2s2 2p4 2p1.
b. 1s2 *1s2 2s2 *2s2 2p1 2p4.
c. 1s2 *1s2 2s2 *2s2 2p4 2p2.
d. 1s2 2s2 1s2 *2s2 2p4 2p1.
Câu 30: Độ tan trong nước của CH3OH, CH3–O–CH3, và C6H14 thay đổi như sau:
a. CH3OH > CH3–O–CH3 > C6H14.
b. CH3–O–CH3 > CH3OH > C6H14.
c. C6H14 > CH3OH > CH3–O–CH3.
d. C6H14 > CH3–O–CH3 > CH3OH.
Câu 31: Nhiết độ nóng chảy của H2O, H2S, H2Se, H2Te biến thiên như sau:
a. Tăng dần trong dãy trên.
b. Giảm dần trong dãy trên.
c. Nhiệt độ nóng chảy của H2O > H2S < H2Se < H2Te.
d. Nhiệt độ nóng chảy của H2O < H2S > H2Se > H2Te.
Câu 32: Chọn cấu hình electron đúng cho nguyên tử trung hòa điện có Z = 24.
a. 1s2 2s2 2p6 3s2 3p6 4s2 3d4.
b. 1s2 2s2 2p6 3s2 3p6 4s2 3d5.
c. 1s2 2s2 2p6 3s2 3p6 4s1 3d5.
d. 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Câu 33: Orbital 1s của nguyên tử H có dạng cầu, nghĩa là:
a. Nguyên tử H là một hình cầu.
b. Xác suất bắt gặp electron 1s của nguyên tử H là như nhau theo mọi hướng trong không gian.
c. Khoảng cách của electron 1s tới nhân nguyên tử là hằng số.
d. Electron 1s chỉ di chuyển trong hình cầu đó.
Câu 34: Tính nồng độ molan của dung dịch chứa 25g H2SO4 hòa tan trong 80g nước. a. 1.6 m b.2.2m c. 3.2 m d. 6.3 m
Câu 35: Dung dịch nào sau đây có áp suất hơi thấp nhất ở 25oC? a. NaCl 1M b.MgCl21M c. Na3PO4 1M d. C6H12O6 1M
Câu 36: Trong các chất H2, BaF2, NaCl, NH3, chất nào có % tính ion cao nhất và thấp nhất? a. H2 và BaF2. b. BaF2 và H2. c. NaCl và H2. d. BaF2 và NH3.
Câu 37: So sánh và giải thích sự khác biệt độ tan trong nước của SO2 và CO2:
a. SO2 tan nhiều hơn CO2 do phân tử SO2 phân cực, phân tử CO2 không phân cực.
b. Cả hai đều là những hợp chất cộng hóa trị nên rất ít tan trong nước. 4 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
c. SO2 tan ít hơn CO2 vì SO2 có khối lượng phân tử lớn hơn CO2.
d. SO2 tan ít hơn CO2 do SO2 có năng lượng mạng tinh thể lớn hơn CO2.
Câu 38: Lai hóa của P trong POCl3 và cơ cấu lập thể của phân tử này là gì? a. sp3, tứ diện đều.
b. sp3, tứ diện không đều. c. sp2, tam giác đều. d. dsp2, vuông phẳng.
Câu 39: Cho 4.305 g một chất không phân cực hòa tan trong 105 g H2O. Dung dịch hóa rắn ở -1.23oC. Tính phân
tử lượng của chất tan, kf(H2O) =1.86oC/m. a. 39.7 g/mol b. 58.4 g/mol c. 46.2 g/mol d. 62.0 g/mol
Câu 40: Trong các tiểu phân sau, CO − +
2, NO2 , NO2 , NO2, tiểu phân nào có cơ cấu thẳng hàng? a. CO + − − + 2, NO2 . b. CO2, NO2. c. CO2, NO2 . d. NO2 , NO2 .
Câu 41: Một trong 4 nguyên tố Na, Mg, Al, Si có các giá trị năng lượng ion hóa (kJ/mol) như sau: I1: 578 I2: 1820 I3: 2570
I4: 11600. Nguyên tố đó là: a. Na. b.Mg. c. Al. d. Si.
Câu 42: Hãy chọn phát biểu sai:
a. Tất cả các ion đều bị hidrat hóa trong dung dịch nước
b. Sự hidrat hóa các hợp chất ion là quá trình thu nhiệt
c. Nhiệt hidrat hóa của các cation tăng khi điện tích của cation tăng
d. Nhiệt hidrat hóa của các cation tăng khi bán kính của cation giảm Câu 43: Nguyên tử Fe (Z = 26) có:
a. Vân đạo hóa trị là 4s, số electron hóa trị là 2.
b. Vân đạo hóa trị là 3d, số electron hóa trị là 6.
c. Vân đạo hóa trị là 3d và 4s, số electron hóa trị là 3.
d. Vân đạo hóa trị là 4s và 3d, cố electron hóa trị là 8.
Câu 44: Nhiều phản ứng giữa các khí xảy ra trong động cơ ô tô và hệ thống thải khí. Một trong những phản ứng + → +
đó là : NO2(k) CO(k) NO(k) CO2(k) . Dùng các dữ liệu thực nghiệm sau để xác định bậc của phản ứng v k[NO ] [CO]= m n 2
đối với mỗi chất và hằng số tốc độ phản ứng. Thí
Tốc độ đầu Nồng độ đầu
Nồng độ đầu [CO] A. v=k[NO2]2.[CO] với k = nghiệm [NO mol/l (mol/l 2] (mol/l) -1.s-1) 1 0,0050 0,10 0,10 2 0,080 0,40 0,10 3 0,0050 0,10 0,20 5 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
Câu 45: Theo thuyết VB, chất nào trong 4 chất sau có liên kết s được tạo nên do sự xen phủ các vân đạo sp và p? a. AlF3. b.BeCl2. c. CH4. d. NH3.
Câu 46: Phân tử Be2 không tồn tại vì: a. Be là kim loại.
b. Be2 có tính phóng xạ nên không bền.
c. Liên kết Be – Be trong Be2 không tồn tại. d. Be + − 2 biến thành Be2 và Be2 .
Câu 47: Một dung dịch chứa 72 gam glucose trong 250 gam nước sẽ đông đặc ở bao nhiêu độ? Biết hằng số
nghiệm lạnh của nước là 1,86 oC/mol.gam. A. -2,976oC. B. -2,796oC. C. -0,2976oC. D. -0,976oC.
Câu 48: Giả sử rằng khối lượng mol của phân tử Hemoglobin là 70000g/mol. Nếu hòa tan 80 gam hemoglobin vào
nước thành 2 lít dung dịch ở nhiệt độ cơ thể bình thường là 37oC thì áp suất thẩm thấu của dung dịch tạo thành là: Cho R=0.082 atm.l.K-1.
A. 0,029 atm. B. 0,0145 atm. C. 7,3.10-3 atm. D. 1 atm.
Câu 49: Sự phân bố electron của nguyên tử C trong các orbital như sau: 1s2() 2s2() 2p 1 1 x () 2py () tuân theo:
a.Nguyên lý bất định Heisenberg. b. Kiểu nguyên tử Bohr. c. Qui tắc Hund.
d. Nguyên lý ngoại trừ Pauli.
Câu 50: Đồng phân orthonitrophenol có nhiệt độ nóng chảy thấp hơn đồng phân paranitrophenol vì:
a. Liên kết hydrogen liên phân tử trong đồng phân ortho mạnh hơn trong đồng phân para.
b. Liên kết hydrogen liên phân tử trong đồng phân ortho yếu hơn trong đồng phân para do nhóm –OH và –NO2
trong đồng phân ortho tạo liên kết hydrogen nội phân tử.
c. Cả hai đồng phân trên đều không tạo được liên kết hydrogen.
d. Liên kết hydrogen nội phân tử trong đồng phân ortho làm tăng độ mạnh của liên kết hydrogen liên phân tử trong đồng phân đó.
Câu 51: Biết rằng tốc độ thẩm thấu các ion qua màng tế bào tỉ lệ nghịch với bán kính ion. Chọn phát biểu đúng: a.
Ion K+ thẩm thấu qua màng tế bào nhanh hơn ion Na+.
b. Ion Cl− và Na+ thẩm thấu qua màng tế bào nhanh như nhau.
c. Ion Na+ thẩm thấu qua màng tế bào nhanh hơn ion K+.
d. Ion Ca2+ thẩm thấu qua màng tế bào chậm hơn ion K+. 6 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
Câu 52: Độ tan của N2 trong máu tại nhiệt độ 37oC và 1 atm là 6,2 × 10-4 M. Nếu một thợ lặn hít không khí (phân
mol N2 = 0,78) ở độ sâu với bình khí có áp suất 2,5 atm, hãy tính nồng độ N2 có trong máu. A.1,2.10-3M. B.
1,55.10-3M. C. 2,4.10-3M. D. 3,1.10-3M.
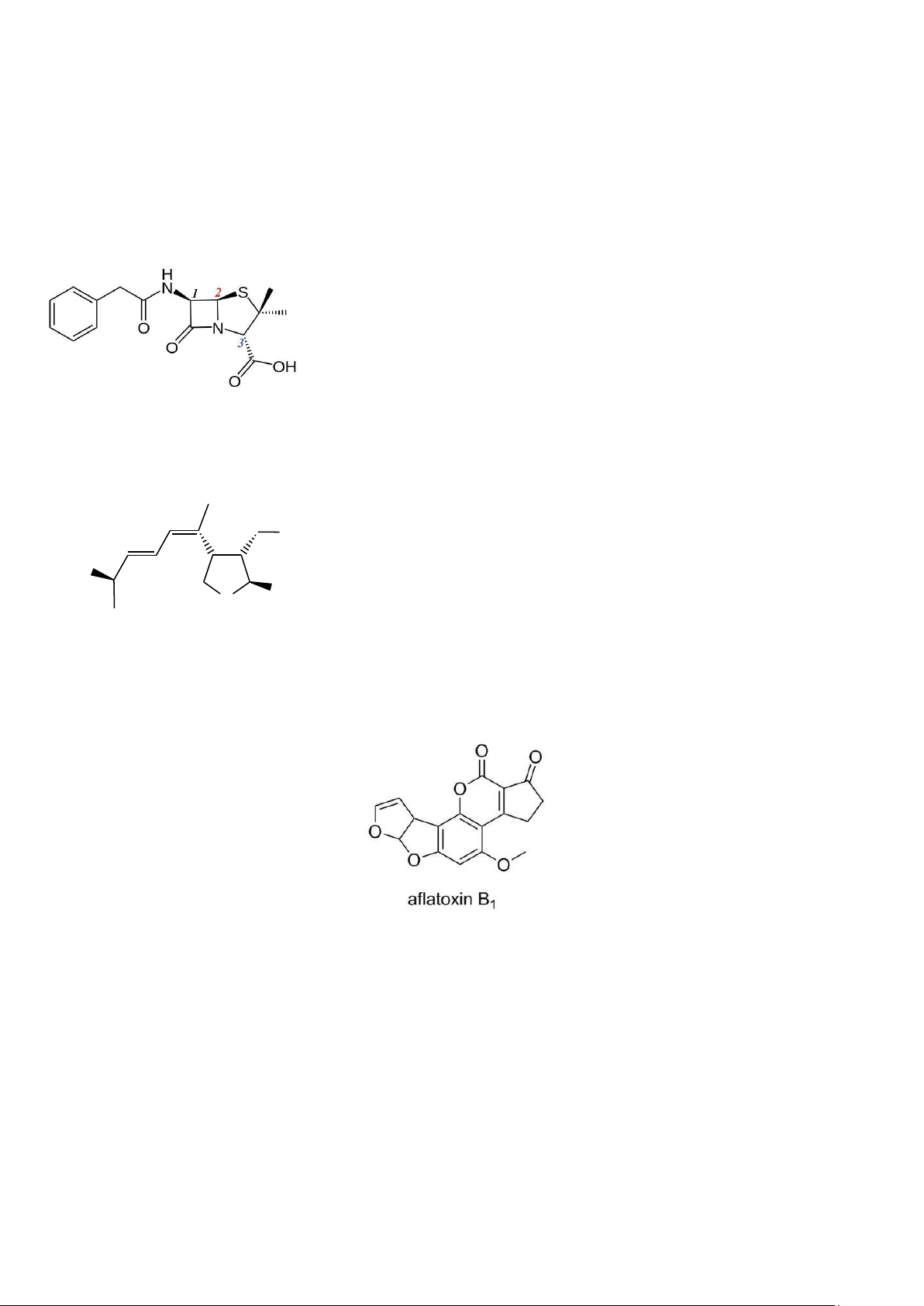
Câu 53: Penicillin G hay Benzylpenicillin tác dụng trên cầu khuẩn Gram (+) như tụ cầu, liên cầu, phế cầu và
Gram (-) như não mô cầu, lậu cầu và một số trực khuẩn gram (+). Penicillin G có công thức cấu tạo như hình sau:
Cấu hình tuyệt đối (R,S) của các carbon bất đối được đánh số thứ tự 1,2 và 3 là:
A. 1S; 2R; 3R. B.. 1R; 2R; 3R. C. 1S; 2S; 3S. D. 1R; 2S; 3S.
Câu 54: Axit Domoic (D) là một chất gây độc thần kinh.Công thức của (D) được cho như hình dưới. Cấu hình của
các trung tâm lập thể từ trái sang phải là: C O O H H O O C ( D ) C O O H N H A.R, E, Z, S, S, S.
B. S, E, Z, R, R, R C. R, Z, E, S, S, S. D. R, E, Z, S, S, R.
Câu 55: Aflatoxin là độc tố vi nấm sản sinh tự nhiên bởi một số loài nấm mốc, đáng chú ý nhất là Aspergillus
flavus và Aspergillus parasiticus. Aflatoxin là độc tố và là tác nhân gây ung thư.
Số tâm C bất đối có trong aflatoxin B1 là: A.1. B. 2. C. 3. D. 4
Câu 56: Cho các chất sau:
1) axit 2-hiđroxipropan-1,2,3-tricacboxylic (có trong quả chanh) 2)
axit 2-hiđroxipropanoic (có trong sữa chua).
3) axit 2-hiđroxibutanđioic (có trong quả táo).
4) axit 3-hiđroxibutanoic (có trong nước tiểu của người bệnh tiểu đường).
5) axit 2,3-đihiđroxibutanđioic (có trong rượu vang).
Thứ tự sắp xếp các axit trên theo chiều tính axit mạnh dần từ trái sang phải là:
A. 2,4,5,3,1. B. 4,2,3,5,1. C. 4,3,2,1,5. D. 2,3,4,5,1. 7 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
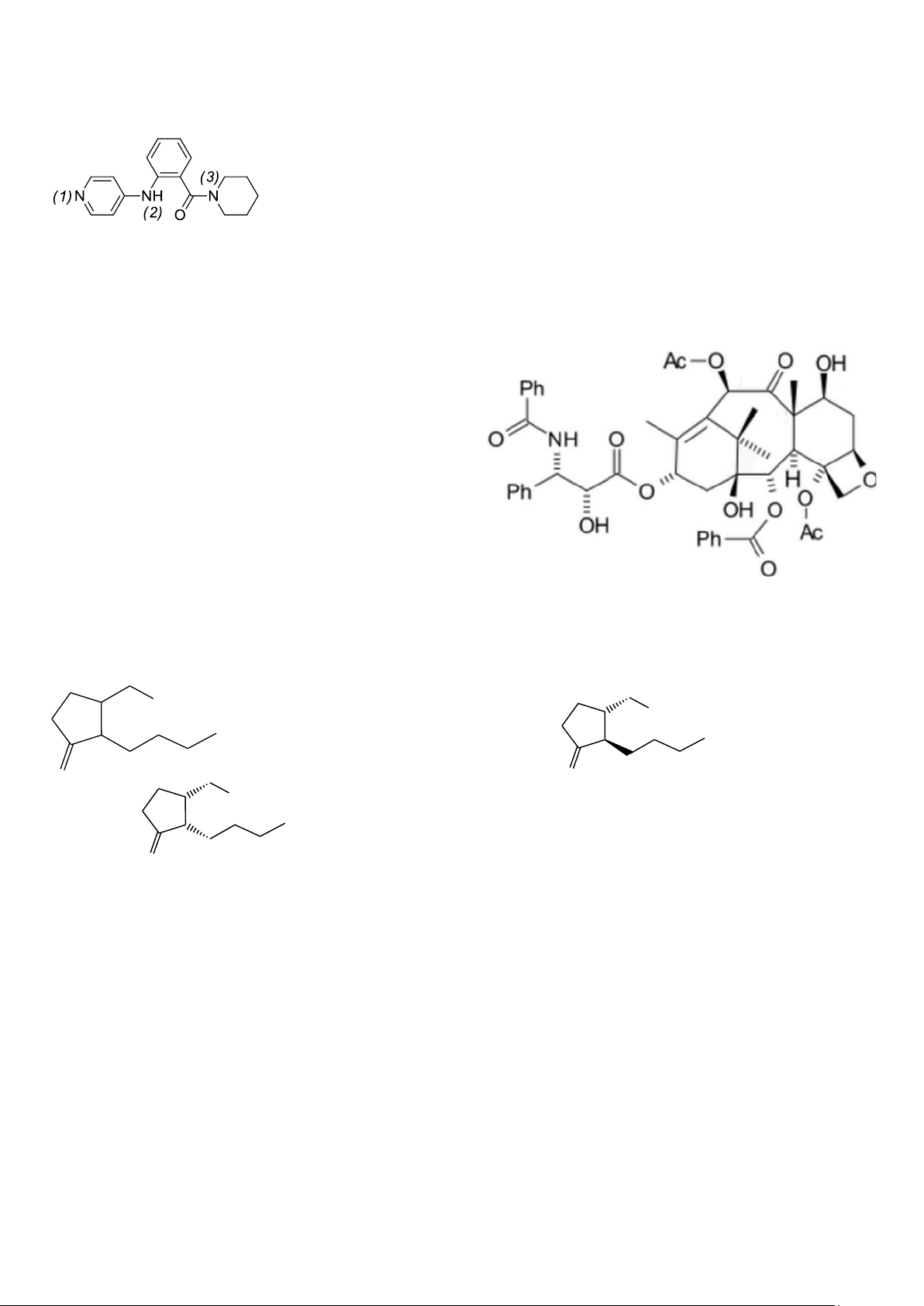
Câu 57: Nguyên tử N nào có tính base mạnh nhất trong Ofornin - một thuốc điều trị bệnh huyết áp:
A. (1). B. (2). C. (3) D. (2) và (3) như nhau.
Câu 58: Đầu những năm 1960, viện Ung thư Quốc gia Mỹ đã tách ra được một hợp chất có hoạt tính từ
cây Thông đỏ gọi là Taxol có tác dụng chống ung thư phổi, ung thư buồng trứng. Có bao nhiêu nguyên tử
cacbon bất đối mang cấu hình R trong phân tử Taxol: A. 4. B. 7. C. 8. D. 5.
Câu 59: Heđion (ký hiệu H) là tên thường của một hương liệu dùng để pha chế một số loại nước hoa nổi tiếng
như cK, NO–19, Eausausage, Anais – amais... Thực ra Heđion là hỗn hợp của 2 đồng phân lập thể C O O C H 3 C O O C H 3 ( H ) O ( H ) O 1 C O O C H 3 ( H ) O 2
Cho các nhận định sau về H1 và H2:
(1) H1 và H2 là đồng phân dia của nhau.
(2) Cấu hình của H1 từ trên xuống là S, R.
(3) Hỗn hợp đẳng mol H1 và H2 không quang hoạt vì là hỗn hợp racemic.
Số nhận định đúng là: A. 1. B. 2. C. 3. D. 0
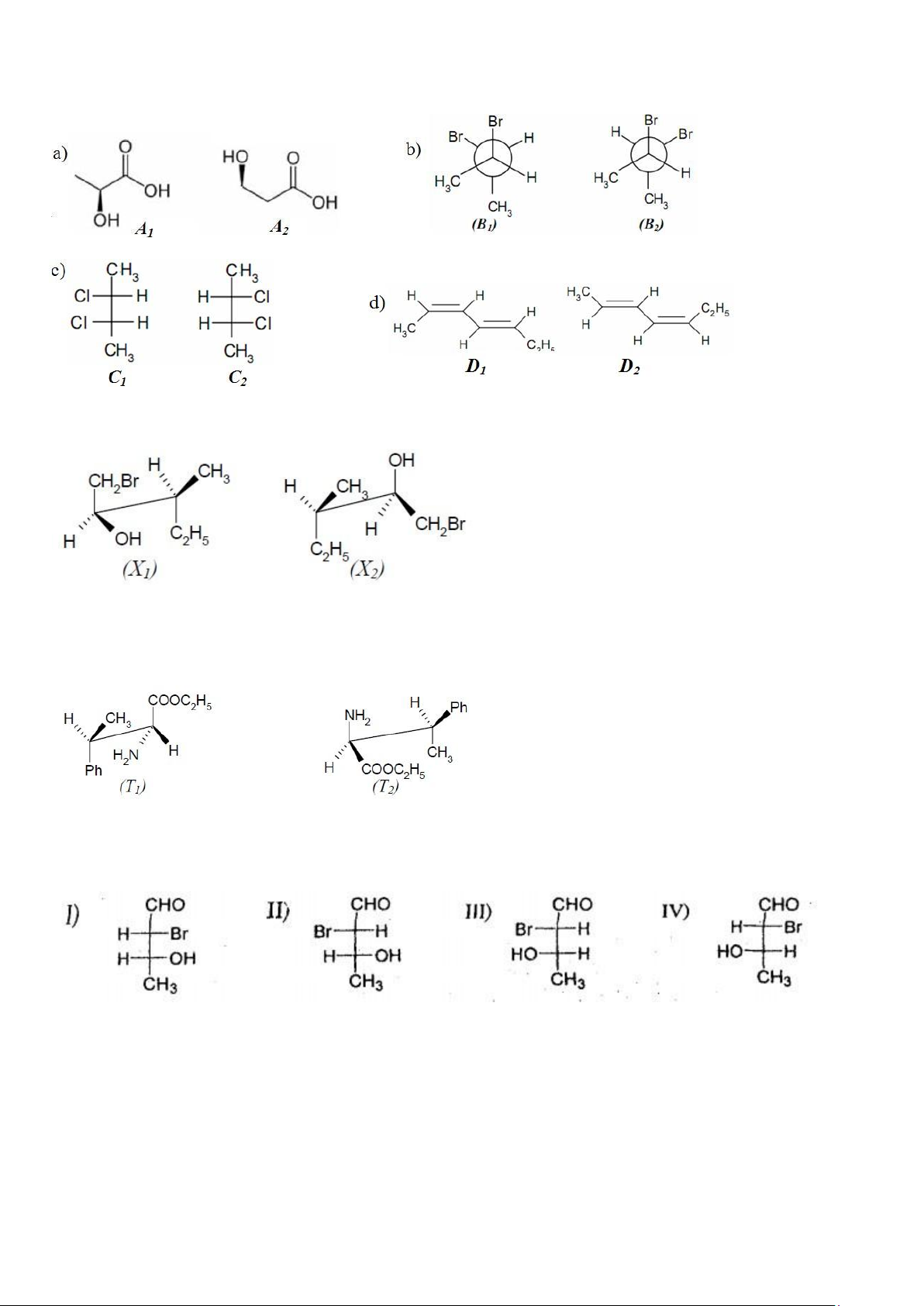
Câu 60: Trong các cặp công thức sau đây, cặp công thức nào biểu diễn cùng một chất: Các cặp công thức sau đây
liên quan với nhau như thế nào (đồng phân cấu tạo, đồng phân cấu hình, cùng một chất): 8 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt
Câu 61: Cho biết tương quan lập thể của hai đồng phân của 1-Bromo-3-methylpent-2-ol:
A. Là đối quang của nhau.
B. Là đồng phân enantiomers.
C. Là đồng phân diastrereomers. D. Là cùng một chất.
Câu 62: Cho biết tương quan lập thể của hai đồng phân:
A. Là đồng phân cấu trạng của nhau.
B. Là đồng phân enantiomers.
C. Là đồng phân diastrereomers. D. Là cùng một chất.
Cho các đồng phân sau được đánh số từ I đến IV hãy trả lời các câu hỏi từ 63 đến
Câu 63: Những chất nào là cặp đối quang threo? A. I, II. B. II, IV. C. I, III. D. III, IV.
Câu 64: Những chất nào có cấu hình L-2R-3S? A. I B. II C.III D. IV
Câu 65: Những chất nào là cặp đối quang erythro: 9 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt A. I, II. B. II, IV. C I,III D. III, IV.
Câu 66: Chất nào có cấu hình L-2S-3S? A. I B. II C.III D. IV
Câu 67: Chất nào có cấu hình D-2R-3R? A. I B. II C.III D. IV
Câu 68: Trong cơ chế phản ứng giữa But-2-en với Br2 trong môi trường nước tạo thành sản phẩm 3-Bromo-
2butanol thì nước đóng vai trò như:
A. Tác nhân Nucleophile
B. Tác nhân Electrophile C. Một base.
D. Một Nucleophile và một base.
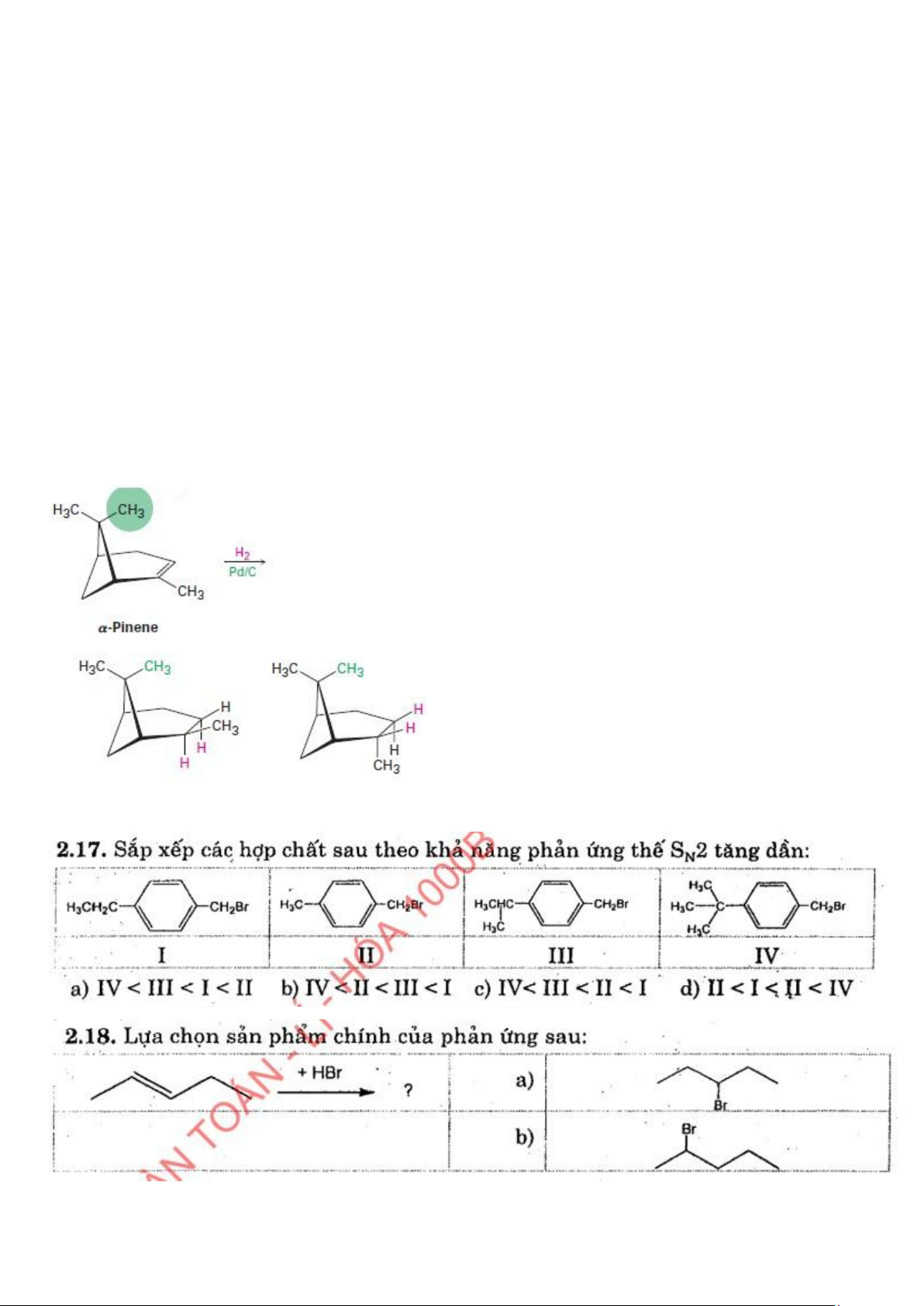
Câu 69: α-Pinene là một diterpene có trong tinh dầu thông. Hidro hóa hợp chất này với xúc tác Pd/C. Sản phẩm tạo thành là: A. B.
C. Cả A và B với cùng tỉ lệ.
D. Cả A và B nhưng khác tỉ lệ.
E. Phản ứng không xảy ra. 10 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt 11 lOMoAR cPSD| 47207194
Đỗ Nguyễn Tường Đạt fffff 12




