






Preview text:
Đoàn Minh Chánh 1614018 Nhóm 16HOH1A
Lê Văn Đạt 1614035 Ngày thực tập: 07/12/2017
BÀI TƯỜNG TRÌNH PHƯƠNG PHÁP CHUẨN ĐỘ COMPLEXON
I. Xác ịnh nồng ộ Mg2+ 1. Nguyên tắc và nội dung
Chuẩn ộ Mg2+ bằng dung dịch complexon III 0.01000 M trong ệm ammoniac
pH = 10 với chỉ thị NET. Màu chỉ thị chuyển từ ỏ nho sang chớm xanh chàm.
Phản ứng chuẩn ộ: Mg2+ + Y4ˉ MgY2ˉ
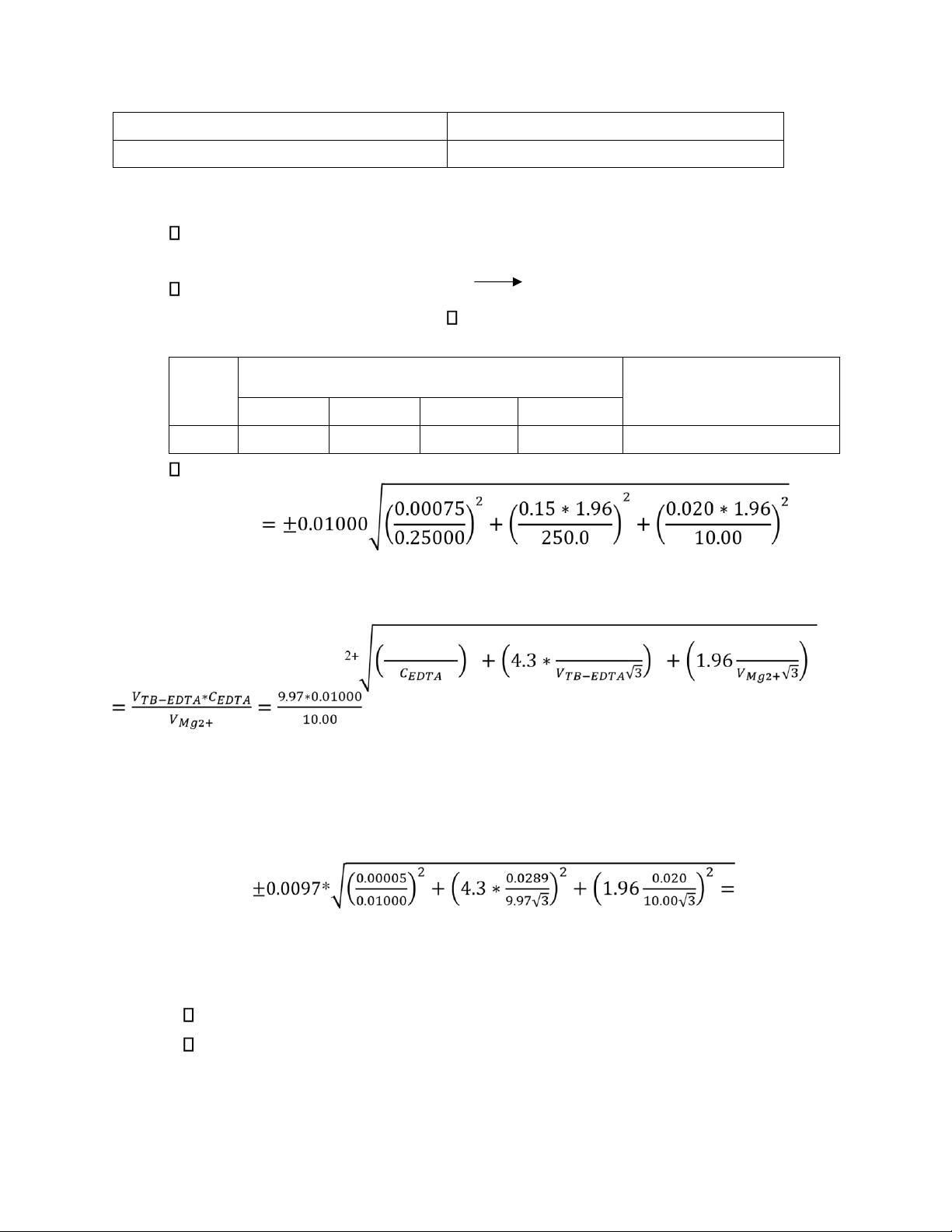
2. Kết quả thực nghiệm và tính toán Bảng kết quả: Chỉ VEDTA(mL) thị
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB NET 9.95 10.00 9.95 9.97 0.00970±0.00010 M
Tính toán và sai số:
𝜀0.95,𝐶−𝐸𝐷𝑇𝐴 = ±0.00005 𝑀 C 2+ Mg = 0.00970 𝑀 𝜀 2
𝜀0.95,𝐶−𝑀𝑔2+ = ± CMg 0.95−𝐸𝐷𝑇𝐴 𝑆𝑛,𝑏𝑢𝑟𝑒𝑡 2 𝜎𝑝𝑖𝑝𝑒𝑡 2 = ± 0.0001 𝑀
𝛍𝟎.𝟗𝟓,𝐂−𝐌𝐠𝟐+ = 𝟎. 𝟎𝟎𝟗𝟕𝟎 ± 𝟎. 𝟎𝟎𝟎𝟏 𝐌 Độ chính xác: 98.96% 3. Nhận xét
Sai số lớn, ộ chính xác chưa cao
Khi thêm chỉ thị, ta nên cho từ từ và lắc ều, không nên thêm quá nhiều
hoặc quá ít sẽ gây ảnh hưởng ến khả năng quan sát sự ổi màu của dung dịch. II.
Xác ịnh nồng ộ Ca2+ 1
1. Nguyên tắc và nội dung
Chuẩn ộ một thể tích chính xác muối Ca2+ bằng dung dịch (0.01000 ± 0.00004)M
với những nồng ộ khác nhau của Ca2+ (0.01M; 0.0005M không có MgY2− và
0.0005M có thêm MgY2−), bằng chỉ thị NET trong ệm pH=10.
Không có MgY2−( cả nồng ộ cao và thấp): Màu chỉ thị chuyển từ ỏ nho sang xanh
chàm rõ rệt. Khi Có MgY2−: Màu chỉ thị chuyển từ ỏ nho sang chớm xanh chàm. Phản ứng chuẩn ộ Không có MgY2− Có MgY2− Ca2+ + Inˉ => CaInˉ
Ca2+ + Inˉ => CaInˉ Mg2+ + Y4ˉ Ca2+ + Y4ˉ => CaY2ˉ => MgY2ˉ CaInˉ + Y’
=> CaY2ˉ + In’ CaInˉ + MgY2ˉ => CaY2ˉ + MgIn-
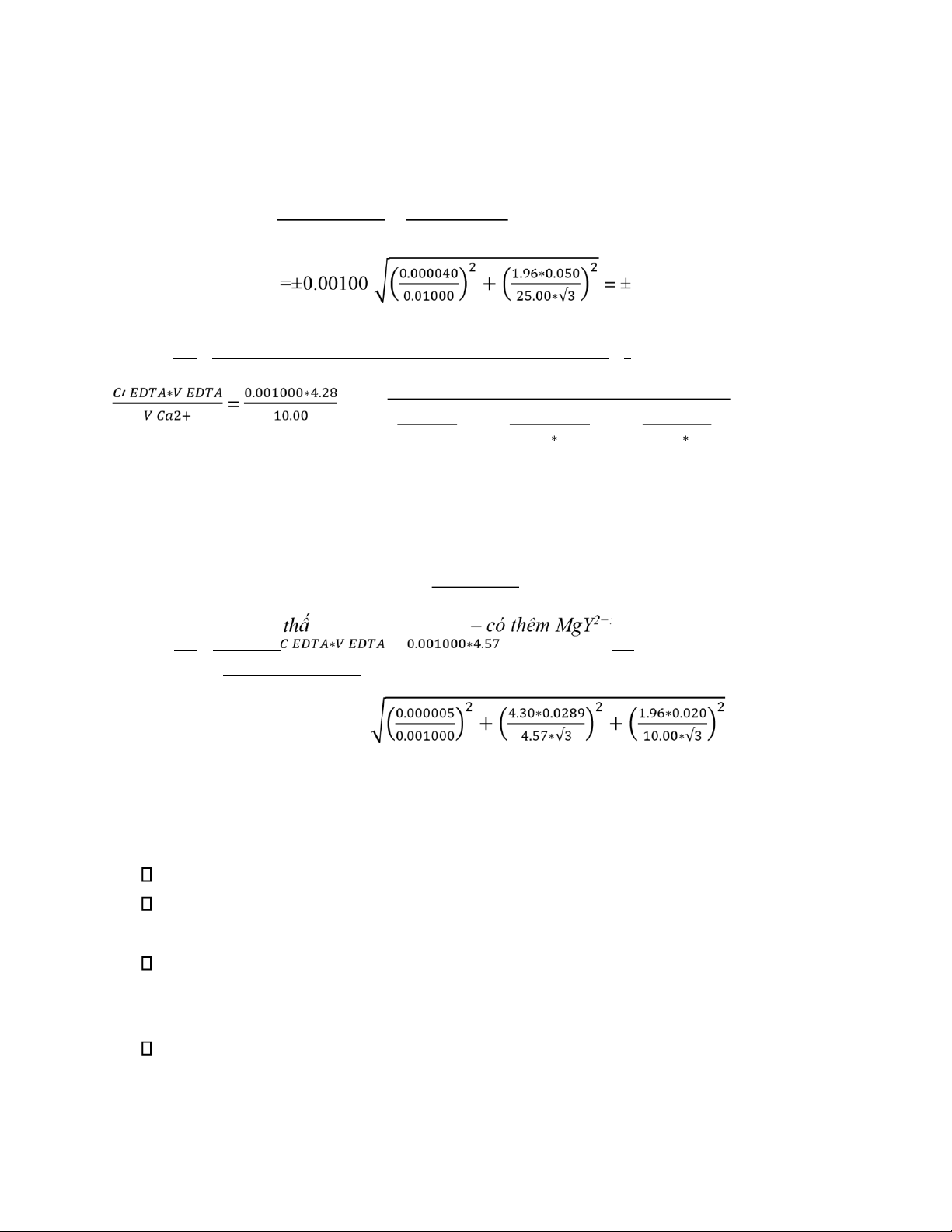
2. Kết quả thực nghiệm và tính toán Dùng chỉ thị NET Bảng kết quả: Nồng ộ VEDTA(mL) Ca2+
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB Nồng ộ cao 10.15 10.10 10.15 10.13 0.010130 ± 0.000085 M Nồng ộ thấp (không MgY2−) 4.30 4.25 4.30 4.28 0.000428 ± 0.000008M Nồng ộ thấp (có 4.55 MgY2−) 4.55 4.60 4.57 0.000457 ± 0.000008M
Tính toán và sai số:
Ca2+ ( EDTA 0.01M) - không thêm MgY2−: C Ca2+ = 2 2 √ 0.000040 4.30∗0.0289 1.96∗0.020 =0.010130 M ( ) + ( ) + ( ) 0.010000 10.13 ∗√ 3 10.00 ∗√ 3 2
ℇ 0.95, C Ca2+= ± 𝐶𝐶𝑎2+ = ±0.000085 M
𝛍𝟎.𝟗𝟓,𝐂−𝐂𝐚𝟐+ = 𝟎. 𝟎𝟏𝟎𝟏𝟑𝟎 ± 𝟎. 𝟎𝟎𝟎𝟎𝟖𝟓 𝐌 Độ chính xác = 99.16% 2
Pha dung dịch EDTA 0.001 M: Lấy chính xác 25.00 mL dung dịch EDTA
0.010000M từ burret vào bình ịnh mức 250mL, sau ó thêm nước cất vào ến vạch
mức, ậy nắp và lắc ều dung dịch, ta ược dung dịch EDTA 0.001000M.
𝐶 𝐸𝐷𝑇𝐴∗𝑉 𝐸𝐷𝑇𝐴 0.01000∗25.000 C’ =
EDTA = 𝑉 𝑏ì𝑛ℎ đị𝑛ℎ 𝑚ứ𝑐 250 = 0.00100 M Ɛ C′ EDTA 0.000005 M
μ0.95,C−E𝐷𝑇𝐴= (0.001000 ± 0.000005) M
Ca2+ (nồng ộ thấp; EDTA 0.001M) - không thêm MgY2−: C Ca2+ = 2 2 √ 0.000005 4.30∗0.0289 1.96∗0.020 =0.000428M ( ) + ( ) + ( ) 0.001000 4.28∗√ 3 10.00 ∗√ 3 2
ℇ 0.95, C Ca2+= ± 𝐶𝐶𝑎2+ = 0.000008 M
μ0.95,C−Ca2+ = 0.000428 ± 0.000008M
Độ chính xác= (1 - ℇ 0.95,C Ca2+ ) * 100=98.13% C Ca2+ Ca2+ (nồng ộ p;
EDTA 0.0005M) C Ca2+ = = =0.000457M 𝑉 𝐶𝑎2+ 10.00
ℇ 0.95, C Ca2+= ± 𝐶𝐶𝑎2+ = ±0.000006 M
𝛍𝟎.𝟗𝟓,𝐂−𝐂𝐚𝟐+ = 𝟎. 𝟎𝟎𝟎𝟒𝟓𝟕 ± 𝟎. 𝟎𝟎𝟎𝟎𝟎𝟖𝐌 Độ chính xác= 98.25% 3. Nhận xét
Độ chính xác không cao.
Ca2+ tạo phức với Y4- bền hơn so với Mg2+ nên dùng chỉ thị NET sẽ quan sát sự ổi
màu sớm, trước iểm tương ương. (sai số thiếu).
Ca2+ ở nồng ộ cao: iểm cuối nằm trong khoảng bước nhảy. Ca2+ ở nồng ộ thấp: iểm
cuối nằm ngoài khoảng bước nhảy (vì khi Co càng nhỏ thì khoảng bước nhảy càng bị thu hẹp).
Đối với Ca2+ nồng ộ thấp ta sử dụng EDTA có nồng ộ thấp ể ạt ộ chính xác cao hơn. 3
Chuẩn ộ Ca2+ ở nồng ộ thấp khi có thêm Mg2+ chính xác hơn vì khoảng bước nhảy
ược mở rộng hơn nên iểm cuối nằm trong khoảng bước nhảy (sự ổi màu ở ây là sự
ổi màu của MgIn- vì MgIn- bền hơn CaIn-).
Nồng ộ Ca2+ ở nồng ộ thấp khi có thêm Mg2+ cao hơn Ca2+ ở nồng ộ thấp khi
không thêm Mg2+ nhưng chênh lệch không áng kể. III. Xác ịnh ộ cứng
chung của nước máy
1. Nguyên tắc và nội dung
Xác ịnh nồng ộ Mg2+ và Ca2+ có trong nước cứng.
Chuẩn ộ một thể tích chính xác nước cứng trong môi trường ệm pH=10 bằng
dung dịch Complexon III (0.01000 0.00019) M với chỉ thị NET.
Phản ứng chuẩn ộ: Ca2+; Mg2+ + EDTA Phức 2. Kết quả thực nghiệm
và tính toán Bảng kết quả: Chỉ VEDTA(mL) thị
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB NET 3.50 3.50 3.55 3.52
𝜇𝐻Σ = 0.704 ± 0.015(m ∋ g) Vrỗng= 0.00 mL Tính toán và sai số: 𝑉
𝐻Σ = (𝑉𝑌 − 𝑉𝑟ỗ𝑛𝑔) 𝑉𝑚ẫ𝑢 100.00 = 0.704(m ∋ g)
Vì ống ong là dụng cụ không o ược ộ chính xác cao, nên bỏ qua sai số của ống ong. 𝜀0.95,𝐻Σ = 𝐻 𝜀0.95−𝐸𝐷𝑇𝐴 2 𝑆 2 ± 0.015 𝑀
𝝁𝑯𝚺 = 𝟎. 𝟕𝟎𝟒 ± 𝟎. 𝟎𝟏𝟓 (𝐦 ∋ 𝐠) Độ chính xác: 97.87% 3. Nhận xét
Do nồng ộ Ca2+ và Mg2+ trong mẫu khá thấp nên cần dùng một lượng lớn
chất mẫu. Sử dụng ống ong dẫn ến sai số lớn.
Trong nước máy có lẫn nhiều kim loại nên ta phải cho thêm 1 số hợp chất
nhằm hạn chế sự ảnh hưởng của các kim loại trên ối với quá trình chuẩn ộ. 4
Khi chuẩn ộ, nếu không ý lắc thật ều và kỷ sẽ dẫn ến sai số của thể tích
EDTA phản ứng, vì thể tích dung dịch lớn, chỉ thị chưa phản ứng kịp.
Nước cất chứa 1 lượng rất nhỏ Ca2+ và Mg2+, không làm ảnh hưởng ến kết quả chuẩn ộ.
IV. Xác ịnh nồng ộ Cu2+ với chỉ thị Murexide 1. Nguyên tắc và nội dung
Chuẩn ộ Cu2+ bằng EDTA với chỉ thị Murexide trong môi trường ệm amoniac
pH=8, chỉ thị có màu vàng. Đến khi chuẩn ộ tại diêm tương ương. Chỉ thị
chuyển từ màu vàng sang tím hoa cà.
Phản ứng chuẩn ộ: Cu(NH3)4 2+ + Y’ CuY2 ˉ + NH3
Phản ứng chỉ thị: CuH2Inˉ + Y’ CuY2 ˉ + In’
2. Kết quả thực nghiệm và tính toán Bảng kết quả: Chỉ VEDTA(mL) thị
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB MUR 10.30 10.35 10.25 10.30 0.01030 ± 0.00014 M Tính toàn và sai số:
𝐶𝐸𝐷𝑇𝐴 ∗ 𝑉𝑇𝐵−𝐸𝐷𝑇𝐴 0.01000 ∗ 10.30 𝐶𝐶𝑢2+ = == 0.01030 𝑀 𝜀0.95,𝐶−𝐶𝑢2+ ± 0.00014 𝑀
𝛍𝟎.𝟗𝟓,𝐂−𝐂𝐮𝟐+ = 𝟎. 𝟎𝟏𝟎𝟑𝟎 ± 𝟎. 𝟎𝟎𝟎𝟏𝟒 𝐌 Độ chính xác: 98.64% 3. Nhận xét Độ chính xác cao.
Phép chuẩn ộ này bắt buộc phải chọn iều kiện chuẩn ộ phù hợp pH=8, màu
sắc sẽ thay ổi rõ ràng.
Phải sử dụng dung dịch NH4Cl (Vì Cu2+ tạo phức tốt với NH3 nên với
pH=10 sẽ xảy ra sự tạo phức giữa NH3 và Cu2+,nên phải cho từ từ, tránh cho quá dư NH3).
V. Xác ịnh nồng ộ Pb2+ 1. Nguyên tắc và nội dung
Chuẩn ộ trực tiếp với chỉ thị XO
Chuẩn ộ trực tiếp Pb2+ bằng EDTA với chỉ thị XO tại môi trường ệm acetat
pH=5. Màu dung dịch chuyển từ ỏ tím sang vàng chanh 5
Phản ứng chuẩn ộ: Pb2+ + Y’ PbY2 ˉ Phản ứng
chỉ thị: PbH2In2 ˉ + Y’ PbY2 ˉ + In’
Chuẩn ộ thay thế với chỉ thị NET
Chuẩn ộ Pb2+ bằng chỉ thị NET, có mặt của Mg2+ trong ệm pH = 10.
Ban ầu iều chế lại dung dịch MgY2- (chuẩn ộ dung dịch Mg2+ 0.1M bằng dung dịch
complexon III 0.01M trong ệm pH = 10. Sau ó cho thêm dung dịch Pb2+ rồi chuẩn ộ bằng complexon III 0.01M.
Phản ứng chuẩn ộ: (Phản ứng thay thế ịnh lượng): Pb2+ + MgY2 ˉ PbY2 ˉ + Mg2+
2. Kết quả thực nghiệm và tính toán Bảng kết quả: Chỉ VEDTA(mL) thị
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB XO 10.45 10.40 10.40 10.42 0.01042 ± 0.00009 M NET 10.35 10.35 10.30 10.33
Sai số và tính toán
Chuẩn ộ trực tiếp với chỉ thị XO
𝐶𝐸𝐷𝑇𝐴 ∗ 𝑉𝑇𝐵−𝐸𝐷𝑇𝐴 0.01000 ∗ 10.417 𝐶𝑃𝑏2+ = == 0.01042 𝑀 𝜀 0.95,𝐶−𝐶𝑃𝑏2+ = ±0.00009 𝑀
𝛍𝟎.𝟗𝟓,𝐂−𝐏𝐛𝟐+ = 𝟎. 𝟎𝟏𝟎𝟒𝟐 ± 𝟎. 𝟎𝟎𝟎𝟎𝟗 𝐌 Độ chính xác: 99.14%
Chuẩn ộ thay thế với chỉ thị NET
𝐶𝐸𝐷𝑇𝐴 ∗ 𝑉𝑇𝐵−𝐸𝐷𝑇𝐴 0.01000 ∗ 10.333 𝐶𝑃𝑏2+ = == 0.01033 𝑀 𝜀 0.95,𝐶−𝐶𝑃𝑏2+ = ±0.00009 𝑀
𝛍𝟎.𝟗𝟓,𝐂−𝐏𝐛𝟐+ = 𝟎. 𝟎𝟏𝟎𝟑𝟑 ± 𝟎. 𝟎𝟎𝟎𝟎𝟗 𝐌 Độ chính xác: 99.12% 3. Nhận xét
Sai số ở 2 phép chuẩn ộ ều phụ thuộc chủ yếu vào nồng ộ EDTA em chuẩn. 6
Chuẩn ộ thay thế có ộ chính xác cao hơn so với chuẩn ộ trực tiếp vì khi có
thêm Mg2+ sẽ làm thay ổi khoảng nhảy và xác inh iểm cuối chính xác hơn.
Không thể dùng chỉ thị NET ở pH=10 ể chuẩn trực tiếp chì, vì ở pH=10
Pb(OH)2 ã kết tủa ngay khi pha dung dịch. ảnh hưởng ến quá trình chuẩn ộ,
còn ối với chuẩn ộ gián tiếp có thể dùng pH=10 vì có thêm Mg nên sẽ ưu tiên tạo phức PbY.
Lúc ầu phải iều chế MgY 2- nên cần phải cẩn thận, không ược cho dư
EDTA, nếu cho dư thì sẽ mắc sai số thừa. VI.
Xác ịnh hỗn hợp Al3+ + Fe3+ 1.
Xác ịnh lại nồng ộ Zn2+ với chỉ thị XO
a. Nguyên tắc
Phản ứng chuẩn ộ: Zn2+ + Y’ => ZnY2ˉ (Vàng chanh) (Hồng tím)
b. Kết quả thực nghiệm và tính toán
𝐶 𝐸𝐷𝑇𝐴∗𝑉 𝐸𝐷𝑇𝐴 0.01000∗10.00 = =0.011136 M 𝑉 𝑍𝑛2+ 8.98 2 2 √ 0.00004 4.30∗0.0289 1.96∗0.020 ( ) + ( ) + ( ) 0.01000 8.98∗√ 3 10.00 ∗√ 3 V Zn2+ (mL) Chỉ thị
Kết quả ± Khoảng bất ổn V1 V2 V3 VTB XO 9.00 9.00 8.95 8.98 0.011136 ± 0.000102 M C Zn2+ = 2
ℇ 0.95, C Zn2+= ± 𝐶 𝑍𝑛2+ = 0.000102 M
𝛍𝟎.𝟗𝟓,𝐂−𝐙𝐧𝟐+ = 𝟎. 𝟎𝟏𝟏𝟏𝟑𝟔 ± 𝟎. 𝟎𝟎𝟎𝟏𝟎𝟐 𝐌 Độ chính xác= =99.08%
2. Xác ịnh riêng Fe3+ với chỉ thị SSA
a. Nguyên tắc Chuẩn ộ trực tiếp Fe3+ bằng Na2H2Y ở khoàng 70oC với chỉ thị SSA
ến khi mất màu hồng tím.
Phản ứng chuẩn ộ: Fe3+ + Y’ => FeYˉ 7
b. Kết quả thực nghiệm và tính toán -
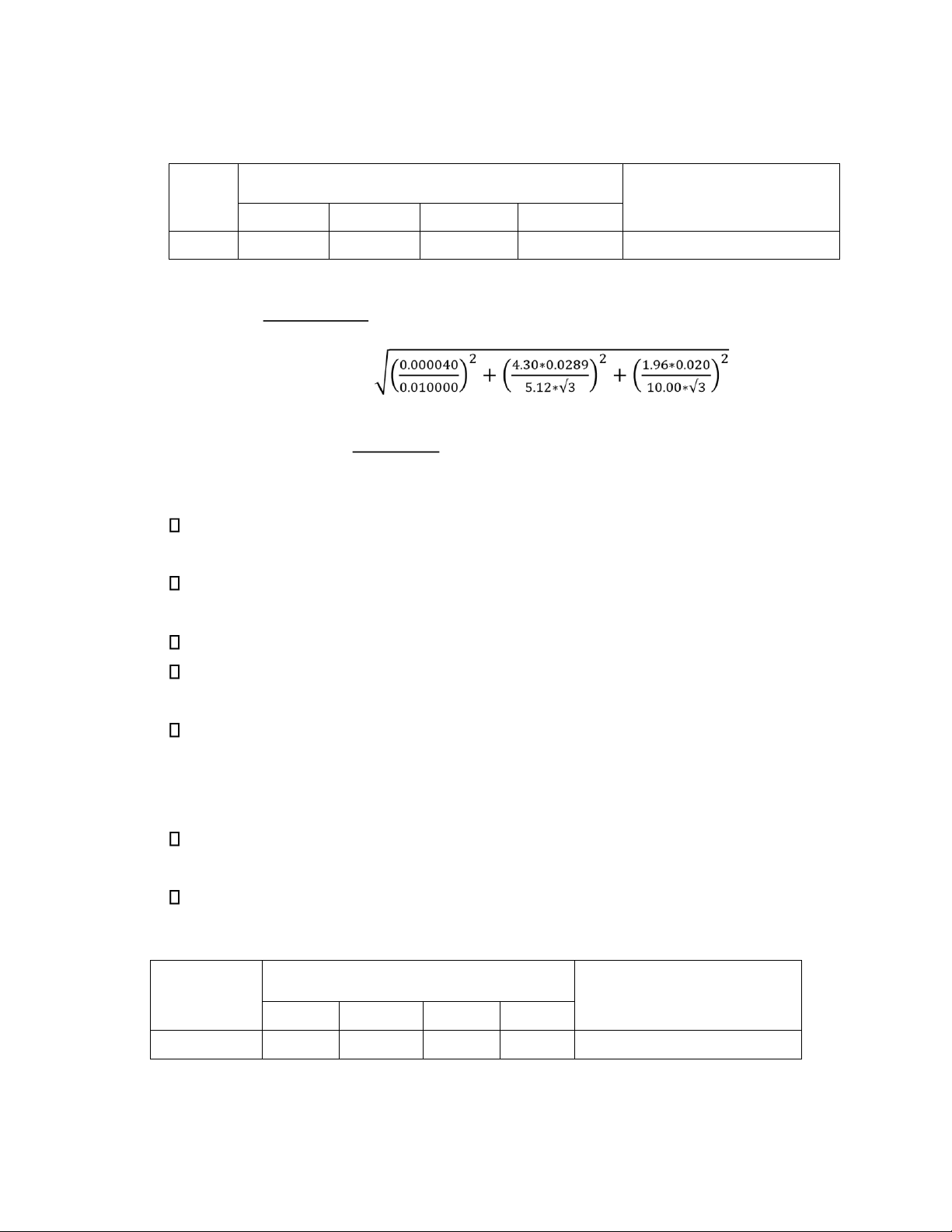
Bảng kết quả Chỉ VEDTA(mL) thị
Kết quả ±Khoảng bất ổn V1 V2 V3 VTB SSA 5.10 5.15 5.10 5.12 0.005120 ± 0.000076 M
- Tính toán và sai số
𝐶 𝐸𝐷𝑇𝐴∗𝑉 𝐸𝐷𝑇𝐴 0.01000∗5.12 C Fe3+ = = =0.005120M 𝑉 𝐹𝑒3+ 10.00
ℇ 0.95, C Fe3+= ± 𝐶𝐹𝑒3+ =0.000076 M
𝛍𝟎.𝟗𝟓,𝐂−𝐅𝐞𝟑+ =0.005120 ± 0.000076 M Độ chính xác= (1 -
ℇ 0.95,C Fe3+ ) * 100=98.52% C Fe3+ c. Nhận xét
Chuẩn ộ trực tiếp sẽ chính xác hơn gián tiếp và ít sai số hơn vì khi chuẩn ộ
gián phải qua nhiều giai oạn.
Cho thêm NH3 nhằm trung hòa dung dịch, sau ó cho thêm HCl ể tạo môi
trường acid có pH=2 khi ó chỉ thị SSA có tác dụng ‘‘che‘‘ Al3+.
Tránh dung dư HCl vì sẽ làm chỉ thị chuyển từ hồng tím sang nâu.
SSA là chất chỉ thị màu ặc hiệu dùng ể chuẩn sắt trong môi trường acid,
pH=2, hạn chế việc tạo phức hidroxo của Al3+ và Fe3+.
Cần un nóng nhằm làm tăng vận tốc phản ứng vì phản ứng này xảy ra khá
chậm ở nhiệt ộ thường.
3. Xác ịnh tổng Al3+ + Fe3+
a. Nguyên tắc
Xác ịnh tổng nồng ộ Al3+ và Fe3+ với chỉ thị XO bằng
phương pháp chuẩn ộ ngược.
Phản ứng chuẩn ộ: Zn2+ + Y’ => ZnY2ˉ vàng
chanh hồng tím b. Kết quả thực nghiệm và tính toán Bảng kết quả: V Zn2+ (mL) Chỉ thị
Kết quả ± Khoảng bất ổn V1 V2 V3 VTB XO 14.10 14.10 14.15 14.12 0.01088 ± 0.00011 M
Tính toán và sai số: 8 𝜎𝑝𝑖𝑝𝑒𝑡 ℇ𝑉ℎℎ = 𝑍0.95 ml
ℇ𝑉−𝐸𝐷𝑇𝐴 = 𝑍0.95 = 0.056 ml ƐVZn2+ = t 0.95; f =2 * 𝑆
𝐶𝐸𝐷𝑇𝐴 ×(𝑉𝐸𝐷𝑇𝐴−𝑉𝑍𝑛2+ ) C hh = = 0.010880 M 𝑉 ℎℎ
Đặt W= 𝑽𝑬𝑫𝑻𝑨 −𝑽𝒁𝒏𝟐+= 25.00 – 14.12 = 10.88 (mL) ƐW = = 0.091 (mL) µ(W) = (10.12 ± 0.091) mL Ɛ 𝐶 0.00011 M Độ chính xác = 98.99% c. Nhận xét
Độ chính xác không cao lắm.
Đun sôi 2 phút ể phản ứng xảy ra hoàn toàn (vì Fe3+ và Al3+ tạo phức với EDTA chậm).
Phải ể cho dung dịch nguội mới cho XO vào (vì chỉ thị này rất kém bền với nhiệt).
Không thể chuẩn ộ trực tiếp hỗn hợp vì Fe3+ và Al3+ có bán kính nhỏ nên
dễ bị thủy phân trong môi trường trung tính => phức hydroxo gồm Al(OH) 3- 3- 6 và Fe(OH)6
pK’ZnY < pK’AlY và pK’ZnY < pK’FeY
Vì Zn2+ phản ứng ược với H2Y2ˉ dư nhưng không phá vỡ phức AlYˉ và
FeYˉ nên sử dụng Zn2+ trong phép chuẩn ộ này.
4. Xác ịnh riêng Al3+ với chỉ thị XO a. Nguyên tắc
Chuẩn ộ Al3+ bằng phương pháp chuẩn ộ thay thế (chất chuẩn là Zn2+).
Cho thêm NaF vào dung dịch vừa chuẩn ộ. Khi ó chỉ có AlYˉ bị phân hủy và chuyển thành phức AlF 3ˉ
6 . Lượng Y” tạo ra tương ương với lượng Al. Ta
chuẩn ộ lượng Y” bằng dung dịch Zn2+ trong ệm pH = 5 với chỉ thị XO.
Dung dịch chuyển từ màu vàng chanh sang cam.
Phản ứng chuẩn ộ: Zn2+ + Y’ => ZnY2ˉ
Phản ứng tạo phức: AlYˉ + 6F’ => AlF63ˉ + Y’ 9
b. Báo cáo kết quả thực nghiệm và tính toán Bảng kết quả V Zn2+ (mL) Chỉ thị
Kết quả ± Khoảng bất ổn V1 V2 V3 VTB XO 3.40 3.45 3.50 3.45 0.003842 ± 0.000142 M Sai số và tính toán
𝐶 𝑍𝑛2+∗𝑉 𝑍𝑛2+ 0.011136∗3.45 C Al3+ = = =0.003842M 𝑉 𝐴𝑙3+ 10.00 0.000084 2 4.30∗0.05 2 1.96∗0.020 2 ) + ) + ) ℇ √ ( ( ( 0.95, 0.011136 3.45∗√ 3 10.00 ∗√ 3 C AL3+= ±𝐶𝐴𝑙3+ =0.000142 M Độ chính xác =96.30% c. Nhận xét
Độ chính xác không cao.
Tránh cho dư Zn2+ khi chuẩn ộ hỗn hợp vì khi ó Zn2+ sẽ phản ứng EDTA nên
bị ẩy ra khi ta cho thêm Fˉ sẽ gây ra sai số thiếu. Phức AlF63ˉ bền hơn phức
AlYˉ trong iều kiện pH=5, tuy nhiên FeF63ˉ kém bền hơn FeYˉ => Có thể chuẩn ộ riêng Al3+. * Nhận xét chung:
Độ chính xác ở các phép chuẩn ộ còn chưa cao.
Sai số lớn, chủ yếu là sai số do tay nghề của người chuẩn ộ.
Cần chú ý ến thao tác chuẩn ộ cũng như cách nhận biết sự ổi màu của dung dịch. 10



