





Preview text:
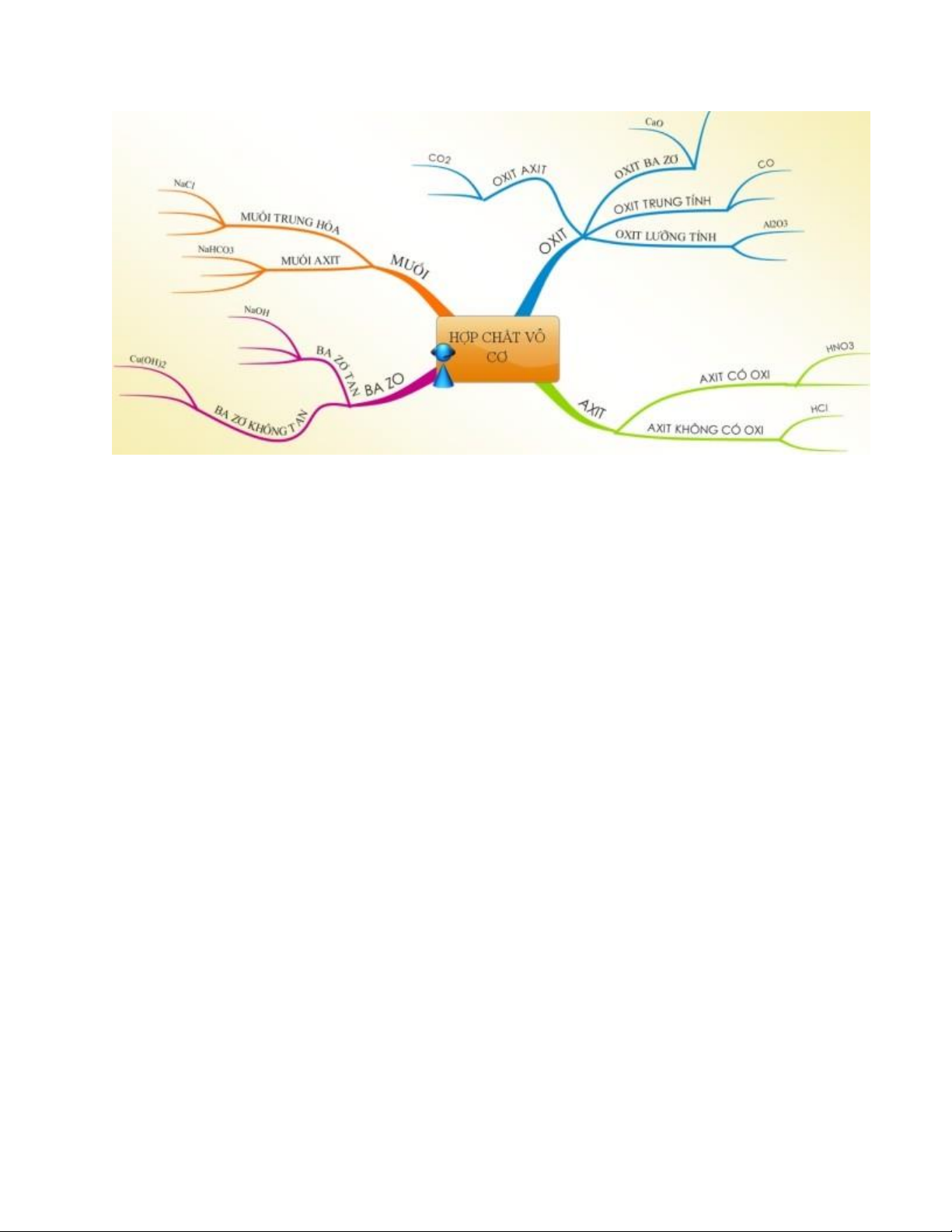
Bảng hệ thống hóa các loại hợp chất vô cơ
A. Bảng hệ thống hóa: Các loại hợp chất vô cơ OXIT AXIT BAZƠ MUỐI Là hợp chất mà phân tử gồm một Là hợp chất mà Là hợp chất mà
hay nhiều nguyên phân tử gồm Là hợp chất phân tử gồm một tử hiđro liên kết một nguyên tử KHÁI trong đó có hay nhiều nguyên với một gốc axit. kim loại liên kết NIỆM một nguyên tử kim loại liên kết Các nguyên tử với một hay tố là oxi với một hay nhiều hidro này có thể nhiều nhóm gốc axit thay thế bởi hidroxit (-OH) nguyên tử kim loại MxOy trong đó: M là M(OH)n trong MxRy trong đó: KHHH của CTHH HnR trong đó: đó: kim loại M là KHHH của TỔNG hoặc phi R là gốc axit, n là
M là KHHH của kim loại R là gốc QUÁT
kim; Hóa trị hóa trị của gốc axit kim loại; n là hóa axit; x, y là các chỉ của M là trị của kim loại. số 2y/x - oxit bazơ Theo thành phần: -Bazơ tan trong - axit có oxi nước (kiềm): - Muối trung hòa: - oxit axit
- axit không có oxi NaOH, KOH, CaCO3, Na2SO4, PHÂN Ca(OH)2, Cu(NO2)2... - oxit lưỡng Theo tính chất: LOẠI Ba(OH)2... tính - axit mạnh: HCl, - Muối axit: HNO3, H2SO4... - Bazơ không NaHCO3, NaHSO4, -oxit trung - axit yếu: H2CO3, tan: Cu(OH)2, Ca(H2PO4)2... tính H2S... Mg(OH)2, Fe(OH)2, Fe(OH)3...
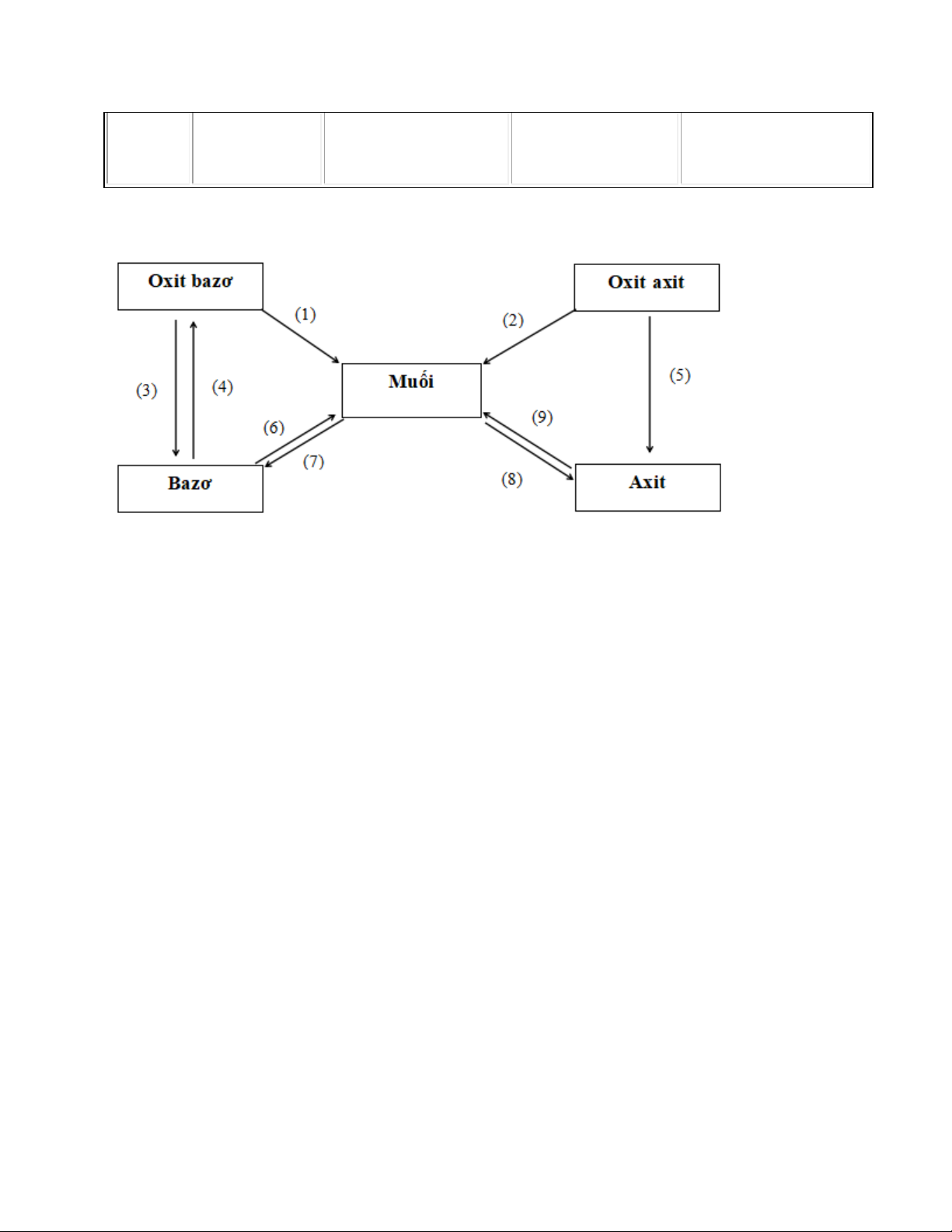
B. Sơ đồ mối quan hệ giữa các hợp chất vô cơ
Những phản ứng hóa học minh họa (1) CuO + 2HCl → CuCl2 + H2 (2) CO2 + KOH → K2CO3 + H2O (3) K2O + H2O → 2KOH o (4) Cu(OH) t 2 CuO + H2O (5) SO2 + H2O → H2SO3
(6) Mg(OH)2 + H2SO4 → MgSO4 + H2O
(7) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(8) AgNO3 + HCl → AgCl + HNO3
(9) H2SO4 + ZnO → ZnSO4 + H2O
C. Bài tập vận dụng nâng cao
Câu hỏi trắc nghiệm vô cơ
Câu 1. Dãy chất nào sau đây gồm các chất tác dụng được với dung dịch H2SO4 đặc, nóng? A. Cu, Mg(OH)2, CuO và SO2 B. Fe, Cu(OH)2, MgO và CO2
C. Cu, NaOH, Mg(OH)2 và CaCO3 D. Cu, MgO, CaCO3 và CO2
Câu 2. Dãy nào sau đây gồm các chất tác dụng được với dung dịch NaOH? A. CO2, HCl và CuCl2 B. KOH, HCl và CuCl2 C. CuO, HCl và CuCl2 D. KOH, CuO và CuCl2
Câu 3. Hỗn hợp gồm Cu và Al có khối lượng 10 gam tác dụng vừa đủ với dung
dịch HCl dư thu được 1,68 lít khí (đktc). Thành phần phần trăm khối lượng của Cu
và Al trong hỗn hợp lần lượt là: A. 27% và 73% B. 86,5% và 13,5% C. 50% và 50% D. 75% và 25%
Câu 4. NaOH không được tạo thành trong thí nghiệm nào sau đây?
A. Cho kim loại Na tác dụng với H2O
B. Cho oxit kim loại Na2O tác dụng với H2O
C. Cho Na2O tác dụng với dung dịch HCl
D. Cho Na2SO4 tác dụng với Ba(OH)2
Câu 5. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là: A. 2 B. 4 C. 3 D. 5
Câu 6. Thí nghiệm nào dưới đây không tạo ra muối
A. Cho bột CuO tác dụng với dung dịch HCl
B. Cho Fe tác dụng với dung dịch HCl
C. Cho muối NaCl tác dụng với AgNO3
D. Cho Ag tác dụng với H2SO4 loãng
Câu 7. Để phân biệt 3 chất rắn CaO, MgO, P2O5 có thể dùng thuốc thử là A. Dung dịch NaOH B. nước và quỳ tím C. Dung dịch Ca(OH)2 D. Dung dịch HCl
Câu 8 Cho hỗn hợp sau: NaCl, Na2CO3 và NaOH. Để thu được muối ăn tinh khiết,
từ hỗn hợp trên có thể dùng một lượng dư dung dịch chất nào sau đây? A. BaCl2 B. HCl C. Na2CO3 D. CaCl2
Câu 9. Hòa tan 1 gam mẫu đá vôi có thành phần chính là CaCO3 và tạp chất Fe2O3
vào 100 ml dung dịch HCl vừa đủ sinh ra 0,1792 khí (đktc). Nồng độ mol của dung dịch axit đã dùng là A. 0,16M B. 0,235M C. 0,25M D. 0,2M
Câu 10. Rót dung dịch BaCl2 dư vào cốc đựng dung dịch MgSO4. Dung dịch lượng
dư các chất theo thứ tự nào sao đây để tách riêng từng muối có trong dung dịch thu được? A. Ba(OH)2, HCl B. Na2CO3, HCl C. Ca(OH)2, HCl D. H2SO4, NaOH
Câu 11. Cho 8 gam hỗn hợp gồm Cu và Fe tác dụng với dung dịch HCl dư tạo
thành 1,68 lít khí H2 thoát ra ở đktc . Tính % về khối lượng của từng kim loại Cu có trong hỗn hợp? A. 47,5% B. 52,5% C. 42,6% D. 57,4%
Câu 12. Nung a mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2
gam hỗn hợp chất rắn. Hoà tan hoàn toàn hỗn hợp chất rắn trên bằng H2SO4 đặc,
nóng, dư thu được dung dịch Y và 6,72 lít khí SO2 (đktc). Giá trị của a mol là A. 0,7 mol B. 0,3 mol C. 0,45 mol D. 0,8 mol
Câu 13. Khi cho từ từ dung dịch K2CO3 vào dung dịch HCl khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho K2CO3 vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Câu 14. Hòa tan hết 3,53 gam hỗn hợp X gồm ba kim loại Mg, Al và Fe trong dung
dịch HCl thu được 2,352 lít khí hiđro (đktc) và dung dịch Y. Cô cạn dung dịch Y,
thu được m gam hỗn hợp muối khan. Giá trị của m là A. 11,195. B. 12,405. C .7,2575. D. 10,985.
Câu 15. Cho một lượng muối FeS2 tác dụng với lượng dư dung dịch H2SO4 loãng,
sau khi kết thúc phản ứng, thấy còn lại một chất rắn. Chất rắn này là: A. FeS
B. FeS2 chưa phản ứng hết C. S D. Fe2(SO4)3
Đáp án hướng dẫn giải chi tiết 1C 2A 3B 4C 5D 6D 7B 8B 9B 10A 11A 12A 13A 14D 15C Câu 7.
Thử với lượng nhỏ mỗi chất.
Cho nước vào các chất rắn, quan sát sau đó cho thêm quỳ tím: Không tan → MgO
+ Tan, tạo thành dung dịch làm quỳ tím hóa đỏ → P2O5 P2O5 + 3H2O → 2H3PO4
+ Tan, tạo thành dung dịch làm quỳ tím hóa xanh → CaO CaO + H2O → Ca(OH)2 Câu 11.
Vì Cu đứng sau H trong dãy các kim loại nên Cu không phản ứng với HCl. Fe + 2HCl → FeCl2 + H2 0,075 mol
Theo phản ứng trên,nFe = nH2 = 0,075 mol.
Suy ra khối lượng Fe = 56.0,075 = 4,2 g.
Khối lượng Cu = 8 - 4,2 = 3,8 g.
Từ đó, %Fe = 4,2.100/8 = 52,5%; %Cu = 100 - 52,5 = 47,5% Câu 12.
Xem hỗn hợp chất rắn là hỗn hợp của x mol Fe, 0,15 mol Cu và y mol O.
Ta có: mhh = 56x + 64.0,15 + 16y = 63,2 (1) Bảo toàn e : 3.nFe + 2.nCu = 2.nO + 2.nSO2
=> 3x + 0,3 = 0,6 + 2y => 3x − 2y = 0,3 (2)
Giải hệ (1) và (2) => x = 0,7 mol, y = 0,9 mol Câu 14. nH2 = 2,352/22,4 = 0,105(mol)
Phương trình tổng quát: Kim loại + HCl → Muối + H2
Bảo toàn nguyên tố H → nHCl = 2nH2 = 2.0,105 = 0,21 (mol) Bảo toàn khối lượng
→mmuoi = mX + mHCl − mH2 =3,53 + 0,21.36,5 − 0,105.2 = 10,985 (g) ............................