







Preview text:
lOMoARcPSD|46342985 lOMoARcPSD|46342985 Báo cáo thí nghiệm Lớp: L42 Nhóm: 3
Họ và tên thành viên MSSV
Bùi Nguyễn Việt Khoa 1913797 Huỳnh Công Hoàng Lâm 2113875 Đặng Thành Lâm 2111625 Bùi Quốc Minh 2111727
Bài 1: KỸ THUẬT PHÒNG THÍ NGHIỆM I.
Giới thiệu dụng cụ
a) Dụng cụ chứa hóa chất: cốc thủy tinh (becher), bình tam giác (erlen), bình cầu.
b) Dụng cụ lấy hóa chất
- Loại có thể tích chính xác: ống hút (pipet) 1ml, 5ml, 10ml,
25ml,…bình định mức (fiol) 100ml, 250ml, 500ml,…
- Loại có chia độ: gồm ống nhỏ giọt (buret), ống hút (pipep có
khắc vạch), ống đông các loại cốc thủy tinh và bình tam giác.
- Phễu chiết, phễu lọc Bunchenr, ống sinh hàn.
2. Một số loại máy thông dụng
a) Cân: Cân kỹ thuật, cân phân tích. b) Máy đo pH
c) Máy đo độ dẫn điện d) Lò nung e) Tủ sấy
3 Một số thao tác cơ bản
a) Rửa dụng cụ 1 lOMoARcPSD|46342985
b) Lắp ráp hệ thống thí nghiệm
c) Sử dụng máy đo
d) Dụng cụ pha chế hóa chất II. Thực hành
1. Thí nghiệm 1: Sử dụng pipep
- Dùng pipep 10ml lấy 10ml nước từ becher cho vào erlen
( hút nước bằng quả bóp cao su vài lần)l
- Lặp lại phần thực hành trên.
2. Thí nghiệm 2: Sử dụng buret
- Dùng becher 50ml cho nước cho vào buret.
- Chờ cho đến khi không còn bọt khí sót lại trong buret.
- Dùng tay trái mở nnhanh khóa burte sao cho dung dịch lấp
đầy phần cuối của buret.
- Chỉnh buret đến mức 0.
- Dùng tay trái điều hỉnh khóa buret để cho 10 ml nước từ buret bào becher.
3. Thí nghiệm 3: Chuẩn độ oxy hóa-khử
- Cân 0,9 g axit oxalic, hòa tan bằng nước cất thành 100 ml
dung dịch axit oxalic ( dùng fiol 100ml). Đổ dung dịch mới pha vào becher.
- Dùng pipep 10 ml lấy H10 SOml dung dịch axit oxalic trên cho erlen. Thêm 2 ml dung dịch 2 4KMnO1N.4
- Dung buret chứa dungKMnOdịch 0,1N. 4 KMnO
- Nhỏ từ từ dung dịchvào erlen trên, lắc đều cho đến khí
dung dịch trong erlen có màu tím nhạt.Đọc thể tích4 đã sử
dụng. Viết phương trình phản ứng tổng quát. Tính nồng độ axit 2MnOoxalic. Bi−ết+ phương5CO− trìn16Hhion+ →thu2Mngọ2+: + 10CO + 8H O 4 2 4 + 2 2
4. Thí nghiệm 4: Pha loãng dung dịch
- Dùng pipep bầu lấy 10 ml dung dịch HCl 1M cho vào bình đình
mức 100 ml. Kế đó thêm nước vào đến gần vạch trên cổ bình
định mức bằng ống đong. Cuối cùng dung bình tai cho từng giọt
nước cho đến vạch. Đậy nút bìn định mwucs, lắc đều. Ta thu
được 100 ml dung dịch HCl 0,1M.
5. Thí nghiệm 5: Kiểm tra nồng độ dung dịch axit đã pha loãng 2 lOMoARcPSD|46342985
- Lấy buret tráng sạch bang nước cất, sau đó tráng bằng dung dịch NaOH 0,1M.
- Cho dung dịch NaOH 0,1M vào buret, sau đó chuẩn đến vạch 0.
- Dùng pipep 10 ml cho vào erlen đã tráng bằng nước cất ( không
tráng thêm bằng axit HCL) 10 ml dung dịch HCl 0,1M vừa pha
xong, thêm 1 giọt chỉ thị phenolphthalein. Cho từ từ dung dịch
NaOH trên buret vào erlen, vừa cho vừa lắc đều cho đến khi
dung dịch chuyển sang màu xanh nhạt thì dừng lại.Đọc thể tích
dung dịch NaOH 0,1M đã dung ở trên buret.
- Tính lại nồng độ dung dịch axit vừa pha loãng.
- Lặp lại hai lần để tính kết quả trung bình.
Bài 2: Nhiệt phản ứng I.
MỤC ĐÍCH THÍ NGHIỆM
- Trong bài thí nghiệm này, chúng ta sẽ đo hiệu ứng nhiệt của các
phản ứng khác nhau và kiểm tra lại định luật Hess. II.
TIẾN HÀNH THÍ NGHIỆM
1. Xác định nhiệt dung của nhiệt lượng kế. - Cách xác đinh :
+ Lấy 50 ml nước ở nhiệt độ phòng cho vào bencher bên ngoài để đo nhiệt độ 0 0 + L
nước kho ng 60 cho vào nhiệt lượng kế. Sau khoảng ấy 50 ml ả 1 . ℃
2 phút, đo nhiệt độ + Dùng ph
ễu đổ nhanh 50 ml nước ở nhiệt độ phòng vào 50 ml 2.
nước trong nhiệt lượng kế. Sau khoảng 2 phút, đo nhiệt độ 3.
TN1: Xác định nhiệt dung riêng của nhiệt lượng kế Lần 1 Lần 2 Lần 3 1 65 31 2 48,5 3,03 3 0 0 Ta có: = . − = . . − , = ( − )−( − ) ( , − ).( − , ) Xác , 2.
định hiệu ứng nhiệt của phản ứng trung hòa HCl và NaOH. 3 lOMoARcPSD|46342985 ả ệ a) Mô t thí nghi→ m + 2 HCl + NaOH -
Dùng buret lất 25 ml dung dị.ch NaOH 1M cho vào vecher 100 ml
để bên ngoài. Đo nhiệt độ 2 -
Dùng phễu đổ nhanh becher chứa dung dịch NaOH vào HCl chuwaas trong nhiệt lượ.ng kế. Khuấy đều dung dịch trong nhiệt
lượng kế. Dô nhiệt độ 1= ( 0 0 + )∆ -
Xác định ∆ Qphản ứng thoe công thức , từ đó xác định .
TN2: Xác định nhiệt hòa tan phản ứng trung hòa HCl và NaOH Lần 1 Lần 2 Lần 3 1 31 31 31 31 3 35,5 36 2 Q(cal) 238.635 265,15 ì ℎ( ) 9545,4 10606 251,89 ∆ ( ) Q = (( 0 0 + +). ( 3 − 1+ 2 2 ) = (3,03 + 25 + 25). (35,5 − 31+31 ) = 238,635( ) 2 51 , 89 ∆ = = 0,025 = 10075,6 ( )
nghiệm. ẽ xác đị 4
3. Xác định nhiệt hòa tan Cu
khan – kiểm tra đinh luật Hess - Chúng ta s
nh hiệu ứng hòa tan của Cu
khan bằng thực 4
+ Cho vào nhiệt lượng kế 50 ml nước. Đo nhiệt độ + 4 2 . + Cân chính xác 4g
vừ a can vào nhiệt lượ ng 1ế ấy đề k , khu u cho
tan hết.. Đo nhiệt độ Xác định Q. Lần 1 Lần 2 Lần 3 m(g) 3,92 3,96 4 lOMoARcPSD|46342985 30,05 30,05 2 35 35,5 1 Q (cal) 281,9025 310,5955 ∆ (cal) 296,249 = ( 0 0 + +). ( 2− 1) (cal/mol) -11276,1 -12423,82 ∆ = = −11849,96∆ 0,025 − −296,249 = (cal/mol)4 2 2 4
Do đây là quá trình tỏa nhiệt nên
mang dấu “-“ Làm tương tự ở ục 3 4 4 ệ ủ ị
4. Xác định nhiệt hòa tan của
Lưu ý: Cách xác định nhiệt độ ả ứ ả 4 - m nhưng thay khan bằng . Cho
nhi t dung riêng c a dung d ch
gần đúng là 1 cal/mol.độ. sau khi ph n ng x y ra.
- Đo nhiệt độ trước phản ứng trong nhiệt lượng kế .
- Vho chất phản ứng vào nhiệt lượng kế.Đo nhiệt độ sau mỗi 30 giây.
- Vẽ đồ thị ∆ nhi.ệt độ theo thời gian. - Xác định 30,05 30,05 ầ ệ độ℃ Nhi t Lần 1 Lần 2 L n 3 1 27 27,05 (gam) 3,96 3,9 m 2 Q (cal) -173,81 -170,97 6952,4 -6838,8 Q ∆ ( / ) (cal) 172,39 ( 0 0+ 2 2 +44 ). ( 2 − 1)
đây là quá trình thu nhiệt nên ấ “ ” ∆ = = ∆ 5 Do mang d u + . lOMoARcPSD|46342985 ∆Ht 2 H h → ịO ụ ớ III. Câu hỏi 1.
của phản ứng HCl + NaOH NaCl +
sẽ được tính the osso
smol HCl hay NaOH khi cho 25 ml dung d ch HCl 2M tác d ng v i 25 = 0,025 à= 2.0,025 = 0,05
ml dung dịch NaOH 1M? Tại sao? không? 3 1
NaOH phản ứng hết, tính theo NaOH.
2. Nếu thay HCl bằng HN
thì kết quả thí nghiệm 2 có thay đổi hay
- Không thay đổi vì HCl và HN 3 đều là axit mạnh, phân li hoàn toàn ể ệ n gh iệ∆ 3
và đây là phản ứng trung hòa. 3. Tính
bằng lí thuyết theo định luật Hess. So sánh với kết quả thí
m. Hãy xem 6 nguyên nhân có th
gây ra sai só trong thí nghi m này:
- Mất nhiệt do nhiệt lượng kế.
- Do nhiệt kế.
- Do dụng cụ đong thể tích háo chất. - Do cân.
- Do sunfat dồng bị hút ẩm.
- Do lấy nhiệt dung riêng của dung dịch sunfat đồng bằng 1 cal/mol.độ.
Theo em, sai số nào là quan trọng nhất còn nguyên nhân nào khác không? Trả lời:
+ ∆ 2 = −18,7 + 2,8 = −15,9 ∆ 3 = ∆ 1
- Theo định luật Hess
- Theo thực nghiệm = −15900 / ∆ = -11849,96 cal/mol
Ta thấy độ chênh lệch là lớn, nguyên nhân có thể là:
- Mất nhiệt do nhiệt lượng kế là quan trọng nhất, do quá trình
thao tác không hoàn toàn chính xác dẫn đến sự mất nhiệt không cần thiết. 6 lOMoARcPSD|46342985 -
Sunfat đồng khan bị hút ẩm, lấy và cần không nhanh dễ làm cho đồng
sunfat4.5 2 b.ị hút ẩm ảnh hưởng đến hiệu ứng nhiệt
Bài 4: XÁC ĐỊNH BẬC PHẢN ỨNG I. MỤC ĐÍCH
- Nghiêng cứu ảnh hưởng của nồng độ đến vận tốc phản ứng.
- Xác định bậc của phản ứng phân hủy 2 2 3trong môi trường
axit bằng thực nghiệm. ẩ ị ố ệ II.
TIẾN HÀNH THÍ NGHIỆM 2 4 2 2 3 và 2 theo bảng
1. Xác định bậc phản ứng theo - Chu n b 3 ng nghi m chứa và 3 tam giác chứa
- Dùng pipet khắc vạch lấy axit cho vào ống nghiệm
- Dùng buret cho nước vào 3 bình tam giác trước. Dau đó tráng buret bằng 2 2 3 vào các bình cầu
- Chuẩn bị đồng hồ bấm giây.
- Lần lượt cho phản ứng từng cặp ống nghiêm và bình tam giác.
- Lặp lại thí nghiệm 1 lần nữa để tính giá trị trung bình. Thời gian (s) Lần 1 Lần 2 Lần 3 Bình 1 82 55 26 Bình 2 85 58 27
Thao tác tương tự ầ Bình 3 sau: 2 2 3
2. Xác định bậc phản ứng theo -
ph n 1 với lượng axit và theo bảng Thời gian (s) Lần 1 Lần 2 Lần 3 Bình 1 57 55 54 Bình 2 58 56 54 -
Xác định bậc phả
n ứng của 2 2 3 Bình 3 7 lOMoARcPSD|46342985 : +Xác định 1 1 0,5761 1 = lglg ((2)) +Xác định = 2 : lg ( 12 ) B c ph n ng theo = 2 = = 1,0809 ậ ả ứ lg (2) 0,5761+1,0809 1+ 2 - Xác
nh b c ph n ứng của = = 0,8285 đị 2 2 ậ ả 2 2 3 +Xác định : 24 1 lg ( 1 ) 1 = = 0,0515 +Xác định : lg (2) 2 2 0,0525 )
Bậc của phản ứng theo 2 = = lglg ((2)3 = 0.052
III. TRẢ LỜI CÂU HỎI 2 4 = 1+ 22
1. Trong thí nghiệm trên, nồng đồ của và đã ảnh h ng th nào n v n t c ph n
ng? Viết lại biểu thức tính vận tốc? ưở ế đế ậ ố ả ử2 2 3 2 4
Tính bậc của phản ứng?
- Nồng độ của
tỉ lệ thuận với tốc độ phản ứng, nồng độ c a
h u như không ả nh hưởng đến tốc độ phả n ứng. - ủ 2 3 ầ 2
Bi u thức tính vận tốc: v = k. [ 2 2 3]0,8285. [ 2 4]0.052 ể 2 4
- Bậc của phản ứng: 0,8285+0,052=0.8805
2. Dựa vào kết quả thí nghiệm có thể kết luận phản ứng (1) hay phản
ứng (2) là phản ứng quyết định vận tốc của phản ứng tức là phản
ứng xảy ra chậm nhất không?Tại sao?
- (1) là phản ứng trao đổi ion nên tốc độ phản ứng xảy ra rất nhanh.
- (2) là phản ứng tự oxi hóa khử nên tốc độ phản ứng xảy ra rất chậm.
Vậy phản ứng (2) quyết định tốc độ phản ứng.
3. Dựa trên cơ sở phương pháp thí nghiệm thì vận tốc trên được
xác định là vận tốc trung bình hay vận tốc tức thời? 8 lOMoARcPSD|46342985 ∆ =ể∆ /∆ ~0) ồ độ ủ ưu huỳ đ
- Vận tốc được xác định theo công thức ( (biến ậ ố ố ứ ∆ thời. ệ đượ ậ thiên n ng c a l nh không
áng k trong khoảng thời gian
) nên v n t c trong các thí nghi m c xem là v n t c t c
4. Thay đổi thứ tự cho 2 4và2 2 3 thì bậc phản ứng có thay đổi không? Vì sao?
- Không thay đổi vì ở một nhiệt độ xác định bậc phản ứng chỉ
phụ thuộc vào bản chất của hệ mà không phụ thuộc vào thứ tự
chất phản ứng.
Bài 8: PHÂN TÍCH THỂ TÍCH I.
THỰC HÀNH THÍ NGHIỆM 1.
TN1: Xây dựng đương cong chuẩn độ 2. TN2:
- Chuẩn độ axit-bazo bằng thuốc thử phenol phtalein
- Tráng buret bằng NaOH 0,1N, cho NaOH 0,1N vào buret
- Dùng pipep 10ml lấy 10ml dung dịch HCl cho vào erlen
150ml, thêm 10ml nước cất + 2 giọt phenol phtalein.
- TIến hành chuẩn độ 3. TN3:
- Làm tương tự TN2, thay phenol phtalein bằng metyl da cam. 4. TN4:
- Làm tương tự thí nghiệm 2, thay HCl bằng axit acetic
- Làm thí nghiệm 4 lần, 2 lần đầu là phenol phtalein, 2 lần sau là metyl da cam. II.
KẾT QUẢ THÍ NGHIỆM
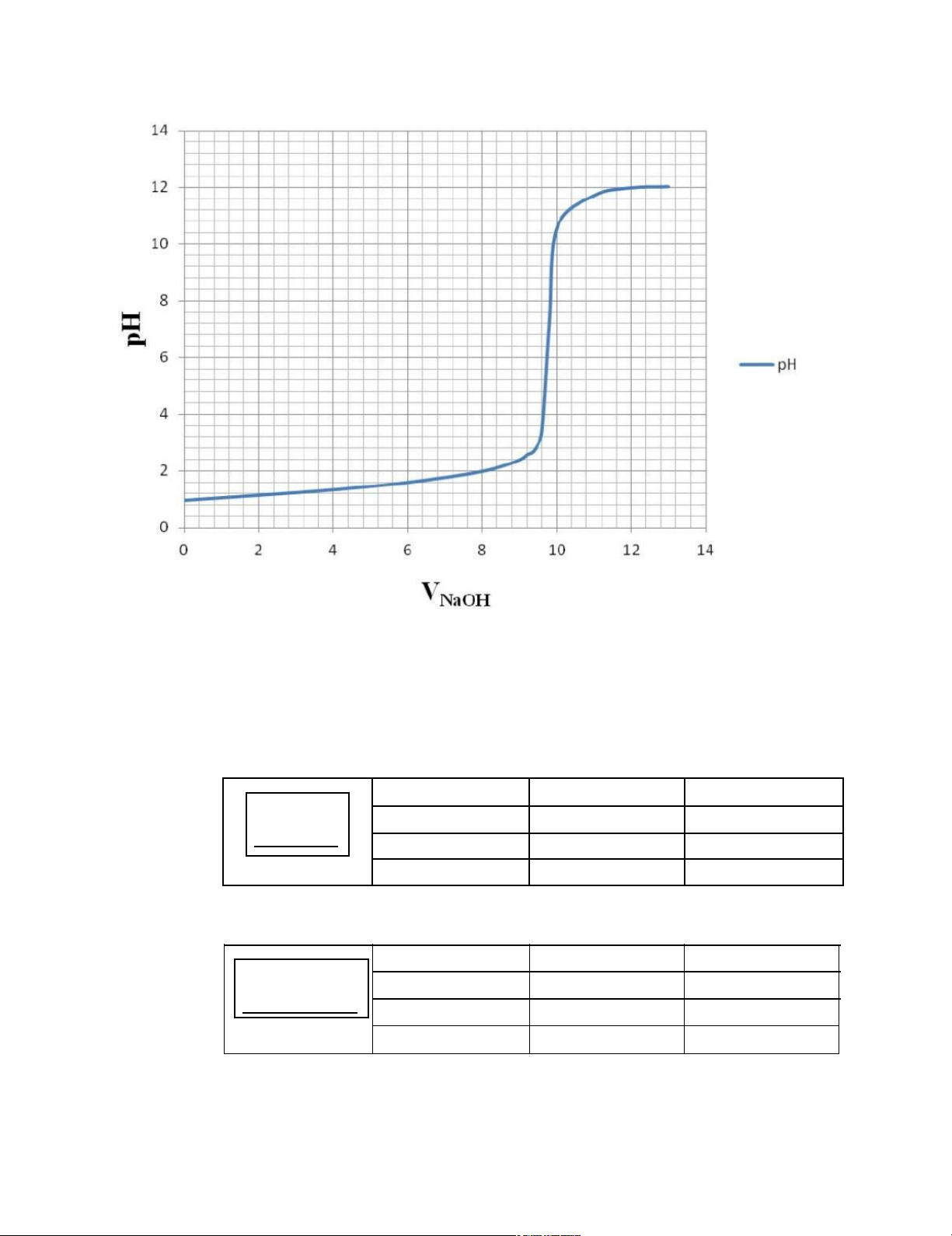
1. TN1: Xác định đường cong chuẩn độ HCl bằng NaOH 9 lOMoARcPSD|46342985 Xác định:
- pH điểm tương đương :7,26
- Bước nhảy pH: từ pH 3,36 đến pH 10,56
- Chất chỉ thị phù hợp: phenol phtalein
2. TN2: Chuẩn độ HCl với phenolphthalein Lần 1 Lần 2 Lần 3 Thể tích 11,2 11,4 NaOH 0,1N
3. TN3: Chuẩn độ HCl với metyl da cam Lần 1 Lần 2 Lần 3 Thể tích NaOH 10,9 11 0,1 N
4. TN4a: Chuẩn độ C 3 với phenolphthalein 10 lOMoARcPSD|46342985 Lần 1 Lần 2 Lần 3 Thể tích 10,1 9,7 NaOH 0,1N
TN4b: Chuẩn độ C 3 với metyl da cam Lần 1 Lần 2 Lần 3 Thể tích NaOH 3,4 3,7 0,1 N III. TRẢ LỜI CÂU HỎI
1. Khi thay đổi nồng độ NaOH và HCl, đường cong chuẩn độ có thay đổi hay không? Tại sao?
- Khi thay đổi nồng độ NaOH và HCl, đường cong chuẩn độ không
thay đổi do phương pháp chuẩn đổ HCl bằng NaOH được xác định +→+2
dựa trên phương trình: ớ ố.=. ũ - V i và và c định nên khi tăng hay giảm thì
c ng tăng hay giảm theo. Từ đó, ta suy ra dù mở rộng hay thụ hẹp
thì đường cong chuẩn độ cũng không thay đổi.
2. Việc xác định nồng độ HCl trong các thí nghiệm 2 và 3 cho kết
quả nào rõ ràng hơn? Tại sao?
- Xác định nồng độ HCl trong thí nghiệm 2 cho kết quả rõ hơn. Vì
phenolphtalein cho kết quả rõ nét hơn, do chuyển từ không màu
sang hồng nhạt, dễ nhận thấy hơn từ đỏ chuyển sang da cam.
3. Từ kết quả thí nghiệm 4, xác định nồng độ axit axetic bằng chỉ
màu nào chính xác hơn? Tại sao?
- Phenolphtalein chỉ thị màu chính xác hơn metyl da cam vì
axit axetic là axit yếu nên điểm định mức lớn hơn 7.
4. Trong phép phân tích thể tích, nếu đổi vị trí của NaOH và axit thì
kết quả có thay đổi không? Tại sao?
- Không thay đổi vì đây cũng chỉ là phản ứng cân bằng. Hết 11




