




































Preview text:
ĐẠI HỌC QUỐC GIA THÀNH PHỐ HỒ CHÍ MINH ĐẠI HỌC BÁCH KHOA
KHOA KỸ THUẬT HÓA HỌC __________
BÁO CÁO THÍ NGHIỆM HOÁ VÔ CƠ
Giảng viên hướng dẫn : Nguyễn Tuấn Anh
Sinh viên thực hiện : Lê Hữu Toàn 61304190 Lương Thị Mỹ Trang 61304228 Lớp : HC13HD
Nhóm : L03 ( Buổi học - chiều thứ 3) Tổ : 10
Thành phố Hồ Chí Minh, tháng 11 năm 2014 1
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 1: KIM LOẠI KIỀM (Phân nhóm IA)
Ngày thí nghiệm: 26/08/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại kiềm trong bản phân loại tuần hoàn Mendeleev, cấu hình electron,
trạng thái oxy hóa, tính chất vật lý và hóa học kim loại kiềm và các hợp chất của nó.
- Hiểu rõ về cách điều chế cacbonat natri bằng phương pháp Solvay.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT NGHIỆM SÁT HIỆN TƯỢNG
PHƯƠNG TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
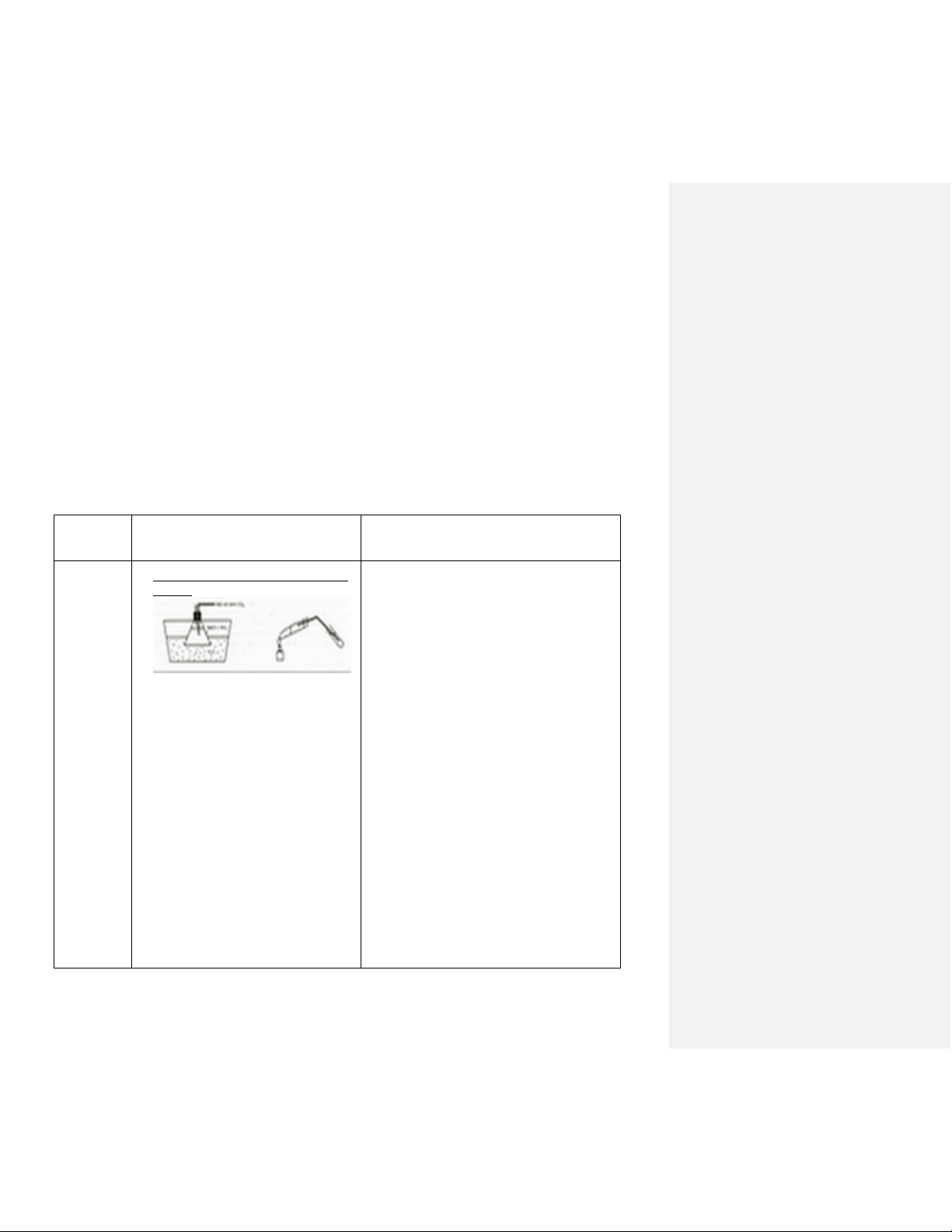
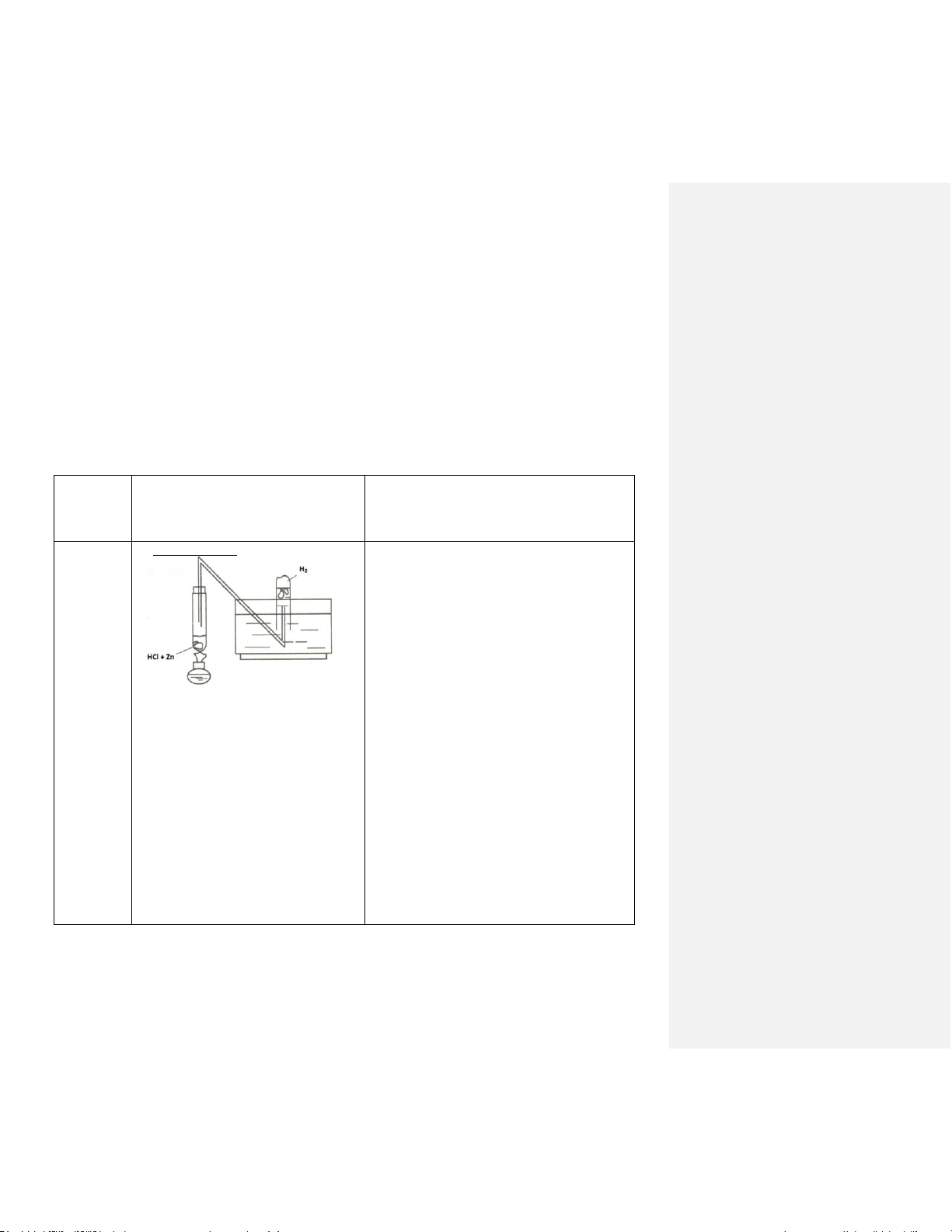
Điều chế Na2CO3 bằng phương pháp Solvay:
- CO2 bị hấp thụ trong nước tạo thành H2CO3 theo phản ứng: CO2 + H2O H2CO3 NH + 3 + H2CO3 NH4 + HCO3- HCO3- + Na+ NaHCO3 Sục CO Cả 4 chất: NaCl, NH 2 vào erlen 125ml chứa 4HCO3, NaHCO3 và
50ml dung dịch NaCl bão hòa trong NH4Cl đều tan trong nước nhưng NaHCO3 hơi NH
ít tan hơn nên tách ra dưới dạng tinh thể (dung
3. Ngâm erlen trong chậu nước lạnh,
đợi cho đến khi có tinh thể trắng tạo dịch ban đầu là bão hòa NH3). Đây là sự cân
1 thành. Lọc chân không lấy tinh thể (tráng bằng giữa khả năng phản ứng và tốc độ phản
bằng cồn, không tráng bằng nước lạnh).
ứng. Nhiệt độ vừa phải để vận tốc không chậm
và độ tan của NaHCO3 không lớn hơn độ tan của NaCl.
Lấy một ít tinh thể trên cho vào Tinh thể NaHCO
cốc nước. Thêm vào một giọt 3 là muối tan trong H
phenolphtalein ta thấy dung dịch chuyển 2O có tính bazơ yếu: H sang màu hồng nhạt.
2O + HCO3- OH- + H2CO3 (1) H2CO3 CO2 + H2O
H2CO3 không bền phân hủy tạo CO2 làm cân
bằng của phản ứng (1) dịch chuyển về phía tạo
ra OH- làm phenolphtalein hóa hồng. 2
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Cho một ít tinh thể vào ống nghiệm, đậy
bằng nút cao su có gắn ống thủy tinh.
Do xảy ra các phản ứng sau đây:
Đun nóng ống nghiệm bằng đèn cồn.
Dẫn khí thoát ra vào nước vôi trong ta 2NaHCO
thấy dung dịch nước vôi trong bị đục 3 o t
Na2CO3 + CO2 + H2O CO
dần. Nếu để trong một thời gian dài thì
2 + Ca(OH)2 CaCO3 + H2O CO
nước vội bị đục sẽ trong trở lại.
2 + H2O + CaCO3 Ca(HCO3)2 tan Kết luận:
Có thể điều chế muối NaHCO3 dựa vào
sự khác nhau về độ tan đủ lớn ở nhiệt độ nhất
định. Trong công nghiệp ta có thể thu lại CO2
bị giải phóng khi nhiệt phân NaHCO3 cũng
như khi nung đá vôi để sử dụng cho giai đoạn đầu.
Quan sát màu ngọn lửa của kim loại kiềm:
Nhúng một đầu mẫu giấy lọc vào
Ở trong ngọn lửa, những electron của
dung dịch LiCl bão hòa rồi đưa vào ngọn nguyên tử và ion kim loại kiềm được kích
lửa đèn cồn ta thấy ngọn lửa có màu đỏ thích nhảy lên các mức năng lượng cao hơn. tía.
Khi trở về những mức năng lượng ban đầu,
các electron này phát ra năng lượng dưới dạng
Làm thí nghiệm tương tự như
trên với dung dịch NaCl bão hòa ta thấy các bức xạ trong vùng khả kiến. Vì vậy, ngọn
ngọn lửa có màu vàng, còn với dung lửa có màu đặc trưng cho từng kim loại.
dịch KCl bão hòa thì ta thấy ngọn lửa có 2 màu tím. Do anion 2
SO giữ electron chặt hơn Khi thay LiCl bằng Li 4
2SO4 thì Cl- nên năng lượng từ ngọn lửa đèn cồn không
thấy màu ngọn lửa không thay đổi.
đủ lớn để kích thích electron lên trạng thái
kích thích nên Li+ trong Li2SO4 không thể hiện
được tính chất như LiCl. Kết luận:
Khi đốt cháy cation kim loại kiềm (trong
hợp chất với anion thích hợp) sẽ cho ngọn lửa
có màu đặc trưng. Trong phân nhóm chính
nhóm IA, khi đi từ trên xuống dưới màu đặc
trưng của ngọn lửa sẽ chuyển từ đỏ đến tím,
nghĩa là năng lượng tăng dần do bán kính
nguyên tử tăng, electron dễ chuyển sang mức năng lượng cao hơn. 3
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Phản ứng của kim loại kiềm với nước:
Cho nước vào chén sứ đến ½ thể
tích, nhỏ vào đó 1 giọt phenolphtalein.
Phương trình phản ứng:
Dùng kẹp sắt lấy một mẫu kim loại Na, 1
dùng dao nhựa cắt thành một mẫu nhỏ Na + H2O NaOH + H2 (1) 2
(1x1mm) ta thấy Na rất mềm. Cho mẫu 1
Na vừa cắt vào chén sứ ta thấy Na phản H2 + O2 H2O (2)
ứng với nước mãnh liệt làm nước nóng 2
lên, có khói trắng bay lên, mẫu Na chạy
Khói trắng là hỗn hợp của H2 và hơi
trên mặt nước.Phản ứng ban đầu rất nước. Do phản ứng (1) tỏa nhiệt rất lớn tạo
nhanh nhưng sau đó chậm dần và dung điều kiện cho phản ứng (2) xảy ra.
dịch chuyển sang màu hồng đậm.
Do phản ứng sinh ra NaOH là một
bazơ mạnh nên dung dịch có chứa
phenolphtalein hóa hồng. Một phần NaOH
sinh ra bao quanh mẫu làm giảm bề mặt tiếp
xúc của Na với H2O nên phản ứng xảy ra
chậm. H2 sinh ra phân bố không đồng đều tạo
nên lực nâng và lực đẩy, đẩy Na chạy trên mặt nước. 3
Ngoài phản ứng (1) còn có phản ứng:
Làm lại thí nghiệm trên nhưng 2NaOH + CuSO
thay nước bằng dung dịch CuSO4 0.5M 4 Cu(OH)2 + Na2SO4 xanh lam
ta thấy phản ứng xảy ra mãnh liệt hơn thí
nghiệm trên: Na bốc cháy kèm theo tiếng
Natri phản ứng mãnh liệt hơn vì:
+ Trong TN đầu NaOH vừa tạo thành bao
nổ, có khói trắng xuất hiện, có kết tủa quanh mẫu Na làm giảm bề mặt tiếp xúc giữa
màu lam và tại chỗ bốc cháy có tủa màu Na với H
đen. Dung dịch chuyển sang màu hồng 2O.
+ Trong TN sau NaOH vừa tạo thành đã
sau đó mất màu hồng đi.
phản ứng ngay với CuSO4 nên không làm
giảm bề mặt tiếp xúc giữa Na với H2O. Vì vậy,
phản ứng mãnh liệt hơn.
Mặt khác, do NaOH mới sinh ra phản
ứng tức thời với lượng dư CuSO4 nên dung
dịch chứa phenolphtalein ban đầu chuyển sang
màu hồng nhưng sau đó mất màu.
Kết tủa màu đen là do nhiệt tỏa ra của
phản ứng (a) làm nhiệt phân tủa Cu(OH)2 thành CuO có màu đen: Cu(OH)2 o t CuO + H2O đen 4
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 Kết luận:
Kim loại kiềm mềm, dễ cắt, rất hoạt động
về mặt hóa học. Trong các phản ứng chúng thể
hiện tính khử mạnh.Ở điều kiện thường, trong
không khí khô kim loại thường được phủ 1 lớp
oxít. Trong không khí ẩm thì lớp oxít sẽ kết
hợp với hơi nước tạo thành các hydroxít kết
hợp với CO2 tạo muối carbonat vì vậy kim loại
kiềm thường được bảo quản trong bình kín
hoặc ngâm trong dầu hỏa.
Độ tan của các muối kim loại kiềm:
Cho vào 2 ống nghiệm mỗi ống khoảng 1 NaF + LiCl NaCl + LiF
ml dung dịch LiCl 0.5M và 5 giọt NH4OH Vì NH đậm đặc.
4OH đặc làm dung môi phân cực hơn
mà LiF có một phần liên kết cộng hóa trị nên
Ống 1: thêm vào 1ml dung dịch tủa nhiều hơn.
NaF 0.5M, lắc đều để yên vài phút ta thấy OH- + H 2-
có tủa trắng tạo thành. Khi thêm NH 2PO4- H2O + HPO4 4OH
4 vào thì lượng tủa nhiều hơn. 2 3 OH- + HPO4 - H2O + PO4 -
Ống 2: thêm vào 1ml dung dịch 3Li+ + PO34- LiPO4
NaH2PO4 lắc đều để yên vài phút ta thấy
có tủa trắng tạo thành. Khi thêm NH4OH
vào thì tủa vẫn không tan. Kết luận:
Đa số các muối kim loại kiềm là dễ tan
trừ một số muối của Li.
Các muối của K+ dễ tan hơn của Li+ vì
khi thay LiCl bằng KCl thì trong các ống đều không có hiện tượng.
Lắc chung hỗn hợp gồm 0.5g
Khi hòa tan hỗn hợp bằng cồn thì do
LiCl và 0.5g KCl với 3ml cồn trong Li+ có bán kính nguyên tử nhỏ nên lực hút hạt
becher 50ml khoảng 5 phút. Lọc và rửa nhân vơi electron ngoài cùng lớn làm cho độ
phần rắn không tan 3 lần, mỗi lần với phân cực trong muối LiCl giảm mà cồn là
5 1ml cồn. Phần cồn qua lọc và cồn dùng dung môi phân yếu nên LiCl được hòa tan tốt
để rửa gộp chung trong một becher. Đun còn KCl thì không tan do tính phân cực mạnh.
cách thủy đền khi cạn khô sẽ thu được 2 Vì vậy, phần qua lọc có chứa LiCl còn mẫu
khối rắn: một ở trên lọc và một do cô rắn là KCl.
cạn. Lấy mẫu rắn trên lạo hòa tan trong
2ml nước rồi chia thành 2 ống nghiệm để thử Li+:
Ống 1: thêm 1ml NaF và 5 giọt
Điều này chứng tỏ chất rắn trên lọc
NH4OH đậm đặc, không có hiện tượng không chứa ion Li+ mà chứa ion K+. 5
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 gì xảy ra.
Ống 2: thêm 10 giọt acid piric
Điều này chứng tỏ trong dung dịch
vào có xuất hiện kết tủa hình kim.
thu được có chứa ion Li+
Làm tương tự với mẫu rắn thu Kết luận:
được do cô cạn thì thấy trong
Trong phân nhóm IA khi đi từ trên
Ống 1: có kết tủa màu trắng
xuống thì độ phân cực của muối kim loại tăng
Ống 2 : không có hiện tượng dần.
Các chất sẽ tan dễ dàng trong dung môi tương tự với nó. 6
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 2:
KIM LO ẠI KIỀM THỔ (Phân nh óm IIA)
Ngày thí nghiệm: 19/08/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại kiềm thổ trong bảng tuần hoàn, hiểu được các tính chất của chúng qua
các phản ứng đặc trưng.
- Hiểu thêm về tính chất nước cứng, tính chất đặc trưng, cách làm mềm nước cứng, thang đo độ cứng.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN NGHIỆM
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
* Quan sát màu của ngọn lửa khi kim
loại kiềm thổ cháy:
Hiện tượng này được giải thích là do ion kim loại
của muối hấp thụ năng lượng từ ngọn lửa, các
- Nhúng một đầu giấy lọc sạch vào dung electron ở lớp ngoài cùng bị kích thích lên mức
dịch CaCl2 bão hoà rồi hơ trên ngọn lửa năng lượng cao hơn nên khi trở về trạng thái cơ
đèn cồn ta thấy ngọn lửa có màu đỏ da bản nó sẽ phát ra bức xạ có bước sóng trong vùng cam.
khả kiến đặc trưng cho mỗi ion kim loại và có màu sắc khác nhau.
- Tiến hành tương tự với dung dịch SrCl2
bão hào và dung dịch BaCl2 ta thấy ngọn
1 lửa có màu đỏ tươi ứng với dung dịch SrCl
2 và màu vàng lục ứng với dung dịch BaCl2. Kết luận :
Khi đốt cháy cation kim loại kiềm thổ (trong hợp
chất với anion thích hợp) sẽ cho ngọn lửa có màu
đặc trưng. Trong phân nhóm chính nhóm IIA, khi
đi từ trên xuống dưới màu đặc trưng của ngọn lửa
sẽ chuyển từ đỏ đến vàng, nghĩa là năng lượng
tăng dần do bán kính nguyên tử tăng, electron dễ
chuyển sang mức năng lượng cao hơn.
* Phản ứng của kim loại kiềm thổ với nước: 2
Lấy 2 ống nghiệm cho vào mỗi ống 1-2
giọt nước, một ít bột Mg và 1 giọt - Phản ứng xảy ra chậm do Mg(OH)2 tạo thành phenolphtalein.
che phủ bề mặt của Mg: - Ống 1:
Mg + H2O Mg(OH)2↓ + H2↑ (1) 7
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
+ Khi để nguội phản ứng xảy ra rất chậm.
Tại bề mặt tiếp xúc pha xuất hiện màu - Do TMg(OH)2 = 10-9.22 nên vẫn có một phần
hồng nhạt đồng thời có bọt khí nổi lên. Mg(OH)2 tan tạo ion OH- khiến phenolptalein hóa Đó là khí hydro.
hồng tại bề mặt phân chia giữa Mg và nước. Mg(OH)2 Mg2+ + 2OH- (2)
- Ở nhiệt độ cao Mg(OH)2 tan nhiều hơn trong
nước nên tạo nhiều OH- khiến màu hồng dung + Khi đun nóng
dịch đậm hơn. Đồng thời sự che phủ của Mg(OH)2
Bọt khí xuất hiện nhiều hơn, màu hồng giảm nên phản ứng (1) xảy ra nhanh hơn bọt
đậm hơn và lan ra toàn bộ dung dịch. khí thoát ra nhiều hơn.
- Ống 2: Cho từ từ dung dịch NH4Cl vào. - Khi cho NH4Cl vào thì Mg(OH)2 bị hòa tan, giải
Phản ứng xảy ra mãnh liệt, màu dung phóng bề mặt Mg làm phản ứng (1) mãnh liệt hơn
dịch nhạt dần đến mất màu, đồng thời khí và khí thoát ra nhiều hơn.
thoát ra nhiều hơn. Sau đó màu hồng xuất hiện trở lại.
Mg(OH)2 + NH4Cl MgCl2 + NH3↑ + H2O
- Do Mg(OH)2 bị hòa tan nên cân bằng (2) bị dịch
chuyển theo chiều thuận làm giảm OH- dẫn đến mất màu phenolptalein.
- Màu hồng xuất hiện trở lại do hai nguyên nhân:
NH3 sinh ra ở phản ứng trên và OH- do phản ứng (2) sinh ra. Kết luận:
Kim loại kiềm thổ tác dụng yếu với nước ở nhiệt
độ thường nhưng phản ứng mạnh khi đun nóng
hoặc có xúc tác thích hợp.
* Điều chế và tính chất của Mg(OH)2:
Lấy 3 ống nghiệm cho vào mỗi ống
dung dịch NaOH ta thấy xuất hiện kết tủa
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
trắng và hầu như không tan trong nước. 3
Ly tâm bỏ phần dung dịch phía trên và
cho phần kết tủa vào 3 ống nghiệm.
- Ống 1: Cho tác dụng với HCl. Kết tủa
tan và dung dịch trở nên trong suốt.
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
- Ống 2: Cho tác dụng với NH4Cl. Kết
tủa tan tạo dung dịch trong suốt và có 8
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 mùi khai.
Mg(OH)2 + 2NH4Cl MgCl2+ 2NH3↑ + 2H2O
- Ống 3: Cho NaOH vào. Không có hiện tượng xảy ra.
NaOH và Mg(OH)2 đều có tính bazơ nên không phản ứng.
* Điều chế và tính chất của hydroxit kim loại kiềm thổ: Mg2+ + 2OH- Mg(OH)2↓ Ca2+ + 2OH- Ca(OH)2↓
Lấy 4 ống nghiệm, mỗi ống lần lượt Sr2+ + 2OH- Sr(OH)2↓
chứa 1 ml dung dịch muối Mg2+, Ca2+, Ba2+ + 2OH- Ba(OH)2
Ba2+ và Sr2+ 0.5M; thêm vào mỗi ống 0.5
ml dung dịch NaOH 1M, ta thấy trong Do đi từ Mg đến Ba thì bán kính nguyên tử tăng
các ống nghiệm đều xuất hiện kết tủa . lên nên lực hút hạt nhân với electron ngoài cùng
Lượng kết tủa tăng dần theo thứ tự Ba2+, giảm và do oxi có độ âm điện lớn nên rút electron
Sr2+, Ca2+ vaø Mg2+. Như vậy độ tan của về phía nó làm cho phân tử hydroxyt phân cực
các hydroxyt tương ứng giảm dần.
mạnh nên tạo dung môi phân cực. Kết luận:
Có thể điều chế các hydroxyt của kim loại
kiềm thổ bằng cách cho muối tan của chúng tác
dụng với kim loại kiềm, Hydroxyt của kim loại kiềm thổ có tính bazơ.
* Khảo sát sự hòa tan của muối sunfat
kim loại kiềm thổ:
- Lấy 4 ống nghiệm cho vào mỗi ống 1
ml lần lượt các dung dịch MgCl2, CaCl2
BaCl2 và SrCl2, sau đó nhỏ từ từ dung dịch H 2 2SO4 2N vào. Ta thấy : Ca2+ + SO4 - CaSO4↓ Ống chứa MgCl 2
2 không có hiện tượng Sr2+ + SO4 - SrSO4↓ Ông chưa CaCl 2-
2 bị vẫn đục do tạo chất ít Ba2+ + SO4 BaSO4↓ tan.. Ống chứa SrCl 4 2 có màu trắng đục.
Ông chứa BaCl2 bị đục nhiều
Điều này hoàn toàn phù hợp với tích số tan của
chúng TCaSO4 = 10-5.04, TSrSO4 = 10-6.49
- Cho H2SO4 đến dư các kết tủa không TBaSO4 = 10-9.97 tan. Do nồng độ của SO 2- 4 tăng lên nên cân bằng
chuyển dịch theo chiều thuận nghĩa là tăng lượng kết tủa. Kết luận :
Độ tan cuûa hydroxyt vào muối sunfat khi đi từ
Mg đến Ba ngược nhau vì đối với muối sunfat
năng lượng hoạt hóa của cation lớn hơn năng
lượng mạng tinh thể hơn nữa đi từ Mg đến Ba bán
kính X2+ tăng dần nên khả năng phân cực trong 9
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
nước giảm và năng lượng hydrat giảm dần nên độ tan giảm từ Mg đến Ba.
* Xác định độ cứng của nước :
- Hút 10ml nước cứng cho vào erlen V1 = 7.7 ml
250ml, thêm nước cất 100ml, thêm 5ml V2 = 7.9 ml
5 dung dịch đệm pH 10 và khoảng 5 giọt V ETDA = 7.8 ml
chỉ thị Erio T đen. Lắc đều và chuẩn độ Vmẫu = 10 ml
bằng dung dịch ETDA 0.02N cho nên khi CN ETDA = 0.02 N
chỉ thị chuyển từ đỏ tím sang xanh dương Tổng hàm lượng Mg2+ và Ca2+:
hẳn. Tiến hành chuẩn độ 2 lần.
X = V ETDA x CN ETDA x 1000/ Vmẫu
= 7.8 x 0.02 x 1000/ 10 = 15.6 (mN) *Làm mềm nước:
- Lấy 50 ml nước cứng cho vào becher
250ml, thêm 5ml dung dịch Na2CO3 V1 =17,5ml, V2 = 18.3ml VETDA = 17.9 ml
0.1M và 2ml vôi sữa. Đun sôi hỗn hợp Vmẫu = 50 ml.
trong 3 phút, lọc bỏ kết tủa. Tiến hành Tổng hàm lượng Mg2+ và Ca2+ còn lại:
chuẩn độ phần nước trong như thí nghiệm X = VETDA x CN ETDA x 1000/ Vmẫu 6 5.
= 17.9x 0.02 x 1000/ 50 = 7.16(mN) Nhận xét:
X < X chứng tỏ hàm lượng Mg2+ và Ca2+ trong
mẫu giảm=>nước được làm mềm khi thêm
Na2CO3 vaø Ca(OH)2 vào thì xảy ra phản ứng: Mg2+ + 2OH- Mg(OH)2↓ Ca2+ + CO 2- 3 CaCO3↓
Làm giảm hàm lượng Mg2+ vaø Ca2+ trong dung dich sau lọc. 10
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 3:
NGUYÊN TỐ NHÓM IIIA
Ngày thí nghiệm: 16/09//2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững vị trí của kim loại nhóm IIIA trong bảng tuần hoàn
- Hiểu được các tính chất của các đơn chất và hợp chất qua các phản ứng đặc trưng.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN SÁT
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
Hydroxyt nhôm – Điều chế và tính chất: o t
a) Lấy 10g quặng bauxite (46% a) Al O +2NaOH 2Na Al OH 2 3 4
Al2O3) cho vào becher 250ml, thêm
40ml dd NaOH 3M. Đun sôi, khuấy Đây là phần nước qua lọc.
đều trong 15 phút. Lọc bỏ cặn đỏ. Phần
nước trong qua lọc được trung hòa H Na Al OH Al OH Na H O 2 4 3
bằng dd HCl 1M cho đến pH 7 ( dùng
vài giọt phenolphtalein để kiểm tra). Ta Lượng tủa lý thuyết thu được:
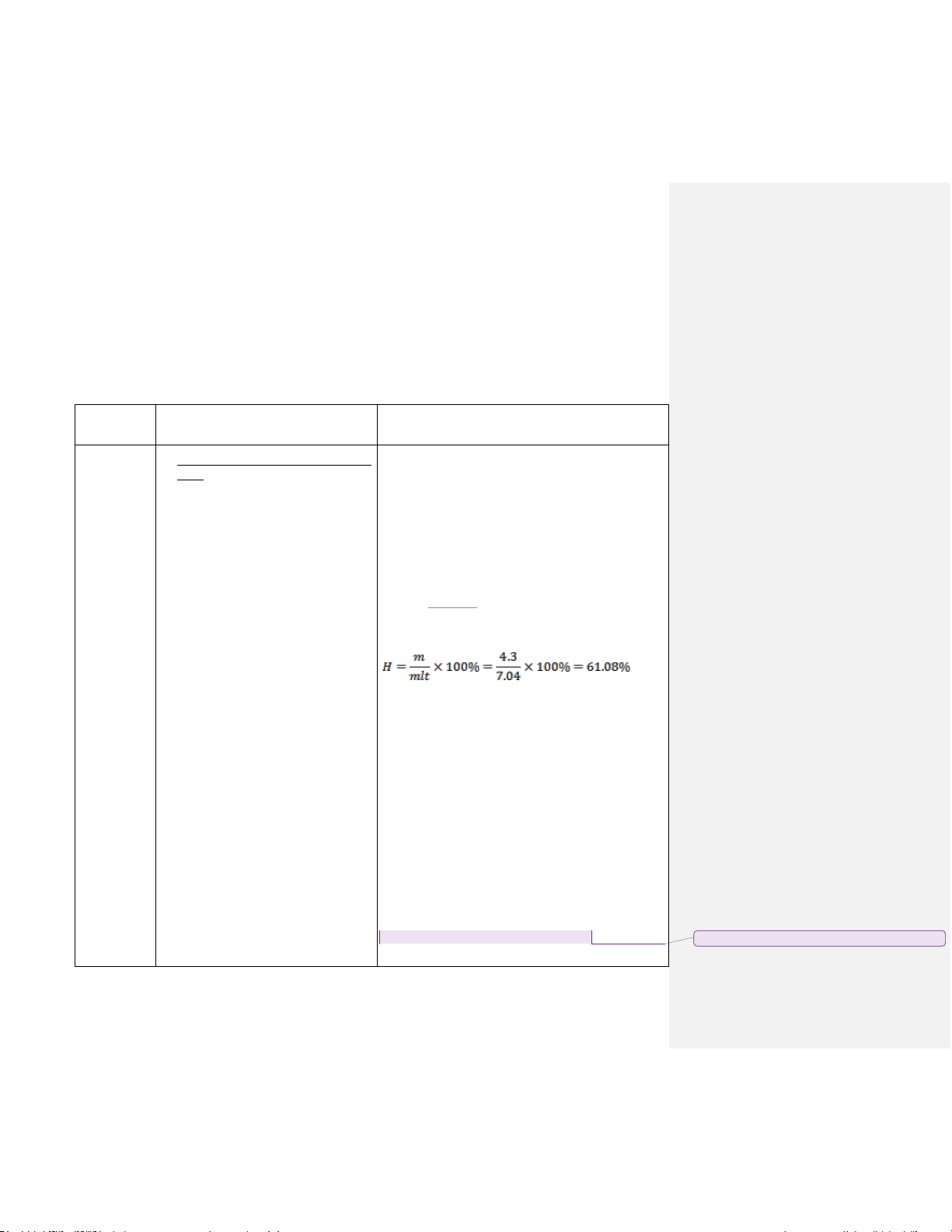
thấy có kết tủa keo trắng hình vói nồng 10x46 m x2x78=7.04 (g)
trên nền hồng của phenolphtalein. Lọc lt 102 x100
rửa kết tủa rồi sấy ở 100oC, sản phẩm Hiệu suất: sau sấy là Al(OH) 3, cân được 4.3g. 1
Hòa tan tủa đã sấy khô với HCl và
NaOH ta thấy tủa tan tạo dd trong suốt.
Al(OH ) NaOH a N AlO 2H O 3 2 2
Al(OH ) HCl AlCl H O 3 3 2
Kết luận: Al(OH)3 là một hidroxit lưỡng tính, vừa tác dụng
acid vừa tác dụng với bazơ b) Al3+ + 3OH- Al(OH)3
Al(OH)3 + NaOH NaAlO2 + 2H2O Al(OH) Commented [t1]:
b) Lấy 3 ống nghiệm, mỗi ống cho
3 + 3NH4OH (NH4)3[Al(OH)6]
Coi lai cai nay,hinh nhu khong PU
5 giọt dd muối Al3+, thêm từ từ từng 11
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
giọt dd NaOH 1M cho đến khi tạo tủa. Kết luận: Sau đó thêm vào:
Al(OH)3 là một chất có tính acid và bazơ đều yếu. Ống 1: cho
NH4Cl vào ta thấy không có hiện tượng. Ống 2: cho
dd NaOH 1M ta thấy kết tủa tan. Ống 3: cho
dd NH4OH đậm đặc ta thấy tủa tan nhưng chậm hơn ống 2.
Phản ứng của nhôm với acid và kiềm:
Lấy 4 ống nghiệm lần lượt cho vào
mỗi ống 1ml dung dịch đậm đặc sau:
H2SO4, HNO3, HCl, NaOH. Thêm vào mỗi ống 1 miếng nhôm. Để ở nhiệt
độ phòng. Quan sát ta thấy:
Ống 1: chứa H2SO4 đậm - Do nhôm bị thụ động hóa trong H2SO4 và HNO3
đặc, không có hiện tượng. đặc nguội. Ống 2: chứa HNO3 đậm
đặc, không có hiện tượng.
2 Ống 3: chứa HCl đậm đặc, - Xuất hiện rắn đen là do nhôm chuyển dạng thù
phản ứng xảy ra mãnh liệt tạo bọt khí hình.
đồng thời có rắn màu đen xuất hiện.
2Al + 6HCl 2AlCl3 + 3H2
Ống 4: chứa NaOH đậm 2Al + 2NaOH +6H2O 2Na[Al(OH)4] + 3H2
đặc, phản ứng xảy ra mãnh liệt tạo bọt
khí đồng thời có rắn màu đen xuất hiện giống ống 3. Ở nhiệt độ cao. Ta thấy: Ống 1: phản ứng mãnh
liệt, Al tan ra tạo dung dịch màu vàng, 2Al+6H2SO4, dđ o t
Al2(SO4)3+3SO2+6H2O có khí SO2 bay ra
Ống 2: phản ứng mãnh liệt
có khí màu nâu bay ra. Khi để nguội thì Al+6HNO3, đđ o t
Al(NO3)3+3NO2 + 3H2O
Al lại bị thụ động hóa.
Ống 3: phản ứng rất mãnh 2Al + 6HCl o t 2AlCl
liệt, có khí thoát ra, rắn đen xuất hiện đđ 3 +3H2
do nhôm bị chuyển dạng thù hình. 12
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ống 4: phản ứng rất mãnh 2Al + 2NaOH +2H2O o t 2NaAlO2 + 3H2
liệt, có khí thoát ra, có rắn đen xuất
hiện do Al bị chuyển dạng thù hình.
* Làm lại thí nghiệm trên với các dung dịch loãng.
2Al+3H2SO4 Al2(SO4)3 + 3H2 Để ở nhiệt
độ phòng. Quan sát ta thấy:
Al + 4HNO3 Al(NO3)3 + NO + 2H2O 2NO + O2 2NO2
Ống 1: phản ứng xảy ra
chậm, có khí thoát ra trên bề mặt Al.
2Al + 6HCl 2AlCl3 +3H2
Ống 2: phản ứng xảy ra
chậm tạo khí không màu hóa nâu trong không khí.
2Al + 2NaOH +2H2O 2NaAlO2 + 3H2
Ống 3: phản ứng xảy ra
chậm, có bọt khí trên bề mặt Al.
Ống 4: Al tan chậm, có bọt 2Al+3H2SO4 Al2(SO4)3 + 3H2
khí thoát ra trên bề mặt Al. Al+6HNO3 o t
Al(NO3)3 + 3NO2 + 3H2O Ở nhiệt độ cao. Quan sát ta thấy:
2Al + 6HCl 2AlCl3 +3H2 Ống 1: phản ứng mãnh
liệt, khí thoát ra rất nhiều.
2Al + 2NaOH +2H2O 2NaAlO2 + 3H2 Ống 2: có khí màu nâu bay ra. Kết luận:
Ống 3: phản ứng xảy ra
Al có thể tan được trong kiềm và acid nhất là
mãnh liệt, khí thoát ra nhiều.
khi đun nóng. Ở nhiệt độ thường Al được bảo vệ bởi
màng oxit nên bị thụ động hóa trong một số acid. Vì
Ống 4: phản ứng xảy ra thế ta dùng nhôm để đựng một số acid đậm đặc như
nhanh hơn khi chưa đun nóng, khí thoát HNO3 và H2SO4. ra nhiều.
Phản ứng của Al với oxy và nước:
Lấy 2 miếng Al, đánh sạch bề mặt,
rửa sạch bằng nước rồi thấm khô bằng 2Al + 3Hg2+
giấy lọc. Nhỏ lên mỗi miếng một giọt 2Al3+ + 3Hg
dd muối Hg2+. Ta thấy giọt dd Hg2+ từ
Chính Hg sinh ra làm cho giọt dung dịch Hg2+
không màu chuyển sang màu xám đen. chuyển màu xám đen.
Sau vài phút dùng giấy lọc thấm
khô dd Hg2+. Một miếng để ngoài
không khí, một miếng ngâm trong
nước.Quan sát hiện tượng ta thấy:
Miếng nhôm để ngoài không
- Tại chỗ nhỏ Hg2+, miếng nhôm tạo thành hỗn 13
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
3 khí có 1 lớp màu trắng xám hình kim hống Hg – Al. Hỗn hống này tiếp xúc với oxy trong phồng dần lên. không khí:
4 Al – Hg + 3O2 2Al2O3 + 4Hg
Lớp oxit hình thành rồi bong ra, lớp hỗn hống
phía trong tiếp xúc tác dụng và cứ thế làm lớp oxit cao dần.
Miếng ngâm trong nước ban
đầu sủi bọt khí nhưng sau đó thì hết
- Do tạo lớp hydroxit nhôm che phủ bề mặt không
cho nhôm tiếp xúc với nước nên không cho phản
đồng thời xuất hiện màng keo tại nơi ứng tiếp diễn. phản ứng.
2Al + 6H2O 2Al(OH)3 + 3H2 Kết luận:
Nhôm có thể tác dụng với oxy trong không khí và
nước nếu không có lớp oxit bảo vệ bên ngoài.
Nhận biết acid boric và borat: a) Cho 0,5g H3PO3 vào ống
nghiệm rồi thêm vào đó 2ml C2H5OH. H
Đun nhẹ ta thấy hầu như không tan. Rót
3BO3 + 3C2H5OH B(OC2H5)3 +3H2O
dd vào chén sứ rồi đốt ta thấy ngọn lửa
có màu xanh lục chứng tỏ H3PO3 có tan trong C2H5OH.
b) Lấy một ít tinh thể borat Na2B4O7 + H2SO4 + 5H2O Na2SO4 + H3BO3
4 Na2B4O7 vào chén sứ. Nhỏ lên vài giọt CaF
H2SO4 đặc cho đến khi tinh thể borat 2 + H2SO4 CaSO4 + 2HF
hoàn toàn bị thấm ướt. Sau đó thêm 3HF + H3BO3 BF3 + 3H2O
một ít CaF2, trộn đều, đem đun cho đến
khi có khói trắng bay ra. Đốt trên khói Nếu HF dư: BF3 + HF HBF4
trắng, ta thấy ngọn lửa có màu xanh
Ở điều kiện thường, BF3 là một chất khí không lục.
màu và bốc khói mạnh trong không khí. Do trong
khói trắng tồn tại nguyên tố Bo nên khi đốt ngọn lửa có màu xanh. Kết luận:
Acid boric và borat có thể nhận biết bằng màu
đặc trưng của ngọn lửa khi đốt cháy những hợp chất của chúng. 14
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo cáo thí nghiệm bài 5
NITƠ VÀ CÁC HỢP CHẤT NHÓM VA
Ngày thí nghiệm: 09/09/2014
I/MỤC ĐÍCH THÍ NGHIỆM
Nắm vững phương pháp điều chế khí Nitơ.
Tính chất của axit nitric, tính chất của các muối nitrit.
Điều chế và tính chất muối NH3
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM
QUAN SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
Điều chế Nitơ:
Cho 2g NaNO2 vào ống nghiệm
và rót vào ống 5ml dd NH4Cl bão
hòa ta thấy có bọt khí sủi nhẹ. Lắp
hệ thống thu khí như hình vẽ: 1 NH4Cl + NaNO2 o t NH4NO2 + NaCl NH4NO2 o t N2 + 2H2O
Khí thu được là khí N2 mà khí N2 thì không duy
trì sự cháy nên ngọn lửa tắt ngay.
Đun nhẹ thì phản ứng mạnh hơn. Kết luận:
Thu khí vào ống nghiệm lớn chứa Có thể điều chế khí N2 bằng cách nhiệt phân muối
đầy nước úp ngược trên 1 chậu amoni nitrat. Khí N2 không duy trì sự cháy.
đựng nước. Lấy que nhang đang
cháy đưa vào ống nghiệm chưa khí
thu được thì ngọn lửa tắt ngay. 2
Tính chất của acid nitric:
a/ Cho vào 2 ống nghiệm nhỏ mỗi ống 3 giọt HNO 3 đậm đặc.
Zn + 4HNO3, đđ Zn(NO3)2 + 2NO2 + H2O Ống 1: thêm vào 1 mẫu
kẽm ta thấy kẽm tan ra, có khí màu Không màu màu nâu
nâu bốc lên, phản ứng tỏa nhiệt
mạnh, dd sau phản ứng không màu. 15
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ống 2: thêm vào 1 mẫu Cu + 4HNO
đồng ta thấy đồng tan ra, có khí
3, đđ Cu(NO3)2 + 2NO2 + H2O
màu nâu bay ra, phản ứng tỏa nhiệt dd màu xanh màu nâu
mạnh, dd sau phản ứng có màu xanh.
b/ Cho vào ống nghiệm một ít
lưu huỳnh. Sau đó thêm 1ml HNO3
đậm đặc. Đun nhẹ ta thấy lưu huỳnh
tan ra, ống nghiệm nóng lên. Khi S + 4HNO
cho 1ml dd Ba2+ vào dd sau phản
3, đđ H2SO4 + 2NO2 + 2H2O
ứng thì thấy xuất hiện kết tủa màu Ba2+ + SO 2 4 - BaSO4 trắng.
c/ Cho vào ống nghiệm 1ml
FeSO4 bão hòa, 5-6 giọt H2SO4 đậm
đặc. Làm lạnh ống nghiệm trong
chậu nước. Thêm từ từ 1ml HNO3
loãng dọc theo thành ống nghiệm và
không lắc. Quan sát màu sắc của dd ta thấy:
- Dung dịch phía trên có màu vàng nâu là do Fe2+
bị oxy hóa thành Fe3+ theo phản ứng: Dung dịch trước khi cho
HNO3 vào có màu xanh lơ của Fe2+. 6FeSO4+3H2SO4+HNO33Fe2(SO4)3+2NO+4H2O Khi cho HNO3 vào thì
Do ống nghiệm bị lạnh nên khí NO tạo thành bị
phần dd phía trên có màu vàng nâu, giữ lại trong dd và tạo phức với FeSO4 chưa phản
có bọt khí đồng thời ở giữa dần dần ứng thành một phức có màu đen:
xuất hiện lớp phân cách màu đen, FeSO4 +xNO [Fe(NO)x]SO4
dd phía dưới vẫn màu xanh lơ. đen
- Do phức trên không bền nên khi ta lắc mạnh sẽ
phân hủy tạo NO thoát ra ngoài rồi hóa nâu ngoài
Khi lắc mạnh dd thì lớp không khí.
phân cách màu đen biến mất, đồng
thời co khí bay ra hóa nâu trong
[Fe(NO)x]SO4 FeSO4 +xNO
không khí và dd sau cùng có màu 2NO + O2 2NO2
nâu đỏ. Khi thêm H2SO4 vào thì
thấy màu nâu đỏ nhạt dần.
Dung dịch sau cùng màu nâu đỏ là do Fe2(SO4)3 thủy phân tạo Fe(OH)
3 màu nâu đỏ. Để kiểm chứng
ta cho H2SO4 vào thì màu nâu đỏ nhạt dần do sự
thủy phân củaFe2(SO4)3 phụ thuộc vào pH của dung dịch. Kết luận:
HNO3 có tính oxy hóa mạnh nên nó có thể tác dụng được với cả kim loại đứng trước, sau hydro,
với phi kim và nhiều hợp chất có tính khử. 16
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Tính chất của dd cường thủy:
Cho vào 3 ống nghiệm, mỗi ống Hg(NO)3 + (NH4)2S HgS + 2NH4NO3
1 giọt Hg(NO3)2 và thêm từ từ dd đen (NH
4)2S cho đến khi kết tủa hoàn
toàn. Quan sát ta thấy kết tủa màu đen.
Li tâm và gạn bỏ phần dd trên
- Nước cường thủy có tính oxy hóa mạnh do tạo kết tủa. ra clo nguyên tử:
3 Ống 1: thêm vào từ từ 1 ml HNO3 + 3HCl NO + 3Cl + 2H2O
cường thủy (3HNO3: HCl), ta thấy Chính clo nguyên tử đã hòa tan HgS:
kết tủa tan ra, có khí thoát ra rồi hóa
nâu trong không khí và trong dd
2Cl + HgS HgCl2 + S vàng
xuất hiện tủa màu vàng. Khi cho Khi cho dư cường thủy:
đến dư nước cường thủy thi tủa
vàng tan ra. Thử bằng dd Ba2+ thì 6Cl + S 6Cl- + S6+ có tủa trắng. SO 2
4 - + Ba2+ BaSO4 trắng
Ống 2: thêm từ từ dd HNO3
đậm đặc ta thấy không có hiện tượng. Kết luận:
Dung dịch nước cường thủy có tính oxy hóa rất
Ống 3: thêm từ từ dd HCl mạnh
đậm đặc thì thấy không có hiện tượng.
Tính chất muối nitrit:
Cho vào 4 ống nghiệm mỗi ống 1ml dung dịch NaNO2.
Ống 1: thêm vào 1 ít dd 6H+ +2MnO 2
4 -+5NO2- 5NO3- + 2Mn2+ + 3H2O
KMnO4 loãng có pha 1 giọt H2SO4 Không màu
đậm đặc. Ta thấy màu tím của hỗn
hợp mất đi và tạo dd trong suốt. 4 Fe2++2H+ +NO
Ống 2: thêm vào dd FeSO4 2- Fe3+ + NO + H2O
và vài giọt H2SO4 đậm đặc (không Khí không màu
lắc). Ta thấy xuất hiện lớp màu nâu FeSO4 +xNO [Fe(NO)x]SO4
đen và có bọt khí không màu rồi hóa nâu. đen
Ống 3: thêm dd KI có pha 1 2NO + O2 2NO2
giọt H2SO4 loãng. Ta thấy đầu tiên
dd có màu vàng nhạt của KI, sau đó 2I-+2NO2- +4H+ 2NO +I2 +2H2O
tạo tủa màu tím than. Khi cho dư dd Tím than
KI thì tủa tan tạo dd màu nâu đất. Khi dư KI: I
Trong quá trình phản ứng có bọt khí 2 + KI KI3 sinh ra. nâu đất. 17
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ống 4: thêm vài giọt H2SO4 NO2- + H+ HNO2
đặc ta thấy dd có sủi bọt khí không 3HNO màu. 2 HNO3 + 2NO +H2O Kết luận:
Muối nitrit vừa có tính khử vừa có tính oxy
hóa. Acid nitrit là acid không bền sẽ tự phân hủy
theo cơ chế tự oxy hóa khử.
Điều chế và tính chất của amoniac:
a) Điều chế NH3: NH
Lắp bộ phận điều chế NH 4Cl + NaOH o t NH4OH + NaCl (1) 3. Cho vào ống nghiệm 3g NH NH 4Cl 4OH o t NH3 + H2O (2)
và 5ml dd NaOH đậm đặc. Lắc kĩ NH + 3 + H2O NH4 + OH- (3)
ống nghiệm, đun nóng bằng đèn
cồn và thu khí thoát ra trong 1
Phenolphtalein hóa hồng là do có OH- sinh ra.
erlen, khi nghe mùi NH3 bay ra và
Sở dĩ nước bị hút vào erlen là vì áp suất trong
thành bình mờ như sương mù thì erlen giảm.Áp suất giảm do: ngưng đun.
+ 1 mol NH4OH khi tan trong nước thì nó chỉ
Đậy ống nghiệm bằng nút cao chiếm khoảng 15ml nhưng nếu 1 mol NH4OH ở thể
su có gắn ống thủy tinh và nhúng hơi thì nó chiếm đến 22,4l.
ngược bình erlen vào chậu nước có + NH
5 thêm vài giọt phenolphtalein. Quan 3 ngưng tụ và tan vào nước.
sát hiện tượng ta thấy nước từ từ bị
hút vào erlen sau đó bỗng nhiên
phụt mạnh và chuyển sang màu hồng
b) Cân bằng trong dung dịch NH + 4Cl NH4 + Cl- NH3:
Phản ứng này làm nồng độ NH + 4 tăng lên làm
Lấy dd thu được thí nghiệm trên cân bằng (3) dịch chuyển theo chiều làm giảm OH-
cho vào 4 ống nghiệm, mỗi ống nên màu hồng nhạt dần. Nhưng màu hồng không nghiệm 1ml:
mất hẳn vì bản chất (3) vẫn là phản ứng thuận nghịch.
Ống 1: thêm một ít dd NH H+ + OH - H
4Cl và lắc cho tan ra ta thấy màu 2O
hồng nhạt dần. Cho đến dư thì màu
Acid vào trung hòa lượng OH – trong dd. Khi cho
hồng không mất hẳn.
đến dư acid thì hoàn toàn hết OH – nên màu hồng của dd mất hẳn. Ống 2: thêm từ từ H 2SO4
loãng đến dư ta thấy màu hồng nhạt
Khi đun nóng thì NH3 bay hơi làm cân bằng phản 18
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
dần rồi mất hẳn.
ứng (3) dịch chuyển theo chiều làm giảm lượng OH-
nên màu hồng của dd nhạt dần.
Ống 3: đun nhẹ ta thấy màu
hồng nhạt dần nhưng không mất hẳn. Kết luận:
Ống 4: giữ để so sánh.
- NH3 tan nhiều trong nước.
So sánh màu trong 4 ống ta thấy
- Dung dịch NH3 là một bazơ yếu
màu dung dịch nhạt dần theo thứ tự
ống 4 > ống 3 > ống 1 > ống 2.
Nhiệt phân muối amoni:
- Do NH4Cl có nhiệt độ phân hủy lớn hơn
nhiệt độ thăng hoa nên sẽ thăng hoa trước. Khi gặp
Cho một ít tinh thể NH4Cl nhiệt độ thấp và hơi nước sẽ đọng lại trên thành ống
vào ống nghiệm, đun nóng. Quan nghiệm.
sát ta thấy trên thành ống nghiệm có
tinh thể trắng bám lên. Làm tương NH4Cl NH3 + HCl
tự như trên nhưng ta cẩn thận xua H O
hơi ẩm ra khỏi ống thì không xảy ra NH3 + HCl 2 NH4Cl (r)
hiện tượng thăng hoa vật lý.
Đây là hiện tượng thăng hoa vật lý vì trước khi 6
đạt nhiệt độ phân hủy thì NH4Cl đã thăng hoa và
Làm lại thí nghiệm trên không bị biến đổi chất. nhưng thay NH 4Cl bằng
(NH4)2SO4. Ta thấy khi đặt giấy tẩm (NH4)2SO4 o t 2NH3+H2SO4 (1)
phenolphtalein thì giấy xuất hiện 2
những vệt hồng, đồng thời dd còn Ba2+ + SO4 - BaSO4
lại tạo tủa trắng với dd Ba2+ và trên
Đây là hiện tượng thăng hoa hóa học vì
thành ống nghiệm không có tinh thể (NH4)2SO4 bị phân hủy theo phản ứng (1), không
trắng tạo thành. Đây là hiện tượng thể kết hợp lại với nhau. thănh hoa hóa học. Kết luận:
Muối amoni không bền, dễ bị nhiệt phân, phản
ứng phân hủy phụ thuộc vào gốc acid tạo thành muối amoni đó. 19
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Bài báo cáo thí nghiệm số 6:
HYDRO – OXY – LƯU HUỲNH ( H2 – O2 – S)
Ngày thí nghiệm: 16/09/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
Điều chế khí hydro và oxi
Tính chất hóa học của hydro, oxy, lưu huỳnh
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT NGHIỆM
QUAN SÁT HIỆN TƯỢNG.
PHƯƠNG TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
Ñieàu cheá H2
Zn + 2HCl ZnCl2 + H2
Do hydro tác dụng với oxi có lẫn trong ống
nghiệm và trong hệ thống dẫn khí nên có tiếng
nổ. Ban đầu lượng oxi nhiều hơn nên có tiếng nổ
- Lắp hệ thống thu khí. lớn.
1 - Cho vào ống nghiệm 3 hạt 0t
kẽm+5ml HCL đậm đặc.Thu khí sinh ra 2H2 + O2 H2O
bằng ống nghiệm nhỏ chứa đầy nước úp Hơi nước tạo thành gặp thủy tinh lạnh nên ngược trong chậu. ngưng tụ.
- Châm lửa đốt khí hydro thoát ra ở
đầu ống dẫn có tiếng nổ nhẹ, ngọn lửa
màu xanh đồng thời tỏa nhiều nhiệt. Kết Luận:
- Lấy thành phễu thủy tinh khô chà - Ñieàu chế hydro bằng cách cho kim loại
lên ngọn lửa. Ta thấy có hơi nước động mạnh tác dụng với axid. lên thành phễu.
- Hốn hợp hydro và oxi là hỗn hợp nổ mà
mạnh nhất khi tỉ lệ xấp xỉ 2:1. 20
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Hoạt tính của hydro nguyên tử và hydro phân tử: Cho 8ml dung dịch H 2SO4 10% + 2 ml dd KMnO 4 0.1M vào ống nghiệm.
Lắc kỹ rồi chia làm 3 ống.
- Ống 1: Dùng làm ống chuẩn.
- Hydro vào ống 2 là hydro phân tử không có
- Ống 2: Cho luồng khí hydro luồng qua. tính khử mạnh nên không tác dụng với KMnO4.
2 Màu không đổi so với ống thứ nhất.
- Hydro mới sinh là hydro nguyên tử, có tính
- Ống 3: Cho vào vài hạt kẽm. Dung dịch khử mạnh nên phản ứng với KmnO
trong suốt, đồng thời có sủi bọt khí. 4 làm mất màu dung dịch.
Khí sinh ra là do hydro nguyên tử chưa phản ứng kết
hợp thành hydro phân tử. Zn + H2SO4 ZnSO4 + 2[H] 5[H] + MnO - 4 + 3H+ Mn2+ + 4H2O Kết luận.
Hidro nguyên tử có tính chát khử mạnh hơn hydro phân tử..
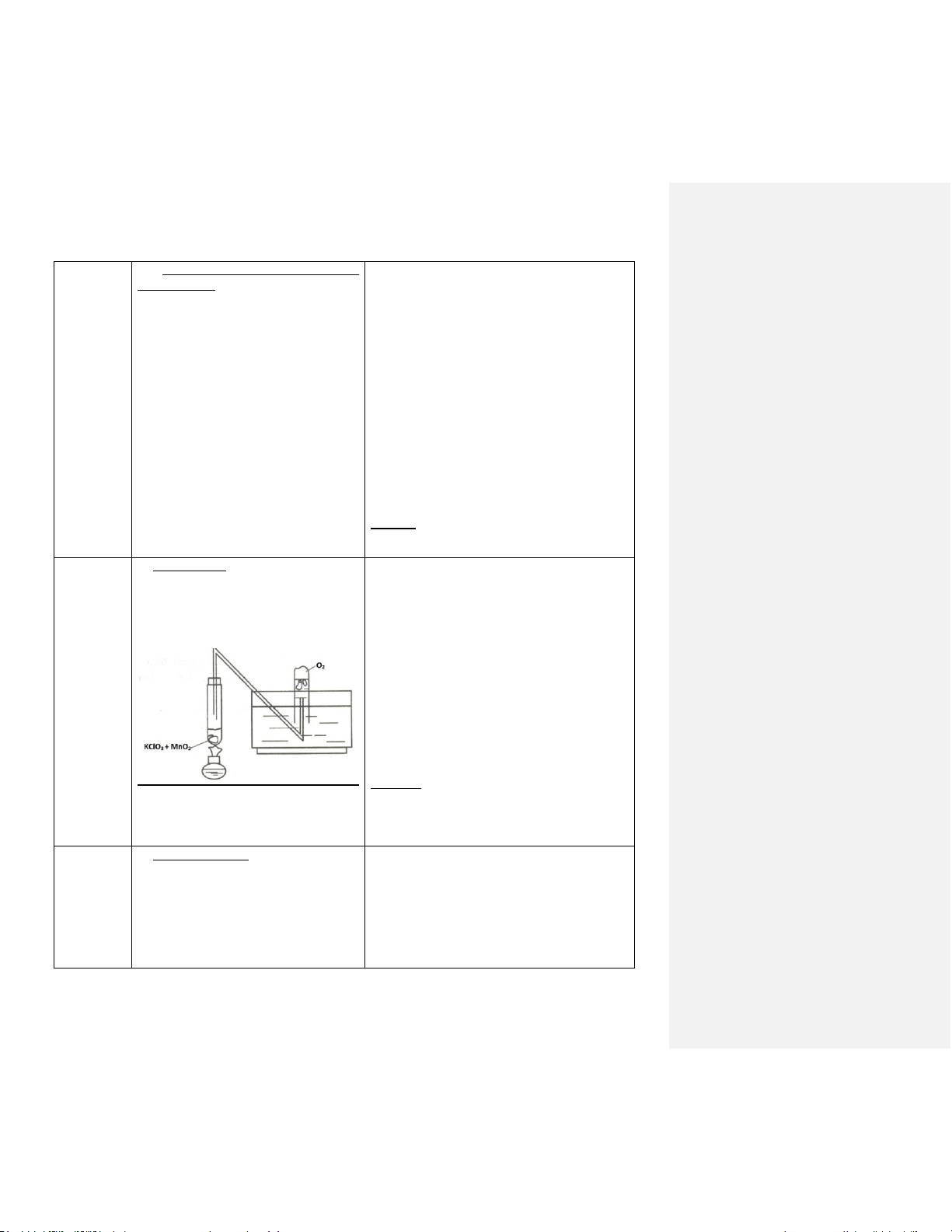
Điều chế Oxi:
- Trộn đều 4g KClO3 + 1g MnO2 bằng
cối và chày sứ, cho vào ống nghiệm thật
khô. Lắp hệ thống thu khí. 2KClO 0 MnO 3 2 ,t 2KCl + 3O2
MnO2 đóng vai trò là chât xúc tác 3 Kết luận:
KClO3 dễ bị nhiệt phân khi có chất xúc tác
- Đung nóng ống nghiệm và thu khí thích hợp tạo ra O2
thiats ra trong một ống nghiệm lớp chứa
đầy nước úp ngược trong chậu nước.
Tính chất của oxi:
- Dùng thìa kim loại lấy 1 ít lưu huỳnh - Lưu huỳnh có ái lực lớn đối với Oxi nên no có
4 đang cháy vào miệng ống nghiệm chứa thể cháy ngoài không khí và cho ngọn lửa xanh
Oxi ta thấy ngọn lửa bùng lên có màu phát nhiều nhiệt.. xanh tím. S + O 0t 2 SO2
Và tạo nên 1 tỉ lệ rất bé.ù 0t S + O3 SO3 21
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ở ống nghiệm lượng oxi nhiều làm tăng vận tốc của phản ứng.
- Đưa một đóm than vào ống nghiệm
chứa khí oxi thứ 2, than bùng cháy có tia - Ở nhiệt độ cao Cacbon có tính khử mạnh nên
lửa, phản ứng tỏa nhiệt mạnh.
khi gặp oxi sẽ phản ứng mãnh liệt: C + O2 0t CO2
- Nung đỏ sợi dây đồng và đưa vào ống
nghiệm chứa khí oxi thứ 3 dây đồng bị -Lớp màu đen là do đồng bị oxi hóa bởi oxi tạo đen lại. đồng oxit. 2Cu + O2 0t 2CuO Kết luận:
- Oxi là chất oxi hóa mạnh( đặt biệt ở nhiệt độ
cao), dễ oxi hóa kim loại và phi kim tạo oxit.
- Oxi duy trì và kích thích sự cháy.
Tính chất của H2O2 :
a) Tính oxi hóa của H2O2:
Cho vào ống nghiệm 4 giọt KI 0.5N
+ 3 gioït H2O2 3% +vài giọtt H2SO4
2I- + H2O2 + 2H+ I2 + 2H2O
2N. Dung dịch có màu nâu đất, làm xanh I2 sinh ra làm hóa xanh hồ tinh bột. hồ tinh bột.
Màu nâu đất của dung dịch là do I2 tạo với KI dư. 5
I2 + KI KI3 ( nâu đất) b)Phân hủy H H 2O2:
2O2 + 2H++ 2e =2H2O E0= +1.77(V)
Cho vào ống nghiệm 10 giọt H2O2 và H2O2 + 2e = 2OH- E0= +0.87(V)
một lượng nhỏ MnO2. Ta thấy dung dịch MnO2 đóng vai trò là chất xúc tác cho sự phân
sủi bọt mạnh, có khí thoát ra. hủy H2O2:
Đưa đóm than vào gẩn ta thấy đóm than 2H Mn 2 O 2O2 2H2O + O2
sáng hơn. Chứng tỏ đó là khí oxi. Kết luận: H2O2 không bền.
Có tính khử và tính oxi hóa.
Phản ứng giữa S và Cu:
- Cho vào chén sứ 1g lưu huỳnh, đun
sôi. Dùng kẹp đưa sợi dây đồng vào - Khói trắng là lưu huỳnh bị bốc hơi.
6 miệng chén. Sợi dây đồng chuyển sang Cu +S CuS ( ñen) màu đen. Kết luận:
Lưu huỳnh có tính chất oxi hóa mạnh ở nhiệt độ cao.
Lưu huỳnh đóng vai trò chất oxi hóa trong phản ứng trên. 22
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Tính khử của Thiosunphat:
Cho vào 2 ống nghiệm mỗi ống 2
giọt dung dịch Na2S2O3 0.5N.
- Ống 1: thêm từng giọt hỗn hợp dung dịch KMnO 2- 2-
4 0.5N vàø H2SO4 2N (tỉ lệ 8MnO4+5S2O3 +14H+10SO4
1:2).Nhận thấy dung dịch mất màu. Sau 1 +8Mn2++7H2O
thời gian dung dịch bị đục. S 2-
2O3 + 2H+ SO2 + S + H2O
S Sinh ra làm đục dung dịch. 7 2S 2- 2- 2O3 + I2 2I- + S4O6
- Ống 2: Thêm từng giọt Iốt màu tím 5H 2- -
2O+S2O3 +4Br2 HSO4 + 8Br- + 8H+
than của I2 mất dần đến không màu. 5H 2- -
2O+S2O3 +4Cl2 HSO4 + 8Cl-+ 8H+
Thay I2 bằng Cl2 hoặc Br2 thì dung dịch cũng mất màu. Kết luận:
Thiosunfat có tính khử mạnh và dễ phân
hủy trong môi trường acid tạo lưu huỳnh.
III/TRAÛ LÔØI CAÂU HOÛI: Caâu 1:
- Thí nghieäm 2 cho thaáy hydro nguyeân töû coù hoïat tính maïnh hôn hydro phaân töû.
- Nguyeân nhaân: Trong caùc phaûn öùng hoùa hoïc, hydro phaân töû tröôùc heát phaûi phaân
huûy thaønh hydro nguyeân töû maø quaù trình phaân huûy ñoù ñoøi hoûi tieâu toán nhieàu
nhieät. Trong khi ñoù ñoái vôùi hydro nguyeân töû thì khoâng caàn thieát. Chính vì vaäy maø
hydro nguyeân töû coù hoïat tính cao hôn.
Phöông trình phaûn öùng:
10[H] + 2KMnO4 + 3H2SO4 K2SO4 +2MnSO4 + 8H2O Caâu2:
Phaûn öùng quan troïng cuûa oxi laø phaûn öùng oxi hoùa, ñaëc bieät laø phaûn öùng chaùy: C + O2 CO2 C6H12O6 +6O2 6CO2 + 6H2O
Oxi coù nhieàu öùng duïng trong thöïc teá: duy trì söï soáng, saûn xuaát caùc hoùa chaát cô
baûn, duøng trong y teá, ñeøn xì …… Caâu3:
Ñeå giöõ cho H2O2 beàn ta phaûi:
Ñöïng trong caùc loï thuûy tinh maøu naâu saãm, ñeå choã raâm maùt.
Cho theâm chaát öùc cheá nhö acid photphoric hay acid sunfuric. Caâu4:
- Phöông trình ñieän töû theå hieän tính oxi hoùa cuûa löu huyønh: S0 +2e S2- 23
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Ví dụ H2 + S H2S
- Phöông trình ñieän töû theå hieän tính khöû cuûa löu huyønh: S0 – 4e S4+ S0 – 64e S6+ Ví dụ S + O 0t 2 SO2
S + 6HNO3ñ H2SO4 + 6NO2 + 2H2O. Caâu5:
Muoái thiosunfat coù tính khöû vì trong ion S 2-
2O3 ngoøai moät nguyeân töû S coù soá oxi
hoùa +6 coøn moät nguyeân töû S coù soá oxi hoùa -2 neân thiosunfat coù tính khöû. Cấu tạo của Na2S2O3 : Na –O O Na –O O S hoặc là S Na –O S Na –S O 2 S 2- 2- 2O3 + I2 2I- + S4O6 5H 2- -
2O + S2O3 + 4Br2 HSO4 + 8Br- + 8H+ 5H 2- -
2O + S2O3 + 4Cl2 HSO4 + 8Cl- + 8H+ 8MnO - 2- 2-
4 +5S2O3 +14H+ 10SO4 + 8Mn2+ +7H2O. 24
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 8: KIM LOẠI NHÓM IB (Cu – Ag – Au)
Ngày thí nghiệm: 23/09//2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Hiểu được các tính chất của Cu, Ag và hợp chất qua các phản ứng đặc trưng.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
*Điều chế CuSO4.5H2O Màu đen là màu của CuO.
Cân 2g CuO cho vào 1 bercher nhỏ CuO + H2SO4 CuSO4 + H2O
thêm vào 15ml H2SO4 4N (đã dư 20%
Cu2+ tạo phức [Cu(H2O)6]2+ làm dd có màu
so với lượng cần thiết). Đun nhẹ trên
xanh. Tinh thể tạo thành: CuSO4.5H2O.
bếp điện, khuấy đều.Ta thấy mẫu CuO CuSO4 + 5H2O CuSO4.5H2O 1 tan tạo dd màu xanh lam.
Lọc, dd qua lọc cô cạn đến khi xuất Hiệu suất phản ứng :
hiện váng tinh thể. Để yên cho kết tinh ở m
nhiệt độ phòng. Tinh thể có màu xanh H 100% x =56% m lớn dần. lt
Lọc tinh thể bằng phễu lọc chân
không thu được khối lượng m = 3.5g Kết luận Cu2+ dễ tạo phức.
Commented [t2]: Tham khao so lieu khac
Muối Cu2+ thường ở dạng hydrat.
Dung dịch Cu2+ có màu xanh. *Tính chất Cu(OH)2
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
Cho vào 3 ống nghiệm mỗi ống 0.5ml
dd CuSO4 5M + vài giọt NaOH 2M. Ta
thấy kết tủa màu lam được tạo thành. Cu(OH) 2 o t CuO + H2O.
Ống 1 : đun nóng xuất hiện 2 tủa màu đen
Cu2+ tạo phức với Cl- tạo dd màu xanh lục.
Ống 2: thêm HCl đđ cẩn thận.
Cu(OH)2 + 2HCl CuCl2 + 2H2O.
Tủa tan tạo dd màu xanh lục. CuCl2 + 2Cl- [CuCl4]2-.
Màu xanh tím là của [Cu(OH)4]2-.
Ống 3: cho lượng dư NaOH
Cu(OH)2 + 2NaOHNa2[Cu(OH)4].
40 %, đun nhẹ. Tủa tan tạo dd màu xanh tím.
Commented [t3]: Hình như cái này sai,kết tủa không tan Kết luận :
Commented [t4]: T cũng nghĩ là không vì sách hóa vô cơ ghi là Cu(OH)
dung dịch kiềm mạnh đặc dư thì mới có pu
2 không tan trong nước, phân huỷ khi đun
nóng và có tính lưỡng tính ( yếu). 25
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
* Thử tính chất đồng II
Cân 0.1g Cu cho vào 1 ml dd CuCl2 2M + thêm 1ml HCl 2M. Đun nóng khoảng 3 phút. Cu + CuCl
Để nguội, thêm nước thấy xuất hiện 2 2CuCl kết tủa trắng đục. 3
Thêm 1ml HCl 2M, đun nóng.Tủa tan CuCl + Cl- [CuCl
Commented [d5]: Theo t nghĩ H+ để tạo môi trường chắc không tạo dd màu xanh rêu. 2]-. thay thế được
[CuCl2]- có màu đen trong nền lam nên tạo dd màu rêu.
Commented [d6]: Có thễ dung NaCl thay thế dc k?
Thêm nước dung dịch có màu xanh
lam và xuất hiện tủa trắng. [CuCl
2]- không bền bị thủy phân:
[CuCl2]- Cl- + CuCl trắng. Kết luận :
Cu2+ có tính oxi hóa yếu.
*Thử tính chất đồng (II) :
Cho vào ống nghiệm lớn 5 giọt dd
CuCl2 2M và 5 giọt dd HCHO 40%.
Cu2+ + HCHO + H2O Cu+ + HCOOH + H+. 4 Đun nóng
Thêm NaOH đđ. Đun nóng, xuất hiện
2Cu+ + 2OH- Cu2(OH)2 vàng. kết tủa đỏ gạch
Cu2(OH)2 Cu2O đỏ gạch + H2O Kết luận :
Cu2+ có tính oxi hóa yếu.
* Thứ tính chất của Ag (I) Cu2+ +2I- CuI2. Lấy 2 ống nghiệm. CuI2 không bền
Ống 1: 5ml dd CuSO4 0.5M + vài giọt 5 2CuI
KI 1M, xuất hiện kết tủa vàng.Đun nhẹ 2 o t 2CuI vàng + I2. Hơi tím xuất hiện là I
hơi tím xuất hiện làm xanh hồ tinh 2.
DD có màu nâu do tạo phức I
bột.Dung dịch có màu đỏ 3-. I- + I2 I3- dd đỏ
Ống 2 : 5 giọt AgNO3 0.1M + vài giọt Ag+
KI 1M. Xuất hiện tủa vàng.Đun nhẹ tủa + I- AgI vàng. Kết luận : vàng không biến đổi.
Ag+ là trạng thái oxi hóa bền của Ag. Lấy 4 ống nghiệm : 6 Ống 1 và 2
Tủa màu lam là của Cu(OH) : 5 giọt CuSO 2. 4 0.5M + vài
giọt NaOH. Xuất hiện kết tủa màu lam. CuSO
4 + 2NaOH Cu(OH)2 + Na2SO4 Ống 1 Cu(OH) : thử tủa với HNO
2 + 2HNO3 Cu(NO3)2 + 2H2O. 3. Tủa tan tạo dd màu xanh lá. (màu xanh) 26
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Cu(OH)2 +4NH4OH [Cu(NH3)4](OH)2+4 H2O.
Ống 2 : thử tủa với NH4OH 2M. Tủa ( xanh đậm)
tan chậm tạo dung dịch màu xanh đậm
AgNO3 + NaOH AgOH + NaNO3.
Ống 3 và 4 : 5 giọt AgNO3 0.1M + vài
AgOH không bền,bị phân hủy:
giọt NaOH. Xuất hiện tủa màu xám. 2AgOH Ag2O + H2O. Ag2O + HNO3 AgNO3 + H2O.
Ống 3 : thử tủa với HNO3. Tủa tan tạo dd không màu.
Ag2O + 4NH4OH 2[Ag(NH3)2]OH + 3H2O.
Ống 4 : thử tủa với NH4OH 2M. Tủa tan
tạo dung dịch không màu. Kết luận :
Các kim loại IB có tính lưỡng tính yếu, dễ tạo
phức bền với dd ammoniac.
Cho vào 3 ống nghiệm mỗi ống 5 giọt AgNO3 0.1M.
Ống 1 : Thêm 10 giọt NaCl 0.1M. Xuất hiện tủa trắng.
Ag+ + Cl- AgCl trắng.
Thêm từng giọt đến dư NH4OH 2M.
Tủa tan tạo dd không màu
AgCl + 2NH4OH [Ag(NH3)2]Cl +2H2O.
7 Ống 2 : Thêm 10 giọt NaBr 0.1M. .
Ag+ + Br- AgBr vàng nhạt.
Xuất hiện tủa vàng nhạt.
Thêm từng giọt đến dư NH4OH. Tủa
AgBr + 2NH4OH [Ag(NH3)2]Br + 2H2O. tan một phần.
Ống 3 : Thêm 10 giọt NaI 0.1M. Xuất Ag+ + I- AgI vàng. hiện tủa vàng.
Thêm từng giọt đến dư NH4OH. Tủa
AgI + 2NH4OH [Ag(NH3)2]I + 2H2O. gần như không tan. Kết luận :
Màu của tủa đậm dần từ Clo đến Íôt.
Độ tan trong dãy AgCl, AgBr, AgI giảm dần do
bán kính anion tăng, khả năng bị cực hóa tăng.
*Phản ứng tráng gương.
AgNO3 + NH4OH AgOH + NH4NO3.
Cho vào ống nghiệm 5 giọt AgNO 2AgOH Ag2O + H2O. 8 3 0.1M + từng giọt NH
Ag2O + 4NH4OH 2[Ag(NH3)2](OH) + 3H2O 4OH 10% . Tủa
xuất hiện sau đó tan dần. o 4[Ag(NH t 4Ag + (NH
Thêm 5 giọt dd HCHO 40% , đun nóng. Xuất 3)2](OH) + HCHO 4)2CO3 + 6NH
hiện tủa bạc sáng ở thành ống nghiệm. 3 + 2H2O.
Commented [t7]: Đúng chưa
Commented [t8]: Hình như đúng rồi ^;^ 27
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo cáo thí nghiệm bài 9: KIM LOẠI NHÓM IIB (Zn-Cd-Hg)
Ngày thí nghiệm 14/10/2014
I/MỤC ĐÍCH THÍ NGHIỆM
- Nắm vững kiến thức về kim loại nhóm IIB
II/KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM
QUAN SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN Lấy 1ml dd H2SO4 10% cho Zn + H2SO4 ZnSO4 + H2
vào ống nghiệm, cho vào đó một
Khí hydro thoát ra bám quanh hạt kẽm làm
hạt kẽm kim loại. Ta thấy có bọt giảm diện tích tiếp xúc giữa kẽm và acid nên phản
khí xuất hiện bám quanh hạt kẽm ứng chậm. nhưng phản ứng chậm.
Vì khi cho CuSO4 vào thì Zn sẽ tác dụng với
CuSO4 tạo đồng bám trên bề mặt hạt kẽm: 1 Zn + CuSO4 ZnSO4 + Cu
Khi cho thêm 2 giọt dd CuSO4
Và khi đó hạt kẽm sẽ trở thành một pin điện
0,1M ta thấy khí thoát ra nhiều
hóa trong đó đồng đóng vai trò là cực âm nên H+
hơn, phản ứng nhanh hơn, có tủa nhận điện tử chuyển thành khí hydro thoát ra ở đỏ tạo thành.
đồng. Chính vì vậy không gây cản trở sự tiếp xúc
giữa Zn và H2SO4 nên phản ứng xảy ra nhanh. Kết luận:
Kẽm có tính khử, nó đẩy kim loại hoạt động yếu
hơn ra khỏi muối của nó.
2 Làm sạch bề mặt kẽm bằng Theo lý thuyết thì kẽm tác dụng được với nước tạo
cách cho tác dụng với HCl đặc hydroxit kẽm nhưng ở điều kiện thường kẽm bị bao
trước. Sau đó cho kẽm lần lượt tác phủ bởi một lớp oxit ZnO bền ngăn cản sự tiếp xúc
dụng trong điều kiện đun nóng:
của Zn với nước.Sau khi xử lý bằng HCl lớp ZnO 28
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
bị hòa tan, làm lộ ra lớp Zn nguyên chât phản ứng
Với H2O: ở điều kiện với H
thường kẽm không tác dụng với 2O:
nước nhưng khi được sử lý bằng Zn + H2O Zn(OH)2 + H2
HCl sau đó mới cho vào nước ban Lớp Zn(OH)
đầu có nhiều bọt khí bay lên sau
2 không tan ngăn Zn phản ứng với H đó giảm dần.
2O.Do đó có thể coi phản ứng không xảy ra. Zn + H 2SO4 loãng ZnSO4 + H2
Với H2SO4 loãng: có bọt
khí quanh hạt kẽm, tạo dung dịch không màu. Zn + H Với H 2SO4 đđ o t
ZnSO4 + SO2 + H2O 2SO4 đặc: thấy có
sủi bọt khí. Khi đun nóng phản
ứng nhanh hơn và có khí mùi sốc. 5Zn+12HNO
3 loãng 5Zn(NO3)2 +N2+ 6H2O
Với HNO3 loãng: sủi bọt
khí không màu, phản ứng diễn ra chậm và tỏa nhiệt. Zn+4HNO
3 đặc Zn(NO3)2 + NO2 +H2O
Với HNO3 đặc: phản ứng
diễn ra mãnh liệt, tỏa nhiệt mạnh, có khí màu nâu bay ra.
Zn + 2H2O + 2OH- [Zn(OH)4]2- + H2
Với NaOH loãng: miếng Các hạt rắn nhỏ màu đen là do kẽm chuyển dạng
kẽm trắng hơn và có bọt khí trên thù hình.
bề mặt hạt kẽm, có tạo các hạt rắn nhỏ màu đen.
Do dd đặc nên làm cho dung dịch khuếch tán
Với NaOH đặc: xuất hiện chậm nên phản ứng xảy ra chậm.
bọt khí li ti nhưng rất ít.
Zn+4NH3+2H2O [Zn(NH3)4](OH)2 + H2
Với NH4OH: xuất hiện
những bọt khí li ti nhưng rất ít. Zn + 2H 2O Zn(OH)2 + H2 Với NH4Cl bão hòa: khi
để nguội không thấy hiện tượng Zn(OH)2+4NH4Cl o t
gì. Còn khi đun nóng phản ứng [Zn(NH3)4]Cl2+2HCl+2H2O
xảy ra rất chậm, có bọt khí li ti bám quanh miếng kẽm.
Với ZnCl2 bão hòa, đun
Zn + H2O Zn(OH)2 + H2
nóng: có rất ít bọt khí thoát ra. Zn(OH)2 + ZnCl2 o t Zn[Zn(OH)2Cl2] Kết luận:
Zn là kim loại lưỡng tính có khả năng phản 29
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
ứng với acid và bazơ cho khí hydro bay ra.
Zn tạo phức được với dd NH3 và NH4Cl bão hòa.
Lấy vào 4 ống nghiệm, mỗi
ống 5 giọt dd mỗi loại lần lượt là: Zn2+, Cd2+, Hg2+, Hg 2+ 2 . Thêm
từng giọt dd NaOH 2N đến khi tạo thành kết tủa.
Ống nghiệm chứa Zn2+: Zn2+ + 2OH- Zn(OH)2
xuất hiện kết tủa màu trắng.
Khi cho dư NaOH ta thấy kết tủa tan ra. Zn(OH) 2 + NaOH Na2ZnO2 +2H2O Khi cho HCl vào thì tủa
cũng tan và tan nhanh hơn trong
Zn(OH)2 + 2HCl ZnCl2 + H2O NaOH dư.
Ống nghiệm chứa Cd2+:
xuất hiện kết tủa màu trắng. Khi cho dư NaOH vào thì tủa vẫn không tan. Cd2+ + 2OH- Cd(OH)2 3
Khi cho HCl vào thì tủa tan nhưng chậm.
Cd(OH)2 + 2HCl CdCl2 + H2O
Ống nghiệm chứa Hg2+:
xuất hiện kết tủa màu vàng. Hg2+ + 2OH- Hg(OH)2 Khi cho dư NaOH vào thì tủa vẫn không tan. Hg(OH)2 HgOvàng + H2O
Khi cho dư HCl vào thì tủa tan ra.
Ống nghiệm chứa Hg 2+ 2 : HgO +2HCl HgCl2 + H2O xuất hiện tủa đen. Hg 2+ + 2OH- 2 Hg2(OH)2 Khi cho dư NaOH vào thì tủa vẫn không tan Hg2(OH)2 HgO+ Hg + H2O
Chính màu của dạng thù hình của Hg có màu đen
Hg + HgO + 2 HCl Hg2Cl2 trắng + H2O
Khi cho HCl vào thì tủa đen Kết luận: chuyển thành màu trắng
Zn(OH)2 thể hiện tính lưỡng tính và tính
lưỡng tính giảm từ Zn đến Hg. 30
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Các hydroxit của kim loại IIB có độ bền
giảm khi đi từ Zn đến Hg. Hydroxit của Hg2+ và Hg 2+
2 không bền, dễ phân hủy cho oxit tương ứng.
Lần lượt cho vào 3 ống
nghiệm, mỗi ống 4 giọt dung dịch muối: Ống 1: ZnCl2 0,5M. Ống 2: CdCl2 0,5M. Ống 3: HgCl2 0,5M.
Thêm từng giọt NH4OH đậm đặc đến dư. Ta thấy: 4
ZnCl2+2NH4OH Zn(OH)2 +2NH4Cl
Ống 1: xuất hiện kết tủa Zn(OH)2+4NH4OH[Zn(NH3)4](OH)2 + H2O
trắng, cho dư NH4OH thì tủa tan tạo dd không màu.
CdCl2+2NH4OH Cd(OH)2 +2NH4Cl
Ống 2: xuất hiện kết tủa
Cd(OH)2+4NH4OH[Cd(NH3)4](OH)2 + H2O trắng, cho dư NH 4OH thì tủa tan tạo dd không màu.
HgCl2+2NH4OH Hg(OH)2 +2NH4Cl
Ống 3: xuất hiện kết tủa Hg(OH)2 HgOvàng + H2O
vàng và không tan khi cho NH- 4OH dư. Kết luận:
Từ Zn đến Hg thì khả năng tạo phức amiacat giảm dần.
Hg không tạo phức amiacat.
Điều chế thuốc thử Nester:
Lấy 2 giọt dd Hg2+ 0,1M. Hg(NO3)2+ 2KI HgI2 + 2KNO3
Thêm từng giọt dd KI. Ta thấy cí đỏ cam
kết tủa đỏ cam xuất hiện. HgI
Tiếp tục cho KI đến dư, ta 2 + 2KI K2[HgI4]
5 thấy tủa tan dần tạo dd màu vàng Phức tan màu vàng trong.
Thêm 5-6 giọt dd NaOH 2K2[HgI4]+3KOH+NH37KI+2H2O+Hg2NI.H2O
20%. Ta thấy màu của dd chuyển
sang vàng sậm. Thử tác dụng của đỏ gạch
thuốc thử Nester với dd NH + 4 hay
dd NH3. Ta thấy xuất hiện kết tủa đỏ gạch. Nếu không thêm dd NaOH
20% mà không thêm ngay dung 31
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 dịch NH + 4 hay dd NH3 thì không
có hiện tượng gì xảy ra. Chứng tỏ
NaOH làm môi trường cho phản
Ứng dụng: Thuốc thử Nester dùng để định tính ứng của thuốc thử.
và đinh lượng tạp chất NH3 và muối amoni ở trong các chất.
Lấy 4 ống nghiệm, cho vào
mỗi ống 5 giọt dd muối Hg2+ và 1 2HgCl giọt dd SnCl
2 + SnCl2 Hg2Cl2trắng + SnCl4 2. Ta thấy có kết tủa màu trắng.
Ly tâm cả 4 ống nghiệm trên,
chắt bỏ phần dung dịch.
Do Sn2+ có tính khử nên khử Hg 2+ 2 thành Hg:
Ống 1: tiếp tục cho thêm
Hg2Cl2 + SnCl2 SnCl4 + 2Hg
vài giọt SnCl2 ta thấy kết tủa đen chuyển sang màu xám đen. Ống 2: thêm 1ml HCl Hg2Cl2 + 2HCl H2[Hg2Cl4]
loãng, đun nóng. Ta thấy tủa tan Phức tan màu vàng
6 chậm tạo dd màu vàng nhạt, đồng Tủa xám dưới đáy ống nghiệm là Hg do trong
thời xuất hiện kết tủa xám dưới dd ion Hg2+2 có cân bằng phân hủy: đáy ống nghiệm. 2+ Hg2 Hg + Hg2+
Ống 3: thêm 1ml HCl đặc,
đun nóng. Ta thấy tủa tan nhanh hơn so với ống 2.
Ống 4: thêm 1ml dd NaCl Hg2Cl2 +2NaCl Na2[Hg2Cl4]
bão hòa, đun nóng. Ta thấy kết tủa Phức tan màu vàng
tan chậm và tạo dd màu vàng
nhạt, dưới đáy ống nghiệm có lớp tủa màu xám.
Kết luận: Hg 2+
2 vừa có tính khử vừa có tính oxy hóa. 32
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 10: NHÓM VB (Crôm)
Ngày thí nghiệm: 07/10/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Hiểu được các tính chất của các đơn chất và hợp chất của Cr3+ và Cr6+ qua các phản ứng đặc trưng.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
Trộn và nghiền mịn nhằm tăng diện tích tiếp xúc,
Cân 2.5g K2Cr2O7 và 1g đường tăng tốc độ phản ứng.
saccaro trộn và nghiền mịn trong cối, cho vào chén sắt.
Thêm 3ml cồn, đốt đến khi cồn 1
Cồn đóng vai trò là dung môi để hòa tan tốt cháy hết
đường, làm nước bay hơi nhanh hơn. C12H22O11 12C + 11H2O. Nung ở 600oC khoảng 1h.
K2Cr2O7 + 2C Cr2O3 +K2CO3 + CO
Để nguội, hòa tan bằng nước, lọc lấy
Sản phẩm thu được là Cr2O3.
phần rắn, sắy khô, cân được khối lượng m = 0.85 gam Hiệu suất : m H 100% x =65.76% mlt * Điều chế phèn nhôm
Màu cam là màu của dd K2Cr2O7. Cr2(SO4)3.K2SO4.24H2O
Khi cho H2SO4 màu dd đậm hơn, toả nhiệt.
Cho vào becher 5g K2Cr2O7 với
25ml nước cất, đun nóng, khuấy đều.
K2Cr2O7 + H2SO4 2CrO3 + K2SO4 + H2O.
Thêm từ từ 6ml dd H2SO4 đậm đặc, Giải thích: lắc đều
H2SO4 và CrO3 lấy nước của dd làm màu dd đậm hơn. 2
Khi để nguội cho thêm cồn dung dịch chuyển
Để nguội,ngâm becher vào nước, thêm sang màu xanh, xuất hiện khí mùi sốc và chua.
từ từ 3ml cồn 95o, lắc đều cho dd có màu xanh
2CrO3 + 3H2SO4 + 2C2H5OH Cr2(SO4)3 + CH3CHO + CH3COOH + 5H2O Mùi sốc là của CH3CHO. Mùi chua là của CH3COOH.
Màu xanh là màu của Cr3+.
Tinh thể thu được có xanh đen.
Trong dd có mặt 2 muốI Cr2(SO4)3 và K2SO4. Sản
phẩm kết tinh thu được là phèn Crôm 33
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 [Cr2(SO4)3.K2SO4.24H2O] Cr2(SO4)3 + K2SO4 + 24H2O Cr2(SO4)3.K2SO4.24H2O
Để nguội, khi kết tinh hoàn toàn Hiệu suất :
lọc và cân được khối lượng m = 10.03 m g H 100% x = 59.09% mlt
* Tính chất các hợp chất Cr3+
Cr3+ + 3OH- Cr(OH)3 xanh xám.
Cho vào 2 ống nghiệm mỗi ống 1ml
dd Cr3+, thêm từ từ dd NaOH loãng,ta
Cr(OH)3 + 3NaOH Na3 [Cr(OH)6]
thấy xuất hiện kết tủa màu xanh xám. lục nhạt. 3 Cr(OH)3 + 3H+ Cr3+ + 3H2O
Ống 1 : Cho NaOH loãng đến dư, ta
thấy kết tủa tan tạo dung dịch màu lục xanh lục nhạt Kết luận :
Ống 2 : Thêm acid loãng, tủa tan tạo
Cr(OH)3 có tính lưỡng tính. dung dịch màu xanh lục * Tính oxy hoá của Cr6+ Màu cam là màu của Cr 2 2O7 -.
Màu xanh là màu của Cr3+.
4 Cho vào ống nghiệm 3 giọt K2Cr2O7 Cr 22O7- + 3NO2- + 8H+ 2Cr3+ + 3NO3- + 4H2O. 0.5N + 5 giọt H2SO4 2N.
Cr3+ + 6 H2O [Cr(H2O)6]3+ màu xanh.
Thêm từ từ dd NaNO2 0.5N. Ta thấy
dung dịch chuyển từ màu cam sang Kết luận : màu xanh.
Cr2O7 2- có tính oxi hóa mạnh trong môi trường acid.
* Cân bằng của ion cromat và 2H+ 2 2 + 2CrO4 - Cr2O7 - + H2O. bicromat vàng da cam 5 Lấy 2 ống nghiệm. Cr 2 2
2O7 - + 2OH- 2CrO4 - + H2O.
Ống 1 :3-4 giọt K2CrO4 + từng giọt da cam vàng H
2SO4 2N. Ta thấy dung dịch chuyển Kết luận :
từ màu vàng sang màu da cam. Cân bằng giữa Cr 2 2
2O7 - và CrO4 - sẽ chuyển dịch
Ống 2 : 3-4 giọt K2Cr2O7 + từng giọt tùy theo pH của môi trường để tạo thành dạng bền :
NaOH 2N. Ta thấy dung dịch từ màu Cr 2 2O7 - bền trong acid.
da cam chuyển sang màu vàng. CrO 2 4 - bền trong base. 34
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 * Muối Cromat ít tan
Cho vào 5 ống nghiệm mỗi ống 3 Ba2+ + CrO 2 4 - BaCrO4 giọt K2CrO4 0.5N. Vàng nhạt
Ống 1 : 2 giọt BaCl2 0.5N, thấy có kết
tủa màu vàng nhạt tạo thành. Sr2+ + CrO 2 4 - SrCrO4
Ống 2 : 2 giọt SrCl2 0.5N, thấy có kết Vàng nhạt
tủa màu vàng nhạt tạo thành
Ống 3 : 2 giọt CaCl2 0.5N. thấy không có hiện tượng. 6
Ống 4 : 2 giọt Pb(NO3)2 0.5N, thấy có Pb2+ + CrO 2 4 - PbCrO4
kết tủa màu vàng tạo thành. vàng
Ống 5 : 2 giọt AgNO3 0.5N, thấy có Ag+ + CrO 2 4 - Ag2CrO4 vàng
kết tủa màu vàng nâu tạo thành
Do độ tan của SrCrO4 lớn T = 3,2.10-7
Ly tâm, tách bỏ chất lỏng thêm vào SrCrO 2 4 Sr2+ + CrO4 -
tủa 1ml dd CH3COOH 2N, ta thấy kết
tủa ở lọ đựng SrCl2 tan ra .
khi thêm H+ cân bằng chuyển dịch sang phải 2H+ 2 2 + 2CrO4 - Cr2O7 - + H2O
Vì vậy SrCrO4 tan nhiều hơn. Kết luận : Muối cromat ít tan
Trong một phân nhóm độ tan giảm dần từ trên xuống. 35
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo Cáo Thí Nghiệm Bài 11: NHÓM VB (Crôm)
Ngày thí nghiệm: 28/10/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
- Hiểu được các tính chất của Mn và hợp chất của chúng
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM SÁT HIỆN TƯỢNG
TRÌNH, TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
Điều chế KMnO4:
Cho thật nhanh 3g KOH cho vào KClO3+3MnO2+6KOH o t 3K2MnO4+KCl+3H2O
chén sứ rồi trộn với 2,5g KClO3. Cho
Màu xanh lục là màu của K2MnO4.
từ từ đến hết 1,5g MnO2. Đun hỗn hợp 3K
ở 600oC khoảng 20 phút. Lấy ra để
2MnO4+2H2O 2KMnO4+MnO2+4KOH (1)
nguội thấy sản phẩm có màu lục xanh.
Hòa tan sản phẩm bằng 50ml nước HCl + KOH KCl + H2O
cất rồi cho vào becher 250ml ta thấy dd
Khi cho HCl vào sẽ phản ứng với KOH làm cân bằng có màu xanh.
phản ứng (1) dịch chuyển theo thuận tạo ra KMnO4.
Cho HCl 2N vào trung hòa từ từ Định phân FeSO4:
cho tới khi dd có màu tím hẳn không còn màu xanh lục.
1 Để yên dd 3 phút rồi lọc lấy dd qua
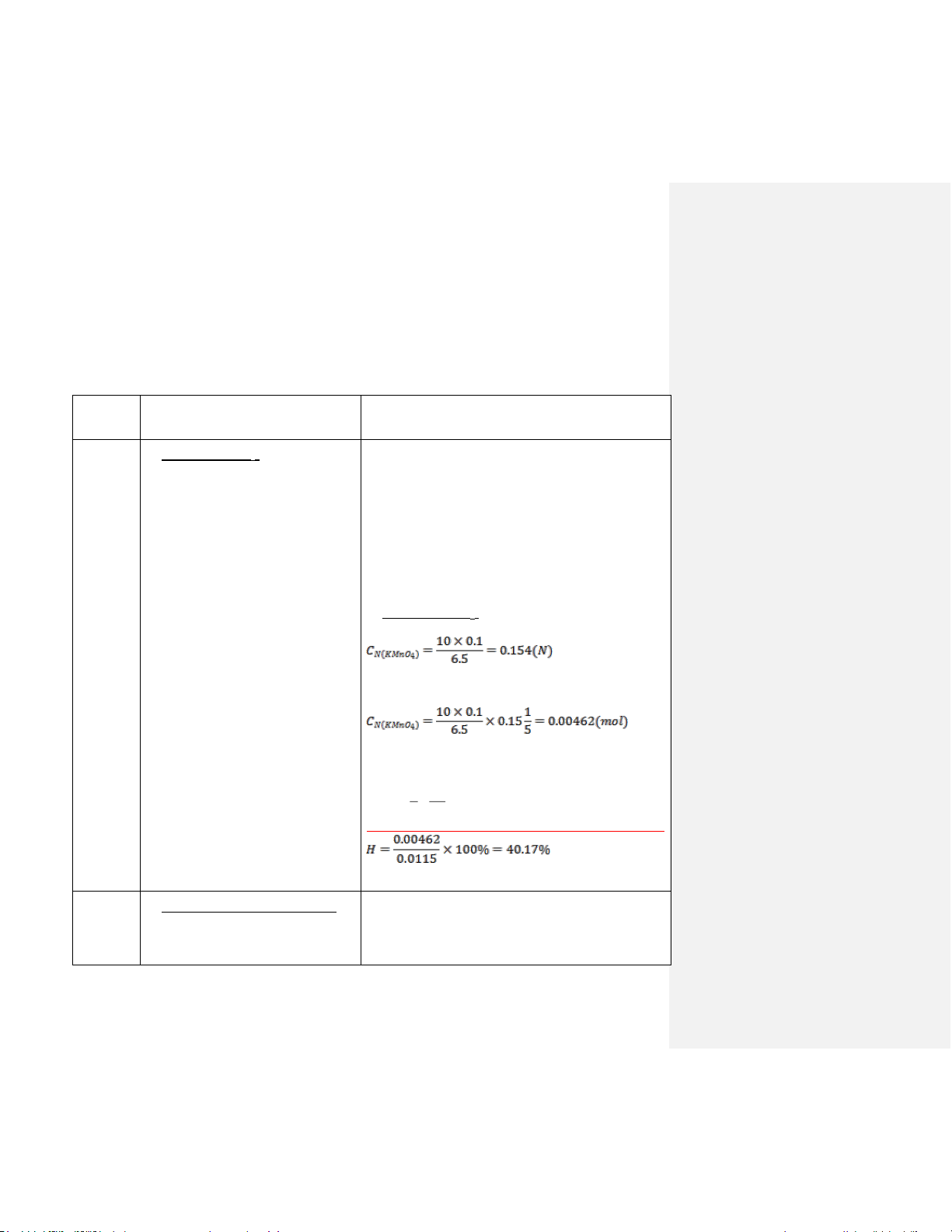
phễu lọc chân không. Thể tích dung Số mol KMnO4 thực tế: dịch thu được là 68ml.
Lấy 25ml dd KMnO4 này cho vào
buret. Dùng ống hút bầu hút chính xác
10ml FeSO4 0,1N cho vào erlen 250ml,
thêm vào 50ml nước cất và 6 ml H2SO4 đậm đặc. Nhỏ KMnO Số mol KMnO 4 xuống từ từ cho 4 lý thuyết:
đến khi dd chyuển sang màu hồng nhạt 2 1,5 thì dừng. Thể tích KMnO mol 4 đã dùng là n x 0, 0115 lt 4.5 ml. 3 87 Hiệu suất:
2 Tính chất của các hợp chất Mn: a)
Cho từ từ NaOH 2N Mn2+ + 2OH- Mn(OH)2 trắng
vào dd Mn2+ ta thấy có tủa Mn(OH)2 xuất hiện. 36
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Khi để tủa Mn(OH)2 ngoài
không khí, kết tủa sẽ hóa nâu đen.
- Do oxy trong không khí oxy hóa Mn(OH)2 thành
MnO(OH) và MnO2 có màu nâu đen.
4Mn(OH)2 +O2 4MnO(OH) + 2H2O
2Mn(OH)2 + O2 2 MnO2 + 2H2O
Thử tủa với HCl 2N thì tủa
tan nhưng sau đó tạo tủa mịn màu đen. Mn(OH)2 +2HCl MnCl2 + 2H2O
Tủa mịn màu đen là MnO(OH) và một phần MnO2
được sinh ra theo cơ chế trên: MnCl 2 + 2H2O Mn(OH)2 + 2HCl
Thử tủa với dd NaOH đậm
đặc dư thì thấy tủa không tan. Kết luận:
Muối Mn2+ thì bền nhưng hydroxit thì không bền dễ bị oxy hóa. b)
Cho vào ống nghiệm - Mn(OH)2 có tính bazơ trội hơn tính acid.
2 giọt dd MnSO4 loãng và 3 giọt dd
NaOH 2N, có kết tủa trắng tạo thành
sau đó hóa nâu một phần trong không Mn2+ + 2OH- Mn(OH)2 trắng
khí. Thêm vào đó 5-6 giọt H2O2 3%. Ta
Mn(OH)2 hóa nâu đen một phần do tác dụng với
thấy có kết tủa nâu đen tạo thành và có oxy trong không khí. Khi cho H2O2 vào:
bọt khí xuất hiện. H2O2 H2O + [O] 2[O] O2
2Mn(OH)2 + O2 + 2H2O 2Mn(OH)4
Mn(OH)4 MnO2nâu đen + 2H2O
Bọt khí là oxy. Oxy nguyên tử sinh ra nhiều chưa c)
Cho vào ống nghiệm kịp tác dụng nên kết hợp với nhau thành oxy phân tử
1ml dd muối Mn2+, thêm vào đó 1 bay ra.
nhúm bột K2S2O8 và 1ml NaOH đặc
rồi đun nhẹ ống nghiệm.
Khi chưa đun đã có tủa màu đen 2- 2-
tạo thành, phản ứng tỏa nhiệt. Mn2+ +S +4OH- +2H 2O8 MnO2đen + 2SO4 2O o 2Mn2+ +5S 2 t 2 2O8 -+16OH- 2MnO4-+10SO4 -+8H2O
Màu tím của dd là do sự hiện diện của ion MnO4-.
Sau khi đun nhẹ thì dd chuyển sang
Màu xanh của dd là do ion MnO 2 4 - tạo thành vì bị
màu tím. Nếu tiếp tục đun sôi thì dd đun mất nước. chuyển sang màu xanh. 2MnO 2
4- + MnO2 + 4OH- 3MnO4 - + 2H2O d) Cho vào ống nghiệm 37
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
1ml KMnO4 loãng, thêm vào 3 giọt KI 2KMnO4+10KI+8H2SO46K2SO4+2MnSO4+5I2+8H2O
0,5N và 3 giọt H2SO4 2N. Ta thấy có Tủa I
tủa tím than tạo thành. Khi cho thêm 2 bị hòa tan trong KI dư:
KI thì tủa tan tạo dd màu nâu đất. I2 + KI KI3 nâu đất
TRẢ LỜI CÂU HỎI:
Câu 1: Giải thích các giai đoạn điều chế KMnO4:
Đun nóng hỗn hợp gồm KOH, KClO3, MnO2 ở 600oC để KOH nóng chảy tạo sự tiếp xúc pha tốt,
thuân lợi cho phản ứng và để oxy hóa MnO2 bằng KClO3 trong môi trường KOH nóng chảy tạo K2MnO4 (do MnO 2
4 - bền trong môi trường OH-).
Hòa tan sản phẩm vào nước rồi cho HCl vào để trung hòa KOH và tạo môi trường cho K2MnO4 thủy phân thành KMnO4.
3K2MnO4+2H2O 2KMnO4+MnO2+4KOH (1)
HCl sẽ trung hòa lượng KOH tạo thành ở (1) làm cân bằng chuyển dịch theo chiều thuận.
Chấm thử trên giấy lọc đến khi có màu tím hẳn để đảm bảo K2MnO4 chuyển hoàn toàn thành KMnO4.
Lọc bỏ rắn dư chưa phản ứng để thu dd KMnO4.
Định phân KMnO4 bằng FeSO4 để xác định nồng độ của KMnO4. Từ đó tính được hiệu suất của quá trình.
Câu 2: Vai trò của KClO3 và KOH:
KClO3 đóng vai trò là chất oxy hóa.
KOH đóng vai trò là môi trường và là xúc tác của phản ứng: KClO3+3MnO2+6KOH o t 3K2MnO4+KCl+3H2O
3K2MnO4+2H2O 2KMnO4+MnO2+4KOH
Từ 2 phản ứng trên ta thấy số phân tử KOH được hoàn trả lại nhỏ hơn số phân tử phản ứng. Vì vậy
KOH là tác chất phản ứng. Câu 3:
Mục đích của việc thêm HCl 2N là để trung hòa KOH nhằm làm cân bằng (1) dịch chuyển theo chiều
tạo ra KMnO4 và tạo môi trường cho K2MnO4 thủy phân thành KMnO4. KOH + HCl KCl +H2O
Câu 4: Phương trình phản ứng định phân giữa KMnO4 và FeSO4 chuẩn:
2KMnO4 + 10FeSO4 + 8H2SO4 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Câu 5: Tính oxy hóa của KMnO4 phụ thuộc vào nhiều môi trường:
Trong môi trường acid: Mn2+ bền. 38
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
MnO4- + 8H+ + 5e Mn2+ + 4H2O
Ví dụ: 2KMnO4 + 10FeSO4 + 8H2SO4 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Trong môi trường trung tính: Mn4+ bền chủ yếu là MnO2.
MnO4- + 2H2O + 3e MnO2 + 4OH-
Ví dụ: 2KMnO4 + 3Na2SO3 + H2O 2MnO2 + 3Na2SO4 + 2KOH
Trong môi trường bazo: Mn6+ bền. MnO 2 4- + 1e MnO4 -
Ví dụ: 2KMnO4 + K2SO3 + 2KOH 2K2MnO4 + K2SO4 + H2O 39
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Báo cáo thí nghiệm bài 12:
KIM LOẠI CHUYỂN TIẾP NHÓM VIIIB
Ngày thí nghiệm 21/10/2014
I/ MỤC ĐÍCH THÍ NGHIỆM
Nắm vững tính chất các hợp chất Fe2+, Fe3+, Ni2+, Co2+.
II/ KẾT QUẢ THÍ NGHIỆM THÍ
MÔ TẢ THÍ NGHIỆM VÀ QUAN
GIẢI THÍCH HIỆN TƯỢNG ,VIẾT PHƯƠNG NGHIỆM SÁT HIỆN TƯỢNG
TRÌNH ,TÍNH TOÁN VÀ RÚT RA KẾT LUẬN
* Điều chế muối Mohr Khí thoát ra là hydro Becher : 25ml dd H2SO4 4N +
Fe + H2SO4 FeSO4 + H2.
2.5g vỏ bào sắt, thấy có khí thoát ra, Dung dịch có màu đen do sắt bị nhiễm bẩn.
dung dịch có màu đen. Đun sôi trong Màu xanh là màu của dd FeSO4.
tủ hút cho đến khi sắt tan hết, thấy Sản phẩm kết tinh thu được là muối Morh
dung dịch có màu canh lơ. Khi đun (NH4)2Fe(SO4)2.6H2O.
1 luôn giữ cho thể tích dd không đổi.. Lọc lấy dung dịch. Thêm vào dd qua lọc 7g
(NH4)2SO4 rắn, đun đến khi xuất hiện váng tinh thể.
Để nguội và cho kết tinh ở nhiệt
độ phòng. Lọc chân không thu được Hiệu suất :
sản phẩm có khối lượng m = 14,03gam m
Commented [d9]: Số này tui nghĩ ra vì nếu dùng số liệu nhóm H 100% x =80,17 %
mình thì hiệu suất chỉ có 41%, còn nếu dùng nhóm khác thì tới 95% mlt
Tính chất các hợp chất của Fe2+ và Fe3+. a.Fe2+ :
Cho muốI Morh tác dụng lần lượt với :
2 1.K3[Fe(CN)6] Xuất hiện tủa màu Fe2+ + K3[Fe(CN)6] KFe[Fe(CN)6]+2K+. xanh dương (xanh dương)
2.H2O2/H2SO4. Dung dịch có màu
2Fe2+ + 3H2O2 + 2H+ 2Fe3+ + 4H2O + O2.
vàng nhạt, có khí thoát ra 3.K 2-
2Cr2O7/H2SO4. Dung dịch có
6Fe2+ + Cr2O7 + 14H+ 6Fe3+ + 2Cr3+7H2O màu xanh rêu. vàng 40
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
4.KMnO4/H2SO4.Dung dịch có màu vàng nhạt.
5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O. vàng nhạt
5.(NH4)2S. Xuất hiện kết tủa đen. Fe2+ + S2- FeS đen
6.NaOH 2N Xuất hiện kết tủa xanh, hóa nâu ngoài không khí.
Fe2+ + OH- Fe(OH)2 xanh.
4Fe(OH)2 + O2 + 2H2O 2Fe(OH)3 nâu đỏ. b. Fe3+.
Cho vào ống nghiệm 2 giọt FeCl3
0.5N + 2 giọt H2SO4 2N + từ từ KI
2Fe3+ + I- Fe2+ + I2 tím than.
0.5N. Xuất hiện tủa màu tím Khi dư KI
than.Khi dư thì tủa tan tạo dd màu
I2 + KI KI3 ( nâu đất)
nâu đất làm xanh hồ tinh bột.
Cho vào 2 ống nghiệm mỗi ống 5 giọt FeCl3 0.5N :
Ống 1 : 2 giọt NH4SCN. Dung dịch
chuyển sang màu đỏ máu.
Fe3+ + 3SCN- Fe(SCN)3 (đỏ máu)
Ống 2 : 1 giọt K4[Fe(CN)6] 0.5N Kết tủa màu xanh đậm.
Fe3+ + K4[Fe(CN)6] KFe[Fe(CN)6] ( xanh berlin) Kết luận : Fe2+ dễ bị oxi hóa.
Muối Fe3+ bền trong không khí, có tính oxi hóa trong acid.
*Tính chất của hiđroxit:
a./Cho vào 2 ống nghiệm mỗi ống Màu hồng là màu của phức [Co(H2O)6]2+.
5 giọt dd CoCl2 loãng. Dung dịch CoCl2 có màu hồng.
Lúc đầu: CoCl2 + NaOH CoOHCl
3 Thêm vài giọt NaOH 2N.Xuất ( xanh)
hiện kết tủa màu xanh sau đó chuyển Sau đó: CoOHCl + NaOH Co(OH)2 + NaCl sang tủa màu đỏ (đỏ)
Ống 1 : Đun nóng để ngoài 4Co(OH)2 + O2 + 2H2O 4Co(OH)3 ( xám)
không khí. Kết tủa chuyển sang màu xám.
2Co(OH)2 + H2O2 2Co(OH)3 ( xám)
Ống 2 : Thêm vài giọt H2O2 3%. 2H2O2 2H2O + O2
Kết tủa chuyển sang xám và xuất 41
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 hiện bọt khí. Kết luận : Co2+ dễ bị oxi hóa.
b/.Cho vào 2 ống nghiệm mỗi ống Ni2+ + 2OH- Ni(OH)2 ( trắng xanh)
5 giọt NiCl2 + 2 giọt dd NaOH 2N,
thấy xuất hiện kết tủa trắng xanh.
Ống 1 : Để tủa ngoài không khí, tủa không bị đổi màu
Khí sinh ra là oxi do H2O2 phân hủy.
Ống 2 : Thêm vài giọt H2O2 3%. 2H2O2 2H2O + O2 Xuất hiện bọt khí
c/ Lấy 4 ống nghiệm.
Ống 1 : 5 giọt Fe2+ + vài giọt
Fe2+ + 2OH- Fe(OH)2 ( trắng xanh).
NaOH.,thấy xuất hiện tủa trắng xanh.
Fe(OH)2 + 2H+ Fe2+ + 2H2O.
Chia tủa thu được làm 2 phần:
Cho tác dụng với HCl đđ., tủa
tan tạo dung dich không màu.
Cho tác dụng với NaOH đđ., không hiện tượng.
Fe3+ + 3OH- Fe(OH)3 ( nâu đỏ)
Ống 2 : 5 giọt Fe3+ + vài giọt NaOH,
xuất hiện kết tủa đỏ nâu.
Fe(OH)3 + 3H+ Fe3+. + 3H2O Chia tủa làm 2 phần :
Cho tác dụng với HCl đđ. Tủa tan tạo dd màu vàng.
Cho tác dụng với NaOH đđ. Tủa không tan.
Co2+ + 2OH- Co(OH)2 ( hồng đỏ)
Ống 3 : 5 giọt Co2+ + vài giọt
NaOH. Xuất hiện tủa màu hồng Co(OH)2 + 2H+ Co2+ + 2H2O.
đỏ.Chia tủa làm 2 phần : (hồng nhạt)
Cho tác dụng với HCl đđ tủa tan
ít tạo dd màu hồng nhạt.
Cho tác dụng với NaOH đđ., không hiện tượng.
Ni2+ + 2OH- Ni(OH)2 ( xanh lục)
Ống 4 : 5 giọt Ni2+ + vài giọt
NaOH. Xuất hiện tủa màu xanh lục.
Ni(OH)2 + 2H+ Ni2+ + 2H2O. 42
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 Chia tủa làm 2.phần :
Cho tác dụng với HCl đđ. Tủa tan tạo dd màu hồng nhạt. Kết luận :
-Độ bền các hợp chất hóa trị II tăng dần, độ bền
Cho tác dụng với NaOH đđ., các hợp chất hóa trị III giảm dần từ Fe đến Ni. không hiện tượng.
-Các hidroxyt có tính base trội hơn và không tan trong kiềm
Sự đổi màu của muối Co2+ và
phản ứng Tsugaep của Ni2+
a./ Dùng dd CoCl2 bão hòa viết
lên tờ giấy lọc. Chữ có màu hồng.
Do phức [Co(H2O)6]2+ khi đun nóng bị mất nước tạo
Hơ trên ngọn lửa đèn cồn. Màu
phức [Co(H2O)4]2+ nhỏ hơn nên có màu xanh tím.
hồng biến mất, xuất hiện màu xanh tím.
b./ Phản ứng Tsugaep của Ni :
Cho vào ống nghiệm 5 giọt NiCl Ni2+ + 2OH- Ni(OH) 2 2 (xanh lục) + 1 giọt NH Ni(OH) 4OH 2N. Xuất hiện kết 2 + 6NH3 [Ni(NH3)6](OH)2
4 tủa màu xanh lục, sau đó tan ra tạo ( xanh đậm) dung dịch xanh đậm. CH3 –C=N –OH
Thêm 1 giọt demethyl glioxyme. 2 + Ni(OH)2 2H2O +
Xuất hiện tủa màu đỏ máu. CH3 –C=N –OH O…H – O CH3 –C =N N=C –CH3 Ni CH3 –C= N N=C-CH3 O –H … O
Phức chất có dạng hình vuông, trung hòa về điện có
tính axit và bazo đều yếu nên tủa trong nước hay
trong dung dịch NH4OH loãng , nhưng lại tan tốt
trong axit và bazo mạnh. Vì vậy, khi thay NH4OH
bằng NaOH, nếu dùng vừa đủ để tạo tủa Ni(OH)2 thì
có tủa màu đỏ nhạt, cho thêm NaOH thì tủa tan ngay.
Phản ứng này dùng để định tính và định lượng Ni2+ trong dung dịch.
Sự tạo phức của Co(II) và Ni(II) với NH3 và Cl-
a./ Lấy 2 ống nghiệm , cho vào mỗi ống 0,5 ml CoCl2
Ống 1 : thêm từ từ dung dịch
Co2+ + 2OH- Co(OH)2 ( hồng ) 43
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
NH4OH đậm đặc đến dư. Ta thấy tủa
Co(OH)2 + 6NH3 [Co(NH3)6](OH)2 (nâu)
hồng xuất hịên rồi tan ra tạo dung Màu xanh là do NH4OH đậm đặc đã hút nước của
5 dịch màu nâu phía trên , màu hồng phức [Co(H2O)6]2+
phía dưới , còn lại ở giữa màu xanh .
Khi lắc mạnh toàn bộ dung dịch chuyển sang màu nâu. [Co(H
2O)6]2+ + 4Cl- [CoCl4 ]- + 6H2O
Ống 2 : thêm HCl đậm đặc ư. Dung hồng xanh dịch có màu xanh.
Ni2+ + OH- Ni(OH)2 (xanh lục)
b./ Thay CoCl2 bằng NiCl2
Ni(OH)2 + 6NH3 [Ni(NH3)6](OH)2
Ống 1 : Thêm từ từ NH4OH đến dư. ( xanh đậm)
Kết tủa xanh tan ngay tạo dd xanh đậm. 2+ 2
Ni(H2O)6 + 4Cl- NiCl4 - + 6H2O xanh vàng
Ống 2 : Thêm HCl đđ dư dung dịch chuyển sang màu vàng Kết luận :
Ni(OH)2 và Co(OH)2 tan trong NH3 do có khả năng tạo phức bền.
Co2+, Ni2+ có khả năng tạo phức với Cl- , phức làm đổi màu dung dịch
III/ TRẢ LỜI CÂU HỎI
TRẢ LỜI CÂU HỎI. Câu 1 : Từ sắt kim loại: Điều chế muốI Fe(II) Fe + 2HCl FeCl2 + H2
Điều chế muốI Fe(III) bằng cách cho tác dụng vớI H2SO4 hoặc HNO3 đặc nóng dư.
Fe + 6HNO3 Fe(NO3)3 + 3NO2+ + 3H2O.
Câu 2 : Sự khác nhau giữa muối kép và muối phức 44
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228 Muối kép Muối phức
-Là hh của nhiều muối kết tinh đồng thời -Là một hợp chất
-Liên kết trong muối kép là lực lk Van Der
-Liên kết trong phức là lk giữa các ion
Waals giữa các phân tử muối
trung tâm và các phối tử Câu 3 : Trong dd muối Morh (NH + 2-
4)Fe(SO4)2.6H2O chứa các ion NH4 , Fe2+ , SO4
+ Cho dung dịch NaOH đậm đặc vào đun nhẹ:
-Có tủa xanh rêu tạo thành nhanh chóng hóa nâu trong không khí: chứng tỏ có Fe2+ Fe2+ +2OH- Fe(OH)2 Fe(OH)2 +O2 +2H2O Fe(OH)3
-Có khí mùi khai bay ra chứng tỏ có NH4+ NH4+ +OH- NH3+H2O + Cho dung dịch muối BaCl 2_
2 vào có tủa trắng tạo thành không tan trong axit mạnh chứng tỏ có SO4 Ba2++SO 2_ 4 BaSO4
Câu 4 : Giải thích các quá trình điều chế muối Morh
Hoà tan Fe trong H2SO4 loãng tạo Fe2+
Đun nóng giúp phản ứng hoà tan diễn ra nhanh hơn . Nó cũng làm H2SO4 đặc hơn , nó sẽ oxi hoá
Fe2+ lên Fe3+ . Vì vậy phải thường xuyên thêm nước để làm loãng H2SO4 hạn chế Fe3+ tạo thành và
giữ Fe dư chuyển Fe3+ thành Fe2+
Khi Fe dư gần hết , lọc để loại bỏ tạp chất 45
Báo cáo thí nghiệm Hóa vô cơ Lê Hữu Toàn: 61304190
Lương Thị Mỹ Trang: 61304228
Thêm ngay (NH4)2SO4 rắn vào bercher thu nước lọc và khuấy đều nhằm tạo dd 2 muối đồng bão hoà
để 2 muối kết tinh đồng thời . (NH4)2SO4 là chất khử sẽ giữ cho Fe 2+ không bị oxi hoá lên Fe3+ trong muối kép
Ngâm bercher trong nước lạnh để quá trình kết tinh thuận lợi hơn.
Câu 5: Phản ứng nhận biết Fe2 + :
Fe2+ + K3 [Fe(CN)6] KFe[Fe(CN)6] xanh + 2K+
Phản ứng nhận biết Fe3+ :
Fe3+ + K4[Fe(CN)6] KFe[Fe(CN)6] xanh + 3K+ Fe3+ + 3SCN- Fe(SCN)3
Câu 6 : Phản ứng Tsugaep là phản ứng tạo phức của Ni(II) : niken dimetylglioximat trong dung dịch NH3
loãng, được dùng để định tính và định lượng Ni2+ trong dung dịch. 46




