













Preview text:
BÁO CÁO KẾT QUẢ THỰC HÀNH
BÀI 9: ĐỘ TAN VÀ TÍCH SỐ TAN Ngày thực hành: Họ và tên: MSSV: Điểm Lời phê
1. Bản chất của tích số tan
Tích số tan của một chấy điện li ít tan được định nghĩa là tích số các nồng độ ion tự do của nó trong dung dịch bão hòa ở một nhiệt độ nhất định
với các số tương ứng là các chỉ số của ion trong phân tử.
Những yếu tố ảnh hưởng đến tích số tan
Tích số tan không phụ thuộc vào nồng độ ion chỉ phụ thuộc vào bản chất của chất tan và nhiệt độ.
2. Quy luật của tích số tan
Với dung dịch chất điện li ít tan AmBn ta có cân bằng sau:
AmBn (rắn) = mA+n(dung dịch) + nB
Vì [AmBn] = 1 nên K = [A+n]m [B-m]n là một hằng số và được gọi là tích số tan T. Như vậy T cũng là một loại hằng số cân bằng do đó nó chỉ phụ
thuộc vào bản chất của chất tan và nhiệt độ.
[A+n]m [B-m]n = T: Ta có dung dịch bão hòa trong đó vận tốc hòa tan bằng vận tốc kết tủa. Kết tủa không tạo thành cũng không tan thêm vào dung dịch.
[A+n]m [B-m]n < T: Dung dịch này là dung dịch chưa bão hòa. Vận tốc hòa tan lớn hơn vận tốc kết tủa, nếu ta thêm chất rắn vào thì nó sẽ tan cho
đến khi đạt trạng thái cân bằng.
[A+n]m [B-m]n > T: Dung dịch loại này quá bão hòa. Tích số nồng độ của các ion trong dung dịch lớn hơn tích số nồng độ bão hòa. Khi đó các ion
này sẽ kết hợp với nhau tạo thành kết tủa tách ra khỏi dung dịch làm giảm nồng độ của chúng trong dung dịch cho đến khi đạt trạng thái bão hòa.
Ứng dụng của quy luật tích số tan trong sự hòa tan và tạo thành kết tủa của các chất điện li ít tan.
Dựa vào quy luật trên người ta có thể điều khiển được quá trình hòa tan hay kết tủa của các chất điện li ít tan như sau:
Muốn hòa tan một kết tủa phải thêm vào kết tủa đó các chất có tác dụng làm giảm nồng độ của các ion do kết tủa phân li ra; thường thì các chất
này tạo phức bền với ion của kết tủa hoặc là tạo thành axit mạnh.
Muốn kết tủa một chất, ta phải thêm vào dung dịch một chấtcó chứa ion đồng loại với kết tủa để làm tăng nồng độ của ion kết tủa trong dung dịch.
3.Nồng độ ảnh hưởng đến sự hòa tan, kết tủa:
Nồng độ ảnh hưởng đến sự hòa tan hay là sự ảnh hưởng nồng độ của các ion trong dung dịch đến sự hòa tan, kết tủa.
Xét chất kết tủa hòa tan : AmBn
Vì [AmBn] = 1 nên Ksp = [A+n]m [B-m]n là một hằng số và được gọi là tích số tan T. Kí hiệu T hay K
độ các ion không bắt buộc phải bằng hằng số tích số tan mà còn tồn tại:
- Nếu tích nồng độ các ion < Ksp thì không có kết tủa tạo thành mặc dù muối tạo thành có thể là muối ít tan theo quy tắc hòa tan. Điều này là bởi
vì nồng độ của các ion không đủ lớn để làm quá trình kết tinh hình thành kết tủa có thể xảy ra.
- Nếu tích nồng độ các ion > Ksp thì nồng độ của các ion đủ lớn cho sự kết tủa có thể xảy ra.
=> Tích nồng độ các ion trong dung dịch quyết định đến sự hòa tan, kết tủa.
4.Kết quả các thí nghiệm
a. Khỏa sát ảnh hưởng của ion đồng loại và các chất khác đến độ tan.
- Giải thích hiện tượng trong tường ống nghiệm
Các ống nghiệm đều chứa dung dịch là CH3COOAg bão hòa:
Ống nghiệm 1: khi cho thêm CH3COONa vào thì xuất hiện các hạt nhỏ hay tinh thể tách ra khỏi dung dịch trong ống nghiệm vì nồng độ của
ion CH3COO- tăng lên thì tích số ion của dung dịch sẽ lớn hơn tích số tan, do đó tinh thể CH
Ống nghiệm 2: Khi cho thêm HNO3 đặc vào có khí thoát mùi giấm ra khỏi ống nghiệm. Vì phản ứng tạo ra axit axetic có phương trình
CH3COOAg + HNO3 = CH3COOH + AgNO3
Ống nghiệm 3: Cho thêm NH4OH vào tạo ra kết tủa đen vì phản ứng xuất hiện Ag
2CH3COOAg +2NH4OH → 2CH3COONH
b. Xác định điều kiện để hình thành kết tủa.
Ống nghiệm 1: dung dịch không thấy hiện tượng.
Ống nghiệm 2: tạo kết trắng trong ống nghiệm.
Vì tích nồng độ các ion trong ống nghiệm 1 nhỏ hơn tích số tan nên không tạo kết tủa và ngược lại tích nồng độ các ion trong ống nghiệm 2 lớn
hơn tích số tan nên phản ứng tạo kết tủa.
c. So sánh khả năng tạo cuae các ion trong cùng một dung dịch
Chưa li tâm: ống nghiệm cho kết tủa màu vàng là màu của AgI Qua 5 lần li tâm thì:
Hai lần đầu tạo kết tủa vàng đục
Hai lần tiếp theo kết tủa trắng là màu của AgCl
Lần li tâm cuối không còn kết tủa dung dịch trong suốt.
Vì tích số tan T(AgI) = 1,1.10-16 nhỏ hơn tích số tan T(AgCl) = 1,8.10-10 nên AgI tạo kết tủa trước AgCl. Sau khi thêm dung dịch AgNO
nồng độ ion Ag+ tăng tiếp tục tạo kết tủa với ion Cl- cho đến khi không tạo kết tủa được nữa. Bài 8: Dung d ị ch đ ệ m
đăng 03:16 30-06-2011 bởi Huỳnh Nguyễn Văn
BÁO CÁO KẾT QUẢ THỰC HÀNH Bài 8: DUNG DỊCH ĐỆM Ngày thực hành: Họ và tên: MSSV Điểm Lời phê
1.Dung dịch đệm là dung dịch có giá trị pH không đổi hoặc thay đổi rất ít khi ta thêm vào hệ một lượng nhỏ axit – bazơ hoặc khi pha loãng.
Phân loại dung dịch đệm.
Có 2 loại dung dịch đệm:
- Dung dịch đệm axit là hệ dung dịch đệm được hình thành bằng cách trộn lẫn một axit yếu với muối của nó với một bazơ mạnh.
- Dung dịch đệm bazơ là dung dịch đệm được hình thành bằng cách trộn lẫn một bazơ yếu với muối của nó với một axit mạnh.
- Dung dịch đệm tạo thành bởi 2 chất lưỡng tính axit-bazơ.
2. pH của dung dịch đệm axit và dung dịch đệm bazơ chỉ phụ thuộc vào hằng số cân bằng của axit/bazơ yếu và tỉ số giữa nồng độ đầu của muối
và nồng độ đầu của các axit/bazơ. Do đó khi chúng ta pha loãng dung dịch hoặc thêm vào dung dịch đệm một lượng axit – bazơ thì pH của dung dịch thay đổi rất ít.
Ứng dụng của dung dịch đệm:
-Khả năng chống lại sự thay đổi pH đột ngột giúp dung dịch đệm được dùng phổ biến trong các quá trình hoá học và cần thiết cho các chu trình hoá sinh.
-Dung dịch đệm giúp giữ nguyên độ pH cho các enzym trong các cơ thể sống hoạt động.
- Hỗn hợp đệm của axit cacbonic (H −
2CO3) và bicacbonat (HCO3 ) hiện diện trong huyết
-Trong công nghiệp, dung dịch đệm được dùng trong các quá trình lên men và được dùng trong từng trường hợp nhuộm riêng lẻ. Chúng cũng
được dùng trong ngành hoá phân tích và chuẩn độ pH.
3.Kết quả các thí nghiệm.
a. Lập thang màu đo pH của dung dịch axit. Màu của dung dịch Nồng độ HCl (N) 0,1 0,01 0,001 0,0001 Chỉ thị thymol xanh Đỏ Đỏ cam Đỏ nhạt Vàng nhạt Chỉ thị metyl da Đỏ Đỏ nhạt Da cam Vàng nhạt cam pH tương ứng 1 2 3 4
b. Hệ đệm axit và khảo sát khả năng đệm của hệ Số giọt dung dịch Hiện tượng Số giọt Hiên tượng HCl H2O Ống 9 Vàng→da cam 1 13 Da cam→hồng 18 Hồng→đỏ Ống 30 Màu không đổi 2 Ống 15 Vàng→da cam 3 18 Da cam→đỏ nhạt 21 Đỏ nhạt→đỏ Ống 30 Màu không đổi 4
c. Lập thang màu đo pH dung dịch bazơ Màu của dung dịch Nồng độ NaOH (N) 0,1 0,01 0,001 0,0001 Chỉ thị Indigocarmin Vàng đậm Vàng Vàng xanh Xanh Chỉ thị Alizarin vàng Đỏ đậm Đỏ Vàng nhạt Vàng R pH tương ứng 13 12 11 10
d. Hệ đệm bazơ và khỏa sát khả năng đệm của hệ. Số giọt dung dịch Hiên tượng Số giọt Hiện tượng NaOH H2O Ống 26 xanh→xanh nhạt 1 40 xanh nhạt→vàng Óng 40 Màu không đổi 2 Ống 17 vàng→vàng cam 3 37 vàng cam→đỏ Ống 40 Màu không đổi 4
e. Xác định pH của dung dịch đệm vừa điều chế trong thí nghiệm 2, 4.
Dựa vào bảng thang màu xác định khoảng pH thì:
Thí nghiệm 2: pH của dung dịch đệm axit bằng 4.
Thí nghiệm 4: pH của dung dịch đệm bazơ bằng 10.
f. So sánh khả năng đệm của dung dịch đệm từ bảng số liệu thực nghiệm của thí nghiệm 2, 4.
Khi thêm axit/bazơ vào hệ đệm axit/bazơ thì pH của hệ đệm axit/bazơ thay đổi rất ít so với ban đầu. Vì vậy độ đệm của dug dịch đệm axit/bazơ
là rất mạnh. Nhưng theo kết quả thực nghiệm cho thấy khả năng đệm của hệ đệm bazơ mạnh hơn so với hệ đệm axit.
g. Nhận xét về sự thay đổi màu :
Khi thêm dung dịch axit vào hệ đệm axit thì màu của hệ thay đổi từ vàng sang đỏ khi ta cho nhiều axit cho thấy sự thay đổi pH là rất ít.
Khi thêm dung dịch bazơ vào hệ đệm bazơ thì màu của hệ thay đổi từ xanh sang vàng (đối với chỉ thị
chỉ thị Alizarin vàng R) khi ta cho nhiều bazơ cho thấy sự thay đổi pH là rất ít.
=> Dung dịch có giá trị pH không đổi hoặc thay đổi rất ít khi ta cho thêm vào hệ một lượng nhỏ axit – bazơ hoặc khi pha loãng hệ. BÀ I 4: Pha dung d ị ch chu ẩ n đ ộ
đăng 03:14 30-06-2011 bởi Huỳnh Nguyễn Văn
BÁO CÁO KẾT QUẢ THỰC HÀNH
BÀI 4: PHA DUNG DỊCH VÀ CHUẨN ĐỘ Ngày thực hành: Họ và tên sinh viên: MSSV: Điểm Lời phê 1.Các định nghĩa
-Nồng độ phần trăm khối lượng ( %) là số mol chất tan chứa trong 100 gam dung dịch. C% =mct.100/mdd
-Nồng độ mol (CM hay M) là số mol chất tan chứa trong một lít dung dịch. CM = n / V
-Nồng độ đương lượng (CN hay N ) là số đương lượng gam chất tan chứa trong một lít dung dịch.
N = Eqchất tan / Vdung dịch. Trong đó Eqchất tan là số đương lượng của chất tan.
-Nồng độ molan (Cm hay m) là số mol chất tan trong 1000 gam dung môi.
-Nồng độ phần mol (Xi) chỉ số mol chất l chia cho tổng số mol của các chất có mặt trong dung dịch. Xi = ni / n .
2.Trong phòng thí nghiệm sẵn có nước cất, các dung dịch CaCl2 20% (d = 1,77) và dung dịch 40% (d = 1,396).Cách pha 200ml dung dịch CaCl230% (d = 1,282):
Theo công thức đường chéo ta có: 20% 10 30% 40% 10
Suy ra: VCaCl2 20% = VCaCl2 40% = 100ml
Cách pha: -Trộn 100ml dung dịch CaCl2 20% với 100ml CaCl2 40%.
-Pha theo CaCl2 40%: C1%d1V1 = C2%d2V2
<=> 40. 1,396. V1 = 30. 1,282. 0,2
<=> V1 = 0,138 lít CaCl2 40%.
Nước cất cần dung 0,062 lít.
3.Cơ sở khoa học của phương pháp xác định nồng độ dung dịch bằng phù kế.
Phù kế là dụng cụ đo nhanh tỷ trọng của chất lỏng, là một phao rỗng băng thủy tinh. Phần trên có bảng chia độ tương ứng với các giá trị của
tỷ trọng đã được hiệu chuẩn ở nhiệt độ xác định có giá trị trong bảng, phần dưới bầu có đầu hạt trì giữ cho phù kế ở vị trí đứng thẳng khi nhúng vào dung dịch.
4.Trình bày tính toán và kết quả thí nghiệm.
a.Pha dung dịch chất rắn trong nước
Pha 500% ml dung dịch NaCl 10%, d = 1,085 g/cm3.
Khối lương NaCl cần lấy: m = = 1,085.500.0,1 = 5,425 g.
Cách pha: Đổ 5,425g NaCl vào bình định mức 500ml, thêm nước đến 500ml dùng phù kế kiểm tra nồng độ thì dung dịch có nồng độ 10%.
b.Pha dung dịch có nồng độ nguyên chuẩn CM HCl 17% = = = 5,54M
Vì CM = CN / N => CN = CM.N = 5,54N (N số đương lượng bằng 1).
Pha 100ml (V2) dung dịch axit HCl 0,1N (C2) từ dung dịch axit 17%
Ta có: C1V1 = C2V2 => V2 =
= 1,8ml.Suy ra lượng nước cất cần dùng là 100 – 1,8 = 98,2 ml.
c.Pha dung dịch từ hai dung dịch có nồng độ khác nhau. 10 2 7 5 3 =>
= . Suy ra V1 = VNaCl 10% = 100ml, V2 = VNaCl 5% =150ml
Cách pha: Trộn 100ml dd NaCl 10% với 150ml dd NaCl 5% ta được 250ml dd NaCl 7%. d.Pha loãng dung dịch
Pha 100ml KMnO4 0,01N từ dung dịch KMnO4 0,1N.Gọi V1 là thể tích dung dịch KMnO dùng.Ta có:
0,1.V1 = 0,01.(V1 + Vn) <=> 0,1.V1 = 1 => V1 = 9,1ml.Vậy lượng nước cần dùng là 100 – 9,1 = 90,9ml.
e.Xác định nồng độ bằng phương pháp chuẩn độ trung hòa
Xác định nồng độ dung dịch HCl có thể tích 20ml khi nhỏ từ từ từng giọt NaOH 0,1N tới khi V
phản ứng với nhau theo đương lượng nên nồng đọ của các dung dịch trong phep chuwnr độ thường dùng là nồng độ đương lượng. Ta có tỷ lệ: = => NHCl = = 0,1N Bài 7: Ch ấ t
ch ỉ th ị màu H ằ n g s ố i đ ệ n ly axit- b az ơ y ế u
đăng 03:09 30-06-2011 bởi Huỳnh Nguyễn Văn [ đã cập nhật 03:26 30-06-2011 ]
BÁO CÁO KẾT QUẢ THỰC HÀNH
BÀI 7: CHẤT CHỈ THỊ MÀU HẰNG SỐ ĐIỆN LI CỦA AXIT – BAZƠ YẾU Ngày thực hành: Họ và Tên: MSSV: Điểm Lời phê
1.Hằng số điện li phụ thuộc vào yếu tố: Ka, Kb về bản chất là hằng số cân bằng nó không đổi và phụ thuộc vào
độ. Ka là đại lượng đặc trương cho cường độ của axit, Ka càng lớn, axit càng mạnh và ngược lại. K
lớn, bazơ càng mạnh và ngược lại.
2.Nguyên tắc của phương pháp dùng chỉ thị để xác định pH: Chỉ thị axit/bazơ là những axit/bazơ hữu cơ có màu sắc thay đổi tùy theo nồng độ của H
dung dịch. Mỗi chỉ thị sẽ đổi màu ở một khoảng pH nhất định và thông thường để chuyển hẳn từng màu này sang màu kia khoảng pH đó gần bằng 2 đơn vị.
Muốn dùng chỉ thị để xác định chính xác pH của một dung dịch, người ta kế hợp cùng một lúc nhiều chỉ thị có khoảng
giá trj pH sẽ ứng với một tổ hợp của nhiều màu. Càng nhiều chỉ thị thì xác suất các tổ hợp màu đó trùng nhau càng ít, pH đo được càng chính xác.
3.Người ta thường sử dụng phenolphthalein làm chất chỉ thị trong phản ứng trung hoà mà không dùng chất chỉ thị khác vì phenolphthalein là
chất có màu thay đổi trong khoảng pH từ 8 - 10. Nếu pH < 8 thì có màu trắng. Nếu pH > 8 thì có màu hồng từ nhạt đến đậm, thể hiện nồng độ của bazơ càng
cao. Nhưng nếu pH > 10 thì phenolphtalein lại không màu như cũ. Do đó, người ta thường hay sử dụng
- bazơ vì: sự thay đổi màu rõ rệt từ trắng sang hồng hoặc ngược lại khi cho dư 1 giọt dung dịch chuẩn độ.
màu ngay tại vị trí pH = 7, nên chọn phenolphtalein làm chất chỉ thị trong phản ứng trung hòa chứ không dùng các chất chỉ thị khác .
4.Khi nào thì sử dụng hỗn hợp các chất chỉ thị: Muốn dùng chỉ thị để xác định chính xác pH của một dung dịch, người ta kế hợp cùng một lúc nhiều chỉ thị
có khoảng chuyển màu kế tiếp nhau. Khi đó mỗi giá trj pH sẽ ứng với một tổ hợp của nhiều màu. Càng nhiều chỉ thị thì xác suất các tổ hợp màu đó trùng
nhau càng ít, pH đo được càng chính xác.
5.Kết quả các thí nghiệm.
a.Lập thang màu – khoảng pH của dung dịch axit. Màu của dung dịch Nồng độ HCl (N) 0,1 0,01 0,001 0,0001 Chỉ thị thymol xanh Đỏ Đỏ cam Đỏ nhạt Vàng Chỉ thị metyl da cam Đỏ Đỏ nhạt Da cam Vàng
b.Xác định khoảng pH của dung dịch axit X bằng chỉ thị
Màu sắc của dung dịch X
Ống nghiệm 1 ( nhỏ thymol xanh): Vàng
Ống nghiệm 2 ( nhỏ metyl da cam): Vàng
pH dung dịch X bằng 4
c.Xác định hằng số điện li của dung dịch axit yếu
Máu sắc dung dịch CH3COOH 0,1N
Ống nghiệm 1( thymol xanh): Đỏ nhạt
Ống nghiệm 2( metyl da cam): Da cam
Hằng số Ka của CH3COOH
pHCH3OOH = 3 => pH = ½ (pKa – lgCa) = 3 => pKa = 10-5
d.Thí nghiệm 4: Lập thang màu – khoảng pH dung dịch bazơ Màu của dung dịch Nồng độ NaOH (N) 0,1 0,01 0,001 0,0001 Chỉ thị Indigocarmin Vàng đậm Vàng Vàng nhạt xanh Chỉ thị Alizarin vàng R Đỏ đậm Đỏ Vàng nhạt Vàng
e.Xác định khoảng pH của dung dịch bazơ Y bằng chỉ thị Màu sắc dung dịch Y
Ống nghiệm 1(Indigocarmin): Xanh
Ống nghiệm 2(Alizarin vàng R): Vàng pH dung dịch Y bằng 11
f.Xác định hằng số điện li của dung dịch bazơ yếu
Màu sắc dung dịch NH4OH 0,1N
Ống nghiệm 1( Indigocarmin): Xanh
Ống nghiệm 2(Alizarin vàng R): Vàng
Hằng số Kb của NH4OH [OH-] = = = 0,0001M => Kb = = = 10-7 BÀ I 6 : Ph ả n ứ n g trao đ ổ i
đăng 03:07 30-06-2011 bởi Huỳnh Nguyễn Văn [ đã cập nhật 03:24 30-06-2011 ]
BÁO CÁO KẾT QUẢ THỰC HÀNH
BÀI 6 : PHẢN ỨNG TRAO ĐỔI Ngàythựchành: Họvàtên: MSSV: Điểm LờiPhê
1.Phảnứngtraođổilàphảnứnghóahọcxảyratrongđókhôngcósựthayđổisốoxihóacủacácchấtvàcác ion.
Đểphảnứngtraođổicókhảnăngxảyraphảicóítnhấtmộtsảnphẩmtạothànhlàchấtkémbềnhoặcchấtđiện li yếuhoặcchấtdễ bay hơi.
2.Phươngtrìnhphảnừngxảyratrongbàithựcnghiệm: Ca(OH)2 + Na2CO3 CaCO3 + 2NaOH
Quátrìnhchuẩnđộxảyratheo 2 giaiđoạn:
Giaiđoạnthứnhất: HCltrunghòaNaOHvàchuyển Na2CO3thànhdạng NaHCO3.Kếtthúcgiaiđoạnnày pH của dung dịchvàokhoảng
8,3.Thuốcthửdùngtronggiaiđoạnnàylàphenolph NaOH + HCl NaCl + H2O Na2CO3 + HCl NaHCO3 + NaCl
Giaiđoạnthứhai: HCl tiếp tục trunghòa NaHCO3 thànhmuốitrungtính Na2CO3.Kếtthúcgiaiđoạnnày pH của dung dịchvàokhoảng
3,8.Thuốcthửdùngtronggiaiđoạnnàylàmetyl da cam. NaHCO3 + HCl CO2 + H2O + NaCl
3. HiệusuấtđiềuchếNaOH.
V1 :ThểtíchHCldùngtronggiaiđoạn 1 là: 23,5ml
V2 :ThểtíchHCldùngtronggiaiđoạn 2 là: 1,5ml
VậyhiệusuấtđiềuchếNaOHlà: HNaOH = ×100 = ×100 =88%
4. Phảikhuấyđềukhichonướcvôitrongvào dung dịch Na2CO3vìCa(OH)2làchấtít tan nênphảikhuấyđềuchoCa(OH) Na2CO3.
5. Giaiđoạnchuẩnđộđầudùng phenolphthalein vì dung dịchtrongphảnứnglà dung dịchbazokhinhỏ phenolphthalein vào dung dịchsẽcómàuhồnggiúp ta
xácđịnhđượclượngbazođãhếtchưakhi ta dùng dung dịchHClđểxácđịnhnồngđộ dung dịchNaOH.
Giaiđoạnchuẩnđộsaudùngmetyl da cam đểxácđịnhlượngNaOHphảnứnghếtvà dung dịchHCldưvìtrong dung dịchbazometyl da cam cómàu da cam
còntrongaxitcómàuhồng.Ta nhậnbiếtbằngsựchuyểnmàutừmàu da cam sang màuhồng. Bài 5: V ậ n t ố c ph ả n ứ n g
đăng 21:45 11-05-2011 bởi Huỳnh Nguyễn Văn [ đã cập nhật 03:23 30-06-2011 ]
BÁO CÁO KẾT QUẢ THỰC HÀNH
BÀI 5: VẬN TỐC PHẢN ỨNG Ngàythựchành: Họtên: MSSV: Điểm Lờiphê
1. Vậntốcphảnứnghóahọcphụthuộcvàonhữngyếutố: A. Nồngđộ:
Theo địnhluậttácdụngkhốilượng, vậntốcphảnứngtỉlệvớinồngđộchấtphảnứng. aA + bB = SP W = k [A]x . [B]y
K – hệsốtỉlệđặctrưngchomỗiphảnứng B. Nhiệtđộ
Tốcđộphảnứngphụthuộcrấtnhiềuvàonhiệtđộxảyraphảnứng.Khinhiệtđộtăng, sốvachạmcóhiệuquảtănglên, do đótốcđộphảnứngtănglên. k2 = k1 .
Trongđó: k2 – hằngsốtốcđộphảnứngtạinhiệtđộ t
k1 – hằngsốtốcđộphảnứngtạinhiệtđộ t C. Chấtxúctác
Chấtxúctáclàchấtcókhảnănglàmtăngnhanhtốcđộcủacácphảnứngkhảnăngxảyramàkhôngbịtiêuhaotrongphảnứng.
D.Nănglượnghoạthóacủaphảnứng.
E. Bềmặtcủacácchấtthamgiaphảnứng.
2. Hằngsốvậntốc k chỉphụthuộcvàobảnchấtchấtphảnứngvànhiệtđộchứkhôngphụthuộcvàonồngđộcủachấtphảnứng.
3. Tốcđộtrungbìnhvàtốcđộtứcthời:
Tốcđộtrungbình W làtrongkhoảngthờigian t, nồngđộchấtphảnứngthayđổimộtlượnglà W =
Tốcđộtứcthờilàkhivậntốcphảnứngtrungbìnhtrongkhoảngthờigian t vôcùngnhỏ (
thìlúcđótốcđộtrungbìnhtiếntớigiớihạnlàvậntốctứcthờitạithờiđiểm t: W = 4. Kếtquảthínghiệm
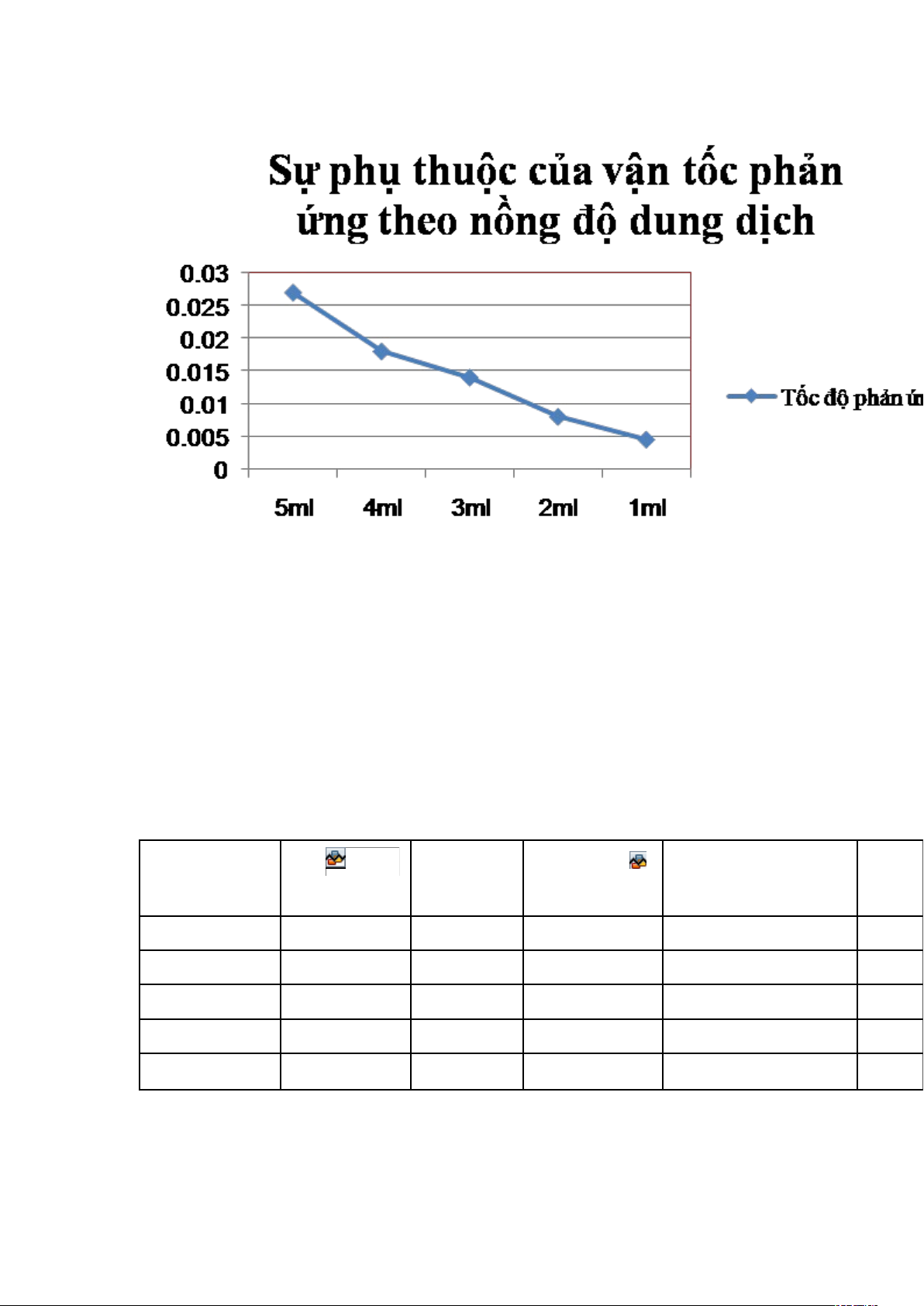
a. Khảosátảnhhưởngcủanồngđộđếnvậntốcphảnứng Thínghiệm V 0,2 V ( VHCl 1M Thờigianquansát Vậntốcphảnứng M (ml) ml) (ml) (t) W = 1/t 1 5 0 5 37 0,027 2 4 1 5 56 0,018 3 3 2 5 72 0,014 4 2 3 5 125 0,008 5 1 4 5 220 0,0045
b. Vẽđườngbiểudiễnsựphụthuộccủavậntốcphảnứng w = 1/t theonồngđộcủa dung dịch Na Nhậnxét:
Giảmnồngđộchấtphảnứngthìtốcđộphảnứnggiảmdần.
c. Dựđoánlượngkhí SO2thayđổinhưthếnàokhi:
- Tănglượng Na2S2O3sửdụnglênhailần: thìlượngkhí SO2khôngthayđổivìlượngHClkhôngđổinênphảnứngkhôngtiếptụcxảyra.
- GiảmlượngHClđihailần: thìlượngkhí SO2giảmđihailầnvìlượngchấtthamgiaphảnứngHClgiảmgâyradưlượngNa
d. Khảosátsựảnhhưởngcủanhiệtđộđếnvậntốcphảnứng Thínghiệm V VHCl1M Nhiệtđộ( C Thờigianquansát Vậntốcphảnứng 0,1N (ml) (ml) ) (t) W = 1/t 1 1 5 30 152 2 1 5 40 59 3 1 5 55 56 4 1 5 60 50 5 1 5 65 37
e. Vẽđườngbiểudiễnsựbiếnthiêncủavậntốcphảnứngtheonhiệtđộ. Nhậnxét:
Khinhiệtđộtăngtốcđộphảnứngtănglên
f. Khảosátảnhhưởngcủa Mn2+lênvậntốcphảnứng Thínghiệm Na2C2O40,1M H2SO44M KMnO40,02M MnSO40,1M (ml) (ml) (giọt) (giọt) 1 3 1 5 0 2 3 1 5 2 3 3 1 5 4 4 3 1 5 6
g. Vẽ đường biểu diễn sự phụ thuộc của vận tốc phản ứng theo lượng dung dịch MnSO Nhậnxét:
Khi lượng chất xúct ác tăng lênt hì vận tốc phản ứng tăng lên đáng kể. | Tệp đính kèm: Picture1.png Bài 12: Ph ả n Ứ n g Oxy hóa - Kh ử
đăng 21:32 11-05-2011 bởi Huỳnh Nguyễn Văn [ đã cập nhật 03:27 30-06-2011 ] Hi There! Câu 3: Cân bằng hóa học
3Na2S2O3 + 4K2Cr2O7 + 13H2SO4 → 3Na2SO4 + 4Cr2(SO
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4 )3 + 2MnSO4 + K As ↑
2S3 + 10HNO3 → 2H3AsO4 + 3S + 10NO2 + 2H2O S + 2HNO3 → H2SO4 + 2NO↑
Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10HNO3 + 6H2O Thí nghiệm 1 Zn + H ↑ 2SO4 → ZnSO4 + H2
- Hiện tượng: sủi bọt khí không màu.
- Giải thích: do khí hidro được giải phóng. Fe + CuSO4 → FeSO4 + Cu
- Hiện tượng: dd mát dần màu xanh chuyển sang trong suốt,trên dây sắt xuất hiện các mảng bám màu vàng.
- Giải thích: Cu bị đẩy ra khỏi muối và bám vào dây sắt,dd mất ion Cu Thí nghiệm 2
Cu + H2SO4 → CuSO4 + SO2 + H2O
- Hiện tượng: dd chuyển sang màu xanh,có sủi bọt khí không màu.
- Giải thích: dd sau PƯ chứa ion Cu2+ nên có màu xanh. PƯ giải phóng khí SO Cu + HNO ↑ 3(đ) → Cu(NO3)2 + NO2 + H2O
- Hiện tượng : dd chuyển sang màu xanh,có khí nâu đỏ thoát ra,phản ứng xảy ra mãnh liệt.
- Giải thích: dd sau PƯ là Cu(NO3)2 nên có màu xanh. Khí thoát ra là NO Thí nghiệm 3
K2Cr2O7 + 7H2SO4 + KI → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
- Hiện tượng: dd chuyển sang màu xanh.
- Giải thích: do PƯ tạo ra Cr2(SO4)3 nên có màu xanh. Thí nghiệm 4
- Ống ngiệm 1: dd chuyển sang màu hồng nhạt. Giải thích: do trong môi trường axit MnO Mn2+ nên có màu hồng.
MnO -4 + 8H+ + 5e → Mn2+ + 4H2O
- Ống nghiệm 2: dd xuất hiện các tinh thể màu nâu đen. Giải thích: do trong MT trung tính MnO MnO2.
MnO -4 + 2H2O + 3e → MnO2 + OH-
- Ống nghiệm 3: dd sang màu xanh. Giải thích: trong MT bazơ mạnh MnO MnO - 2 4 + e → MnO4 Thí nghiệm 5
- ống nghiệm 1: dd bị mất màu và trở nên trong suốt.
2KMnO4 + 3H2SO4 + KNO2 → 5KNO3 + 2MnSO4 + K2SO4 + 3H
- Ống nghiệm 2: dd xuất hiện kết tủa đen(Iot) và có khí màu nâu đỏ thoát ra trên bề mặt(do khí NO thoát ra bị Oxi
không khí oxy hóa ngay lập tức thành NO2 có màu nâu đỏ).
2KI + 2H2SO4 + KNO2 → 2KSO4 + I2 + 2NO + 2H2O
Document Outline
- Bài 8: Dung dịch đệm
- BÀI 4: Pha dung dịch chuẩn độ
- Bài 7: Chất chỉ thị màu Hằng số điện ly axit-bazơ yếu
- BÀI 6 : Phản ứng trao đổi
- Bài 5: Vận tốc phản ứng
- Bài 12: Phản Ứng Oxy hóa - Khử





