















Preview text:
HỌC VIỆN NÔNG NGHIỆP VIỆT NAM
KHOA CÔNG NGHỆ THỰC PHẨM BÁO CÁO THỰC HÀNH
MÔN AN TOÀN THỰC PHẨM Giảng viên hướng dẫn: Lê Thị Ngọc Thúy Mã học phần: CP02007 Nhóm thực hành: 04 Tổ thực hành: 04 Thời gian thực hành:
Sáng thứ 4, tiết 1-2-3-4-5 Hà Nội-2023
DANH SÁCH THÀNH VIÊN STT Họ và Tên Mã sinh viên Lớp Đánh giá K67CNTPC 1 Hoàng Minh Quân 672269 9 K67CNTPC 2 Nguyễn Đức Thăng 672278 9 K67CNTPC 3 Ngô Thị Anh Thơ 672290 9 K67QLTPA 4 Nguyễn Thị Thu 672631 9 K67CNTPC 5 Vũ Phương Trang 672313 9 K67QLTPA 6 Nguyễn Quốc Trung 672316 9 K67QLTPA 7 Nguyễn Kim Vân 672326 9 Mục Lục
Bài 1: XÁC ĐỊNH LƯỢNG NITRAT(NO3-) TRÊN RAU ................................ 1
I. Khái quát chung....................................................................................... 1
1. Tồn dư lượng Nitrat trên rau ............................................................... 1
2. Định lượng nitrat bằng so màu axit disunfophenic ............................... 1
II. Cách tiến hành ....................................................................................... 1
1. Xây dựng phương trình đường chuẩn .................................................. 1
2. Tiến hành phân tích mẫu ..................................................................... 2
2.3. Tính toán kết quả .............................................................................. 3
III. Kết luận ................................................................................................ 4
BÀI 2. XÁC ĐỊNH LƯỢNG DƯ CÁC HOÁ CHẤT SỬ DỤNG TRỎNG QUÁ
TRÌNH SẢN XUẤT, CHẾ BIẾN NÔNG SẢN THỰC PHẨM ......................... 5
I. Xác định sự có mặt của TBVTV lân hữu cơ (Wofatox) ............................. 5
1. Khái quát chung ................................................................................. 5
2. Cách tiến hành ..................................................................................... 6
3. Kết quả ................................................................................................ 7
II. Xác định sự có mặt của hàn the trong thực phẩm .................................... 7
1. Khái quát chung .................................................................................. 7
2. Cách tiến hành .................................................................................... 7
3. Kết quả ................................................................................................ 9
BÀI 3: XÁC ĐỊNH CHỈ TIÊU VI SINH VẬT TRÊN NÔNG SẢN THỰC
PHẨM ...........................................................................................................10
I. XÁC ĐỊNH CHỈ TIÊU VI SINH TRONG MỘT SỐ LOẠI THỰC
PHẨM .......................................................................................................10 1.
Chỉ tiêu Coliforms tổng số ..............................................................10 2.
Chỉ tiêu tổng số nấm men và nấm mốc ............................................11 3.
Chỉ tiêu tổng số lượng vi khuẩn hiếu khí .........................................12 II.
ĐỊNH LƯỢNG BẰNG PHƯƠNG PHÁP ĐẾM KHUẨN LẠC TRÊN
MÔI TRƯỜNG THẠCH............................................................................12 1.
Cách tiến hành ...............................................................................12
2. Công thức tính mật độ coliforms .........................................................15
III. Kết quả và tính toán ..........................................................................15
IV. Kết luận ............................................................................................17
Bài 1: XÁC ĐỊNH LƯỢNG NITRAT(NO3-) TRÊN RAU I. Khái quát chung
1. Tồn dư lượng Nitrat trên rau
- Sự tạo thành nitrat (NO -
-) là một quá trình chuyển hóa nitơ tự 3 ) và nitrit (NO2 nhiên trong cây trồng.
Nguyên nhân gây tồn dư hàm lượng nitrat trên rau:
- Lạm dụng phân hóa học: người trồng rau sử dụng lượng phân đạm hóa học quá
nhiều và bón gần thời gian thu hoạch.
- Ô nhiễm đất trồng nước tưới: đất trồng, nước tưới rau bị nhiễm các hợp chất giàu
gốc Nitrat từ bã thải sinh hoạt và công nghiệp chế biến.
2. Định lượng nitrat bằng so màu axit disunfophenic • Nguyên tắc:
Ion NO3 phản ứng với axit disunfophenic tạo thành trinitrophenol màu vàng
có cường độ màu tương quan thuận với nồng độ nitrat. C6H3(HSO3)2OH + 3HNO3
C6H2(OH)(NO2)3 + 2H2SO4 + H2O Axit disunfophenic Trinitrophenol (màu vàng)
Xác định NO3- bằng cách đo cường độ màu vàng bằng quang phổ kế tại bước
sóng 420 – 460nm (kính lọc màu xanh). Phương pháp này có độ nhạy rất cao đến 0,001ppm. II. Cách tiến hành
1. Xây dựng phương trình đường chuẩn
- Xây dựng đường chuẩn (dung dịch chuẩn KMnO 0.01mg / ml ¿ 3
- Lấy 6 cốc thủy tinh, hút vào từng cốc dung dịch chuẩn KMnO3
- Thêm vào mỗi cốc nước cất đến đủ 25ml
-Tính nồng độ : V C =V C 1 1 2
2 (C: nồng độ dung dịch) 1
- Cô cạn dung dịch trên bếp điện đến khi còn 1-2 giọt. Để cốc nguội tự nhiên
sau cô cạn, sau đó thêm 1ml axit disunfophenic láng đều bề mặt cặn. Thêm
25-30 ml nước cấ, trung hòa bằng naOH 10% đến khi chuyển màu vàng thì
dừng lại, thêm nước cất lên thể tích 50ml. Tiến hành đo màu ở máy quang
phổ (OD) tại bước sóng 420nm.
2. Tiến hành phân tích mẫu:
- Mẫu được sử dụng để phân tích là rau cải
- Rau cải sau khi rửa sạch để ráo nước, thái nhỏ khoảng 5mm rồi trộn đều.
Cân lấy 7g mẫu cho vào bình tam giác 250ml.
- Thêm 75ml nước cất vào bình chứa mẫu, đun sôi trong 1 phút rồi để nguội. 2
- Lọc lấy dịch bằng bông vào cốc thủy tinh (1) sau đó thêm nước cất lên thể tích 100ml.
- Hút 10ml vào cốc thủy tinh (2), thêm nước cất lên 100ml
- Cô cạn dung dịch đến khi còn 1 – 2 giọt nhưng không cháy mẫu rồi để nguội.
- Thêm vào cốc 1ml axit disunfophenic, thêm 25 – 30ml nước cất trung hoà
bằng NaOH 10% đến pH 7,5 – 8 đến khi chuyển màu vàng thì dừng lại. Tiếp
tục cho nước cất lên thể tích 50ml.
- Đo màu ở máy quang phổ tại bước sóng 420 nm. 3
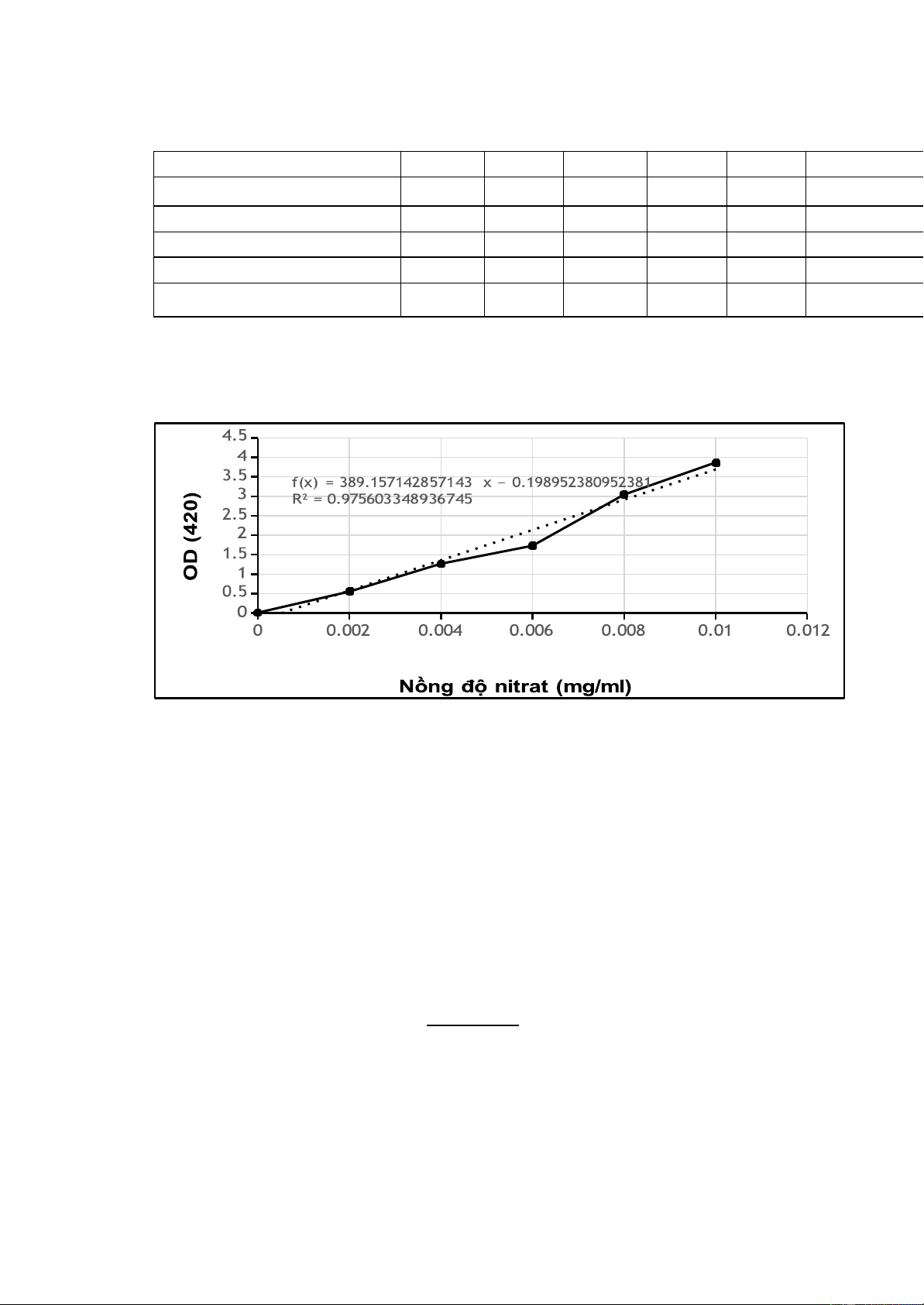
3. Tính toán kết quả Cốc 1 Cốc 2 Cốc 3 Cốc 4 Cốc 5 Cốc 6 V KNO3 0,01mg/ml (ml) 0 5 10 15 20 25 V H2O (ml) 25 20 15 10 5 0 V dd (ml) 25 25 25 25 25 25 Nồng độ (mg/ml) 0 0.002 0.004 0.006 0.008 0.01
OD (độ hấp thụ quang) 0.011 0.553 1.268 1.732 3.047 3.870
Vì R2 = 0.9756 > 0.95, do đó dùng đường chuẩn để tính kết quả. - Mẫu rau cải: m = 7(g)
- OD mẫu = 0.722 thay vào phương trình ta có X (nồng độ NO3).
+ Theo phương trình ta có: Y= 389.16X – 0.199
Với Y = 0.722 => X = 0.0024
+ Gọi A là hàm lượng NO3 - có trong mẫu, ta có: x×V ×1000 A = (mg/kg) V 1 × P Trong đó:
V : tổng thể tích triết ra từ mẫu (ml)
V1: tổng thể tích dd trích để so màu (ml) 4
P: khối lượng mẫu đem phân tích (g) x: nồng độ NO -
3 từ pt đường chuẩn bằng việc thay OD mẫu vào giá trị Y(mg/ml)
=>Áp dụng công thức ta có:
0 .0024 ×100 ×1000 A = = 3.42 (mg/kg) 10× 7 III. Kết luận
Theo WHO, hàm lượng NO -3 trung bình trong một số loại rau, không được
cao hơn 300mg/kg rau tươi (thường quy định riêng cho từng loại rau), trong
khi đó nước uống không được cao hơn 50mg/lít. Vậy so với tiêu chuẩn mẫu
rau muống trên chưa hàm lượng NO -3 rất thấp, an toàn cho người tiêu dùng. 5
BÀI 2. XÁC ĐỊNH LƯỢNG DƯ CÁC HOÁ CHẤT SỬ DỤNG
TRỎNG QUÁ TRÌNH SẢN XUẤT, CHẾ BIẾN NÔNG SẢN THỰC PHẨM
I. Xác định sự có mặt của TBVTV lân hữu cơ (Wofatox) 1. Khái quát chung
Hiện nay, thuốc BVTV ngày càng đóng vai trò quan trọng trong việc
phòng trừ sâu bệnh bảo vệ sản xuất, đảm bảo an ninh lương thực thực phẩm.
Theo tính toán của các chuyên gia, trong những thập kỷ 70, 80, 90 của thế kỷ
20, thuốc BVTV góp phần bảo vệ và tăng năng suất khoảng 20 - 30% đối với
các loại cây trồng chủ yếu như lương thực, rau, hoa quả.
Tuy nhiên, việc lạm dụng thuốc hóa học BVTV đem lại những hệ lụy xấu, tiêu cực:
- Thuốc gây độc hại cho người và gia súc, ảnh hưởng xấu đến sức khỏe
cộng đồng, làm ô nhiễm môi trường, diệt cả côn trùng và vi sinh vật có
ích, từ đó tạo điều kiện cho dịch bệnh phát triển, bùng phát mạnh hơn.
Dùng thuốc không đúng kỹ thuật, sẽ nhanh chóng tạo nên tính kháng thuốc của sâu bệnh.
- Thuốc BVTV nhiều khi còn để lại dư lượng độc hại trên nông sản làm
ngộ độc người sử dụng giảm chất lượng và khả năng cạnh tranh của nông sản trên.
- Sử dụng thuốc BVTV càng nhiều, càng rộng, càng không đúng kỹ thuật
thì những nhược điểm, hạn chế, tiêu cực của thuốc càng lớn, càng nguy
hại. Và tiêu biểu là Wofatox.
Wofatox là loại thuốc trừ sâu được sử dụng phổ biến của nước ta trước đây
nhưng đã được đưa vào danh sách thuốc BVTV bị cấm sử dụng. Wofatox còn
được gọi là Parathion Metyl có tên hóa học là O.O.Dimetyl-O- P- Nitrophenyl 6
Phosphorothionat cũng như các thuốc bảo vệ thực vật hữu cơ khác đều không
bền vững ở môi trường kiềm NaOH và sẽ thủy phân thành Natri paranitrophenolat và Natri Dimetyl-O-Thiophosphat. (Chất Natri
paranitrophenolat là một chất có màu vàng rơm, nhận dạng dễ dàng.) 2. Cách tiến hành
- Mẫu phân tích: quả dưa chuột và đỗ - Cách tiến hành:
+ Chiết xuất Wofatox bằng cồn etylic 90-100o kết hợp với việc ma sát, cọ rửa
bằng bông, xối rửa bằng bình tia dung môi.
+ Lấy mẫu trong lô có nghi vấn có thuốc bảo vệ thực vật hữu cơ. (Ví dụ tiến
hành thí nghiệm với mẫu là dưa chuột và đỗ). Đặt dưa chuột và đỗ trong lòng
phễu trên bình tam giác. Dung bình tia đựng cồn phun ướt nửa trên của mẫu.
Hình ảnh mẫu dung dịch sau kiểm tra của dưa chuột và đậu đỗ
Dùng bông lau lần lượt từng phần từ trái qua phải, từ trên xuống dưới. Xoay
mẫu 180o và tiến hành tương tự.
+ Nếu nồng độ thuốc trong dung môi nhỏ, ta phải làm đậm đặc bằng cách cô
cách thủy ở nơi thoáng gió, trong tủ hút.
+ Lấy 3 ml dung dịch mẫu vừa rửa của dưa chuột, đỗ vào ống nghiệm. Thêm
3 ml NaOH 1N, lắc đều dung dịch, quan sát và đánh giá.
- Đánh giá kết quả:
+ Nếu thấy dung dịch có màu vàng rơm xuất hiện: sản phẩm có Wofatox,
thuốc bảo vệ thực vật lân hữu cơ.
+ Nếu dung dịch không có màu vàng rơm xuất hiện: sản phẩm không có dư
lượng thuốc Wofatox thuốc bảo vệ thực vật lân hữu cơ. 7 3. Kết quả
Dung dịch có màu vàng rơm xuất hiện.
Dưa chuột có dư lượng thuốc Wofatox, thuốc bảo vệ thực vật lân hữu cơ.
và đỗ không có dư lượng thuốc Wofatox, thuốc bảo vệ thực vật lân hữu cơ.
II. Xác định sự có mặt của hàn the trong thực phẩm 1. Khái quát chung
Hàn the là một hợp chất hoá học hay được gọi là Borax một loại muối rắn
màu trắng đục, không mùi, không vị, dễ tan trong nước, có khả năng diệt khuẩn và nấm.
Hàn the có phản ứng kiềm với phenolphtalein cho dung dịch màu hồng. Nếu
cho dung dịch này tác dụng với dung dịch Glyxerin trung tính, dung dịch sẽ
chuyển thành axit, sẽ mất màu hồng, trở thành không màu(phản ứng axit với
phenoiphtalein do tạo thành axit glyxero boric có tính axit) 2. Cách tiến hành
Mẫu thí nghiệm: bánh phở, bún 8 Cách tiến hành:
+ Lấy 7g sản phẩm, thái nhỏ 3-5mm, ngâm trong 25ml nước cất đã đun sôi.
+ Sau 5 phút gạn lấy nước.
+ Lọc lấy 5ml nước trong cho vào ống nghiệm.
+ Nhỏ vào ống nghiệm 2-3 giọt phenolphtalin 1% rồi lắc đều. Đánh giá kết quả:
- Nếu có màu hồng xuất hiện nhỏ tiếp 2-3 giọt glyxerin trung tính,
màu hồng sẽ mất đi thành không màu => sản phẩm có hàn the. -
Nếu không có màu hồng xuất hiện => sản phẩm không có hàn the. 9 3. Kết quả
Hình ảnh mẫu nước ngâm phở đã nhỏ phenolphtalein 1%
⇨ Sau khi nhỏ phenolphtalin, dung dịch không xuất hiện màu hồng nên
sản phẩm bún không chứa hàn the. 10
BÀI 3: XÁC ĐỊNH CHỈ TIÊU VI SINH VẬT TRÊN NÔNG SẢN THỰC PHẨM I.
XÁC ĐỊNH CHỈ TIÊU VI SINH TRONG MỘT SỐ LOẠI THỰC PHẨM
1. Chỉ tiêu Coliforms tổng số
- Coliforms là trực khuẩn Gram (-) không sinh bào tử, hiếu khí hoặc kỵ
khí tuỳ tiện, có khả năng lên men lactose sinh acid (sinh hơi) ở 37 ℃ trong 24 – 48h.
- Nhóm coliforms hiện diện rộng rãi trong tự nhiên, trong ruột người,
động vật. Coliforms được xem là nhóm vi sinh vật chỉ thị; số lượng
hiện diện của chúng trong thực phẩm, nước hay các mẫu môi trường
được dùng để chỉ thị khả năng hiện diện của các vi sinh vật gây bệnh
khác. Nhiều nghiên cứu cho thấy rằng khi số coliforms của thực phẩm
cao thì khả năng hiện diện của các vi sinh vật gây bệnh khác cũng cao.
- Nhóm Coliforms gồm 4 giống là: Escherichia, Citrobacter, Klebsiella, Enterobacter.
Định lượng Coliforms bằng phương pháp đếm khuẩn lạc trên môi trường VRBL Nguyên tắc:
- Quá trình lên men lactose dẫn đến kết quả acid hoá môi trường, được
thể hiện bằng màu đỏ của chỉ thị pH (màu đỏ trung tính) và kết tủa
muối mật xung quanh các khuẩn lạc.
- Sự hiện diện đồng thời của muối tinh thể tím và muối mật ức chế vi khuẩn Gram(+).
- Mẫu được đồng nhất được cấy một lượng thích hợp trên môi trường
thạch chọn lọc chứa lactose. Đếm số khuẩn lạc lên men và sinh acid
sau khi nuôi ở 37 ℃ trong 48h. 11
- Trên môi trường này, khuẩn lạc coliforms có màu đỏ đến màu đỏ đậm,
đường kính > 0.05mm, xung quanh khuẩn lạc có vùng tủa của muối mật.
2. Chỉ tiêu tổng số nấm men và nấm mốc 2.1. Nấm men
- Vi sinh vật hiếu khí ưa ẩm, ở nhiệt độ 25 ℃ dưới các điều kiện thích
hợp phát triển thành các khuẩn lạc tròn, bóng hoặc mờ trên về mặt môi
trường thạch nấm, thường có mép viền đều và bề mặt lồi ít hoặc lồi nhiều. 2.2. Nấm mốc
- Vi sinh vật dạng sợi nhỏ hiếu khí ưa ấm, ở nhiệt độ 25 ℃ dưới các điều
kiện quy định trong tiêu chuẩn này, phát triển thành các mầm/chồi mọc
lan như lông tơ hoặc dẹt hoặc thành các khuẩn lạc trên bề mặt môi
trường thạch nấm, thường có màu trái cây hoặc có cấu trúc mang bào tử.
- Trong thực phẩm nếu có nấm men, nấm mốc phát triển có thể làm thay
đổi màu của thực phẩm, phát sinh mùi, vị lạ làm hư hỏng hay thay đổi
cấu trúc của thực phẩm, một số tạo ra độc tố gây hư hỏng thực phẩm.
- Môi trường nuôi cấy nấm men, nấm mốc là YGC Agar (Yeast Glucose
Chloramphenicol Agar) được khuyến cáo bởi APHA và Liên đoàn sữa
quốc tế. Yeast Glucose Chloramphenicol Agar là một môi trường dinh
dưỡng mà ức chế sự sinh trưởng của các sinh vật không phải nấm men
và nấm mốc do sự có mặt của chloramphenicol.
- Chiết xuất nấm men cung cấp những chất dinh dưỡng cơ bản cần thiết
cho sự sinh trưởng. Glucose là nguồn cung cấp nguyên tố carbon cho
sinh vật phát triển. Chloramphenicol ức chế sự sinh trưởng của vi
khuẩn. Sau khi ủ ở 25 ℃, khuẩn lạc được đếm là khuẩn lạc của nấm
men được phân biệt với nấm mốc bởi hình thái của chúng.
3. Chỉ tiêu tổng số lượng vi khuẩn hiếu khí 12
- Vi khuẩn hiếu khí là vi khuẩn tăng trưởng và hình thành khuẩn lạc
trong điều kiện có sự hiện diện của oxy phân tử.
- Tổng số vi khuẩn hiếu khí hiện diện trong mẫu phản ánh vệ sinh chế
biến, độ tươi mới hay nguy cơ gây hư hỏng của thực phẩm.
- Tổng số các nhóm vi khuẩn này trong thực phẩm có thể xác định bằng
phương pháp nuôi cấy trải lên bề mặt thạch hoặc bằng phương pháp tạo
hộp đổ. Thông qua số lượng khuẩn lạc đếm được trên các đĩa petri cho
phép xác định được lượng vi sinh vật còn có khả năng sinh trưởng
trong môi trường mẫu ban đầu.
- Plate count agar (PCA) là môi trường được sử dụng cho xác định tổng
số lượng vi khuẩn hiếu khí sống trong mẫu.
- Đĩa được ủ ở 20 hoặc 30 ℃ trong 2 ngày.
- Sau khi ủ, tiến hành đếm số lượng khuẩn lạc mọc trên đĩa, con số này
nằm trong khoảng 25 – 250 là thích hợp nhất để đưa ra kết quả chính xác. II.
ĐỊNH LƯỢNG BẰNG PHƯƠNG PHÁP ĐẾM KHUẨN LẠC
TRÊN MÔI TRƯỜNG THẠCH 1. Cách tiến hành
- Bước 1: Đồng nhất mẫu: tạo sự đồng đều về mật độ Coliforms ở tất cả các điểm trên mẫu.
+ Cắt nhỏ, trộn đều: dao, thớt.
+ Giã nhỏ, trộn đều: chày, cối sứ.
+ Xay, nghiền, trộn đều: máy xay, máy nghiền.
- Bước 2: Pha loãng mẫu (trà chanh Cozy hòa tan): làm giảm nồng độ
coliforms trong mẫu, tạo điều kiện cho quá trình đếm.
+ Đối với mẫu chất lỏng: dùng pipet hút 1ml mẫu cho vào ống nghiệm
chứa 9ml dung dịch pha loãng, khi đó ta sẽ được nồng độ pha loãng là − −
10 1. Tiếp tục từ ống nghiệm 10 1 hút tiếp 1ml và cho vào ống nghiệm 13
chứa 9ml dung dịch pha loãng tạo độ pha loãng − 10 2. Tiếp tục như vậy đến nồng độ − 10 7.
+ Đối với mẫu rắn: cân chính xác 1g mẫu, sau đó cho vào 9ml dung
dịch pha loãng tạo nồng độ pha loãng −
10 1. Và tiếp tục pha loãng đến nồng độ −
10 7 tiến hành tương tự như mẫu nước.
3 ống nghiệm với nồng độ pha loãng giảm dần
- Bước 3: Chuẩn bị môi trường:
+ Cân hoá chất, môi trường với lượng thích hợp.
+ Hoà tan hoá chất bằng khuấy từ.
+ Đo và điều chỉnh pH môi trường.
+ Cho môi trường vào hấp khử trùng 121 ℃, 15 phút.
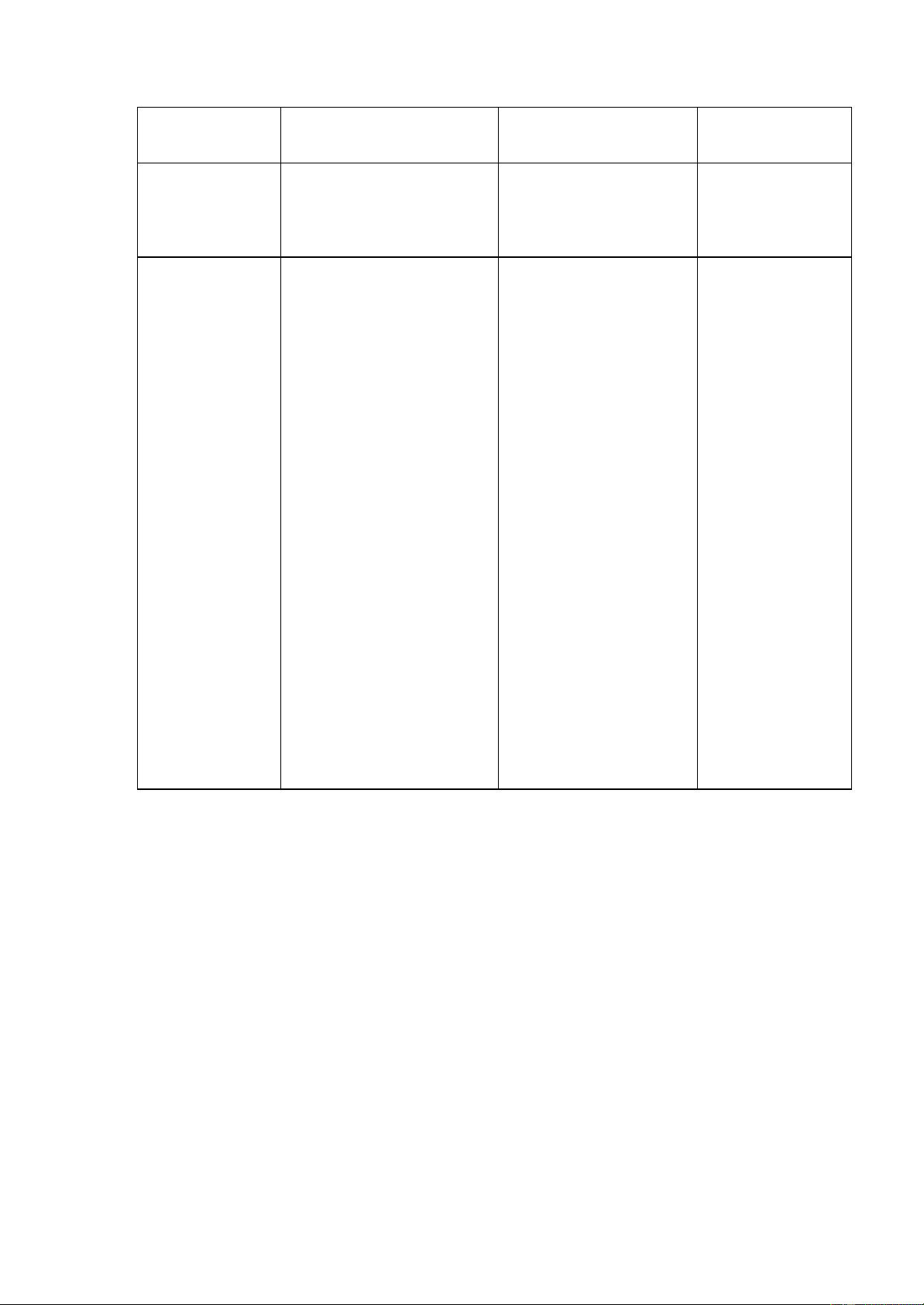
➢ Chuẩn bị môi trường
Chỉ tiêu VSV Tổng số VSV hiếu khí Tổng số nấm men, Tổng Coliform 14 nấm mốc Môi trường PCA YGC VRBL nuôi cấy Peptone: 7 Cao nấm men: 3 Cao nấm men: 5 Lactose: 10 Peptone: 5 Glucose: 20 NaCl: 5 Thành phần Cao nấm men: 2 Chloromphenicol: môi trường Đỏ trung tính: Glucose: 1 0,1 0,03 (g/l) Agar: 20 Agar: 20 Tím tinh thể: 0,002 Agar: 20 Muối mật bò 1,5 Môi trường PCA, VRBL, YGC - Bước 4: Cấy mẫu
+ Chuyển 1ml mẫu trà chanh Cozy đã pha loãng vào đĩa petri.
+ Bổ sung vào 18 đĩa petri môi trường thạch VRBL, PCA, YGC ở 45 ℃ .
+ Xoay đĩa – để mẫu và môi trường hoà đều vào nhau.
+ Chờ cho môi trường trong đĩa đông đặc, lật ngược đĩa và ủ ở 37 ℃ trong 48h.
+ Đếm số khuẩn lạc có đặc điểm của khuẩn lạc coliforms. 15
2. Công thức tính mật độ coliforms Công thức tính: A= N ×R
( n f + n f +n f ) ×V 1 1 2 2 3 3 Trong đó:
- N: Tổng số khuẩn lạc đếm được
- ni: số đĩa có khuẩn lạc đếm được chọn tại mỗi độ pha loãng
- V: dung dịch mẫu(ml) vào mỗi đĩa (1ml)
- fi: độ pha loãng có số khuẩn lạc được chọn tại các đĩa đếm
- R: tỉ lệ khẳng định • RVSV hiếu khí = 1
• Rnấm men, nấm mốc =1 • Rcoliforms = 0,9
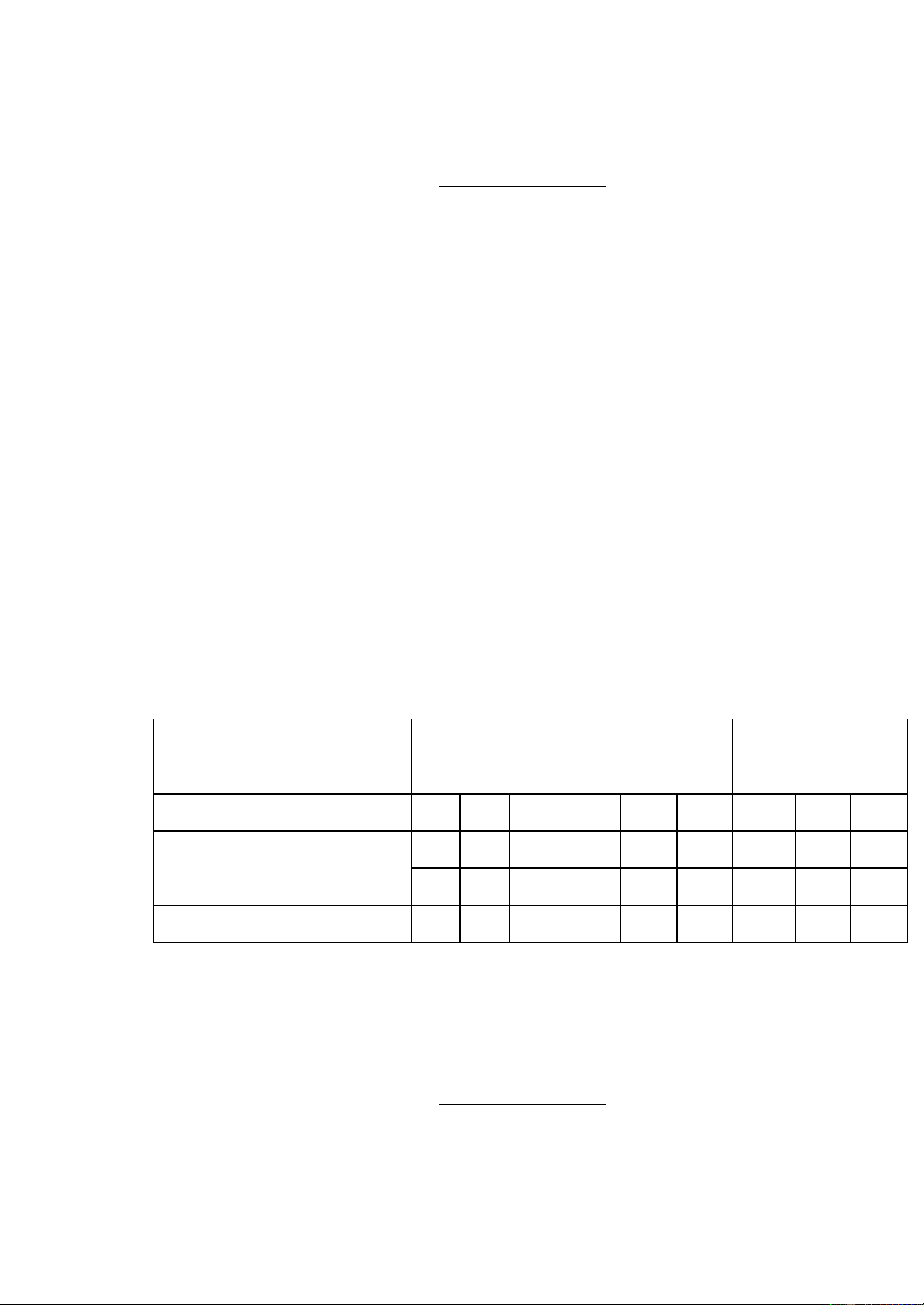
III. Kết quả và tính toán
Tiến hành thí nghiệm trên mẫu trà chanh Cozy Môi trường Môi trường Môi trườngYGC Môi trường PCA VRBL Nồng độ 10-5 10-6 10-7 10-5 10-6 10-7 10-5 10-6 10-7 15 10 28 13 14 20 0 0 0 Số lượng 54 106 20 31 130 40 26 120 37 Tổng số 69 116 48 44 144 60 26 120 37
Tính toán kết quả ADCT: A= N ×R
( n f + n f +n f ) ×V 1 1 2 2 3 3 16
- Môi trường thạch VRBL, mật độ coliforms là:
Với N =380, n1= 2, V=1, f1=10-5 , f1=10-6 , f1=10-7 , R= 0.9, ta có: A= 8 9+226+65 .0,9=18000 ( CFU ) − − − 2.(10 5+10 6+10 7) .1 ml
- Môi trường thạch YGC, mật độ nấm men nấm mốc là:
Với N= 908, n1=n2=n3=2, f1=10-2, f2=10-3, f3=10-4, R=1, ta có: A= 181+347+380 .1=40900,9( CFU ) − − − 2.(10 5+10 6+10 7) .1 ml
- Môi trường thạch PCA, mật độ vi sinh vật hiếu khí là:
Với N= 132, n1=n2=n3=2, f1=10-2, f2=10-3, f3=10-4, R=1, ta có: A= 16+37+79 .1=5945,9( CFU ) − − − 2.(10 5+10 6+10 7).1 ml IV. Kết luận
Sau 48h nuôi cấy mẫu trà chanh Cozy trong 3 môi trường và 3 nồng độ khác
nhau, thì ta quan sát được:
+ Mật độ của các khuẩn lạc và nấm men, nấm mốc phân bố không
giống nhau và không đồng đều trên các đĩa petri
+ Do số lượng vi khuẩn phát triển nhanh và dày đặc cộng với sự có mặt
của các vi sinh vật xâm nhiễm từ môi trường bên ngoài vào trong quá trình cấy. 17


