














Preview text:
Trường Đại học Khoa học Tự nhiên – Đại học Quốc gia TP.HCM
Khoa Sinh học – Công nghệ sinh học
BÁO CÁO THỰC TẬP VI SINH
(Năm học 2022 – 2023) Nhóm 16 Nguyễn Anh Đào 21180269
Nguyễn Trần Tiến Đạt 21180271 Nguyễn Thanh Dương 21180275
Thành phố Hồ Chí Minh Ngày 09/03/2023 Mục lục
Phần chuẩn bị môi trường và các thao tác. . . . . . . . . . . . . . . . . . . . . . . 2
Chủ đề 1: Phương pháp phát hiện vi sinh vật. . . . . . . . . . . . . . . . . . . . . . . 4
Chủ đề 2: Quan sát hình thái vi sinh vật. . . . . . . . . . . . . . . . . . . . . . . . . . . 11
Chủ đề 3: Phương pháp định lượng vi sinh vật. . . . . . . . . . . . . . . . . . . . . 12
Chủ đề 4: Kiểm sát tăng trưởng vi sinh vật. . . . . . . . . . . . . . . . . . . . . . . . 18
Chủ đề 5: Biến dưỡng ở vi sinh vật. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
Bảng phân công nhiệm vụ Nguyễn Anh Đào
Chủ đề 3, 4, tổng hợp, chỉnh sửa báo cáo. Nguyễn Trần Tiến Đạt Chủ đề 1, 2 Nguyễn Thanh Dương Chủ đề 5 1
CHUẨN BỊ MÔI TRƯỜNG, THAO TÁC VÔ TRÙNG, BẢO QUẢN GIỐNG VI SINH VẬT I/ Môi trường: 1. Định nghĩa:
- Môi trường dinh dưỡng là hỗn hợp thành phần hóa học để cung cấp C, H, O, N,…để cho vi sinh vật phát triển.
- Đường cung cấp C cho vi sinh vật để biến dưỡng tạo các thành phần quan trọng trong tế
bào như nucleotide, acid amin và ATP (năng lượng cho tế bào duy trì hoạt động sống)
- Các muối có gốc NH +4, NH3 cung cấp N cho vi sinh vật
- Nguồn cung cấp O đến từ không khí. 2. Phân loại:
a) Dựa vào thành phần:
- Môi trường tự nhiên: dùng các sản phẩm có trong tự nhiên như sữa, huyết thanh, khoai
tây, cám, đường,…Thành phần hóa học của những sản phẩm này thường phức tạp và không ổn định.
- Môi trường tổng hợp: dùng các chất có thành phần hóa học xác định để pha chế nên môi trường.
- Môi trường bán tổng hợp: kết hợp việc dùng các sản phẩm tự nhiên và các hóa chất tổng
hợp (cao nấm men, peptone, tryptone,…)
b) Dựa vào tính chất vật lý:
- Môi trường lỏng hay môi trường dịch thể.
- Môi trường rắn hay môi trường chứa 1,5 - 2% agar hoặc 10 – 20% gelatin.
- Môi trường rắn mềm là môi trường có chứa 0,35 – 0,7% agar.
c) Dựa vào công dụng:
- Môi trường chọn lọc: là môi trường đảm bảo sự phát triển ưu thế của một loại hoặc một
nhóm vi sinh vật xác định nào đó (VD: môi trường dùng để phân lập hoặc nuôi cấy vi sinh
vật cố định đạm, vi khuẩn nitrat hóa,…)
- Môi trường phân lập: là môi trường làm một loại hoặc một nhóm vi sinh vật xác định nào đó có biểu hiện khác.
- Môi trường tăng sinh: là môi trường mà vi sinh vật nào cũng sống được và tăng trưởng bình thường.
3. Nguyên tắc khi chuẩn bị môi trường:
- Xác định mục đích và loại vi sinh vật sử dụng để sử dụng môi trường phù hợp
- Biết rõ các nhu cầu của vi sinh vật về các chất dinh dưỡng và đặc điểm trao đổi chất chủ yếu của chúng.
- pH, yếu tố hữu cơ, vô cơ, thế oxi hóa khử, nồng độ các chất dinh dưỡng đưa vào phải
thích hợp, không chứa các yếu tố độc hại và hoàn toàn vô trùng. 2 4. Các môi trường: LB Vi khuẩn (E.coli, PGA Hansen Gause Bacillus subtilis, Nấm mốc Nấm men Xạ khuẩn Lactobacillus) -Cao nấm men 5g/L - Khoai tây, Glucose, -Glucose (50g/L) - Gause 1X pha sẵn - Tryptone 30g/L Agar -Peptone (10g/L) (NaCl, KNO3, FeSO4) - Agar 1,5% (15g/L) - 1,5g Agar / 300ml -KH2PO4 (3g/L) - Tinh bột 2% 20g/L - MgSO4 (3g/L) - Agar 2% 20g/L
II/ Phương pháp vô trùng:
1. Các phương pháp vô trùng:
- Tia UV, gama vô trùng vật chứa.
- Nhiệt độ và áp suất. (121 độ C, 1atm, 20 phút đến 30 phút)
- Màng lọc 0,2μm đến 0,4μm / lỗ.
2. Phương pháp vô trùng sử dụng trong các bài thực tập vi sinh:
- Bước 1: Sắp xếp, kiểm tra lại dụng cụ cần thiết trước khi bước vào thí nghiệm.
- Bước 2: Vệ sinh tay, dụng cụ, khu vực thí nghiệm bằng cồn 70 độ.
- Bước 3: Bật ngọn lửa đèn cồn và lưu ý chỉ thao tác thí nghiệm trong phạm vi bán kính
20cm so với ngọn lửa đèn cồn.
- Bước 4: Bắt đầu thí nghiệm.
- Bước 5: Kết thúc thí nghiệm thì tắt đèn cồn và ghi chú (đối với đĩa petri thường để úp
ngược xuống, trừ bài kiểm soát tăng trưởng vi sinh vật)
- Bước 6: Vệ sinh tay, dụng cụ, khu vực thí nghiệm lại bằng cồn 70 độ. 3
CHỦ ĐỀ 1: PHÁT HIỆN VI SINH VẬT I/ Nguyên tắc:
- Có nhiều phương pháp để phảt hiện các chủng vi sinh vật trong tự nhiên. Về nguyên tắc có
thể chia thành ba nhóm là các phương pháp dựa trên kiểu hình, các phương pháp dựa trên
tính miễn dịch và các phương pháp dựa trên DNA.
- Vi sinh vật sẽ phát triển và tăng sinh trong một môi trường phù hợp, vì thế sau một khoảng
thời gian nhất định nếu sống trong môi trường phù hợp thì vi sinh vật sẽ hình thành sinh
khối làm đục môi trường (môi trường lỏng) hoặc tạo 1 lớp sinh khối trên bề mặt nuôi cấy (môi trường rắn).
- Phát hiện vi sinh vật bằng môi trường chọn lọc: Môi trường chọn lọc là môi trường chứa
những chất thiết yếu đối với sự sinh trưởng của chủng vi sinh vật mục tiêu. Do đó có thể
sử dụng các loại môi trường có thành phần phù hợp với từng loại vi sinh vật để phân lập
hoặc phát hiện chủng cần tìm trên mẫu thử nghiệm:
o Môi trường LB : Vi khuẩn như E. coli, Bacilus subsilit, Lacto Bacilus,…
o Môi trường PGA : Nấm mốc
o Môi trường Hansen : Nấm men
o Môi trường Gauss : Xạ khuẩn
II/ Kỹ thuật tạo khuẩn lạc đơn:
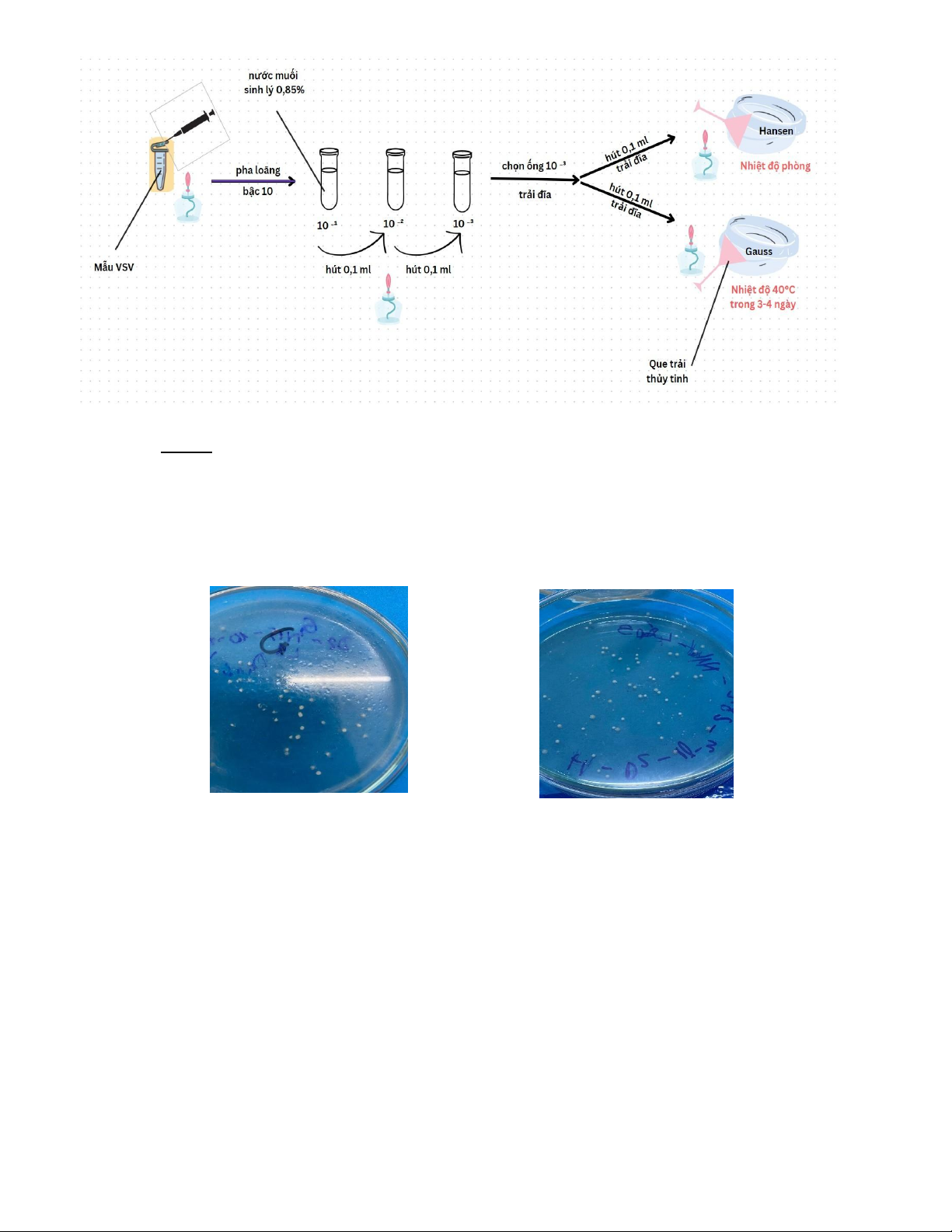
1. Phương pháp pha loãng và trải đĩa: a) Dụng cụ:
- Ống nghiệm chứa mẫu vi sinh vật.
- Ống nghiệm chứa nước muối sinh lý.
- Pipetman 100 – 1000μL, pipetman 10 - 100μL và các đầu tip phù hợp.
- Đèn cồn, bật lửa, ly đựng rác, ly chứa cồn để đựng que trải, bút lông, bông gòn.
- Đĩa petri môi trường Hansen và Gause. - Que trải b) Quy trình
- Vô trùng khu vực làm việc, sắp xếp dụng cụ thuận tay, khử trùng tay.
- Đảm bảo các thao tác thực hiện trong điều kiện vô trùng trước ngọn lửa đèn cồn. -
Dùng micropipette hút 1mL mẫu VSV cho vào ống nghiệm chứa 9mL nước muối sinh lý
và tiếp tục pha loãng bậc 10-1 đến 10-2 , 10-3 .
- Dùng micropipette hút 0,1mL ống nghiệm có độ pha loãng 10-3 cho vào mỗi đĩa môi
trường Hansen và Gause ( mỗi loại môi trường 3 đĩa petri).
- Tiếp tục dùng que thủy tinh đã khử trùng thực hiện phương pháp trải dung dịch chứa vi
sinh vật trên các môi trường.
- Ghi chú lên đĩa petri, dọn dẹp dụng cụ, khử trùng tay và khu vực làm việc .
- Ủ đĩa đã được trải ở các nhiệt độ và thời gian thích hợp.
Sơ đồ hóa quy trình thực hiện: 4 Lưu ý:
- Luôn thực hiện thao tác trong bán kính 20cm xung quanh đèn cồn để đảm bảo vô trùng.
- Khi thực hiện hút các mẫu không được để không khí lọt vào.
- Đốt cồn trên que trải 2 lần và để nguội rồi mới bắt đầu trải.
- Trải nhẹ, đều tay để tránh làm rách môi trường và trải đến khi mẫu khô. c) Kết quả:
Môi trường Gause
Môi trường Hansen -
Ở trên 3 đĩa môi trường Gauss và 3 đĩa môi trường Hansen đều có khuẩn lạc xuất hiện và phát
triển trên bề mặt thạch
- Ở đĩa môi trường Gauss : Xuất hiện khuẩn lạc có hình thái nhỏ, hơi ngả vàng, khô và nằm đều trên
bề mặt môi trường thạch => nấm men
- Ở đĩa môi trường Hansen : Xuất hiện khuẩn lạc có hình thái nhỏ, sợi khuẩn ty nhỏ, trắng đục mọc
trên đĩa thạch => xạ khuẩn
- Khuẩn lạc trên đĩa bị ít vì ở độ pha loãng 10-3 số lượng VSV có trong mẫu bị giảm bớt nên số
khuẩn lạc cũng bị ít đi theo. Độ pha loãng càng thấp tỉ lệ thuận với mật độ khuẩn lạc có trên đĩa. 2. Phương pháp ria: a) Dụng cụ:
- Ống nghiệm chứa vi sinh vật.
- Đèn cồn, bật lửa, bút lông. 5
- Ly đựng rác, bình xịt cồn 70 độ, bông gòn. - Que cấy.
- Đĩa petri môi trường LB. b) Quy trình:
- Sắp xếp dụng cụ, kiểm tra dụng cụ cần thiết cho thí nghiệm.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Bật đèn cồn, hơ que cấy cho nóng đỏ, sau đó để nguội.
- Đưa que cấy vào để lấy chủng.
- Cho que cấy vào ria trên mặt dĩa theo quy tắc zig zắc như sơ đồ minh họa bên dưới.
- Hơ nóng lại que cấy rồi tắt đèn cồn.
- Vệ sinh lại khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ. -
Ghi chú sau đó đem ủ trong điều kiện thích hợp rồi ghi nhận kết quả.
Sơ đồ hóa quy trình: Lưu ý:
- Hơ ống chủng sau khi mở bông và trước khi đóng bông lại, hơ đĩa petri trước thao tác và sau khi thao tác xong.
- Phải để đĩa petri khi mở hướng về phía ngọn lửa đèn cồn.
- Thao tác trong vòng bán kính 20cm đèn cồn để đảm bảo vô trùng. c) Kết quả:
- Ta quan sát trên đĩa môi trường LB có xuất hiện khuẩn lạc nhỏ tròn, bóng, ẩm, trong chính là E. coli. 6
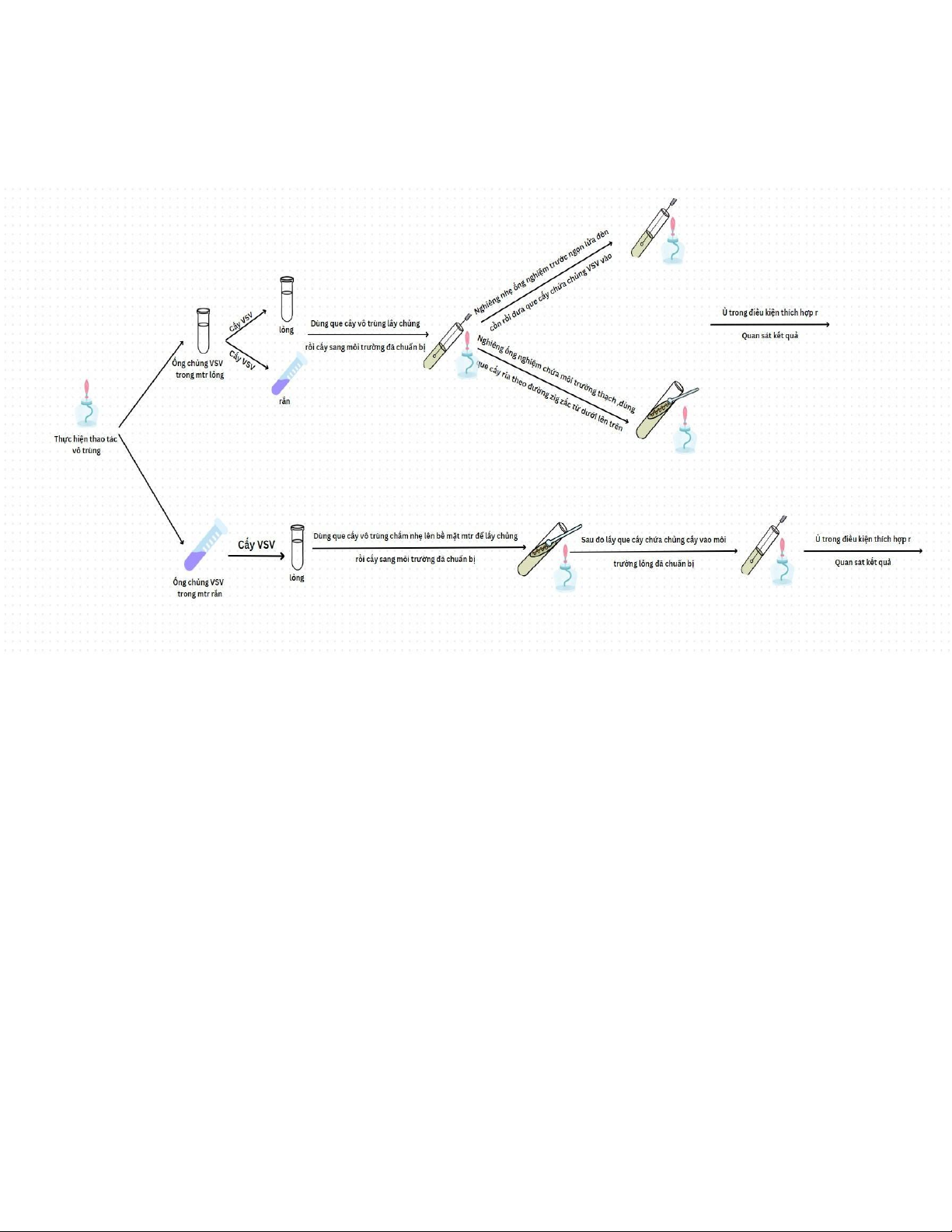
III/ Kỹ thuật cấy vi sinh vật:
1. Từ môi trường lỏng sang lỏng: a) Dụng cụ: - Ống chủng vi sinh vật. - Ống môi trường lỏng. - Que cấy. -
Đèn cồn, bật lửa, bình xịt cồn 70 độ, bông gòn, ly đựng rác, bút lông. b) Quy trình:
- Sắp xếp dụng cụ, kiểm tra dụng cụ cần thiết cho thí nghiệm.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Bật đèn cồn, hơ que cấy cho nóng đỏ, sau đó để nguội.
- Đưa que cấy vào ống chủng vi sinh vật để lấy chủng.
- Đưa que cấy đã có chủng vào ống môi trường lỏng và khua nhẹ que cấy trong dung dịch
của ống môi trường lỏng.
- Tắt đèn cồn, kết thúc thí nghiệm.
- Vệ sinh lại khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Ghi chú và đem ủ trong điều kiện thích hợp rồi ghi nhận kết quả. Lưu ý:
- Thao tác trong vòng bán kính 20cm đèn cồn để đảm bảo vô trùng.
- Lắc đều ống chủng vi sinh vật trước khi lấy.
- Hơ ống nghiệm chủng và môi trường lỏng sau khi lấy bông ra và trước khi đóng bông lại. c) Kết quả:
- Sau thời gian ủ thì ống môi trường được cấy đã xuất hiện sinh khối (ống bị đục). d) Nhận xét:
- Phương pháp cấy từ lỏng sang lỏng này dùng để duy trì sự phát triển, giữ giống của vi sinh
vật. Ta phát hiện vi sinh vật nhờ sự tăng sinh của nó trong môi trường lỏng được cấy khi
nó làm đục môi trường. 7
2. Từ môi trường lỏng sang rắn: a) Dụng cụ: - Ống chủng vi sinh vật. -
Ống môi trường rắn LB + Agar (ống thạch nghiêng). - Que cấy. -
Đèn cồn, bật lửa, bình xịt cồn 70 độ, bông gòn, ly đựng rác, bút lông. b) Quy trình:
- Sắp xếp dụng cụ, kiểm tra dụng cụ cần thiết cho thí nghiệm.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Bật đèn cồn, hơ que cấy cho nóng đỏ, sau đó để nguội.
- Đưa que cấy vào ống chủng vi sinh vật để lấy chủng.
- Đưa que cấy đã có chủng vào ống môi trường rắn và ria zic zắc trên ống thạch nghiêng.
- Tắt đèn cồn, kết thúc thí nghiệm.
- Vệ sinh lại khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Ghi chú và đem ủ trong điều kiện thích hợp rồi ghi nhận kết quả. Lưu ý:
- Thao tác trong vòng bán kính 20cm đèn cồn để đảm bảo vô trùng.
- Lắc đều ống chủng vi sinh vật trước khi lấy.
- Hơ ống nghiệm chủng và môi trường lỏng sau khi lấy bông ra và trước khi đóng bông lại.
- Phải hơ que cấy từ đầu cấy đến đụng cán để khi đưa sâu vào ria ống thạch nghiêng vẫn đảm bảo vô trùng. c) Kết quả:
- Sau thời gian ủ thì bề mặt ống môi trường thạch nghiêng đã có sinh khối. d) Nhận xét:
- Phương pháp cấy từ môi trường lỏng sang rắn dùng để nghiên cứu về sinh hóa dựa trên
các phản ứng của sinh khôi trên bề mặt ống thạch nghiêng. Ta phát hiện vi sinh vật nhờ sự
tăng sinh của nó khiến tạo một lớp bề mặt trắng đục phủ lên ống thạch nghiêng. 8
3. Từ môi trường rắn sang lỏng: a) Dụng cụ: - Ống môi trường lỏng. -
Ống chủng vi sinh vật môi trường rắn thạch nghiêng. - Que cấy. -
Đèn cồn, bật lửa, bình xịt cồn 70 độ, bông gòn, ly đựng rác, bút lông. b) Quy trình:
- Sắp xếp dụng cụ, kiểm tra dụng cụ cần thiết cho thí nghiệm.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Bật đèn cồn, hơ que cấy cho nóng đỏ, sau đó để nguội.
- Đưa que cấy vào ống chủng thạch nghiêng để lấy chủng.
- Đưa que cấy đã có chủng vào ống môi trường lỏng và khua nhẹ que cấy trong dung dịch của ống.
- Tắt đèn cồn, kết thúc thí nghiệm.
- Vệ sinh lại khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ.
- Ghi chú và đem ủ trong điều kiện thích hợp rồi ghi nhận kết quả. Lưu ý:
- Thao tác trong vòng bán kính 20cm đèn cồn để đảm bảo vô trùng.
- Lắc đều ống chủng vi sinh vật trước khi lấy.
- Hơ ống nghiệm chủng và môi trường lỏng sau khi lấy bông ra và trước khi đóng bông lại.
- Phải hơ que cấy từ đầu cấy đến đụng cán để khi đưa sâu vào lấy chủng ở ống thạch
nghiêng vẫn đảm bảo vô trùng. c) Kết quả:
- Sau thời gian ủ thì ống môi trường lỏng được cấy đã xuất hiện sinh khối (ống bị đục) d) Nhận xét:
- Phương pháp cấy từ rắn sang lỏng dùng để duy trì sự phát triển, giữ giống của vi sinh vật,
ta phát hiện vi sinh vật nhờ sự tăng sinh trong ống môi trường được cấy khiến ống đục. 9
4. Sơ đồ hóa các quy trình kỹ thuật cấy vi sinh vật: 10
CHỦ ĐỀ 2: QUAN SÁT VI SINH VẬT TRÊN KÍNH HIỂN VI VÀ
KHUẨN LẠC TRÊN ĐĨA PETRI I/ Nguyên tắc:
- Tùy vào kích thước, vi sinh vật có thể được quan sát bằng mắt thường (quan sát thô) hoặc cần
đến những thiết bị như kính lúp, kính hiển vi,…
- Ở đây ta sẽ quan sát vi sinh vật ở 2 mức độ:
+ Quan sát thô: dựa trên khuẩn lạc (mỗi tế bào vi sinh vật phát triển thành một tập hợp trên đĩa
petri gọi là khuẩn lạc, ta có thể dùng phương pháp trải đĩa hay ria với môi trường thích hợp cho
vi sinh vật), từng loại vi sinh vật khác nhau sẽ hình thành dạng khuẩn lạc khác nhau và ta có thể
quan sát bằng mắt thường.
+ Quan sát bằng kính hiển vi: Kính hiển vi là công cụ quan trọng trong nghiên cứu hình thái và
nhận diện vi sinh vật. Kính hiển vi được thiết kế để có tính năng khác nhau nhằm đáp ứng yêu
cầu cho phép phóng đại và quan sát rõ, chân thật các đối tượng vi sinh vật, nội bào quan khác nhau.
II/ Quan sát vi sinh vật trong kính hiển vi:
Vi khuẩn E. coli Nấm men Xạ khuẩn Nấm mốc Chấm tròn nhỏ li Tròn lớn hơn E. Sợi dài, khuẩn ti Có rõ hình dạng ti, đơn lẻ dày
coli, có hiện tượng nhiều, dày đặc như túi bào tử, cuốn đặc, trong nảy chồi, trong rễ cây bào tử
III/ Quan sát khuẩn lạc trên đĩa petri:
Vi khuẩn E. coli Nấm men Xạ khuẩn Nấm mốc Khuẩn Nhỏ, tròn, bóng Tròn, to hơn E. Trắng đục, ngà vàng, ti dày đặc, nhìn như ẩm, màu trong coli, trắng đục tâm lõm (có chấm đen sợi bông (trắng, hơi ngà sữa, khô, tâm nhô hoặc trắng), răng cưa vàng, xanh) 11
CHỦ ĐỀ 3: PHƯƠNG PHÁP ĐỊNH LƯỢNG VI SINH VẬT
I/ Xác định tế bào bằng phương pháp đếm khuẩn lạc: 1. Nguyên tắc:
- Phương pháp đếm khuẩn lạc cho phép định lượng các tế bào vi sinh vật sống hiện diện
trong mẫu. Phương pháp này có đặc điểm là cho phép định lượng chọn lọc vi sinh vật tùy
môi trường và điều kiện nuôi cấy. 2. Thí nghiệm:
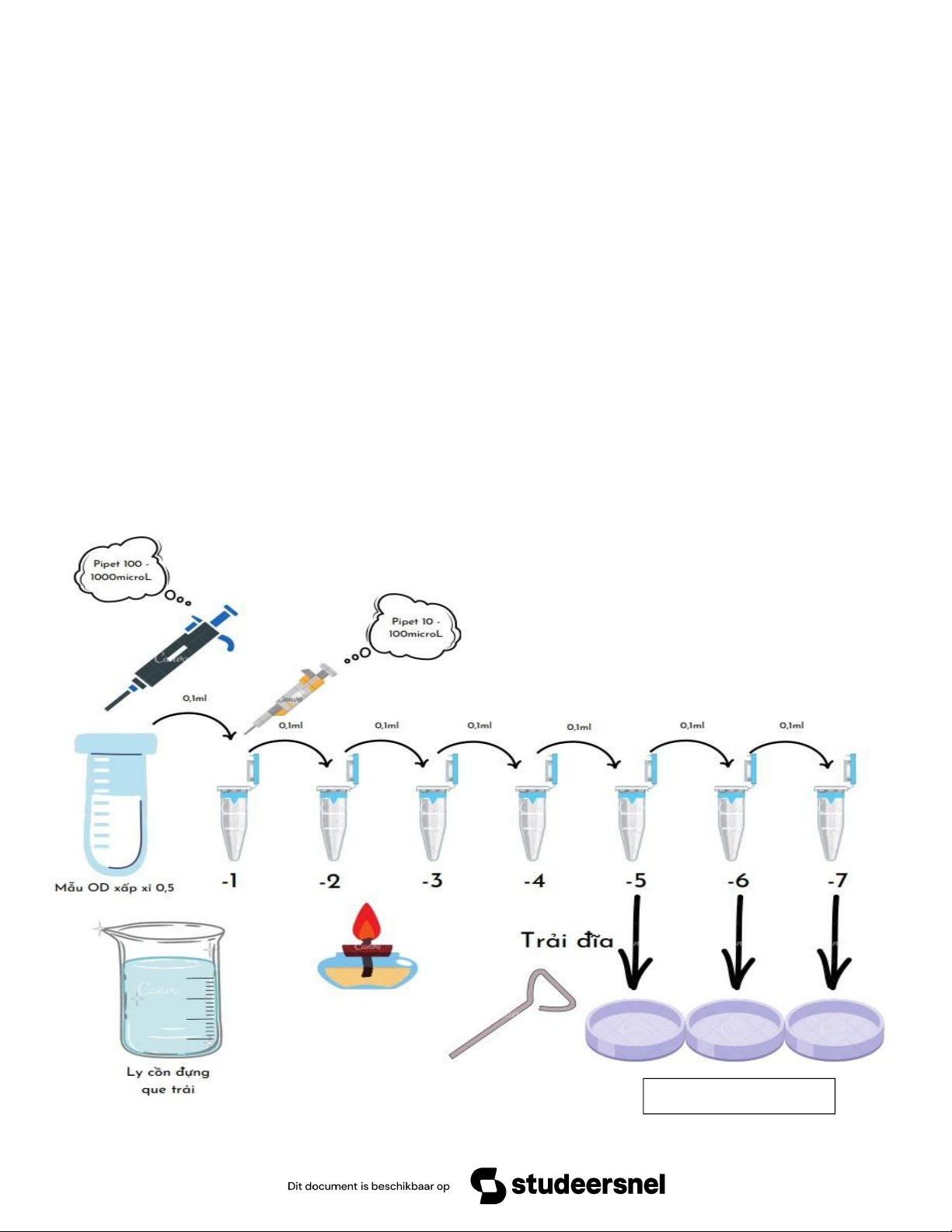
- Dụng cụ thí nghiệm:
- Đĩa petri môi trường LB Agar, ống nghiệm chứa huyền phù E. coli cần xác định mật độ
(ở nhóm 16 huyền phù E. coli có OD610nm là xấp xỉ 0,5).
- Đèn cồn, bật lửa, que trải, bông gòn, ly đựng rác, bút lông.
- Pipetman 100 – 1000μL, pipetman 10 - 100μL và các đầu tip phù hợp.
- Eppendorf chứa 0,9ml nước muối sinh lý 0,85%
- Quy trình thực hiện trải để tạo khuẩn lạc: Các đĩa Petri đã ghi chú 12 *Lưu ý:
- Vệ sinh nơi thí nghiệm, dụng cụ và tay bằng cồn 70 độ trước và sau khi thí nghiệm.
- Toàn bộ thao tác trong quá trình thí nghiệm phải được thực hiện trong bán kính 20cm xung
quanh đèn cồn để đảm bảo vô trùng.
- Ghi chú trên eppendorf và petri trước khi thực hiện thí nghiệm.
- Trong quá trình hút huyền phù phải đảm bảo không có bọt khí lọt vào.
- Khi hút huyền phù tế bào E. coli từ ống nghiệm thì dùng pipetman 100 – 1000μL, khi hút
huyền phù tế bào đã pha loãng từ eppendorf này sang eppendorf khác thì dùng pipetman 10 – 100μL.
- Lắc kỹ mỗi eppendorf vừa được pha loãng rồi mới tiến hành hút mẫu pha loãng tiếp.
- Khi sát trùng que trải thì phải đảm bảo toàn bộ cồn trên que đã cháy hết rồi mới nhúng vào
cồn đế sát khuẩn tiếp, nếu lỡ làm cồn trong ly cháy thì lấy hộp đựng đầu tip đậy lại ly cồn để
dập tắt lửa. Phải để que trải nguội rồi mới thực hiện thao tác trải nếu không sẽ làm chết vi sinh
vật dẫn đến kết quả không chính xác.
- Tránh chạm tay vào phía trong eppendorf để tránh nhiễm các vi sinh vật khác từ tay mình.
- Kết quả của nhóm:
- Mẫu 0,5: đĩa petri 10-5 có số khuẩn lạc lớn hơn 300; đĩa petri 10-6 có 184 khuẩn lạc; đĩa petri 10-7 có 127 khuẩn lạc.
- Công thức tính mật độ vi sinh vật: Nd = A.10.d (số tế bào/ml)
+ Trong đó: A là số khuẩn lạc đếm được, d là độ pha loãng.
+ Theo công thức ta tính được: N5 = 3.0×108 ; N6 = 1,8×109 ; N7 = 1,3×1010 (tế bào/ml)
+N6/N5 = 6 > 2 => chọn N5 - Biện luận:
- Ta nhận thấy kết quả đếm khuẩn lạc hợp lý vì độ pha loãng tăng dần, nồng độ giảm thì dẫn
đến mật độ vi sinh vật có trong mẫu cũng giảm dần từ đó số khuẩn lạc cũng giảm dần từ 10-5 đến 10-7.
- Ở đây nhóm đã thực hiện thao tác pha loãng và trải dĩa tương đối chính xác. - Kết luận:
- Phương pháp trải sẽ làm phân tán các vi sinh vật trong dung dịch và từng vi sinh vật sống đó
sẽ phát triển ở môi trường đĩa petri hình thành các khuẩn lạc, ta đếm các khuẩn lạc và thực
hiện tính mật độ vi sinh vật bằng công thức ta sẽ biết được mật độ vi sinh vật có trong dung dịch.
- Ở các độ pha loãng khác nhau thì sẽ có mật độ vi sinh vật khác nhau, độ pha loãng càng cao
thì mật độ vi sinh vật càng thấp.
- Độ chính xác sẽ phụ thuộc vào thao tác của người trải đĩa, nên trải càng kĩ và đều, dừng đúng
lúc khô thì khả năng chính xác càng cao.
- Phương pháp này có ưu điểm là phân biệt được vi sinh vật sống và chết (do chỉ vi sinh vật
sống thì mới hình thành khuẩn lạc) tuy nhiên nhược điểm của nó là dễ nhầm lẫn trong quá
trình đếm bằng mắt thường. Độ chính xác tương đối, không quá cao, không thích hợp cho
huyền phù vi sinh vật có mật độ thấp. 13
II/ Xác định bằng phương pháp đo độ đục: 1. Nguyên tắc:
- Khi một pha lỏng có chứa nhiều phân tử không tan thì sẽ tạo thành một hệ huyền phù
(sespension: rắn – lỏng, không phải là dung dịch: chất tan – lỏng) và có độ đục bởi các phân
tử hiện diện trong môi trường lỏng cản ánh sáng, làm tán xạ chùm ánh sáng tới. Tế bào vi sinh
vật là một thực thể nên khi hiện diện trong môi trường cũng làm môi trường trở nên đục.
Phương pháp đo độ đục dựa trên sự tán xạ ánh sáng, mức độ tán xạ ánh sáng tỷ lệ thuận với
nồng độ tế bào. Số lượng tế bào càng nhiều thì độ đục càng lớn, mức độ tán xạ ánh sáng nhiều
hơn và máy OD sẽ cho giá trị bước sóng càng cao khi mức độ quang thấu càng thấp. Từ giá trị
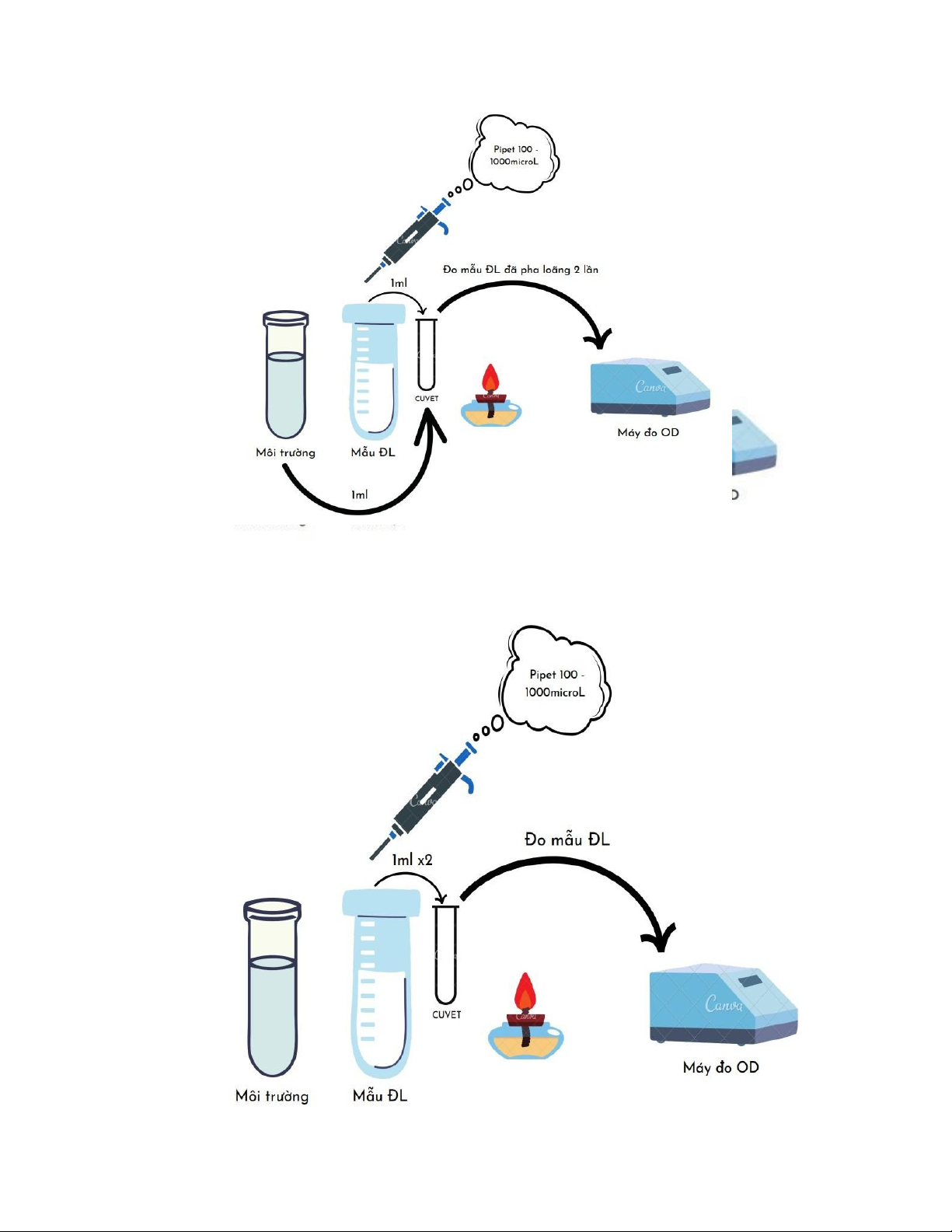
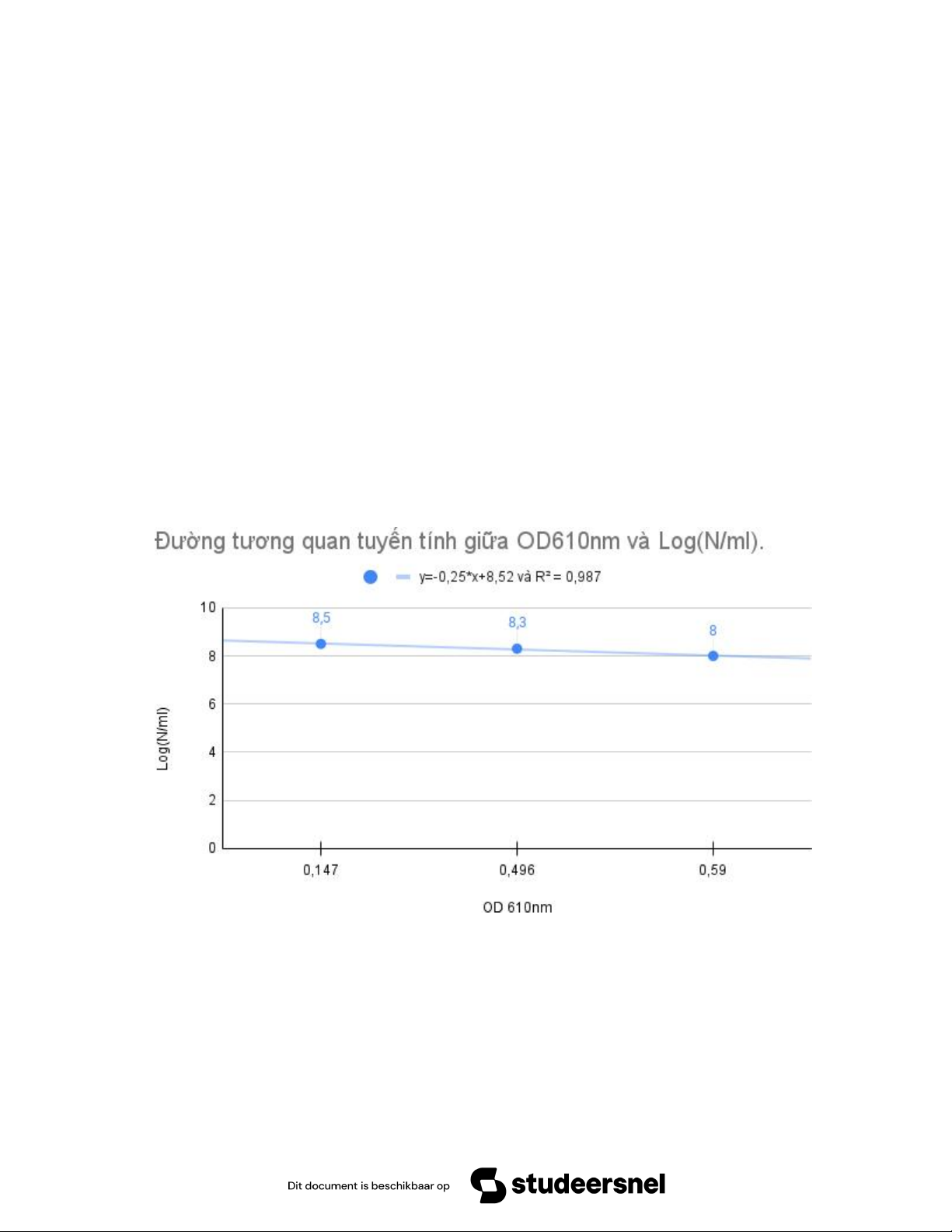
∆OD của mẫu đo được dựa vào đường chuẩn (đường tương quan mật độ tế bào theo OD610nm) để định lượng mẫu. 2. Thí nghiệm: a) Dụng cụ: - Cuvet. - Máy đo OD.
- Đèn cồn, bật lửa, ly đựng rác, bông gòn.
- Pipetman 100 – 1000μL và đầu tip phù hợp.
- Dung dịch ống đối chứng (Blank).
- Dung dịch huyền phù E. coli.
b) Các bước thực hiện đo OD 14 - Đối với
nhóm 16 có thêm mẫu ĐL, sau khi thực hiện các thao tác đo OD mẫu 0,5 thì nhóm tiếp tục
thực hiện thao tác đo mẫu ĐL và đo được giá trị là 0,950, giá trị ngoài khoảng cho phép. Tiến hành pha loãng 2 lần, thao 15
tác như trên với 1ml mẫu ĐL và 1ml dung dịch Blank, sau khi pha loãng đo lại được giá trị 0,560. c) Lưu ý:
- Phải thực hiện thao tác Blank.
- Blank bằng dung dịch giống như loại dung dịch dùng để nuôi cấy vi sinh vật (tức là cùng một
loại dung dịch nhưng dung dịch cần đo có vi sinh vật nhưng dung dịch Blank không có vi sinh
vật), đo Blank để khi đo mẫu ta trừ đi giá trị Blank để ra giá trị chính xác của riêng mẫu.
- Khoảng cho phép là khoảng trên đường chuẩn
- Khi pha loãng thì pha bằng dung dịch Blank.
- Khi hút dung dịch từ ống nghiệm không được để bọt khí đi vào.
- Cầm cuvet ở mặt nhám (với cuvet 4 mặt trong thì cầm ở 2 mặt không cho ánh sáng đi qua) và
cầm ở phía trên gần miệng cuvet. 3. Kết quả:
- Xác định mật độ tế bào theo độ đục:
+ Đo độ đục của một huyền phù tế bào X có mật độ chưa biết.
+ Từ giá trị OD610nmđo được, suy ra trị số log (N/ml) tương đương. Suy ra trị số mật độ N/ml
theo công thức: N/ml = 10a với a = log (N/ml)
+ Mẫu 0,5: đo được 0,584; không tiến hành pha loãng nữa. Dựa vào sống liệu đường chuẩn, ta
tính được 2.4×108 (tế bào/ml)
+ Mẫu ĐL sau khi pha loãng là 0,560. Dựa vào số liệu đường chuẩn ta tính được 2.4×108 (tế bào/ml). 4. Biện luận:
- Phương trình chuẩn có R2 là 0,987. 16
- Phương trình chuẩn có R2 tin cậy, trong quá trình thực hiện thao tác đã xảy ra ít sai sót và làm
kết quả đường chuẩn có thể phản ánh mật độ tế bào với độ chính xác cao. 5. Kết luận:
- Trong phương pháp này cần xây dựng biểu đồ tương quan tuyến tính giữa độ đục và số lượng
vi sinh vật có trong môi trường bằng phương pháp đếm khuẩn lạc trực tiếp.
- Đường chuẩn có càng nhiều điểm và R2 càng lớn thì có độ tin cậy càng cao.
- Đây là một phương pháp có thể tiết kiệm thời gian khi phải đo nhiều mẫu thay vì phải tốn
nhiều thời gian trải rồi đợi khuẩn lạc hình thành sau đó đếm.
- Tuy nhiên phương pháp này cũng có 3 nhược điểm lớn:
+ Không phân biệt được vi sinh vật sống hay chết (do xác vi sinh vật cũng cản ánh sáng như sinh vật sống)
+ Phương pháp này cần dùng thêm phương pháp khác để dựng đường chuẩn thì mới tính toán
được mật độ vi sinh vật.
+ Rất dễ xảy ra sai sót dẫn đến kết quả sai lệch trong quá trình thao tác. 17
CHỦ ĐỀ 4: KIỂM SOÁT TĂNG TRƯỞNG CỦA VI SINH VẬT I/ Nguyên tắc:
- Vi sinh vật có thể bị giới hạn tăng trưởng bởi một số yếu tố lý hóa của môi trường như nhiệt
độ, năng lượng chiếu xạ, hóa chất,…con người có thể sử dụng các yếu tố lý hóa này để kiểm
soát sự tăng trưởng của vi sinh vật không mong muốn.
- Có thể áp dụng nhiều phương pháp như khử trùng ở nhiệt độ cao hoặc nhiệt ẩm, năng lượng
chiếu xạ ở bước sóng ngắn, các hóa chất, chất diệt khuẩn,…
- Ngoài ra nhiều sinh vật có tính mẫn cảm với kháng sinh, có thể được kiểm soát bằng kháng
sinh. Kháng sinh là nhóm các sản phẩm chuyển hóa được tạo bởi vi sinh vật có tác dụng ức
chế sự tăng trưởng hoặc tiêu diệt vi sinh khác nhau, kháng sinh có tính chọn lọc.
- Tính mẫn cảm của một vi sinh vật đối với kháng sinh có thể quan sát bằng thực nghiệm dựa
trên kỹ thuật đĩa kháng sinh và vòng vô khuẩn. Đường kính của vòng vô khuẩn sẽ thể hiện độ
mẫn cảm của vi sinh vật với kháng sinh. Dùng kĩ thuật này ta có thể xác định được tính kháng
khuẩn của kháng sinh hoặc các hợp chất kháng khuẩn.
II/ Thí nghiệm kiểm soát quá trình tăng trường của vi sinh vật bởi kháng sinh: 1. Dụng cụ: - Đĩa giấy vô trùng. - Petri môi trường LB.
- Đèn cồn, bật lửa, bút lông, bông gòn. - Tăm bông vô trùng. - Thước kẻ li.
- Pipetman 10 - 100μL đã chỉnh 50μL. - Kháng sinh Ampicillin. - Kháng sinh Kanamycin. 2. Thí nghiệm:
a) Các bước thí nghiệm:
- Sắp xếp, kiểm tra dụng cụ cần thiết cho thí nghiệm.
- Đánh dấu, ghi chú lên đĩa petri.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay bằng cồn 70 độ
- Bật đèn cồn, lấy tăm bông ra khỏi bịch sau đó cột bịch tăm bông lại.
- Lấy mẫu từ ống nghiệm bằng tăm bông.
- Bôi đều mẫu lên đĩa petri môi trường LB
- Hơ kẹp nóng sau đó để nguội và lấy đĩa giấy từ eppendorf.
- Lấy đĩa giấy đặt vào chỗ đã đánh dấu.
- Dùng pipet hút 50μL lần lượt kháng sinh Ampicillin và Kanamycin cho vào đĩa giấy ở phía
đĩa petri đã được đánh dấu cho từng loại kháng sinh.
- Tắt đèn cồn, kết thúc thí nghiệm.
- Vệ sinh khu vực thí nghiệm, dụng cụ và tay lại bằng cồn 70 độ.
b) Sơ đồ hóa thí nghiệm: 18 19




