


Preview text:
CAC PTHH CƠ BẢN THƯỜNG GẶP
A. Tính chất hóa học của kim loại I. Tác dụng với phi kim 1. Tác dụng với oxi 2Mg + O2 2MgO 3Fe + 2O2 → Fe3O4
* Kết luận: Hầu hết các kim loại (trừ Ag, Au, Pt) phản ứng với oxygen ở nhiệt độ thường
hoặc nhiệt độ cao tạo thành oxit.
2. Tác dụng với phi kim khác
- Tác dụng với Cl2: tạo muối clorua (kim loại có hóa trị cao nhất) Cu + Cl2 to→ CuCl2 2Fe + 3Cl2 to→ 2FeCl3
Nếu Fe dư: Fedư + 2FeCl3 to→ 3FeCl2
- Tác dụng với lưu huỳnh: khi đun nóng tạo muối sunfua (trừ Hg xảy ra ở nhiệt độ thường) Fe + S to→ FeS Hg + S → HgS
=> Ứng dụng: dùng lưu huỳnh để thu hồi thủy ngân khi ống nhiệt kế bị vỡ
II. Tác dụng với dung dịch axit
1. Dung dịch axit tác dụng được với một số kim loại như Fe, Zn, Al,. .tạo thành muối và giải phóng khí hiđro.
- Phương trình phản ứng:
Acid + kim loại → muối + H2
- Điều kiện phản ứng sẽ là:
+ Acid: Thường sẽ dùng HCl, H2SO4 loãng bởi tính chất hóa học của H2SO4 và tính chất
hóa học của axit HCL sẽ dễ giải phóng H2 hơn các chất khác.
+ Kim loại: Sử dụng các kim loại đứng trước H trong dãy hoạt động hóa học
- Dãy hoạt động hóa học của kim loại đó là:
K, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
- Cách để ghi nhớ dãy kim loại này là: Khi nào cần may áo Záp sắt nên sang phố hỏi cửa hàng á phi âu 2. Ví dụ minh họa: 2Na + 2HCl → 2NaCl + H2
Mg + H2SO4 (loãng) → MgSO4 + H2 Fe + 2HCl → FeCl2 + H2
3H2SO4 (loãng) + 2Al → Al2(SO4)3 + 3H2 Zn + 2HCl → ZnCl2 + H2
Bài tập : Viết thêm 3 PTHH kim loại tác dụng với acid HCl/H2SO4
III. Tác dụng với dung dịch muối Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhận xét: Cu hoạt động hóa học mạnh hơn Ag Fe + CuSO4 → FeSO4 + Cu
Nhận xét: Fe hoạt động hóa học mạnh hơn Cu
=> Hoạt động hóa học của Fe > Cu > Ag
B. Tính chất của phi kim I. Tính chất vật lí
- Phi kim có thể tồn tại ở 3 trạng thái: + Thể rắn: I2, S, C,… + Thể lỏng: Br2 + Thể khí: O2, N2, Cl2,… II. Tính chất hóa học
1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối Ví dụ:
+ Iron cháy trong khí clorine xuất hiện chất rắn màu nâu đỏ PTHH: 2Fe + 3Cl2 to→ 2FeCl3
+ Copper tác dụng với sulfur tạo hợp chất màu đen: PTHH: Cu + S to→CuS 2. Tác dụng với hiđro
- Oxygen tác dụng với khí hyđrogen tạo thành nước: 2H2 + O2 to→2H2O
- Hydrogen cháy trong khí clorine (màu vàng lục) tạo thành khí không màu làm giấy quỳ tím ẩm chuyển đỏ PTHH: H2 + Cl2 to→ 2HCl 3. Tác dụng với oxi
- Nhiều phi kim tác dụng với oxygen tạo thành acidic ocid
Svàng + O2 to→ SO2 không màu
4Pđỏ + 5O2 to→2P2O5 trắng
4. Mức độ hoạt động của phi kim
- Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng
và mức độ phản ứng của ohi kim đó với kim loại và hiđro. Ví dụ:
+ F, Cl, O là những phi kim mạnh
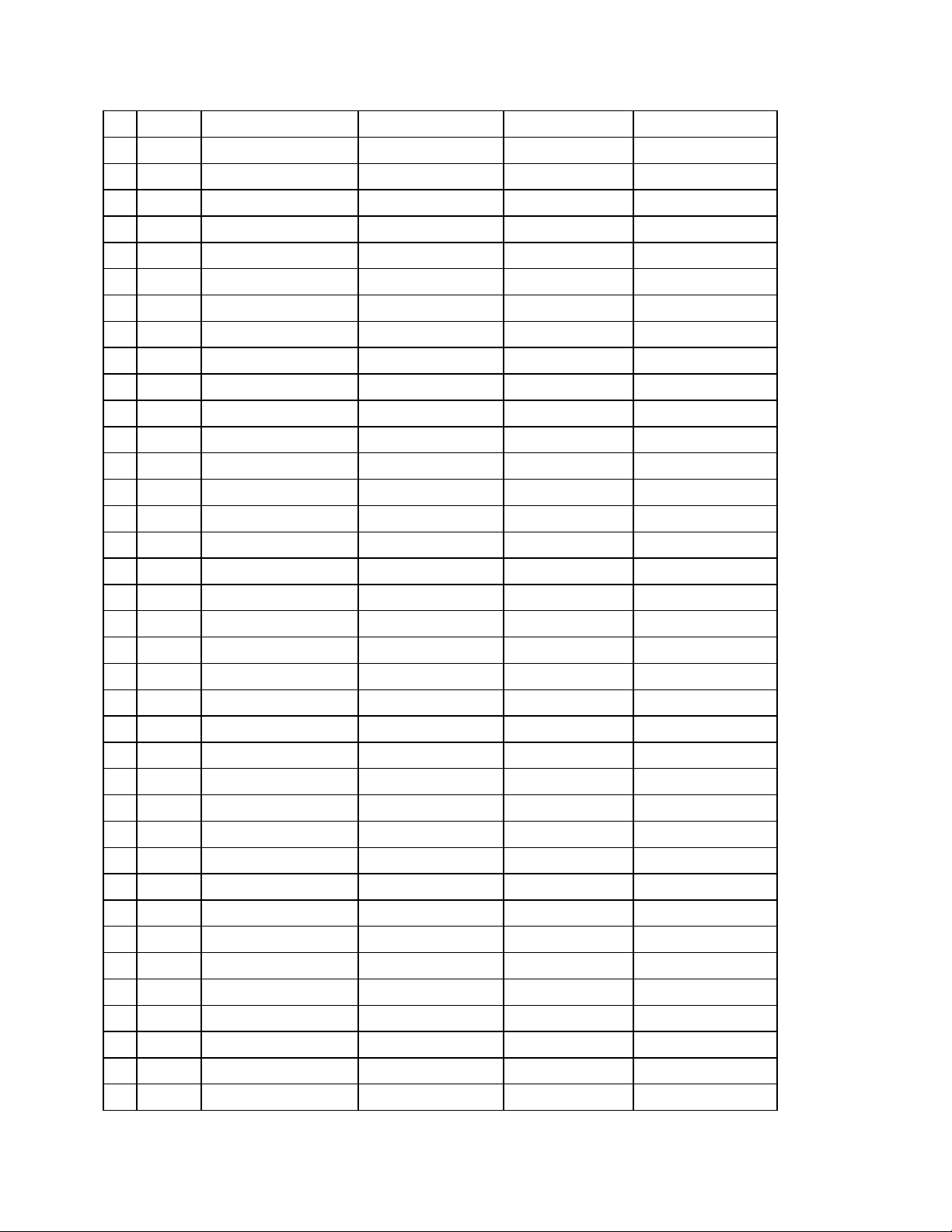
+ S, P, C, Si là những phi kim yếu STT Số Tên nguyên tố Hoá trị nguyên proton mới
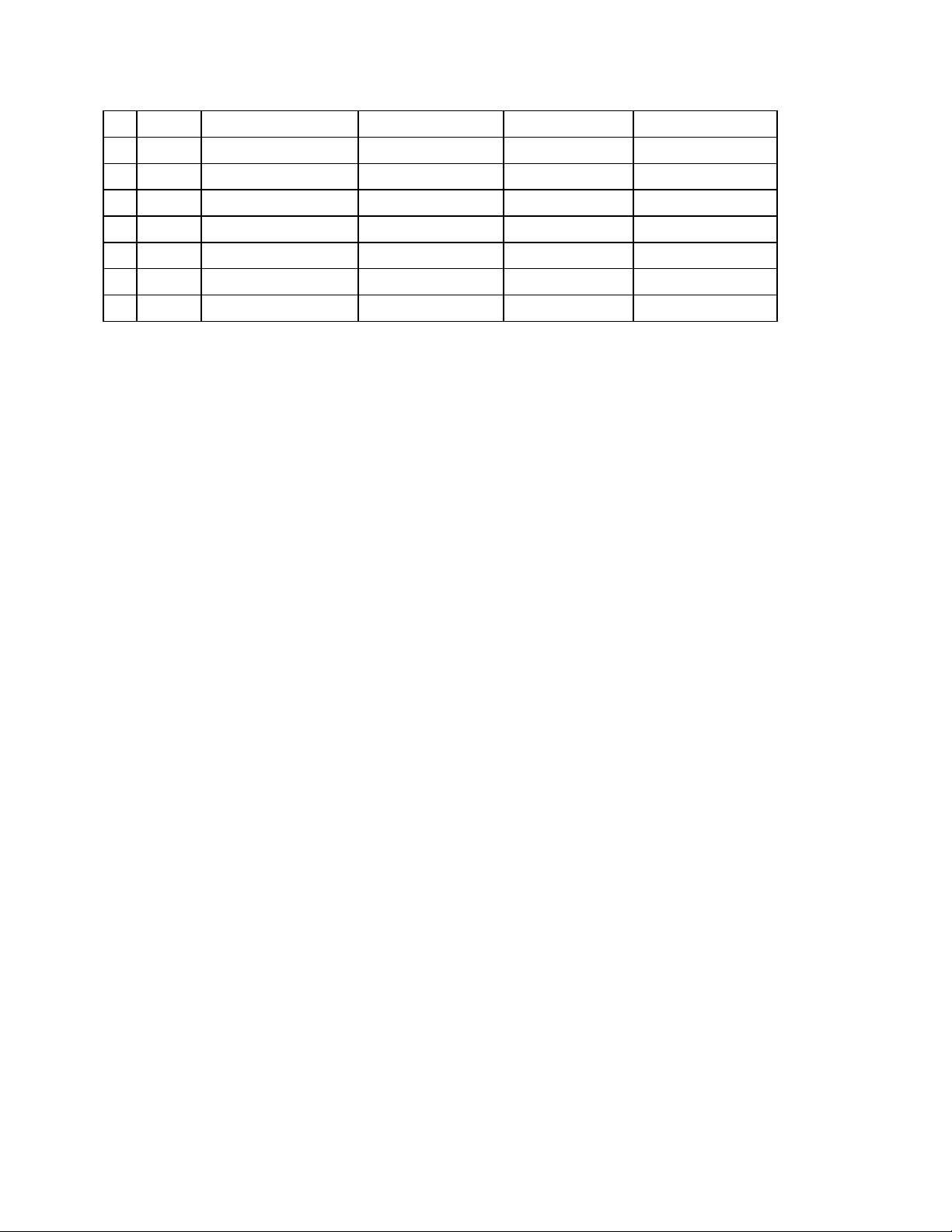
Ký hiệu hoá họ Nguyên tử khối tố 1 1 Hydrogen H 1 I 2 2 Helium He 4 3 3 Lithium Li 7 I 4 4 Beryllium Be 9 II 5 5 Boron Bo 11 III 6 6 Carbon C 12 IV, II 7 7 Nitrogen N 14 II, III, IV… 8 8 Oxygen O 16 II 9 9 Flourine F 19 I 10 10 Neon Ne 20 11 11 Sodium Na 23 I 12 12 Magnesium Mg 24 II 13 13 Aluminium Al 27 III 14 14 Silicon Si 28 IV 15 15 Phosphorus P 31 III, V 16 16 Sulfur S 32 II, IV, VI 17 17 Chlorine Cl 35,5 I,… 18 18 Argon Ar 39,9 19 19 Potassium K 39 I 20 20 Calcium Ca 40 II 21 21 Scandium Sc 22 22 Titanium Ti 23 23 Vanadium V 24 24 Chromium Cr 52 II, III 25 25 Manganese Mn 55 II, IV, VII… 26 26 Iron Fe 56 II, III 27 27 Cobalt Co 28 28 Nickel Ni 29 29 Copper Cu 64 I, II 30 30 Zinc Zn 65 II 33 33 Arsenic As 34 34 Selenium Se 35 35 Bromine Br 80 I,. . 36 36 Krypton Kr 84 37 37 Rubidium Rb 38 38 Stronti Sr 88 II 39 39 Yttri Y 89 40 46 Palladium Pd 41 47 Silver Ag 108 I 42 48 Cadmium Cd 43 50 Tin/Stantum Sn 119 44 53 Iodine I 127 I,. 45 55 Caesium Cs 133 46 56 Barium Ba 137 II 47 73 Tantalum Ta 181 48 74 Tungsten W 184 49 75 Rhenium Re 186 50 76 Osmium Os 190 51 78 Platinum Pt 195 52 79 Aurum/Gold Au 197 53 80 Mercury Hg 201 I, II 54 82 Lead/Plumbum Pb 207 II, IV 55 85 Astatine At 210
Document Outline
- CAC PTHH CƠ BẢN THƯỜNG GẶP
- B.Tính chất của phi kim


