










































Preview text:
Cập nhật KTCM về dược
PHÁP LUẬT VÀ QUẢN LÝ CHUYÊN MÔN VỀ DƯỢC |

Lỗi thường gặp
- Không có thiết bị, triển khai ứng dụng CNTT (01/01/2019), không bảo đảm kiểm soát XX, giá cả, không chuyển thông tin cho CQQL,..
- Sổ sách hoặc máy tính để quản lý việc xuất, nhập, tồn trữ
(lưu trữ 1 năm sau khi hết hạn dùng) o Lưu đơn thuốc ngoại trú (thuốc KS, GN, HT) o Người quản lý chuyên môn vắng mặt (ko thực hiện uỷ quyền)
Lỗi thường gặp
▪ Thuốc độc, thuốc trong Danh mục thuốc, dược chất thuộc danh mục chất bị cấm sử dụng trong một số ngành, lĩnh vực phải được bảo quản tách biệt, không được để cùng các thuốc khác, phải sắp xếp gọn gàng, tránh nhầm lẫn, dễ quan sát
▪ Phải có máy tính kết nối internet và thực hiện quản lý hoạt động phân phối thuốc bằng phần mềm vi tính. Có cơ chế chuyển thông tin về việc phân phối thuốc, chất lượng thuốc giữa nhà sản xuất với khách hàng cũng như việc chuyển giao thông tin cho cơ quan quản lý liên quan khi được yêu cầu.
▪ Niêm yết công khai CCHN, GCNĐĐKKDD
NỘI DUNG
QĐ kê đơn thuốc bằng hình thức điện tử | TT 27/2021/TT-BYT, TT 04/2022/TT-BYT |
QĐ về kê đơn (thuốc cổ truyền, thuốc dược liệu và kê đơn kết hợp thuốc cổ truyền, thuốc dược liệu với thuốc hoá dược) | TT 44/2018/TT-BYT |
Tổ chức - Hoạt động dược lâm sàng của cơ sở KCB | Luật dược, NĐ 131/2020/NĐ-CP |
Đăng ký thuốc | TT 08/2022/TT-BYT |
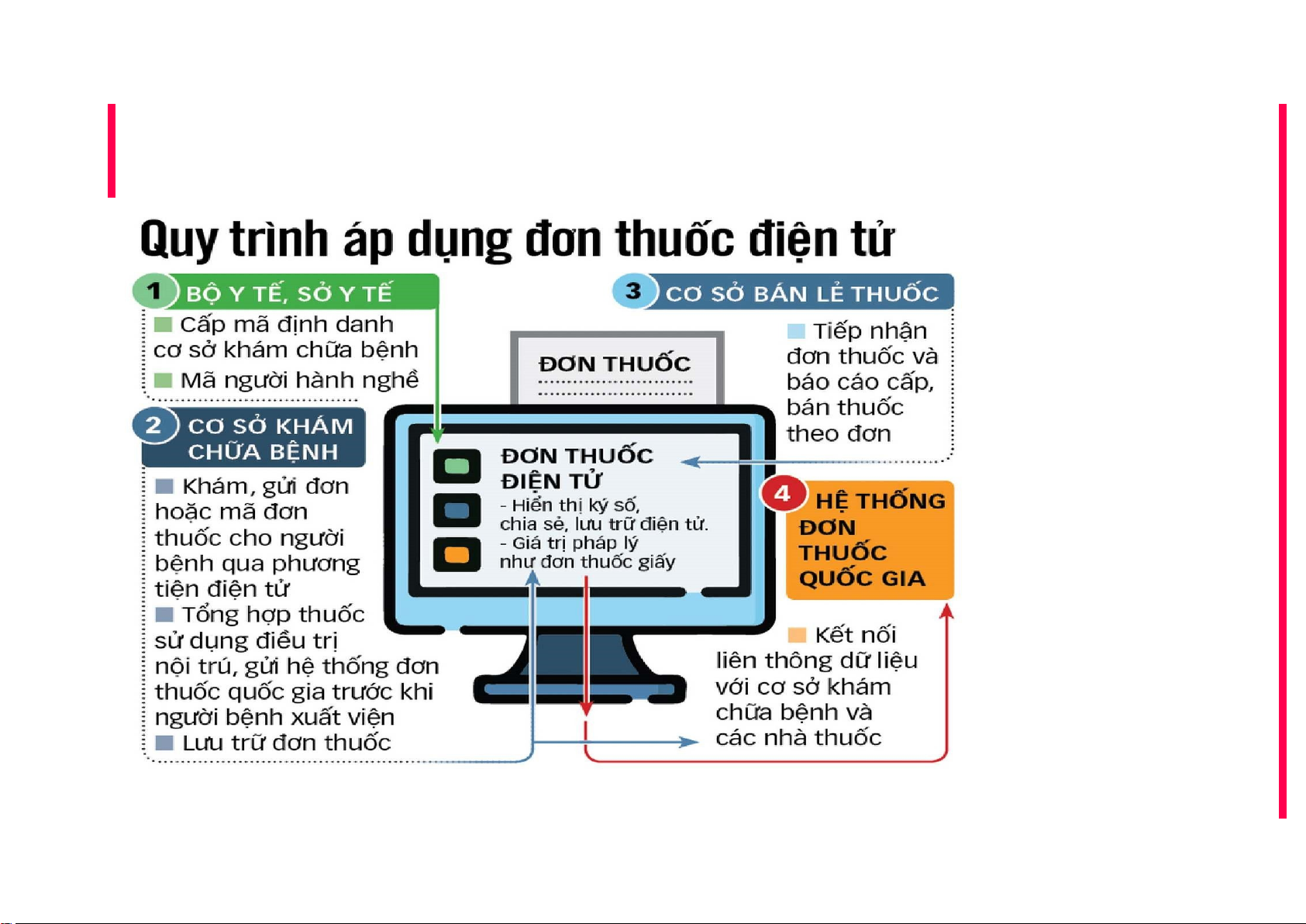
QUY ĐỊNH KÊ ĐƠN THUỐC BẰNG HÌNH THỨC ĐIỆN TỬ |
Kê đơn thuốc bằng hình thức điện tử
 ▪ BV từ hạng 3 trở lên: trước ngày 31/12/2022
▪ BV từ hạng 3 trở lên: trước ngày 31/12/2022
▪ Cơ sở khác: trước ngày 30/6/2023
Kê đơn thuốc bằng hình thức điện tử

QUY ĐỊNH KÊ ĐƠN THUỐC CỔ TRUYỀN, THUỐC DƯỢC LIỆU |
Một số khái niệm
Thuốc dược liệu là thuốc có thành phần từ dược liệu và có tác dụng dựa trên bằng chứng khoa học, trừ thuốc cổ truyền


Thuốc cổ truyền (bao gồm cả vị thuốc cổ truyền) là thuốc có thành phần dược liệu được chế biến, bào chế hoặc phối ngũ theo lý luận và phương pháp của y học cổ truyền hoặc theo kinh nghiệm dân gian thành chế phẩm có dạng bào chế truyền thống hoặc hiện đại.
Một số khái niệm

Vị thuốc cổ truyền là dược liệu được chế biến theo lý luận và phương pháp của y học cổ truyền dùng để sản xuất thuốc cổ truyền hoặc dùng để phòng bệnh, chữa bệnh.
Một số khái niệm

▪ Thuốc thang là dạng thuốc cổ truyền gồm có một hoặc nhiều vị thuốc cổ truyền kết hợp với nhau theo lý luận của y học cổ truyền hoặc theo kinh nghiệm dân gian được thầy thuốc đóng gói theo liều sử dụng.
Một số khái niệm
 ▪ Thuốc thành phẩm là dạng thuốc cổ truyền đã qua các công đoạn sản xuất, kể cả đóng gói và dán nhãn theo phương pháp truyền thống hoặc hiện đại thuộc một trong các dạng bào chế: viên, nước, chè, bột, cao và các dạng khác.
▪ Thuốc thành phẩm là dạng thuốc cổ truyền đã qua các công đoạn sản xuất, kể cả đóng gói và dán nhãn theo phương pháp truyền thống hoặc hiện đại thuộc một trong các dạng bào chế: viên, nước, chè, bột, cao và các dạng khác.
Hình thức kê đơn
- Kê đơn riêng thuốc thang, thuốc thành phẩm, thuốc dược liệu.
- Kê đơn bài thuốc gia truyền.
- Kê đơn phối hợp thuốc thành phẩm và thuốc thang.
Hình thức kê đơn kết hợp
▪ Kết hợp thuốc thang và thuốc hóa dược.
▪ Kết hợp thuốc thành phẩm và thuốc hóa dược.

▪ Kết hợp thuốc thang, thuốc thành phẩm, thuốc hóa Dược.
Nguyên tắc kê đơn
▪ Người hành nghề chỉ được kê đơn thuốc sau khi có kết quả khám bệnh, chẩn đoán bệnh.
▪ Kê đơn thuốc phải phù hợp với chẩn đoán bệnh và tình trạng bệnh.
▪ Được kê đơn phối hợp thuốc thang và thuốc thành phẩm trên một người bệnh mà giữa các thuốc này có sự trùng lặp một số vị thuốc trong thành phần, công thức.
▪ Trường hợp có sửa chữa nội dung đơn thuốc thì người kê đơn phải ký tên ngay bên cạnh nội dung sửa.
Nguyên tắc kê đơn
▪ Trường hợp đơn thuốc có chứa dược liệu độc phải ghi rõ số lượng bằng số và bằng chữ, trường hợp số lượng dưới 10 phải ghi số 0 ở phía trước.
▪ Không được ghi vào đơn thuốc thông tin, quảng cáo, tiếp thị, kê đơn, tư vấn, ghi nhãn, hướng dẫn sử dụng có nội dung dùng để phòng bệnh, chữa bệnh, chẩn đoán bệnh, điều trị bệnh, giảm nhẹ bệnh, điều chỉnh chức năng sinh lý cơ thể người đối với sản phẩm không phải là thuốc, trừ trang thiết bị y tế.
Nguyên tắc kê đơn kết hợp
▪ Kê đơn thuốc hóa dược trong điều trị ngoại trú thực hiện theo quy định tại Thông tư số 52/2017/TT-BYT.
▪ Kê đơn có kết hợp thuốc hóa dược trong điều trị nội trú thì thời gian sử dụng thuốc hóa dược áp dụng theo quy định về kê đơn thuốc hóa dược.
Hướng dẫn cách ghi đơn thuốc
Cách ghi đơn thuốc đối với thuốc cổ truyền, thuốc dược liệu
▪ Khi kê đơn thuốc thang ghi tên thường dùng, ghi rõ liều lượng, đơn vị tính, không viết tắt tên thuốc đối với các vị thuốc YHCT; Hướng dẫn cụ thể cách sắc thuốc, cách uống thuốc, thời gian uống thuốc;
▪ Chỉ định rõ liều dùng, cách dùng và đường dùng;
Hướng dẫn cách ghi đơn thuốc
Cách ghi đơn thuốc đối với thuốc cổ truyền, thuốc dược liệu
▪ Đối với thuốc thành phẩm do cơ sở khám bệnh, chữa bệnh tự sản xuất thì ghi theo tên đã được Sở Y tế hoặc Bộ Y tế phê duyệt lưu hành nội bộ (trừ đơn vị do Bộ Quốc phòng quản lý); Đối với thuốc được lưu hành toàn quốc thì ghi tên thuốc theo tên đã được Bộ Y tế cấp số đăng ký lưu hành;
▪ Trường hợp người kê đơn cho người bệnh dùng quá liều thông thường so với quy trình chuyên môn của Bộ Y tế hoặc phác đồ hướng dẫn điều trị thì phải ký xác nhận bên cạnh.
Hướng dẫn cách ghi đơn thuốc
Thứ tự kê đơn thuốc trong đơn thuốc và hồ sơ bệnh án
▪ Thứ tự kê đơn thuốc cổ truyền, thuốc dược liệu: Thuốc thang, thuốc thành phẩm.
Đối với thuốc thành phẩm, kê theo thứ tự: Thuốc dạng viên, thuốc dạng nước, thuốc dạng chè, thuốc dạng bột, thuốc dạng cao và các dạng thuốc khác;
▪ Thứ tự kê đơn thuốc kết hợp: Kê thuốc hóa dược trước, thuốc cổ truyền và thuốc dược liệu sau.


Thời gian sử dung trong kê đơn thuốc
Kê đơn thuốc trong điều trị ngoại trú
▪ Bệnh cần chữa trị dài ngày: Mỗi lần kê đơn thuốc tối đa không quá 30 ngày hoặc theo hướng dẫn điều trị của mỗi bệnh;
▪ Các bệnh khác: Mỗi lần kê đơn thuốc tối đa không quá 10 ngày. Đối với vùng sâu, vùng xa, biên giới, hải đảo, vùng có điều kiện kinh tế xã hội khó khăn hoặc đặc biệt khó khăn được kê đơn điều trị tối đa không quá 30 ngày
Thời gian sử dụng trong kê đơn thuốc
Kê đơn thuốc trong điều trị nội trú, điều trị nội trú ban ngày (01/2019/TT/BYT)
▪ Thực hiện kê đơn thuốc tối thiểu hai lần trong 10 ngày;
▪ Đối với kê đơn thuốc thang: nếu không thay đổi chỉ định điều trị và vẫn giữ nguyên bài thuốc đã được chỉ định ngay trước đó thì được phép kê lại bằng cách ghi “Bài thuốc hoặc đơn thuốc của ngày, tháng, năm” và chỉ được một lần, nếu tiếp tục sử dụng bài thuốc đó lần sau kế tiếp phải ghi lại bài thuốc.
2. HOẠT ĐỘNG DƯỢC LÂM SÀNG |
MỘT SỐ KHÁI NIỆM
Hành nghề dược
việc sử dụng trình độ chuyên môn của cá nhân để kinh doanh dược và hoạt động DLS Dược lâm sàng hoạt động NCKH và thực hành dược về tư vấn sử dụng thuốc hợp lý, an toàn, hiệu quả nhằm tối
Người chịu trách nhiệm chuyên môn về dược của nhà thuốc có thể đồng thời là người làm công tác dược lâm sàng tại nhà thuốc.
ưu hóa việc sử dụng thuốc.
Người phụ trách công tác DLS phải có chứng chỉ hành nghề dược.
Nội dung hoạt động dược lâm sàng
- Tư vấn trong quá trình xây dựng DMT tại cơ sở khám bệnh, chữa bệnh để bảo đảm mục tiêu sử dụng thuốc hợp lý, an toàn, hiệu quả.
- Tư vấn và giám sát việc kê đơn và sử dụng thuốc.
- Thông tin, hướng dẫn sử dụng thuốc cho người hành nghề khám bệnh, chữa bệnh, người sử dụng thuốc và cộng đồng.
- Tham gia xây dựng quy trình, hướng dẫn chuyên môn liên quan đến sử dụng thuốc và giám sát việc thực hiện các quy trình này.
Nội dung hoạt động dược lâm sàng
- Phân tích, đánh giá hiệu quả sử dụng thuốc tại cơ sở khám bệnh, chữa bệnh.
- Tham gia theo dõi, giám sát phản ứng có hại của thuốc.
- Tham gia hoạt động nghiên cứu khoa học liên quan đến sử dụng thuốc hợp lý, an toàn, hiệu quả.
Triển khai hoạt động dược lâm sàng
Người đứng đầu cơ sở khám bệnh, chữa bệnh có sử dụng thuốc
Nội dung hoạt động dược lâm sàng Người chịu trách nhiệm chuyên môn của Nhà thuốc
- Tư vấn, cung cấp thông tin về thuốc cho người mua, người sử dụng thuốc;
- Tư vấn, trao đổi với người kê đơn trong trường hợp phát hiện việc kê đơn thuốc không hợp lý; c) Tham gia theo dõi, giám sát phản ứng có hại của thuốc.
Bộ phận dược lâm sàng
▪ Bộ phận dược lâm sàng thuộc khoa dược của cơ sở khám bệnh, chữa bệnh tổ chức thực hiện các hoạt động DLS tại cơ sở để phục vụ người bệnh ngoại trú có thẻ BHYT và người bệnh nội trú;
▪ Cơ sở khám bệnh, chữa bệnh không tổ chức khoa dược theo quy định của pháp luật về khám bệnh, chữa bệnh vẫn phải tổ chức bộ phận DLS để thực hiện các hoạt động DLS phục vụ người bệnh ngoại trú có thẻ BHYT và người bệnh nội trú;
▪ Nhà thuốc trong khuôn viên cơ sở khám bệnh, chữa bệnh thực hiện các hoạt động DLS tại nhà thuốc để phục vụ người mua thuốc trong trường hợp cơ sở khám bệnh, chữa bệnh có tổ chức nhà thuốc.
Số lượng người làm công tác dược lâm sàng
<200 giường bệnh

NT/CS KCB

>=200
giườngbệnh
Ko tổ chức KD theo QĐ



Người phụ trách công tác DLS: 01 kiêm làm công tác

Ngườiphụtráchcông
tácDLS: 01
Sốlượngngườilàm
côngtácDLS:
01
/200giường nộitrú
01
/1000 đơncấpphát
ngoạitrú(BHYT)

Ngườilàmcôngtác
DLS: 01/01 địađiểm
kinhdoanh(người
chịutráchnhiệm
chuyênmônvề
dược)
.
DLS (nội trú)
Số lượng người làm công tác DLS: 01/1000 đơn cấp phát ngoại trú (BHYT)

Lộ trình tăng SL người làm công tác DLS
Thời gian | Cơ sở | Yêu cầu |
01/01/2026 | BV hạng 2 trở lên | 01/150 giường bệnh nội trú 1,5/1000 đơn thuốc ngoại trú (BHYT) |
01/01/2031 | Các cơ sở KCB | 01/100 giường bệnh nội trú 02/1000 đơn thuốc ngoại trú (BHYT) |
Điều kiện người làm công tác dược lâm sàng
Cơ sở KCB bằng YHCT







CơsởKCB

NT/CS KCB
Một trong các văn bằng sau:

Tốtnghiệptrìnhđộ
đạihọcngànhDược
(
được
trở
lên
cấp
hoặccôngnhậntại
VN)

Tốtnghiệptrìnhđộđạihọc
ngànhDượctrởlên(được
cấphoặccôngnhậntại
VN)
Tôt nghiệp trình độ đại học ngành Dược trở lên (được cấp hoặc

công nhận tại VN)
Bằng tốt nghiệp đại học
ngành dược cổ truyền trở lên;
Bằng tốt nghiệp đại học ngành YHCT trở lên.
Điều kiện thực hành – Phụ trách công tác DLS
Cơ sở thực hành (2 năm)
- CS kinh doanh dịch vụ thử thuốc trên lâm sàng/thử TĐSH của thuốc,
- TT hoặc khoa, phòng nghiên cứu dược lý, DLS của các trường đào tạo y, dược bậc đại học
- TT quốc gia hoặc khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc
- Cơ sở khám, chữa bệnh có tổ chức, hoạt động DLS
*Tại CS khám, chữa bệnh bằng YHCT: thực hành tại BV, viện có giường bệnh có hoạt động YHCT và có tổ chức, hoạt động DLS
Hoạt động dược lâm sàng
Tại khoa lâm sàng, khoa phòng khám bệnh
Khai thác thông tin của người bệnh, bao gồm cả khai thác thông tin trên bệnh án, tiến hành phỏng vấn trực tiếp người bệnh
Xem xét các thuốc được kê đơn cho người bệnh trong quá trình đi buồng bệnh hoặc xem xét y lệnh trong hồ sơ bệnh án, đơn thuốc
Hướng dẫn sử dụng thuốc cho điều dưỡng viên, hộ sinh viên
Phối hợp với người hành nghề khám bệnh, chữa bệnh để cung cấp thông tin tư vấn cho người bệnh về những điều cần lưu ý trong quá trình sử dụng thuốc.
Tại Nhà thuốc/CS KCB
Tư vấn, cung cấp thông tin về thuốc cho người mua, người sử dụng thuốc
Tư vấn, trao đổi với người kê đơn trong trường hợp phát hiện việc kê đơn thuốc không hợp lý
Tham gia theo dõi, giám sát phản ứng có hại của thuốc
Hoạt động dược lâm sàng tại khoa lâm sàng, khoa phòng khám bệnh
1. Khai thác thông tin của người bệnh, bao gồm cả khai thác thông tin trên bệnh án, tiến hành phỏng vấn trực tiếp người bệnh, bao gồm: a) Tiền sử sử dụng thuốc;
b) Tóm tắt các dữ kiện lâm sàng và các kết quả cận lâm sàng đã có.
Hoạt động dược lâm sàng tại khoa lâm sàng, khoa phòng khám bệnh
2. Xem xét các thuốc được kê đơn cho người bệnh trong quá trình đi buồng bệnh hoặc xem xét y lệnh trong hồ sơ bệnh án, đơn thuốc, bao gồm: a) Chỉ định;
- Chống chỉ định;
- Lựa chọn thuốc;
- Dùng thuốc cho người bệnh: liều dùng, khoảng cách dùng, thời điểm dùng, đường dùng, dùng thuốc trên các đối tượng đặc biệt, thời gian dùng thuốc;
đ) Các tương tác thuốc cần chú ý;
- Phản ứng có hại của thuốc.
Lộ trình thực hiện
Bệnh viện hạng III, IV, BV chưa xếp hạng từ tuyến quận,
Bệnh viện hạng I trở huyện, thị xã, TP
lên thuộc tỉnh













01/01/2021
01/01/2024
01/01/2027
01/01/2030
Bệnh viện hạng II
Các cơ sở KB, CB khác có hoạt động sử dụng thuốc
ĐĂNG KÝ THUỐC (Những điểm thay đổi) |
Quy định liên quan CPP
▪ CPP phải được cấp bởi cơ quan có thẩm quyền và có đủ nội dung theo mẫu của WHO được công bố trên trang thông tin điện tử của WHO (https://www.who.int).
▪ không yêu cầu phải có 2 CPP mà chỉ yêu cầu 1 CPP từ nước SRA để tăng khả năng tiếp cận thuốc, đặc biệt là thuốc mới, thuốc đáp ứng nhu cầu điều trị đặc biệt;
▪ không quy định xác thực 100% các hồ sơ mà chỉ quy định xác thực các trường hợp nghi ngờ cần xác thực trước khi cấp phép.
Xác thực HS
chỉ quy định xác thực các trường hợp nghi ngờ cần xác thực trước khi cấp phép
▪ CPP: tẩy xoá, sửa chữa TT, CSSX lần đầu có thuốc ĐK lưu hành tại VN, bản điện tử, không có dấu xác nhận
của CQ có thẩm quyền cấp
▪ Giấy tờ pháp lý của CS đăng ký, CSSX: lần đầu có thuốc đăng ký tại VN
Thư uỷ quyền
▪ chỉ quy định nội dung phải có trong thư ủy quyền, không bắt buộc theo mẫu
▪ không yêu cầu chứng thực chữ ký người ủy quyền
Đứng tên CS đăng ký | Ký tên trên HS đăng ký |
Tên và địa chỉ chủ sở hữu giấy phép lưu hành hoặc cơ sở sản xuất ủy quyền | Tên và địa chỉ cơ sở đăng ký |
Tên và địa chỉ cơ sở đăng ký được ủy quyền | Tên và chức danh người ủy quyền và người được ủy quyền |
Tên thuốc; nồng độ hàm lượng dược chất; dạng bào chế | |
Nội dung uỷ quyền | |
Hiệu lực của thư uỷ quyền | |
Kiểm soát SĐK lưu hành
cấp 2 giấy đăng ký lưu hành đối với thuốc của cùng cơ sở sản xuất có cùng dược chất hoặc thành phần dược liệu; dạng bào chế; đường dùng; hàm lượng hoặc nồng độ trong một đơn vị phân liều:
▪ 01 giấy đăng ký lưu hành với tên thương mại
▪ 01 giấy đăng ký lưu hành với tên chung quốc tế.
Kiểm soát SĐK lưu hành (tên thương mại của thuốc)
Nguyên tắc đặt tên thương mại:
- Không có tính chất quảng cáo;
- Không gây hiểu lầm về thành phần, xuất xứ của thuốc. Thuốccó nhiều thành phần DC, DL thì không được sử dụng tên của từng thành phần để đặt tên thuốc;
- Không gây hiểu lầm hoặc mang tính chất mô tả quá mức về tácdụng, hiệu quả, chỉ định của thuốc;
- Không vi phạm thuần phong, mỹ tục, truyền thống của Việt
Nam;
đ) Không gây xung đột với các đối tượng SHTT của cá nhân, tổ chức khác đang được bảo hộ;
Kiểm soát SĐK lưu hành (tên thương mại của thuốc)
Nguyên tắc đặt tên thương mại:
- Không trùng hoặc tương tự với tên thuốc đã được cấp GĐK lưu hànhcủa cơ sở đăng ký khác;
- Không được đặt tên thuốc giống nhau nếu thuốc có thành phần HCkhác nhau;
- Không được đặt tên thuốc khác nhau trong TH có cùng tất cả tiêu chí:HC, DL, DBC, đường dùng, nồng độ, hàm lượng và NSX . (không áp dụng với thuốc SX gia công và thuốc gia công này thực hiện theo quy định của Bộ trưởng Bộ Y tế về gia công sản xuất thuốc;
- Đối với thuốc có cùng tên thuốc, cùng NSX, cùng DBC, cùng HC nhưngcó nhiều HL/NĐ khác nhau: tên thuốc có thể ghi kèm theo hàm lượng, nồng độ tương ứng ngay cạnh tên thuốc để nhận biết và phân biệt.
Quy định về thay đổi nhỏ
▪ chỉ yêu cầu thông báo (11 nội dung thay đổi/70 nội dung thay đổi)
▪ không phải thẩm định và phê duyệt bởi cơ quan quản lý nhà nước.
Số lần sửa chữa hồ sơ
▪ cơ sở chỉ được phép sửa đổi, bổ sung không quá 03 lần đối với các hồ sơ đề nghị cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
Cấu trúc SĐK thuốc
Gồm 12 chữ số:
▪ Mã nước SX: 3 chữ số (mã quốc gia)
▪ Mã nhóm thuốc: 1 chữ số (HD, DL, VX, SP,…)
▪ Mã phân loại thuốc kê đơn: 1 chữ số
▪ Mã PL thuốc KSĐB: 1 chữ số
▪ Mã thứ tự cấp: 4 chữ số
▪ Mã năm cấp: 2 chữ số
