










Preview text:
Ch ơng 4. LIÊN K T CÁC H NG NG T . C U T O VÀ TÍNH CH T
4.1. Đ i c ơng về tinh thể
4.1.1. Đặc tr ng về c u trúc a. Khái ni m
Nếu giả thiết các phần tử cấu tạo nên vật chất là các nguyên tử, ion hoặc phân tử,
thì tinh thể là trạng thái mà đó, các phần tử sắp xếp trong không gian tạo nên một quy
luật nào đó. Về mặt hình học, các phần tử cấu tạo được xem như những chất điểm, quy
luật c a những chất điểm này là tính đối x ng và hoàn toàn trong không gian tinh thể.
Do vậy, tinh thể thư ng nhận một hình thái nhất định dưới dạng một đa diện nào đó.
Khi làm nguội từ từ một dung dịch bão hòa hay một chất lỏng, chuyển động
nhiệt c a các hạt giảm, những phân tử, nguyên tử hay ion tập hợp lại và phân bố, sắp
xếp thành mạng lưới không gian với một cấu trúc xác định. Khi đó ta có một tinh thể,
hay quá trình này gọi là quá trình kết tinh.
Trong thực tế, các chất rắn tinh thể được tạo thành từ nhiều tinh thể rất nhỏ
(khoảng 10 – 20 µm) định hướng khác nhau. Các chất rắn như vậy gọi là đa tinh thể.
Với những tinh thể tạo nên chất rắn như một tinh thể duy nhất được gọi là đơn tinh thể. b. Tính ch t
- Tính bất đẳng hướng c a tinh thể: Trong tinh thể, các đơn vị cấu trúc liên kết với
nhau bằng những liên kết hóa học và được phân bố một cách tuần hoàn theo những
quy luật nhất định tạo thành một mạng lưới không gian đều đặn, mặc dù chúng có thể
đẳng hướng với một vài tính chất nào đó.
Ví dụ: Tinh thể muối ăn dạng lập phương, đẳng hướng về tính quang học,
nhưng dị hướng về nhiều tính chất như: tính cơ học, tính dẫn điện,... Tính
bất đẳng hướng thể hiện chỗ nhiều tính chất vật lý như độ bền cơ học, sự
khúc xạ ánh sáng, tính dẫn nhiệt, tính dẫn điện, độ c ng, tốc độ hòa tan,... có giá trị
khác nhau theo những hướng khác nhau.
- Lực hút giữa các hạt (nguyên tử, phân tử, ion) trong mọi trạng thái tinh thể luôn là lực hút tĩnh điện.
Ví dụ tinh thể cấu tạo từ các phân tử trung hòa điện thì sự định hướng tương đối
giữa chúng có thể liên quan tới sự có mặt c a lưỡng cực điện trong hạt.
- Tính định vị nhất định trong vùng không gian tinh thể: nhiệt độ thư ng, các phân
tử dao động quanh vị trí cân bằng với một biên độ nhất định, nhưng nhiệt độ càng
tăng, biên độ dao động càng lớn.
- Mỗi tinh thể trong quá trình kết tinh phụ thuộc vào các yếu tố sau:
+ Tính đối x ng: Thông thư ng một chất có thành phần hóa học càng đơn giản
thì mạng lưới tinh thể có tính đối x ng càng cao.
+ Tỷ lệ giữa bán kính các loại hạt trong mạng lưới. 54
+ Lực tương tác giữa các hạt (bao gồm độ mạnh, tính định hướng c a các mối
liên kết giữa các hạt).
+ Điều kiện bên ngoài (nhiệt độ, áp suất,...), đôi khi cũng ảnh hư ng đến cấu trúc c a tinh thể.
4.1.2. Các h tinh thể
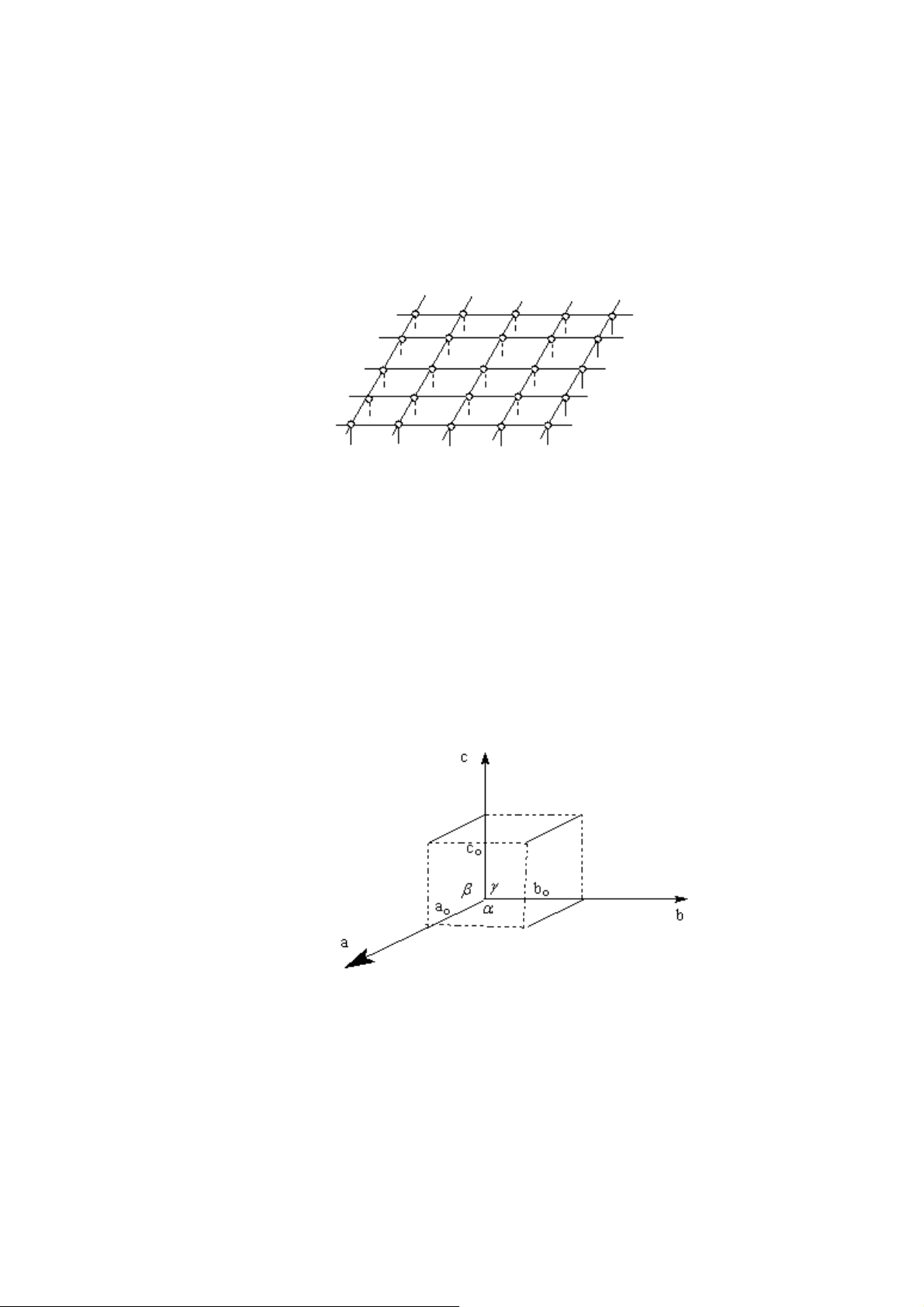
Mạng lưới tinh thể có thể coi như được cấu tạo b i những hình hộp mà đỉnh là
các cấu tử đồng nhất (nguyên tử, phân tử, ion).
Hình 21. Mạng lưới tinh thể
Một hình hộp đặc biệt gọi là tế bào sơ đẳng (hay ô mạng cơ s ) được xác định
bằng sự kết hợp một số điều kiện sau đây:
- Tế bào sơ đẳng phải có tính đối x ng cao.
- Số góc ô vuông phải nhiều nhất.
- Thể tích phải nhỏ nhất.
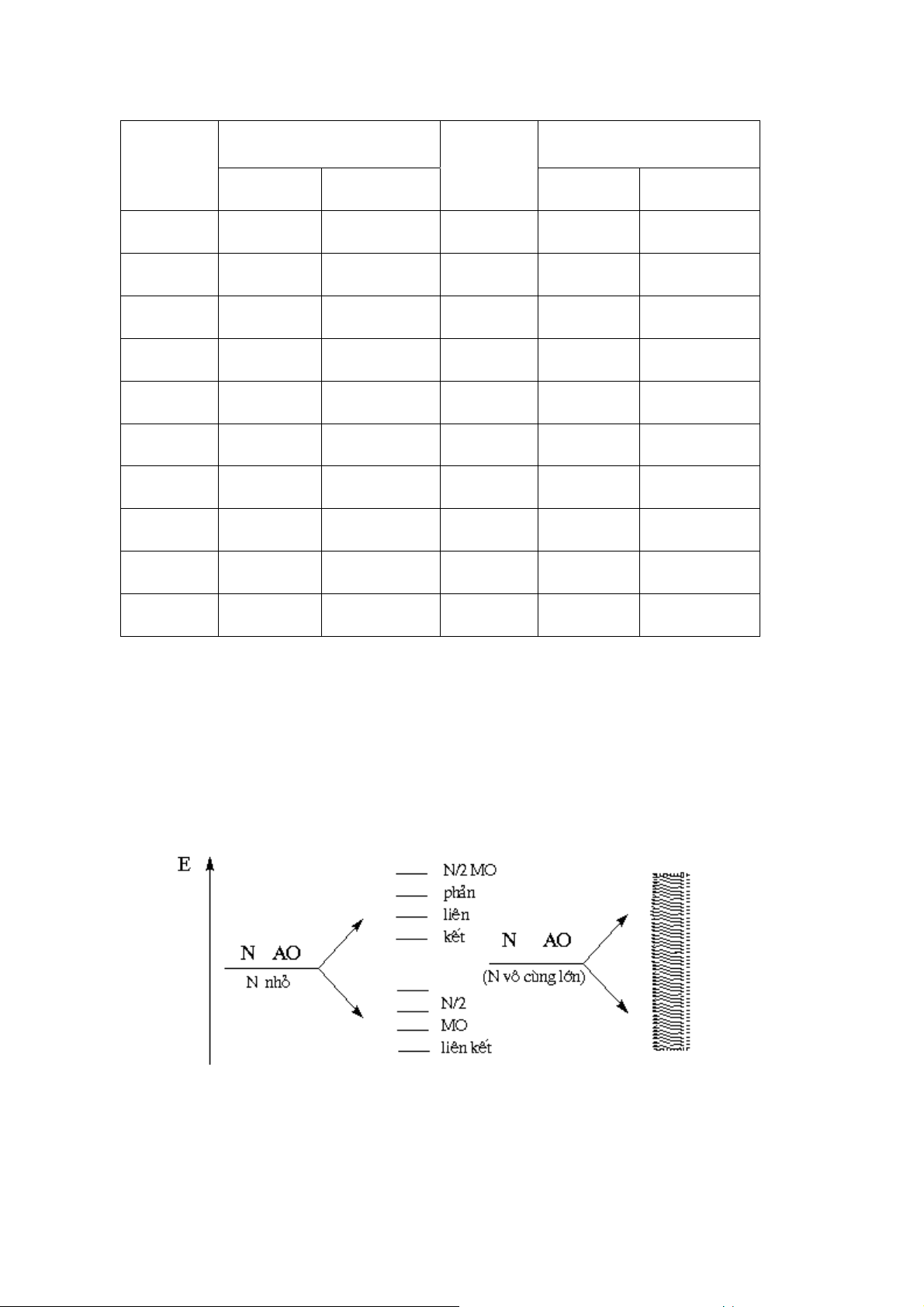
Trong tinh thể học, hệ thống tọa độ được chọn làm 3 trục đi qua một điểm mạng
và trùng với phương c a 3 cạnh c a tế bào sơ đẳng. Các trục a, b, c, các góc
α,β,γ ,cũng như các cạnh a0, b0, c0 c a tế bào sơ đẳng (được sử dụng làm đơn vị dài
ng với trục a, b, c) được quy định thống nhất như sau:
Hình 22. Tế bào sơ đẳng và hệ trục tọa độ qui ước Các cạnh a α β γ 0, b0, c0, các góc
, , , được gọi là hằng số mạng.
Có 7 hệ tinh thể: Hệ tam tà, hệ đơn tà, hệ trực thoi, hệ tam phương, hệ t
phương, hệ lục phương, hệ lập phương.
4.1.3. Các m ng l ới Brave (Bravais)
Trong ô mạng Brave được lựa chọn tuân theo nguyên tắc c a ô mạng cơ s ,
nghĩa là tính đối x ng c a nó được giữ nguyên như toàn mạng, số góc ô vuông nhiều
nhất và thể tích nhỏ nhất. 55
Sau đây là các mạng Brave: Tam tà Đơn tà T giác Trực giao Trực thoi Lập phương Lục giác
Hình 23. Mư i bốn mạng Brave Trong
mạng Brave có tính đối x ng cao nhất c a hệ tinh thể. Tuy nhiên tinh thể
thư ng có tính đối x ng thấp hơn. Trong mạng, ngoài các yếu tố đối x ng thông
thư ng, xuất hiện hàng loạt yếu tố đối x ng đặc trưng cho mạng không gian. Ngoài sự
đa dạng đó, trong cấu trúc tinh thể còn bắt gặp nhiều hiện tượng thể hiện chỗ vô số
yếu tố đối x ng cùng loại song song. 4.2.Tinh thể ion
4.2.1. Liên k t hóa học trong tinh thể ion
a. Khái quát mô hình ion và sự hình thành tinh thể ion * Mô hình ion đ
c hình thành trên cơ sở
- Tinh thể c a các chất mà nút mạng c a chúng được hình thành b i những cation và
anion hình cầu với một bán kính xác định.
- Lực tương tác giữa các ion trên nút mạng là lực hút tĩnh điện không định hướng.
* Sự hình thành tinh thể ion
Trong những tinh thể ion, các nguyên tử biến thành các ion dương hay âm xen
lẫn nhau, và sự cố kết này có được là do sự hút tĩnh điện gây nên. Khi đó các nút lưới 56
là do các ion dương hoặc âm lần lượt chiếm giữ, các ion này liên kết với nhau bằng liên kết ion.
Vì liên kết ion là loại liên kết bền không định hướng, không bảo hoà, nên mạng
lưới ion có đặc điểm:
+ Có độ bền cao, độ c ng cao.
+ Tuân theo nguyên lý sắp xếp đặc khít nhất.
+ Tính dẫn điện, dẫn nhiệt kém. Ví d :
Trong mạng tinh thể ion NaCl có số phối trí bằng 6. Ô mạng cơ s có dạng hình
lập phương. Các ion Na+ nằm tâm và trung điểm các cạnh hình lập phương, các ion
Cl- đỉnh và điểm giữa các mặt hình lập phương.
Nếu xem các ion các nút mạng như những quả cầu tiếp xúc với nhau thì đối
với mỗi ion ta sẽ tìm thấy một bán kính xác định và không đổi, khi ta chuyển từ trạng
thái chất này sang hợp chất khác.
Các cation có bán kính nhỏ hơn bán kính c a nguyên tử kim loại tương ng.
Các cation nói chung có bán kính ion nhỏ hơn so với các anion.
Các giá trị c a bán kính theo angstrom (A0): Cl- 1,81 Na+ 0,95 Na 1,92 I- 2,16 K+ 1,33 K 2,38 b. Năng l
ng m ng l ới h p ch t ion
Năng lượng mạng lưới c a một hợp chất ion kết tinh là năng lượng được giải
phóng trong quá trình hình thành một mol phân tử tinh thể từ những ion riêng rẽ (ký
hiệu là U, thư ng quy ước có dấu trừ). Ví dụ: NaCl. Uml = - 766kJ/mol.
Năng lượng mạng lưới quyết định độ bền, độ hòa tan và nhiều tính chất khác c a tinh thể.
Công th c thực nghiệm xác định năng lượng mạng lưới theo Booc – Lanđê (Born và Landé): 2 2 NAz e 1 U = − 1 ( − ) ml r n n-
hệ số đẩy Booc, được xác định từ tinh thể chịu nén c a ion Với NaCl, n = 9,1; LiF, n = 5,9; NaBr, n = 9,5 N - số Avogađro
A - hằng số Mađơlung, phụ thuộc cấu trúc mạng lưới tinh thể ; với NaCl, A = 1,748. 57
Công th c gần đúng xác định năng lượng mạng lưới theo Kapustinxki: z .z v 5 , 1071 . ∑ . c a U = − [kJ/mol] ml r + r c a
zc, za - số điện tích c a cation và anion.
rc, ra – bán kính c a cation và anion tính ta A0.
∑v - số ion trong đơn vị công th c. Với CaCl v = 2 thì ∑ . 3
4.2.2. C u trúc c a tinh thể ion Do tính không
định hướng c a lực hút tĩnh điện giữa các ion trong tinh thể ion,
nên cấu trúc tinh thể ion về căn bản là do sự tương quan giữa bán kính cation và anion quyết định.
Ví dụ: Trong tinh thể NaCl
Trong tinh thể NaCl, mỗi loại ion tạo thành một mạng lưới lập phương tâm
diện. Mỗi ion được bao quanh b i 6 ion khác dấu gần nhất nằm tại đỉnh c a hình bát
diện đều mà tâm là ion trên. Số phối trí là 6.
4.2.3. Tính ch t c a tinh thể ion
Tính chất các hợp chất ion phần nhiều được quyết định b i cấu trúc c a tinh thể
và lực tương tác giữa các ion trong tinh thể.
Các hợp chất ion có độ rắn, nhiệt độ nóng chảy, nhiệt độ sôi tương đối cao, độ
giãn n nhiệt cũng như độ chịu nén tương đối nhỏ. Yếu tố này là do lực tương tác tĩnh
điện giữa các ion tương đối lớn.
Hệ số giãn n nhiệt cũng phụ thuộc vào năng lượng mạng lưới ion: Hệ số giãn
n nhiệt càng lớn khi điện tích c a các ion càng nhỏ và khoảng cách giữa các ion càng lớn.
Ví dụ, khoảng cách giữa các ion tăng theo th tự NaF, NaCl, NaBr, NaI, nên hệ
số giãn n cũng tăng theo th tự trên. Các
hợp chất ion là những chất dẫn điện trạng thái nóng chảy: Các tinh thể
ion rắn và dòn hơn, độ dòn c a chúng là do khi ion d i chỗ thì lực đẩy c a các ion tích
điện cùng dấu bắt đầu thắng lực lực hút giữa các ion khác dấu, và tinh thể dễ bị phá
vỡ. Vì vậy trạng thái rắn, các ion không có tính dẫn điện. 58
Bảng 4. Nhiệt độ nóng chảy các tinh thể ion (0C) Cation Anion Li+ Na+ F- 848 995 Cl- 610 800 Br- 550 750 I- 449 662 OH- 473 321 S2- - 1180 O2- 1570 - − ΝΟ 220 283 2
Nhiệt độ nóng chảy cao, cho thấy các hợp chất ion có năng lượng lớn.
4.3. Tinh thể kim lo i
4.3.1. Liên k t hóa học trong tinh thể kim lo i
a. Mô hình “khí electron” c a Đruđơ và Loren (Drude, Lorentz)
Theo mô hình này, các electron có khả năng tách khỏi nguyên tử và di động
tương đối tự do trong nguyên tử tạo thành một đám “khí electron”. Sự tương tác giữa
“khí electron” này với ion dương kim loại các nút mạng là nguyên nhân c a lực liên kết kim loại.
Dựa trên mô hình này, ta có thể giải thích một số tính chất vật lý c a kim loại
như: tính dẫn nhiệt, dẫn điện, tính c ng, khả năng hấp thụ và phản xạ ánh sáng,...
Tuy nhiên với mô hình trên, khó khăn trong việc giải thích nhiệt dung c a kim loại.
J/(kg K) = 2.389x10-4 kcal/(kg oC)
1 kJ/(kg K) = 0.2389 kcal/(kg oC)
1 kcal/(kg oC) = 4,186.8 J/ (kg K)
Theo thuyết động học của chất khí, trong tinh thể kim loại, các electron tự do
phải có phần đóng góp vào nhiệt dung chung của tinh thể kim loại là 3/2R (R - hằng
số khí = 8,3144J/mol.K = 1,98 cal/mol.K). Điều này mâu thuẫn với kết quả thực
nghiệm là phần đóng góp của “các khí electron” là không đáng kể. 59
Bảng 5. Nhiệt dung cụ thể c a một số kim loại thông thư ng Nhiệt dung riêng Nhiệt dung riêng c a kim loại - cp c a kim loại - cp Kim loại Kim loại (kJ/kg K) (kcal/kgoC) (kJ/kg K) (kcal/kgoC) K 0.75 0.180 Pt 0.13 0.032 Be 1.83 0.436 Cd 0.23 0.055 Al 0.91 0.22 Cr 0.46 0.11 Se 0.32 0.077 Co 0.42 0.1 Mg 1.05 0.243 Bi 0.13 0.03 Sb 0.21 0.05 Cd 0.23 0.055 Cu 0.39 0.092 Au 0.13 0.031 Mn 0.48 0.114 Fe 0.46 0.108 Hg 0.14 0.033 Pb 0.13 0.031 Mo 0.25 0.06 Ni 0.54 0.106
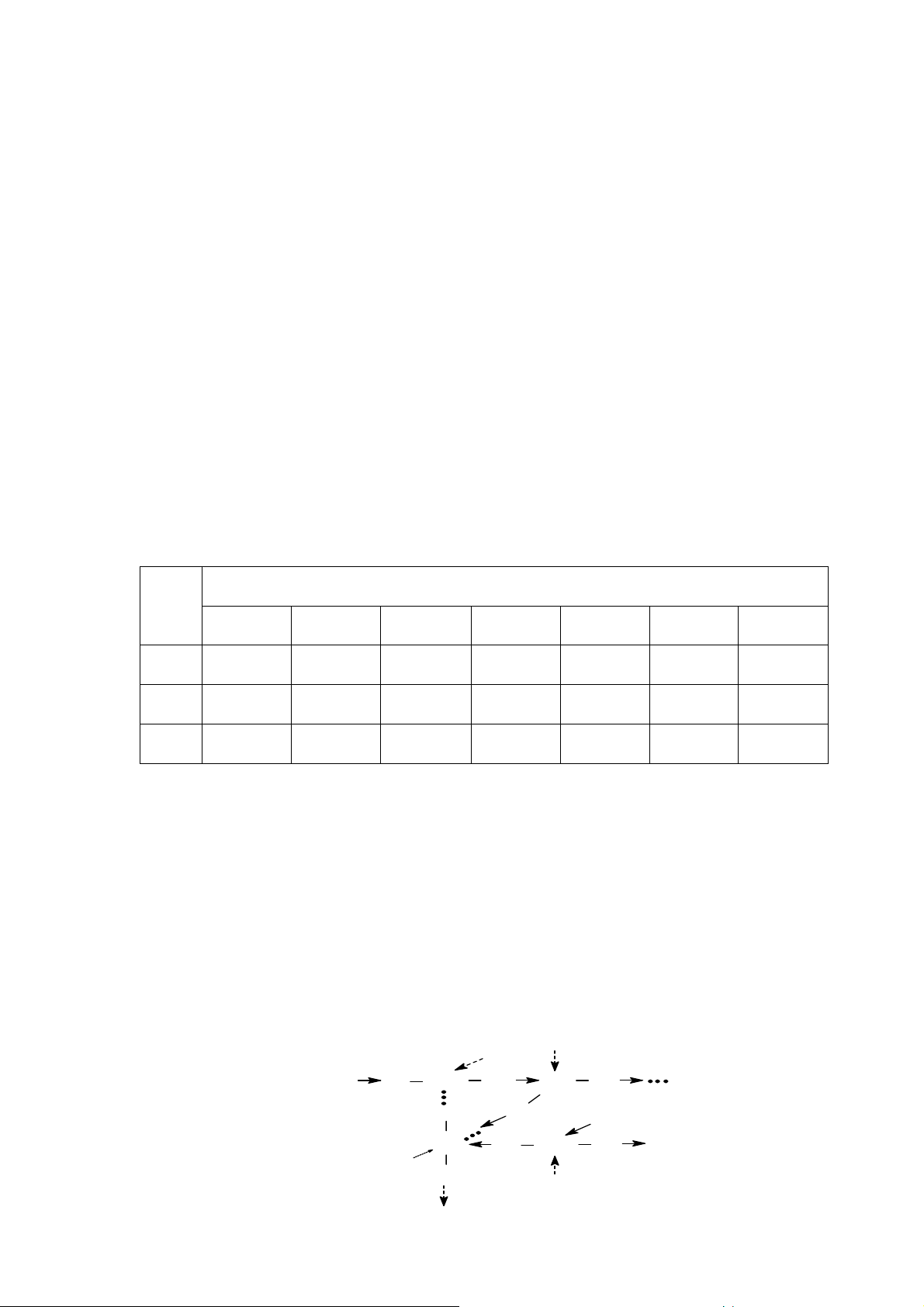
b. Mô hình d i năng l ng
Mô hình này dựa trên cơ s về electron không định cư (t c là electron chuyển
động trên các MO chung c a toàn phân tử). Trên cơ s này, thuyết MO thích hợp trong
việc mô tả liên kết kim loại. Các
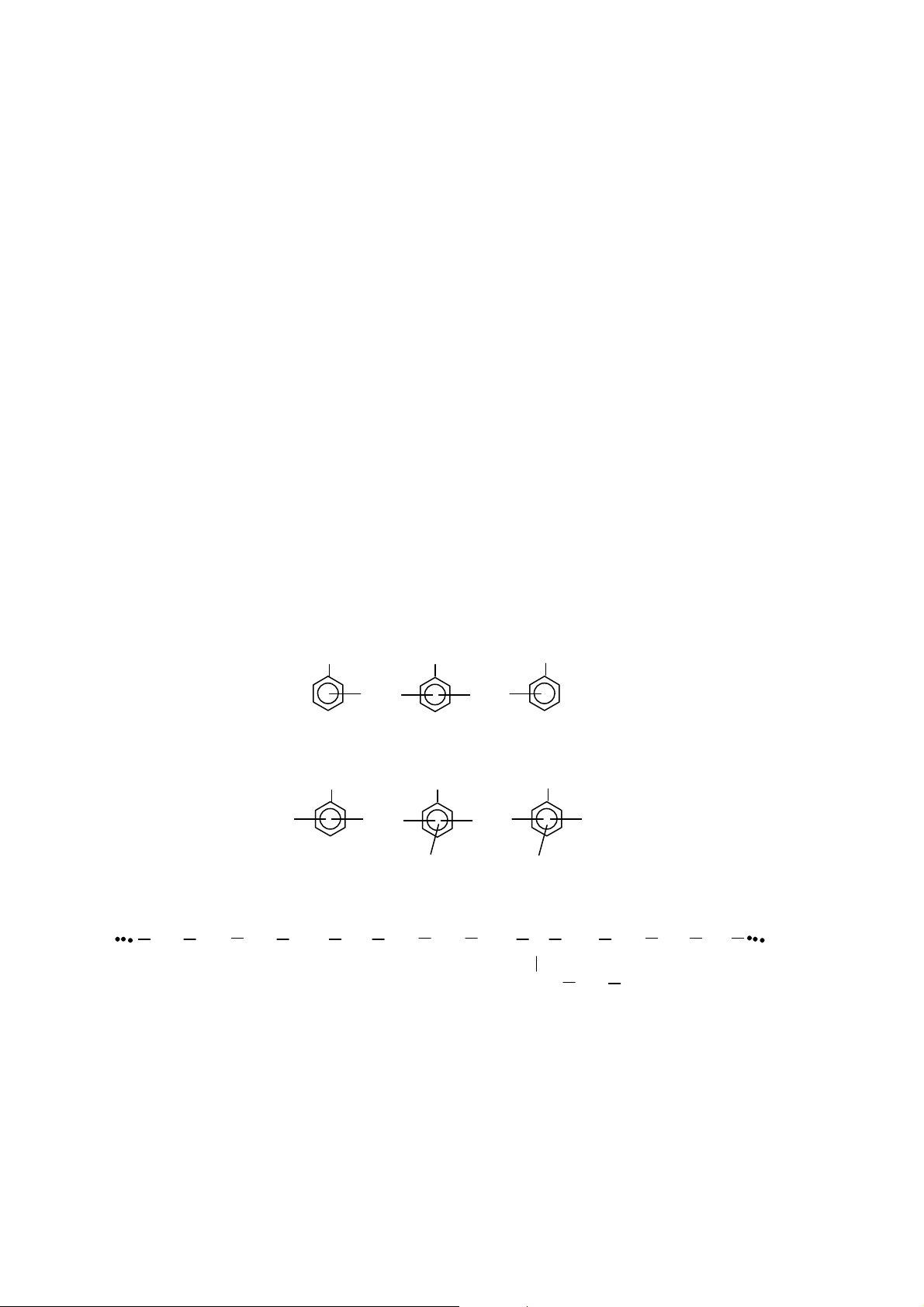
trạng thái electron đây cũng được hình dung như các trạng thái electron
π không định cư trong phân tử benzen hay trong các hệ electron π không định cư
trong phân tử có hệ liên kết liên hợp.
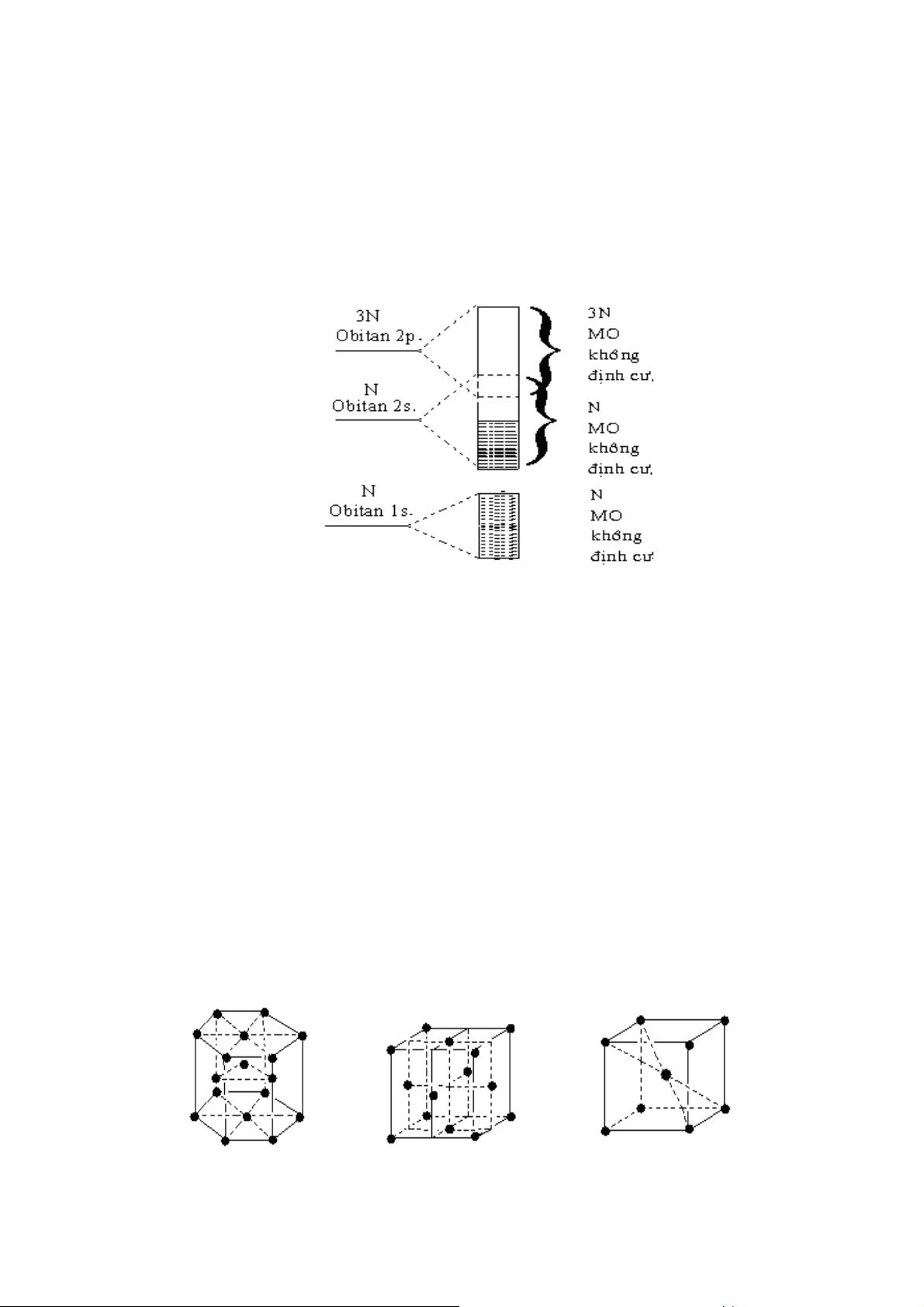
Hình 24. Sự hình thành dải năng lượng c a MO không định cư
Giải thích theo mô hình trên:
- Đối với phân tử có sự tổ hợp c a N obitan nguyên tử sẽ cho N/2 MO liên kết
và N/2 MO phản liên kết với các m c năng lượng r i rạc, gián đoạn. 60
- Trong tinh thể kim loại, số nguyên tử vô cùng lớn, nên số AO cũng vô cùng
lớn. Vì vậy, sự tổ hợp các AO này cũng cho một số vô cùng lớn các MO, và như thế
hiệu các m c năng lượng sẽ vô cùng nhỏ. Khi đó sự phân bố m c năng lượng gần như
liên tục và tập hợp các m c năng lượng nằm sát nhau được gọi là dải năng lượng.
- Khi hiệu năng lượng giữa các m c phản liên kết thấp nhất và các m c liên kết
cao nhất càng nhỏ trên nguyên tử trong tinh thể kim loại thì sẽ xảy ra sự xen ph các dải năng lượng. Ví dụ:
Hình 25. Dải năng lượng đối với tinh thể Li
4.3.2. C u trúc trong tinh thể kim lo i
Trong tinh thể kim loại thư ng mỗi nguyên tử hay ion kim loại được bao bọc
b i 12 hay 8 nguyên tử cùng loại (số phối trí bằng 8 hoặc 12). Các ion hoặc nguyên tử
kim loại trong mạng lưới liên kết với nhau nh các mây electron tự do không định chỗ
và không cố định vào một nguyên tử nào.
Trong tinh thể kim loại các nguyên tử kim loại nằm cạnh nhau nh “mây
electron hoá trị” xen ph lẫn nhau, nên mỗi electron hoá trị sẽ chịu tác dụng đồng th i
điện trư ng c a nhiều nguyên tử. Vì vậy electron hoá trị có thể chuyển từ nguyên tử
này sang nguyên tử khác mà không cần tiêu thụ năng lượng. Đó là những electron tự do trong tinh thể.
Các nguyên tử kim loại được sắp xếp một cách khít nhất ng với một số phối trí
cực đại. Vì các nguyên tử kim loại được coi là hình cầu, nên cách sắp xếp này được
coi là cách sắp xếp một quả cầu khít nhất.
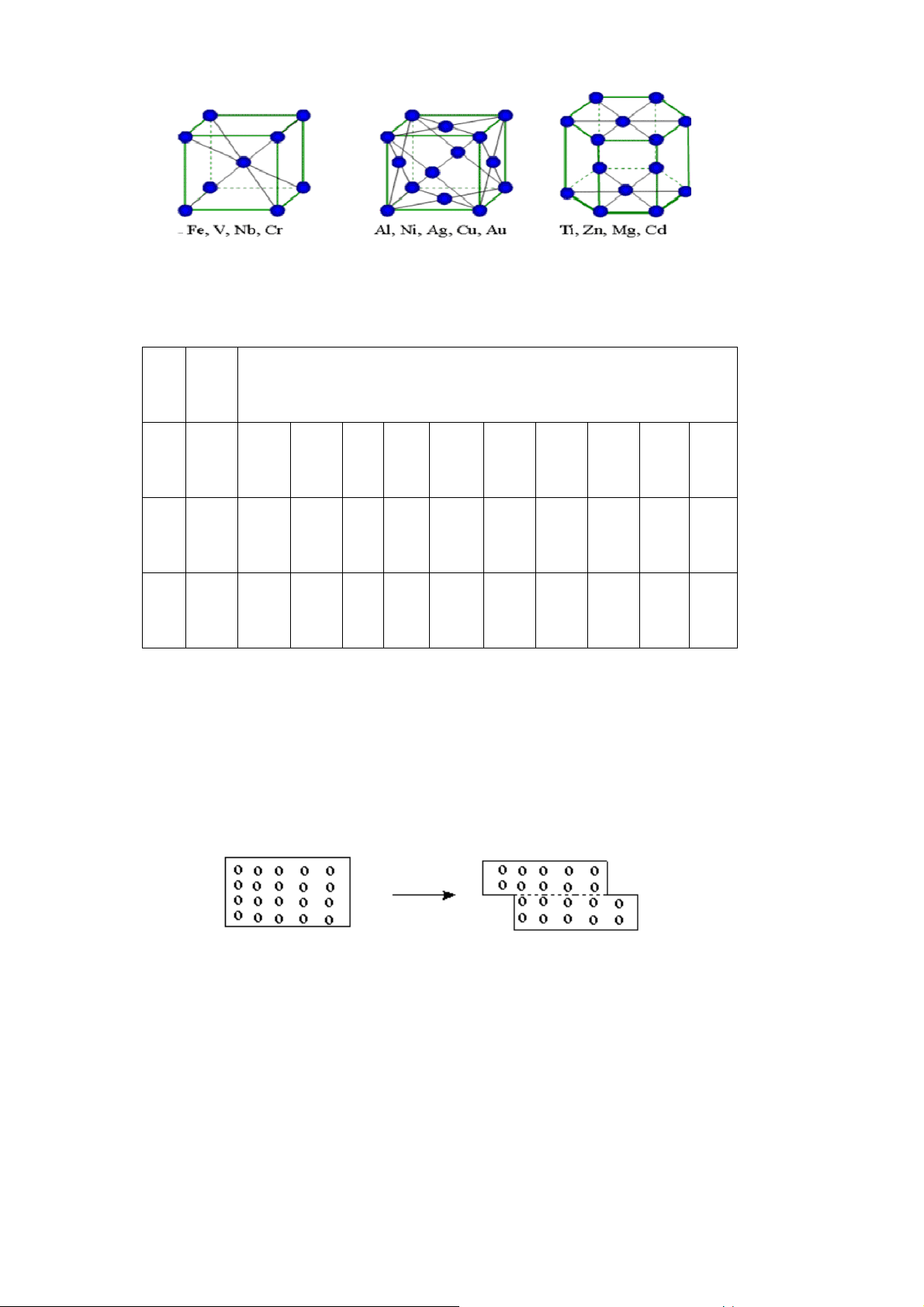
Ba kiểu mạng tinh thể c a hầu hết kim loại là: lục phương, lập phương tâm diện
và lập phương tâm khối.
Lục phương, Lập phương tâm diện Lập phương tâm khối.
Hình 26. Các kiểu mạng tinh thể kim loại 61
Hình 27. Một số dạng cấu trúc tinh thể trạng thái cơ bản
Bảng 6. Kiến trúc tinh thể c a các kim loại: Li Be 3 2 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn 3 1,2 1,2 2,3 3 3 - 1,3 1,2 1,2 1 2 Rb Sr Y Zr Nb Mo Te Ru Rh Pd Ag Cd 3 1 2 2,3 3 2,3 2 1,2 1 1 1 2 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg 3 3 1,2 2,3 3 3 2 1,2 1 1 1 -
Trong đó: Số 1- Chỉ mạng lưới lập phương tâm diện;
Số 2- Chỉ mạng lưới lục phương;
Số 3- Chỉ mạng lưới lập phương tâm khối;
4.3.3. Tính ch t c a kim lo i Tinh
thể kim loại có những tính chất đặc biệt như: khả năng biến dạng đàn hồi,
dễ dẫn điện, dẫn nhiệt, ánh kim,…
Hình 28. Sự biến dạng không đàn hồi c a kim loại Giải thích:
- Khả năng biến dạng c a kim loại được giải thích b i tính không định hướng c a lực
liên kết và tính đồng nhất c a các cấu tử. Khi xẩy ra biến dạng có sự trượt c a các mặt lưới so với nhau.
- Mặc dù trên các MO đã bão hòa, thì sự chuyển động c a electron không tuân theo
một phương xác định. Nhưng theo mô hình dải năng lượng thì trong mạng tinh thể kim
loại luôn tồn tại những MO tự do (không có electron), có m c măng lượng gần với các
MO bão hòa electron. Do đó, khi có sự tương tác c a điện trư ng ngoài, các electron 62
dễ chuyển lên các MO tự do và từ đó có sự di chuyển electron theo phương c a điện
trư ng ngoài. Đó là nguyên nhân c a tính dẫn điện c a kim loại.
- Kim loại có điện tr nhỏ, điện tr kim loại là hệ quả sự khuếch tán c a electron khi gặp ion dao động.
- Khả năng biến dạng c a kim loại cho phép những nguyên tử chiếm vị trí mới mà
không làm đ t liên kết. Cũng do nguyên nhân này mà kim loại điển hình có nhiệt độ nóng chảy thấp.
4.4. Tinh thể nguyên tử
4.4.1. Liên k t hóa học trong tinh thể nguyên tử
Trong tinh thể nguyên tử, các cấu tử là những nguyên tử, liên kết với nhau bằng
liên kết cộng hóa trị. Vì vậy tinh thể nguyên tử còn được gọi là tinh thể cộng hóa trị.
Ví dụ: kim cương, than chì, Sn, Ge, BN, GaAs,...
Số phối trí c a nguyên tử trong tinh thể nguyên tử thư ng có giá trị từ 1 – 8.
Đối với đơn chất trạng thái tinh thể, số phối trí thư ng bằng 8 trừ số th tự c a nhóm
nguyên tố đó. Điều này được giải thích b i quy tắc bát tử. Khi đó, hệ điện tử thuận lợi về mặt năng lượng.
Bảng 7. Chỉ số phố trí c a một số nguyên tố Chu
Số phối trí các nguyên tố các nhóm kỳ I II III IV V VI VII 2 Li – 8 Be – 12 B – 5(7) C – 4 N – 1 O – 1 F – 1 3 Na – 8 Mg – 12 Al – 12 Si – 4 P – 3 S – 2 Cl – 1 4 K – 8 Ca – 12 Ga – 1 Ge – 4 As – 3 Se – 2 Br – 1
Sn (dạng α ): Thiết “xám’dạng bột; còn với thiết “trắng”(dạng β ) có cấu trúc hình bát diện.
Một số hợp chất AB tạo thành tinh thể kiểu nguyên tử, khi tổng số điện tử hóa trị
c a A và B bằng 8. Thoả mãn điều kiện này có các hợp chất c a các nguyên tố thuộc
nhóm I và VII (như CuCl); II và VI (như ZnS); III và V (như BN) và IV (như SiC).
Cần chú ý rằng, nguyên tử các nguyên tố nhóm IA và một phần IIA do có độ âm
điện thấp, nên chúng dễ dàng ion hóa tạo thành tinh thể ion.
Nhiều chất có khả năng tạo thành tinh thể nguyên tử nh các liên kết cho -
nhận, các liên kết này xuất hiện giữa những nguyên tử khác nhau c a các phân tử riêng
biệt khi chất chuyển sang trạng thái rắn. Chẳng hạn với BeF2: F B e F B e F F F B e F B e F F 63
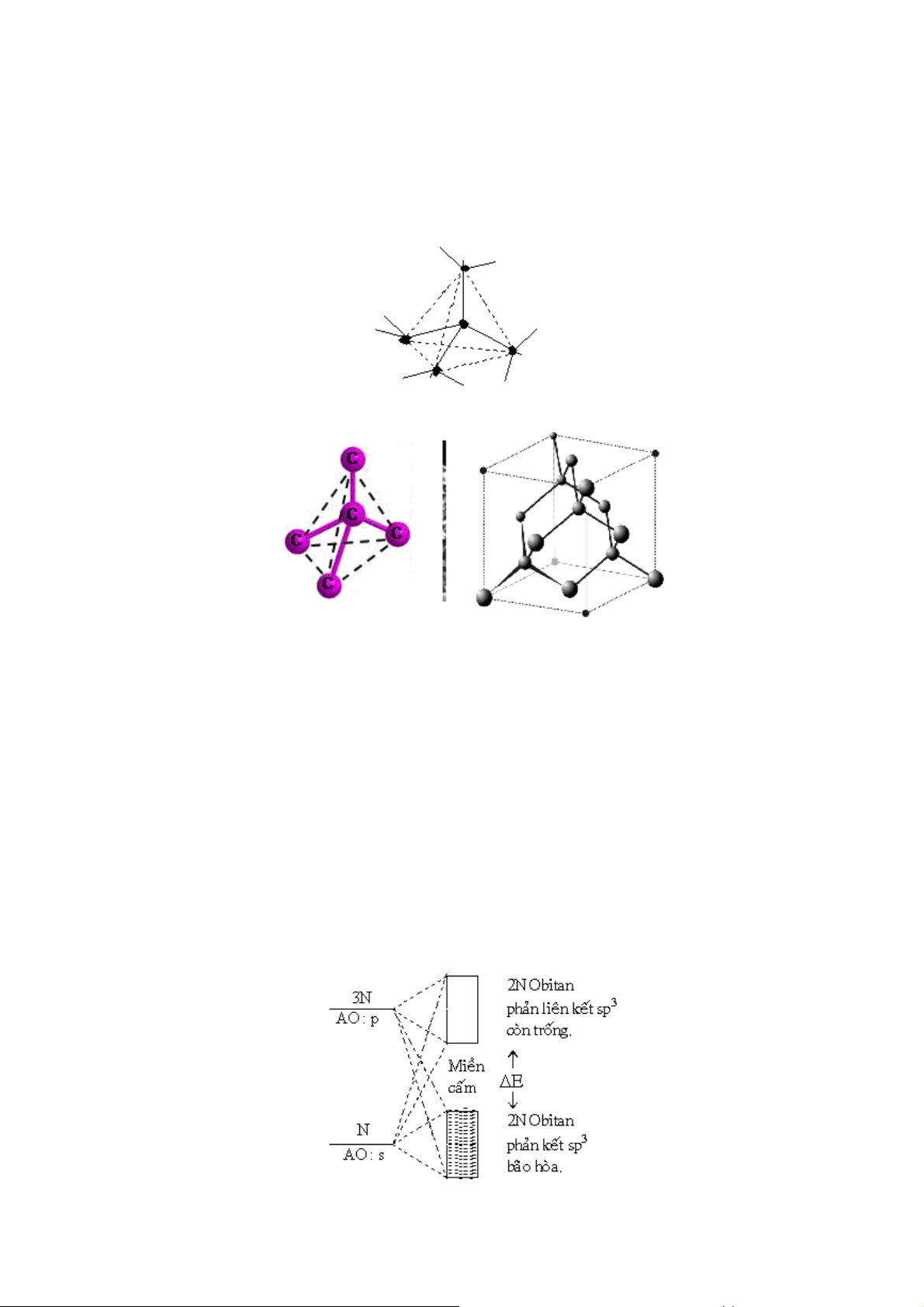
4.4.2. C u trúc m ng l ới kim c ơng
Tinh thể kim cương có cấu trúc t diện. Các nguyên tử cacbon nằm tâm và
đỉnh c a t diện đều liên kết với nhau bằng liên kết cộng hoá trị. Khoảng cách C – C
bằng 1,54A0, khoảng cách này bằng khoảng cách C – C c a hidrocacbon no. Cấu trúc
này được lặp lại trong toàn bộ tinh thể kim cương. Vì mỗi nguyên tử cacbon liên kết
với 4 nguyên tử cacbon gần nhất nên kim cương có rất nhiều tính chất riêng.
Các liên kết C – C trong tinh thể kim cương
Hình 29. Cấu trúc tinh thể kim cương
Khối lượng riêng c a kim cương là 3,52 g/cm³
4.4.3. Tính ch t c a tinh thể nguyên tử Độ rắn lớn,
Nhiệt độ nóng chảy và nhiệt độ sôi cao, độ c ng cao.
Chúng là chất cách điện hay bán dẫn.
Không luôn luôn tuân theo triệt để nguyên lý sắp xếp đặc khít nhất, vì các
nguyên tử phải sắp xếp phù hợp với phương liên kết.
4.4.4. Ch t cách đi n, ch t bán dẫn
Tính dẫn điện c a kim loại, chất bán dẫn và chất cách điện đều có thể được giải
thích trên cơ s mô hình dải năng lượng.
Hình 30. Dải năng lượng đối với tinh thể cộng hóa trị 64
Vùng hóa trị: Là vùng có năng lượng thấp nhất theo thang năng lượng, là vùng
mà điện tử bị liên kết mạnh với nguyên tử và không linh động.
Vùng dẫn: Vùng có m c năng lượng cao nhất, là vùng mà điện tử sẽ linh động
(như các điện tử tự do) và điện tử vùng này sẽ là điện tử dẫn, có nghĩa là chất sẽ có
khả năng dẫn điện khi có điện tử tồn tại trên vùng dẫn. Tính dẫn điện tăng khi mật độ
điện tử trên vùng dẫn tăng.
Vùng cấm (hay miền cấm): Là vùng nằm giữa vùng hóa trị và vùng dẫn, không
có m c năng lượng nào và do đó điện tử không thể tồn tại trên vùng cấm.
Đối với tinh thể cộng hóa trị (chẳng hạn tinh thể kim cương), các dải năng
lượng ng với MO liên kết và dải phản liên kết (dải dẫn điện) nằm cách biệt nhau (b i
giá trị ΔΕ ). Với chất bán dẫn hay chất cách điện thì dải hóa trị hoàn toàn bảo hòa
electron, trong khi đó dải dẫn điện hoàn toàn còn trống (theo giản đồ trên).
Khi electron chuyển từ vùng MO lên vùng MO*, thì trong dải dẫn điện mới
chuyển động tự do dưới tác dụng c a điện trư ng ngoài. Khác
với kim loại, các tinh thể cộng hoá trị do có có miền “cấm”, nên sự dịch
chuyển electron lên các MO* đòi hỏi phải tiêu tốn một năng lượng nhất định là ΔΕ . Vì
vậy, một chất sẽ là chất cách điện, khi miền “cấm” quá rộng kể cả khi có sự
tương tác c a năng lượng điện, điện từ. Lúc này các electron không thể chuyển động lên miền dẫn. Trong
th c tế, điều kiện thư ng, một chất được coi là chất cách điện, khi độ
rộng c a miền “cấm” có giá trị vào khoảng 3eV. Với chất bán dẫn thì độ rộng c a
miền “cấm” nhỏ hơn.
Bảng 8. Độ rộng c a miền “cấm” c a một số nguyên tố Tinh thể Kim cương Si Ge Sn (dạng α ) ΔΕ [eV] 6,00 1,10 0,70 0,08
Từ bảng trên ta thấy, kim cương là chất cách điện, các tinh thể trên là chất bán dẫn.
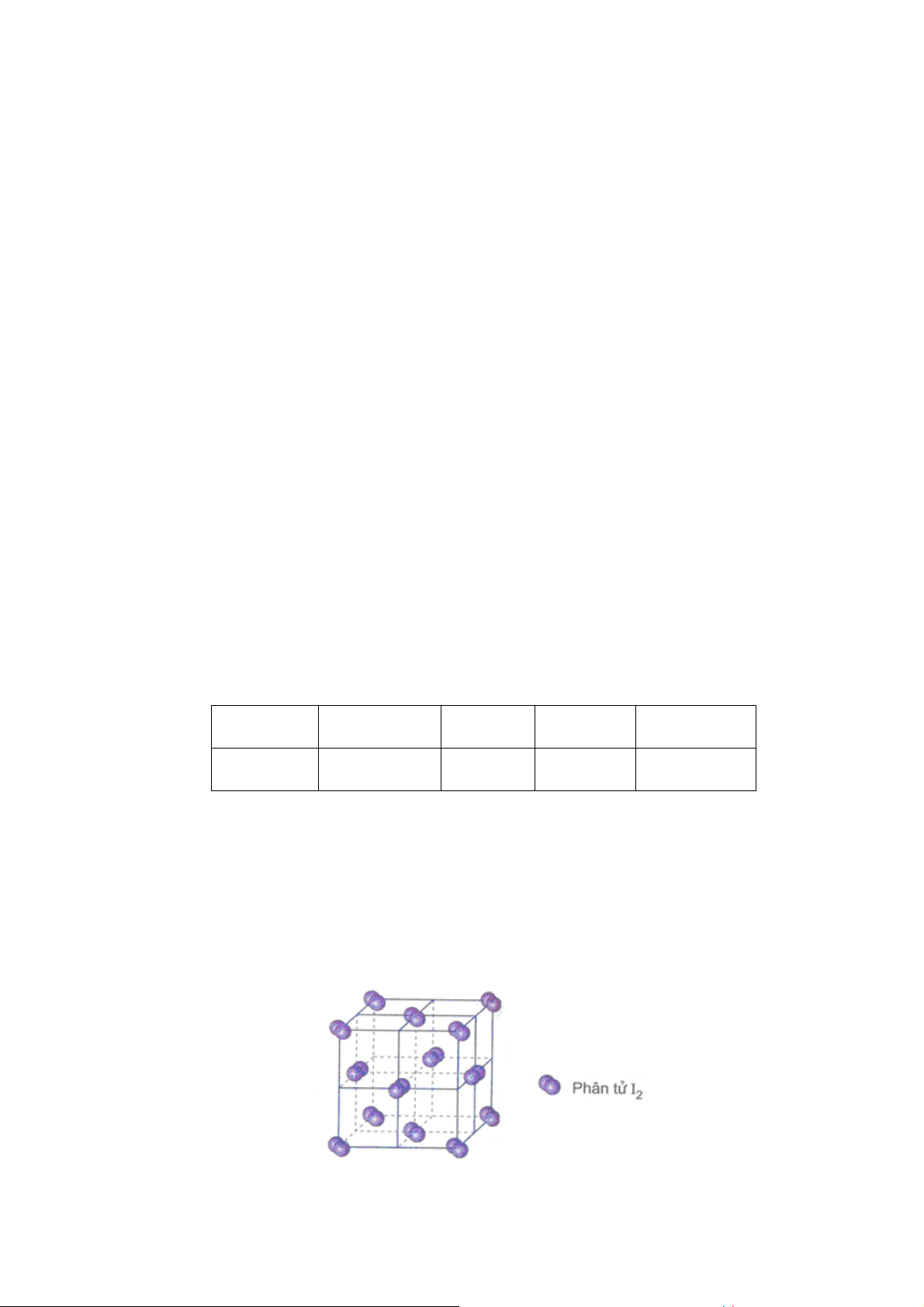
4.5. Tinh thể phân tử
4.5.1. Liên k t hóa học trong tinh thể phân tử Trong tinh
thể phân tử, mạng lưới không gian được cấu tạo b i các phân tử như
CO2, I2, H2O, N2,... cũng như nguyên tử c a các khí trơ.
Hình 31. Mô hình tinh thể phân tử c a iôt 65
4.5.2. C u trúc c a tinh thể phân tử
Những tinh thể c a các khí trơ là những tinh thể phân tử đơn giản nhất về mặt
cấu trúc. Vì phân tử c a khí trơ là phân tử đơn nguyên tử, nên cấu tử c a tinh thể là
nguyên tử hình cầu. Lực tương tác đây chỉ là lực khuếch tán không định hướng.
Những tinh thể phân tử thư ng gặp nhất là tinh thể c a các hợp chất hữu cơ.
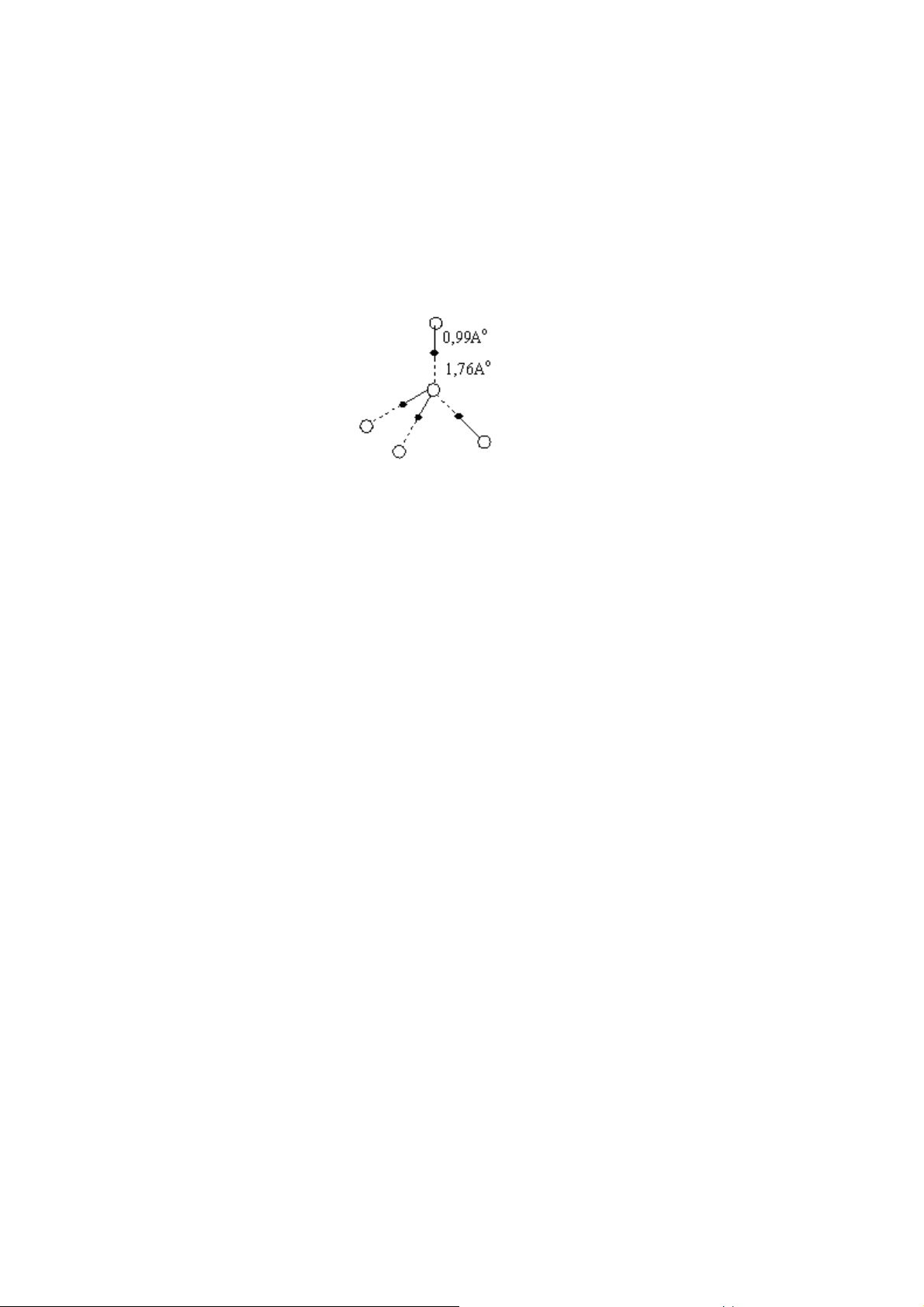
Do có sự tham gia c a liên kết cầu nối hiđro nên nước đá có cấu trúc t diện.
Cấu trúc này có độ xốp lớn nghĩa là có tỷ khối nhỏ. Vì vậy OoC, nước đá nhẹ hơn nước.
Hình 32. Cấu trúc t diện c nước đá
Mỗi phân tử nước có khả năng tạo 4 mối liên kết hiđro với 4 phân tử khác nằm
chung quanh và hình thành cách sắp xếp kiểu t diện trong nước đá.
Sự bền hóa cấu trúc của nước đá có thể xảy ra không những do có mặt các ion
lỗ trống của nó, mà còn do đưa thêm vào những phân tử tạo được liên kết hiđro với
các phân tử nước. Đồng thời cấu trúc của nước được làm bền, khi nước còn nằm ở
trạng thái lỏng và khi trộn lẫn nó với chất khác.
4.5.3. Tính ch t c a tinh thể phân tử. Tinh
thể phân tử có độ c ng nhỏ, vì năng lượng tương tác giữa các phân tử có
giá trị nhỏ (liên kết b i lực van de van - lực này yếu hơn so với liên kết hóa học), nên
nhiệt độ nóng chảy c a chúng thấp.
Các tinh thể phân tử tan tốt, nhưng sự lựa chọn các dung môi phụ thuộc vào bản
chất c a các chất, mà trước hết vào độ phân cực giữa chúng và khả năng hình thành liên kết hiđro.
Các tinh thể phân tử dòn, độ c ng thấp, chúng không có tính dẫn điện (trừ
những cấu trúc kiểu grafít ch a hệ thống chung liên kết pi không định chỗ).
4.6. Ch t rắn vô định hình, tinh thể lỏng và tr ng thái lỏng
4.6.1. Ch t rắn vô định hình
Chất rắn vô định hình là những chất rắn mà về cấu trúc vi mô không có sự phân
bố một cách tuần hoàn đều đặn các cấu tử cơ bản trong toàn khối chất rắn. Ví
dụ: Th y tinh, cao su, nhựa,…
Các chất rắn vô định hình thông thư ng được sản xuất khi một chất lỏng đ độ
nhớt bị làm lạnh rất nhanh, vì thế không có đ th i gian để các mắt lưới tinh thể thông
thư ng có thể tạo thành.
Chất rắn vô định hình có tính đẳng hướng, nghĩa là những tính chất vật lý như:
điện tr , độ dẫn điện,.. đều giống nhau theo mỗi hướng. 66
Chất rắn vô định hình không có nhiệt độ nóng chảy xác định. Khi nhiệt độ tăng,
tính linh động c a các hạt tăng theo và chất rắn vô định hình chuyển sang trạng thái
lỏng. Suốt trong quá trình nóng chảy, nhiệt độ luôn thay đổi.
Trong những điều kiện khác nhau, khi chuyển từ trạng thái nóng chảy sang
trạng thái rắn, nhiều đơn chất như Se, S, P, cũng như nhiều hợp chất như, (đặc biệt là
các oxit SiO2, GeO2, As2O3,…) có thể tồn tại dạng tinh thể hay dạng vô định hình.
Chẳng hạn như cao su, th y tinh.
Do nhiều hiệu ng khác nhau, sự kết tinh có thể bị cản tr và khi làm lạnh dưới
nhiệt độ kết tinh, chất nóng chảy chuyển thành chất lỏng quá lạnh.
Đối với nhiều chất trong điều kiện quá lạnh, tại một khoảng nhiệt độ quá lạnh,
tại một khoảng nhiệt độ xác định, độ nhớt tăng nhanh dẫn đến sự ngừng hoàn toàn c a
chuyển động tịnh tiến và ta có trạng thái th y tinh. Về mặt cấu trúc, khi tạo thành th y
tinh, các t diện [SiO4]4- trong pha lỏng không chuyển về dạng trật tự, mà tồn tại trong
chất rắn một cách không trật tự, hay vô dịnh hình.
Th y tinh là một chất rắn vô định hình đồng nhất, có gốc silicát (SiO2), thư ng
được pha trộn thêm các tạp chất để có tính chất theo ý muốn. Th y tinh thuần SiO2
(còn gọi là th y tinh thạch anh). Có hai hợp chất thông thư ng hay được bổ sung vào
cát trong công nghệ nấu th y tinh nhằm giảm nhiệt độ nóng chảy c a nó xuống khoảng
1.000 °C. Một trong số đó là sô đa (cacbonat natri Na2CO3), hay bồ tạt (t c cacbonat
kali K2CO3). Th y tinh được sử dụng rộng rãi trong xây đựng, làm đồ ch a (chai, lọ,
cốc, chén, ly, tách,… v.v) hay vật liệu trang trí.
4.6.2. Tinh thể lỏng
Tinh thể lỏng là các chất lỏng hữu cơ có trật tự cấu trúc. Tinh thể lỏng chiếm vị
trí trung gian giữa chất lỏng và chất rắn. Do tương tác đặc biệt, giữa các phần tử cấu
tạo tinh thể lỏng có sắp xếp theo trật tự nhất định, thể hiện tính dị hướng như tinh thể,
nhưng chúng lại có độ linh động như chất lỏng.
Một số tinh thể lỏng (trung gian giữa tinh thể và vô định hình), ngay cả th y
tinh cũng thể hiện tính dị hướng nhưng dị hướng gián đoạn chỉ có chất kết tinh.
Một số hợp chất hữu cơ có thể tồn tại trạng thái tinh thể lỏng. Khi nóng chảy,
các chất này tr thành tr thành một chất lỏng đục. Khi tiếp tục đun nóng, thì tại một
nhiệt độ nhất định, chất lỏng này tr nên trong suốt và đồng th i cũng tr nên đẳng
hướng về tính chiết quang.
mạng lưới tinh thể, các phân tử c a các hợp chất trên định hướng song song
với nhau. Khi nóng chảy, chúng có khả năng chuyển động tự do, tuy nhiên khi đó vẫn
tồn tại những ổ gồm hàng triệu phân tử mà trong đó vẫn còn sự định hướng song song
c a các phân tử. Sự tương tác giữa ánh sáng và các khu vực đó với một sự phân bố có
trật tự và gây nên hiện tượng chiết quang kép.
Chuyển động tịnh tiến tăng cùng với sự tăng c a nhiệt độ và tại nhiệt độ nhất
định, trật tự trong các “ổ” phân tử bị phá vỡ. Tại nhiệt độ này, hợp chất trên chuyển từ
trạng thái tinh thể lỏng sang trạng thái đẳng hướng bình thư ng.
Điều kiện cần thiết c a việc xuất hiện trạng thái tinh thể lỏng là phân tử c a hợp
chất phải có một dạng thích hợp (mạch dài) và phải có một momen lưỡng cực vĩnh cửu 67
hay momen cảm ng. Với điều kiện này, các phân tử mới có khả năng tương tác với
các phân tử bên cạnh và dẫn đến sự định hướng song song c a chúng.
4.6.3. Tr ng thái lỏng a. Khái ni m
Khi làm nguội các chất trạng thái khí, hay nén các chất khí thật mạnh, lực tương
tác giữa các phân tử bắt đầu trội hơn năng lượng chuyển động c a chúng, và nhiệt độ
xác định (riêng cho từng chất), chất khí chuyển qua trạng thái lỏng.
Chất lỏng là một trạng thái vật chất khá phổ biến, mà các phân tử cấu tạo nên nó
có liên kết không chặt so với liên kết rắn và có hình dạng phụ thuộc vào vật ch a nó.
b. Liên k t trong ch t lỏng
Lực liên kết trong chất lỏng được quyết định b i cấu tạo hình học và cấu tạo
electron c a nguyên tử hay phân tử trong chất lỏng. Tùy theo sự liên kết hóa học giữa
các phân tử, ngư i ta phân biệt chất lỏng có cực hay không có cực (μ = 0) .
Khi kim loại trạng thái lỏng, lực liên kết giữa các nguyên tử là lực liên kết
kim loại. Mà bản chất c a liên kết kim loại là liên kết không có hướng, nên có thể cho
phép các nguyên tử liên kết thay đổi vị trí c a mình mà không cần phải b t đ t. Vì vậy
kim loại điển hình phải có điểm nóng chảy thấp và điểm sôi cao. Nghĩa là trạng thái
lỏng c a kim loại phải ng với một khoảng nhiệt độ rộng. Ví
dụ, Gali là chất lỏng nhiệt độ từ 32 – 22400C. Nhưng đa số kim loại, đặc
biệt là các nguyên tố d, thì giữa các nguyên tử ngoài việc xuất hiện liên kết kim loại
còn xuất hiện liên kết nguyên tử (liên kết có hướng trong không gian), dẫn đến sự tăng
mạnh nhiệt độ nóng chảy c a chúng.
Với muối chảy lỏng, thì lực liên kết giữa cation và anion là tương tác tĩnh điện giống tinh thể ion. Khi
trạng thái nóng chảy, thể tích chất lỏng thư ng chỉ thay đổi 10% so với
ban đầu. Điều đó có nghĩa là khoảng cách giữa các cấu tử chỉ biến thiên khoảng vài
phần trăm (do có sự bay hơi).
c. C u trúc c a ch t lỏng
Kết quả nghiên c u cho thấy chất lỏng tồn tại những nhóm phân tử mà trong đó
các phân tử cũng được phân bố theo một trật tự nào đó, được gọi là trật tự gần. Tuy
nhiên các nhóm này liên tục được hình thành rồi tự “giải tán”.
trạng thái lỏng, các phân tử dao động chung quanh một vị trí cân bằng tạm
th i trong một nhóm rồi chuyển động tịnh tiến sang một vị trí cân bằng khác. Nhiệt độ
càng cao thì th i gian cư trú c a phân tử một nhóm càng ngắn. Vì vậy, nhiệt độ càng
cao trạng thái lỏng càng gần với trạng thái khí.
d. Tính ch t c a ch t lỏng
S c căng bề mặt được định nghĩa là lực căng trên một đơn vị chiều dài cắt
ngang bề mặt. Trong hệ đo lư ng quốc tế, s c căng bề mặt được đo bằng Newton trên
mét (N.m-1). Hoặc có thể định nghĩa s c căng bề mặt là công cơ học thực hiện khi lực
căng làm cho diện tích bề mặt thay đổi một đơn vị đo diện tích. 68
S c căng bề mặt c a chất lỏng phụ thuộc vào năng lượng tương tác giữa các
phân tử (hoặc các nguyên tử) c a chất. Khi
đun nóng chất lỏng, lực tương tác giữa các tiểu phân c a nó yếu đi, và s c
căng bề mặt giảm xuống. nhiệt độ nào đó, s c căng bề mặt bằng không, gọi là nhiệt độ tới hạn.
Chất lỏng có khuynh hướng làm giảm s c căng bề mặt bằng cách giảm diện
tích bề mặt, đó là nguyên nhân làm chất lỏng dễ tạo thành những giọt khối cầu có
đư ng kính khác nhau và các giọt dễ nhập lại thành giọt lớn.
Th i gian d i chỗ chất lỏng là công tiêu thụ để vận chuyển chất lỏng theo
đư ng ống phụ thuộc vào độ nhớt chất lỏng.
Độ nhớt là tính chất các lớp chất lỏng cản lại sự chuyển động c a lớp này đối
với lớp kia, là thông số đại diện cho ma sát trong c a dòng chảy. υ F η Δ = .S . Δ A
F là lực cần thiết để làm chuyển dịch lớp chất lỏng này so với lớp chất lỏng kia.
S : là diện tích tiếp xúc giữa hai lớp chất lỏng.
Δ υ : là hiệu số tốc độ hai lớp.
Δ A : là khoảng cách hai lớp.
η : Là độ nhớt, phụ thuộc vào bản chất c a các chất, khi tăng nhiệt độ độ nhớt các chất lỏng đều giảm.
Th nguyên c a độ nhớt: “khối lượng/ độ dài × th i gian”, trong hệ CGSE nó
tương ng g/cm.s. Đơn vị này gọi là poazơ (P) và bằng lực ma sát trên 1cm2, nếu
những lớp cách nhau 1cm có tốc độ chuyển động khác nhau 1cm/s.
Độ nhớt c a chất lỏng khác nhau khá nhiều. Khi tăng nhiệt độ, độ nhớt c a chất
lỏng giảm, điều này có liên quan đến sự giảm lực tương tác giữa các tiểu phân. Ví dụ,
độ giảm c a nước khi đun nóng từ 0 đến 900C giảm 5 lần.
Thông thư ng nhiệt độ sôi c a các chất lỏng tăng khi phân tử khối c a chúng
tăng, vì lúc này lực tương tác tăng do cộng tính c a lực khuếch tán.
Sự tăng độ phân cực c a các phân tử dẫn đến sự tăng lực định hướng và do đó
cũng dẫn đến sự tăng nhiệt độ sôi.
Đối với các hiđrocacbon có liên kết đôi, nhiệt độ sôi tăng cùng với sự tăng c a
hệ liên hợp, vì trong trư ng hợp này khả năng phân cực hóa tăng và do đó làm tăng lực
liên kết giữa các phân tử.
4.7. H p ch t cao phân tử (polime)
4.7.1. C u trúc và đặc điểm
Các polime được hình thành khi các phân tử thông thư ng kết hợp với nhau
thành mạch dài, do các liên kết hóa học được hình thành giữa chúng. Khi đó nếu các
phân tử ban đầu giống nhau (A), thì tạo thành phân tử lớn polime đồng thể kiểu: - A –
A – A – A – A - (A là gốc c a phân tử ban đầu). 69
Các Polime thẳng phân nhánh gồm các phân tử rất dài, độ dài c a chúng vượt
quá độ dày c a chúng hàng chục nghìn lần.
Có 2 loại cấu trúc polime: dạng viên và dạng bó.
Cấu trúc polime dạng viên: khi tạo thành từ các monome, chúng dễ bị n t ra
theo đư ng ranh giới phân cách giữa các viên và dễ bị phá vỡ. Nếu các viên xếp chặt
hơn, khi ranh giới giữa chúng bị xói mòn, thì vật liệu polime tr nên trong suốt và bền.
Như vậy với cấu trúc dạng viên, độ nhớt c a dung dịch chất polime rất nhỏ.
Với cấu trúc dạng bó: các mạch phân tử lớn tổ hợp với nhau, thu được những
tập hợp thẳng, đó là những bó phân tử lớn. Điều này xảy ra là do các phân tử lớn riêng
rẽ không thể co tròn lại thành viên.
4.7.2. Tính ch t và ng d ng. a. Tính ch t
Vật liệu polime rất phổ biến trong thực tế, do nhiều nguyên nhân:
- Sự đa dạng về các tính chất c a vật liệu polime: rắn và mềm, đàn hồi, dẻo, nhẹ,...
- Tương đối dễ chế tạo thành sản phẩm.
- Tương đối rẻ và dễ kiếm nguyên liệu (than, dầu mỏ, khí).
- Bền đối với tác dụng hóa học - bền với sự ăn mòn.
Có 3 loại biến dạng tồn tại vật liệu polime: - Biến dạng đàn hồi,
- Biến dạng đàn tính cao. - Biến dạng chảy.
Khi có tác động bên ngoài lên polime thì cấu trúc c a nó được xây dựng lại dần
dần - được gọi là sự hồi phục. Sự biến dạng đàn hồi có liên quan đến sự biến đổi góc
hóa trị giữa các nguyên tử trong mạch polime. Sự biến dạng chảy gây ra b i sự chuyển
dịch các phân tử lớn đối với nhau, lúc này các polime sẽ thể hiện như chất lỏng. b. ng d ng * Sự hoà tan polime Polime
ưa nước: polime có cấu trúc mạch thẳng có thể tan hoặc trương mạnh
trong nước. Thuộc loại này có các nhóm có cực ch a các nguyên tử O và N trong
thành phần phân tử, các nguyên tử này tạo liên kết với hidro.
Để làm dung môi cho các loại polime, ngư i ta sử dụng các hidrocacbon:
benzen, xăng, axeton, rượu,...điều này được giải thích do những phân tử nhỏ c a dung
môi đi vào polime và gây nên quá trình trương lên c a polime trong dung môi.
Một số polime có độ nhớt cao và có tính dính cao, là do trong dung dịch polime
ch a các phân tử lớn và tương tác mạnh. Khả năng kết dính càng cao khi tăng nồng độ
c a polime trong dung dịch và khi hạ nhiệt độ. Dung dịch polime thuộc loại này là hồ và sơn. * N u ch y polime Polime khi
nấu chảy tồn tại 2 dạng: hợp chất dẻo nóng và hợp chất c ng nóng. 70
Polime dẻo nóng khi đun nóng bị mềm ra và nóng chảy, còn khi làm lạnh chúng
hóa c ng. Thuộc kiểu này có polietylen, polistirol, capron,...chúng gồm những phân tử
lớn hoặc phân nhánh, các phân tử này khi đun nóng chúng không ″bị khâu lại” thành cấu trúc lưới.
Polime c ng nóng khi đun nóng sẽ không nóng chảy và không hòa tan, do xảy
ra phản ng giữa các polime c a chúng tạo thành cấu trúc dạng lưới. Thuộc kiểu này
có nhựa phenolfomanđehit, nhựa này là cơ s c a bakelit, cacbolit. Từ chúng ngư i ta
chế tạo các sản phẩm c ng và bền như: thân máy điện thoại, vỏ dụng cụ điện,...
* Sự hóa dẻo các vật li u
điều kiện tinh khiết các polime không có tính đàn hồi cao, tuy nhiên có thể
tạo polime c ng có khả năng biến dạng đàn hồi cao bằng cách thêm vào chúng những
chất thấp phân tử nào đấy có khả năng làm tăng đồng th i tính dẻo c a vật liệu. Chất
thấp phân tử như thế gọi là chất dẻo hóa.
Chất dẻo hóa sử dụng có tính đặc trưng: độ nhớt cao, ít bay hơi.
Mục đích ch yếu chất thấp phân tử khi đưa vào polime là hạ nhiệt độ th y tinh
hóa c a polime, biến chúng mềm hơn và m rộng vùng biến dạng đàn tính cao mà
đó polime được sử dụng.
Chẳng hạn: nhiệt độ thư ng, polivinyclorua là polime rất c ng, có nhiệt độ
thuỷ tinh hóa +750C. Thêm thêm dibutylftalat có thể hạ nhiệt độ th y tinh hóa đi
1000C và thu được vật liệu có tính mềm và tính đàn hồi khác nhau.
* Sự s i bọt c a polime Các
chất dẻo xốp hợp thành một nhóm chất dẻo đặc biệt, đó là những vật liệu
tương đối mới. Nó được sử dụng để chế tạo các toa làm lạnh, các thiết bị làm lạnh, các
phao tiêu,...Nó được điều chế bằng cách cho nhựa tổng hợp vào bọt đặc, bọt này rắn
lại dưới dạng tổ ong ch a các lỗ nhỏ, hoặc bằng cách thổi khí vào chất dẻo đã được làm mềm. Trong
kỹ thuật xây dựng, ngư i ta sử dụng ch yếu các chất dẻo rỗ tổ ong. Để
tạo chúng, ngư i ta ép một số lớp giấy đưới dạng tổ ong. Sau đó tẩm lên bằng những
chất nhựa nhân tạo rồi bít một đầu hoặc cả hai đầu bằng chất dẻo bền chắc hơn. * Độn các polime.
Để hạ giá thành polime, ngư i ta thêm vào chúng chất độn: mồ hóng, cao lanh,
mạt cưa,...chất độn làm thay đổi tính chất polime: làm giảm tỷ trọng, làm tăng độ bền. * C u t ng hóa các polime.
Nhằm mục đích là cố định các phân tử lớn với nhau nh hình thành các liên kết
hóa học giữa chúng và chuyển thành chất dẻo. Quá trình này tiến hành không cần chất
phụ gia, nh quá trình đa ngưng tụ giữa những nhóm ch c tự do c a các phân tử lân
cận. Quá trình như thế gọi là sự hóa c ng.
Ví dụ: Sự lưu hóa cao su. …- CH = CH - … …- CH - CH - … +S8 Sn Sn
…- CH = CH - … …- CH - CH - … 71
* Giới thi u một số h p ch t cao phân tử.
- Polietylen (PE): được dùng làm chất dẻo trong kỹ thuật điện, bao bì, đồ dùng dân dụng,...
- Higt density polietylen (HDPE): được điều chế từ nhựa PE có cho thêm chất chống
oxy hoá, chất ổn định và chất màu cần thiết. Đặc điểm quan trọng là loại nhựa này rất dẻo, độ bền hóa cao.
- Polistyren: được dùng làm vật liệu cách điện, để sản xuất một số dụng cụ quang học, dụng cụ văn phòng,...
- Polivinylclorua (PVC): được dùng làm vật liệu cách điện, ống nước, vải che mưa,...
- Polivinylaxetat: có khả năng kết dính tốt vào th y tinh, kim loại, gỗ,... nên được dùng
để chế tạo sơn và keo dán.
- Polimetylmetacrylat: có tính chịu nhiệt, chịu va chạm và độ bền cơ học cao (chịu
được 700 kg/cm2), nên được dùng làm kính khó vỡ.
- Polibutadien: được dùng làm cao su nhân tạo.
- Poliamit: được dùng để kéo tơ dệt vải may mặc. Đặc biệt dùng để may áo c u hỏa. - Poliphenolfomandehit: +
Nếu dùng xúc tác H+, lấy dư phenol, tạo ra novolac: được dùng để tạo sơn, vecni. OH OH OH CH [ ] 2 CH2 n
+ Khi dùng xúc tác OH-, lấy dư fomandehit, được poli zezol: OH OH OH HOCH CH 2 [ ] 2 CH2 CH2OH n CH2OH CH2OH
- Poliurefomanđehit: được dùng làm keo dán, chất dẻo, pha sơn.
NH CO NH CH2 NH CO NH CH2 N CH2 NH CO NH CO NH CH2OH
- Poli epoxit: dùng làm keo dán,… 72
Câu hỏi và bài tập
1. Hãy nêu cấu trúc và tính chất c a tinh thể? Ý nghĩa c a tế bào sơ đẳng? Các mạng lưới Brave?
2. Hãy nêu cấu trúc và tính chất c a tinh thể nguyên tử. Cho ví dụ. Giải thích vì sao
kim cương, than chì, than hoạt tính đều được cấu tạo b i sự liên kết c a cacbon, nhưng
kim cương lại có độ c ng lớn nhất?
3. Hãy nêu cấu trúc và tính chất c a tinh thể phân tử? Cho ví dụ.
4. Hãy nêu cấu trúc và tính chất c a tinh thể ion? Cho ví dụ. Khái niệm về chỉ số phối
trí. Ý nghĩa c a nó trong việc giải thích bản chất c a liên kết trong tinh thể.
5. Hãy nêu cấu trúc và tính chất c a tinh thể kim loại? Cho ví dụ.
6. ng dụng “mô hình dải năng lượng” để giải thích một số tính chất vật lý c a kim loại.
7. Phân tích các kiểu mạng tinh thể c a kim loại để so sánh xác định tính c ng và tính
dẻo c a kim loại. Giải thích ng dụng c a nó trong công nghệ vật liệu kim loại.
8. So sánh sự khác nhau giữa chất rắn vô định hình và chất rắn tinh thể?
9. Khái niệm tinh thể lỏng và trạng thái lỏng? Ý nghĩa c a s c căng bề mặt và độ nhớt.
10. Hãy nêu một số ng dụng thực tế c a hợp chất cao phân tử (polime)? 73




