







Preview text:
CHƯƠNG 2 CÁC NGUYÊN TỐ NHÓM IA
2.1. Một số đặc điểm về cấu tạo
2.2. Tính chất vật lý
2.3. Tính chất hoá học
2.4. Trạng thái tự nhiên và phương pháp điều chế
2.5. Các hợp chất của kim loại kiềm
2.1. Một số đặc điểm về cấu tao
+ Nhóm IA gồm các nguyên tố Li (Liti), Na (Natri), K (Kali), Rd (Rubidi), Cs
(Xesi) và Fr (Franxi) trong đó Franxi là ngyên tố phóng xạ tự nhiên.
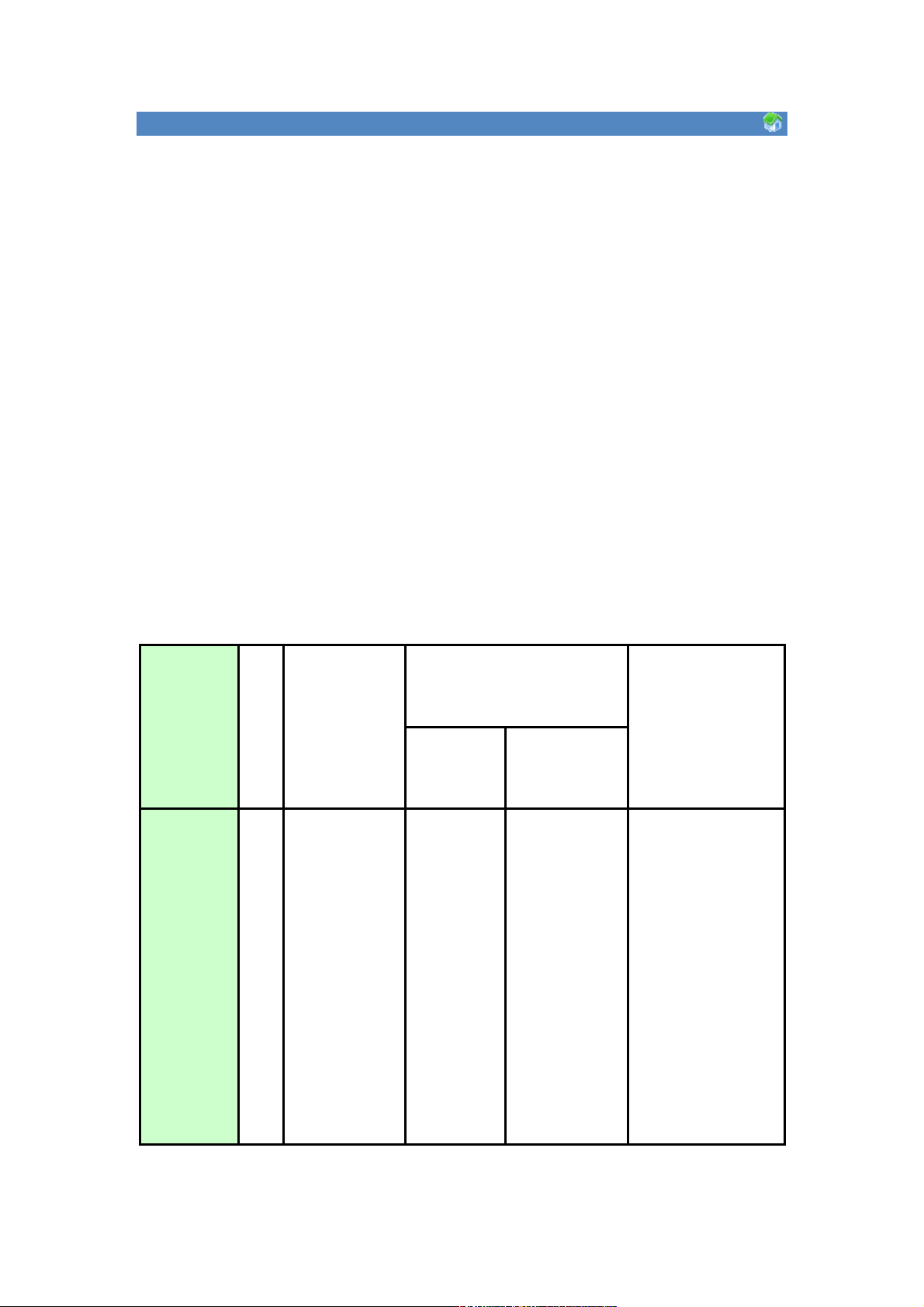
+ Một số đặc điểm về cấu tạo của các kim loại kiềm: Nguyên tố Stt Cấu hình Năng lượng ion hoá I (ev) Thế điện cực electron I1 I2 Li 3 [He]2s1 5,39 75,6 -3,02 Na 11 [Ne]3s1 5,14 47,3 -2,71 K 19 [Ar]4s1 4,34 31,8 -2,92 Rb 37 [Kr]5s1 4,18 27,4 -2,99 Cs 55 [Xe]6s1 3,89 23,4 -2,92 Fr 87 [Rn]7s1 - - -
+ Do đều có 1 electron hoá trị ns1 ở bên ngoài cấu hình bền của khí hiếm nên
các kim loại kiềm dễ dàng mất 1 electron để tạo nên ion M1+ thể hiện ở chỗ (I1 nhỏ
hơn rấ nhiều so với I2).
+ Các kim loại kiềm là những chất khử mạnh nhất trong các chu kỳ, nó hể
hiện ở chỗ thế điện cực của các kim loại kiềm rất âm.
+ So với các nhóm khác các kim loại trong nhóm IA có nhiều tính chất giống
nhau hơn và biến đổi một cách đều đặn hơn từ Li đến Fr. Tuy nhiên Li đứng ngay sau
khí hiếm [He] (lớp vỏ có 2 electron, các khí hiếm khác lớp vỏ đều có 8 electron) nên
Li có một số tính chất khác biệt như: thế điện cực của Li âm nhất trong số các chất,
các hợp chất của Li ít tan hơn (LiOH, LiF, Li2CO3, Li3PO4). Thế điện cực của Li nhỏ
nhất được giải thích như sau:
-Xét cặp oxi hoá khử Mn+/ M. Mn+ là ion kim loại, nó được tạo thành trong
dung dịch nước từ kim loại M như sau: M(r) - n(e) + aq → Mn+.aq
- Thế khử của cặp Mn+/M ứng với sự biến thiên thế đẳng áp của quá trình: Mn+.aq + n(e) → M(r) + aq
- Như vậy có thể phân tích thành các giai đoạn trung gian như sau: 0 - Như vậy: ∆G0 ϕ
= -(∆G0h + ∆G0ion +∆G0th ) +∆G0e = -nF (Mn+/M) G0 ∆ + G ∆ i0 h on+ G0 ∆ G0 th ∆ e 0 + − - Từ đó: ϕ M n / M = nF nF - Trong đó:
∆G0h- sự biến thiên thế đẳng áp chuẩn của quá trình hiđrat hoá ion Mn+.
∆G0ion- sự biến thiên thế đẳng áp chuẩn của quá trình ion hoá nguyên tử M.
∆G0th- sự biến thiên thế đẳng áp chuẩn của quá trình thăng hoa nguyên tử M.
∆G0e- sự biến thiên thế đẳng áp chuẩn khi chuyển n(e) trong kim loại thành n(e) ở trạng thái khí. 0 +
- Như vậy từ công thức trên chúng ta thấy thế điện cực ϕ M n / M càng âm
khi năng lượng hiđrat hoá càng âm.
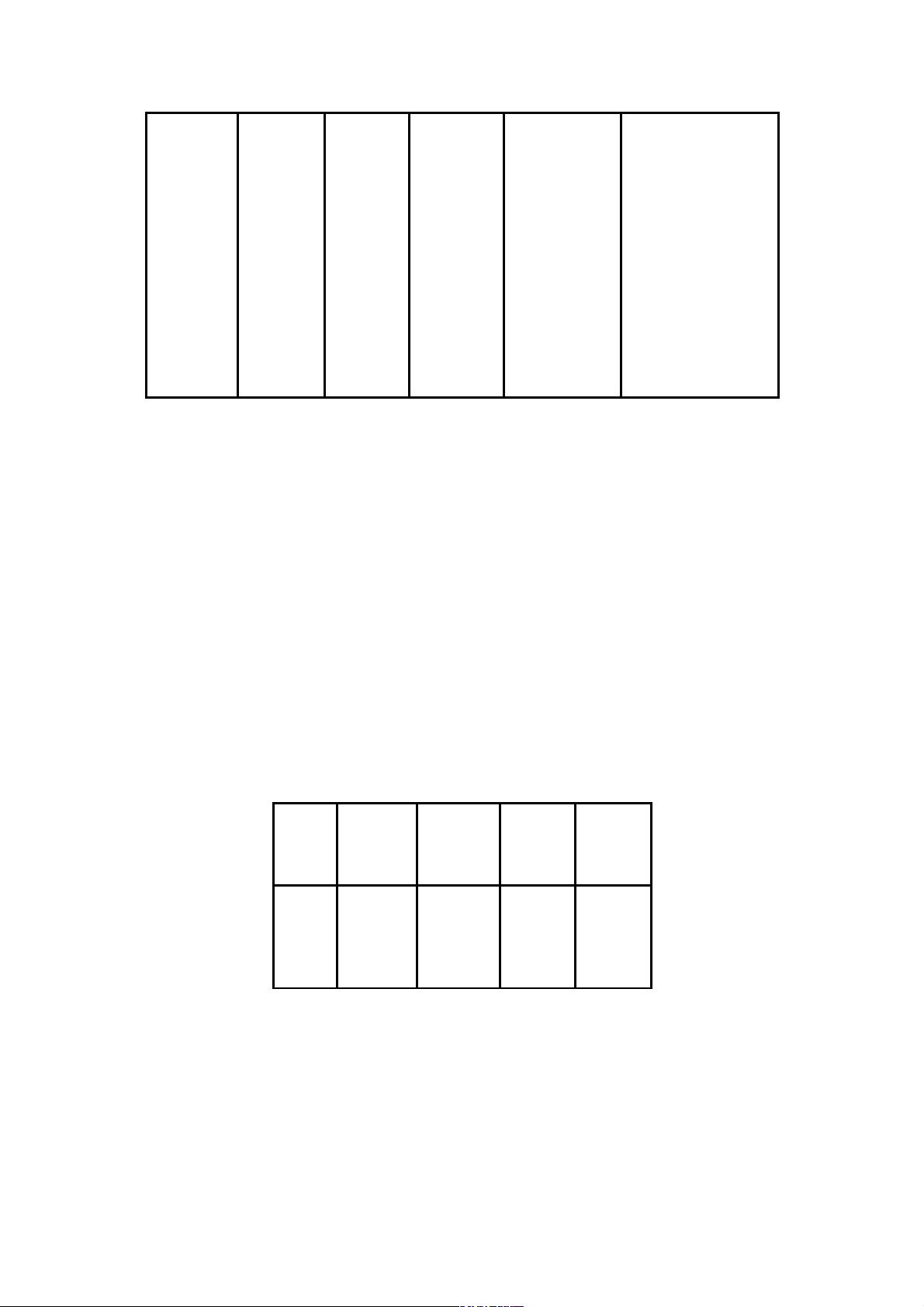
- Do Li+ có bán kính nhỏ nhất, nên khả năng hiđrat hoá của Li+ là lớn nhất tức
là nhiệt hiđrat hoá của Li+ rất âm (quá trình hiđro hoá Li+ toả ra rất nhiều nhiệt). Điều
này đẫn đến thế điện cực của Li là âm nhất. Ion Bán kính ion (A0) ∆H0h, kJ/mol Li+ 0,60 -506 Na+ 0,95 -397 K+ 1,33 -313 Rb+ 1,48 -288 Cs+ 1,69 -255
+ Các kim loại kiềm tạo nên chủ yếu là các hợp chất ion với số oxi hoá duy
nhất là +1. Tuy nhiên ở trạng thái khí các kim loại kiềm tồn tại một phần các phân tử
M2 (Li2, Na2, Rb2, Cs2) trong đó liên kết giữa hai nguyên tử là liên kết cộng hoá trị.
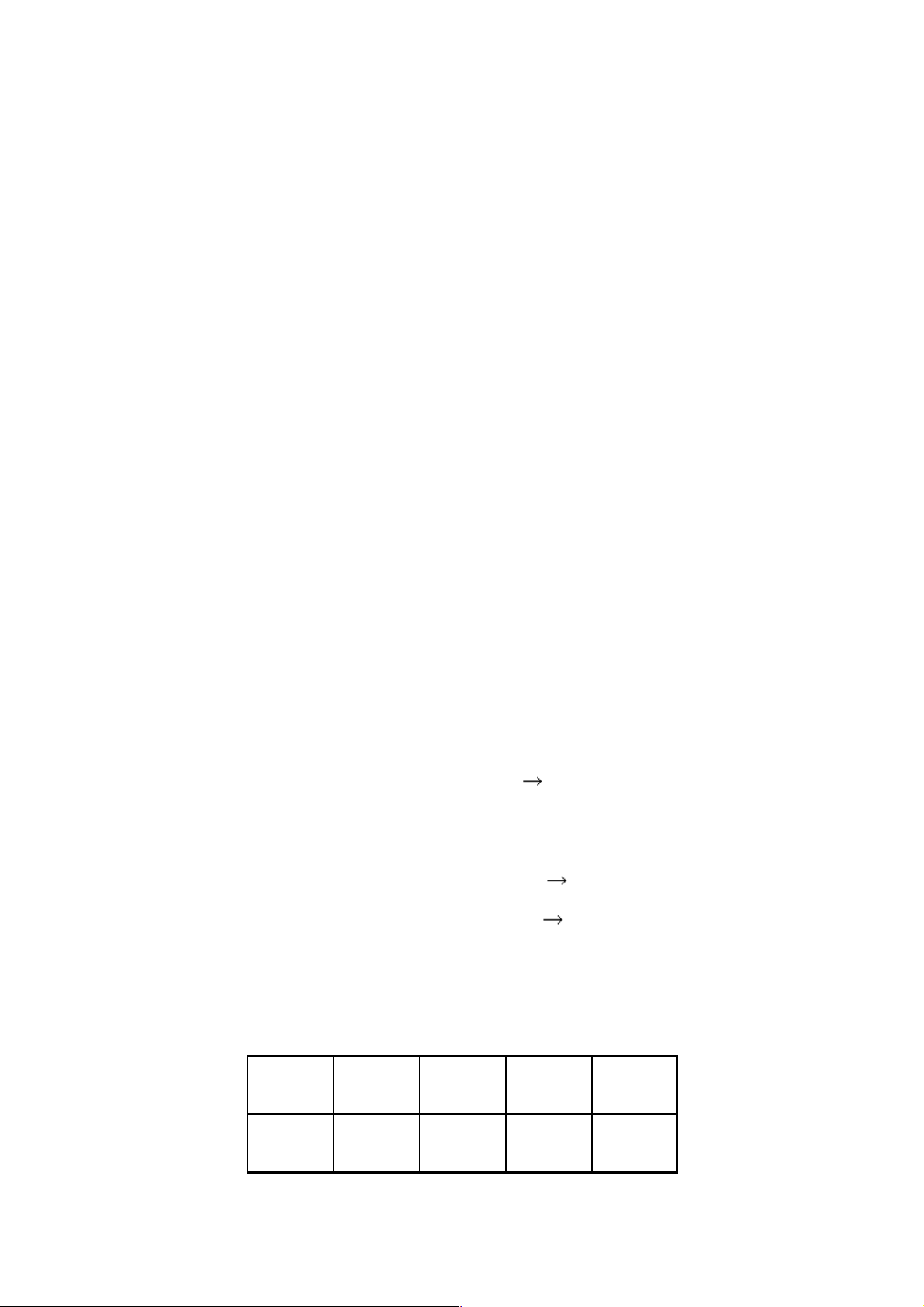
Năng lượng liên kết giữa các phân ử M2 là khá bé và giảm dần từ Li đến Cs: Li2 Na2 K2 Rb2
Năng lượng liên kết, kJ/mol 108 73,2 49,8 47,3
+ Các ion của các kim loại kiềm thường không có màu, nói chung các hợp chát
của chúng dễ tan trong nước trừ một số hợp chất của Li.
2.2. Tính chất vật lý
+ Các kim loại kiềm đều có cấu trúc mạng lưới tinh thể lập phương tâm khối.
Đây chính là nguyên nhân dẫn đến tính chất vật lý của các kim loại kiềm biến đổi đều
đặn từ trên xuống dưới.
+ Các kim loại nhóm IA đều là chất rắn màu trắng bạc (Cs có màu vàng) và có
ánh kim nhưng ánh kim nhanh chóng bị biến mất khi kim loại tiếp xúc với không khí.
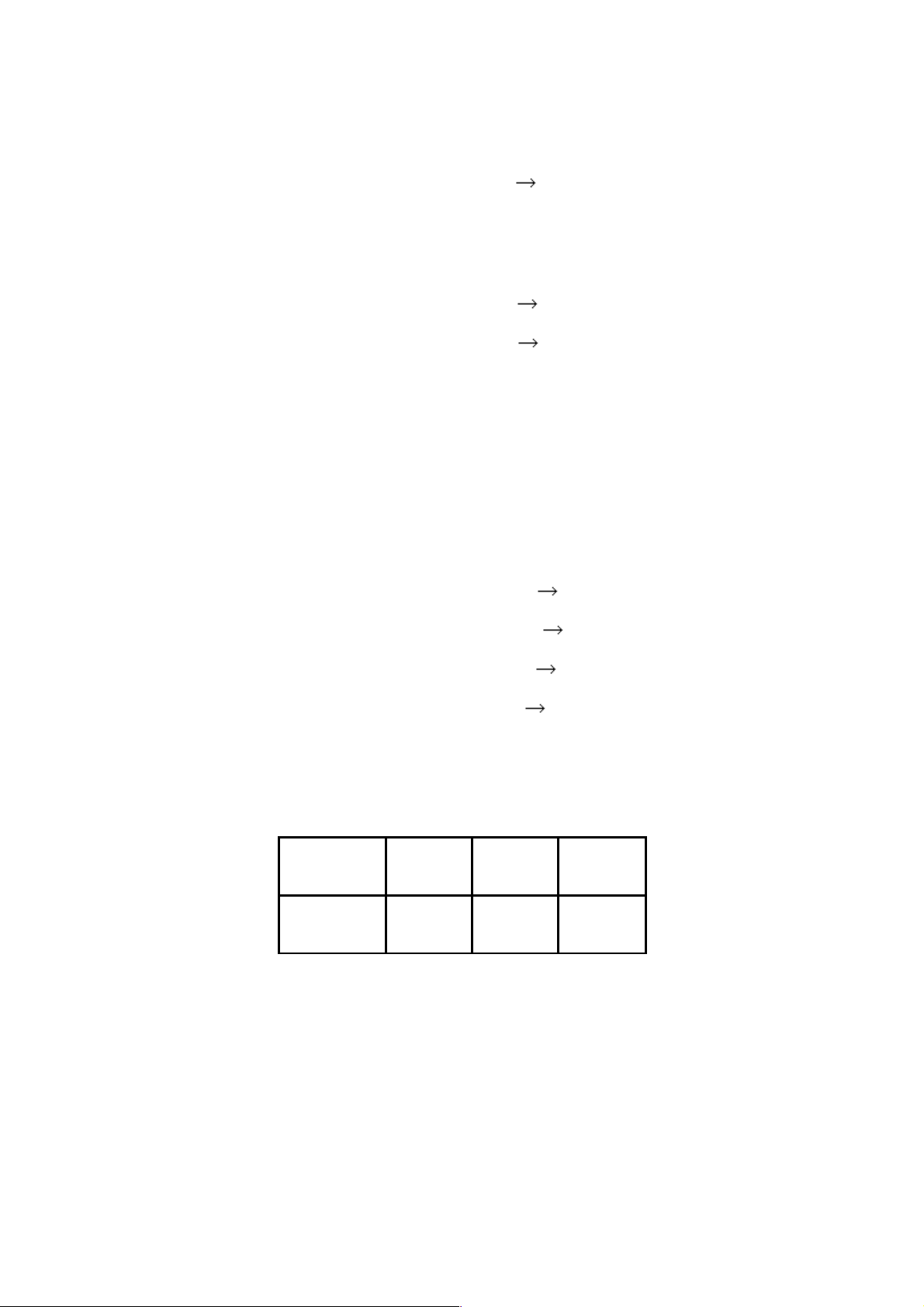
+ Một số hằng số vật lý của kim loại kiềm Nguyên t0 nc (0C) t0sôi (0C) d(g/cm3) Độ dẫn điện Độ cứng tố (Hg = 1) (kim cương =10) Li 180 1317 0,53 11 0,6 Na 98 883 0,97 21 0,4 K 64 760 0,86 14 0,5 Rb 39 689 1,53 8 0,3 Cs 29 666 1,87 5 0,2
+ Do có 1 electron hoá trị nên liên kết kim loại trong mạng lưới của kim loại
kiềm rất yếu do vậy kim loại kiềm rất mềm (có thể cắt được bằng dao kéo) nhiệt độ
nóng chảy và nhiệt độ sôi của các kim loại kiềm đều thấp và giảm dần từ Li đến Cs
nguyên nhân do bán kính nguyên tử tăng dần và độ bền của liên kết giảm dần.
+ Các kim loại kiềm đều nhẹ Li nổi trên dầu hoả còn Na và K đều nổi trên mặt nước.
+ Do có cấu trúc mạng lưới tinh thể giống nhau nên các kim loại kiềm có thể
dễ dàng tan vào nhau để tạo thành hợp kim đặc biệt các kim loại kiềm đều dễ dàng tan
vào trong Hg để tạo thành hỗn hống, thông dụng nhất là hỗn hống của Na-Hg nó
thường được dùng làm chất khử trong các phản ứng tổng hợp hữu cơ.
+ Các kim loại kiềm và các hợp chất dễ bay hơi của chúng khi được đưa vào
ngọn lửa không màu thì sẽ làm cho ngọn lửa trở lên có màu đặc trưng. Li Na K Rb Cs đỏ vàng tím tím hồng xanh lam tía Giải thích:
+ Ở trong ngọn lửa, những electron của nguyên tử và ion kim loại kiềm được
kích thích nhảy lên những mức năng lượng cao hơn. Khi electron nhảy về mức năng
lượng ban đầu, những electron đó hoàn trả lại những năng lượng đã hấp thụ. Năng
lượng hoàn trả này nhỏ và được phát ra dưới dạng các bức xạ trong vùng trông thấy.
Vì vậy ngọn lửa có những màu đặc trưng của các kim loại.
+ Dưới tác dụng của các tia tử ngoại, các kim loại Na, K, Rb và Cs sẽ phóng
ra các electron, cường độ của dòng electron được phóng ra tỉ lệ với cường độ của ánh
sáng được hấp thụ. Lợi dụng tính chất này người ta thường dùng các kim loại kiềm
nhất là Rb và Cs để làm các tế bào quang điện dùng trong vô tuyến truyền hình.
2.3. Tính chất hoá học
Các kim loại kiềm rất hoạt động về mặt hoá học trong các phản ứng chúng
đều thể hiện tính khử mạnh và tính khử tăng dần từ Li đến Cs.
Tác dụng với oxi:
- Điều kiện thường trong không khí khô (không có mặt hơi nước).
Li bị bao phủ một lớp màu xám gồm Li2O, Li3N.
Na bị oxi hoá tạo thành peoxit Na2O2 và có lẫn một ít oxit Na2O.
K bị phủ một lớp supeoxit KO2 bên ngoài và K2O ở bên trong.
Rd và Cs tự bốc cháy tạo thành lớp supeoxit RdO2 và CsO2
- Khi để trong không khí ẩm:
Các lớp oxit kết hợp với hơi nước của không khí tạo thành hiđroxit rồi hiđroxit
lại kết hợp với khí CO2 của không khí tạo thành muối cacbonat. Vì vậy để bảo quản
các kim loại kiềm bằng cách đựng trong các lọ rất kín hoặc ngâm chúng trong dầu hoả
hoặc được bảo quản trong khí quyển trơ (agon). - Khi đốt cháy
Tuỳ thuộc vào bản chất của kim loại kiềm mà có thể tạo thành oxit M2O, peoxit (M2O2), supeoxit (MO2).
Li tạo thành lớp oxit Li2O
Na tạo thành lớp peoxit Na2O2
K, Rb, Cs thì tạo thành lớp supeoxit MO2 (KO2, RbO2, CsO2)
Tác dụng với lưu huỳnh (S):
- Phản ứng gây nổ khi nghiền bột S với kim loại kiềm sản phẩm tạo thành là sunfua M2S 2M + S M2S 2Na + S Na2S
+ Với N2, C, Si: Trong các kim loại kiềm chỉ có Li là tác dụng trực tiếp được
với 3 chất trên tạo thành Li3N, L2C2, L6Si2. Trong đó Li có phản ứng trực tiếp với nitơ
ngay ở điều kiện thường. Nguyên nhân chính của sự khác biệt giữa Li và các kim loại
kiềm khác được giải như sau:
- Do bán kính của Li+ nhỏ hơn nhiều so với các ion M+ của các kim loại
kiềm khác nên tạo ra các hợp chất L2C2, và Li3N có năng lượng mạng lưới rất âm,
thuận lợi cho sự tạo thành chúng. Hợp chất Li3N Na3N K3N Rb3N Cs3N ∆H0298, kJ.mol-1 -318 -151 +84 +180 +314
Tác dụng với halogen: phản ứng xảy ra mãnh liệt tạo thành muối halogenua 2M + X2 2MX 2Na + Cl2 → 2NaCl
- Với cùng một kim loại kiềm thì khả năng phản ứng giảm dần từ F2 đến I2.
- Với cùng một halogen thì khả năng phản ứng tăng dần từ Li đến Cs.
- Các kim loại kiềm bốc cháy trong khí Cl2 khi có mặt hơi ẩm ở nhiệt độ
thường. Với brom lỏng thì K, Rb, Cs gây nổ mạnh còn Li và Na chỉ phản ứng trên bề
mặt. Với iot, các kim loại kiềm chỉ tương tác mạnh khi được đun nóng.
Tác dụng với hiđro:
- Khi đun nóng các kim loại kiềm đều tác dụng được với hiđro để tạo thành
hiđrua ion nhưng khả năng phản ứng tăng dần từ Li đến Cs: 0 600 C ÷ 0 700 C 2Li + H → 2 2LiH 0 350 C ÷ 0 400 C 2M + H → 2 2MH Với nước:
- Do có thế điện cực rất âm nên các kim loại kiềm đều phản ứng rất mạnh với
nước tạo thành hiđroxit và độ mãnh liệt tăng dần từ Li đến Cs: 2M + 2H2O → 2MOH + H2
- Li: phản ứng êm dịu không cho ngọn lửa.
- Na: nóng chảy thành hạt tròn nổi và chạy quanh mặt nước.
- K: bốc cháy khi tiếp xúc với nước
- Rb và Cs: gây phản ứng nổ khi tiếp xúc với nước.
- Do phản ứng mạnh với nước nên người ta dùng Na để làm khan các dung
môi hữu cơ ví dụ để làm khan ete là chất không có phản ứng với natri. Với NH3:
- Khi đun đến quá nhiệt độ nóng chảy các kim loại kiềm rồi sau đó cho phản
ứng với NH3 thì kim loại kiềm có thể thay thế 1 nguyên tử hiđro trong NH3 tạo thành
amiđua NH2 (các amiddua dễ dàng phản ứng với nước giải phóng NH3). 2Na + 2NH3 2NaNH2 + H2 NaNH2 + H2O NaOH + NH3
+ Kim loại kiềm phản ứng được với một số hợp chất hữu cơ có hiđro linh động như axit và rượu:
2CH3COOH + 2Na → 2CH3COONa + H2
2C2H5OH + 2Na → 2C2H5ONa + H2
2.4. Trạng thái tự nhiên và phương pháp điều chế
2.4.1. Trạng thái tự nhiên
- Do có hoạt tính hoá học cao nên các kim loại kiềm không tồn tại ở trạng thái
đơn chất mà chỉ tồn tại ở trạng thái hợp chất dưới dạng ion dương với số oxi hoá duy nhất là +1.
- Na và K thuộc loại nguyên tố phổ biến nhất ở trong vỏ trái đất nó thường
nằm trong nước biển và một số mỏ muối như xinvinit (NaCl.KCl); cacnanit KCl.
MgCl2.6H2O, KNO3 (diêm tiêu), Na2SO4.10H2O, xôđa Na2CO3.H2O, criolit (Na3AlF6),
borat (Na2B4O7.10H2O)...Do hiện tượng phong hoá một số hợp chất tan của natri và
kali được tạo thành. Những muối này được kéo từ trong lòng đất ra biển rồi đại
đương, như ion K+ bị đất giữ lại nhiều hơn so với Na+ nên ở trong nước biển lượng
muối kali thấp hơn lượng muối natri đến 60 lần.
- Li là nguyên tố ít phổ biến, khoáng vật cính chứa Li là các alumosilicat là
khoáng vật mà rong thành phần có chứa các nguyên tố như Al, Si, O và M (là kim loại
kiềm) ví dụ : [Li2Al2Si4O12] (spođumen).
- Rd và Cs là nguyên tố rất hiếm nguồn để khai thác chúng là các khoáng vật của Li và K.
- Fr là nguyên tố phóng xạ, nó thường có một lượng vô cùng nhỏ trong các
quặng chứa Urani (U). Trong 1 tấn uran có gần 1 gam rađi; 0,59.10-3 gam actini; 1,34.10-11 gam franxi 2.4.2. Ứng dụng
- Hợp chất của Na và K là hết sức cần thiết đối với con người và động thực
vật, trong đó K là một trong 3 nguyên tố (N, P, K) thường xuyên phải cung cấp cho
cây trồng để tăng thu hoạch của mùa màng. Natri cần thiết cho động vật cũng như kali cần thiết cho cây.
- Natri ở trong cơ thể tồn tại chủ yếu ở dạng muối tan chủ yếu là clorua,
photphat và hiđrocacbonat. Trong cơ thể NaCl có vai trò duy trì áp suất thẩm thấu của
huyết tương máu ở mức cần thiết.
- Trong công nghiệp, Na được sản xuất nhiều nhất, nó được dùng làm nguyên
liệu để điều chế Na2O2 (natri supeoxit), natriamidua (NaNH2) và từ chất này điều chế
natrixianua (NaCN) ...Ngoài ra natri cũng được dùng để điều chế một số kim loại khó
nóng chảy như titan, ziconi và một số kim loại khác, hợp kim của natri và kali được
dùng nhiều trong các phản ứng tổng hợp hữu cơ...Hợp kim của chì với natri và caxi
được dùng làm chất bôi trơn ổ trục của các toa tàu. 2.4.3. Điều chế
- Các kim loại kiềm là kim loại mạnh nên không thể dùng các chất khử thông
thường mà phải dùng phương pháp điện phân nóng chảy muối clorua hoặc hiđroxit:
- Điều chế Na người ta thường điện phân nóng chảy hỗn hợp của NaCl với
25%NaF và 12%KCl ở nhiệt độ 610 ÷ 6500C, cực dương là than chì và cực âm làm bằng Fe. dpnc 2NaCl → 2Na + Cl2
- Điều chế Li người ta thường điện phân nóng chảy hỗn hợp của LiCl và KCl:
- Rb và Cs dễ bay hơi nên có thể dùng Ca để khử các hợp chất của Rd và Cs ở
nhiệt độ cao (7000C) trong chân không: 2RbCl + Ca CaCl2 + 2Rb
- Trong điều kiện đó, Rb và Cs bay hơi và được ngưng tụ lại. Những quá trình
sau đây cũng được sử dụng ở nhiệt độ cao. Rb2CO3 + 3Mg 3MgO + C + 2Rb 2CsCl + CaC2 CaCl2 + 2Rb + 2C
2.5. Các hợp chất của kim loại kiềm
2.5.1. Oxit của kim loại kiềm M2O
+ Tất cả các M2O đều là chất rắn có màu sắc biến đổi từ trắng đến da cam. Li2O Na2O K2O Rb2O Cs2O trắng trắng trắng vàng da cam
+ Là oxit bazơ điển hình chúng phản ứng mãnh liệt với nước tạo thành
hiđroxit tương ứng trừ Li2O ít tan trong nước và phản ứng toả ra rất nhiều nhiệt. M2O + H2O 2MOH
+ Chỉ có Li2O bền ở điều kiện thường các M2O đều dễ dàng phản ứng với oxi
tạo thành peoxit hoặc supeoxit, như vậy khi cháy trong oxi chỉ có Li mới tạo thành Li2O. 2Na2O + O2 Na2O2 2K2O + 3O2 2KO2 + Điều chế.
- Li2O được điều chế bằng cách chi Li tác dụng với oxi hoặc nhiệt phân LiOH,
Li2CO3 hay LiNO3 ở 8000C trong khí quyển hiđro. 0 800 C 2LiOH → Li2O + H2O
- Các M2O khác được điều chế bằng cách đun nóng (M2O2, MOH, MNO2,
MNO3) với các kim loại tương ứng. 2Na + 2NaOH 2Na2O + H2 2NaNO2 + 6Na 4Na2O + N2 2KNO3 + 10K 6K2O + N2 Na2O2 + 2Na 2Na2O
2.5.2. Peoxit M2O2 của kim loại kiềm
+ Các peoxit M2O2 đều là chất rắn có màu vàng, khả năng tạo peoxit chỉ đặc
trưng từ Na đến Cs đặc biệt là Na còn Li không đặc trưng. Na2O2 K2O2 Rb2O2 Cs2O2 Vàng nhạt vàng vàng vàng + Là oxit có chứa ion O 2-
2 nên chỉ các kim loại kiềm và kim loại kiềm thổ mới
có thể tạo thành peoxit ion.
+ Chúng đều là chất rắn hút ẩm mạnh và chảy rữa trong không khí phản ứng
mạnh với nước hoặc axit để giải phóng H2O2 hoặc O2.
+ Natripeoxit Na2O2 là peoxit quan trọng nhất đối với thực tế.
- Là chất bột màu trắng nếu tinh khiết nhưng thường có màu vàng do lẫn tạp
chất. Nó nóng chảy ở 4600C và sôi ở 6600C và bị phân huỷ rõ rệt ở 6000C. Nó tương
tác mãnh liệt với nước và phản ứng toả ra nhiều nhiệt và thu được khí oxi do. Na2O2 + 2H2O 2NaOH + H2O2
- Nhưng vì H2O2 không bền trong môi trường kiềm nên 2H2O2 O2 + 2H2O
- Như vậy trong phòng thí nghiệm người ta thường dùng phản ứng của Na2O2
với nước để điều chế oxi. 2Na2O2 + 2H2O 4NaOH + O2 2Na2O2 + H2SO4 Na2SO4 +H2O2
- Nếu ở nhiệt độ thấp thì thu được H2O2 theo phản ứng. Na2O2 + 2H2O 2NaOH + H2O2
- Na2O2 ngoài ra còn có khả năng tác dụng với khí CO, khí CO2 hoặc dung
dịch CO2 trong nước để gải phóng ra khí O2. Na2O2 + CO Na2CO3 2Na2O2 + 2CO2 2Na2CO3 + O2 Na2O2 + H2O + CO2 Na2CO3 + H2O2
- Dựa vào phản ứng với khí CO2 mà Na2O2 được dùng làm nguồn cung cấp khí
oxi trong các bình lặn và trong tầu ngầm. Dựa vào phản ứng với dung dịch CO2 trong
nước Na2O2 được dùng làm chất tẩy trắng vải, rơm, rạ...Thực ra tính tẩy rẳng ở đây
không phải của Na2O2 mà là của H2O2. Người ta thường tẩy trắng bằng cách hoà tan
Na2O2 trong nước lạnh đã có chứa một ít H2SO4 hoặc MgSO4 tương tác với NaOH.
Trong loại bột giặt thường dùng có chứa một ít Na2O2.
- Giống với H2O2, Na2O2 cũng là chất oxi hoá mạnh và là chất khử yếu.
Là chất oxi hoá trong phản ứng Na2O2 + 2KI + 2H2SO4 Na2SO4 + K2SO4+ I2 + 2H2O
Là chất khử trong phản ứng 2KMnO4 + 5Na2O2 + 8H2SO4 2MnSO4 + K2SO4 + Na2SO4 + 8H2O + 5O2
- Điều chế Na2O2: cho O2 hoặc không khí khô đi qua Na nóng chảy ở
1800C (trong bình thép hoặc bình nhôm). 0 180 2Na + O C 2 → Na2O2
Document Outline
- 2.2. Tính chất vật lý
- 2.2. Tính chất vật lý
- 2.5. Các hợp chất của kim loại kiềm

