















Preview text:
Chương 2:
XỬ LÝ DỮ KIỆN ĐỘNG HỌC Võ Đạt Nguyên
Khoa Kỹ thuật Hóa học
Trường Đại học Bách khoa – ĐHQG TPHCM vdnguyen@hcmut.edu.vn
Phương trình vận tốc (PTVT)
➢ Đặc trưng cho phản ứng
➢ Được xác định từ: • Lý thuyết, • Mô hình cho trước, • Thực nghiệm
➢ Xác định PTVT: Hai giai đoạn:
• Phụ thuộc nồng độ,
• Phụ thuộc nhiệt độ 2
TBPU có thể hoạt động gián đoạn hoặc liên tục
➢ Theo dõi mức độ phản ứng:
• Nồng độ của một cấu tử
• Tính chất vật lý của hỗn hợp (tính dẫn điện, chỉ số khúc xạ, …)
• Áp suất tổng của hệ đẳng tích
• Thể tích của hệ đẳng áp 3
Các phương pháp theo dõi biến thiên nồng độ Ví dụ 1: Chuẩn độ
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
Chuẩn độ biến thiên NaOH
Phản ứng được dừng bằng cách lấy mẫu phản ứng cho vào bình tam giác đựng sẵn
HCl có nồng độ dư chính xác
Chuẩn độ nồng độ HCl còn dư trong bình tam giác → nồng độ NaOH phản ứng 4
Các phương pháp theo dõi biến thiên nồng độ Ví dụ 2: Đo áp suất ClCOOCCl3 = 2COCl2
Biến thiên áp suất chất phản ứng = - tốc độ tăng áp suất
Ví dụ 3: Đo biến thiên độ dẫn
C6H5(CO)CH2Br + C5H5N = C6H5(CO)CH2NC5H5 + Br-
Chất phản ứng không dẫn điện, 2 sản phẩm dẫn điện → độ dẫn tăng (điện trở giảm) 5
Các phương pháp xử lý số liệu động học
➢ Phương pháp tích phân (integral method)
➢ Phương pháp vi phân (differential method)
➢ Phương pháp thời gian bán sinh (half-life time)
➢ Phương pháp tốc độ phản ứng ban đầu (initial reaction rate) 6
2.1. Thiết bị phản ứng gián đoạn có thể tích không đổi (thể tích hỗn hợp phản ứng)
➢ Độ chuyển hóa (conversion: XA), là phần tác chất đã chuyển hóa thành sản phẩm
➢ V = constant (thể tích hỗn hợp phản ứng thực sự) 1 𝑑𝑁 1 𝑑 𝐶 1 𝐶 𝑑𝐶 𝑟 𝑖 𝑖𝑉
𝑖𝑑𝑉 + 𝑉𝑑𝐶𝑖 𝑖 𝑖 = = = = 𝑉 𝑑𝑡 𝑉 𝑑𝑡 𝑉 𝑑𝑡 𝑑𝑡 ▪ Với khí lý tưởng: 1 𝑑𝑃 𝑟 𝑖 𝑖 = 𝑅𝑇 𝑑𝑡 7
Thực tế thường đo tổng áp suất của hỗn hợp trong pha khí để theo dõi phản ứng aA + bB +… = rR + sS +… Tại t=0 NA0 NB0 +… NR0 NS0 +… Ntr Tại t NA=NA0-ax NB=NB0-bx NR=NR0+rx NS=NS0+sx, Ntr
Tổng số mol ban đầu: 𝑁 = 𝑁𝐴0 + 𝑁𝐵0 + ⋯ + 𝑁𝑅0 + 𝑁𝑆0 + 𝑁𝑡𝑟
Tại thời điểm t: 𝑁 = 𝑁0 + 𝑥 𝑟 + 𝑠 + ⋯ − 𝑎 − 𝑏 − ⋯ = 𝑁0 + 𝑥∆𝑛
Với ∆𝑛 = 𝑟 + 𝑠 + ⋯ − 𝑎 − 𝑏 − ⋯ 8 𝑃 𝑁 𝑁 𝑁 𝑎 𝑁 − 𝑁 𝐶 𝐴 𝐴 𝐴0 − 𝑎𝑥 𝐴0 0 𝐴 = = = = − 𝑅𝑇 𝑉 𝑉 𝑉 ∆𝑛 𝑉 Hay 𝑎
𝑝𝐴 = 𝐶𝐴𝑅𝑇 = 𝑝𝐴0 − 𝑃 − 𝑃 ∆𝑛 0 (2.3) Cho R: 𝑟
𝑝𝑅 = 𝐶𝑅𝑅𝑇 = 𝑝𝑅0 + 𝑃 − 𝑃 ∆𝑛 0 (2.4)
Với 𝑃0 : Áp suất tổng lúc ban đầu của hệ
𝑃 : Áp suất tổng tại thời điểm t của hệ
𝑝𝐴0 : Áp suất riêng phần ban đầu của A
𝑝𝑅0 : Áp suất riêng phần ban đầu của R 9
2.1.1. Phương pháp tích phân
1) Giả thiết cơ chế và phương trình vận tốc tương ứng 𝑑𝐶 −𝑟 𝐴 𝐴 = − = 𝑘𝑓 𝐶 𝑑𝑡
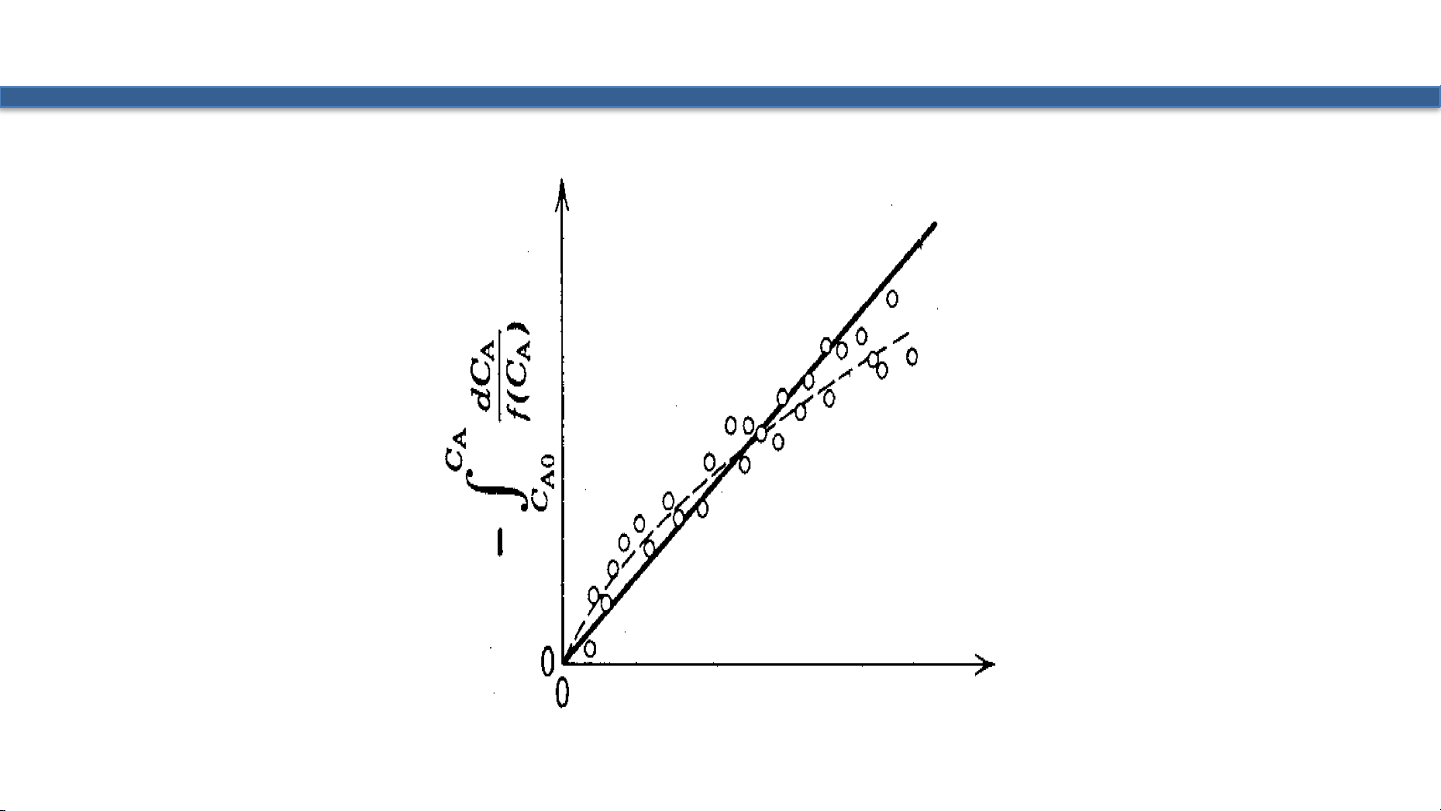
2) Sắp xếp và lấy tích phân 𝑑𝐶 𝑑𝐶 𝐶 𝑡 −𝑟 𝐴 𝐴 𝐴 𝑑𝐶𝐴 𝐴 = − = 𝑘𝑓 𝐶 − = 𝑘𝑑𝑡 − = 𝐹 𝐶 𝑑𝑡 = 𝑘𝑡 𝑑𝑡 𝑓 𝐶 𝐴 = 𝑘 𝐴 𝐶𝐴0 𝑓 𝐶𝐴 0
3) Xác định F(CA) theo thực nghiệm 4) Vẽ F(CA) theo t
5) Nếu không thẳng, giả thuyết lại 10 Hình 2.1 11
(1) Phản ứng không thuận nghịch bậc 1 loại 1 phân tử
Xét phản ứng: 𝐴 → 𝑠ả𝑛 𝑝ℎẩ𝑚
1) PTVT có dạng: 𝑑𝐶 − 𝐴 = 𝑘𝐶 𝑑𝑡 𝐴
2) Tách và lấy tích phân: 𝐶 𝑡
− 𝐴 𝑑𝐶𝐴 = 𝑘 𝑑𝑡 𝐶𝐴0 𝑓 𝐶𝐴 0
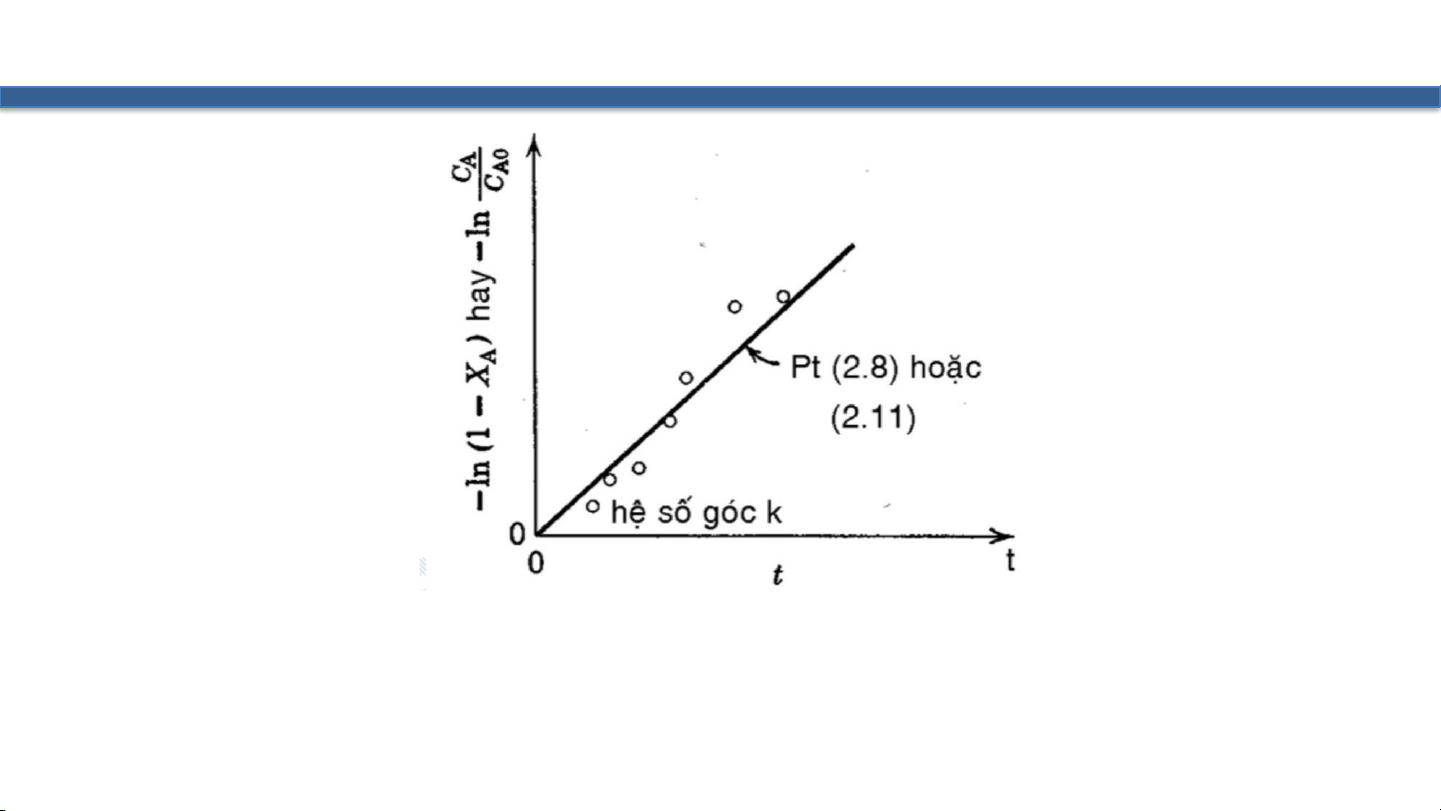
Đơn vị của k là [s-1]: 𝐶 −𝑙𝑛 𝐴 = 𝑘𝑡 𝐶𝐴0 12
Độ chuyển hóa, XA là phần tác chất chuyển hóa thành sản phẩm
𝑁𝐴 = 𝑁𝐴0 1 − 𝑋𝐴 𝑁 𝑁 𝐶 𝐴 𝐴0 1 − 𝑋𝐴 𝐴 = = = 𝐶 𝑉 𝑉 𝐴0 1 − 𝑋𝐴 ; 𝐶 ⇒ 𝑋 𝐴0 − 𝐶𝐴 𝐴 = 𝐶𝐴0 𝑑𝑋 −𝑑𝐶 𝐴
𝐴= 𝐶𝐴0𝑑𝑋𝐴 ⇒ 𝑃𝑇𝑉𝑇 𝑡𝑟ở 𝑡ℎà𝑛ℎ = 𝑘 1 − 𝑋 𝑑𝑡 𝐴 𝑋𝐴 𝑑𝑋 𝑡 ⇒ න 𝐴
= 𝑘 න 𝑑𝑡 ⇒ −𝑙𝑛 1 − 𝑋𝐴 = 𝑘𝑡 0 1 − 𝑋𝐴 0 13 Hình 2.2 − 𝑑𝐶 Τ 0.6 0.4
𝐴 𝑑𝑡 = 𝑘𝐶𝐴 𝐶𝐵 , là bậc một nhưng không áp dụng được 14
(2) Phản ứng không thuận nghịch bậc 2 loại 2 phân tử
Xét phản ứng: 𝐴 + 𝐵 → 𝑠ả𝑛 𝑝ℎẩ𝑚 𝑑𝐶 𝑑𝐶 −𝑟 𝐴 𝐵 𝐴 = − = − = 𝑘𝐶 𝑑𝑡 𝑑𝑡 𝐴𝐶𝐵 (2.12)
Ta có: 𝐶𝐴0𝑋𝐴 = 𝐶𝐵0𝑋𝐵 𝑑𝑋 −𝑟 𝐴 𝐴 = 𝐶𝐴0 𝑑𝑡
−𝑟𝐴 = 𝑘 𝐶𝐴0 − 𝐶𝐴0𝑋𝐴 𝐶𝐵0 − 𝐶𝐴0𝑋𝐴 Đặt: 𝐶 𝑀 = 𝐵0 𝐶𝐴0 15
(2) Phản ứng không thuận nghịch bậc 2 loại 2 phân tử 𝑑𝑋 −𝑟 𝐴 2 𝐴 = 𝐶𝐴0 = 𝑘𝐶 1 − 𝑋 𝑑𝑡 𝐴0 𝐴 𝑀 − 𝑋𝐴
Phân tích biến số và lấy tích phân: 𝑋𝐴 𝑑𝑋 𝑡 න 𝐴 = 𝑘𝐶𝐴0 න 𝑑𝑡 0
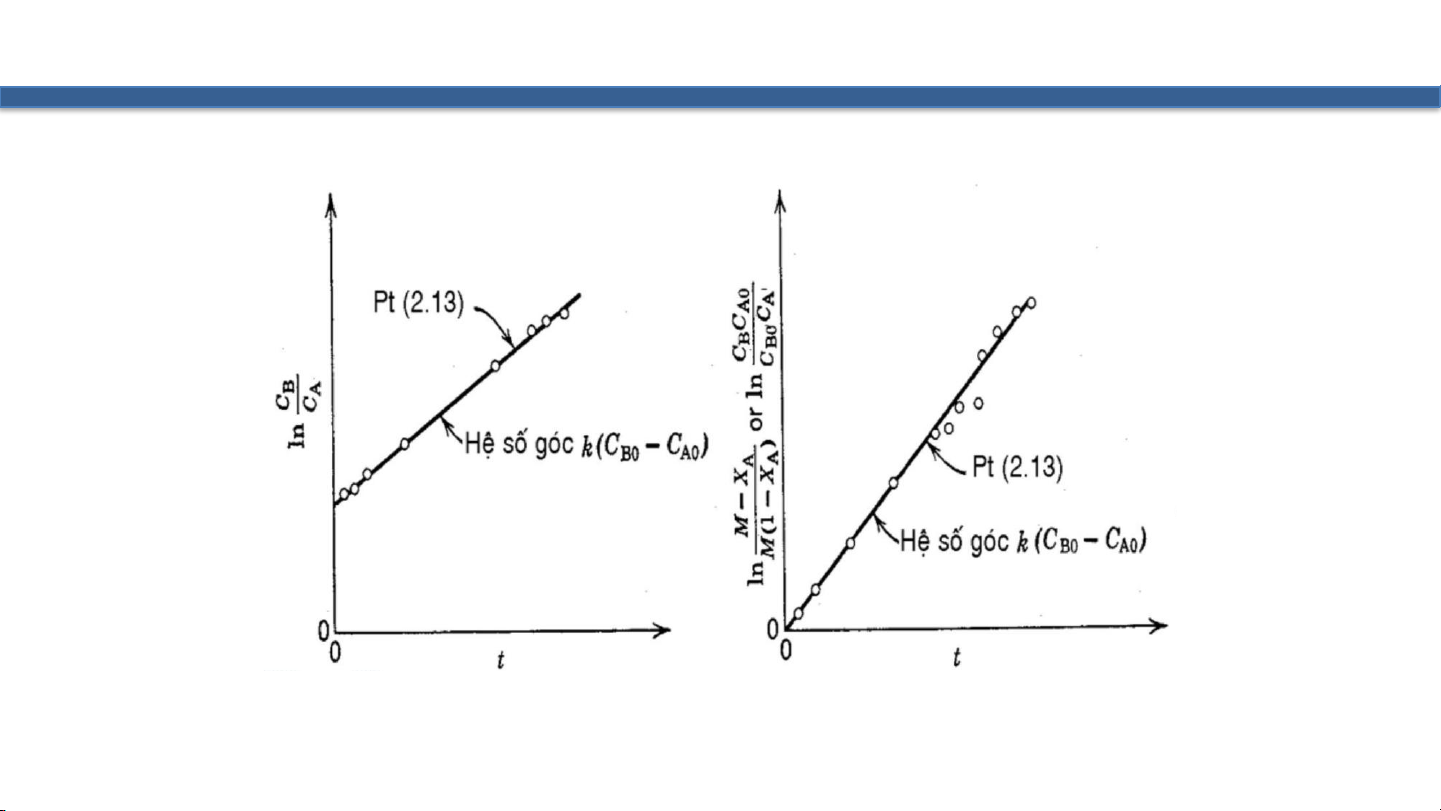
1 − 𝑋𝐴 𝑀 − 𝑋𝐴 0 1 − 𝑋 𝑀 − 𝑋 𝐶 𝐶 𝑙𝑛 𝐵 = 𝑙𝑛 𝐴
= 𝑙𝑛 𝐵𝐶𝐴0 = 𝑙𝑛 𝐵 1 − 𝑋𝐴 𝑀 1 − 𝑋𝐴 𝐶𝐵0𝐶𝐴 𝑀𝐶𝐴
= 𝐶𝐴0 𝑀 − 1 𝑘𝑡 = 𝐶𝐵0 − 𝐶𝐴0 𝑘𝑡, 𝑀 ≠ 1
▪ Nếu 𝑪𝑩𝟎 ≫ 𝑪𝑨𝟎 thì 𝑪𝑩 gần như không đổi, phản ứng xem như giả bậc một 16 Hình 2.3 17
Lưu ý: Tác chất dùng theo tỉ lệ lượng hóa học
a) 𝟐𝑨 → 𝒔ả𝒏 𝒑𝒉ẩ𝒎 𝑑𝐶 −𝑟 𝐴 2 2 2 𝐴 = − = 𝑘𝐶 = 𝑘𝐶 1 − 𝑋 (2.14) 𝑑𝑡 𝐴 𝐴0 𝐴 1 1 1 𝑋 − = 𝐴 = 𝑘𝑡 𝐶𝐴 𝐶𝐴0 𝐶𝐴0 1−𝑋𝐴
Vẽ 1/CA theo t ta được đường thẳng có hệ số góc là k, tung độ góc là 1/CA0 18
b) A + 2B → sản phẩm
Bậc 1 theo A, bậc 1 theo B, bậc tổng quát là 2 𝑑𝐶 −𝑟 𝐴 2 2 𝐴 = − = 𝑘𝐶 1 − 𝑋 ; 𝑀 = 2 (2.15) 𝑑𝑡 𝐴𝐶𝐵 = 2𝑘𝐶𝐴0 𝐴 𝑑𝐶 − 𝐴 = 𝑘𝐶 2 1 − 𝑋 𝑑𝑡 𝐴𝐶𝐵 = 𝑘𝐶𝐴0 𝐴
𝑀 − 2𝑋𝐴 ; 𝑀 ≠ 2 𝐶 𝑀 − 2𝑋
𝑙𝑛 𝐵𝐶𝐴0 = 𝑙𝑛 𝐴 = 𝐶 𝐶
𝐴0 𝑀 − 2 𝑘𝑡; 𝑀 ≠ 2 𝐵0𝐶𝐴 𝑀 1 − 𝑋𝐴
Tỉ lệ nồng độ ban đầu của tác chất bằng tỷ lượng hóa học (M = 2) 1 1 1 𝑋 − = 𝐴 = 2𝑘𝑡 𝐶𝐴 𝐶𝐴0 𝐶𝐴0 1 − 𝑋𝐴 19
(3) Phản trình vận tốc thực nghiệm có bậc n 𝑑𝐶 −𝑟 𝐴 𝑛 𝐴 = − = 𝑘𝐶 𝑑𝑡 𝐴 Lấy tích phân ta được: −𝑟 1−𝑛 1−𝑛 𝐴 = 𝐶𝐴
− 𝐶𝐴0 = 𝑛 − 1 𝑘𝑡, 𝑛 ≠ 1 (2.21)
Hay theo độ chuyển hóa XA: 𝐶1−𝑛 1−𝑛 𝐴0 1 − 𝑋𝐴 − 1 = 𝑛 − 1 𝑘𝑡 (2.22)
▪ Bậc n không thể xác định trực tiếp từ phương trình (2.21) hay (2.22)
→ sử dụng phương pháp dọ dẫm: chọn từng giá trị n → xác định k
→ Giá trị n cần tìm là giá trị làm k ít biến đổi nhất 20



