










Preview text:
CHƯƠNG 9 CÁC PHƯƠNG PHÁP PHÂN TÍCH ĐIỆN HÓA
9.1 PHƯƠNG PHÁP PHÂN TÍCH ĐIỆN THẾ
9.1.1 Các loại điện cực trong phân tích điện hóa
Điện cực là phần quan trọng trong mạch điện hóa, nhúng trong dung dịch chất
điện li và thực hiện phản ứng điện hóa. Có thể chia điện cực thành 3 loại chính dựa trên
chức năng của điện cực: điện cực loại 1, điện cực loại 2 và điện cực chọn lọc ion.
9.1.1.1 Điện cực loại I
Điện cực loại một có thế phụ thuộc nồng độ chất trong dung dịch. Nhóm này
gồm 3 loại chính điện cực kim loại – ion, điện cực oxi hóa – khử, điện cực hydro. a)
Điện cực kim loại - ion
Sơ đồ hệ điện cực gồm một kim loại nhúng vào dung dịch chứa ion của nó.
M ï M+ , ký hiệu“ï“ để chỉ bề mặt ngăn cách giữa hai pha rắn và lỏng.
Một vài thí dụ về loại điện cực này là điện cực bạc và đồng: AgïAg+; CuïCu2+...
Phản ứng trên bề mặt điện cực như sau: Mn+ + ne ⇋ Mo
Phương trình Nernst tương ứng là E = Eo + RT ln a n+
M . Trong đó R là hằng số khí, nF
T là nhiệt độ tuyệt đối, F là hằng số Faraday, n là số electron trao đổi. Khi thay các hằng
số R,T,F vào phương trình ở nhiệt độ 250C và chuyển sang logarit thập phân thì phương trình trên chuyển thành: E = Eo + 0,0592 lg a n+ M (9.1) n
Đối với cực bạc: E = 0,799 + 0,0592 lg[Ag+] (dung dịch loãng, hoạt độ bằng nồng độ)
b) Điện cực oxi hoá - khử
Điện cực được cấu tạo gồm cực kim loại quý, trơ (Pt, Au) nhúng trong dung dịch
chứa một cặp oxi hoá khử liên hợp Mm+/Mn+.
Thế cân bằng của điện cực tuân theo
phương trình Nernst như sau: m+ E = Eo + 0,0592 lg [ ] (9.2) m n- M c) Điện cực hydro
Điện cực có thể được dùng như điện cực so sánh hoặc điện cực chỉ thị pH. Cấu
tạo gồm kim loại platin phủ một lớp muội platin tinh khiết để hấp phụ lên bề mặt khí
H2, được mô tả bằng sơ đồ nửa bình điện thế như sau:
Pt ½ H2 (PH2= x.at) H+ ║. Trong đó, áp xuất của hydro, PH2 và nồng độ H+ có
thể thay đổi, ký hiệu “║“ để chỉ cầu muối trong bình điện thế.
Trên bề mặt cực Pt của hệ này có cân bằng: H2 - 2e ⇋ 2H+ Phương
trình Nernst viết cho điện cực này: [ ] E = Eo + 0,0592 lg H+ 2 (9.3) 2 PH2
Thế của cực hydro phụ thuộc hoạt độ ion hydro và áp suất của khí hydro trên bề
mặt điện cực. Khi áp suất riêng phần của khí hidro, PH2 trên bề mặt điện cực bằng 1 at
và hoạt độ ion hydro bằng 1, thế tiêu chuẩn Eo của điện cực này bằng 0.
9.1.1.2 Điện cực loại II
Điện cực loại II có cấu tạo gồm một kim loại phủ hợp chất khó tan của kim loại
đó đồng thời nhúng trong dung dịch muối chứa ion của kết tủa đó (thường bão hoà). Có
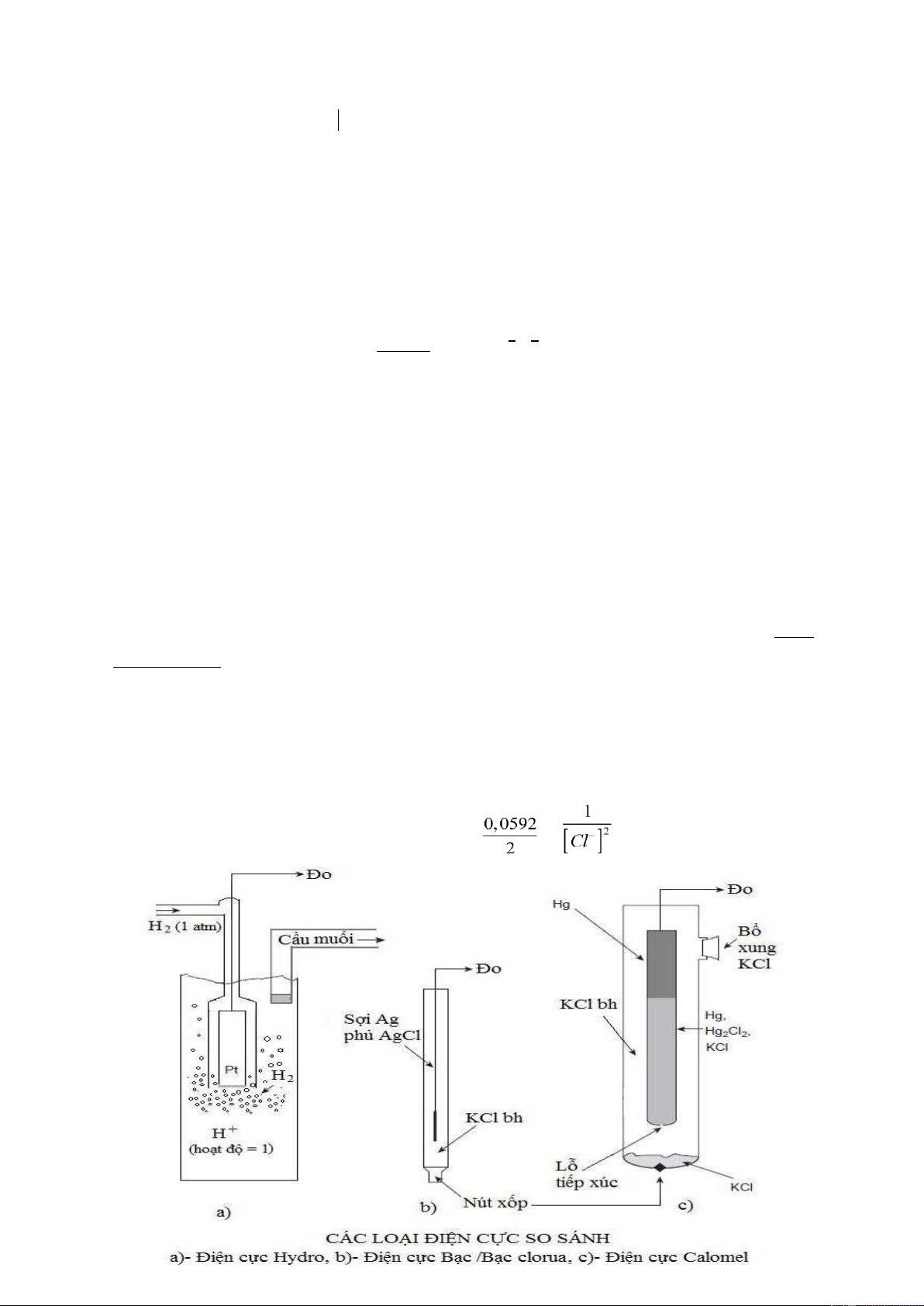
hai dạng điện cực loại 2 điển hình là điện cực calomen và điện cực bạc/bạc clorua. Điện cực calomen:
Điện cực có cấu tạo và phản ứng như sau: Hg, Hg2Cl2 ½ KCl ║ Hg2Cl2 + 2e ⇋ 2Hg + 2Cl -
Thế cân bằng của nó phụ thuộc vào nồng độ ion Cl - E = Eo + lg (9.4)
Hình 9.1 Các điện cực so sánh sử dụng trong bình điện thế
Khi nồng độ dung dịch KCl bão hoà thì thế của cực là 0,2420V so với cực hydro tiêu chuẩn (ở 250C).
Điện cực bạc / bạc clorua
Điện cực bạc/bạc clorua là hệ gồm một dây bằng bạc, trên bề mặt có phủ một lớp
bạc clorua nằm trong dung dịch chứa ion clorua có hoạt độ xác định (hình 9.1). Sơ đồ
nguyên lý và phản ứng của điện cực: Ag, AgCl ½ KCl ║
AgCl¯ + e ⇋ Ago + Cl - Thế
cân bằng của điện cực này tuân theo phương trình sau: E = Eo + lg (9.5)
Khi nồng độ dung dịch KCl bão hoà thì thế của cực này là 0,199V ở 250C.
Các điện cực loại II có thế không đổi nên thường được dùng làm cực so sánh
trong phân tích điện thế
9.1.1.3 Điện cực chọn lọc ion (ĐCI)
Điện cực chọn lọc ion là điện cực mà trong điều kiện thích hợp có thế cân bằng
chỉ phụ thuộc một cách chọn lọc vào hoạt độ (nồng độ) của một loại cation hoặc anion
nào đó trong dung dịch. Có 2 loại ĐCI như sau: + Điện cực thuỷ tinh
+ Điện cực màng rắn hoặc lỏng
a) Điện cực thuỷ tinh
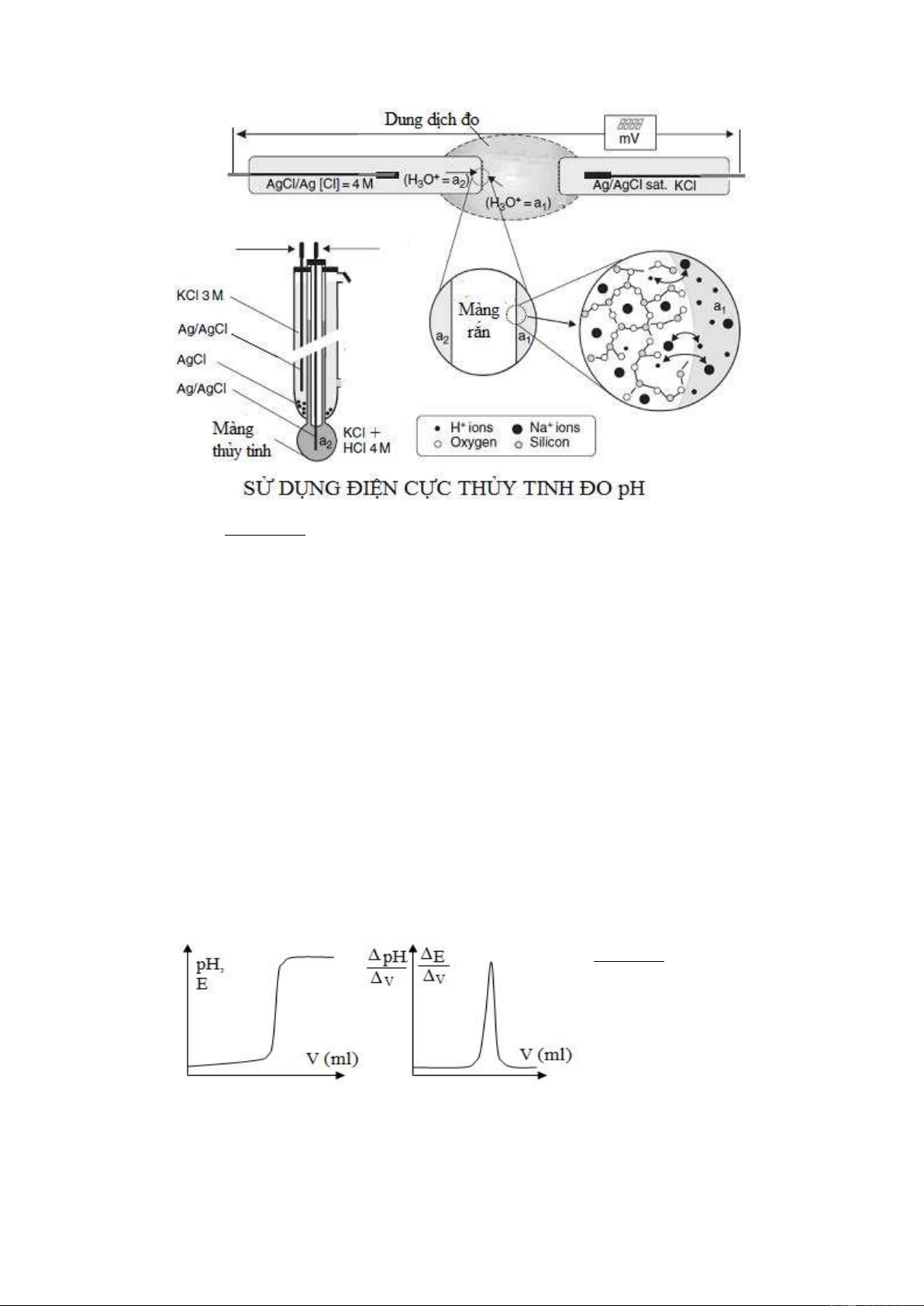
Điện cực gồm màng thuỷ tinh thường có thành phần: Na2O, SiO2, CaO (thí dụ
thuỷ tinh Corning có thành phần 22% Na2O; 6 % CaO; 72% SiO2) hình cầu chứa dung
dịch nội gắn với hệ dẫn điện cực. Thí dụ màng thủy tinh gắn với AgCl-dây bạc.
Ag, AgCl bão hoà ½ Cl- 1M , H3O+ (1) ½ Màng tt ║ Hình 9.2 Các điện cực chọn lọc ion A- Điện cực thủy tinh B- Điện cực màng
Thông thường, phía trong màng thuỷ tinh luôn tiếp xúc với một dung dịch nội có
nồng độ H+ xác định, phía kia của màng tiếp xúc với dung dịch đo, phản ứng trao đổi
ion giữa ion H+ của dung dịch và ion H+ của màng thuỷ tinh (R-H+Th) như sau:
H+dd + R-H+Th ⇌ R-H+dd + H+Th
Khi cân bằng được thiết lập thì trên ranh giới tiếp xúc điện cực và dung dịch xuất
hiện một thế gọi là thế cân bằng, thế này là hàm số của nồng độ ion H+ trong các dung
dịch mà màng ngăn cách. Như vậy hai phía của màng có hai dung dịch có nồng độ khác nhau sẽ có hai thế.
Hình 9.3 Xác định thế điện cực màng (thủy tinh)
Thế tiếp xúc phía trong của màng dung dịch nội có nồng độ H+ 0,1M/l và Cl-
4M, với nồng độ này cao, không đổi nên thế màng là hằng số. Có thể viết thế cân bằng
cho mặt tiếp xúc trong của màng thuỷ tinh như sau:
E1 = Eo1 + 0,059 log[H+](1)/[H+]’(1)
Trong đó, Eo1 là hằng số phụ thuộc cực tiếp xúc và dung dịch 1, [H+](1), [H+]’(1) là
nồng độ của H+ của dung dịch nội và bề mặt tiếp xúc trong, với hệ số hoạt độ bằng 1.
Phía ngoài màng tiếp xúc với dung dịch đo (x) có thế:
E2 = Eo2 + 0,059 log[H+] (x)/[H+]’(2)
Trong đó, Eo2 là hằng số phụ thuộc cực tiếp xúc và dung dịch 2, [H+](x), [H+]’(2) là
nồng độ của H+ của dung dịch đo và bề mặt tiếp xúc ngoài, với hệ số hoạt độ bằng 1.
Thế màng là hiệu thế của hai mặt màng thuỷ tinh:
o - Eo2 + 0,0592log[[HH++ ](1).[](x).[HH++ ]]''(2)(1) EM = E1 -E2 hay EM = E1
Các đại lượng [H+](1), [H]’(1), [H+]’(2) là hằng số, như vậy, thực chất, thế của màng
chỉ phụ thuộc nồng độ H+ bên ngoài là hằng số nên EM chỉ phụ thuộc [H+](x) EM = ConstantM + 0,0592pH (9.6)
b) Điện cực màng rắn, lỏng
Màng rắn đồng thể thường được chế tạo từ các loại đơn tinh thể của các hợp chất
khó tan như lantan florua LaF3 hoặc các muối nóng chảy được để đông cứng và các
muối khó tan ở dạng bột (như AgCl, CuS, Ag2S,...) được nén và ép trong khuôn ở áp
suất cao thành viên mỏng. Màng rắn dị thể được chế tạo bằng cách đưa tinh thể chất có
hoạt tính điện cực vào khung tạo màng thích hợp như cao su silicon hoặc PVC.
Điện cực màng lỏng có hai kiểu khác nhau. Một loại được chế tạo một ngăn
mỏng chứa một chất trao đổi ion lỏng, thí dụ để phân tích Ca2+ dùng di-(ndecyl)
photphate. Ngăn chứa chất trao đổi ion đó dược gắn vào cuối thân cực bằng teflon
(PVC). Mặt ngăn tiếp xúc với dung dịch phân tích là một màng xốp bằng teflon hay
PVC. Dung dịch nội chứa ion Ca2+ có nồng độ chuẩn, phía ngoài màng là dung dịch
phân tích Ca2+. Phản ứng xảy ra ở cả hai phía của màng khi các dung dịch tiếp xúc với màng như sau: Ca2+ + 2 (C -
10H21O)2PO2 = Ca(C10H21O)2PO2. Do chênh lệch nồng độ
Ca2+, xuất hiện thế màng tương ứng với nồng độ Ca2+.
Loại thứ hai dùng màng chọn lọc gắn với hệ dẫn gồm dung dịch nội và muối khó
tan của kim loại và dây dẫn kim loại để tạo thành một bán pin điện, xem hình 9.2
9.1.2 Bình điện thế và thế điện cực tiêu chuẩn
Một bình điện thế bao gồm một hệ điện cực và các thiết bị cần thiết khác để các
cân bằng phản ứng ở catot và anot không hoàn toàn bị phá vỡ và xuất hiện dòng điện
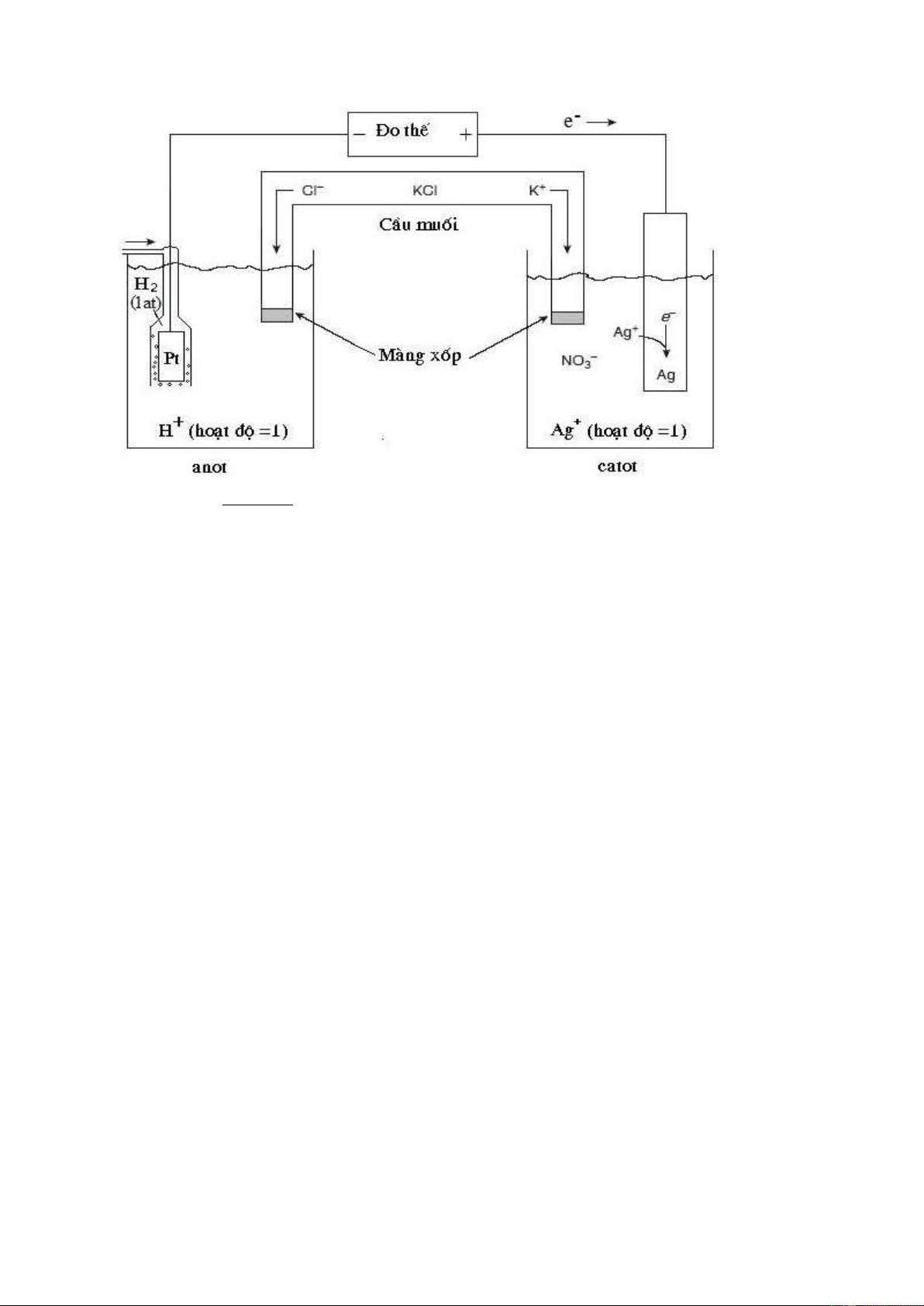
rất nhỏ trong mạch. Thí dụ bình điện thế gồm điện cực Ag nhúng trong dung dịch Ag+
và điện cực hydro tiêu chuẩn H2 (Pt) nhúng trong dung dịch H+. Hai điện cực được nối
với nhau bằng dây dẫn, còn hai dung dịch được nối với nhau qua cầu muối (hình 9.4).
Hình 9.4 Bình điện thế đo thế tiêu chuẩn của điện cực Ag Ở
bình này, cân bằng phản ứng ở các điện cực xảy ra như sau: Catot : Ag+ + e ⇌ Ago Anot : 1/2H2 –e ⇌ H+
Các electron cho và nhận này được di chuyển trong dây dẫn, đồng thời cầu muối
làm nhiệm vụ trung hòa điện tích của các dung dịch. Tất cả các phản ứng và di chuyển
của điện tích phải được thực hiện đồng thời thì đây mới được gọi là bình điện thế. Tất
nhiên, khi đo thế điện cực hay thế của bình, cần hạn chế dòng trong mạch gần như bằng
zero để đảm bảo thế đo chính xác.
Thế điện cực tiêu chuẩn (Eo) được xác định trong điều kiện hoạt độ của các chất
điện hoạt bằng đơn vị và nhiệt độ 25oC. Để đo được thế tiêu chuẩn của một điện cực bất
kỳ, phải dựa vào thế điện cực tiêu chuẩn của một điện cực đã biết, ghép hai điện cực
trong một bình điện thế, với các điều kiện đã đề cập ở trên, đo thế của bình từ đó tính
thế của điện cực.Trong bình điện thế trên để đo thế điện cực tiêu chuẩn của điện cực
Ag, nhúng điện cực Ag trong dung dịch có hoạt độ Ag+ bằng 1 ở 25oC. Điện cực so sánh
là điện cực hydro tiêu chuẩn (hoạt độ H+ =1, áp suất H2 1 at, nhiệt độ 25oC).
Trong điều kiện tiêu chuẩn như vậy, thế của cực hydro bằng zero, thế của bình
điện thế chính là thế của điện cực bạc, Eo = + 0,799V. Kí hiệu “+” để chỉ rõ dòng electron
chảy từ trái qua phải; điện cực Ag đóng vai trò catot. Bình điện thế như vậy được ký hiệu như sau:
Pt (r) ½ H2(hđ=1)½ H+(hđ= 1)║Ag+ (hđ=1) ½ Ag(r)
Ta cũng có thể viết gọn lại theo sơ đồ: S.H.E║Ag+ (hđ=1) ½ Ag(r), trong đó
S.H.E được viết tắt từ standard hydrogen electrode.
9.1.3 Phương trình Nernst
Một bán phản ứng xảy ra theo phương trình: aA + ne ⇌ bB Phương
trình Nernst được viết cho bán phản ứng như sau: E = +Eo RTnF lnaaaAbB
Trong đó: Eo là thế điện cực tiêu chuẩn (khi hoạt độ các cấu tử bằng đơn vị), T
nhiệt độ tuyệt đối, n là số electron trao đổi của bán phản ứng, F hằng số Faraday, a là
hoạt độ của tiểu phân i.
9.1.4 Xác định thế của bình và chiều của phản ứng
Chúng ta đã đề cập đến bình điện thế như hình 9.8 ở trên, tuy nhiên đôi khi
cũng gặp khó khăn để xác định anot và catot hay chiều dòng điện trong mạch. Bằng
việc tính toán thế của bình, có giá trị “-“ hay “+” ta có thể biết được chiều của phản
ứng. Nguyên tắc chung xác định thế của một bình điện thế là dựa vào thế của điện cực
tiêu chuẩn và thế tiêu chuẩn, Eo của điện cực, từ đó tính thế của bình.
Có năm bước tính thế của bình điện thế là:
Bước 1.Viết các phản ứng của hai nửa bình điện thế (Eo có trong phụ lục).
Bước 2:Viết phương trình Nernst cho bán phản ứng bên phải, tếp xúc với đầu dương
của nguồn điện hoặc đồng hồ đo điện thế, đó là Ep (thông thường là catot, là
cực nhận electron chuyển từ anot tới)
Bước 3 Viết phương trình Nernst cho bán phản ứng bên trái, tiếp xúc với đầu âm của
nguồn điện hoặc đồng hồ đo điện thế, đó là Etr.
Bước 4 Tìm thế của bình điện thế qua Ep và Etr (bỏ qua thế tiếp xúc) E = Ep - Etr
Bước 5 Xác định chiều phản ứng (trừ đại số hai bán phản ứng, lấy phương trình phải
trừ phương trình trái), nếu kết quả + thì phản ứng xảy ra theo chiều thuận còn
khi kết quả có giá trị âm, phản ứng xảy ra theo chiều ngược.
Mặt khác từ thế của bình điện thế (đo được) và thế của điện cực so sánh, có thể
tìm ra thế của một điện cực bất kỳ. Hình 9.5:
Nguyên tố điện hoá (bình điện thế) dùng
trong phân tích điện thế gồm cực so sánh
calomen và cực chỉ thị
Người ta cố gắng hạn chế tối đa dòng
điện trong mạch đo thế sao cho I » 0 bởi vì
dòng điện làm thay đổi thế điện cực, phép đo bị ảnh hưởng.
Giả sử có điện cực calomen bão hoà KCl có
thế so với cực hidro tiêu chuẩn là 0,242V ở 250C được dùng làm điện cực so sánh được
ghép với một điện cực chỉ thị, nguyên tố đó được mô tả bằng sơ đồ sau:
Điện cực so sánh ║Cầu muối ç Dung dịch nghiên cứu ç Điện cực chỉ thị
Điện cực cần đo thế còn gọi cực chỉ thị, trên đó xảy ra phản ứng khử là cực phải
catot (Ep), cực so sánh là cực anot (Etr), khi nối mạch, còn sinh ra một thế tiếp xúc rất
nhỏ (Etx) thì thế đo được Eđo sẽ bằng: Eđo = Ep - Etr + Etx (9.7)
Nếu chất điện li dùng để dẫn điện trong cầu muối được chọn là chất mà cation
của nó có linh độ ion rất gần nhau (chẳng hạn KCl hoặc KNO3) thì giá trị của thế tiếp
xúc rất nhỏ, có thể bỏ qua được và từ giá trị E đo được và giá trị của thế cực so sánh ta
dễ dàng tính được thế của cực chỉ thị.
Thí dụ 9.1: Tìm giá trị thế của bình điện thế mà nửa phải của bình là cực bạc nhúng
trong dung dịch AgNO3 0,50M còn ở nửa trái của bình điện thế là cực cadimi nhúng
trong dung dịch Cd(NO3)2 0,010M. Viết phản ứng tổng quát và xác định chiều của phản ứng. Giải: Bước 1
Phản ứng ở cực phải 2Ag+ + 2e = 2Ag(r) ; Eo = 0,799V
Phản ứng ở cực trái Cd(r) - 2e = Cd2+ ; Eo = -0,402V Bước 2
Phương trình Nernst cho điện cực phải
Ep = Eop + (0,0592)/2log[Ag+]2
= 0,799 + (0,0592)/2log (0,50)2 = 0,781 Bước 3
Phương trình Nernst cho cực trái
Etr = Eotr + (0,0592)/2log[Cd2+]
= -0,402 + (0,0592/2) log(0,010) = -0,461 Bước 4 Tìm thế của bình
E = Ep - Etr = 0,781- (-0,461) = + 1,242 V Bước 5
Phương trình tổng cộng của bình: 2Ag+ + 2e = 2 Ag(r) Cd(r) - 2e = Cd2+
→ Cd(r) + 2Ag+ = Cd2+ + 2Ag(r)
Thế của bình có giá trị “+” nên phản ứng có chiều từ trái qua phải, điều đó có nghĩa Cd
bị oxi hóa còn Ag+ bị khử.
9.1.5 Ứng dụng của phương pháp phân tích điện thế
9.1.5.1 Đo điện thế trực tiếp xác định nồng độ chất trong dung dịch
Trong phương pháp này bình điện thế, còn gọi là nguyên tố galvanic được thiết lập
giống phần trên. Cực so sánh có thế không đổi Es, ghép với điện cực chọn lọa ion có thế
Ect phụ thuộc nồng độ ion chất phân tích. Ngoài ra hệ còn có thế tiếp xúc, Etx thường
nhỏ. Thế đo được của hệ có mối liên hệ sau: Eđo = Ect – Es + Etx (9.8)
Khi thế của điện cực chỉ thị phụ thuộc nồng độ ion X (hệ số hoạt độ =1) ta có: E n ct = L –
0,059 pX; Thay Ect vào 14.11 ta có: -log[X] = pX =- (Eđo + Es –Etx -L) n 0,059
Phương trình trên có thể viết gọn lại khi ES, Etx và L đều là hằng số, viết chung là K: pX = - n (Eđo –K) (9.9) 0,059
Tương tự đối với anion, ta có phương trình pA = n (Eđo –K) (9.10) 0,059
Hai phương trình (9.9) và (9.10) dùng để xác định trực tiếp nồng độ chất phân tích nếu
biết hằng số K. Người ta có thể xác định K bằng thực nghiệm dựa vào dãy dung dịch
chuẩn đã biết trước nồng độ.
9.1.5.2 Dùng phương pháp thêm chuẩn và đo điện thế trực tiếp xác định nồng độ chất trong dung dịch
Phương pháp thêm chuẩn được thực hiện với hai phép đo trong bình đện thế giống
ở trên: thứ nhất là đo thế của dung dịch có nồng độ X được Eđo1, thêm một lượng chính
xác chất chuẩn và thực hiện phép đo tương tự như trên được Eđo2. Dựa vào biểu thức
(9.12) tính ra nồng độ chất phân tích.
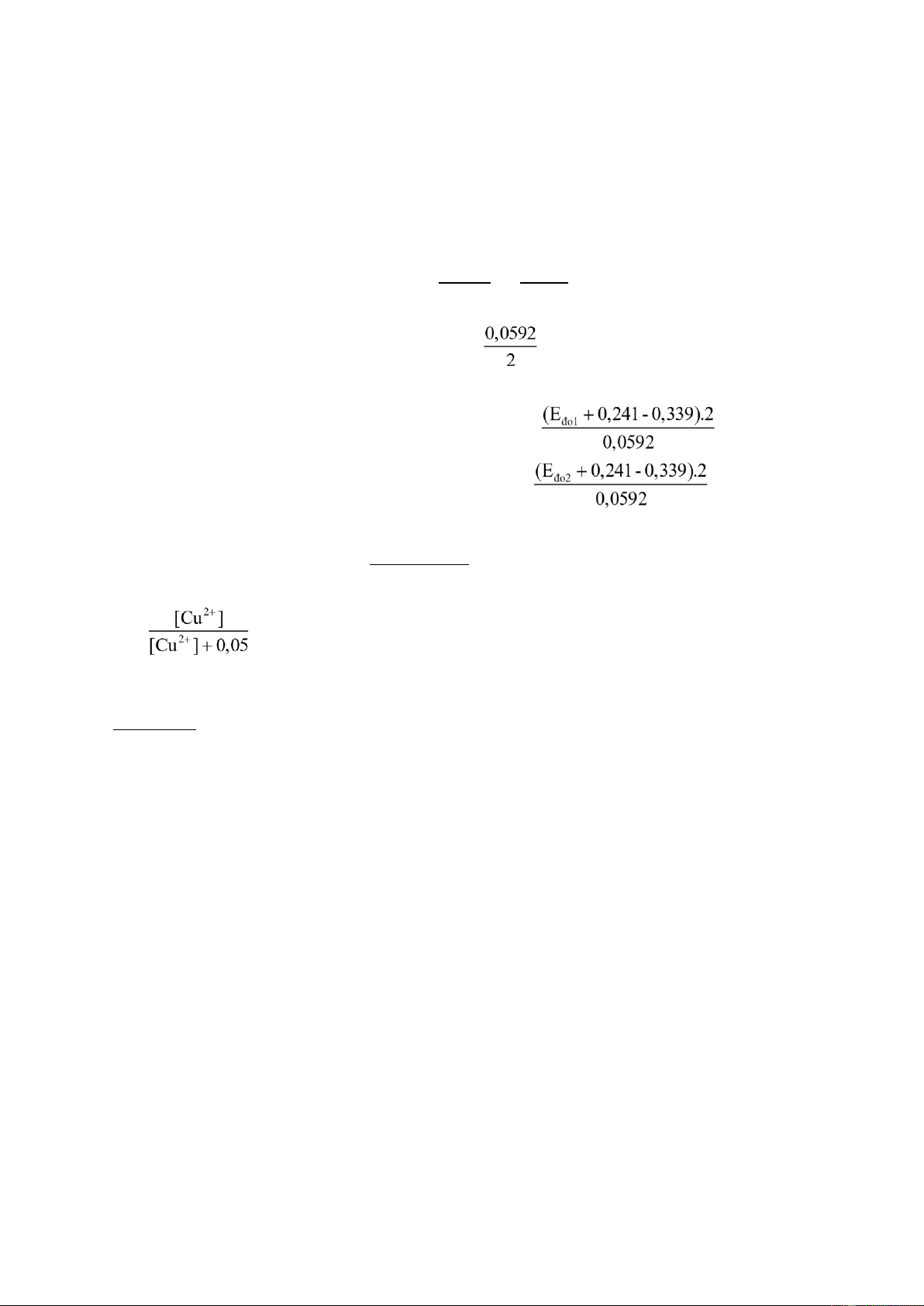
Thí dụ 9.2: Một bình điện thế gồm cực Cu và điện cực calomen bãp hòa nhúng trong
dung dịch CuSO4 0,1M. Cực Cu đóng vai trò catot còn cực calomen đóng vai trò cực
anot. (EoCu2+/Cu= 0,339V; EoCal.bh= 0,241V)
a) Viết phản ứng cho cực Cu
b) Viết phương trình Nernst cho điện cực Cu
c) Tính thế cho bình khi nồng độ CuSO4 0,1M
d) Bình điện thế chứa dung dịch CuSO4 không biết nồng độ có thế 0,05V, thêm vào
bình điện thế một lượng CuSO4 có nồng độ 0,05M, thể tích không đổi, thế của
bình lúc này là 0,1V. Tính nồng độ CuSO4 ban đầu.
Giải: a) Phương trình phản ứng cho điện cực Cu: Cu2+ + 2e ⇌ Cuo
b) Phương trình Nernst: E=EoCu2+/Cuo + 0,0592 log[Cu2+o ] 2 Cu
c) Tính thế: Eđo= Ep - Etr hayE = đo 0,339 +
log0,1- 0,241(bỏ qua thế tiếp xúc) Eđo = 0,068 V
d). Với dung dịch chưa biết nồng độ: log[Cu2+]= (9.11)
Thêm 0,05M Cu2+ vào: log([Cu2+]+0,05) = (9.12) [Cu2+]
Lấy 9.11 trừ 9.12 ta có: log[Cu2+]+ 0,05 =-1,689187 = 0,02 Þ [Cu2+] = 0,05M
Thí dụ 9.3: Tính thế và vẽ độ thị đường cong thế khi thêm dần dung dịch NaBr 0,05M
vào 50 ml dung dịch AgNO3 0,05M. Biết rằng bình điện thế gồm cực so sánh là cực
thủy tinh có điện thế +0,2V, cực chỉ thị là sợi dây bạc. Các thể tích NaBr lần lượt được
thêm vào là: 1,0ml ; 25,0ml; 49,5ml; 50,0ml; 50,5ml; 55,0ml; 60,0ml.
Cho EoAg+/Ag= 0,799V , TAgBr = 5.10-13 Giải:
Phản ứng điện cực: Ag+ + e ⇋ Ago.
Eđo = Ep - Etr vậy Eđo = (0,799 + 0,0592log[Ag+]) - 0,2 Phản ứng chuẩn độ: Ag+ + Br- = AgBr¯
Điểm tương đương ứng với thể là 50 ml
V= 1 ml: Số milimol Ag+ ban đầu 50x0,05 = 2,5 mM Số milimol Br- đã chuẩn 1x0,05 = 0,05mM Số milimol Ag+ dư: 2,5-0,05 = 2,45mM
Nồng độ Ag+ là : 2,45/51= 0,048M
Eđo = (0,799 + 0,0592log 0,048) – 0,2 = 0,521V
V= 25 ml E = 0,4937V; V = 49,5ml E = 0,3857V
V =50,0 ml Nồng độ Ag+ tính theo tích số tan của AgBr
[Ag+] = (5.10-13)1/2 = 7,071.10-7; E = 0,235V
V = 50,5ml [Br-] = (0,5 x 0,05)/100,5 = 2,4876.10-4
[Ag+] =5.10-13/ 2,4876.10-4 = 2,01.10-9; E = 0,084V
V = 55 ml E = 0,0261V ; V = 60ml E = 0,00945 V
9.1.5.3 Đo pH của dung dịch
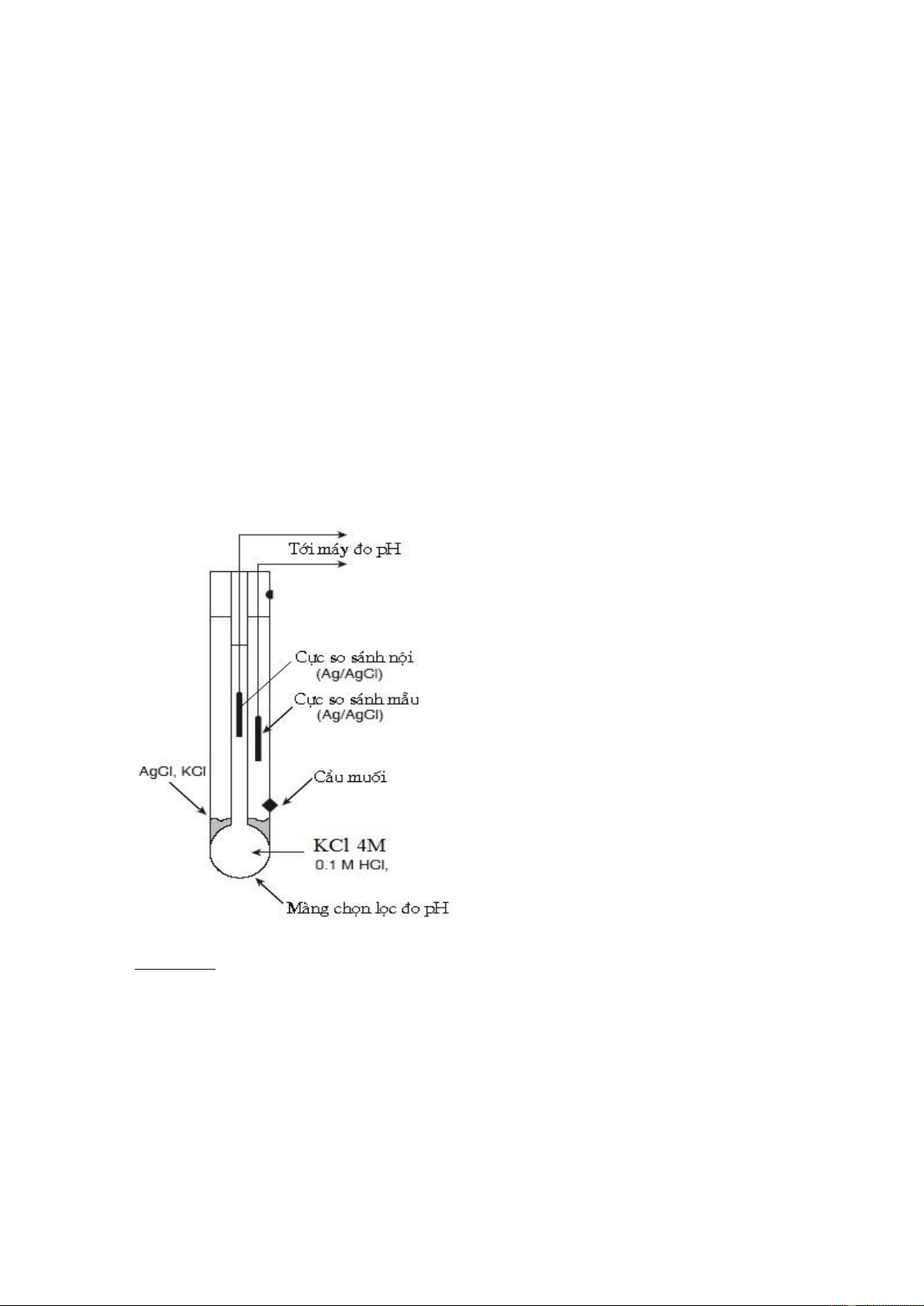
Để đo pH của dung dịch, ghép điện cực màng thuỷ tinh với điện cực so sánh
(Ag/AgCl) để tạo thành nguyên tố galvanic, sơ đồ của nguyên tố điện hoá đó là:
Ag, AgCl½Cl- 4M, H3O+(1) ½Màng tt ║H3O+(2)đo, KClbh½AgCl, Ag
Đây là bình điện thế gồm hai điện cực Ag/AgCl nối với nhau qua hệ dẫn trong
đó thế màng tiếp xúc với dung dịch phân tích quyết định thế của bình và biến đổi thành pH của dung dịch.
Phía bên phải của bình điện thế, điện cực bạc clorua có thế điện cực, EAgCl phụ
thuộc EoAgCl và nồng độ Cl-, tuy nhiên nồng độ Cl- rất lớn (bão hòa), không đổi nên thế
điện cực này là hằng số.
Phía bên trái của bình cũng gồm điện cực
Ag/AgCl tiếp xúc với dung dịch phía trong
màng thủy tinh có nồng độ KCl 4M, pH=1,
cũng có thế màng nhất định không đổi sau
đó mới đến dung dịch đo pH qua phía ngoài
của màng thủy tinh (hình 9.6b).
Các ion hydro từ dung dịch trao đổi với
Na+ hoặc H+ của mạng lưới là cơ sở hình
thành thế màng. Hoạt độ của H+ của dung
dịch nội lớn, không đổi, như vậy toàn bộ
mạch điện hóa, duy nhất thế màng thủy tinh
phía ngoài thay đổi theo nồng độ H+ của dung dịch đo.
Hình 9.6a Điện cực thủy tinh đo pH
Thế đó biểu thị bằng mV, tuy nhiên để cho tiện, biến đổi thành pH của dung dịch.
Hình 9.6b Điện cực thủy tinh và các phản ứng điện cực
EAgCl.= EoAgCl - 0,059 log[Cl-] = costantC (9.13)
Kết hợp với phương trình (9.6), thế của bình là thế đo tổng cộng, Eđo là:
Eđo = EAgCl - EM = constantC – (costantM + 0,0592 pH)
Hay Eđo = constant - 0,0592 pH (9.14)
Ghi chú: thuỷ tinh bị tan trong kiềm mạnh và axit mạnh nên phương trình trên áp dụng
đo các dung dịch có pH 1-11.
9.1.5.4 Chuẩn độ điện thế
Chuẩn độ điện thế là một phương pháp phân tích thể tích trong đó người ta không
dùng các chất chỉ thị hoá học để xác định điểm cuối của phép chuẩn độ mà đo thế của
điện cực chỉ thị trong quá trình chuẩn độ.
Điện cực chỉ thị là điện cực có thế cân bằng phụ thuộc vào nồng độ của thuốc
thử hoặc nồng độ của chất cần chuẩn độ, điện cực so sánh có thế không đổi. Sơ đồ
thiết bị được trình bày ở hình 9.8 và các dạng đường định phân được biểu diễn ở hình 9.7.
Hình 9.7 Các loại đường định
phân trong chuẩn độ điện thế
Có thể biểu diễn đường cong chuẩn độ theo pH - V(ml), E - V(ml), trong đó E là
thế của nguyên tố đo được trong quá trình chuẩn độ hoặc DpH (DE) /DV - V(ml). Hình 9.8:
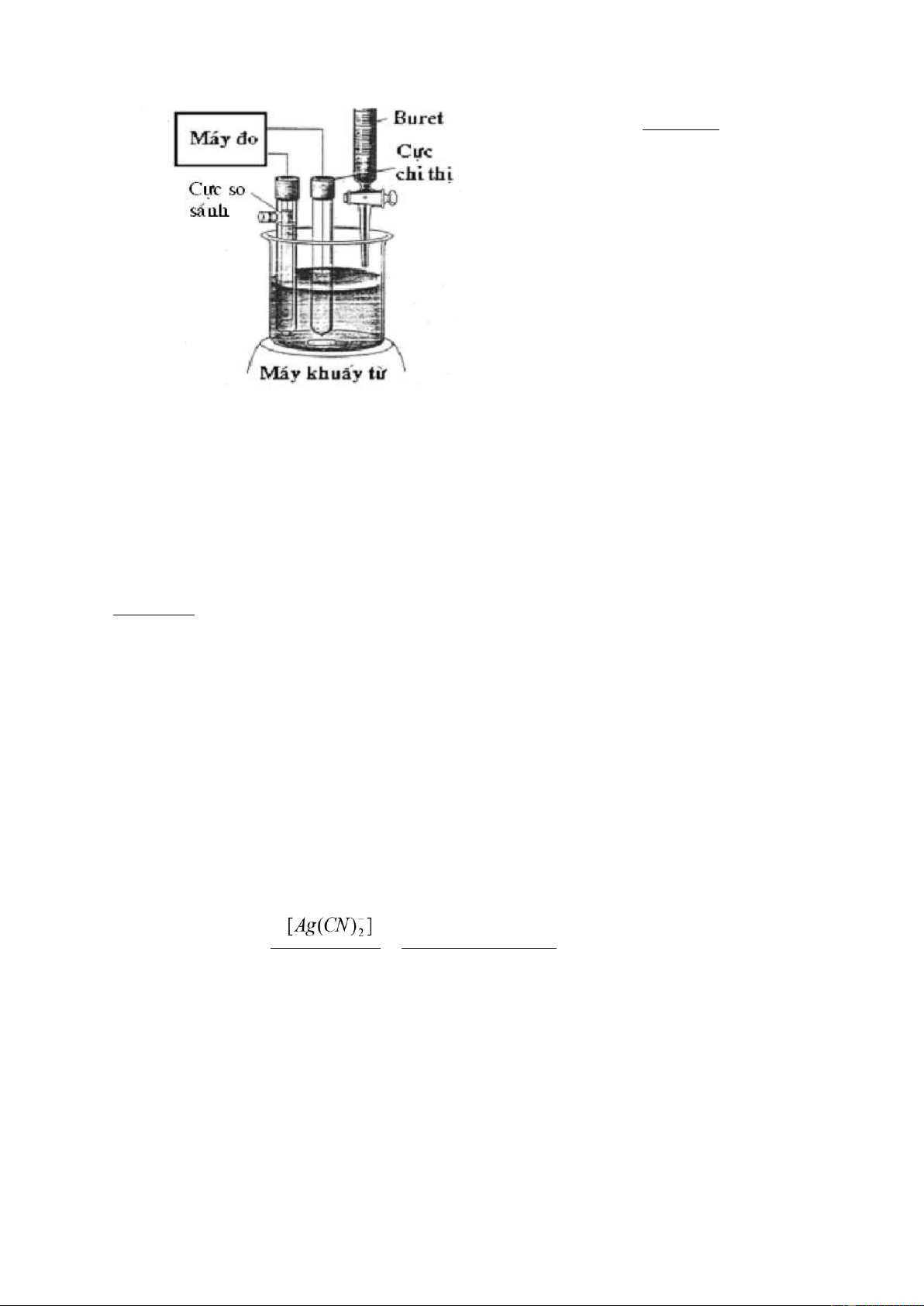
Sơ đồ thiết bị chuẩn độ điện thế gồm bình
điện thế dùng cực calomen, cực chỉ thị,
máy đo thế, buret và máy khuấy từ.
Thiết bị chuẩn độ điện thế theo dõi được
sự biến thiên nồng độ của chất cần xác
định hoặc thuốc thử trong quá trình chuẩn
độ và từ đó vẽ được đường định phân và
xác định được điểm tương đương.
9.1.5.5 Xác định hằng số cân bằng
Tích số tan, hằng số bền, hằng số phân ly có thể tính được qua phép đo thế điện
cực. Phương pháp có thể đo thế của các cân bằng phức tạp trong dung dịch, thí dụ thế
điện cực bạc trong dung dịch chứa các ion Ag+, CN-, và phức hình thành giữa chúng
phụ thuộc vào cả ba cấu tử. Ag+ + 2CN- ⇌ Ag(CN) -2
Thí dụ 9.4 Một bình điện thế được ghép bởi điện cực Ag và calomen bão hòa (saturated
calomel electrode- SCE) như sau:
SCE║Ag(CN) -2(7,5.10-3M), CN- (0,025M) ∣ Ag. Tính hằng số bền của
phức Ag(CN) -2 biết thế của bình - 0,625 V; thế điện cực calomen bão hòa là 0,244V.
Giải: Phản ứng điện cực: Ag+ + e = Ago ; Eo = + 0,799V
-0,625 V = Ep - Etr = EAg+ - 0,244
Vậy Ep = -0,625 + 0,244 = -0,381V
Phương trình Nernst cho điện cực Ag: -0,381 = 0,799 + 0,0592 log [Ag+]
Log [Ag+] = (-0,381 – 0,799)/0,0592 = 19,93 [Ag+] = 1,2.10-20 ; Kb = 1.10
Kb = [Ag+].[CN-]2 = 1.2.107-20,5.(x102,5.-310-2 2) 21
9.2 PHƯƠNG PHÁP ĐIỆN PHÂN VÀ ĐIỆN LƯỢNG.
9.2.1 Cơ sở của phương pháp điện phân và điện lượng
9.2.1.1 Định luật Faraday
Điện phân là quá trình phân huỷ chất dưới tác dụng của dòng điện. Chất bị thay
đổi số oxi hoá, để biến thành chất khác, thí dụ dưới tác dung của dòng điện, ion đồng
biến thành đồng kim loại trên catot, còn clorua lại biến thành khí clo… Cu2+ + 2e = Cuo (9.15) 2Cl- - 2e = Cl2 (9.16)
Người ta thấy mối tương quan giữa lượng chất phản ứng trên điện cực và lương
điện tiêu thụ. Nhà điện hoá học người Anh M. Faraday năm 1934 đã tìm ra quy luật về
mói quan hệ này và ông đã đưa ra 2 định luật cơ bản về sự điện phân như sau: 1.
"Lượng các chất tham gia phản ứng điện cực và được tạo thành trên bề mặt các
cực trong quá trình điện phân tỉ lệ thuận với điện lượng đi qua dung dịch". 2.
"Với những điện lượng như nhau trong quá trình điện phân, lượng một chất được
tạo thành trên điện cực tỉ lệ thuận với đương lượng hoá học của chất đó".
1 Faraday có giá trị 96487 culong, làm tròn là 96500, kí hiệu là F. Kết hợp hai
định luật trên, ta có công thức biểu diễn lượng chất thoát ra trên các điện cực trong quá
trình điện phân như sau: M m = 1. .Q (9.17) F n
trong đó, m là lượng các chất thoát ra trên điện cực, tính bằng gam (g), điện lượng Q
tính bằng culong, C, n là số electron trao đổi, tỉ số M / n là đương lượng hoá học. Mặt
khác điện lượng Q có thể tính từ dòng điện và thời gian điện phân, giây (Q=It); vì vậy
phương trình 9.17 có thể viết lại là: M m = 1 . .It (9.18) F n
9.2.1.2 Đường phân cực, điện áp phân hủy
Đường phân cực là đường biểu diễn sự phụ thuộc của cường độ dòng điện vào
điện thế áp vào các điện cực.
Trên đồ thị đường phân cực, trục hoành là trục biểu diễn thế còn trục tung ghi
các giá trị cường độ dòng. Điện áp phân cực từ gốc toạ độ về phía phải là về phía âm
hơn (catot). Đường phân cực còn được gọi là đường dòng-thế hoặc đường von-ampe.
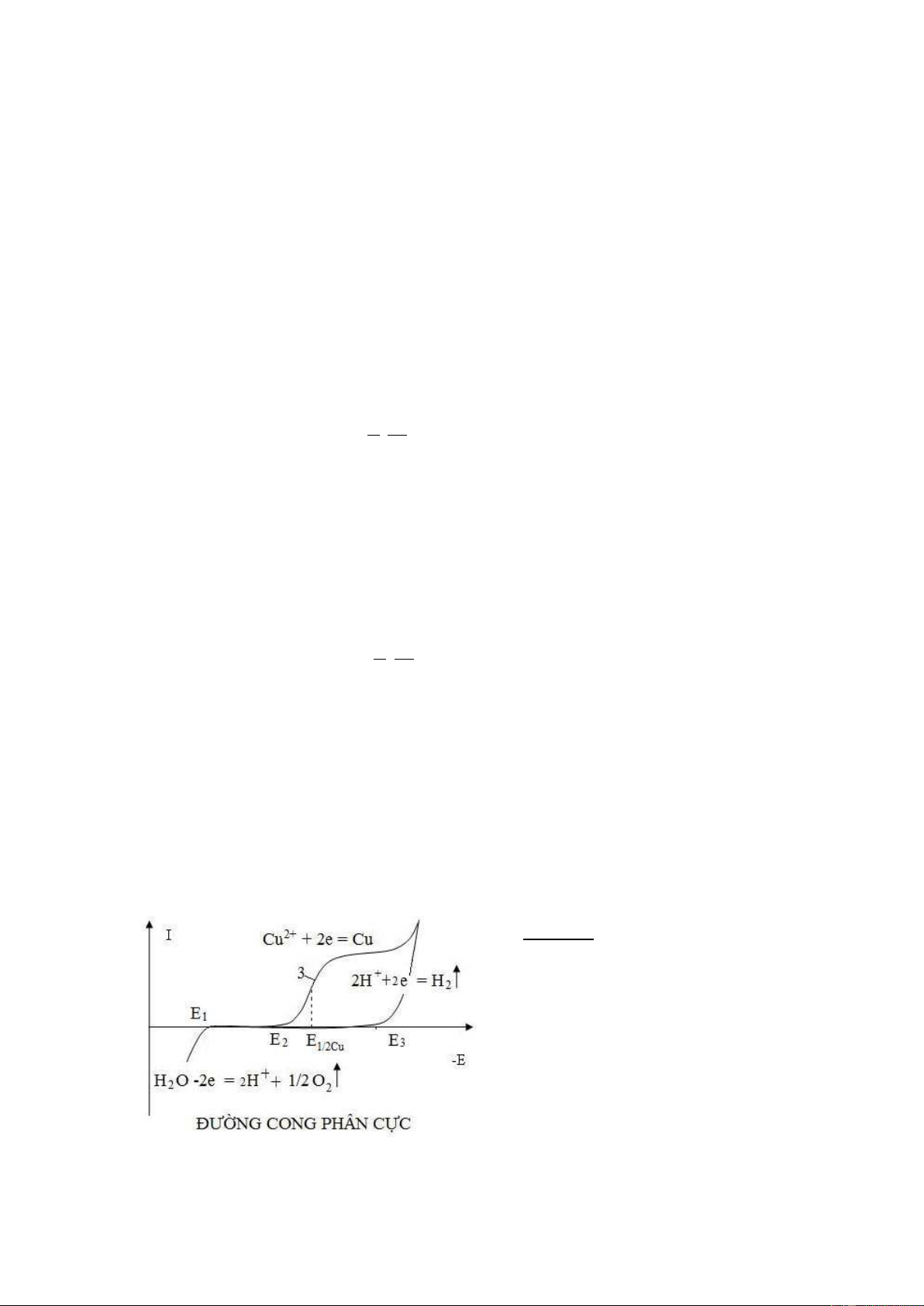
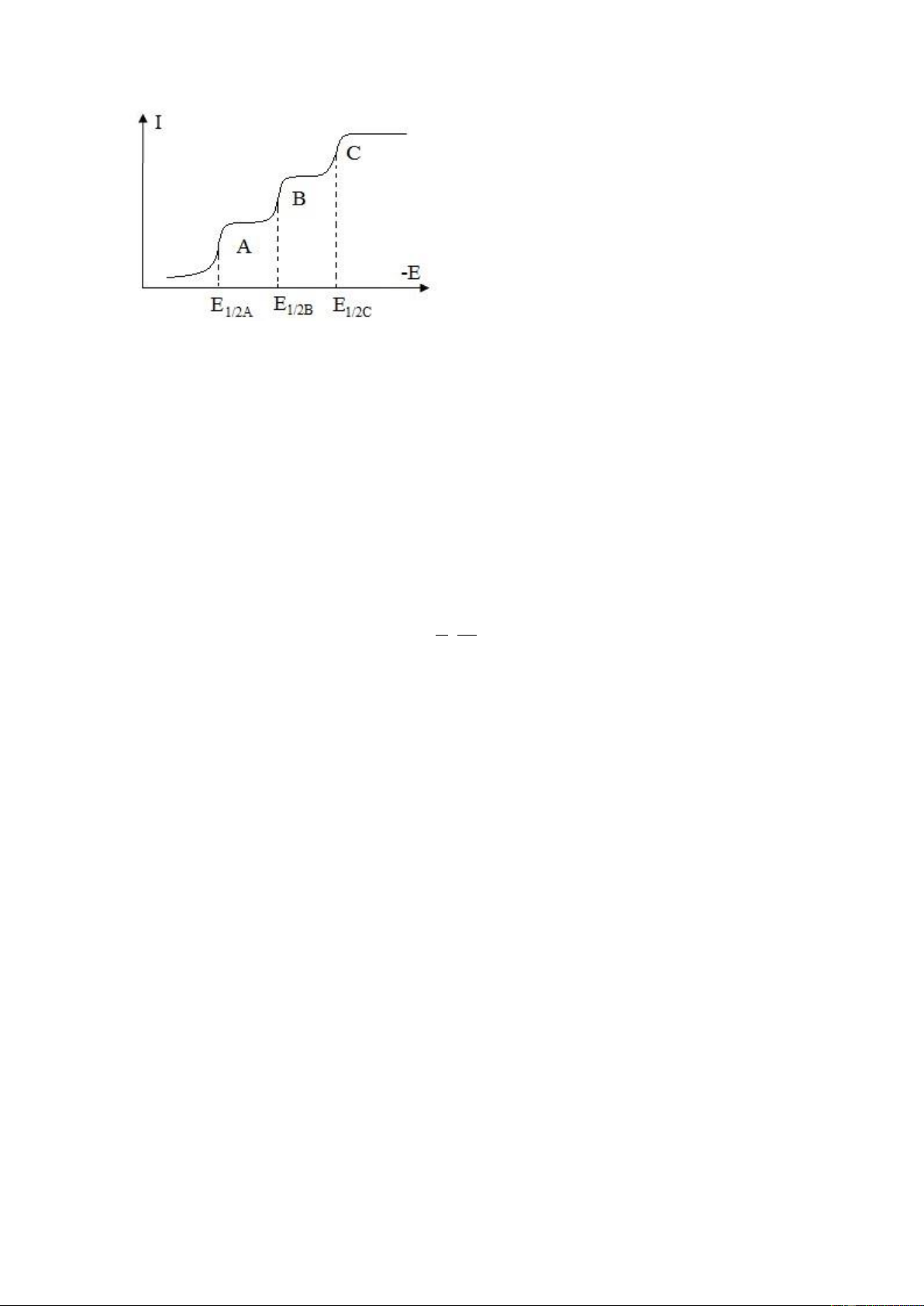
Hình 9.9 Đường von-ampe dung dịch CuSO4
Trên hình 9.9 là các đường điện
phân của dung dịch H2SO4 và dung dịch
CuSO4 trong nền dung dịch H2SO4 trên
điện cực Pt (cực so sánh calomen và cực phụ trợ bằng Pt).
Đoạn gần gốc toạ độ, tương ứng với thế E1 được gọi là thế phân huỷ có dòng
anot, trong đó trên anot Pt xảy ra phản ứng oxi hoá nước:
H2O - 2e ¾¾® 1/2 O2 + 2 H+ (9.19)
Khi phân cực âm hơn, đến thế E3 dòng catot ứng với sự khử ion H+: 2 H+ + 2e ¾¾® H2 (9.20)
Đường 3 đường phân cực của dung dịch CuSO4 nồng độ C1 trên nền H2SO4. E2
là thế bắt đầu phân huỷ Cu2+: Cu2++ 2e ® Cu . Mỗi ion kim loại có thế khử khác nhau
trên điện cực nên người ta đưa ra khái niệm thế bán sóng, E1/2 mô tả thế tại đó dòng giới hạn đạt ½ chiều cao.
9.2.1.3 Các phương pháp phân tích bằng điện phân
Khi phân cực cho điện cực, tùy thuộc vào điện áp đặt vào và bản chất của chất
điện hoạt, quá trình xảy ra có thể là oxi hóa hoặc khử. Khái niệm về anot hoặc catot phải
tùy thuộc vào phản ứng điện hóa xảy ra.
Đối với một chất điện hoạt, catot là điện cực mà ở đó phản ứng khử được thực
hiện còn anot là điện cực mà ở đó phản ứng oxi hóa được thực hiện. Vì vậy để kết tủa
chất phân tích trên điện cực, phải phân cực cho điện cực ở thế tương ứng với dòng giới
hạn của chất khử cực, chúng ta gọi là phân cực catot. Phân cực anot tức là chúng ta đặt
thế để phản ứng oxi hóa được thực hiện. Phương pháp phân tích bằng điện phân dựa
trên phân cực catot hay anot để các phản ứng oxi hóa hy khử xảy ra. Có hai phương
pháp định lượng chất phân tích bằng điện phân: -
Phương pháp tách chất phân tích dưới dạng kết tủa trên bề mặt điện cực.
Cơ sở của các phương pháp này là dựa vào khối lượng chất hình thành trong quá trình
điện phân nên còn gọi là phương pháp điện khối lượng. -
Phương pháp điện phân xác định chất phân tích dựa vào điện lượng tiêu
thụ trong quá trình điện phân hoặc đo điện lượng tiêu thụ khi điều chế thuốc thử phản
ứng hoá học với chất phân tích, từ đó xác định chất cần phân tích dựa theo định luật
Faraday. Vì vậy các phương pháp thuộc nhóm này có tên chung là phân tích điện
lượng. Trong các phương pháp trên, người ta thường sử dụng hai loại điện cực làm việc,
đó là điện cực trơ bằng platin hoặc điện cực thuỷ ngân có diện tích bề mặt lớn. Để chọn
các điều kiện tối ưu, các đường phân cực trên các điện cực được nghiên cứu.
9.2.1.4 Thế Nernst, thế ôm (W), thế điện phân
Như đã đề cập ở trên thế Nernst của một bình điện thế đo được khi dòng trong
mạch rất nhỏ, gần bằng zero. Tuy nhiên trong phương pháp điện phân và điện lượng,
dòng điện trong mạch không thể bằng zero. Để duy trì một dòng điện trong mạch, thế
đặt vào bình điện phân phải cao hơn thế Nernst về giá trị tuyệt đối do thế này phải vượt
qua rất nhiều yếu tố hợp thành, đó là thế ôm, thế phân cực nồng độ ...
Bất kỳ một bình điện thế nào đều có điện trở, điện áp cần thiết để hình thành dòng (ion)
chạy trong bình được gọi là thế điện phân tối thiểu, là thế điện phân tương ứng điện trở
ôm của bình. Nói một cách khác, thế điện phân tối thiểu (thế ôm) là thế tiêu hao do điện
trở của bình, được biểu diễn qua biểu thức: Eom = IR trong
đó, I là dòng điện trong mạch, R là điện trở của bình.
Trong một bình điện thế không có dòng điện thì không có thế vì I = 0. Nếu dòng
tăng, điện áp ra giảm theo vì một phần của năng lượng sinh ra bằng phản ứng hóa học
cần thiết để vượt qua điện trở nội của bình. Điện áp đặt vào một bình điện phân cần phải
đủ lớn để sinh ra phản ứng hóa học và vượt qua thế tối thiểu của bình.
Chúng ta ký hiệu điện áp của bình khi dòng bằng zero là ENernst, là một số “dương”
đối với phản ứng tự tiến hành, và đối với quá trình điện phân là -ENernst. Thế này dễ dàng
có được trong các tài liệu. Khi không có bất kỳ một ảnh hưởng nào khác, điện áp đặt
vào bình điện phân bị giảm đi một đại lượng thế tối thiểu bằng IR và điện áp đặt vào
bình điện phân cần tăng lên một đại lượng IR để cho dòng điện chạy trong mạch.
Hiệp hội quốc tế về chất tinh khiết và hóa học ứng dụng (Intenational Union of
Pure and Applied Chemisstry-IUPAC) gần đây đã đưa ra quy tắc "dương bên phải".
Theo quy tắc này, điện áp ra của bình điện thế được tính dựa vào thế Nernst sẽ luôn có
giá trị dương, vì vậy khi thiết lập sơ đồ bình điện thế, phải đặt cực có thế cao hơn ở bên
phải để điện áp ra luôn dương (Enernst = Ep- Etr). Đối với bình điện phân, điện áp đặt vào
mang dấu "-" nhưng về độ lớn phải là số trị tuyệt đối của nó. Có thể tóm tắt điện áp của
bình điện thế và bình điện phân như sau:
• Điện áp ra của bình điện thế giảm Ecell = ENernst - IR
• Điện áp vào của bình điện phân
Eđiện phân = - ENernst -IR
Lưu ý “Điện áp ra của bình điện thế có ký hiệu dương còn điện áp đặt vào bình
điện phân có ký hiệu âm”
Thí dụ 9.5: Có bình điện thế, được thiết kế theo sơ đồ sau
Cd(r)∣ CdCl2(0,005M) ║ AgCl(r),Cl-(0,02M) ∣ Ag(r)
Phản ứng hóa học diễn ra là: Cdo + 2Ag2+ + 2Cl- = CdCl2 +2Ag(r)
a) Tính thế nhiệt động của bình (ENernst)
b) Điện áp cần đặt vào bình điện phân để có dòng 2mA, biết điện trở của bình là 15 Ω
Cho biết EoCd2+/Cd= -0,403V; EoAgCl/Ag = 0,222 V
Giải: a) ECd = -0,403 + log0,005= -0,471V EAg = 0,222 + 0,0592log = 0,263V
ENernst = 0,263 -(-0,471) = 0,734V
b) Điện áp cần đặt vào bình
Eđp = - ENernst - IR = -0,734 - 0,002 x15 = - 0,764V Như
vậy điện áp đặt vào bình phải là 0,764V về trị tuyệt đối.
9.2.2 Các kỹ thuật điện phân
Dòng và thế là hai tham số tùy thuộc vào phản ứng điện hóa xảy ra trong bình
điện phân, có mối liên hệ hữu cơ, cho nên có hai kỹ thuật điện phân:
- Điện phân khi cường độ dòng không đổi,
- Điện phân khi giữ thế của điện cực làm việc không đổi.
9.2.2.1 Điện phân khi cường độ dòng không đổi
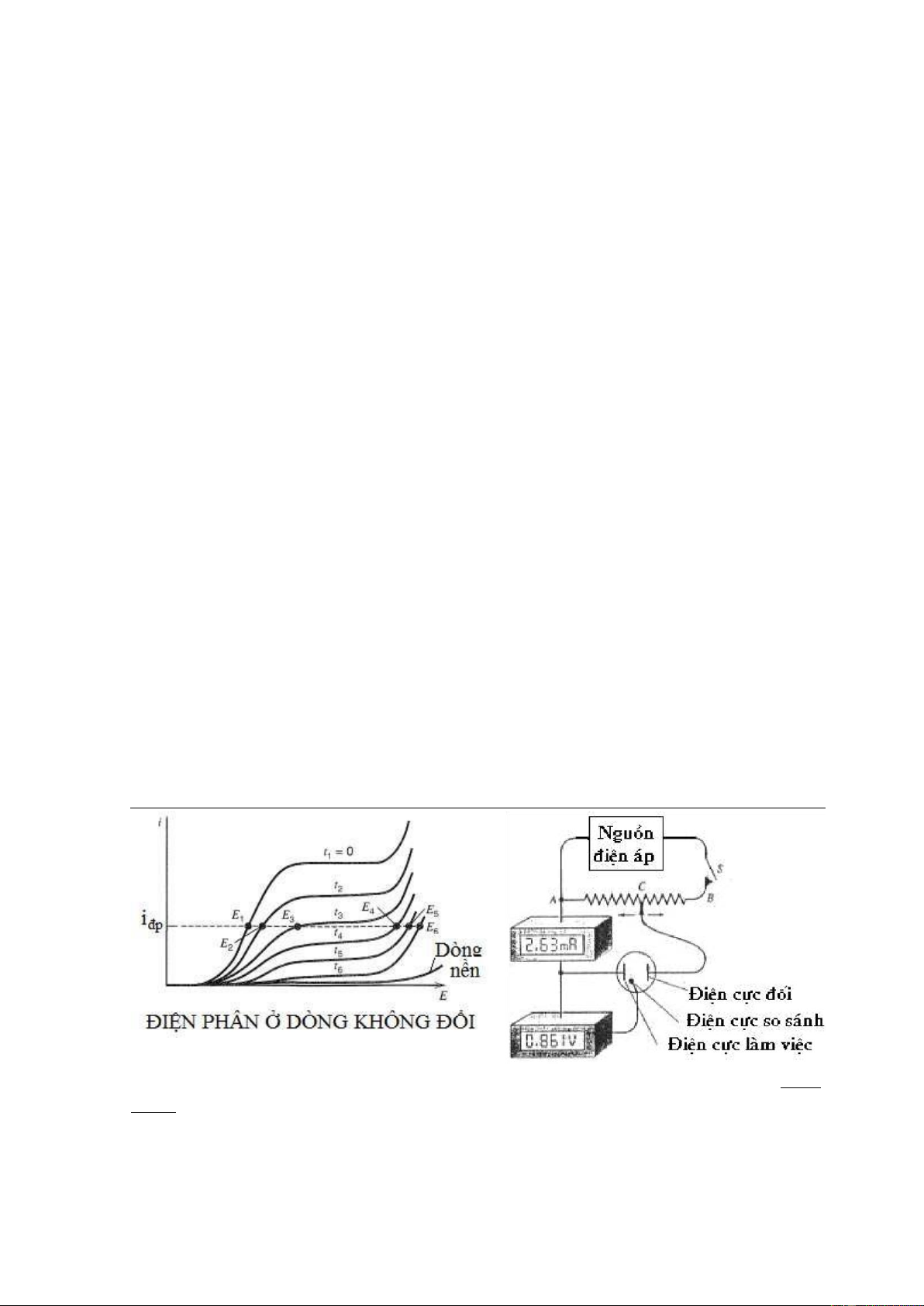
Bình điện phân thường có điện cực làm việc 2 là cực trên đó xảy ra sự điện phân
chất cần phân tích, và điện cực phụ trợ 1, mắc nối tiếp với một biến trở R. Khi thay đổi
biến trở đó ta có thể tiến hành điện phân với một cường độ dòng I không đổi tuỳ ý. Cực
so sánh 3 dùng để đo thế phân cực đặt vào. Tuy nhiên, thế này phải thay đổi trong suốt
quá trình điện phân để cho dòng không đổi. Từ các đường phân cực của ion Cu2+ ở
những nồng độ khác nhau, ta thấy thế của catot (cực làm việc) thay đổi từ giá trị E1 đến
E6, chuyển dịch về phía âm hơn. Thế tăng nhiều nhất xảy ra khi dòng điện phân bằng dòng giới hạn (i3-i4).
Khi điện phân với cường độ dòng không đổi, sự điện phân thường xảy ra một
cách ít chọn lọc vì để giữ cho dòng không đổi thì trên cực làm việc thường xảy ra sự kết
tủa nhiều chất. Đường dòng-thế ở các thời gian khác nhau, từ t1-t6 khi cường độ dòng
không đổi là iđp. Phương pháp điện phân khi cường độ dòng không đổi thường được sử
dụng trong phân tích để tiến hành phương pháp điện khối lượng và điện phân để tách
loại một ion nào đó khỏi hỗn hợp chất cần phân tích. Hình 9.10a
Các đường điện phân của dung dịch Cu2+, H+ trong quá trình điện phân. Hình
9.10b Thiết bị điện phân
Hình 9.10b là thiết bị điện phân. Bằng cầu chia thế C hoạt động tự động có thể
áp vào cực làm việc một giá trị thế nào đó so với điện cực so sánh. Khi điện phân với
cường độ dòng không đổi, cầu chia thế C thay đổi để có dòng không đổi.
9.2.2.2 Điện phân khi giữ thế điện cực không đổi
Để kết tủa chọn lọc chất phân tích, căn cứ vào thế bán sóng của chất điện hoạt,
người ta thường tiến hành điện phân khi kiểm soát thế của điện cực làm việc. Đó là áp
vào cực làm việc một giá trị thế thích hợp và giữ không đổi.
Khi đó chỉ xảy ra phản ứng oxi
hoá hoặc khử một mình ion cần xác định
trên điện cực. Phương pháp này thường
được tiến hành trong bình điện phân với
hệ 3 điện cực: cực làm việc, cực so sánh và cực phụ trợ.
Hình 9.11 Các đường phân cực với E không đổi.
Trên hình 9.11 là các đường dòng thế của chất phân tích khi áp thế không đổi.
Tại thời điểm ban đầu, t = 0, dòng lớn nhất và giảm dần theo thời gian điện phân. Thí
dụ 9.6: a) Về mặt nguyên tắc, Cu2+ và Pb2+ trong dung dịch có thể tách bằng kỹ thuật
điện phân được không? b) Nếu được, khoảng thế điện phân so với calomen bão hòa là
bao nhiêu, giả sử trong dung dịch mẫu ban đầu cả hai ion kim loại đều có nồng độ 0,1M
và phép tách được xem là hoàn toàn khi nồng độ ion đã tách loại bằng 1/104 so với nồng độ ion chưa tách.
Cho EoCu2+/Cu = 0,337V; EoPb2+/Pb = -0,126V; EoCal. = 0,244V.
Giải: a) Hai ion kim loại Pb2+ và Cu2+ có thế phân hủy khá xa vì vậy khả năng chọn
được thế kết tủa chọn lọc để tách hai ion khỏi nhau là có. Tuy nhiên cần phải tính thế
cần thiết để tách chúng.
Theo thế tiêu chuẩn của 2 ion Cu2+ và Pb2+, rõ ràng khi phân cực catot để kết
tủa, Cu2+ kết tủa trước. Khi nồng độ Cu2+ còn 1/104 nồng độ của Pb2+ là 10-5M Phương trình Nernst cho Cu2+: E = 0,337 + log10-5 = 0,189V
Khi Pb2+ bắt đầu kết tủa: E = -0,126 + log10-1 = - 0,156V
Như vậy khi Cu2+ đã tách hoàn toàn theo yêu của bài thì Pb2+ chưa kết tủa; có thể tách Cu2+ khỏi Pb2+.
b) Khoảng thế catot để tách Cu2+ là -0,156 < E < 0,189V. Tuy nhiên khoảng thế của bình
điện phân là: Eđp = Ecatot - Ecal.
⇒ Khoảng thế điện phân từ (-0.156- 0,244) đến (0,189-0,244) hay -0,4V < Eđp < -0,055V
9.2.3 Kỹ thuật phân tích điện khối lượng
9.2.3.1 Điện khối lượng với catot platin
Phương pháp điện khối lượng thường được sử dụng để định lượng các ion kim
loại có hoạt tính điện hoá và trong một số trường hợp cần dùng để xác định một số anion
có khả năng kết tủa điện hoá trên bề mặt điện cực làm việc thường có dạng hình trụ lưới
bằng platin, đôi khi bằng bạc. Cực phụ trợ thường là một dây Pt dạng lò so hoặc thanh có kích thước nhỏ.
Các yếu tố ảnh hưởng đến chất lượng kết tủa là mật độ dòng, nhiệt độ và thành
phần dung dịch chất điện li nền. Thực nghiệm chứng tỏ rằng kết tủa điện hoá các kim
loại lên bề mặt điện cực Pt (dạng lưới) có chất lượng tốt khi mật độ dòng không cao và
đặc biệt kết tủa từ dung dịch chất tạo phức để ion kim loại bị khử chậm, bám chắc và
đều trên bề mặt cực. Vì vậy để điện phân như Ag+, Cu2+, Ni2+, Cd2+ người ta thường đưa
chúng vào các phức với xianua CN- hoặc với NH3. Bảng 9.1 đưa ra một số phương pháp
phân tích điện khối lượng.
Bảng 9.1 Một vài chất phân tích và điều kiện áp dụng Chất PT Sản phẩm cân Catot Anot Điều kiện Ag+ Ag Pt Pt Dung dịch KCN Br- AgBr Pt Ag Dung dịch NaOAc Cd2+ Cd Cu/Pt Pt Dung dịch KCN Cu2+ Cu Pt Pt Dung dịch H2SO4/HNO3 Mn2+ MnO Pt Pt đĩa Dung dịch HCOOH/HCOONa 2 (ở anot) Ni Cu/Pt Pt Dung dịch amoniac Ni2+ PbO2 Pt Pt Dung dịch HNO3 đặc Pb2+ Zn Cu/Pt Pt Dung dịch Citrat-axit Zn2+
9.2.3.2 Phương pháp tách bằng điện phân trên catot thuỷ ngân
Catot thuỷ ngân là một loại điện cực làm việc có rất nhiều ưu điểm, được sử dụng
rất rộng rãi trong phân tích điện hoá. Những ưu điểm nổi bật là: khoảng thế làm việc
rộng (từ + 0,2V đến -1,8V), dễ tạo hỗn hống với nhiều kim loại và dễ được làm sạch
(chúng ta sẽ đề cập kỹ ở phần phương pháp von-ampe).
Để tách các kim loại trên điện cực thủy ngân, thực hiện điện phân với bình điện
phân chứa catot thủy ngân còn anot là điện cực trơ.
Giả sử mẫu có 3 ion kim loại A, B, C với 3 thế
E1/2 khác nhau (hình 9.12). Trước hết điện phân
ở thế tương ứng dòng giới hạn của A để tách hết
kim loại A trên catot thủy ngân sao cho B và C
không bị khử cực. Tách riêng hỗn hống chứa
kim loại A, sau đó, thay catot Hg mới và tiến
hành điện phân ở thế tương ứng
Hình 9.12 Đường phân cực của 3 kim dòng giới hạn của B sao cho C không phản ứng để tách hết B.
loại A, B, C trên catot Hg
Như vậy phương pháp dựa vào thế khử cực khác nhau của các ion kim loại mà tách chúng khỏi nhau.
9.2.4 Kỹ thuật phân tích đo điện lượng tiêu thụ
9.2.4.1 Phương pháp điện lượng ở thế không đổi
Trong các phương pháp này người ta tiến hành điện phân dung dịch phân tích ơt
thế không đổi và đo điện lượng để xác định các chất bị điện phân bằng cách dựa vào M
biểu thức của định luật Faraday: m = 1 x . .Q (9.21) F n
trong đó Q là điện lượng tiêu tốn trong quá trình điện phân chất cần phân tích X, M là
khối lượng mol của nó, n là số electron trao đổi, F là điện tích Faraday (96487C).
Yêu cầu quan trọng nhất đối với phương pháp này là phải tiến hành sao cho
không được xảy ra các phản ứng phụ. Phản ứng xảy ra chọn lọc với chất phân tích, tốt
nhất là nên tiến hành điện phân ở thế không đổi. Để đo điện lượng tiêu tốn trong quá
trình điện phân người ta dùng các điện lượng kế mắc nối tiếp với bình điện phân.
Để xác định chọn lọc các kim loại trong các đối tượng phức tạp người ta thường
dùng phương pháp điện lượng sử dụng catot thuỷ ngân.
Phương pháp này có thể sử dụng các dữ kiện rất phong phú về cực phồ để chọn
nền chất điện li và thế điện phân. Thí dụ để điện phân Cd, dùng nền KCl 0,1M ở thế 1V
cn để điện phân Pb dùng nền KCl 0,5 M -0,5V. Cả hai trường hợp đều dùng catot ̣ thuỷ ngân.
9.2.4.2 Phương pháp chuẩn độ điện lượng
Thiết bị để chuẩn độ đã trình bày trên hình 9.14b. Trong phương pháp này dùng
hệ điện hóa để điều chế ra hóa chất cần thiết cho phản ứng hóa học, tuy nhiên trong
phản ứng đôi khi cần thêm thuốc thử để nhận biết điểm tương đương. Lượng điện tiêu
thụ được tính theo công thức: Q = I . t
Từ lượng điện tiêu thụ cho phản ứng tính ra nồng độ chất phân tích.




