
lOMoARcPSD|61096548
Thuyet MO
Hóa Đại Cương (Trường Đại học Y khoa Phạm Ngọc Thạch)

lOMoARcPSD|
61096548
Chuyên đề THUYẾT MO-PHƯƠNG PHÁP OBITAN PHÂN TỬ
I/ MỞ ĐẦU
I.1. Thành công của thuyết MO
+ Thuyết MO giải thích triệt để nhiều kết quả thực nghiệm. Ví dụ như trước đây khi áp
dụng thuyết VB không giải thích được tính thuận từ của O
2
. Nhưng thuyết MO đã giải
thích được điều đó: cấu hình cơ bản của O
2
có 2 electron độc thân…Đặc biệt nó giải thích
được các liên kết hóa học trong phân tử mà thuyết VB không giải thích được như phân tử
H
2
+
; O
2
; B
2
H
6
…
+ Thuyết MO có cơ sở toán học vững chắc, có khả năng định lượng tốt. Và do vậy
được sử dụng để xây dựng các phần mềm tính toán hóa học lượng tử
+ Có thể kết hợp với các thuyết khác để thực hiện các phép tính gần đúng ngày càng
chính xác.
I.2. Hạn chế
+ Bản chất của thuyết MO là xây dựng các obitan phân tử; là sự tổ hợp tuyến tính các
AO của các nguyên tử trong phân tử . Các MO liên kết giải tỏa trên toàn phân tử do đó
khó khăn trong việc xây dựng mô hình hình học phân tử
II. NỘI DUNG
II.1 Những luận điểm cơ bản của thuyết MO:
1) Trong phân tử, tính cá thể (độc lập) của các nguyên tử không
còn tồn tại. Phân
tử gồm có một số giới hạn các hạt nhân nguyên tử và các electron. Các electron (chủ yếu
là các electron hóa trị) phân bố trên các obitan chung của phân tử.
2) Trong phân tử tồn tại những trạng thái riêng cho các electron,
trạng thái đó được xác định bởi một hàm không gian gọi là obitan phân tử
(MO). Các MO này thu được từ sự tổ hợp tuyến tính các AO nguyên tử. Tổng
số MO thu được bằng tổng số AO tham gia tổ hợp. Mỗi MO tương ứng với
một mức năng lượng xác định. Các MO thu được có năng lượng khác nhau
hình thành một giản đồ năng lượng có giá trị từ thấp đến cao.
Sự che phủ các AO dọc theo trục liên nhân → MOσ (MOσ nhận trục liên nhân
làm trục đối xứng). Sự che phủ các AO về hai phía trục liên nhân →MOπ ( MOπ có mặt

lOMoARcPSD|
61096548
phẳng phản xứng chứa trục liên nhân). Năng lượng các MO phụ thuộc vào năng lượng
AO và mức độ che phủ giữa các AO đó.
3) Trong phân tử, sự phân bố các electron trên các MO cũng tuân
theo nguyên lý vững bền, nguyên lý Pauli và qui tắc Hund, từ đó ta có cấu
hình electron của phân tử.
4) Các AO chủ yếu được sử dụng trong việc thành lập các MO
phải mãn các điều kiện sau:
- Có năng lượng xấp xỉ nhau.
- Có tính đối xứng giống nhau đối với trục liên kết (hay có mức độ xen phủ
rõ
rệt).
5) Bậc liên kết = (số electron trên MO liên kết - số electron trên MO phản liên
kết).
II.2 MO liên kết và MO phản liên kết
1) MO liên kết: có sự tập trung mật độ xác suất có mặt của electron ở khoảng
giữa hai hạt nhân. Electron có tác dụng liên kết hai hạt nhân và khi ở trạng thái
này, electron có năng lượng thấp hơn khi ở trạng thái nguyên tử.
2) MO phản liên kết: Xác suất có mặt của electron ở khoảng giữa hai hạt nhân
nhỏ và ở trạng thái này, electron có năng lượng cao hơn ở trạng thái nguyên tử
(điều đó có nghĩa trạng thái đó kém bền hơn trạng thái nguyên tử). * Chú ý:
+ Chỉ hai AO có tính đối xứng giống nhau mới có khả năng xen phủ và tạo thành 1 MO
liên kết và 1 MO phản liên kết. Đối với những AO không có tính đối xứng giống nhau thì
không có sự xen phủ. Khi đó ta có MO không liên kết. AO + AO → MO liên kết (,
…), E < E
MO AO
AO - AO → MO phản liên kết (* ,* …), E > E
MO* AO
0 0 o
AO → MO không liên kết ( , …), E = E
MO AO
+ Sự tạo thành các MOσ từ AOs
2
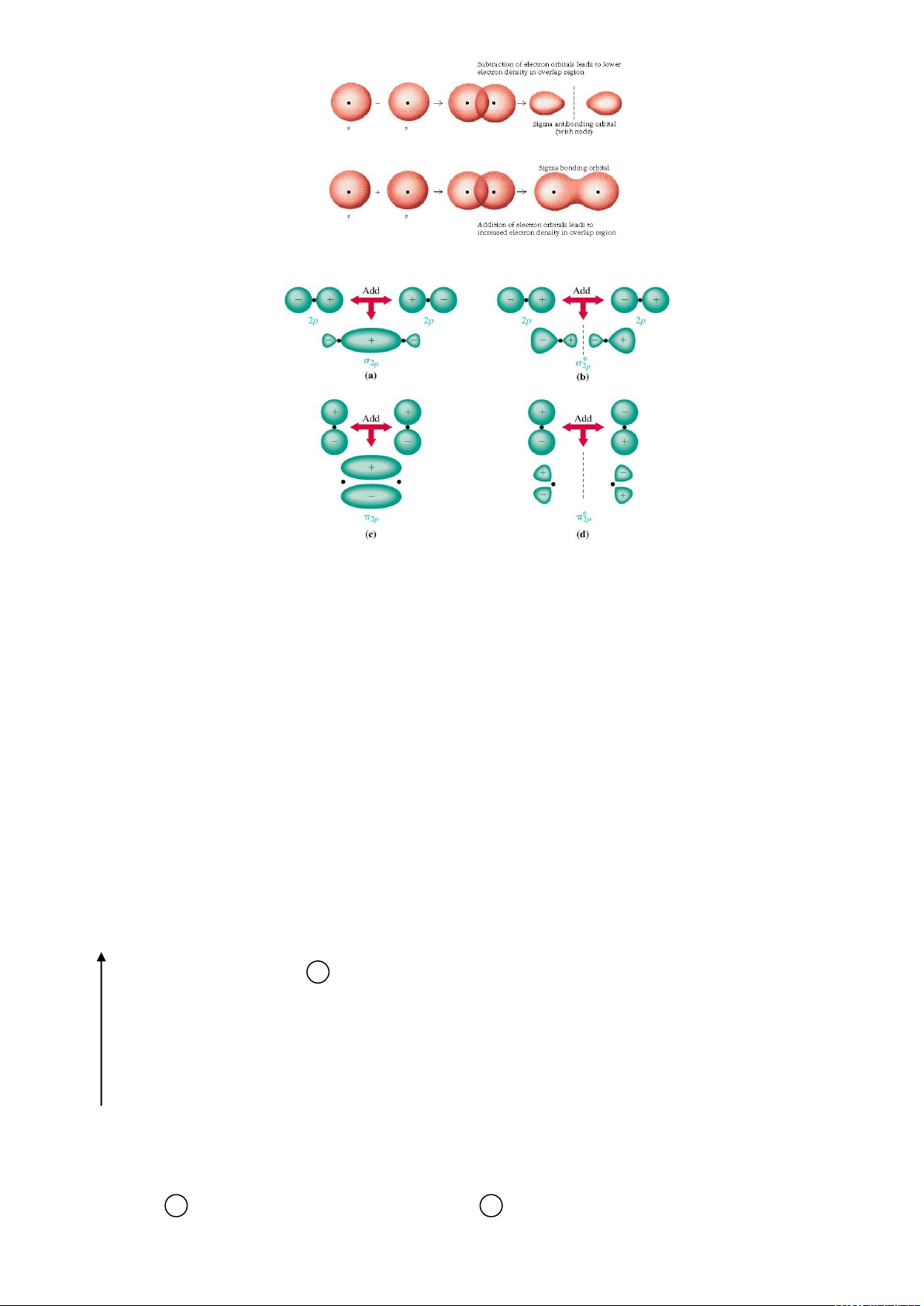
lOMoARcPSD|
61096548
+ Sự tạo thành các MOσ,MO từ các AOp
+ Việc mô tả cấu trúc phân tử gồm các bước:
Bước 1: Xét sự tạo thành MO từ các AO
Bước 2: Sắp xếp các MO theo thứ tự năng lượng tăng dần
Bước 3: Xếp các electron vào các MO
Bước 4: Xét các đặc trưng liên kết
II.3. Thuyết MO và phân tử 2 nguyên tử
II.3.1. Phân tử 2 nguyên tử đồng hạch A2
a) Các phân tử A
2
thuộc chu kỳ 1:
Giản đồ phân tử các MO như sau:
E AO MO AO
s
*
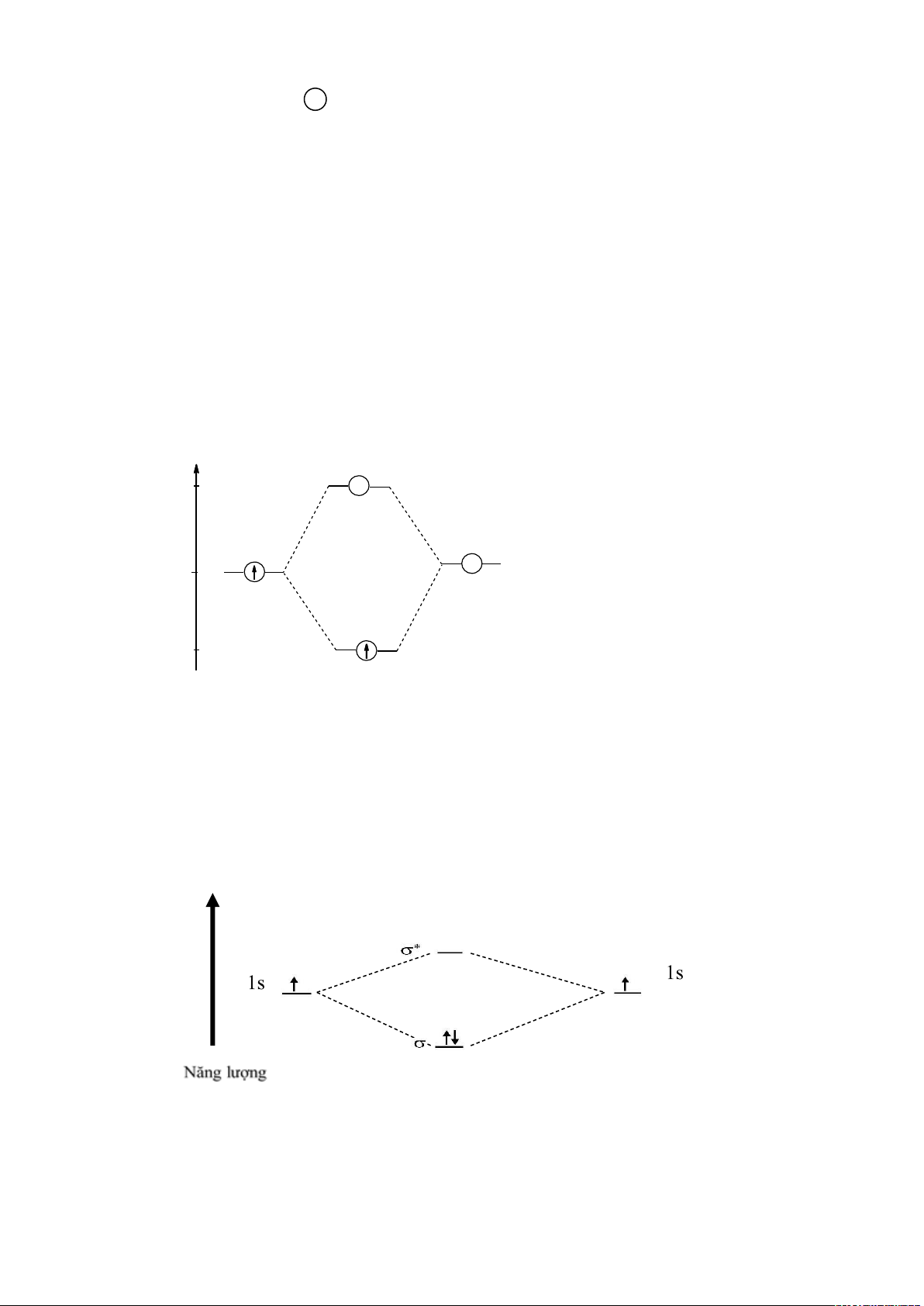
lOMoARcPSD|
61096548
1s 1s
s
Dựa vào độ bội liên kết, thuyết MO cho phép đánh giá về năng lượng liên kết và độ dài
liên kết (Giữa 2 nguyên tử, số liên kết càng lớn thì năng lượng liên kết càng lớn và độ dài
liên kết càng nhỏ).
Thuyết MO cũng cho ta xác định được từ tính của phân tử (thuận từ khi có electron
độc thân, nghịch từ khi các electron đều ghép đôi).
VD: Phân tử H
2
: Cấu hình (
1s
)
1
AO H
a
MO H
2
AO H
b
VD: Phân tử H
2
2
H : [(σ ) ] Bậc liên kết = 1 Hai nguyên tử H liên kết với nhau băng một liên kết đơn:
2 1s
H - H
4
s
s
x
*
S1
S1
b
a
a
+
b
a
-
b
AO MO AO
H H2 H
1
1
lOMoARcPSD|
61096548
Nghịch từ
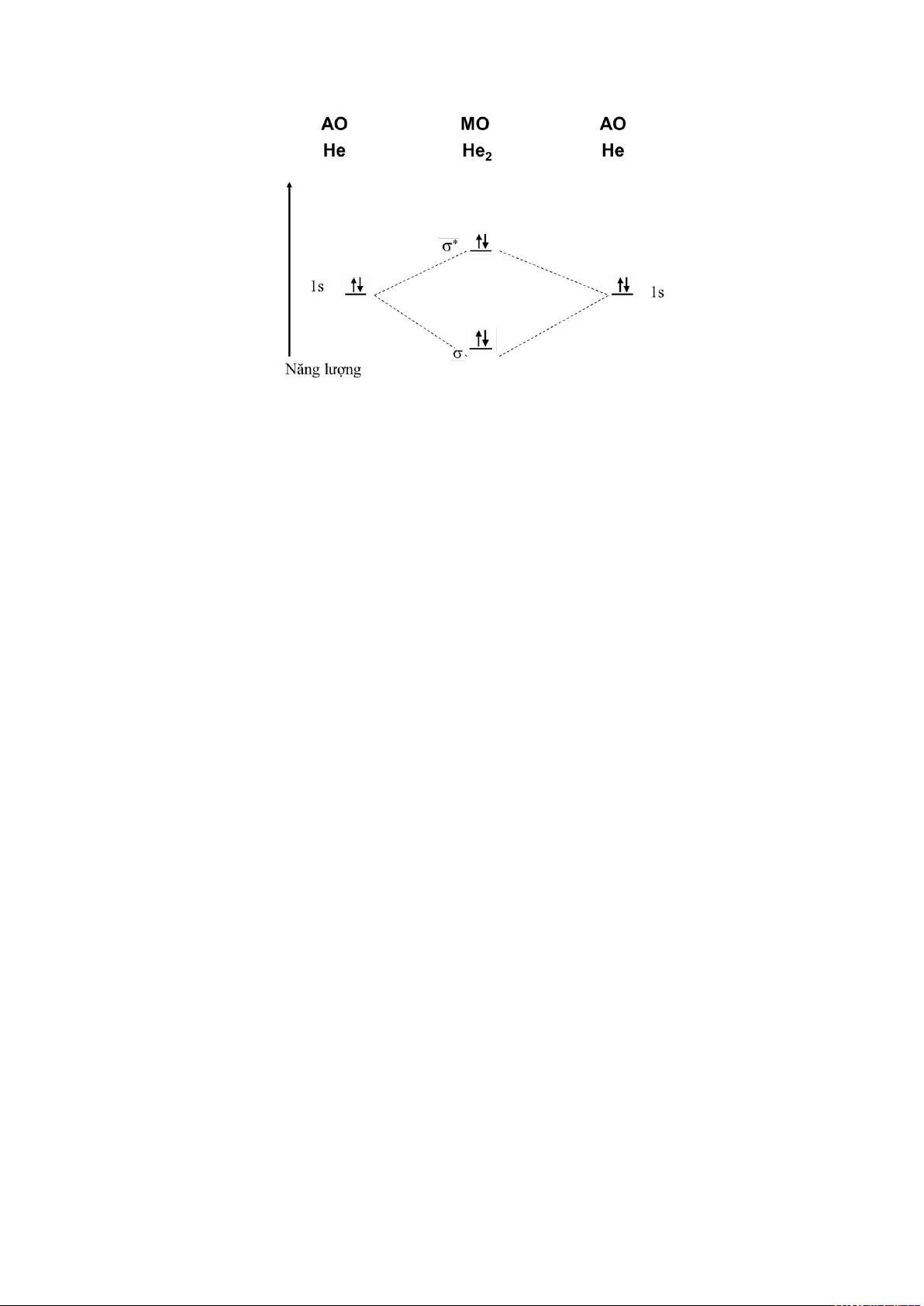
VD: Phân tử He
2
Bậc liên kết = 0 => Không tồn tại
b) Các phân tử A
2
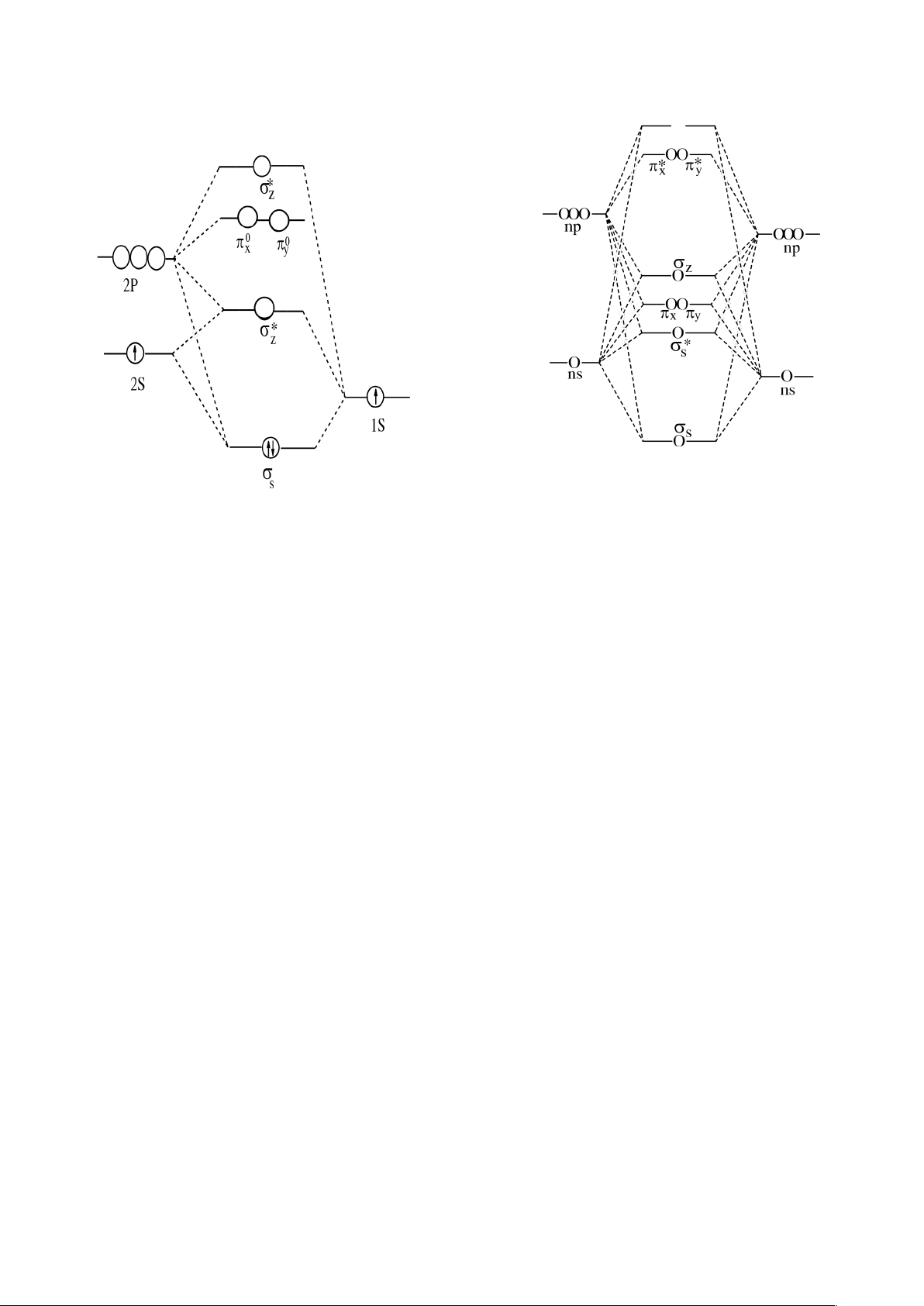
thuộc chu kỳ 2:
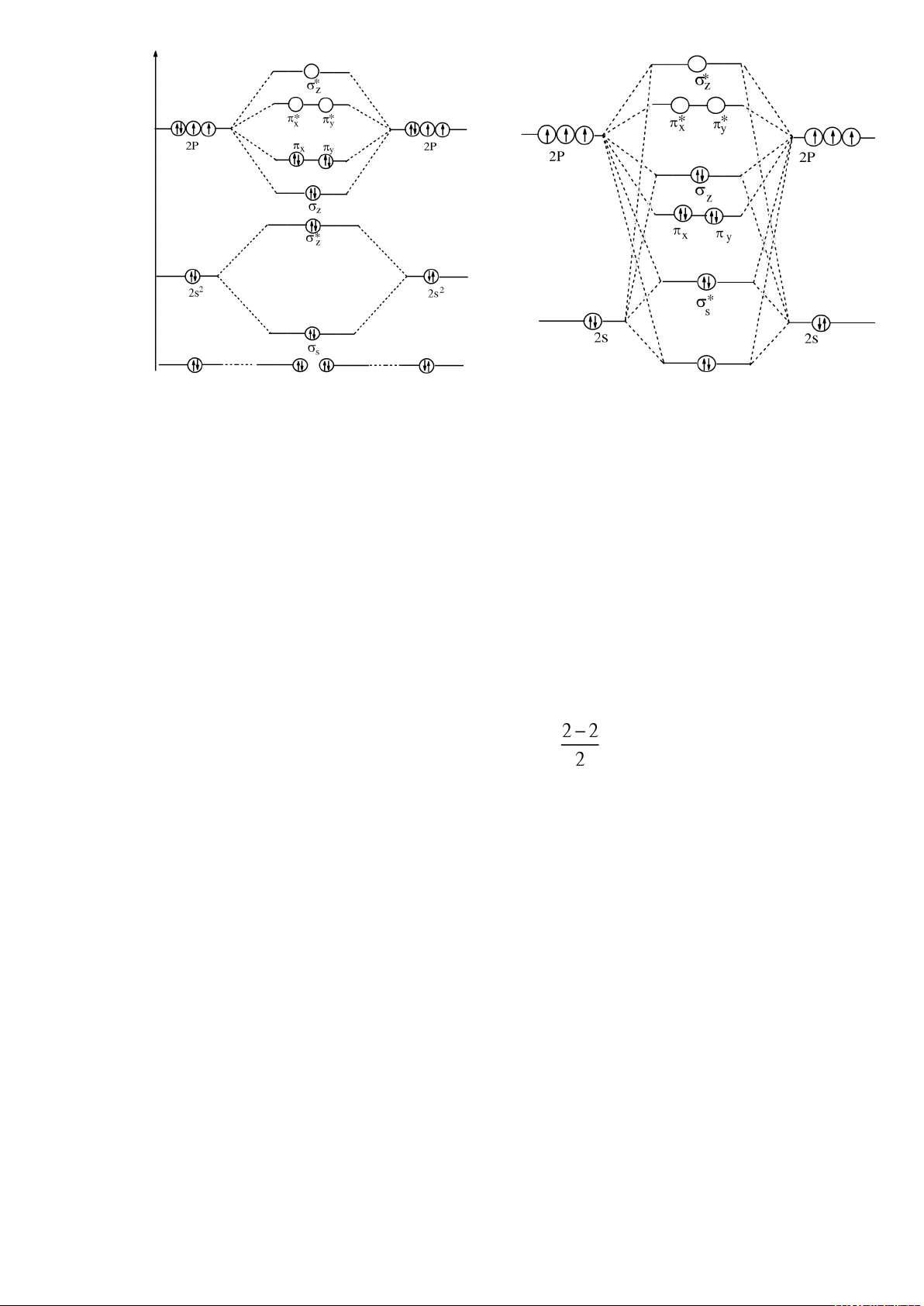
Quang phổ nghiệm cho biết, đối với nguyên tử O, F và Ne, hiệu năng lượng của
obitan 2p và 2s khá lớn, vì vậy ta chỉ tổ hợp các obitan 2s riêng với nhau, các obitan 2p
riêng với nhau. Đối với phân tử O
2
và F
2
, phổ phân tử cho biết các mức năng lượng của
các MO có thứ tự như hình vẽ (Giản đồ I).
Đây là trường hợp của O
2
và F
2:
S
<
*
S
<
Z
<
x
=
y
<
*
x
=
*
y
<
*
Z
Đối với các nguyên tử thuộc đầu chu kỳ 2 (Li, Be, B, C, N), hiệu hai mức năng lượng 2p
và 2s tương đối nhỏ, vì vậy có sự tổ hợp của tất cả các obitan 2s và 2p
z
. Thứ tự các mức
năng lượng của các MO như hình vẽ (Giản đồ II).
Trường hợp của Li
2
, Be
2
, C
2
, N
2:
S
<
*
S
<
x
=
y
<
Z
<
*
x
=
*
y
<
*
Z
lOMoARcPSD|
61096548
1sa
2
1s
2
b
s
*
E AOAa MOA2 AOAb E AOAa MOA2
AOA
b
+ Phân tử Li2
có cấu hình electron (
S
)
2
+ Phân tử Be2.
Cấu hình electron hoá trị của nguyên tử Berili là 2s
2
.
Phân tử Be
2
có cấu hình
S
2
*
S
2
với số liên kết = = 0.
Do đó phân tử Be
2
không tồn tại, phù hợp với thực tế.
+ Phân tử B2.
Cấu hình electron hoá trị của nguyên tử Bo: 2s
2
2p
1
.
Cấu hình electron của B
2
:
S
2
*
S
2
1
x
1
y
, ứng với một liên kết.
+ Phân tử C2.
Cấu hình electron hoá trị của nguyên tử cacbon là: 2s
2
2p
2
.
các mức năng lượng của
Z
và
x,y
được phân bố sao cho cấu hình (
S
)
2
(
*
S
)
2
(
x,y
)
4
và (
S
)
2
(
*
S
)
2
(
x,y
)
3
(
Z
)
1
hầu như tương đương về năng lượng.
Hiện này người ta coi trạng thái cơ bản là trạng thái với cấu hình (
S
)
2
(
*
S
)
2
(
x,y
)
4
(bền vững hơn so với cấu hình kia là 0,1eV).
6
lOMoARcPSD|
61096548
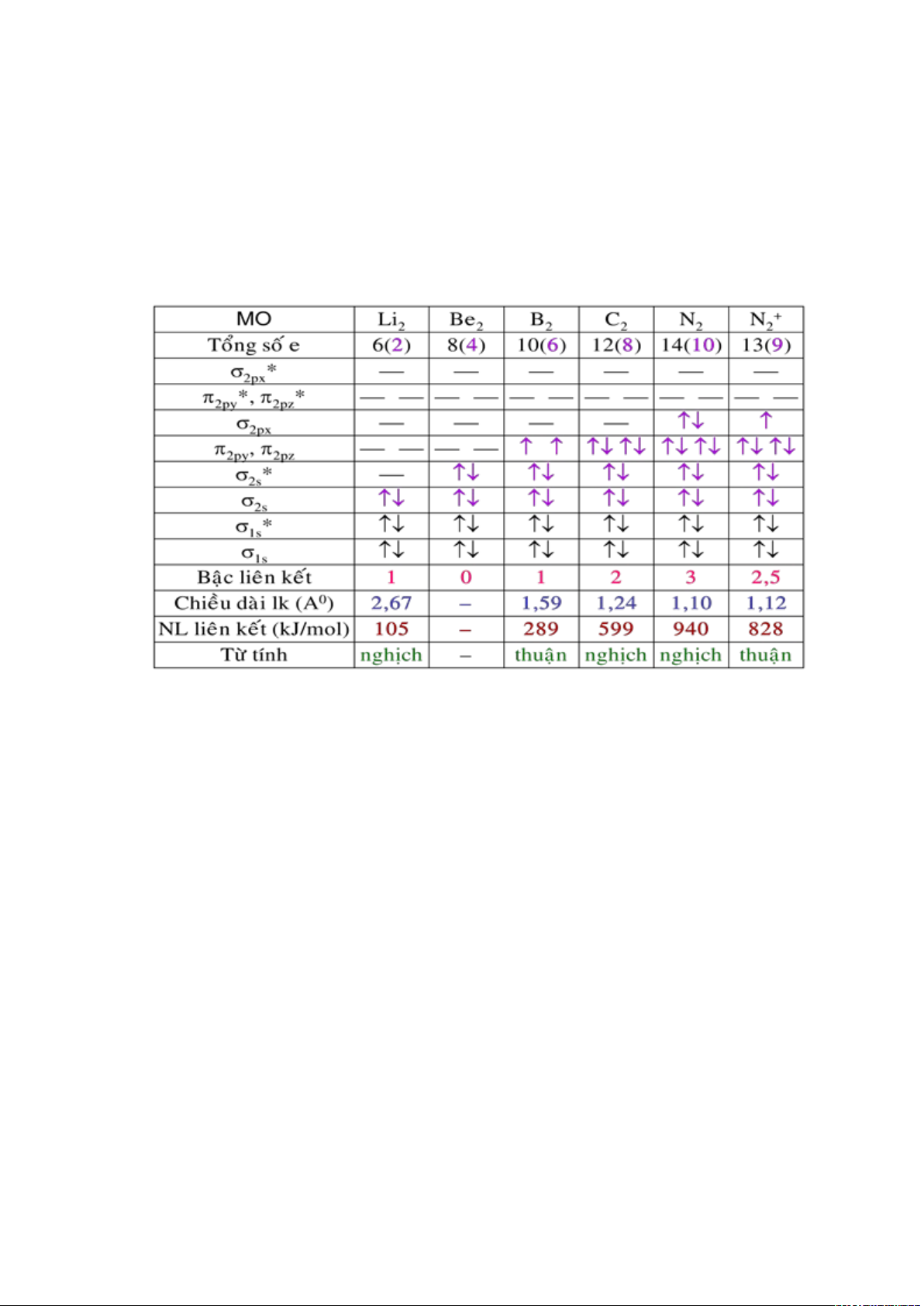
+ Phân tử N2.
Cấu hình electron hoá trị của nguyên tử nitơ là: 2s
2
2p
3
.
Phù hợp với tính nghịch từ của N
2
xác định được bằng thực nghiệm cho thấy cấu
hình electron của phân tử N
2
có dạng (
S
)
2
(
*
S
)
2
(
x,y
)
4
(
Z
)
2
.
Trong phân tử N
2
có ba liên kết (một liên kết và hai liên kết ). Đó là liên kết
cực đại của phân tử A
2
và do đó N
2
rất bền vững
Các phân tử hai nguyên tử của các nguyên tố đầu chu kỳ II
+ Phân tử O2.
Cấu hình electron hoá trị của nguyên tử oxi ở trạng thái cơ bản: 2s
2
2p
4
.
Cấu hình electron của phân tử oxi O
2
: (
S
)
2
(
*
S
)
2
(
Z
)
2
(
x,y
)
4
(
*
x
)
1
(
*
y
)
1
.
Như vậy, trong O
2
có hai electron trên các MO
*
x,y
chưa cặp đôi và do đó O
2
là
chất thuận từ.
Kết quả này hoàn toàn phù hợp với thực nghiệm. Đó là một thành công của
phương pháp MO, vì theo Lewis, sự tồn tại hai electron chưa cặp đôi trong phân tử oxi là
hoàn toàn không giải thích được.
+ Phân tử F2.
Cấu hình electron hoá trị của nguyên tử flo: 2s
2
2p
5
.
Cấu hình electron của phân tử F
2
:(
S
)
2
(
*
S
)
2
(
Z
)
2
(
x,y
)
4
(
*
x,y
)
4
ứng với một liên kết
và không có electron độc thân.
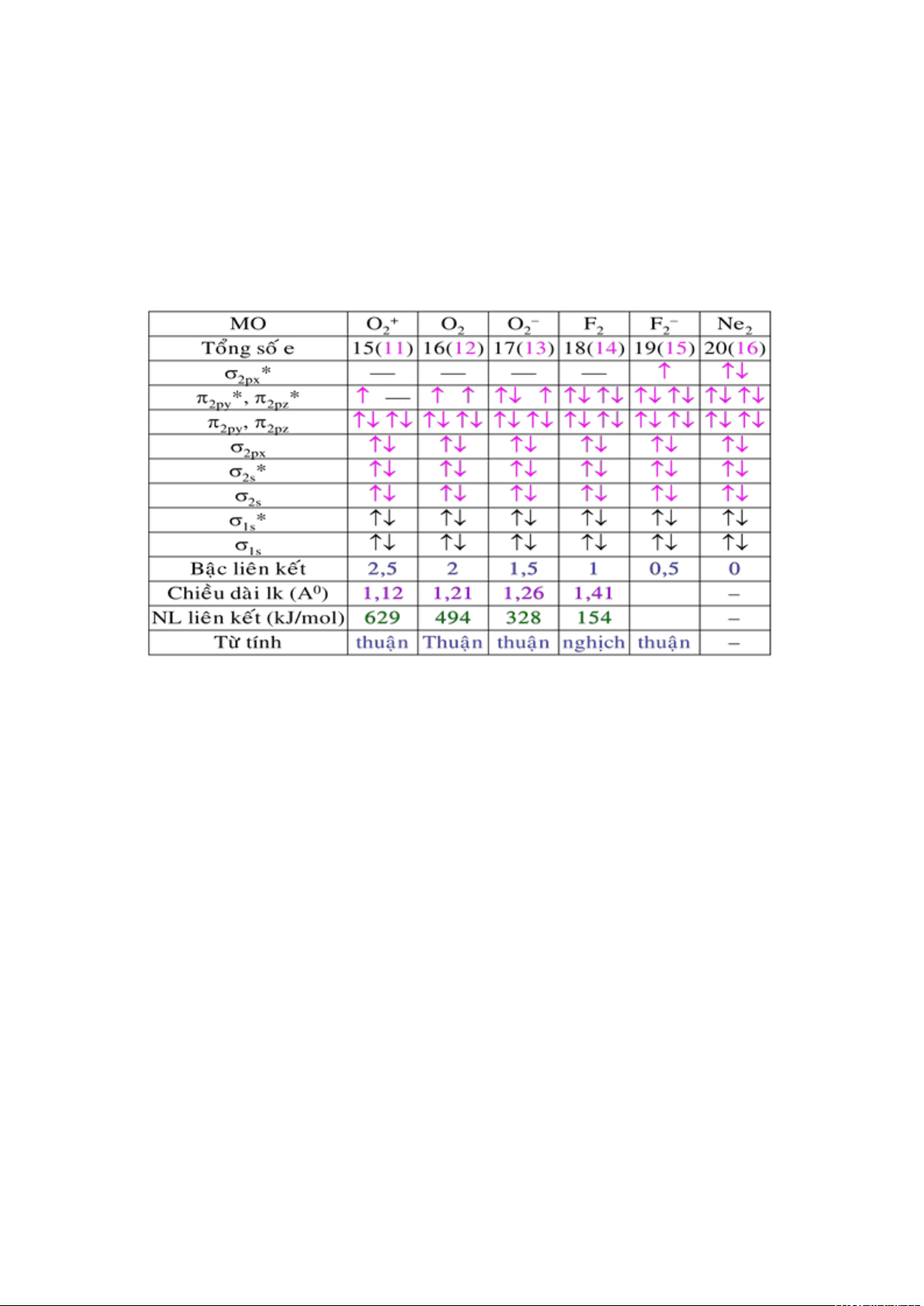
lOMoARcPSD|
61096548
Cấu hình electron này phù hợp với tính nghịch từ của F
2
+
Phân tử Ne2.
Nguyên tử Neon có cấu hình electron lớp ngoài cùng 2s
2
2p
6
.
Phân tử neon giả định có cấu hình electron là: (
S
)
2
(
*
S
)
2
(
Z
)
2
(
x,y
)
4
(
*
x,y
)
4
(
*
Z
)
2
.
Do đó trong Ne
2
có số liên kết bằng không. Do đó phân tử Ne
2
không tồn tại.
Điều đó hoàn toàn phù hợp với thực nghiệm.
Các phân tử hai nguyên tử cùng loại của những nguyên tố cuối chu kỳ II c)
Một số phân tử A
2
khác:
Khi khảo sát cấu tạo của các phân tử bất kì loại A
2
, có thể sử dụng giản đồ các mức
năng lượng của các MO đối với các phân tử của các nguyên tố thuộc chu kì 2 hệ thống
tuần hoàn bằng cách thay giá trị số lượng tử chính n.
+ Các phân tử Na
2
, K
2
, Rb
2
, Cs
2
.
Phân tử hai nguyên tử của tất cả các kim loại kiềm ở trạng thái cơ bản có cấu hình
(
S
)
2
với
một liên kết chúng là những chất nghịch từ.
+ Các phân tử Cl
2
, Br
2
, I
2
:
Trạng thái cơ bản của các phân tử halogen (X
2
) có cấu hình electron (
S
)
2
(
*
S
)
2
(
Z
)
2
(
x,y
)
4
(
*
x,y
)
4
, có 1 liên kết trong X
2
. Tất cả các phân tử đều nghịch từ.
II.3.2. Phân tử 2 nguyên tử dị hạch AB a) Phân tử LiH: cấu hình electron của LiH
là
S
2
.Khi đó phần lớn thời gian các electron ở gần nguyên tử H làm cho phân tử LiH
phân cực: Li
+
H
8
lOMoARcPSD|
61096548
AO Li MO LiH AO H E AO-A MO-AB
AO-B
O
*
z
b)Giản đồ năng lượng các MO của phân tử AB (độ âm điện của A nhỏ hơn B):
Một số phân tử AB cụ thể.
Phân tử BN (8 electron hoá trị):
Cấu hình electron của phân tử BN ở trạng thái cơ bản: (
S
)
2
(
*
S
)
2
(
x,y
)
4
.Như vậy,
về cấu tạo electron, phân tử BN tương tự C
2
.
Các phân tử BO, CN, CO
+
(đều có 9 electron hoá trị): ở trạng thái cơ bản, cấu hình
electron của tất cả ba phân tử là:
S
2
*
S
2
x,
4
y
1
Z
ứng với trạng thái
2
và 2,5 liên kết (ít hơn
BN là 0,5 liên kết). Khoảng cách giữa các nguyên tử ngắn hơn so với trong BN (hoặc
trong C
2
) và là 1,20 Å ở BO; 1,17 Å ở CN; 1,15 Å ở CO
+
.
Các phân tử CO, NO
+
, CN
(10 electron hoá trị):
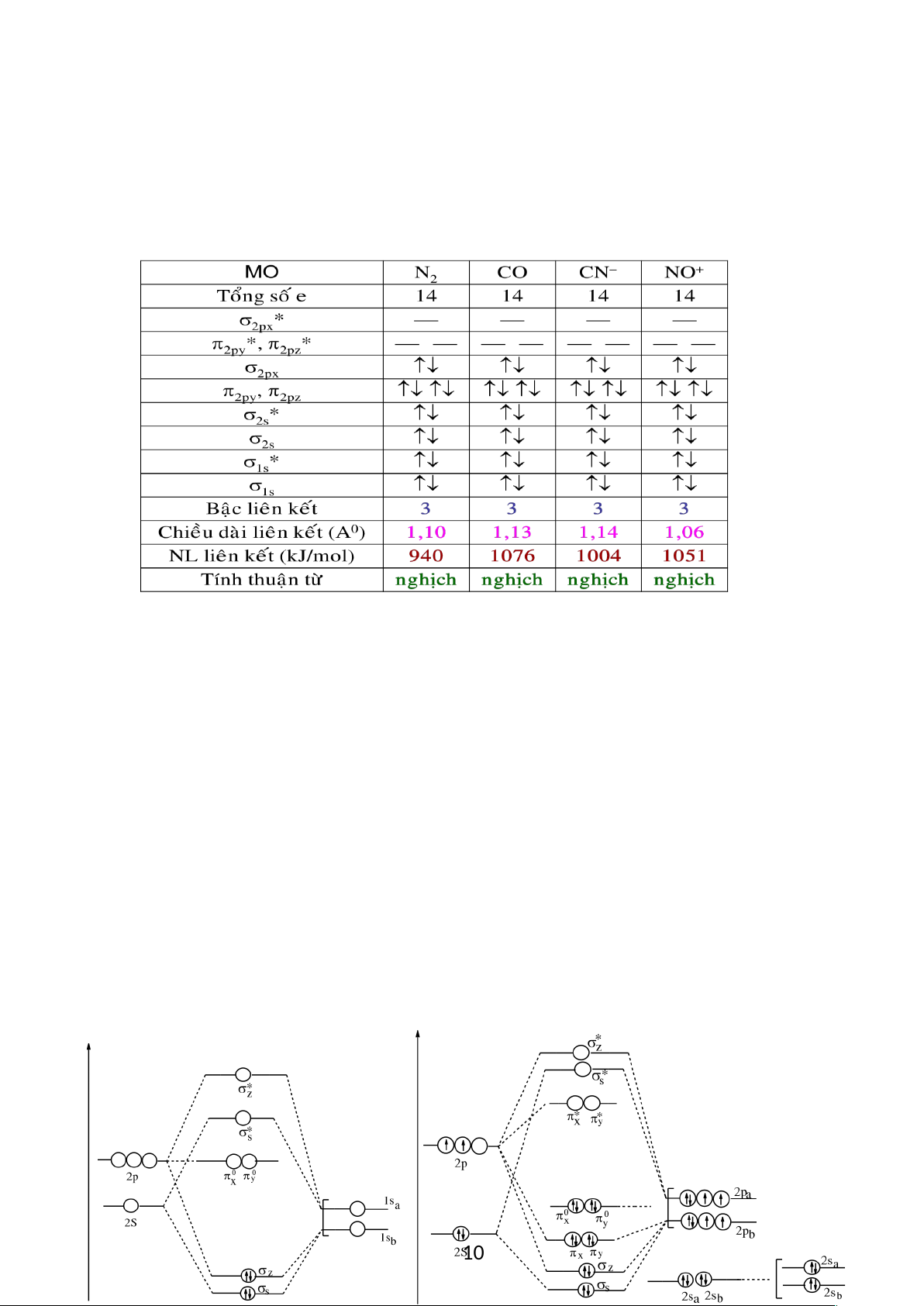
lOMoARcPSD|
61096548
Cả ba phân tử này có số electron giống nitơ và trạng thái cơ bản của chúng được
mô tả bởi số hạng
1
. Cấu hình
S
2
*
S
2
x,
4
y
2
Z
ứngvới sự hình thành một liên kết và hai
liên kết . Khoảng cách giữa các nguyên tử tăng theo thứ tự NO
+
< CO < CN
và tương
ứng là 1,062; 1,128; 1,14 Å. Năng lượng liên kết trong phân tử CO là 255,8 Kcal/mol,
thậm chí cao hơn năng lượng liên kết của phân tử N
2
(225 Kcal/mol).
Phân tử NO (11 electron hoá trị):
Trạng thái cơ bản của phân tử NO có cấu hình:
S
2
*
S
2
x,
4
y
2
Z
*
x,
1
y
ứng với trạng thái
2
.
Số liên kết ở NO là 2,5
II.3.3. Phương pháp MO và phân tử nhiều nguyên tử.
II.3.3.1. Phân tử ba nguyên tử AB2 không thẳng.
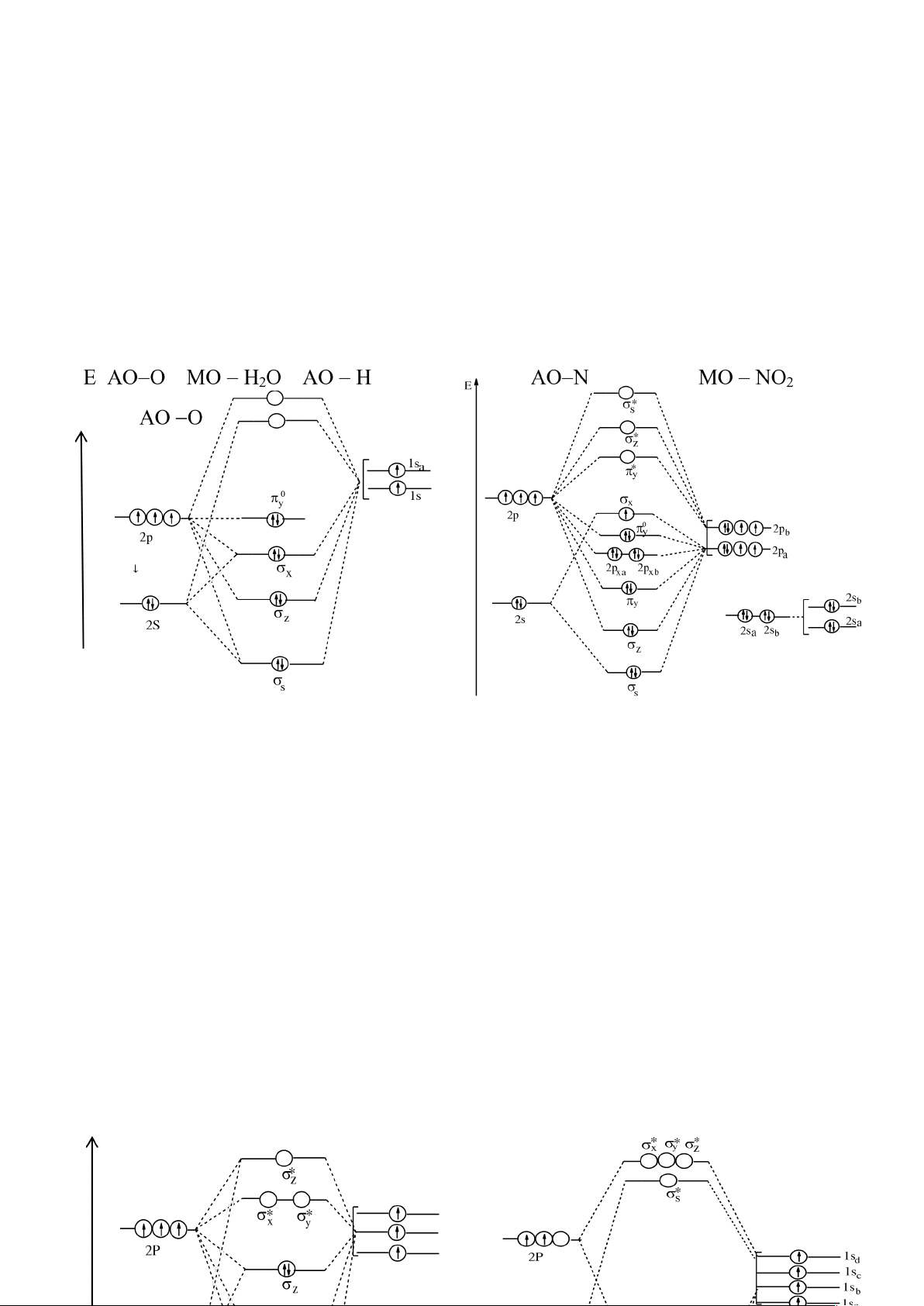
a) Phân tử BeH2:
Trạng thái cơ bản của phân tử BeH
2
có cấu hình electron:
S
2
,
2
Z
.
E AO-Be MO-BeH
2
AO-H E AOC MOCO
2
AOO
10
lOMoARcPSD|
61096548
b) Phân tử ba nguyên tử thẳng với các liên kết :
Ví dụ ta khảo sát cấu tạo của phân tử CO
2
Trạng thái cơ bản của phân tử CO
2
:(2s
a
)
2
(2s
b
)
2
(
S
)
2
(
Z
)
2
(
x,y
)
4
(
0
xy
)
4
. Do đó,
trong phân tử CO
2
có 2 liên kết và hai liên kết . Kết quả này cũng thu được khi khảo
sát phân tử CO
2
theo phương pháp liên kết hoá trị.
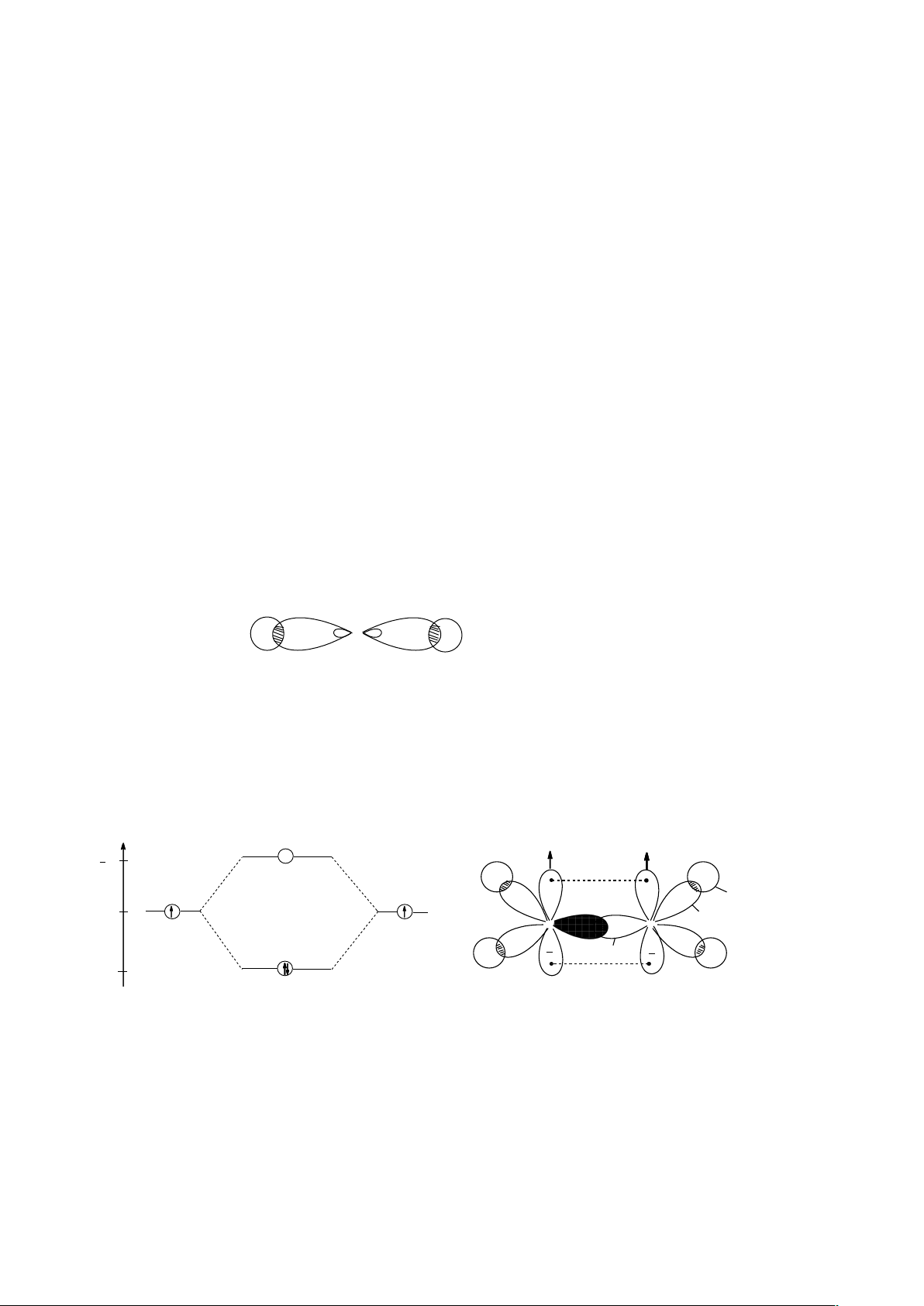
II.3.3.2. Phân tử ba nguyên tử AB2 không thẳng:
Phân tử H
2
O. Phân tử NO
2
lOMoARcPSD|
61096548
II.3.3.3. Phân tử AB
3
tháp tam giác. Phân tử NH
3
II.3.3.4. Các phân tử tứ diện AB4. Phân tử CH4.
E AON MONH
3
AOH AOC
MOCH
4
AOH
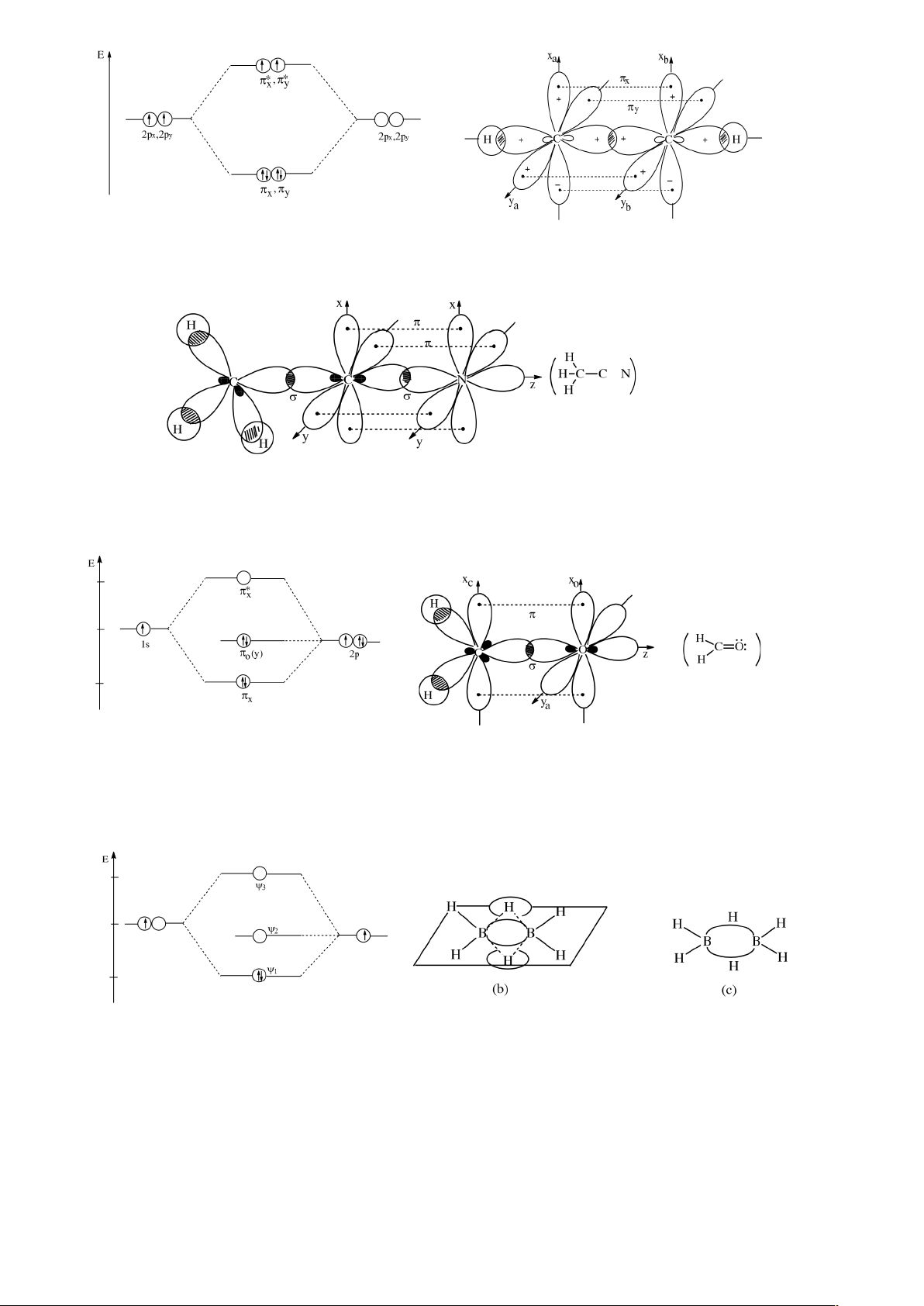
II.3.3.5. Những mô hình khác nhau về liên kết. a. Mô hình
liên kết hai tâm.
Hai obitan liên kết của BeH2:
1
2
Phân tử C
2
H
4
Giản đồ các mức năng lượng của các MO trong C
2
H
4
AOC MO (C
2
H
4
) AO C
Phân tử C
2
H
2
.
Giản đồ mức năng lượng của các MO.
AO C MO (C
2
H
2
) AO C
12
+
+
+
+
H
H
Be
sp
2
2
sp
H
H
C C
H
H
1s
+
+
+
+
+
+
+
+
+
+
+
+
x
a
x
b
E
x
x
*
a
b
a
a
+
b
lOMoARcPSD|
61096548
Phân tử CH
3
CN (Axetônitril): Axetônitril có nhóm chức C N:
Phân tử H
2
CO (Phân tử có nhóm chức cacbonyl C=O)
AO C MO H
2
CO AO O
b. Mô hình liên kết ba tâm.
Phân tử B2H6. (Đi Boran).
AO BB MOB-H-B AO H
Phân tử XeF2. (Phân tử thừa electron).
Dựa vào mô hình liên kết ba tâm ta có thể giải thích dễ dàng trạng thái liên kết trong
XeF
2
(mà không cần sử dụng phân lớp d để tạo thành lai hoá pd khó thực hiện, vì năng
lượng kích thích quá lớn).

lOMoARcPSD|
61096548
MO liên kết (), không liên kết (
o
) và phản liên kết (*)
Do sự xen phủ obitan p của Xe với hai obitan p của hai nguyên tử F cũng xuất hiện 3
obitan phân tử trong đó obitan liên kết và obitan không liên kết bị chiếm bởi hai electron
của hai nguyên tử F. ở đây ta có liên kết ba tâm 4 electron. c. Mô hình liên kết nhiều
tâm.
Đối với nhiều trường hợp, đặc biệt các phân tử phẳng liên hợp vòng (ví dụ C
6
H
6
) chỉ có
thể biểu diễn một cách gần đúng, các liên kết bằng những MO định cư hai tâm, còn các
obitan phân tử không thể biểu diễn bằng các MO định cư hai tâm tương đương
được.Theo thuyết MO, phân tử benzen có cấu tạo phẳng.
a) b) c)
a) Các liên kết (MO định cư 2 tâm);
b) MO không định cư 6 tâm; c) Công thức benzen.
IV/ BÀI TẬP
Bài 1: Sử dụng thuyết VB hãy viết công thức của phân tử O
2
và C
2
. Nghiên cứu tính chất
của O
2
và C
2
người ta thu được các kết quả thực nghiệm sau:
Phân tử Năng lượng liên kết, kJ/mol Độ dài liên kết, pm Từ tính
O
2
495 131 thuận từ
C
2
620 121 nghịch từ
a. Kết quả thực nghiệm này có phù hợp với cấu tạo phân tử đưa ra bởi thuyết VB không
biết rằng: E
C=C
trong C
2
H
4
= 615 kJ/mol, E
C
C
trong C
2
H
2
= 812 kJ/mol, và E
O-O
trong
H
2
O
2
= 142 kJ/mol.
b. Sử dụng thuyết MO hãy giải thích kết quả thực nghiệm thu được.
14
F
+
+
F
X e
F
++
F
X e
X e
F
+
+
+
+
+
F
o
*

lOMoARcPSD|
61096548
Hướng dẫn
a. Cấu tạo phân tử O
2
và C
2
theo thuyết VB:
C C O O
Kết quả thực nghiệm:
Phân tử Năng lượng liên kết, kJ/mol Độ dài liên kết, pm Từ tính
O
2
495 131 thuận từ
C
2
620 121 nghịch từ
C
2
H
4
E
C=C
= 615
C
2
H
2
E
C
C
= 812
H
2
O
2
E
O-O
= 142
-Phân tử C
2
: không phù hợp vì liên kết bốn C-C không thể có năng lượng nhỏ hơn liên
kết ba.
-Phân tử O
2
: phù hợp về mặt năng lượng liên kết nhưng không phù hợp về mặt từ tính.
b. Theo thuyết MO, cấu hình electron của phân tử O
2
và C
2
lần lượt là:
O2: (1s)2(*1s)2(2s)2(*2s)2(2p)2(1)2(2)2(*1)1(*2)1
C2: (1s)2(*1s)2(2s)2(*2s)2(1)2(2)2
-Độ bội liên kết của phân tử C
2
hay O
2
đều là 2. Điều này phù hợp với thực nghiệm.
-Về mặt từ tính, C
2
nghịch từ còn O
2
thuận từ cũng phù hợp với thực nghiệm.
-Sự có mặt của hai electron ở MO phản liên kết trong phân tử O
2
làm cho liên kết đôi
O=O trở nên kém bền hơn so với liên kết đôi C=C cho dù d(O=O) < d(C=C). HS không
giải thích được ý cuối cùng, chỉ cho 0,25đ phần b.
Bài 2:
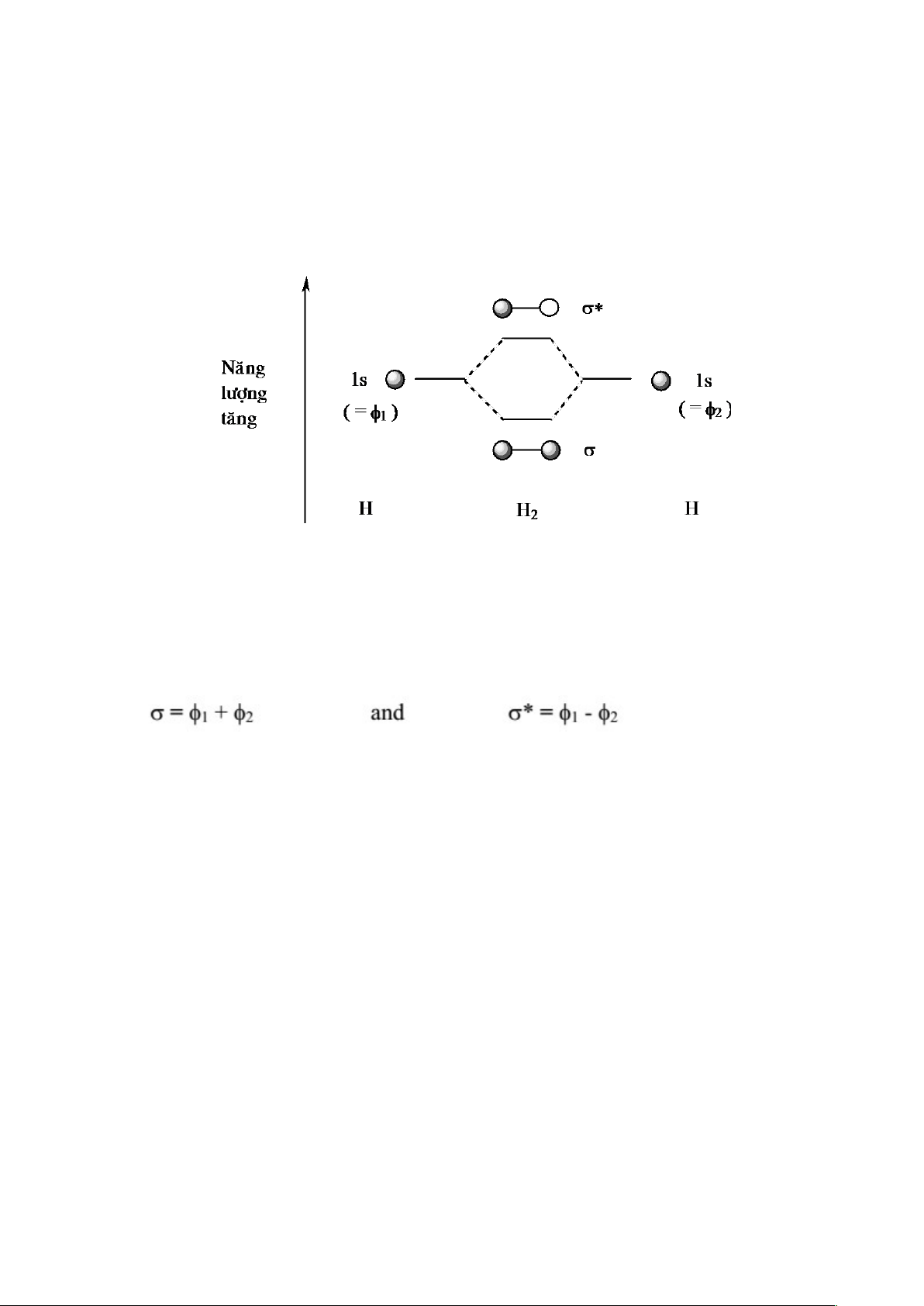
a) Vẽ sơ đồ mức năng lượng biểu diễn sự kết hợp các obitan nguyên tử 1s của hai nguyên
tử hidro để tạo thành phân tử H
2
.
b) Mô tả các MO (obitan phân tử) của H
2
và tương quan của chúng với các obitan nguyên
tử ban đầu.
c) Tại sao MO có năng lượng cao hơn trong H
2
được gọi là obitan phản liên kết?
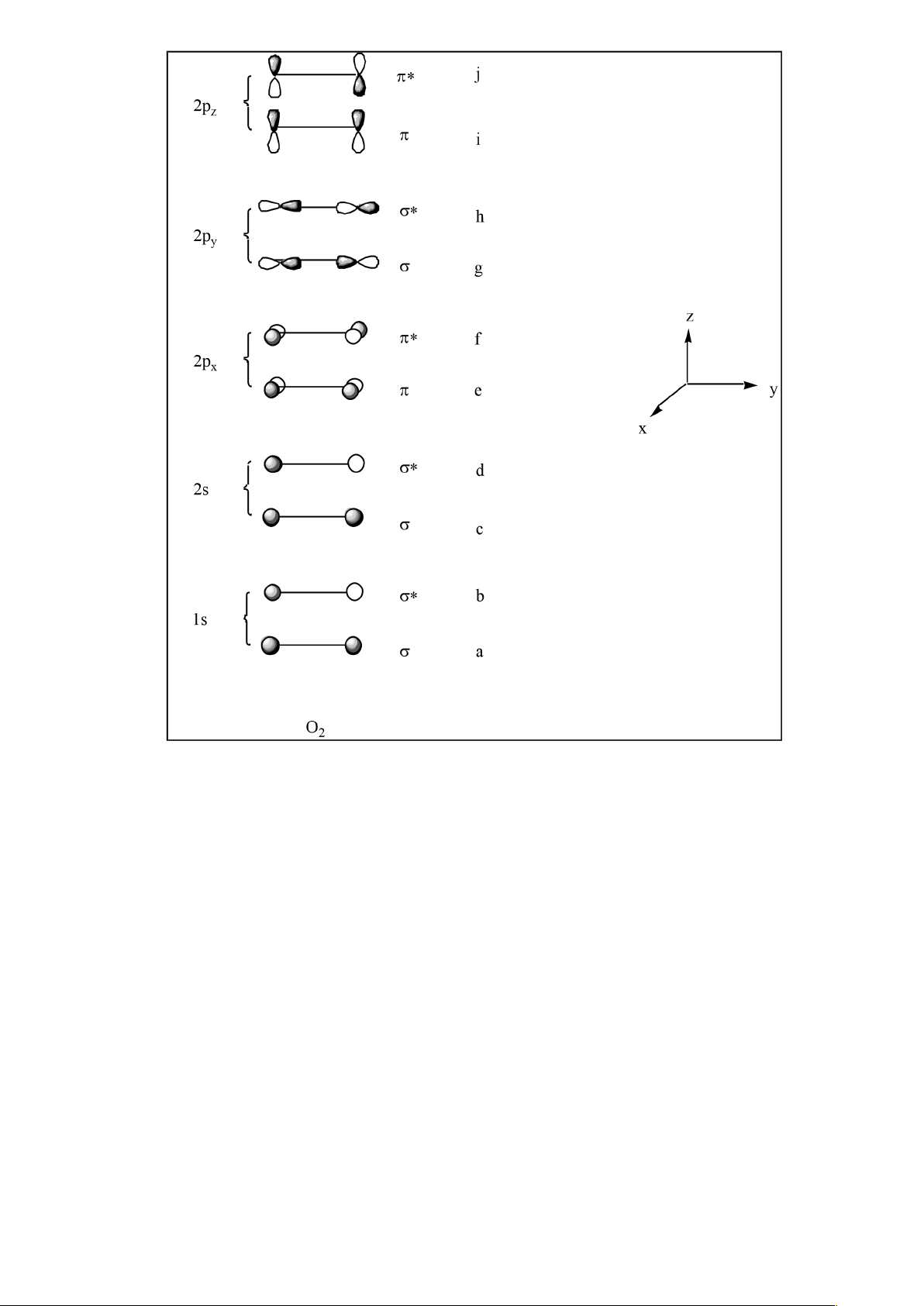
d) Tương tự, ta có thể kết hợp các obitan nguyên tử của các nguyên tử phức tạp hơn để
tạo obitan phân tử. Xét phân tử oxi, O
2
. Xếp các nguyên tử oxi như dưới đây (dọc
theo trục y) và giả thiết rằng có các obitan 1s, 2s, 2px, 2py và 2pz trong mỗi nguyên tử.
z
O O y 1s 2s 2p
x
2p
y
2p
z
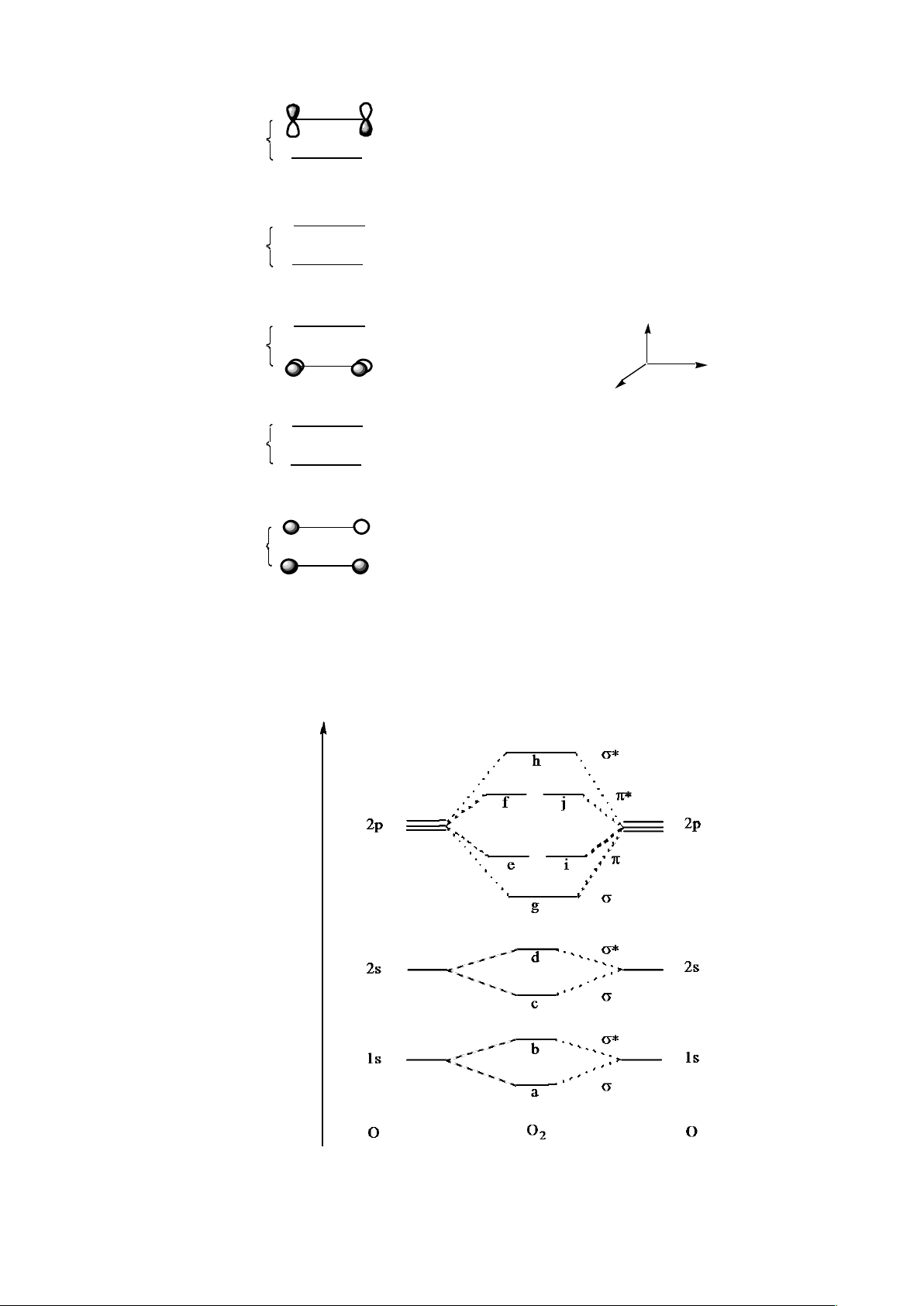
lOMoARcPSD|
61096548
Xây dựng các obitan phân tử từ tương tác của các obitan nguyên tử 2s, 2px, 2py và 2pz
có trong hai nguyên tử oxi và điền chúng vào sơ đồ dưới đây:
j
2p
z
i
h
2p
y
g
z
f
2p
x
ey
x
d
2s
c
b
1s
a
O
2
e) Ta có thể xếp đặt lại các obitan phân tử này theo thứ tự năng lượng tăng dần trong sơ
đồ obitan phân tử MO:
Tại sao năng lượng của obitan g thấp hơn e hoặc i, tương tự, vì sao năng lượng của obitan
h cao hơn f hoặc j?
16
lOMoARcPSD|
61096548
f) Tại sao các obitan e và i có cùng mức năng lượng?
g)Nếu phân tử O
2
bị kéo dãn (nghĩa là khoảng cách O–O tăng lên) thì năng lượng của
obitan j thay đổi thế nào? Sự thay đổi này là nhiều hơn hay ít hơn so với sự thay đổi
năng lượng của obitan h?
Hướng dẫn
a) Sơ đồ mức năng lượng biểu diễn sự kết hợp các obitan nguyên tử 1s của hai
nguyên tử hidro để tạo thành phân tử H
2
.
b) Obitan phân tử (nay viết tắt theo qui ước là MO) của H
2
được tạo thành từ sự kết
hợp, với lượng bằng nhau, các obitan nguyên tử (nay viết tắt theo qui ước là AO) 1s trên
mỗi nguyên tử hidro. Hai MO được tạo thành: một nằm ở mức cao hơn năng lượng của
AO 1s, một nằm ở mức năng lượng thấp hơn. MO có năng lượng thấp hơn được tạo từ sự
kết hợp đồng pha của các AO 1s trên mỗi nguyên tử hidro. MO năng lượng cao tạo thành
do sự kết hợp lệch pha. Tham chiếu sơ đồ trên, ta có thể viết:
c) Được gọi là MO phản liên kết vì sau cùng có sự giảm mật độ electron giữa các
nguyên tử. d)
lOMoARcPSD|
61096548
e) Sự xen phủ dọc của hai AO p trong g xảy ra nhiều hơn xen phủ bên trong e hoặc i.
Như vậy tính chất liên kết trong g nhiều hơn, năng lượng obitan sẽ thấp hơn. Giải thích
tương tự với năng lượng của h so với f và j. Sự xen phủ trong h vẫn nhiều hơn trong f
hoặc j. Như vậy tính chất phản-liên kết trong h nhiều hơn vì thế năng lượng obitan cao
hơn.
f) Obitan e và i đều từ sự xen phủ bên của các obitan nguyên tử p. Các obitan p ở
trục x tất nhiên giống như các obitan p ở trục z (x và z được chỉ định tùy ý) và vì thế các
MO tạo thành phải giống nhau.
g) Khi kéo dãn phân tử O2 sự xen phủ giữa các obitan nguyên tử của hai nguyên tử
trong phân tử sẽ giảm. Như vậy tính chất phản-liên kết trong MO j giảm, từ đó năng
lượng của nó giảm. Do sự xen phủ dọc của obitan h lúc đầu nhiều hơn so với sự xen phủ
bên của j, nên sự xen phủ của h sẽ giảm nhanh hơn khi phân tử O2 bị kéo giãn. Như vậy,
tính chất phản-liên kết giảm nhanh hơn, từ đó năng lượng của h giảm nhiều hơn g.
Bài 3: Lí thuyết obitan phân tử (MO) có thể được áp dụng để xác định sự lấp đầy các
obitan (orbital occupancy) của CN, NN, và NO.
a) Bậc liên kết trong mỗi phân tử trên là bao nhiêu?
b) Phân tử nào trong các phân tử CN, N
2
, và NO có IE (năng lượng ion hóa) cao nhất?
18
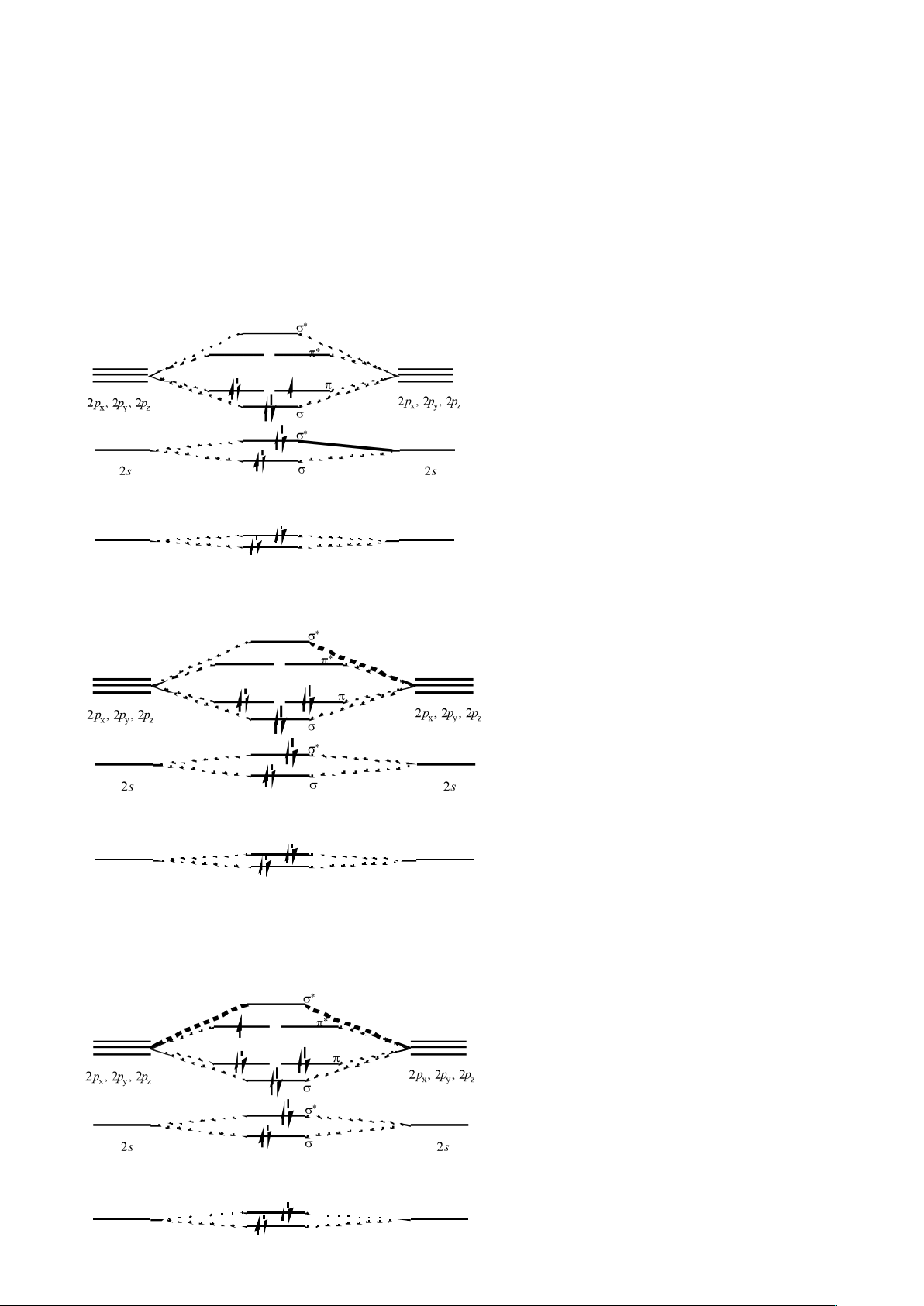
lOMoARcPSD|
61096548
Phân tử nào có IE thấp nhất? [IE(X) = ΔH
o
f(X
+
) – ΔH
o
f(X)]
c) Phân tử nào có ái lực electron cao nhất? (Ái lực electron là năng lượng phóng thích
khi gắn một electron vào một tiểu phân và có trị số dương khi quá trình nhận electron
là tỏa nhiệt).
d) Sự thêm hoặc bớt các electron của CN hoặc NO tạo thành các tiểu phân có cùng số
electron với N
2
. Những tiểu phân có cùng số electron thu được sẽ có độ bền liên kết
tương tự N
2
không? Nếu có thì tại sao? Nếu không thì vì sao?
Hướng dẫn
a) Ta có giản đồ MO như sau:
1s
C N
1s
N N
1
s
1s
1s
Bấm Tải xuống để xem toàn bộ.




