















Preview text:
lOMoARcPSD|45316467 lOMoARcPSD|45316467
CHUYÊN ĐÀ 9 : Đ¾I C¯¡NG VÀ KIM LO¾I A. KI¾N THĄC C¡ BÀN
I. VÞ TRÍ CĂA KIM LO¾I TRONG HTTH. CÂU T¾O CĂA KIM LO¾I
1. Vß trí căa kim lo¿i:
- Nhóm IA (trừ H); nhóm IIA; nhóm IIIA (trừ B); 1 phần của nhóm IVA đến VIA.
- Nhóm IB đến VIIIB.
- Họ Lantan và Actini.
2. CÃu t¿o căa kim lo¿i: - CÃu t¿o nguyên tử:
+ Nguyên tử của hầu hết các nguyên tố kim loại điều có ít electron á lớp ngoài cùng (1,2
hoặc 3). Ví dụ: Na[Ne]3s1,Mg[Ne]3s2, Al[Ne] 3s23p1.
+ Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và
đián tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim. Ví dụ: 11Na 12Mg 13Al 14Si 15P 16S 17Cl
Bán kính: 0,157 0,136 0,125 0,117 0,11 0,104 0,099 Chú ý: Ôn t¿p căng cố
- Cách viết cÁu hình electron nguyên tử.
- Phương pháp xác định vị trí của nguyên tố hóa học trong b¿ng tuần hoàn từ cÁu hình electron
nguyên tử và ngược lại.
- Phân biát nhóm chính , nhóm phụ.
Mở rộng và nâng cao.
Phương pháp xác định vị trí của nguyên tử kim loại thuộc nhóm phụ
dạng tổng quát (n-1)da nsb (n là số lớp electron, chu kỳ) a + b < 8 = 8,9,10 > 10
Vị trí nhóm kim loại = a + b = VIIB = (a+b) - 8 (stt nhóm B )
3. Liên k¿t kim lo¿i: Là liên kết được hình thành do lực hút tĩnh đián giữa các ion dương kim loại và các electron tự do.
II. TÍNH CHÂT CĂA KIM LO¾I. DÃY ĐIÞN HOÁ CĂA KIM LO¾I
1. TÍNH CHÂT V¾T LÍ CHUNG: á điều kián thưßng các kim loại á trạng thái rắn (trừ Hg) có tính
dẻo, dẫn đián, dẫn nhiát và có ánh kim.
Tóm lại tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các e tự do trong
mạng tinh thể kim loại.
2. TÍNH CHÂT V¾T LÍ RIÊNG:
Kim loại khác nhau có khối lượng riêng, nhiát độ nóng ch¿y và tính cứng khác
nhau. VD: - Kim loại có khối lượng riêng lớn nhÁt là: Os
- Kim loại có khối lượng riêng nhỏ nhÁt là: Li
- Kim loại có nhiát độ nóng ch¿y cao nhÁt là: W
- Kim loại có nhiát độ nóng ch¿y thÁp nhÁt là: Hg
- Kim loại có tính cứng lớn nhÁt là: Cr
- Kim loại có tính cứng nhỏ nhÁt là: Cs
3. TÍNH CHÂT HOÁ HàC: Tính chÁt hoá học chung của kim loại là tính khử.:
GV: Th.S Lê Thị Mỹ Trang 1 lOMoARcPSD|45316467 M → Mn+ + ne
- Tác dāng với phi kim: VD: 2Fe + 3Cl2 ³ 2FeCl3 ; 3Fe + 2O2 ³ Fe3O4 ; t 0 t 0 4Al + 3O2 ³t0 2Al2O3. Fe + S ³t0 FeS; Hg + S ² HgS ; t 2Mg + O 0 2 ³ 2MgO.
Kim loại là chÁt khử (bị oxi hóa).
Phi kim là chÁt oxi hóa (bị khử)
- Tác dāng với dung dßch axit:
+ Với dd HCl, H2SO4 loãng. Trừ các kim loại đứng sau hidro trong dãy
đián hóa. Fe + 2HCl ² FeCl2 + H2 ±
2Al + 3H2SO4 (l) ² Al2(SO4)3 + 3H2±
+ Với dd HNO3, H2SO4 đặc VD:
3Cu + 8HNO3 loãng ² 3Cu(NO3)2 + 2NO± + 4H2O
Cu + 2H2SO4 đặc ² CuSO4 + SO2 + 2H2O
Kim loại là chÁt khử (bị oxi hóa). Axit là chÁt oxi hóa (bị khử)
* Chú ý: - Al, Fe, Cr, bị HNO3 đặc nguội và H2SO4 đặc nguội làm thụ động hóa.
- Kim loại có nhiều số oxi hóa bị dung dịch HNO3, H2SO4 đặc oxi hóa đến số oxi hóa cao nhÁt.
- Tác dāng với n°ớc:
Chỉ có các kim loại nhóm IAvà IIA, trừ Be,Mg) khử H2O á nhiát độ thưßng, các kim loại còn lại
khử được H2O á nhiát độ cao hoặc không khử được. VD: 2Na + 2H2O ² 2NaOH + H2 ±
Kim loại là chÁt khử (bị oxi hóa). Nước là chÁt oxi hóa (bị khử)
- Tác dāng với dung dßch muối: VD: Fe + CuSO4 ² FeSO4 + Cu³
Fe chÁt khử (bị oxi hóa), Cu2+ chÁt oxh (bị khử)
4. DÃY ĐIÞN HOÁ KIM LO¾I
- Cặp oxi hóa khử căa kim lo¿i VD: Ag+ + 1e ³ ü ³ ü ³ ü Ag; Cu+ + 2e Cu; Fe2+ + 2e Fe
+ Nguyên tử kim loại đóng vai trò chÁt khử, các ion kim loại đóng vai trò chÁt oxi hóa.
+ Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa - khử của kim loại
VD: Ag+ /Ag, Cu2+/Cu, Fe2+/Fe,...
- Dãy đißn hóa căa kim lo¿i: + + 2+ 3+ 2+ 2+ 2+ 2+ 2+ + 2+ + 3+ K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au
Tính oxi hoaùcuûa ion kim loaïi taêng K Na Mg Al Zn Fe Ni Sn Pb H 2 Cu Ag Au
Tính khöûcuûa kim loaïi giaûm
Tính oxi hóa của ion kim loại tăng, tính khử của kim loại giảm
- So sánh tính chÃt cặp oxi hóa khử
So sánh tính chÁt giữa các cặp oxi hóa khử: Ag+ /Ag và Cu2+/Cu, Zn2+/Zn, nhận thÁy:
Tính oxh các ion: Ag+> Cu2+> Zn2+
Tính khử: Zn>Cu>Ag
- Ý nghĩa dãy điện hóa
Cho phép dự đoán chiều ph¿n ứng giữa 2 cặp oxh khử theo qui tắc α
GV: Th.S Lê Thị Mỹ Trang 2 lOMoARcPSD|45316467 ZN2+ HG 2+ AG+ C 2 U2+ HG AG Z Zn + Cu2+² Zn2++ Cu Hg + 2Ag+² Hg2++ 2Ag N CU
chất oxh mạnh + chất khử mạnh → chất oxh yếu + chất khử yếu.
VD: ph¿n ứng giữa 2 cặp Cu2+/Cu và Fe2+/Fe là: Fe + Cu2+ ² Fe2+ + Cu 5. Hÿp kim: - K
HÁI NIàM : Hợp kim là vật liệu gồm một kim loại cơ bản và một số kim loại hoặc phi kim
khác. VD: Thép, gang, inox, hợp kim đuyra,... - TÍ
NH CHÀT : Hợp kim có nhiều tính chÁt hóa học tương tự tính chÁt của các đơn chÁt tham gia tạo thành hợp
kim, nhưng tính chÁt vật lí và tính chÁt cơ học của hợp kim lại khác nhiều tính chÁt các đơn chÁt.
+ Hợp kim có nhiát độ nóng ch¿y và nhiát độ sôi thÁp
hơn. + Hợp kim cứng và giòn hơn. 6. Sþ N MÒN KIM LO¾I a) S ÿ n mòn kim lo¿i
(Khái niám chung: n mòn kim loại là sự phá hủy kim loại hay hợp kim do tác dụng của các chÁt trong môi trưßng.
(B¿n chÁt của sự n mòn kim loại là sự oxi hóa kim loại thành ion kim loại: M ² Mn+ +ne b) P
hân lo¿i : n mòn hóa học và n mòn đián hóa. - n
mòn hóa hác: n mòn hóa học là quá trình oxi hoá – khử, trong đó các electron của kim loại
được chuyển trực tiếp đến các chÁt trong môi trưßng. (Đặc điÃm:
+ Không phát sinh dòng đián.
+ Nhiát độ càng cao thì tốc độ n mòn càng nhanh. - n
mòn đißn hóa: n mòn đián hóa là quá trình oxi hóa –khử, trong đó kim loại bị n mòn do tác
dụng của dung dịch chÁt đián li và tạo nên dòng đián. + C¢ ch¿
* Kim loại hoạt động mạnh hơn đóng vai trò là cực âm (anot). à đây x¿y ra quá trình oxi hóa M ² Mn+ + ne
* Kim loại hoạt động yếu hơn hoặc phi kim đóng vai trò là cực dương (catot). à đây x¿y ra quá
trình khử: 2H+ + 2e ² H2 hoặc O2 + 2H2O + 4e ² 4OH-
* Dòng đián chuyển dßi từ cực âm sang dương.
+ ĐiÁu kißn có n mòn đißn hóa:
* Các đián cực ph¿i khác nhau về b¿n chÁt.
* Các đián cực ph¿i tiếp xúc trực tiếp hoặc gián tiếp với nhau.
* Các đián cực ph¿i cùng tiếp xúc với dd chÁt đián li.
c) Cách chống n mòn kim lo¿i:
(Nguyên tÁc chung: Hạn chế hay triát tiêu ¿nh hưáng của môi trưßng đối với kim loại. (Ph°¢ng pháp:
* Phương pháp b¿o vá bề mặt: Dùng các chÁt bền với môi trưßng phủ lên bề mặt kim loại
* Dùng phương pháp đián hoá
Nguyên tắc: Gắn kim loại có tính khử mạnh với kim loại cần được b¿o vá (có tính khử yếu hơn). 7. ĐiÁu ch¿ kim lo¿i:
GV: Th.S Lê Thị Mỹ Trang 3 lOMoARcPSD|45316467
- NGUYÊN TÀC: Khử ion kim loại thành nguyên tử: Mn+ + ne → M - PH¯¡NG PHÁP: + P
h°¢ng pháp nhißt luyßn: Dùng các chÁt khử như CO, H2, C, NH3, Al,… để khử các ion kim loại
trong oxit á nhiát độ cao. VD: Fe2O3 + 3CO ³t0 2Fe + 3CO2
Phương pháp này dùng để điều chế các kim loại có độ hoạt động trung bình (sau Al) + P
h°¢ng pháp thăy luyßn: Dùng kim loại tự do có tính khử mạnh hơn để khử ion kim loại trong
dung dịch muối. VD: Fe + CuSO4 ² FeSO4 + Cu
Phương pháp này dùng để điều chế các kim loại hoạt động yếu (sau H) + P
h°¢ng pháp đißn phân:
* Đißn phân hÿp chÃt nóng chÁy: Dùng dòng đián để khử ion kim loại trong hợp chÁt nóng ch¿y
(oxit, hidroxit, muối halogen) dpnc Vd 1: 2Al 2O3 ³ 4Al + 3O2
Vd 2: 4NaOH dpnc ³ 4Na + O2 + 2H2O
Phương pháp này dùng để điều chế kim loại có độ hoạt động mạnh (từ đầu
đến Al) * Đißn phân dung dßch: Dùng dòng đián để khử ion trong dung dịch muối.
Vd1: CuCl2 dpdd ³ Cu + Cl2 ý
Vd2: CuSO4 + H2O dpdd ³ Cu + 1/2O2+ H2SO4
Phương pháp này dùng điều chế các kim loại trung bình, yếu (sau Al).
* Tính l°ÿng chÃt thu đ°ÿc ở các đißn cÿc: m = A.I.t/(n.F)
m: Khối lượng chÁt thoát ra á đián cực (gam)
A: Khối lượng mol của chÁt
đó n: Số electron trao đổi.
Ví dụ: Cu2+ + 2e ² Cu, thì n = 2 và A = 64
2OH- ² O2 (+ 2H+ + 4e, thì n = 4 và A = 32.
t: Thßi gian đián phân (giây, s)
I: Cưßng độ dòng đián (ampe, A)
F: Số Faraday (F = 96500).
B. CÂU HâI VÀ BÀI T¾P THEO CHUYÊN ĐÀ. NH¾N BI¾T
Câu 1: Kim loại nào sau đây tác dụng với khí Cl2 và HCl loãng cùng cho một loại muối clorua kim loại ? A. Fe. B. Al. C. Cu. D. Ag.
Chú ý: Ôn tập củng cố về hóa trị , số oxi hóa tính chÁt hóa học chung của các kim loại cơ b¿n
trong phạm vi dãy đián hóa.
Câu 2: Khi đián phân NaCl nóng ch¿y ( đián cực trơ), tại catot x¿y ra. A. Sự khử ion Cl-.
B. Sự oxi hóa ion Cl-. C. Sự khử ion Na+.
D. Sự oxi hóa ion Na+.
Câu 3: Dãy các kim loại đều có thể được điều chế bằng phương pháp đián phân dung dịch muối của chúng là: A. Fe, Cu, Ag. B. Mg, Zn, Cu. C. Al, Fe, Cr. D. Ba, Ag, Au.
Câu 4: Muối sunfua nào dưới đây có thể điều chế được bằng H2S với muối của kim loại tương ứng? A. Na2S. B. ZnS. C. FeS. D. PbS.
Câu 5: Sự phá hủy kim loại hoặc hợp kim do tác dụng của môi trưßng xung quanh, được gọi chung là
GV: Th.S Lê Thị Mỹ Trang 4 lOMoARcPSD|45316467
A. sự n mòn kim loại.
B. sự n mòn hóa học.
C. sự khử kim loại.
D. sự n mòn đián hóa.
Câu 6: ChÁt nào sau đây tác dụng với Cu A. dung dịch HCl. B. dd HNO3 loãng C. H2SO4 loãng D. dung dịch CuCl2.
Câu 7: Cho hợp kim Zn-Mg-Ag vào dung dịch CuCl2. Sau ph¿n ứng thu được hỗn hợp 3 kim loại là A.Zn, Mg, Cu B.Zn, Mg, Ag C.Mg, Ag, Cu D. Zn, Ag, Cu
Câu 8: Dãy các kim loại đều tác dụng với nước á nhiát độ thưßng là: A. Na, K, Ba B. Na, Al, Fe C. Mg, K, Na D. Ca, Na, Zn
Câu 9: Dãy kim loại nào sau đây đã được xếp theo chiều t ng dần của tính khử? A. Al, Mg, Ca, K B. K, Ca, Mg, Al C. Al, Mg, K, Ca D.Ca, K, Mg, Al
Câu 10: Tính chÁt hoá học chung của kim loại là A. tính khử
B. tính dß nhận electron C. tính dß bị khử
D. tạo liên kết kim loại
Câu 11: Có các kim loại Cu, Ag, Fe, Al, Au. Độ dẫn đián của chúng gi¿m dần theo thứ tự A.Ag,Cu,Au,Al, B. Ag,Cu, Fe, Al, Au C. Au, Ag, Cu, Fe, Al D.Al,Fe,Cu,Ag, Fe Au
Câu 12: Đặt một vật bằng hợp kim Zn-Cu trong không khí ẩm. Quá trình x¿y ra á cực âm là
A. Zn ² Zn2++ 2e B. Cu ² Cu2++ 2e
C. 2H+ + 2e ² H2
D.2H2O + 2e ² 2OH- + H2
Câu 13: Trưßng hợp nào sau đây là hián tượng n mòn đián hóa?
A.Thép bị gỉ trong không khí ẩm.
B.Na cháy trong không khí
C.Zn tan trong dung dịch H2SO4 loãng.
D. Zn bị phá hủy trong khí Clo.
Câu 14: Những tính chÁt vật lí chung quan trọng của kim loại là: tính dẻo, dẫn nhiát, dẫn đián và
ánh kim. Nguyên nhân những tính chÁt vật lí chung đó là do trong nguyên tử kim loại có
A. nhiều electron độc thân .
B. các ion dương chuyển động tự do.
C. nhiều electron chuyển động tự do.
D. nhiều ion dương kim loại.
Câu 15: Kim loại có những tính chÁt vật lý chung nào sau đây?
A. Tính dẻo, tính dẫn nhiát, nhiát độ nóng ch¿y cao
B. Tính dẻo, tính dẫn đián và nhiát, có ánh
C. Tính dẫn đián và nhiát, khối lượng riêng lớn.
kim D. Tính dẻo, có ánh kim, rÁt cứng.
Câu 16: Mạng tinh thể kim loại gồm có
A. nguyên tử, ion kim loại và các electron độc thân.
B. nguyên tử, ion kim loại và các electron tự do.
C. nguyên tử kim loại và cácelectron độc thân .
D. ion kim loại và electron độc thân
Câu 17: Phát biểu nào sau đây là KHÔNG đúng?
A. n mòn kim loại là sự hủy hoại kim loại và hợp kim dưới tác dụng của môi trưßng xung quanh.
B. n mòn kim loại là một quá trình hóa học trong đó kim loại bị n mòn bái các axit trong môi trưßng không khí ẩm.
C.Trong quá trình n mòn, kim loại bị oxi hóa thành ion kim loại của nó.
D. n mòn kim loại được chia làm hai dạng: n mòn hóa học và n mòn đián hóa.
Câu 18:Trên cửa của các đập nước bằng thép thưßng thÁy có gắn những là Zn mỏng. Làm như
vậy là để chống n mòn cửa đập theo phương pháp nào trong các phương pháp sau đây?
A. Dùng hợp kim chống gỉ
B. Phương pháp bao phủ bề mặt
C. Phương pháp biến đổi hóa học lớp bề mặt
D.Phương pháp đián hóa
Câu 19: Điều khẳng định nào sau đây là KHÔNG đúng?
A.Trong hợp kim có liên kết kim loại hoặc liên kết cộng hóa trị .
B.Tính chÁt của hợp kim phụ thuộc vào thành phần, cÁu tạo của hợp kim.
C. Hợp kim có tính chÁt hoá học khác với tính chÁt hóa học của kim loại tạo ra chúng .
D.Hợp kim có tính chÁt vật lí và tính cơ học khác nhiều so với kim loại tạo ra chúng
Câu 20: Cho 4 cặp oxi hóa - khử: Fe2+/Fe; Fe3+/Fe2+; Ag+/Ag;Cu2+/Cu. Dãy xếp các cặp theo chiều
t ng dần về tính oxi hóa và gi¿m dần về tính khử là dãy chÁt nào?
A. Fe2+/Fe; ;Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag
B. Fe3+/Fe2+; Fe2+/Fe; Ag+/Ag; Cu2+/Cu
C. Ag+/Ag; Fe3+/Fe2+; Cu2+/Cu; Fe2+/Fe
D. Cu2+/Cu; Fe2+/Fe; Fe3+/Fe2+; Ag+/Ag
Câu 21: Nguyên tố X có đián tích hạt nhân là 26. CÁu hình electron của X, chu kỳ và nhóm
trong há thống tuần hoàn lần lượt là:
GV: Th.S Lê Thị Mỹ Trang 5 lOMoARcPSD|45316467 2 2 6 2 6 6 2 2 6 2 6 6 2
A. 1s 2s 2p 3s 3p 3d , chu kỳ 3 nhóm VIB.
B. 1s 2s 2p 3s 3p 3d 4s , chu kỳ 4 nhóm IIA. 2 2 6 2 6 5 2 2 6 2 6 6 2
C. 1s 2s 2p 3s 3p 3d , chu kỳ 3 nhóm VB.
D.1s 2s 2p 3s 3p 3d 4s ,chu kỳ 4 nhóm VIIIB.
Câu 22: Câu nào sau đây không đúng?
A. Số electron á lớp ngoài cùng của nguyên tử kim loại thưßng có ít (1 đến 3e).
B. Số electron á lớp ngoài cùng của nguyên tử phi kim thưßng có từ 4 đến 7.
C. Trong cùng chu kỳ, nguyên tử kim loại có bán kính nhỏ hơn nguyên tử phi kim.
D. Trong cùng nhóm, số electron ngoài cùng của các nguyên tử thưßng bằng nhau.
Câu 23: Cho các cÁu hình electron nguyên tử sau: 1) 1s22s22p63s1
2) 1s22s22p63s23p64s2 3) 1s22s1 4) 1s22s22p63s23p1
Các cÁu hình đó lần lượt là của những nguyên tố
A. Ca (Z=20), Na(Z=11), Li(Z=3), Al(Z=13)
B. Na(Z=11), Ca(Z=20), Li(Z=3), Al(Z=13
C. Na(Z=11), Li(Z=3), Al(Z=13), Ca(Z=20)
D. Li(Z=3), Na(Z=11), Al(Z=13), Ca(Z=20)
Câu 24: Cho các câu phát biểu về vị trí và cÁu tạo của kim loại sau:
(I): Hầu hết các kim loại chỉ có từ 1e đến 3e lớp ngoài cùng
(II): TÁt c¿ các nguyên tố nhóm B (phân nhóm phụ) đều là kim loại.
(III): à trạng thái rắn, đơn chÁt kim loại có cÁu tạo tinh thể
(IV): Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại và lớp electron tự do.
Những phát biểu đúng là A.(I) B.( I ), (II ) C. (I), (III), (IV)
D. (I), (II), (III), (IV) THÔNG HIÂU
Câu 1: Cho hỗn hợp Fe, Cu ph¿n ứng với dung dịch HNO3 loãng. Sau khi ph¿n ứng hoàn
toàn, thu được dung dịch chỉ chứa một chÁt tan và kim loại dư. ChÁt tan đó là A. Cu(NO3)2. B. HNO3. C. Fe(NO3)2. D. Fe(NO3)3.
Câu 2: Ph¿n ứng sau đây tự x¿y ra : Zn + 2Cr3+ ³ Zn2+ + 2Cr2+ .
Ph¿n ứng này cho thÁy :
A. Zn có tính khử mạnh hơn Cr2+ và Cr3+ có tính oxi hóa mạnh hơn Zn2+.
B. Zn có tính khử yếu hơn Cr2+ và Cr3+ có tính oxi hóa yếu hơn Zn2+.
C. Zn có tính oxi hóa mạnh hơn Cr2+ và Cr3+ có tính khử mạnh hơn Zn2+.
D. Zn có tính oxi hóa yếu hơn Cr2+ và Cr3+ có tính khử yếu hơn Zn2+.
Câu 3: Đián phân dung dịch CuCl2 bằng đián cực than chì, đặt m¿nh giÁy quì tím ẩm á cực
dương. Màu của giÁy quì chuyển A. đỏ.
C. đỏ sau mÁt mầu. B. xanh. D. không đổi.
Câu 4: Đián phân một dung dịch có chứa HCl, CuCl2. pH của dung dịch biến đổi như thế nào theo thßi gian đián phân?
A. T ng dần đến pH = 7 rồi không đổi. B. Gi¿m dần.
C. T ng dần đến pH > 7 rồi không đổi.
D. pH không đổi, luôn nhỏ hơn 7.
Câu 5: Cho hỗn hợp bột X gồm 3 kim loại : Fe, Cu, Ag. để tách nhanh Ag ra khỏi X mà không
làm thay đổi khối lượng có thể dùng hóa chÁt nào sau đây? A. dd FeCl3dư B. dd AgNO3dư C. dd HCl đặc D. dd HNO3 dư
Câu 6: Chọn câu tr¿ lßi đúng. Tính oxi hóa của các ion được xếp theo thứ tự gi¿m dần như sau:
A.Fe3+ > Cu2+ > Fe2+ > Al3+ > Mg2+
B. Mg2+ > Al3+ > Fe2+ > Fe3+ > Cu2+
C. Al3+ > Mg2+ > Fe3+ > Fe2+ > Cu2+
D. Fe3+ > Fe 2+ > Cu 2+ > Al3+ > Mg2+
Câu 7: Đem ngâm miếng kim loại sắt vào dung dịch H2SO4 loãng. Nếu thêm vào đó vài giọt
dung dịch CuSO4 thì sẽ có hián tượng gì đối với lượng khí thoát ra? A. không đổi. B. nhiều hơn. C. ít hơn .
D. ngừng thoát ra (do đồng bao quanh miếng sắt).
Câu 8: Dãy gồm các nguyên tử và ion có cùng số electron á lớp ngoài cùng là
GV: Th.S Lê Thị Mỹ Trang 6 lOMoARcPSD|45316467
A. Ar, K+, Ca2+, S2-, Cl- B. C¿ A, D đều sai
C. C¿ A, D đều đúng
D.Ne, F-, O2-, Na+, Mg2+, Al3+
Câu 9: Ion Fe3+ có cÁu hình electron phân lớp ngoài cùng là 3d5. Vậy nguyên tử Fe sẽ có cÁu hình là:
A.1s22s22p63s23p64s23d5.
B.1s22s22p63s23p63d64s2. C.
D.1s22s22p63s23p63d54s2. 1s22s22p63s23p63d8.
Câu 10: Nhúng một lá Fe kim loại vào các dung dịch muối AgNO3 (1), Al(NO3)3 (2), Cu(NO3)2 (3),
Fe(NO3)3 (4). Các dung dịch có thể ph¿n ứng với Fe là: A. 1 và 3 B. 1 và 2 C. 1,3 và 4 D. TÁt c¿.
Câu 11: Từ dung dịch MgCl2 ta có thể điều chế Mg bằng cách
A. Đián phân dung dịch MgCl2.
B. Chuyển MgCl2 thành Mg(OH)2 rồi chuyển thành MgO rồi khử MgO bằng CO …
C. Cô cạn dung dịch rồi đián phân MgCl2 nóng ch¿y.
D. Dùng Na kim loại để khử ion Mg2+ trong dung dịch.
Câu 12: Kết luận nào sau đây không đúng?
A. Thiết bị máy móc bằng kim loại tiếp xúc với hơi nước á nhiát độ cao có kh¿ n ng bị n mòn hóa học.
B. Nối thanh Zn với vỏ tàu thuỷ bằng thép thì vỏ tàu thủy sẽ được b¿o vá.
C. Để đồ vật bằng thép ngoài không khí ẩm thì đồ vật đó sẽ bị n mòn đián hóa.
D. Một miếng vỏ đồ hộp làm bằng sắt tây (sắt tráng thiếc) bị xây xát tận bên trong, để trong không khí ẩm
thì Sn sẽ bị n mòn trước.
Câu 13: Khi cho luồng khí hiđro (có dư) đi qua ống nghiám chứa Al2O3, FeO, CuO, MgO nung
nóng đến khi ph¿n ứng x¿y ra hoàn toàn. ChÁt rắn còn lại trong ống nghiám bao gồm
A.Al2O3, FeO, CuO, Mg B. Al2O3, Fe, Cu, MgO C.Al, Fe, Cu, Mg D. Al, Fe, Cu, MgO
Câu 14: Điểm giống nhau giữa n mòn hóa học và n mòn đián hóa là đều
A. x¿y quá trình oxy hóa - khử.
B. có sự trao đổi electron nên phát sinh dòng đián.
C. bị oxi hóa bái không khí .
D. chỉ x¿y ra với kim loại nguyên chÁt.
Câu 15: Tiến hành bốn thí nghiám sau: Thí nghiám 1: nhúng thanh Fe vào dung dịch FeCl3. Thí nghiám 2:
nhúng thanh Fe vào dung dịch CuSO4. Thí nghiám 3: nhúng thanh Cu vào dung dịch FeCl3. Thí nghiám 4:
cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl. Số trưßng hợp xuÁt hián n mòn đián hóa làA.3 B.1 C.2 D.4
Câu 16: Điều khẳng định nào sau đây KHÔNG đúng?
A. Để đồ vật bằng thép ra ngoài không khí ẩm thì đồ vật đó sẽ bị n mòn đián hoá.
B. Các thiết bị máy móc bằng kim loại tiếp xúc với hơi nước á nhiát độ cao có kh¿ n ng bị n mòn hoá học.
C. Nối thanh Zn với vỏ tàu thuỷ bằng thép thì vỏ tàu thuỷ sẽ được b¿o vá.
D. Một miếng vỏ đồ hộp làm bằng sắt tây (sắt tráng thiếc) bị xây sát tận bên trong, để ngoài không
khí ẩm thì thiếc sẽ n mòn đián hoá. V¾N DĀNG THÂP
Câu 1: A là một kim loại. Thực hián các ph¿n ứng theo thứ tự (A) + O2 ³ (B)
(B) + H2SO4 loãng ³ (C) + (D) + (E)
(C) + NaOH ³ (F)ÿ + (G)
(D) + NaOH ³ (H)ÿ + (G) (F) + O2 + H2O ³ (H) Kim loại A là A. Zn. B. Mg. C. Al. D. Fe.
Câu 2: Có các nhận định sau:
(1)CÁu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong b¿ng tuần hoàn các nguyên tố
hoá học, nguyên tố X thuộc chu kì 4, nhóm VIIIB.
(2)Các ion và nguyên tử: Ne , Na+ , F− có điểm chung là có cùng số electron.
(3)Khi đốt cháy ancol no thì ta có n(H2O) : n(CO2)>1.
GV: Th.S Lê Thị Mỹ Trang 7 lOMoARcPSD|45316467
(4)Dãy gồm các nguyên tố được sắp xếp theo chiều gi¿m dần bán kính nguyên tử từ trái sang ph¿i là K, Mg, Si, N.
(5)Tính bazơ của dãy các hiđroxit: NaOH, Mg(OH)2, Al(OH)3 gi¿m dần.
Cho: N (Z = 7), F (Z=9), Ne (Z=10), Na (Z=11), Mg (Z=12), Al (Z=13), K (Z = 19), Si (Z = 14).
Số nhận định đúng: A. 3. B. 5. C. 4. D. 2.
Câu 3: Cho hai muối X, Y thõa mãn điều kián sau:
X + Y ³ không x¿y ra ph¿n ứng
X + Cu ³ không x¿y ra ph¿n ứng
Y + Cu ³ không x¿y ra ph¿n ứng
X + Y + Cu ³ x¿y ra ph¿n ứng
X, Y là muối nào dưới đây?
A. NaNO3 và NaHCO3. B. NaNO3 và NaHSO4. C.Fe(NO3)3 và D. Mg(NO3)2 và KNO3. NaHSO4.
Câu 4: Để tách riêng từng kim loại ra khỏi dung dịch chứa đồng thßi muối AgNO3 và Pb(NO3)2,
ngưßi ta dùng lần lượt các kim loại A. Cu, Fe B. Pb, Fe C. Ag, Pb D. Zn, Cu
Câu 5: Nhúng một lá sắt vào dung dịch CuSO4, sau một thßi gian lÁy lá sắt ra cân nặng hơn so với
ban đầu 0,2 g. Khối lượng đồng bám vào lá sắt là A. 0,2gam B. 1,6gam C. 3,2gam D. 6,4gam
Câu 6: Hoà tan hoàn toàn 2,17 gam hỗn hợp 3 kim loại A, B, C trong dung dịch HCl dư thu được
2,24 lít khí H2 (đktc) và m gam muối. Giá trị của m là A. 9,27. B. 5,72. C. 6,85. D. 6,48.
Câu 7: Cho 7,8 gam K vào 192,4 gam nước thu được m gam dd và một lượng khí thoát ra. Giá trị m là A. 198g B. 200,2g C. 200g D. 203,6g
Câu 9: Ngâm một lá Zn trong dd có hòa tan 4,16 gam CdSO4. Ph¿n ứng xong khối lượng lá Zn t ng
2,35%. Khối lượng lá Zn trước ph¿n ứng là A. 40 g B. 60g C. 80g D. 100g
Câu 8: Hoà tan hoàn toàn 7,5g hỗn hợp Mg và Al trong dung dịch H2SO4 loãng (vừa đủ) thu được
7,84 lít khí H2 (đktc). Khối lượng muối khan thu được sau ph¿n ứng là A. 76,1g B.14,1g C. 67,1g D. 41,1g
Câu 9: Ngâm một lá Fe trong dung dịch CuSO4. Sau một thßi gian ph¿n ứng, lÁy lá Fe ra rửa nhẹ, làm
khô, đem cân thÁy khối lượng t ng thêm 1,6g. Khối lượng Cu bám trên là Fe là bao nhiêu gam? A.12,8g B.8,2g C.6,4g D.9,6g
Câu 10: Đián phân 200ml dung dịch CuCl2 1M (đián cực trơ) thu được 0,05mol Cl2 . Ngâm một đinh sắt
sạch vào dung dịch còn lại sau khi đián phân, khi ph¿n ứng kết thúc lÁy đinh sắt ra. Hỏi khối lượng đinh
sắt t ng thêm bao nhiêu gam? A.0,4 B.3,2 C.9,6 D.1,2
Câu 11: Một hợp kim tạo bái Cu và Al có cÁu tạo tinh thể hợp chÁt hóa học và có chứa 12,3%
khối lượng nhôm. Công thức hóa học của hợp kim là A.Cu3Al B.CuAl3 C.Cu2Al3 D.Cu3Al2
Câu 12: Hòa tan 6g hợp kim Cu-Ag trong dung dịch HNO3 tạo ra được 14,68g hỗn hợp muối
Cu(NO3)2 và AgNO3. Thành phần % khối lượng của hợp kim là
A.50% Cu và 50% Ag B. 64% Cu và 36% Ag C. 36% Cu và 64% Ag D.60% Cu và 40% Ag
GV: Th.S Lê Thị Mỹ Trang 8 lOMoARcPSD|45316467 V¾N DĀNG CAO
Câu 1: Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lá mol tương ứng là 1: 2 vào dung dịch chứa 0,2
mol Fe2(SO4)3. Sau khi các ph¿n ứng x¿y ra hoàn toàn, thu được m gam kim loại. Giá trị của m là A. 6,40. B. 16,53. C. 12,00. D. 12,80.
Câu 2: Cho 5,6 gam Fe tan hết trong dung dịch HNO3 thu được 21,1 gam muối và V lít NO2 (đktc). Giá trị của V là A. 3,36 lít B. 4,48 lít C. 5,6 lít D. 6,72 lít
Câu 3: Trộn 84 gam bột Fe với 32 gam bột S rồi đun nóng (không có không khí). Hoà tan chÁt rắn
A sau khi nung bằng dung dịch HCl dư được d/dịch B và khí C. Đốt cháy khí C cần V lít oxi (đktc).
Các p/ứng x¿y ra hoàn toàn. Giá trị của V là A. 16,8 lít B. 39,2 lít C. 11,2 lít D. 33,6 lít
Câu 4: Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các
ph¿n ứng, lọc bỏ phần dung dịch thu được m gam bột rắn. Thành phần phần tr m theo khối lượng
của Zn trong hỗn hợp bột ban đầu là A. 90,27%. B. 85,30%. C. 82,20%. D. 12,67%.
Câu 5: Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO 3 a mol/l và Cu(NO3 )2 2a
mol/l, thu được 45,2 gam chÁt rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 7,84 lít
khí SO2 (á đktc, là s¿n phẩm khử duy nhÁt). Biết các ph¿n ứng x¿y ra hoàn toàn. Giá trị của a là A. 0,25. B. 0,30. C. 0,15. D. 0,20.
Câu 6: Hòa tan hoàn toàn 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X
và 1,344 lít (á đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí
H2 là 18. Cô cạn dung dịch X, thu được m gam chÁt rắn khan. Giá trị của m là A. 97,98. B. 106,38. C. 38,34. D. 34,08.
Câu 7: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí
NxOy (s¿n phẩm khử duy nhÁt, á đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là A. NO và Mg. B. N2O và Al C. N2O và Fe. D. NO2 và Al.
Câu 8: Hòa tan hoàn toàn 14,6 gam hỗn hợp X gồm Al và Sn bằng dung dịch HCl (dư), thu được
5,6 lít H2(á đktc). Thể tích khí O2 (á đktc) cần để ph¿n ứng hoàn toàn với 14,6 gam hỗn hợp X là A. 3,92 lít. B. 1,68 lít C. 2,80 lít D. 4,48 lít
GV: Th.S Lê Thị Mỹ Trang 9 lOMoARcPSD|45316467
ĐÀ KIÂM TRA CHÂT L¯þNG
Câu 1. Trong các kim loại: Al, Mg, Fe và Cu, kim loại có tính khử mạnh nhÁt là A. Cu. B. Mg. C. Fe. D. Al.
Câu 2. Trong công nghiáp, để điều chế NaOH ngưßi ta đián phân dung dịch chÁt X (có màng ng n). X là A. Na2SO4. B. NaNO3. C. Na2CO3. D. NaCl.
Câu 3. Khí sinh ra trong trưßng hợp nào sau đây không gây ô nhißm không khí?
A. Quá trình đun nÁu, đốt lò sưái trong sinh hoạt.
B. Quá trình quang hợp của cây xanh.
C. Quá trình đốt nhiên liáu trong động cơ ô tô.
D. Quá trình đốt nhiên liáu trong lò cao.
Câu 4. S¿n phẩm của ph¿n ứng este hóa giữa ancol metylic và axit propionic là A. propyl propionat. B. metyl propionat. C. propyl fomat. D. metyl axetat.
Câu 5. Sục khí CO2 vào lượng dư dung dịch Ba(OH)2 tạo thành kết tủa có màu A. nâu đen. B. trắng. C. xanh thẫm. D. trắng xanh.
Câu 6. Dung dịch chÁt nào sau đây không làm quỳ tím chuyển màu? A. Etylamin. B. Anilin. C. Metylamin. D. Trimetylamin.
Câu 7. à điều kián thưßng, nhôm bị bốc cháy khi tiếp xúc với A. khí O2. B. H2O. C. khí Cl2. D. dung dịch NaOH.
Câu 8. ChÁt nào sau đây vừa ph¿n ứng với dung dịch NaOH vừa ph¿n ứng với dung dịch HCl? A. AlCl3. B. Al2(SO4)3. C. NaAlO2. D. Al2O3.
Câu 9. Polime nào sau đây được tổng hợp bằng ph¿n ứng trùng hợp? A. Polisaccarit. B. Poli(vinyl clorua).
C. Poli(etylen terephatalat). D. Nilon-6,6.
Câu 10. Kim loại crom tan được trong dung dịch
A. HNO3 (đặc, nguội). B. H2SO4 (đặc, nguội). C. HCl (nóng). D. NaOH (loãng).
Câu 11. Thủy phân hoàn toàn tinh bột trong môi trưßng axit, thu được s¿n phẩm là A. saccarozơ. B. glucozơ. C. amilozơ. D. fructozơ.
Câu 12. Đốt cháy photpho trong khí oxi dư thu được s¿n phẩm chính là A. P2O3. B. PCl3. C. P2O5. D. P2O.
Câu 13. Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi ph¿n ứng x¿y ra hoàn toàn,
thu được 3,36 lít khí H2 (đktc). Phần tr m khối lượng của Al trong X là A. 54,0%. B. 49,6%. C. 27,0%. D. 48,6%.
Câu 14. Hòa tan hoàn toàn 9,4 gam K2O vào 70,6 gam nước, thu được dung dịch KOH có nồng
độ x%. Giá trị của x là A. 14. B. 18. C. 22. D. 16.
Câu 15. Cho dãy các chÁt sau: tripanmitin, axit aminoaxetic, Ala-Gly-Glu, etyl propionat. Số
chÁt trong dãy có ph¿n ứng với dung dịch NaOH (đun nóng) là A. 2. B. 4. C. 1. D. 3.
Câu 16. Cho dung dịch chứa m gam hỗn hợp gồm glucozơ và fructozơ tác dụng với lượng dung dịch
AgNO3/NH3. Đun nóng thu được 38,88 gam Ag. Giá trị m là A. 48,6. B. 32,4. C. 64,8. D. 16,2.
Câu 17. Cho hỗn hợp gồm CH3COOC2H5 và CH3COONH4 tác dụng vừa đủ với 200 ml dung
dịch NaOH 1M, thu được dung dịch chứa m gam muối. Giá trị của m là A. 19,6. B. 9,8. C. 16,4. D. 8,2.
Câu 18. Phát biểu nào sau đay sai?
GV: Th.S Lê Thị Mỹ Trang 10 lOMoARcPSD|45316467
A. Khi cho giÁm n (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì có kết tủa xuÁt hián.
B. Xenlulozơ và tinh bột có phân tử khối bằng nhau.
C. Tinh bột là lương thực cơ b¿n của con ngưßi.
D. Thành phần chính của sợi bông, gỗ, nứa là xenlulozơ.
Câu 19. Muối nào sau đây là muối axit? A. NaHCO3. B. BaCl2. C. K2SO4. D. (NH4)2CO3.
Câu 20. Xà phòng hóa hoàn toàn este X mạch há trong dung dịch NaOH, thu được hỗn hợp các
chÁt hữu cơ gồm: (COONa)2, CH3CHO và C2H5OH. Công thức phân tử của X là A. C6H10O4. B. C6H10O2. C. C6H8O2. D. C6H8O4.
Câu 21. Thực hián các thí nghiám sau:
(1) Cho lá kim loại Fe nguyên chÁt vào dung dịch CuSO4.
(2) Cho lá kim loại Al nguyên chÁt vào dung dịch HNO3 loãng, nguội.
(3) Đốt cháy dây Mg nguyên chÁt trong khí Cl2.
(4) Cho lá kim loại Fe-Cu vào dung dịch H2SO4 loãng.
Số thí nghiám x¿y ra n mòn hóa học là A. 4. B. 3. C. 2. D. 1.
Câu 22. Khi thủy phân hoàn toàn một triglixerit X trong môi trưßng axit thu được hỗn hợp s¿n phầm
gồm glixerol, axit panmitic và axit oleic. Số công thức cÁu tạo của tho¿n mãn tính chÁt trên là A. 2. B. 8. C. 4. D. 1.
Câu 23. Cho các dung dịch loãng: (1) AgNO3 , (2) FeCl2, (3) HNO3, (4) FeCl3, (5) hỗn hợp gồm
NaNO3 và HCl. Số dung dịch ph¿n ứng được với Cu là A. 2. B. 5. C. 3. D. 4.
Câu 24. Cho các loại tơ sau: nilon-6, lapsan, visco, xenlulozơ axetat, nitron, enang. Số tơ thuộc tơ hóa học là A. 6. B. 4. C. 5. D. 3.
Câu 25. Đốt a mol X là trieste của glixerol và các axit đơn chức, mạch há thu được b mol CO2 và c mol
H2O, biết b - c = 4a. Hiđro hóa hoàn toàn m gam X cần 6,72 lít H2 (đktc) thu được 133,5 gam Y. Nếu đun
m gam X với dung dịch chứa 500 ml NaOH 1M đến ph¿n ứng x¿y ra hoàn toàn, cô cạn dung dịch sau ph¿n
ứng khối lượng chÁt rắn khan thu được là A. 139,1 gam. B. 138,3 gam. C. 140,3 gam. D. 112,7 gam.
Câu 26. Tiến hành các thí nghiám sau:
(a) Cho Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch NaOH.
(c) Cho Na2CO3 dư vào dung dịch Ca(HCO3)2.
(d) Cho bột Fe dư vào dung dịch FeCl3.
(e) Hoà tan hỗn hợp rắn gồm Na và Al (có cùng số mol) vào lượng nước dư.
(f) Sục khí Cl2 dư vào dung dịch FeCl2.
Sau khi các ph¿n ứng x¿y ra hoàn toàn, dung dịch thu được chứa một muối tan là A. 6. B. 5. C. 4. D. 3.
Câu 27. Cho các phát biểu sau:
(a) Hợp chÁt Fe(NO3)2 vừa có tính khử, vừa có tính oxi hóa.
(b) Dung dịch Fe(NO3)2 tác dụng được với dung dịch HCl đặc.
(c) Corinđon có chứa Al2O3 á dạng khan.
(d) Sục khí H2S vào dung dịch FeCl3 thu được kết tủa.
(e) Na2CO3 là hóa chÁt quan trọng trong công nghiáp
thủy tinh. Số phát biểu đúng là A. 2. B. 5. C. 3. D. 4.
Câu 28. Cho các phát biểu sau:
(a) Saccarozơ được cÁu tạo từ hai gốc -glucozơ.
(b) Oxi hóa glucozơ, thu được sobitol.
GV: Th.S Lê Thị Mỹ Trang 11 lOMoARcPSD|45316467
(c) Trong phân tử fructozơ có một nhóm –CHO.
(d) Xenlulozơ trinitrat được dùng làm thuốc súng không khói.
(e) Trong phân tử xenlulozơ, mỗi gốc glucozơ có ba nhóm –OH.
(g) Saccarozơ bị thủy phân trong môi trưßng
kiềm. Số phát biểu đúng là A. 2. B. 5. C. 4. D. 3.
Câu 29. Một học sinh tiến hành nghiên cứu dung dịch X đựng trong lọ không dán nhãn thì thu được kết qu¿ sau:
- X đều có ph¿n ứng với dung dịch NaOH và dung dịch Na2CO3.
- X đều không ph¿n ứng với dung dịch HCl và HNO3.
X là dung dịch nào sau đây? A. AgNO3. B. MgCl2. C. KOH. D. Ba(HCO3)2.
Câu 30. Hỗn hợp X gồm một số amino axit (chỉ có nhóm chức –COOH và –NH2, không có nhóm chức
khác). Trong hỗn hợp X, tỉ lá khối lượng của oxi và nitơ tương ứng là 192 : 77. Để tác dụng vừa đủ với
19,62 gam hỗn hợp X cần 220 ml dung dịch HCl 1M. Mặt khác đốt cháy hoàn toàn 19,62 gam hỗn hợp X
cần V lít O2 (đktc) thu được 27,28 gam CO2 (s¿n phẩm cháy gồm CO2, H2O, N2). Giá trị của V là A. 17,472. B. 16,464. C. 16,576. D. 16,686.
Câu 31. Cho vào 2 ống nghiám, mỗi ống nghiám 2 ml etyl axetat, sau đó thêm vào ống thứ nhÁt 1
ml dung dịch H2SO4 20% và ống thứ hai 1 ml dung dịch NaOH 30%. Sau đó lắc đều c¿ 2 ống
nghiám, lắp ống sinh hàn đồng thßi đun cách thuỷ trong kho¿ng 5 phút.
Hián tượng trong 2 ống nghiám là
A. ChÁt lỏng trong c¿ hai ống nghiám trá thành đống nhÁt.
B. ChÁt lỏng trong ống thứ hai trá thành đống nhÁt.
C. ChÁt lỏng trong ống thứ nhÁt trá thành đống nhÁt.
D. ChÁt lỏng trong c¿ hai ống nghiám có sự phân tách lớp.
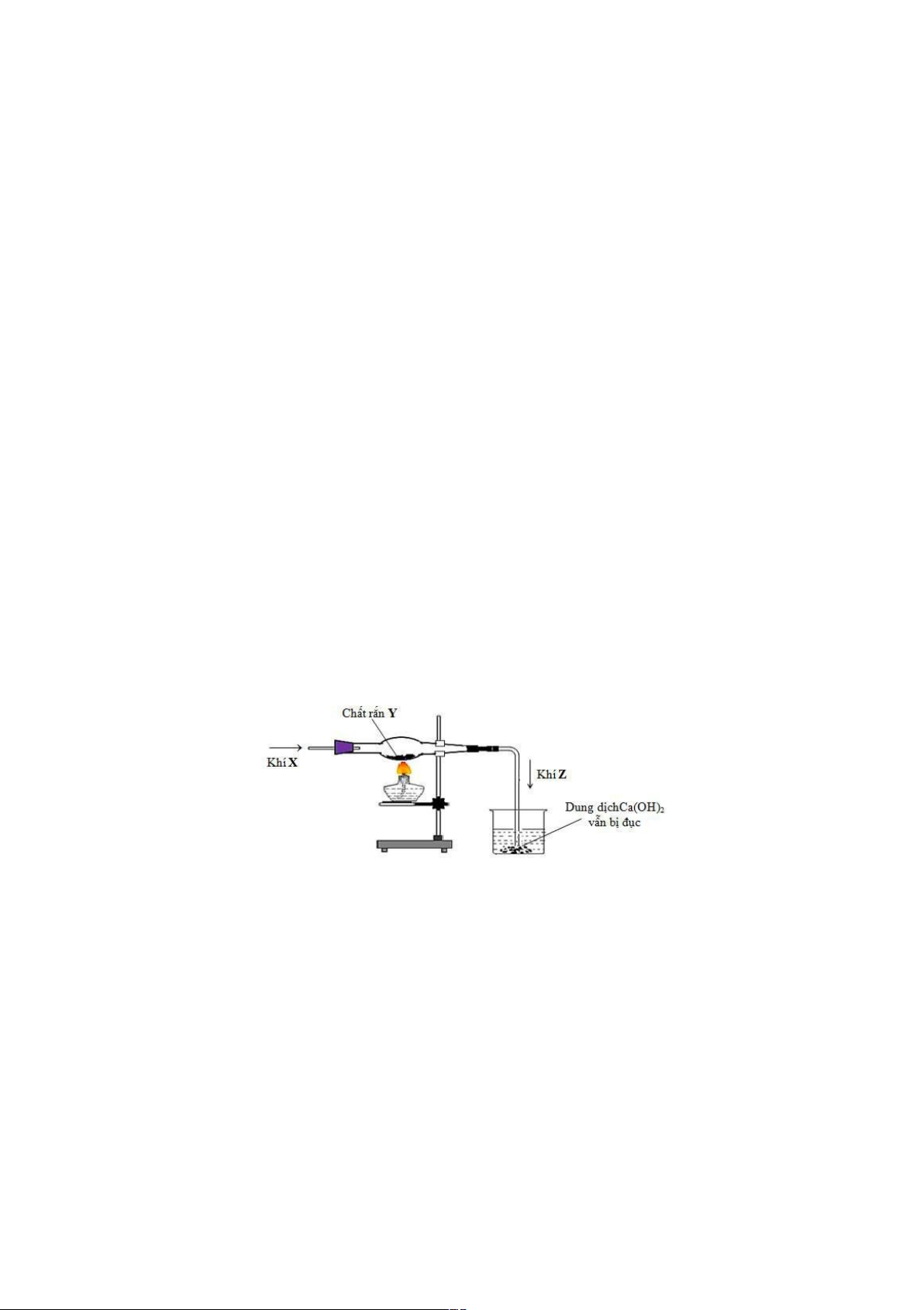
Câu 32. Hình vẽ sau đây mô t¿ thí nghiám khí X tác dụng với chÁt rắn Y, nung nóng sinh ra khí Z:
Cho các ph¿n ứng hoá học sau: o t t o
(1) CaSO3 + HCl ³ CaCl2 + SO2 + H2O (2) CuO + CO³ Cu + CO2 t o t o (3) C + Fe3O4 ³ Fe + CO2
(4) Fe2O3 + 3H2 ³ 2Fe + 3H2O
Số ph¿n ứng tho¿ mãn thí nghiám trên là A. 2. B. 3. C. 1. D. 4.
----------H¾T----------
GV: Th.S Lê Thị Mỹ Trang 12 lOMoARcPSD|45316467
C. LUYÞN T¾P (RÈN LUYÞN KĨ N NG = PHĀ Đ¾O KI¾N THĄC)
D¿ng 1 Cấu hình electron nguyên tử và vị trí trong bảng tuần hoàn
Bài 1: Viết cÁu hình electron nguyên tử, xác định vị trí trong b¿ng tuần hoàn của Na (z=11), Mg(z=12),
Al(z=13), Fe(z=26), Fe3+, Na+, Mg2+, Al3+...
Bài 2: Liên kết kim loại là gì? So sánh liên kết kim loại với liên kết cộng hóa trị và liên kêt ion?
Dạng 2 Rèn kỹ năng viết PTHH
Bài 1 Ngâm một lá niken trong những dung dịch muối sau: MgSO4, NaCl, CuSO4, AlCl3, ZnCl2, Pb(NO3)2,
AgNO3. Hãy cho biết muối nào có ph¿n ứng với Ni ? Gi¿i thích và viết phương trình hoá học.
Dạng 3 Sự ăn mòn kim loại và phương pháp bảo vệ kim loại
Bài 1. Để b¿o vá vỏ tầu biển bằng thép ngưßi ta thưßng gắn vào vỏ tàu (phần ngâm dưới nước)
những tÁm kim loại nào? Áp dụng phương pháp gì để b¿o vá vỏ tàu? Bài 2. Cho lá sắt kim loại vào :
a) Dung dịch H2SO4 loãng.
b) Dung dịch H2SO4 loãng có cho thêm vài giọt dung dịch CuSO4.
Nêu hián tượng x¿y ra, gi¿i thích và viết phương trình hoá học của các ph¿n ứng x¿y ra trong mỗi trưßng hợp.
Dạng 4. Điều chế kim loại
Bài 1 Bằng những phương pháp nào có thể điều chế được Ag từ dung dịch AgNO3, điều chế Mg từ
dung dịch MgCl2 ? Viết các phương trình hoá học.
Dạng 5 . Xác định tên kim loại
Bài 1. Cho 6,2g hỗn hợp 2 kim loại kiềm á 2 chu kì liên tiếp tác dụng hết với nước thÁy có 2,24 lít khí H2 (đktc) bay ra.
a, Khối lượng hiđroxit kim loại tạo ra trong dung dịch ?
b. Xác định tên hai kim loại kiềm trên?
Bài 2. Cho 1,38g kim loại X hóa trị I tác dụng hết với nước cho 2,24 lít H2 á đktc.Xác định
tên X ? Dạng 6. Bài tập định lượng
Bài 1 . Cho 10 gam hỗn hợp gồm Fe và Cu khi tác dụng với dung dịch H2SO4 loãng (dư). Sau ph¿n
ứng thu được 2,24 lit khí H2 (đktc), dung dịch X và m gam chÁt rắn không tan. Tính giá trị của m ?
Bài 2. Cho 12,2 g hỗn hợp 2 muối cacbonat của kim loại kiềm á 2 chu kì liên tiếp tác dụng hết với dung
dịch HCl, thu được 2,24lít khí (đktc). Tính khối lượng muối tạo ra sau ph¿n ứng ? (p2 ĐLBTKL)
Bài 3 . Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4%. Khi lÁy vật
ra khỏi dung dịch thì lượng AgNO3 trong dd gi¿m 17%. Tính khối lượng của vật sau ph¿n ứng ?
Bài 4. Ngâm một lá Zn trong 100 ml dd AgNO3 0,1M khi ph¿n ứng kết thúc khối lượng lá Zn t ng
hay gi¿m bao nhiêu gam? (p2 t ng, gi¿m khối lượng)
GV: Th.S Lê Thị Mỹ Trang 13 OMoARcPSD|45316467
GV: Th.S Lê Thị Mỹ Trang 14



