














Preview text:
c
ĐẠI CƯƠNG VỀ KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
A. TÓM TẮT LÝ THUYẾT
I. ĐƠN CHẤT KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
1. Đặc điểm cấu tạo nguyên tử
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất gồm các
nguyên tố có số hiệu nguyên tử từ 21 (Sc) đến 29 (Cu), thuộc chu kì 4.
Bảng 1: Một số đặc điểm nguyên tử của nguyên tố kim loại chuyển tiếp dãy thứ nhất Sô hiệu Nguyên tử
Cấu hình electron nguyên tử Độ âm điện (theo Pauling) 21 Scandium (Sc) ls22s22p63s23p63d14s2 1,36 22 Titanium (Ti) ls22s22p63s23p63d24s2 1,54 23 Vanadium (V) ls22s22p63s23p63d34s2 1,63 24 Chromium (Cr) ls22s22p63s23p63d54s1 1,66 25 Manganese (Mn) ls22s22p63s23p63d54s2 1,55 26 Sắt (Fe) ls22s22p63s23p63d64s2 1,83 27 Cobalt (Co) ls22s22p63s23p63d74s2 1,88 28 Nickel (Ni) ls22s22p63s23p63d84s2 1,91 29 Đồng (Cu) ls22s22p63s23p63d104s1 1,90
Đặc điểm cấu hình electron trong nguyên tử của các kim loại chuyển tiếp dãy thứ
nhất đều có lớp vỏ bên trong của khí hiếm Ar.
Số electron trên phân lớp 3d tăng dần từ 1 (ở Sc) đến 10 (ở Cu). c
Trong khi đó trên phân lớp 4s, số electron thường bằng 2 (trừ Cr và Cu).
Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hoá trị thuộc
phân lớp 3d và 4s nên kim loại chuyển tiếp dây thứ nhất thường tạo thành các hợp chất
với nhiều số oxi hoá khác nhau. Chú ý:
+ Kim loại chuyển tiếp gồm toàn bộ các nguyên tố họ d và họ f, đều thuộc nhóm B trong bảng tuần hoàn
+ Nguyên tố họ d gồm 4 dãy: dãy 3d (chu kì 4), dãy 4d (chu kì 5), dãy 5d (chu kì 6) và
dãy 6d (chu kì 7). Nguyên tố họ f gồm 2 dãy: dãy 4f (họ lanthanides, chu kì 6) và dãy 5f (họ actinides, chu kì 7).
2. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp
Một số thông số vật lí của kim loại chuyển tiếp dãy thứ nhất được trình bày ở Bảng 27.2.
Bảng 2. Một số thông số vật lí của kim loại chuyển tiếp dãy thứ nhất Kim loại Sc Ti V Cr Mn Fe Co Ni Cu Nhiệt độ nóng chảy (°C)
1541 1668 1917 1907 1244 1535 1494 1453 1084 Khối lượng riêng
2,98 4,50 6,11 7,15 7,21 7,86 8,90 8,91 8,96 (g/cm3) Độ dẫn điện ở 20 °C 1,7 2,3 4,9 7,7 0,7 10 15,4 13,8 57,1 (Hg = 1) Độ dẫn nhiệt ở 25 °C (Hg = 1) 1,9 2,6 3,7 11,3 0,9 9,7 12,0 11,0 48,3 Độ cứng (kim cương = 10) - 6 7 8,5 6 4 5 4 3
(Số liệu được lấy từ SGK/tr130. Hóa 12 Kết nối tri thức)
Các kim loại chuyển tiếp thường có khối lượng riêng lớn, cứng và khó nóng chảy.
Một số tính chất vật lí và ứng dụng của các kim loại chuyển tiếp dãy thứ nhất được c trình bày ở dưới đây
Bảng 3. Tính chất vật lí và ứng dụng của các kim loại chuyển tiếp dãy thứ nhất Tính chất Đặc điểm Ứng dụng
Khó nóng chảy, đặc biệt là Nhiệt độ nóng
Chế tạo dụng cụ, máy móc, thiết vanadium, chromium và chảy
bị làm việc ở nhiệt độ cao. cobalt.
Khá cao, chromium là kim loại Chế tạo vật liệu hàng không, gọng Độ cứng
cứng nhất trong tất cả các kim
kính. Sản xuất phương tiện giao loại.
thông, máy móc, bệ máy,. . Scandium và titanium tương Khối lượng
đối nhẹ. Các kim loại khác đều Chế tạo dây dẫn, thiết bị điện,. . riêng là kim loại nặng.
Tương đối tốt, đồng là kim loại Độ dẫn điện
Chế tạo dây dẫn, thiết bị điện
dẫn điện tốt (chỉ sau bạc).
(Số liệu được lấy từ SGK/tr131. Hóa 12 Kết nối tri thức)
II. HỢP CHẤT CỦA KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
1. Số oxi hoá và màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Do có nhiều electron hoá trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy
thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hoá khác nhau.
Bảng 4: Các số oxi hoá phổ biến của một số nguyên tố kim loại chuyển tiếp dãy thứ nhất Nguyên tố
Số oxi hoá phổ biến Chromium (Cr) +3, +6 Manganese (Mn) +2, +4, +7 Sắt (Fe) +2, +3 Đồng (Cu) +2 c
Khi tham gia phản ứng hoá học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên
nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng. Ví dụ: Fe Fe2+ + 2e [Ar]3d64s2 [Ar]3d6 Fe Fe3+ + 2e [Ar]3d64s2 [Ar]3d5
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú
Màu sắc của một số ion kim loại chuyển tiếp dãy thứ nhất trong dung dịch
3. Chuẩn độ iron(II) sulfate bằng thuốc tím
Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương
pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric acid theo phương trình hoá học:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
*Nhận biết ion Cu2+ bằng dung dịch kiềm: Cho vào ống nghiệm khoảng 1 mL dung
dịch CuSO4. Nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm.
- Hiện tượng: Xuất hiện kết tủa xanh là Cu(OH)2.
- Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
*Nhận biết ton Fe3+ bằng dung dịch kiềm: Cho vào ống nghiệm khoảng 1 mL dung
dịch FeCl3. Nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm. c
- Hiện tượng: Xuất hiện kết tủa nâu đỏ là Fe(OH)3.
- Phương trình hoá học: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
4. Nhận biết một số ion kim loại chuyển tiếp
Trong hoá học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc
trưng của ion, của hợp chất ít tan hoặc của phức chất tương ứng.
B. CÂU HỎI LUYỆN TẬP
PHẦN I. CÂU HỎI TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN. Mỗi câu
thí sinh chọn một phương án. 1. Mức độ nhận biết
Câu 1. Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất? A. Ti. B. Rb. C. Ca. D. K.
Câu 2. Dãy kim loại nào sau đây thuộc loại kim loại chuyển tiếp thứ nhất? A. Co, V, Na. B. Fe, Sc, Al. C. Cr, Mn, Ni. D. Cu, Mg, Ag.
Câu 3. Các nguyên tố kim loại chuyển tiếp không cùng dãy thứ nhất là A. Sc, Ni, Ti. B. Fe, Mn, Co. C. Cr, Cu, V. D. Ni, Cu, Ag.
Câu 4. Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp là.
A. [Ne]3d1 10 4s1 2. B. [Ar]3d1 10 4s2.
C. [Ar]3d1 10 4s1 2. D. [Ar]3d1 10 4s1.
Câu 5. Cấu hình electron nào sau đây là của kim loại chuyển tiếp dãy thứ nhất?
A. [Ar]3d104s24p1. B. [Ar]3d64s2. C. [Ar]4s2. D. [Ar]3d104s24p6
Câu 6. Cấu hình electron của nguyên tử nguyên tố chromium (Z = 24) là c A. [Ar]3d44s2. B. [Ar] 4d55s1. C. [Ar]3d54s1. D. [Kr]3d54s1
Câu 7. Cấu hình electron của nguyên tử nguyên tố copper (Z = 29) là A. [Ar]3d104s1. B. [Ar]3d94s2. C. [Ne]3d94s2. D. [Kr]3d104s1
Câu 8. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố chuyển tiếp dãy thứ nhất được xếp ở A. chu kì 3. B. chu kì 4. C. chu kì 5.
D. chu kì 3 và chu kì 4.
Câu 9. Kim loại chuyên tiêu này thứ nhất thuộc khối nguyên tố nào sau đây ? A. Nguyên tố s.
B. Nguyên tố p. C. Nguyên tố d. D. Nguyên tố f.
Câu 10. Kim loại chuyển tiểu dãy thứ nhất có chứa phân lớp nào sau đây? A. 4d. B. 4f. C. 4p. D. 3d.
Câu 11. Sự hình thành các nguyên tố chuyển tiếp dãy thứ nhất là do có sự sắp xếp lần
lượt các electron vào phân lớp? A. 3d. B. 4s. C. 4p. D. 3p.
Câu 12. Cấu hình electron của nguyên tử vanadium ở trạng thái cơ bản là [Ar]3d34s2.
Trong bảng tuần hoàn, nguyên tố vanadium thuộc nhóm A. VB. B. IB. C. VIB. D. IIB.
Câu 13. Trong bảng tuần hoàn, nguyên tố nickel (Z = 28) thuộc
A. chu kì 4, nhóm IIA.
B. chu kì 3, nhóm IIB.
C. chu kì 4, nhóm VIIIB.
D. chu kì 3, nhóm VIIIA.
Câu 14. Cấu hình electron của nguyên tử copper ở trạng thái cơ bản là [Ar]3d104s1.
Trong bảng tuần hoàn, nguyên tố copper thuộc A. chu kì 4, nhóm IA. B. chu kì 4, nhóm IB.
C. chu kì 4, nhóm IIB.
D. chu kì 4, nhóm IIA.
Câu 15. Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hòa? A. Sc (Z = 21). B. Cu (Z = 29). C. Ni (Z = 28). D. Mn (Z = 25). c
Câu 16. Sắt là kim loại phổ biến thứ hai (sau nhôm) trên vỏ Trái Đất do nguyên tử sắt
thuộc loại nguyên tử bền. Số neutron có trong một nguyên tử A. 30. B. 26. C. 56 D. 28.
Câu 17. Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
A. phân lớp 3d và phân lớp 4s. B. phân lớp 3d. C. lớp 4s.
D. phân lớp 3p và phân lớp 3d.
Câu 18. Nguyên tử chronium (Cr) có cấu hình electron là 1s22s22p63s23p63d54s1. Số
electron độc thân trong nguyên từ Cr là A. 7. B. 5. C. 6. D. 4.
Câu 19. Nguyên tử Ti có cấu hình electron là [Ar] 3d24s2. Số electron hóa trị trong nguyên từ Ti là A. 3. B. 2. C. 1. D. 4
Câu 20. Nguyên tử manganese có số oxi hóa +4 trong hợp chất nào sau đây? A. KMnO4. B. K2MnO4. C. MnO2. D. MnSO4.
Câu 21. Trong hợp chất K2Cr2O7, số oxi hóa của nguyên tử Cr là A. +6. B. +3. C. +2. D. 0.
Câu 22. Crom có số oxi hóa +3 trong hợp chất nào sau đây? A. CrO3. B. Na2CrO4. C. Cr(OH)2. D. Cr2O3.
Câu 23. Nguyên tử iron (Fe) có số oxi hóa là +2 trong hợp chất nào sau đây? A. Fe(OH)3. B. FeCl3. C. FeO. D. Fe2O3.
Câu 24. Nguyên tử (Fe) có số oxi hóa là +3 trong hợp chất nào sau đây? A. Fe(OH)2. B. FeCl2. C. FeO. D. Fe2O3.
Câu 25. Các số oxi hóa đặc trưng của chrominium trong các hợp chất là A. +2, +3, +5. B. +3, +4, +6. C. +2, +3, +7. D. +2, +3, +6.
Câu 26. Trạng thái oxi hoá phổ biến của Fe và Mn tương ứng là
A. +2, +3 và +2, +4, +7.
B. +2, +3 và +2, +4, +6.
C. +2, +3 và +2, +6, +7.
D. +2, +6 và +2, +4, +7. c
Câu 27. Nguyên tố nào sau đây không thể hiện xu hướng có nhiều số oxi hóa trong hợp chất? A. Cr. B. Mn. C. Fe. D. Mg.
Câu 28. Từ cấu hình electron của nguyên tử Cu ở trạng thái cơ bản là [Ar]3d104s1, xác
định được cấu hình electron của ion Cu2+ là A. [Ar]3d9. B. [Ar]3d84s1. C. [Ar]3d10. D. [Ar]3d8.
Câu 29. Nguyên tử iron có số hiệu nguyên tử là 26. Cấu hình electron của Fe2+ là
A. 1s22s22p63s23p63d64s2. B. 1s22s22p63s23p63d6.
C. 1s22s22p63s23p64s23d6.
D. 1s22s22p63s23p63d44s2.
Câu 30. Cấu hình electron của Mn2+ là
A. 1s22s22p63s23p63d74s2. B. 1s22s22p63s23p63d5.
C. 1s22s22p63s23p64s23d3.
D. 1s22s22p63s23p63d44s1.
Câu 31. Cấu hình electron của Cu2+ là A. [Ar]3d94s2. B. [Ar]3d104s1. C. [Ar]3d84s1. D. [Ar]3d9.
Câu 32. Cấu hình electron của các ion Cr3+, Co3+, Fe3+ lần lượt là (cho (ZCr = 24, ZCo = 27, ZFe = 26)
A. [Ar]3d3, [Ar]3d6, [Ar]3d5.
B. [Ar]3d3, [Ar]3d5, [Ar]3d6.
C. [Ar]3d5, [Ar]3d6, [Ar]3d3.
D. [Ar]3d3, [Ar]3d7, [Ar]3d5.
Câu 33. Ở trạng thái cơ bản, cấu hình electron của Mn (Z = 25) là [Ar]3d54s2. Số oxi hoá
cao nhất của Mn trong các hợp chất là A. +5. B. +7. C. +2. D. +6.
Câu 34. Nguyên tử Cr có cấu hình electron ở trạng thái cơ bản là [Ar]3d54s1. Trong
phản ứng hóa học, khi nguyên tử Cr nhường đi 3 electron để tạo thành ion Cr3+, số
electron còn lại trên phân lớp 3d là A. 5. B. 4. C. 3. D. 2. c
Câu 35. Cho phát biểu "Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất
mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có. .(1). .
và nguyên tử của chúng có. .(2) " Cụm từ cần điền vào (1) và (2) lần lượt là:
A. độ âm điện bé, nhiều electron hoá trị.
B. độ âm điện lớn, nhiều electron hoá trị.
C. điện tích hạt nhân lớn, bán kính bé.
D. bán kính bé, điện tích hạt nhân lớn.
Câu 36. Phát biểu nào sau đây không đúng?
A. Các nguyên tố kim loại chuyển tiếp dãy thứ nhất thuộc khối d.
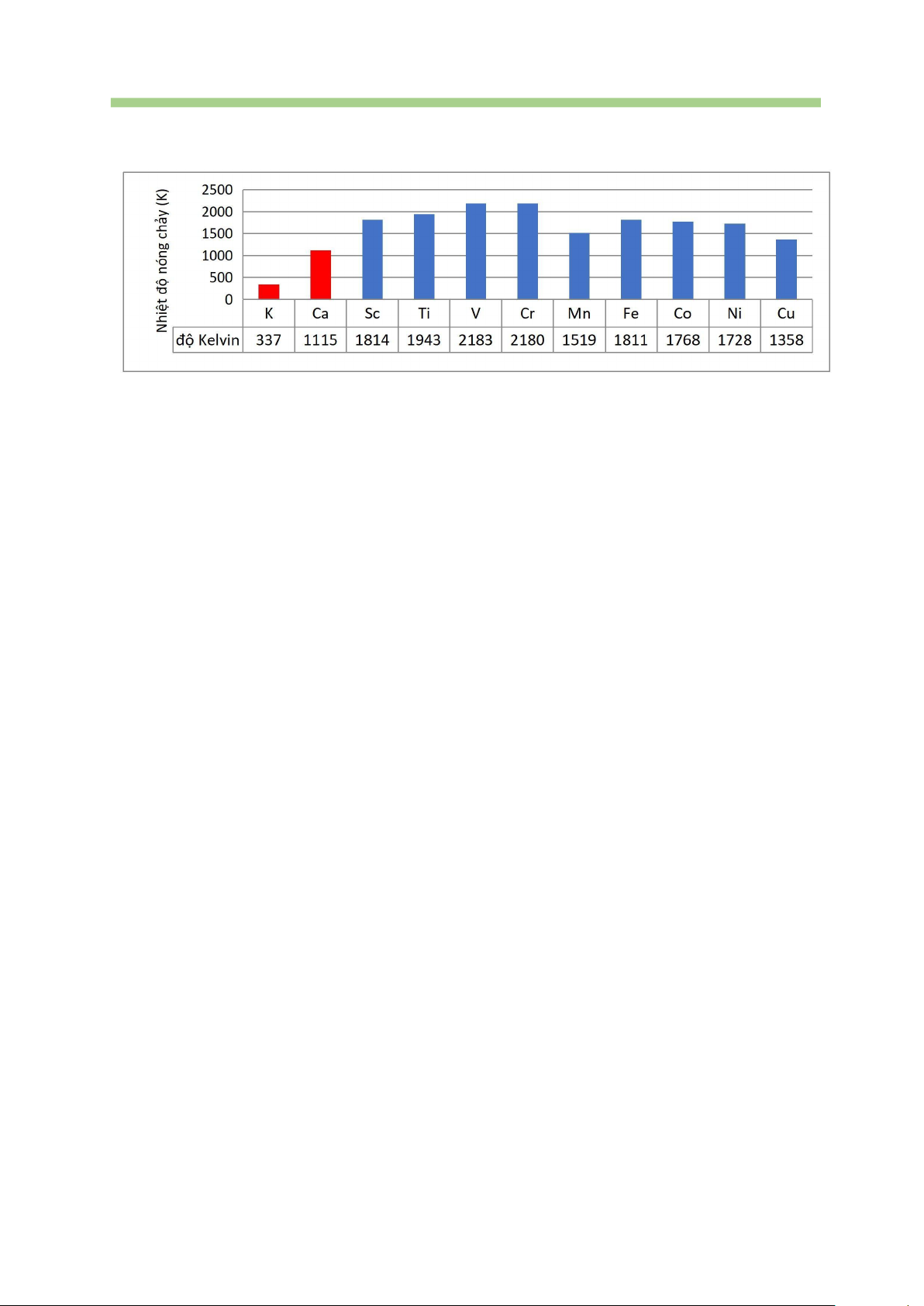
B. Zn (Z = 29) là nguyên tử kim loại chuyển tiếp dãy thứ nhất có phân lớp 3d đã điền đầy electron.
C. Nguyên tử các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar.
D. Kim loại chuyển tiếp dãy thứ nhất thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau.
Câu 37. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là A. Ti. B. Fe. C. Cr. D. Cu.
Câu 38. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là A. Fe. B. Ti. C. Cu. D. Mn.
Câu 39. Ở khoảng 20°C đến 25 °C, đơn chất có độ dẫn điện cao nhất là A. V. B. Cr. C. Co. D. Cu.
Câu 40. Kim loại được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ
(dùng làm thìa, dao, dụng cụ y tế,…) là A. Na. B. Mg. C. Cr. D. Ca.
Câu 41. Sắt được sử dụng để sản xuất nam châm trong các máy phát điện và nhiều thiết
bị (loa, chuông, tivi, máy tính, điện thoại,…) dựa trên tính chất nào sau đây?
A. Tính dẫn điện. B. Tính dẫn nhiệt. C. Tính dẻo. D. Tính nhiễm từ.
Câu 42. Đồng kim loại được sử dụng để chế tạo dây dẫn điện, thiết bị điện,. dựa trên c
tính chất vật lí đặc trưng nào sau đây? A. Dẫn điện tốt. B. Tính dẻo. C. Dẫn nhiệt tốt. D. Ánh kim.
Câu 43. Nguyên tố kim loại có trong hemoglobin làm nhiệm vụ vận chuyển oxygen, duy trì sự sống là A. sodium. B. magnesium. C. nhôm D. sắt.
Câu 44. Dãy kim loại nào sau đây sắp xếp theo thứ tự tăng dần nhiệt độ nóng chảy? A. Na, Fe, Mg. B. Na, Mg, Fe. C. Fe, Mg, Na. D. Mg, Fe, Na.
Câu 45. Dãy các đơn chất có nhiệt độ nóng chảy giảm dần từ trái sang phải là A. Fe, Cr, Co. B. V, Sc, Ti. C. Cr, Fe, Ni. D. Cu, Mn, Ni.
Câu 46. Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào? A. Tăng dần. B. Không đổi. C. Giảm dần.
D. Không có quy luật.
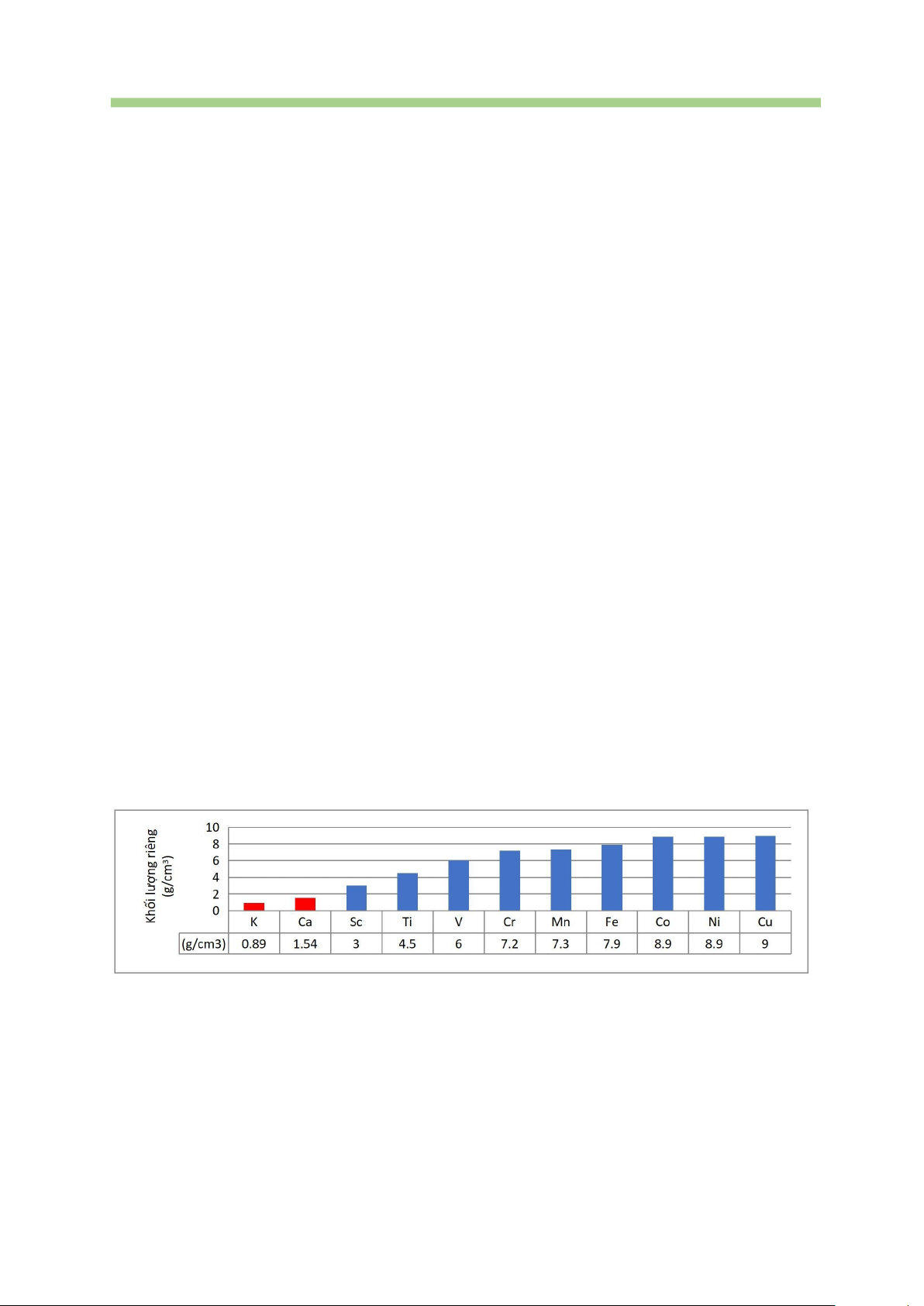
Câu 47. Ở điều kiện thường, dãy các đơn chất kim loại có khối lượng riêng tăng dần từ trái sang phải là A. Sc, Ti, Co, Ni. B. V, Cr, Mn, Fe. C. Sc, Ti, Co, Cu. D. Sc, Ti, Ni, Cu.
Câu 48. Đồ thị khối lượng riêng của các nguyên tố kim loại chu kì 4 (từ nhóm IA đến IB):
Hãy cho biết nhận định nào sau đây là đúng?
A. Kim loại họ s có khối lượng riêng gần bằng kim loại chuyển tiếp.
B. Kim loại họ s có khối lượng riêng lớn hơn kim loại chuyển tiếp.
C. Kim loại họ s có khối lượng riêng bé hơn kim loại chuyển tiếp.
D. Khối lượng riêng tăng dần theo chiều tăng của bán kính nguyên tử. c
Câu 49. Đồ thị nhiệt độ nóng chảy của các nguyên tố kim loại chu kì 4 (từ nhóm IA đến IB):
Hãy cho biết nhận định nào sau đây là đúng?
A. Nhiệt độ nóng chảy của nguyên tố họ s gần bằng kim kim loại chuyển tiếp.
B. Nhiệt độ nóng chảy của nguyên tố họ s cao hơn kim kim loại chuyển tiếp.
C. Nhiệt độ nóng chảy của nguyên tố họ s thấp hơn kim kim loại chuyển tiếp.
D. Nhiệt độ nóng chảy tăng dần theo chiều tăng của điện tích hạt nhân.
Câu 50. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại nào sau đây đều là kim loại nhẹ? A. Cr, Mn. B. Fe, Co. C. Sc, Ti. D. Ni, Cu.
Câu 51. Phát biểu nào sau đây đúng?
A. Cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất đều có phân lớp 3d chưa bão hòa.
B. Tất cả các nguyên tố chuyển tiếp dãy thứ nhất đều là kim loại.
C. Tất cả các nguyên tố thuộc nhóm B, chu kì 4 đều là nguyên tố chuyển tiếp dãy thứ nhất.
D. Tất cả các kim loại chuyển tiếp dãy thứ nhất đều là kim loại nặng.
Câu 52. Nhận xét nào sau đây là đúng?
A. Sắt thuộc nhóm kim loại nặng và có nhiệt độ nóng chảy cao nhất trong dãy
kim loại chuyển tiếp thứ nhất.
B. Trong số các kim loại chuyển tiếp dãy thứ nhất, chromium có nhiệt độ nóng chảy cao nhất.
C. Chromium có độ cứng cao nên được dùng mạ lên các thiết bị để chống mài mòn.
D. Các đơn chất kim loại có khối lượng riêng lớn sẽ có độ cứng cao.
Câu 53. Muối nào sau đây có khả năng làm mất màu thuốc tím trong môi trường sulfuric acid loãng? A. Na2SO4. B. FeSO4. C. MgSO4. D. Fe2(SO4)3.
Câu 54. Trong dung dịch, potassium manganate (K2MnO4) màu lục bị phân huỷ tạo
thành MnO2 (chất rắn, màu nâu) và dung dịch có màu tím. Chất có màu tím là A. KMnO4. B. K3MnO4. C. Mn2O7. D. HMnO4.
Câu 55. Trong phép chuẩn độ dung dịch Fe2+ bằng MnO –4, bình tam giác đựng dung
dịch Fe2+ thường được đi trên 1 tờ giấy trắng. Mục đích của việc này là gì? c
A. Để phản ứng trong bình tam giác xảy ra nhanh hơn.
B. Để quan sát sự thay đổi màu dung dịch trong bình tam giác được rõ hơn.
C. Để nhận biết được sự thay đổi thể tích dung dịch burette được rõ hơn
D. Để nhận biết được sự xuất hiện màu của ion Fe3+ trong bình tam giác rõ hơn.
Câu 56. Trong thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím,
nhận xét nào sau đây là không đúng?
A. lon Fe2+ là chất bị oxi hóa.
B. H2SO4 là chất tạo môi trường phản ứng.
C. lon MnO4- là chất bị khử.
D. Dung dịch muối Fe(II) có màu vàng nhạt.
Câu 57. Nguyên tố nào sau đây được mệnh danh là “nguyên tố của màu sắc” do
có khả năng thể hiện màu sắc phong phú? A. Sắt. B. Đồng. C. Nickel. D. Chromium.
Câu 58. Trong dung dịch muối sulfate, ion kim loại nào sau đây có màu xanh? A. Mn2+. B. Fe3+. C. Ti3+. D. Cu2+.
Câu 59. Dung dịch muối Fe2(SO4)3 có màu A. vàng nâu. B. xanh. C. tím. D. đỏ.
Câu 60. Dung dịch muối chứa Cu2+(aq) có màu A. vàng. B. xanh. C. tím. D. đỏ.
Câu 61. Dung dịch muối chứa Co2+(aq) có màu A. vàng. B. xanh. C. tím D. hồng.
Câu 62. Dung dịch muối K2Cr2O7 có màu A. vàng chanh. B. da cam. C. tím. D. hồng
Câu 63. Dung dịch muối nào sau đây có màu vàng chanh? A. CuSO4. B. FeCl3. C. KMnO4. D. FeSO4.
Câu 64. Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước? A. Mn2+. B. Sc3+. C. Ti3+. D. Cr3+.
Câu 65. Cho khoảng 2mL dung dịch NaOH vào ống nghiệm chứa khoảng 1mL dung
dịch Fe2(SO4)3. Hiện tượng quan sát được là
A. dung dịch chuyển sang màu xanh.
B. xuất hiện kết tủa màu vàng.
C. xuất hiện kết tủa màu nâu đỏ.
D. dung dịch chuyển sang màu nâu đỏ.
Câu 66. Cho khoảng 2mL dung dịch NaOH vào ống nghiệm chứa 1mL dung dịch
CuSO4. Hiện tượng quan sát được là
A. dung dịch chuyển sang màu vàng.
B. xuất hiện kết tủa màu xanh nhạt.
C. xuất hiện kết tủa màu nâu đỏ.
D. dung dịch chuyển sang màu nâu đỏ.
Câu 67. Cho dung dịch FeCl2 vào dung dịch chất X, thu được kết tủa Fe(OH)2. Chất X c là A. H2S. B. AgNO3. C. NaOH. D. NaCl.
Câu 68. Các hợp chất ứng với số oxi hóa cao nhất của Cr có tính oxi hóa mạnh. Giá trị
thế điện cực chuẩn nào sau đây thuộc về cặp Cr2O72-, H+/Cr3+ A. -0.44V. B. -2,93V. C. 0V. D. +1,36V.
Câu 69. Kim loại nào sau đây thể hiện hai hóa trị khi tác dụng với dung dịch HCl và khí Cl2 (toC) A. Nhôm. B. Sắt. C. Đồng. D. Magnesium.
Câu 70. Ion nào sau đây vừa có khả năng thể hiện tính khử, vừa có khả năng thể hiện tính oxi hóa? A. Cr3+. B. CrO2-. C. AlO -2. D. Sc3+.
Câu 71. Hợp chất iron (III) có khả năng thể hiện tính oxi hóa khi tác dụng với chất khử.
Quá trình khử ion Fe3+ được biểu diễn là A. Fe3+ + 1e → Fe2+. B. Fe2+→ Fe3+ + 1e. C. Fe2+ + 2e → Fe. D. Fe → Fe2+ + 1e.
Câu 72. Trong không khí ẩm, gang và thép bị ăn mòn điện hóa. Trong quá trình ăn mòn,
sắt bị oxi hóa ở anode tạo thành ion Fe2+ theo quá trình A. Fe2+ + 2e → Fe. B. Fe → Fe2+ + 1e. C. Fe3+ + 1e → Fe2+ . D. Fe2+→ Fe3+ + 1e.
2. Mức độ thông hiểu
Câu 73. Trong các số oxi hoá của các kim loại chuyển tiếp dãy thứ nhất, trạng thái
thường gặp nhất là +2. Điều này được giải thích là do đa số các kim loại chuyển tiếp dãy
thứ nhất có độ âm điện không cao và
A. dễ nhường đi 2 electron ở phân lớp 3d.
B. dễ nhường đi 1 electron ở phân lớp 3d và 1 electron ở phần lớp 4s.
C. có khả năng nhận thêm 2 electron vào phân lớp 3d.
D. có 2 electron lớp ngoài cũng.
Câu 74. Cho các tinh chất vật lí sau:
(a) dẫn điện và dẫn nhiệt kém.
(b) thường có khối lượng riêng lớn. (c) độ cứng cao.
(d) nhiệt độ nóng chảy cao. Những tinh chất vật lí thường gặp với các kim loại chuyển tiếp là A. (a), (b), (c). B. (a), (c), (d). C. (a), (b), (d). D. (b), (c), (d).
Câu 75. Phát biểu nào sau đây đúng?
A. Các kim loại chuyển tiếp dãy thứ nhất đều có nhiệt độ nóng chảy cao hơn các
kim loại nhóm IA và nhóm IIA.
B. Các kim loại chuyển tiếp dãy thứ nhất có xu hướng thể hiện nhiều trạng thái oxi hóa.
C. Tất cả hợp chất của kim loại chuyển tiếp dãy thứ nhất đều có màu. c
D. Cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất đều có phân lớp 4s đã bão hòa.
Câu 76. Phát biểu nào sau đây không đúng?
A. Tất cả các nguyên tố thuộc nhóm B đều là nguyên tố chuyển tiếp dãy thứ nhất.
B. Các nguyên tố chuyển tiếp dãy thứ nhất thường có nhiệt độ nóng chảy cao
hơn các kim loại nhóm IA và IIA.
C. Số oxi hóa của nguyên tử nguyên tố chromium trong hợp chất K2CrO4 và K2Cr2O7 bằng nhau.
D. Trạng thái oxi hóa thường gặp của Mn là +2, +4,+ 7.
Câu 77. Khi so sánh kim loại Fe với Ca, nhận định nào sau đây không đúng?
A. Kim loại Fe có khối lượng riêng lớn hơn.
B. Kim loại Fe có độ cứng cao hơn.
C. Kim loại Fe có tính khử mạnh hơn.
D. Kim loại Fe có nhiệt độ nóng chảy cao hơn.
Câu 78. Khi so sánh nguyên tử Ti với K, nhận định nào sau đây không đúng?
A. Ti có bán kính lớn hơn.
B. Ti có số elctron hóa trị nhiều hơn.
C. Ti có số electron độc thân nhiều hơn. D. Ti có độ âm điện lớn hơn.
Câu 79. Nguyên tử Mn có cấu hình electron là [Ar] 3d54s2.
a) Mn là kim loại chuyển tiếp dãy thứ nhất.
b) Số oxi hoá cao nhất có thể có của Mn là +6.
c) Mn thuộc nhóm VB trong bàng tuần hoàn.
d) Ion Mn2+ có 5 electron độc thân ở lớp ngoài cùng. Số phát biểu đúng về Mn là A. 2. B. 1. C. 3. D. 4
Câu 80. M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
- Có nhiều số oxi hóa trong các hợp chất, trong đó có số oxi hóa +2 và +3.
- Nguyên tử có 4 electron độc thân.
- Ở dạng đơn chất, là kim loại nặng. M là nguyên tố nào sau đây? A. Cr. B. Ni. C. Fe. D. Cu.
Câu 81. Muối nào sau đây vừa có khả năng thể hiện tính khử (trong môi
trường kiềm), vừa có khả năng thể hiện tính oxi hóa (trong môi trường acid)? A. K2Cr2O7. B. K2CrO4. C. Na2CrO4. D. Cr2(SO4)3.
Câu 82. Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng
phương pháp chuẩn độ theo phương trình hóa học sau:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Phát biểu nào sau đây không đúng?
A. H2SO4 đóng vai trò là môi trường cho phản ứng.
B. Phương pháp chuẩn độ như trên được xếp vào nhóm phương pháp chuẩn độ oxi hóa- khử.
C. FeSO4 là chất bị khử, KMnO4 là chất bị oxi hóa. c
D. Dung dịch thuốc tím KMnO4 sau phản ứng bị mất màu tím.
Câu 83. Một học sinh tiến hành chuẩn độ dung dịch Fe2+ bằng dung dịch KMnO4 theo hai cách sau:
Cách 1: Nhỏ từ từ dung dịch KMnO4 vào dung dịch chứa Fe2+ trong môi
trường acid cho đến khi xuất hiện màu hồng nhạt bền trong khoảng 30 giây.
Cách 2: Nhỏ từ từ dung dịch chứa Fe2+ trong môi trường acid vào dung dịch
KMnO4 cho đến khi màu hồng của dung dịch KMnO4 biến mất. Hãy cho biết
cách tiến hành chuẩn độ nào là phù hợp? A. Cách 1. B. Cách 2. C. Cả hai cách.
D. Không có cách nào.
Câu 84. Chuẩn độ dung dịch Fe2+ trong môi trường acid bằng dung dịch KMnO4. Kết
quả sẽ không phù hợp nếu nồng độ dung dịch Fe2+ khá lớn ( > 0,500M). Điều này là do
A. tiêu tốn một lượng dung dịch KMnO4 quá lớn.
B. tại điểm trong dương, dung dịch có màu vàng đậm.
C. Fe2+ dễ bị oxi hoá bởi oxygen của không khi
D. Fe2+ sẽ bị oxi hoá tiếp bởi KMnO4.
Câu 85. Mn2O7 là acidic acid. Khi cho Mn2O7 vào dung dịch NaOH dư, thu
được H2O và sản phẩm nào sau đây? Biểu rằng phản ứng không có sự thay đổi số oxi hoá. A. HMnO4. B. H2MnO4. C. NaMnO4. D. Na2MnO4.
Câu 86. Cho Fe2O3 vào dung dịch HCl dư, thu được dung dịch X. Thêm tiếp dung dịch
NaOH vào X, thu được kết tủa Y. Công thức của Y là A. Fe(OH)3. B. FeCl2. C. FeCl3. D. Fe(OH)2.
Câu 87. Cho dung dịch NaOH dư vào dung dịch gồm Fe(NO3)2 và Fe(NO3)3, thu được
kết tủa X. Cho X tác dụng với lượng dư dung dịch H2SO4 (đặc, nóng), thu được dung dịch chứa muối
A. Fe2(SO4)3 và Na2SO4. B. FeSO4 và Na2SO4. C. FeSO4. D. Fe2(SO4)3.
Câu 88. Có thể loại bỏ sắt trong nước ngầm bằng cách đưa nước ngầm lên các bể lắng,
lọc và sục không khi vào. Khi đó Fe2+ trong nước ngầm bị chuyển thành Fe(OH)3 và
lắng xuống. Chất oxi hóa Fe2+, thành Fe(OH)3 là A. khí O2. B. khí N2. C. nước và khi O2. D. khí O2 và OH-.
Câu 89. Dung dịch chứa muối iron (II) trong môi trường acid khi để ngoài không khi bị
chuyển từ màu xanh nhạt sang màu vàng nâu. Điều này được giải thích là do
A. phân huỷ một phần tạo thành Fe và Iron(III).
B. oxygen trong không khi oxi hoá thành hợp chất có màu vàng nâu.
C. oxygen trong không khí oxi hoá thành iron III) oxide.
D. oxygen trong không khí oxi hoá thành iron(III) hydroxide.
Câu 90. Dung dịch muối chromium(III) sulfate có lẫn copper(II) sulfate, sử dụng dung
dịch nào sau đây có thể loại bỏ nguyên tố copper ra khỏi muối chromium(lll) sulfate? A. Dung dịch ammonia. B. Dung dịch xút. c
C. Dung dịch barium chloride. D. Dung dịch soda.
Câu 91. Hòa tan Fe3O4 vào dung dịch H2SO4 (loãng, dư), thu được dung dịch X.
Cho dãy các chất: KMnO4, Cl2, Cu, KNO3. Số chất trong dãy tác dụng được với X là A. 3. B. 4. C. 1. D. 2.
Câu 92. Trong phòng thí nghiệm, nồng độ iron (II) sulfate có thể được xác định bằng
phương pháp chuẩn độ theo phương trình hóa học sau:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Chuẩn độ 10 mL dung dịch FeSO4 0,1M cần V mL dung dịch KMnO4 0,02M. Giá trị của V là A. 20. B. 15. C. 1. D. 10.
Câu 93. Chuẩn độ 10,00 mL dung dịch FeSO4 và H2SO4 loãng bằng dung dịch KMnO4
0,010 M. Kết quả thu được như sau: Lần thứ 1 2 3
Thể tích dung dịch KMnO4 (mL) 8,54 8,54 8,52
Nồng độ mol phù hợp nhất của FeSO4 trong dung dịch chuẩn độ là A. 4,263.10-2 M. B. 4,266.10-2 M. C. 4,264.10-2 M. D. 4,265.10-2 M Hướng dẫn trả lời
MnO4-+ 5Fe2+ + 8H+ → 5Fe3+ + Mn2+ + 4H2O
V trung bình = (8,54 + 8,53 + 8,52)/3 = 8,53 (mL)
Bảo toàn electron: nFe2+ = 5nKMnO4 → 10.CMFe2+ = 5.8,53.0,01
Nồng độ mol phù hợp nhất của FeSO4 trong dung dịch chuẩn độ = 4,265.10-2 (M)
Câu 94. Nước ngầm nhiễm sắt là nước chứa hàm lượng sắt hoà tan dưới dạng Fe2+ cao
vượt mức cho phép (> 5mg/L) gây ra hiện tượng nước có mùi tanh, vị chua, đục và
sẫm màu. Một mẫu nước giếng khoan ô nhiễm sắt ở dạng Fe2+ (aq) với nồng độ là 25
ppm (1ppm = 1 mg/L). Nồng độ mol của Fe2+ trong nước giếng khoan là bao nhiêu?
(Cho biết MFe = 55,85 gmol-1) A. 4.48. 10-4 mol/L. B. 2,24.10-4 mol/L. C. 5,60. 10-4 mol/L. D. 2,50. 10-4 mol/L. Hướng dẫn trả lời Nồng độ mol của 3 Fe2+ = 25.10 4 4,48.10 (mol / ) L 55,85
Câu 95. Dung dịch FeCl3 có môi trường acid do sự thủy phân của ion Fe3+ theo phản c ứng đơn giản hóa: Fe3+ (aq) + H2O (l) [Fe(OH)]2+ (aq) + H+(aq) Ka = 10-2,19
Gía trị pH của dung dịch FeCl3 0,1 M là A. 2,19. B. 1,66. C. 0,22. D. 1,22 Hướng dẫn trả lời
Fe3+ (aq) + H2O (l) ⇌ [Fe(OH)]2+ (aq) + H+(aq) 0,1 M x x xM (0,1 – x) x xM 2 x 2,19 K x pH x a 10 0,0224 log 1,66 0,1 x
Câu 96. Khi làm lạnh dung dịch FeCl3 thu được tinh thể FeCl3.6H2O. Cho độ tan của
FeCl3.6H2O trong nước ở một số nhiệt độ như sau: Nhiệt độ 0 20 30 Độ tan 74,4 91,8 106,8
Dung dịch bão hòa của FeCl3 ở 0oC có nồng độ phần trăm là A. 22,2%. B. 17.4%. C. 18,2%. D. 25,6%.
Hướng dẫn trả lời 74,4 .162,5 mFeCl 270,5 3 C% .100% .100% 25,6%. S 100 74,4 100
PHẦN II. CÂU HỎI TRẮC NGHIỆM ĐÚNG SAI. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai. 1. Mức độ thông hiểu
Câu 1. Mỗi phát biểu sau đây là đúng hay sai?
a) Ở trạng thái cơ bản, lớp ngoài cùng của nguyên từ kim loại chuyển tiếp dãy thứ
nhất có tối đa hai electron.
b) Nguyên tố kim loại chuyển tiếp dãy thứ nhất đều có nhiều số oxi hoá trong các hợp chất
c) Phân lớp 3d trong nguyên tử các kim loại chuyển tiếp dãy thứ nhất chưa bão hoà.
d) Các kim loại chuyển tiếp dãy thứ nhất đều là các nguyên tố nhóm A.
Hướng dẫn trả lời c a. Đúng. b. Đúng.
c. Sai. Cu có cấu hình [Ar] 3d104s1.
d. Sai. Các nguyên tố nhóm B.
Câu 2. Xét các phát biểu về đặc điểm của nguyên tố kim loại chuyển tiếp dãy thứ nhất:
a) Có các electron hoá trị phân bố cả trên phân lớp 3d và phân lớp 4s.
b) Từ 21Sc đến 29 Cu , số electron trong phân lớp d có xu hướng tăng dần (trừ trường hợp ngoại lệ).
c) Thể hiện nhiều số oxi hoá dương hoặc âm trong các hợp chất.
d) Tạo nên nhiều cation và anion có điện tích khác nhau. Hướng dẫn trả lời a. Đúng. b. Đúng.
c. Sai. Nguyên tố kim loại chuyển tiếp thể hiện nhiều số oxi hóa dương khác nhau.
d. Sai. Thường là cation với các số oxi hóa khác nhau.
Câu 3. Theo IUPAC, nguyên tố chuyển tiếp là những nguyên tố có phân lớp d
chưa được xếp (hoặc điền) đầy electron ở trạng thái nguyên tử hoặc ở trạng thái ion.
a) Calcium không phải là nguyên tố chuyển tiếp do không có phân lớp d
trong cấu hình electron của nguyên tử.
b) Nguyên tố có Z = 30 là nguyên tố chuyển tiếp.
c) Nguyên tố có Z = 29 không phải là nguyên tố chuyển tiếp.
d) Nguyên tố chuyển tiếp có tính kim loại nên còn được gọi là nguyên tố kim loại chuyển tiếp. Hướng dẫn trả lời a. Đúng.
b. Sai. Z = 30 không phải nguyên tố chuyển tiếp.
c. Sai. Z = 29 là kim loại chuyển tiếp. d. Đúng.
Câu 4. Ở trạng thái cơ bản, nguyên tử Cr có cấu hình electron là [Ar]3d54s1.
a) Nguyên tố chromium thuộc chu kì 4, nhóm VIB trong bảng tuần hoàn.
b) Chromium là kim loại nhẹ, có nhiệt độ nóng chảy thấp.
c) Chromium là kim loại chuyển tiếp dãy thứ nhất.
d) Nguyên tử chromium có số oxi hóa cao nhất là +3 trong các hợp chất.
Hướng dẫn trả lời a. Đúng.
b. Sai. Chromium là kim loại nặng, nhiệt độ nóng chảy cao. c. Đúng.
d. Sai. Số oxi hóa cao nhất của chromium là +6. c
Câu 5. Nguyên tử sắt (Fe) có cấu hình electron là [Ar] 3d64s2.
a) Sắt là kim loại chuyển tiếp dãy thứ nhất.
b) Ion Fe2+ có cấu hình electron là [Ar]3d44s2.
c) Kim loại Fe có tính nhiễm từ.
d) Dung dịch muối Fe3+ có màu vàng. Hướng dẫn trả lời a. Đúng.
b. Sai. Vì Cấu hình electron của Fe2+ là [Ar]3d6 c. Đúng. d. Đúng .
Câu 6. Copper là nguyên tố thứ 29 trong bảng tuần hoàn hóa học. Copper là một
kim loại khả năng dẫn nhiệt và dẫn điện tốt.
a) Nguyên tử Cu có cấu hình electron là [Ar]3d94s2.
b) Copper có khả năng dẫn điện tốt nên được sử dụng làm dây dẫn điện trong gia đình.
c) Nguyên tử copper thường có số oxi hoá đặc trưng là +2.
d) Cation Cu2+ có màu lục nhạt. Hướng dẫn trả lời
a. Sai. Nguyên tử Cu có cấu hình electron là [Ar]3d104s1. b. Đúng. c. Đúng.
d. Sai. Cation Cu2+ có màu xanh lam.
Câu 7. Kim loại chuyển tiếp có nhiều đặc điểm vật lý riêng biệt.
a) Các kim loại chuyển tiếp dãy thứ nhất đều có nhiệt độ nóng chảy cao hơn các kim loại nhóm IA và nhóm IIA.
b) Tất cả các kim loại chuyển tiếp đều có độ dẫn điện tốt.
c) Kim loại chuyển tiếp thường nặng hơn so với kim loại họ s.
d) Độ cứng của kim loại chuyển tiếp không thay đổi theo từng nguyên tố.
Hướng dẫn trả lời a. Đúng.
b. Sai. Không phải tất cả đều dẫn điện tốt, một số có độ dẫn điện kém.
c. Đúng. Chúng thường nặng hơn so với kim loại họ s.
d. Sai. Độ cứng có thể thay đổi giữa các nguyên tố.
Câu 8. Xét các phát biểu về tính chất vật lí của kim loại chuyển tiếp thứ nhất.
a) Các kim loại chuyển tiếp thường có khối lượng riêng lớn, cứng và khó nóng chảy.
b) Độ dẫn điện, dẫn nhiệt của các kim loại chuyển tiếp tương đối tốt, điển hình là đồng.
c) Hợp chất của các kim loại chuyển tiếp dãy thứ nhất thường không có màu.
d) Kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy cao hơn so với potassium (K).
Hướng dẫn trả lời c a. Đúng. b. Đúng
c. Sai. Hợp chất của các kim loại chuyển tiếp dãy thứ nhất thường có màu sắc đặc trưng. d. Đúng.
Câu 9. Tính chất của ion kim loại chuyển tiếp có thể thể hiện qua màu sắc.
a) Ion Co²⁺ có màu xanh lam.
b) Dựa trên sự khác nhau về màu sắc, có thể phân biệt được sự có mặt của cation kim
loại chuyển tiếp trong dung dịch.
c) Ion Ni2⁺ có màu xanh lá cây
d) Màu sắc của ion không liên quan đến cấu hình electron. Hướng dẫn trả lời
a. Sai. Co2+ có màu hồng, b. Đúng. c. Đúng.
d. Sai. Màu sắc của ion liên quan mật thiết đến cấu hình electron.
Câu 10. Kim loại chuyển tiếp thứ nhất có nhiều ứng dụng trong cuộc sống và
sản xuất như: V được dùng để chế tạo thiết bị làm việc ở nhiệt độ cao; Cr được
dùng để chế tạo mũi khoan; Ti được dùng để chế tạo vật liệu hàng không; Cu
được dùng để chế tạo dây dẫn điện,. .
a) V là kim loại có nhiệt độ nóng chảy cao.
b) Cr là kim loại cứng nhất trong tất cả các kim loại. c) Ti là kim loại nặng.
d) Cu là kim loại dẫn điện tốt nhất trong tất cả các kim loại. Hướng dẫn trả lời
a. Đúng. V là kim loại có nhiệt độ nóng chảy cao.
b. Đúng. Cr là kim loại cứng nhất trong tất cả các kim loại.
c. Sai. Ti là kim loại nhẹ (D = 4,5 gam/cm3).
d. Sai. Kim loại dẫn điện tốt nhất là Ag.
Câu 11. Phát biểu sau đúng hay sai?
a) Các kim loại chuyển tiếp thường cứng và khó nóng chảy.
b) So với calcium (là kim loại thuộc nguyên tố s), các kim loại chuyển tiếp dãy thứ
nhất có khối lượng riêng, độ cứng và nhiệt độ nóng chảy thấp hơn.
c) Nhờ có độ cứng cao, đồng thời bền trước tác động của các tác nhân ăn mòn nên
chromium được dùng làm lớp bảo vệ chống ăn mòn cho các dụng cụ, máy móc, thiết bị, đồ gia dụng,. .
d) Do có độ cứng vừa phải và dẫn điện tốt nên sắt được sử dụng làm da dẫn trong các
thiết bị và mạng lưới điện gia dụng. Hướng dẫn trả lời a, c, đúng
b) Sai so với calcium (là kim loại s), các kim loại chuyển tiếp dãy thứ nhất có




