
Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠOBÌNH THUẬN | ĐỂ THI HỌC SINH GIỎI CẤP TỈNH LỚP 9 CẤP THCS NĂM HỌC 2024-2025 Môn thi: KHTN – Kiến thức Hóa học) Thời gian làm bài: 150 phút (không kể thời gian giao đề Đề thi gồm: 02 trang. |
|---|
ĐỀ
Câu 1. (4,0 điểm)
1.1 Viết các phương trình hóa học minh họa cho các thí nghiệm sau:
a. Điện phân nóng chảy Al₂O₃.
b. Cho dòng khí CO dư đi qua CuO, nung nóng.
c. Cho dung dịch NaCl vào dung dịch AgNO₃.
d. Cho bột Fe vào dung dịch H₂SO₄ loãng, dư.
e. Cho dung dịch ethylic alcohol loãng phản ứng với oxygen có men giấm làm xúc tác.
f. Cho 2 mL dung dịch acetic acid vào 2 mL ethylic alcohol, sau đó thêm vài giọt dung dịch sulfuric acid đặc làm xúc tác rồi đun nóng nhẹ.
g. Cho vào ống nghiệm khoảng 1 thìa thủy tinh đá vôi đập nhỏ, thêm tiếp khoảng 1 mL dung dịch acetic acid 10% vào ống nghiệm.
h. Dẫn từ từ hỗn hợp khí gồm ethylene và ethane qua ống nghiệm chứa nước bromine
1.2. Carbon dioxide (CO₂) được biết đến là tác nhân chính gây ra hiệu ứng nhà kính, tuy nhiên không thể phủ nhận những ứng dụng của CO₂ trong đời sống như bảo quản thực phẩm, chữa cháy, sản xuất nước ngọt có gas… Trong phòng thí nghiệm, CO₂ được điều chế như hình bên.
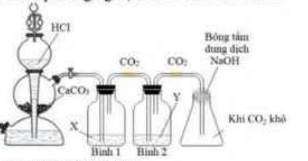
a. Viết phương trình hóa học điều chế CO₂ trong thí nghiệm trên.
b. Biết bình (1), (2) lần lượt dùng các chất X, Y có thể là hai trong các chất sau: H₂SO₄ đặc, NaHSO₃, NaHCO₃. Xác định X, Y phù hợp và giải thích.
c. Nêu vai trò của bông tẩm dung dịch NaOH trong thí nghiệm trên. Giải thích.
d. Theo em, có nên thay dung dịch HCl bằng dung dịch H₂SO₄ không? Vì sao?
Câu 2. (4,0 điểm)
2.1. Hỗn hợp gồm bột aluminium (Al), iron (Fe), copper (Cu). Bằng kiến thức hóa học hãy trình bày phương pháp tách riêng ba kim loại trên. Viết phương trình hóa học xảy ra.
2.2. Một loại phân NPK có độ dinh dưỡng ghi trên bao bì là 16-16-8. Để cung cấp 13,9 kg nitrogen (N), 2,8 kg phosphorus (P) và 17,6 kg potassium (K) cho một thửa ruộng, người ta sử dụng đồng thời x kg phân NPK (ở trên), y kg đạm chloride NH₄Cl (độ dinh dưỡng là 25%) và z kg phân kali (độ dinh dưỡng là 60%) . Tính tổng khối lượng phân bón đã sử dụng.
Câu 3. (4,0 điểm)
3.1: Một bình gas (khí hóa lỏng) có chứa 12 kg hỗn hợp propane và butane với tỉ lệ mol tương ứng là 1:2. Khi đốt cháy hoàn toàn 1 mol propane thì nhiệt lượng tỏa ra là 2220 kJ và 1 mol butane nhiệt lượng tỏa ra là 2850kJ. Trung bình mỗi ngày, nhiệt lượng tiêu thụ từ đốt cháy gas của một hộ gia đình X là 11000 kJ, hiệu suất sử dụng nhiệt là 85%, giá bình gas trên là 450000 đồng. Tính số tiền hộ gia đình X cần chi trả cho việc mua gas trong một tháng (30 ngày).
3.2. Cho 3,7185 lít (đo ở điều kiện chuẩn) hỗn hợp khí A gồm hydrocarbon X có công thức dạng CnH2n+2 và hydrocarbon Y có công thức dạng CmH2m đi qua bình nước bromine dư thấy có 8,0 gam bromine tham gia phản ứng. Tìm công thức phân tử hai hydrocarbon X, Y. Biết hỗn hợp A nặng 6,5 gam, n và m thỏa mãn điều kiện: n ≥ 2; m ≤ 4.
Câu 4. (4,0 điểm)
4.1. Xăng sinh học được sản xuất bằng cách phối trộn ethylic alcohol với xăng thông thường theo một tỉ lệ nhất định. Hiện nay, xăng E5 đang dùng phổ biến ở nước ta gồm 5% ethylic alcohol và 95% xăng thông thường về thể tích. Gọi là xăng sinh học vì ethylic alcohol pha vào xăng được điều chế thông qua quá trình lên men các sản phẩm hữu cơ như tinh bột, cellulose,...
a. Tính thể tích ethylic alcohol tạo thành khi lên men 1 tấn ngô. Biết trong 1 tấn ngô, tinh bột chiếm 81% về khối lượng, hiệu suất toàn bộ quá trình lên men tạo thành ethylic alcohol là 70%, khối lượng riêng của ethylic alcohol là 0,789 g/ml.
b. Lấy toàn bộ ethylic alcohol điều chế được ở trên pha với xăng thông thường để sản xuất xăng E5. Tính thể tích xăng E5 thu được.
4.2. Nguyên tố hóa học M và hợp kim M có nhiều ứng dụng trong thực tế như xây dựng nhà, công trình, đóng tàu… Nguyên tử M có tổng số các loại hạt là 82 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt.
a. Xác định số hạt proton, neutron, electron và tên nguyên tố M.
b. Viết các phương trình hóa học theo sơ đồ chuyển hóa sau và ghi rõ điều kiện phản ứng (nếu có):
MS2 X₁
X₂
X₃
X₄
X₅
M₂(SO₄)₃
Biết X₁, X₂, X₃, X₄, X₅ là các hợp chất khác nhau của M.
Câu 5. (4,0 điểm)
5.1. Hỗn hợp X gồm Zn, Fe, Cu. Cho 27,75 gam hỗn hợp X vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 7,437 lít H₂ (đo ở điều kiện chuẩn). Mặt khác, khi cho 0,225 mol hỗn hợp X tác dụng vừa đủ với 0,2625 mol Cl₂. Xác định thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
5.2. Hòa tan 13,4 gam hỗn hợp A gồm MgCO₃ và một muối cacbonat của kim loại R bằng một lượng vừa đủ dung dịch HCl 9,781% thu được dung dịch B và 3,7185 lít CO₂ (đo ở điều kiện chuẩn). Nồng độ muối MgCl₂ trong dung dịch B là 8,0%. Xác định tên kim loại R và tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp A.
(Cho khối lượng nguyên tử: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80)

