


















Preview text:
Đại Học Quốc Gia Hà Nội
Trường Đại Học Khoa Học Tự Nhiên
Lớp : K58D – hóa dược Đề Cương
Hóa Học Vô Cơ 1 Hà Nội 2014
Chương I- Hiđro . oxi . nước. hidropeoxit 1.
Tính chất vật lí đặc trưng nhất của khí hiđrô đưa đến những ứng dụng gì trong thực tế ?
• Hiđro tồn tại ở dạng phân tử H2
• Năng lượng của liên kết H-H là 435kJ/mol và độ dài liên kết là 0,74 A0
• Phân tử H2 có độ bền lớn ,khó bị cực hóa,hết sức bé và nhẹ nhất nên có nhiệt độ nóng
chảy (-259,1 0C) và nhiệt độ sôi ( -252,6 0C) rất thấp
• Ở nhiệt độ thường, hiđro là chất khí không màu ,không mùi, không vị ,nhẹ nhất trong
tất cả các khí 1lit H2 ở đktc nặng 0,08985g, nhẹ hơn không khí gấp 15 lần
• Nhờ tốc độ khuếch tán lớn khí hiđro có độ dẫn điện lớn
• Khí H2 rất ít tan trong nước và các dung môi hữu cơ ứng dụng :
• Dùng khí hiđro để làm nguội ,quá trình làm nguội nhanh hơn gấp 6 lần không khí
• Vì nhẹ nên khí hiđro được dung để bơm vào khí cầu
• Hiđro kim loại còn có triển vọng làm nguồn nhiêu liệu hóa học và nguồn nhiên liệu
nhiệt- nhân rất lí tưởng trong tương lai
Tính chất hóa học đặc trưng của hiđro. Tại sao khí hiđrô chỉ hoạt động khi
đun nóng ? Nêu những dẫn chứng cho thấy hiđrô nguyên tử hoạt động hơn
hiđrô phân tử. Khí hiđrô có thể khử được oxit của những kim loại nào ?
• Phân tử hiđro với vỏ electron của He ,có độ bền lớn rất khó phân hủy thành nguyên tử.
Nó chỉ phân hủy rõ rệt ở 2000 0C H 0 2 = 2H
Δ H = 436kJ/mol ( phản ứng thu nhiệt)
• Ở nhiệt độ thường, hiđro kém hoạt động về mặt hóa học . Khi đun nóng hiđro kết hợp với nhiều nguyên tố :
• Kết hợp trực tiếp với các kim loại kiềm và kim loại kiềm thổ tạo hiđrua kim loại
=> hiđro tồn tại ở dạng anion H- thể hiện tính oxi hóa. 2Li + H2 = 2 LiH Ca + H2 = CaH2
• Kết hợp với các nguyên tố phi kim như halogen, lưu huỳnh, nitơ, oxi … H o 2 + Cl2 = 2HCl (t cao) H2 + S = H2S
Với oxi thì cần tiếp xúc với ngọn lửa hoặc có tia điện thì nổ mạnh phát ra nhiều nhiệt O 0 2 + 2 H2 = 2H2O Δ H = -241,82 kJ/mol
• Với các hợp chất : do có ái lực mạnh với oxi nên hiđro có thể khử nhiều oxit kim
loại như Cu , Pb , Fe , Hg … ở nhiệt độ cao CuO + H2 = Cu + H2O Fe3O4 + 4 H2 = 3 Fe + 4 H2O
• Hiđro ở điều kiện thường có thể khử được một số kim loại ra khỏi dung dịch muối của chúng AgNO3 + 1/2 H2 = Ag + HNO3 H2PtCl4 + H2 = Pt + HCl
• Ngoài ra có mặt chất xúc tác Hiđro có thể khử được nhiều hợp chất hữu cơ :
khử hợp chất không no thành no, anđehit thành rượu….
• Hiđro nguyên tử hoạt động hơn hiđro phân tử
H2 + KMnO4 + H2SO4 = không phản ứng
H + KMnO4 + H2SO4 = MnSO4 + K2SO4 + H2O
Phương pháp điều chế khí hiđro trong công nghiệp và trong phòng thí nghiệm ?
• Trong phòng thí nghiệm :
Cho kẽm hạt tác dụng với dung dịch H2SO4 loãng hoặc HCl trong bình kíp (Zn
tinh khiết phản ứng xảy ra chậm cho them một ít muối đồng cho pứ xảy ra nhanh hơn ) Zn + H2SO4 = ZnSO4 + H2
• Trong công nghiệp :
- Điện phân nước ( điện phân dung dịch H2SO4 20% hoặc NaOH 20%)
- Bay hơi phân đoạn không khí lỏng
- Phương pháp đi từ than : C + H 0 0
2O = CO + H2 Δ H = 130 kJ/mol ,1000 -10000 C CO + H 0 0 2O = CO2 + H2 Δ H = -42 kJ/mol , 450 C, (xt Fe2O3,Cr2O3)
Làm sạch thu được khí hiđro -
Khí đồng hành trong sản xuất dầu mỏ CH 0 0 4 + H2O = CO + 3 H2 Δ H = 209 kJ/mol ,1000 C -
Đốt cháy hoàn toàn khí thiên nhiên 2CH 0 4 + O2 = 2 CO + 4 H2 Δ H = -71kJ/mol ,
2. Các hiđrua: sự phân loại và tính chất của mỗi loại.
Có 3 loại : hiđrua ion, hiđrua cộng hóa trị, hiđrua kim loại . hiđrua ion
-Là hợp chất của hiđrua với các kim loại dương điện mạnh
-Là các hợp chất ở dạng tinh thể không màu giống muối
- H+ +e- = H- có tính oxi hóa giống với các halogen nhưng ái lực electron của hiđro
kém hơn của halogen 3-5 lần
-Các hiđrua ion rất kém bền nó có thể phản ứng được với nhiều đơn chất và hợp chất
trong đó nó đóng vai trò là chất khử mạnh. Vì vậy trong hóa học người ta sử dụng hiđrua
này (LiH ,NaH ,KH,CaH2,MgH2 …) làm các chất khử
- Hidrua ion có hoạt tính hóa học rất cao, chúng phản ứng nhanh chóng và hoàn toàn với
những chất dù chỉ là những vết ion H+ (là những axit yếu) NaH + H2O = NaOH + H2 CaH2 + 2H2O = Ca(OH)2 + 2H2
-Hiđrua ion có thể tác dụng với một số hợp chất cộng hóa trị tạo phức chất LiH + BH3 =Li[BH4] NaH + AlH3 =Na[AlH4]
Các phức này cũng có tính khử mạnh
• Các hiđrua ion thường kém bền dễ bị phân hủy
• Điều chế :Đun nóng kim loại trong khí quyển 2Na + H2 = 2NaH Ca + H2 = CaH2
Hiđrua cộng hóa trị
-Là hiđrua của các phi kim và nửa kim loại : SiH4, CH4 NH3 AlH3…
-Liên kết của các hiđrua này là liên kết cộng hóa trị phân cực ,độ bền của liên kết thì giảm
dần từ trên xuống trong một nhóm và tăng dần từ trái sang phải trong một chu kì
-Liên kết giữa các phân tử là liên kết van-de-van . Vì vậy các hiđrua này có nhiệt nóng
chảy thấp, trong một số hiđrua công hóa trị có hình thành lien kết hiđro
-Một số hiđrua cộng hóa trị khi tan trong nước cho môi trường axit .một số không bền dễ
bị thủy phân trong nước giải phóng khí H2 BeH2 + 2H2O = Be(OH)2 + 2H2 MgH2 + 2H2O = Mg(OH)2 + 2H2 Hiđrua kim loại
-Là hợp chất giữa hiđro và kim loại chủ yếu là kim loại chuyển tiếp
-Dạng bột hay dạng khối giòn nhưng bền về mặt hóa học, có ánh kim và dẫn điện tốt
-Các hiđrua kim loại có đặc tính ưu việt so với các kim loại đó là làm các kim loại chuyển
tiếp tăng độ cứng độ bền,tăng nhiệt độ nóng chảy,giảm hoạt tính hóa học đồng thời các
hiđrua này có ứng dụng nhiều trong thực tế
3. Cấu tạo phân tử, tính chất lí hóa học và phương pháp điều chế oxi trong công
nghiệp và trong phòng thí nghiệm.
Cấu tạo phân tử : phân tử O 0
2 thuận từ có độ dài liên kết 1,21 A ,năng lượng liên kết là
494 kJ/mol , phân tử không phân cực. GT : - Phương pháp VB: 2s 2p4 ↑↓ ↑↓ ↑ ↓ O O O O ↑↓ ↑↓ ↑ ↓ - Phương pháp MO
Tính chất vật lí :
• O2 có cấu tạo O=O , liên kết không phân cực , phân tử bền => có nhiệt độ nóng chảy
và nhiệt độ sôi thấp (to o o o nc=-218,9 C , t s=-183 C)
• Phân tử O2 không phân cực nên ít tan trong dung môi không phân cực , O2 có thể tan
trong một số kim loại nóng chảy
VD : ở 973 oC , một thể tích Ag có thể hòa tan 22,4 lít thể tích oxi ở điều kiện áp suất thường
ở 1080 oC , một thể tích Ag có thể hòa tan 20 lít thể tích oxi ở điều kiện áp suất thường
• Oxi là một khí không màu ,không mùi, không vị , nặng hơn không khí. Ở trạng thái
lỏng, oxi có màu xanh lam và nặng hơn nước
Tính chất hóa học:
-Phân tử O2 bền ,năng lượng liên kết phân tử lớn,khá trơ ở nhiệt độ thường nhưng do
có 2e nằm trên AO * phản lien kết => hoạt tính hóa học của oxi là khá cao ở nhiệt độ thường
- O2 là nguyên tố phi kim điển hình => có thể tương tác với hầu hết các nguyên tố trong
bảng tuần hoàn trừ các halogen khí hiếm và một số kim loại quý. Cụ thể:
• Tính chất đặc trưng của O2 là phản ứng oxi hóa
• Phản ứng oxi hóa khử có sự tham gia của oxi là tương đối phổ biến
• Oxi tinh khiết cũng như oxi trong không khí đều có khả năng phản ứng với đơn
chất và hợp chất ở nhiệt độ nào đó ,nhiệt độ đó gọi là nhiệt bốc cháy ,nhiệt bốc
cháy của oxi tinh khiết thấp hơn trong không khí là khoảng 50 oC
• Do phản ứng oxi hóa thường tỏa ra nhiều nhiệt nên nó được sử dụng nhiều trong thực tế. Điều chế • Trong PTN :
-Nhiệt phân hợp chất giàu oxi : KMnO4,KClO3 … 2KMnO4 = K2MnO4 + MnO2 + O2 KClO3 = KCl + 3/2 O2 -Điện phân nước . • Trong công nghiệp : -
Chủ yếu là phương pháp bay hơi phân đoạn không khí lỏng -
Điện phân nước ( điện phân H2SO4 20% or NaOH 20%)
4. Trình bày công thức cấu tạo của phân tử O3. Tính chất lí hóa học, phương pháp
điều chế ozôn trong phòng thí nghiệm và trong công nghiệp. Cách nhận biết khí
O3; So sánh tính chất lí hoá học của khí oxi và khí ozôn. Phản ứng phân biệt O3 và O2
công thức cấu tạo của phân tử O3
• Phân tử ozon có ba nguyên tử oxi liên kết với nhau. Nguyên tử oxi trung tâm tạo nên
một liên kết cho - nhận với một trong hai nguyên tử oxi và hai liên kết cộng hóa trị với nguyên tử oxi còn lại:
• Là phân tử phân cưc ,độ dài liên kết là 1,278 Ao ,góc liên kết là 117 o
• Năng lượng tạo thành của O 0 3 là Δ H = 142,3 kJ/mol , • Lai hóa sp2.
Tính chất vật lí học
• Do ozon có khối lượng tương đối lớn,có cưc dễ bị cực hóa nên ozon có nhiệt độ
nóng chảy (-192,7 oC) và nhiệt độ sôi (-111,9 oC) cao hơn oxi.
• Ở nhiệt độ thường O3 là chất khí có màu xanh lam nhạt ,mùi tanh đặc biệt,ở dạng
lỏng có màu tím lam , dạng rắn có màu tím đen và có tỉ khối là 1,71
• Do phân tử phân cực => O3 tan khá nhiều trong nước và nhiếu hơn O2 gấp 15 lần
• O3 có tồn tại trong khí quyển ở tầng cao có nồng độ nhỏ có khả năng hấp thụ các
tia tử ngoại, trong bức xạ vũ trụ nó là yếu tố cực kì quan trọng trong bảo vệ sự sống.
Tính chất hóa học
• Dễ bị phân hủy O3 = O2 + O
• O3 hoạt động hóa học mạnh : -
O3 phản ứng được với nhiều kim loại 2Ag + O3 = Ag2O + O2 -
Có thể biến sunfua thành sunfat PbS + 4 O3 = PbSO4 +4O2 -
Oxi hóa được KI ngay trong môi trường kiềm
2KI + O3 + H2O = 2KOH + O2 + I2 -
Nhiều hợp chất hữu cơ bốc cháy khi tiếp xúc với O3 Điều chế • Trong PTN - Phương pháp hóa học : K2S2O8 + H2O = KHSO4 + H2O2
( H2SO4 đặc làm môi trường) H2O2 = H2O + O O + O2 = O3 -
Phương pháp phóng điện êm • Trong công nghiệp
Sử dụng phương pháp phóng điện ở điện thế cao
Cách nhận biết khí O3 :
• Dựa vào tính chất vật lí của ozon : khí O3 có màu xanh lam nhạt và có mùi tanh đặc trưng.
• Dựa vào tính chất hóa học : O3 có tính oxi hóa mạnh , -
O3 phản ứng được với nhiều kim loại 2Ag + O3 = Ag2O + O2 -
Có thể biến sunfua thành sunfat PbS + 4 O3 = PbSO4 +4O2 -
Oxi hóa được KI ngay trong môi trường kiềm
2KI + O3 + H2O = 2KOH + O2 + I2
So sánh tính chất lí hoá học của khí oxi và khí ozôn Tính chất OXI OZON Vật lí
-Là phân tử không phân cực, phân -Là phân tử phân cực,không bền ,tan tử bền, ít tan
nhiều hơn oxi gấp 15 lần
- có nhiệt độ nóng chảy và nhiệt độ - Có nhiệt độ nóng chảy (-192,7 oC) và sôi thấp (to o o o nc=-218,9 C , t s=-183
nhiệt độ sôi (-111,9 C) cao hơn oxi. oC)
- Ở nhiệt độ thường O3 là chất khí có màu
-Là một khí không màu ,không mùi, xanh lam nhạt ,mùi tanh đặc biệt,ở dạng
không vị , nặng hơn không khí. . Ở lỏng có màu tím lam , dạng rắn có màu tím
trạng thái lỏng, oxi có màu xanh
đen và có tỉ khối là 1,71 lam và nặng hơn nước -Dễ bị phân hủy O3 = O2 + O
-Tính chất đặc trưng của O2 là
-O3 hoạt động hóa học mạnh ,mạnh hơn phản ứng oxi hóa O2: + phản ứng với phi kim
+O3 phản ứng được với nhiều kim loại S + O2 = SO2 2Ag + O3 = Ag2O + O2
Hóa học + phản ứng với kim loại trừ
+Có thể biến sunfua thành sunfat Ag,Au,Hg .. PbS + 4 O3 = PbSO4 +4O2 3 Fe + 2O2 = Fe3O4
+Oxi hóa được KI ngay trong môi trường + Với hợp chất kiềm
C2H5OH + 3O2 = 2CO2 + 3H2O 2KI + O3 + H2O = 2KOH + O2 + I2
+Nhiều hợp chất hữu cơ bốc cháy khi tiếp xúc với O3
Phản ứng phân biệt O3 và O2 O2 + Ag = không phản ứng 2Ag + O3 = Ag2O + O2
2KI + O2 + H2O = không phản ứng
2KI + O3 + H2O = 2KOH + O2 + I2
=> Dấu hiệu nhận biết oxi và ozon.
5. Trình bày cấu tạo phân tử, tính chất lí hóa học của nước. Các phương pháp làm
sạch nước trong phòng thí nghiệm.
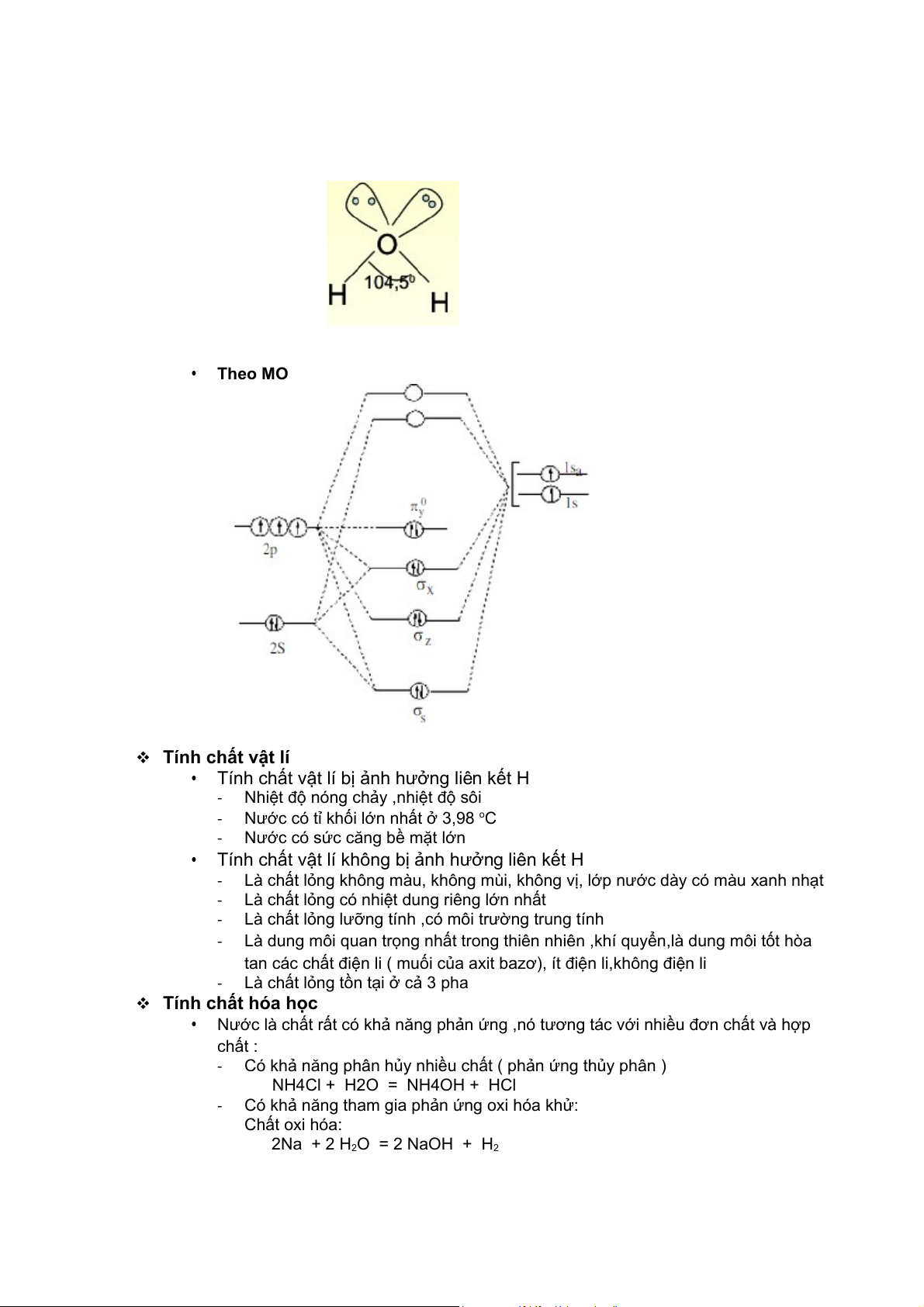
Cấu tạo phân tử
• Phân tử nước bao gồm hai nguyên tử hiđrô và một nguyên tử ôxy.
• Phân tử nước có góc liên kết là 105°. Do các cặpđiện tử tự do chiếm nhiều chỗ
nên góc này sai lệch đi so với góc lý tưởng của
. Chiều dài của liên kết hình tứ diện O-H là 0,99 Ao
• Phân tử nước có khả năng tụ hợp phân tử bằng phân tử hiđro.
• GT theo VB: O lai hóa sp2
Liên kết O- H bị phân cực mạnh • Theo MO
Tính chất vật lí
• Tính chất vật lí bị ảnh hưởng liên kết H -
Nhiệt độ nóng chảy ,nhiệt độ sôi -
Nước có tỉ khối lớn nhất ở 3,98 oC -
Nước có sức căng bề mặt lớn
• Tính chất vật lí không bị ảnh hưởng liên kết H -
Là chất lỏng không màu, không mùi, không vị, lớp nước dày có màu xanh nhạt -
Là chất lỏng có nhiệt dung riêng lớn nhất -
Là chất lỏng lưỡng tính ,có môi trường trung tính -
Là dung môi quan trọng nhất trong thiên nhiên ,khí quyển,là dung môi tốt hòa
tan các chất điện li ( muối của axit bazơ), ít điện li,không điện li -
Là chất lỏng tồn tại ở cả 3 pha
Tính chất hóa học
• Nước là chất rất có khả năng phản ứng ,nó tương tác với nhiều đơn chất và hợp chất : -
Có khả năng phân hủy nhiều chất ( phản ứng thủy phân ) NH4Cl + H2O = NH4OH + HCl -
Có khả năng tham gia phản ứng oxi hóa khử: Chất oxi hóa: 2Na + 2 H2O = 2 NaOH + H2 Chất khử: 4F2 + 2 H2O = 4HF + O2 -
Tạo phức với các ion trong môi trường nước : [Ti(H 6+ 3+ 2O)2] , [Cr(H2O)6] … -
Tạo tinh thể ngậm nước (hiđrat tinh thể) : CuSO4.5H2O , H2C2O4.2H2O … -
Là chất lưỡng tính vừa có tính axit vùa có tính bazơ -
Làm xúc tác cho một số lớn các phản ứng 2NO + O2 →2 NO2 2Fe + 3Cl2 → 2 FeCl3
Các phương pháp làm sạch nước trong phòng thí nghiệm. Chưng cất nước : -
khi chưng cất cho thêm dung dịch KmnO4 trong môi trường axit hoặc kiềm vào
nước để phá hủy các tạp chất hữu cơ có trong nước. -
Phần nước cất thu được lúc ban đầu còn chứa các khí tan cho nên bỏ đi chỉ hứng phần sau . -
Bằng những nhựa trao đổi ion thích hợp người ta thu được nước tinh khiết như nước cất.
6. Trình bày cấu tạo phân tử, tính chất lí, hóa học của H2O2. Trình bày phương pháp
điều chế H2O2 trong công nghiệp và trong phòng thí nghiệm.
Cấu tạo phân tử:
• Phân tử H2O2 có dạng gấp khúc
• Liên kết giữa các nguyên tử H và nguyên tử O là liên kết cộng hóa trị có cực (cặp
electron chung lệch về phía nguyên tử O).
• Độ dài liên kết O-O là 1,48 Ao , O-H là 0,95 Ao ,góc liên kết OOH là 95o, năng lượng liên kết O-O là 217,5 kJ/mol
• Do phân tử không có đối xứng nên H2O2 có cực tính lớn
Tính chất vật lí
• H2O2 tinh khiết sánh như nước đường vì có liên kết H
• Nhiệt độ sôi 152,1 oC , hóa rắn ở -0,89 oC
• Chất lỏng không màu,có vị kim loại nặng hơn nước, hóa rắn ở −0,480C, tan trong nước theo bất kì tỉ lệ nào.
• Là hợp chất không bền dễ bị phân hủy nhiệt
Tính chất hóa học
• Là chất rất hoạt động hóa học
• H2O2 có khả năng thể hiện tính oxi hóa, tính khử Cụ thể : - H2O2 dễ bị phân hủy H2O2 → H2O + O -
H2O2 thể hiện tính oxi hóa PbS + H2O2 → PbSO4 + H2O
2KI + H2O2 + H2SO4 → K2SO4 + I2 + 2H2O - H2O2 thể hiện tính khử
2KMnO4 + 5H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 8H2O + 5O2
Phương pháp điều chế • Trong PTN : BaO2 + H2SO4 → BaSO4 + H2O2 • Trong công nghiệp : -
Phương pháp điện phân : người ta điện phân ở nhiệt độ khoảng 5-10 độ C dd H2SO4
50% hoặc dd (NH4)2SO4 trong H2SO4 với mật độ dòng điện lớp và điện cực
plantin.Tuy cơ chế của quá trình điện phân chưa được biết rõ hoàn toàn nhưng có thể
được biểu diễn như sau: 2HSO - 2- + 4 - 2e = S2O8 + 2H 2SO 2- 2- 4 - 2e =S2O8
Axit peoxiđisunfuric (H2S2O8)được tạo nên khi điện phân sẽ kết hợp với nước cho H2O2. H2S2O8 + 2H2O = 2H2SO4 + H2O2
Chưng cất hỗn hợp ở áp suất thấp sẽ được dd H2O2 loãng .Cô cặn dd trong chân
không rồi chưng cất phân đoạn nhiều lần sẽ được dung dịch H2O2 90-99%. -
Phương pháp antraquinol người ta dùng oxi để oxi hóa đihiđrô antraquinol thu được
H2O2 và tái sinh lại được đihiđro antraquinol bằng cách dùng H2 khử với chất xúc tác Pd: C14H10O2 + O2 =C14H8O2 + H2O2
Dung dịch H2O2 thu được có nồng độ 20-25%.Nguyên liệu chủ yếu của phương pháp
này là H2 ,O2,không khí và H2O nên giá thành rẻ hơn so với phương pháp điện phân
Chương II- Các kim loại kiềm (nhóm IA)
Liti (Li) – Natri (Na) – Kali (K) – Rubidi (Rb) – Xesi (Cs) 7.
Sự biến đổi tính chất vật lí trong dãy các kim loại kiềm
• Các kim loại kiềm đều có cấu tạo mạng tinh thể lập phương tâm khối, là kiểu mạng
kém đặc khít, có bán kính nguyên tử lớn, khối lượng riêng nhỏ
• Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh ( ánh kim dễ mất khi KL
tiếp xúc với không khí )
• Nhiệt độ nóng chảy và nhiệt độ sôi đều thấp và giảm dần từ Li → Cs ( do liên kết kim loại yếu )
• Các kim loại kiềm đều nhẹ, Li nổi trên dầu hỏa, Na và K nổi trên nước
• Các kim loại đều mềm có thể cắt bằng dao được, Cs mềm nhất còn Li cứng hơn
• Kim loại kiềm có độ dẫn điên cao nhưng kém hơn Ag
• Các kim loại tự do cũng như hợp chất dễ bay hơi của chúng khi được đưa vào ngọn
lửa không màu làm cho ngọn lửa trở nên có màu đặc trưng : Li : màu đỏ tía Na : màu vàng K : màu tím Rb : màu tím hồng Cs : màu xanh lam
• Các kim loại kiềm có thể hòa tan lẫn nhau và đều dễ tan trong thủy ngân tạo lên hỗn hống
• Các kim loại kiềm tan được trong amoniac lỏng và độ tan của chúng khá cao.
Dung dịch loãng có màu xanh lam và dẫn điện.Dung dịch có nồng độ cao hơn có
màu đỏ đồng và có ánh kim
Sự biến đổi tính chất hóa học trong dãy các kim loại kiềm
Các kim loại kiềm rất hoạt động về mặt hóa học. Trong phản ứng chúng thể hiện tính khử
mạnh và tính khử đó tăng dần từ Li → Cs.
Tác dụng với phi kim:
Hầu hết các kim loại kiềm có thể khử được các phi kim. -
Với hidro: Khi đun nóng, các kim loại kiềm kết hợp với hidro tạo hidrua ion:
Li ở 600-700oC, còn các kim loại kiềm khác ở 350-400oC. M + H → MH - Với oxi:
+ Ở điều kiện thường và trong không khí khô:
Li bị phủ một lớp màu xám gồm Li2O và Li3N. 4 Li + O2 → 2Li2O 3Li + 1/2 N2 → Li3N
Na bị oxi hóa thành Na2O2 và lẫn một ít Na2O. 4Na + O2 → 2Na2O Na2O + 1/2O2 → Na2O2
K bị phủ lớp KO2 ở ngoài cùng và bên trong là lớp K2O. 4K + O2 → 2K2O K2O + 3/2 O2 → 2KO2
Rb và Cs tự bốc cháy tạo RbO2 và CsO2.
+ Khi đốt nóng: Li tạo Li2O và một ít Li2O2, còn các kim loại kiềm khác, oxit của
chúng tác dụng tiếp với oxi tạo peoxit (Na2O2) hoặc supeoxit (KO2, RbO2, CsO2). - Với halogen, lưu huỳnh:
Các kim loại kiềm bốc cháy trong khí clo khi có mặt hơi ẩm ở nhiệt độ cao. Với brom
lỏng, K, Rb, Cs nổ mạnh, Li và Na chỉ tương tác trên bề mặt. Với iot, các kim loại kiềm
chỉ tương tác mạnh khi đun nóng.
Khi nghiền kim loại kiềm với bột lưu huỳnh sẽ gây phản ứng nổ. Với nitơ, cacbon, silic:
Chỉ có Li có thể tương tác trực tiếp tạo Li3N, Li2C2, Li6Si2 khi đun nóng. Li6Si2 là dạng
tinh thể màu tím hút ẩm rất có khả năng phản ứng Tác dụng với nước :
Các kim loại kiềm có thế điện cực rất thấp, vì thế chúng tương tác rất mãnh liệt với
nước giải phóng khí hidro. M + H2O → MOH + ½ H2
Khi phản ứng với nước, Li không cho ngọn lửa, Na nóng chảy thành hạt tròn nổi và
chạy trên mặt nước, hạt lớn có thể bốc cháy, K bốc cháy ngay còn Rb và Cs gây phản ứng nổ.
Do kim loại kiềm hoạt động hóa học mạnh, đặc biệt là bị oxi hóa nhanh trong không
khí và có phản ứng mãnh liệt với nước, cần phải bảo quản kim loại kiềm trong dầu hỏa
khan, trong chân không hoặc trong khí trơ và thật cẩn thận khi làm thí nghiệm với kim loại kiềm.
Khi đun nóng (quá nhiệt độ nóng chảy của kim loại) trong khí NH3 các kim loại
kiềm dễ tạo thành amiđua Na + 2NH3 → 2NaNH2 + H2 Tác dụng với axit
Thế điện cực chuẩn của cặp oxi hóa – khử của kim loại kiềm có giá trị từ -3.05V đến
-2,71V cho nên các kim loại kiềm có thể khử dễ dàng ion H+ của dung dịch axit thành khí hidro. 2M + 2H+ → 2M+ +H2
Phản ứng của kim loại kiềm với axit cũng là phản ứng gây nổ nguy hiểm.
Các kim loại kiềm có thể thay thế H trong các axit hữu cơ tạo nên muối ion.
Kim loại kiềm cũng tạo lên những hợp chất cộng hóa trị như LiCH3 , NaC2H5 …
nhưng không dễ tạo nên những phức chất.
Mối liên hệ giữa tính chất đó với cấu hình điện tử hóa trị của chúng
• Do có một e hóa trị ns1 ở ngoài cấu hình e bền của các khí hiếm, các kim loại kiềm
rất dễ mất đi một e hóa trị biến thành ion dương M+
→ Thể hiện chúng hoạt động rất mạnh, năng lượng ion hóa của chúng rất thấp
• Vì chỉ có 1 e hóa trị duy nhất nên tính chất hóa học của các kim loại kiềm đơn giản
hơn các nhóm kim loại khác.
Hãy nêu dẫn chứng chứng minh rằng, liti có nhiều tính chất khác biệt với các kim loại kiềm khác.
• Li có thế điện cực âm hơn các kim loại kiềm khác,một số hợp chất của Li ít tan .
• Li phản ứng với H2 ở nhiệt độ cao hơn các kim loại kiềm khác
• Li có thể phản ứng trực tiếp với N2 ,C ,Si Li + 3/2 N2 = Li3N Li + C = Li2C2 6 Li + 2 Si = Li6Si2
Trình bày phương pháp điều chế natri kim loại trong công nghiệp.
Điện phân muối clorua nóng chảy :
Dùng thùng điện phân bằng thép pử trong lót gạch sa mốt,cực dương bằng than chì và
cực âm = sắt, giữa 2 cực có màng ngăn và chất điện phân không phải là NaCl tinh khiết
mà là hỗn hợp của NaCl với 25% NaF và 12% KCl (cho phép điện phân ở 610 – 650 oC)
8. Phản ứng nhuốm màu ngọn lửa của các kim loại kiềm và kiềm thổ. Giải thích.
• Các kim loại tự do khi được đưa vào ngọn lửa không màu làm cho ngọn lửa trở nên có màu đặc trưng :
Li : đỏ tía - Na : vàng - K : tím - Rb : tím hồng - Cs : xanh lam
Ca : đỏ da cam – Sr : đỏ son – Ba : lục hơi vàng
Giải thích : ở trong ngọn lửa những e của nguyên tử hay ion kim loại được kích động nhảy ra
mức năng lượng cao hơn . khi nhảy về những mức ban đầu, những e đó hoàn trả lại những
năng lượng đã hấp thụ. Trong trường hợp này, năng lượng đó là bé và được phát ra dưới
dạng bức xạ vùng nhìn thấy. Vì vậy, ngọn lửa có những màu đặc trưng của các kim loại.
Chương III- Các kim loại kiềm thổ (nhóm IIA)
9. Trình bày tính chất lí hoá học của magiê kim loại. Phương pháp sản xuất magiê kim loại trong công nghiệp
Tính chất vật lí
Có màu xám nhạt, có ánh kim T o o o o
nc = 650 C; ts = 1100 C ,tỉ khối 1,74 cao hơn kim loại kiềm Độ cứng của Mg cao
Mg có tính cơ học tốt : dẻo dễ dát mỏng ,kéo sợi được.
Dễ tạo hợp kim với kim loại khác ,hợp kim của Mg có nhiều ứng dụng trong công
nghiệp , 2 hợp kim thông dụng : -
macnhali :10-30% Mg và 30-70% Al cứng và bền hơn Al tinh khiết
nhưng dễ chế hóa và dễ bào nhẵn hơn -
electron 83% Mg, 10%Al ,5% Zn ,2%Mn có tính chất cơ lí tốt
Tính chất hóa học Mg
Là kim loại rất hoạt động đứng sau kiềm. thể hiện tính khử đặc trưng
Ở áp suất lớn của khí H2 (200atm) có mặt MgI2 , Mg có thể kết hợp với H2 ở 570 oC tạo MgH2 Mg + H2 → MgH2
Trong không khí ở to thường Mg bị bao phủ lớp oxit rất mỏng và bền ngăn cản chúng tiếp
xúc với oxi . Khi đốt cháy tạo oxit ,Mg cháy phát sáng chói và giàu tia tử ngoại Mg + ½ O 0 2 → MgO
Δ H = -610 kJ/mol < pứ tỏa nhiều nhiệt >
Khi đun nóng Mg pứ mãnh liệt với halogen, nitơ, lưu huỳnh ,photpho,cacbon,silic
Mg cháy trong không khí còn có pứ
Mg3N2 + 6 H2O → 3Mg(OH)2 + 2 NH3 Mg +2C → MgC2
MgC2 + 2H2O → Mg(OH)2 + C2H2 2Mg + Si → Mg2Si
Mg không tan trong nước lạnh nhưng tan chậm trong nước nóng Mg + 2 H2O → Mg(OH)2 + H2
Phương pháp sản xuất magiê kim loại trong công nghiệp
Điện phân cacnalit hoặc hỗn hợp muối clorua của Mg và kim loại kiềm ở 700-750 oC trong
thùng điện phân làm = thép là cực âm ,cực dương là thanh chì đặt trong ống sứ xốp để cho khí clo thoát ra
Ngoài ra có thể dùng than cốc khử MgO chế từ magiezit hay dùng ferosilic (hợp kim Fe và
Si) khử hỗn hợp MgO và CaO chế từ đolomit ở nhiệt độ cao và trong chân không .
MgO + C → Mg + CO <2000oC>
CaO +MgO +Si → Mg + 2 CaO.SiO o 2 <1500 C>
Hơi magie bay lên và được làm ngưng tụ lại
Chương IV- Các nguyên tố nhóm IIIA
Bo (B) – Nhôm (Al) – Gali (Ga) – Inđi (In) – Tali (Tl)
10. Sự biến đổi tính chất của các nguyên tố nhóm IIIA. Giải thích.
• Các nguyên tố nhóm này đều có chung một lớp electron hoá trị ns2np.
• Số oxi hoá chung là 3+ ,(trừ B) tính chất chúng không giống nhau nhiều -
B:có năng lượng Ion hóa lớn nên B không thể mất e để tạo ion B3+ → B là phi kim -
Al: lớp e ngoài cùng ngay sau vỏ khí hiếm, khoảng cách s và p gần→ dễ tách 3 e, nên
số oxi hóa là +3 bền.năng lượng hydrat hóa của Al3+ rất thấp → Al là kim loại hoạt động mạnh -
Ga và In: sau lớp vỏ khí hiếm còn có 10 e của (n-1)d,lại bị ảnh hưởng của sự co d→ khó tách e -
Tl: sau lớp vỏ khí hiếm còn có 14 e của (n-2)f và 10 e của (n-1)d, lại bị ảnh hưởng của
sự co f → khó tách cả 3 e nên số oxi hóa là +1 là bền,trong các dãy hc tạo thành tồn
tại cả muối Tali(III) và Tali(I)
• Tính kim loại của các nguyên tố nhóm IIIA biến thiên tuyến tính chứ không tăng dần từ trên
xuống dưới như KL kiềm thổ -
Từ Al đến Ga: tính kim loại hơi giảm xuống do tổng I hơi tăng (vì Ga dứng sau các
KL chuyển tiếp nên chịu ảnh hưởng của sự co d) -
Từ Ga đến In tính kim loại tăng do I giảm, từ In đến Tl thì lại giảm do I tăng( vì Tl
đứng sau các kl nhóm lantanoit nên chịu ảnh hưởng của sự co f)
Các ion hidrat hóa của các ion Al3+ Ga3+ và In3+ dễ hình thành trong dung dịch (thế
điện cực chuẩn của quá trình M3+ + 3e → M khá âm). -
Ga và In: sau lớp vỏ khí hiếm còn có 10 e của (n-1)d,lại bị ảnh hưởng của sự co d→ khó tách e -
Tl: sau lớp vỏ khí hiếm còn có 14 e của (n-2)f và 10 e của (n-1)d, lại bị ảnh hưởng
của sự co f → khó tách cả 3 e nên số oxi hóa là +1 là bền,trong các dãy hc tạo
thành tồn tại cả muối Tali(III) và Tali(I)
11. Liên kết ba tâm hai điện tử và tính chất lí hoá học của các boran. Phương pháp điều chế boran.
Liên kết tam nhị hay còn gọi là liên kết 3 tâm 2 điện tử là một liên kết hóa học thiếu điện tử
(electron-deficient chemical bond) khi 2 nguyên tử hình thành liên kết có chung 2 electron. Để đơn
giản, người ta còn gọi liên kết này là liên kết 3c-2e (3-center 2-electron bond)
Vd: B2H6 : Hai electron trong liên kết H-B-H là minh họa cho liên kết 3c-2e.
Tính chất lí hoá học của các boran : BH3, B2H4, B3H5, B2H6 ,.. • Tính chất vật lí : -
ở to thường B2H6 và B4H10 là chất khí ,B5H9,B5H11, B6H10 là chất lỏng còn lại là chất rắn. -
Tính chất vật lí của các boran biến đổi đều đặn theo khối lượng phân tử: nhiệt độ
nóng chảy và nhiệt độ sôi tăng dần -
Tất cả các boran có mùi khó chịu và rất độc gây nhức đầu,nôn mửa. • Tính chất hóa học -
Các Boran là hợp chất kém bền và hoạt động về mặt hóa học,khi đun nóng chúng
phân hủy thành nguyên tố,ở nhiệt độ thấp hơn thì phân hủy thành các boran khác. -
Các boran tiếp xúc với không khí đều có thể bốc cháy với tốc độ khác nhau,phát nhiệt nhiều: B2H6 + 3O2 = B2O3 + H2O -
Boran tương tác mạnh với halogen B2H6 + 3 Cl2 = B2H5Cl + HCl
B2H6 + 6 Cl2 (dư)= BCl3 + 6 HCl -
Tất cả các boran đều bị nước và dung dịch kiềm phân hủy thành axit boric hay
muối borat và hiđro. Kém bền nhất với nước là điboran B2H6 + 6 H2O = 2H3BO3 + 6H2 -
Điboran có thể tương tác với nhiều hợp chất như hiđrua kim loại kiềm, cacbonmonooxit, amoniac,... -
Phương pháp điều chế boran.
• 6MgB2 + 12HCl = H2 + B4H10 + 6MgCl2 +8B
• 3NaBH4 + 4BF3 = 3NaBF4 + 2 B2H6
• Một số boran điều chế bằng phương pháp khác -
Điều chế B9H15 bằng cách đun nóng B5H11 khi có mặt urotropin -
Điều chế B10H16 bằng cách phóng điện êm qua hỗn hợp B5H9 và H2 -
Điều chế B20H16 bằng cách cho dòng điện một chiều 1700V phóng qua hỗn hợp B10H4 và H2
12. Cấu tạo tinh thể và tính chất lí, hoá học của axit boric. Tính chất lí hoá học và công
dụng của B2O3, Na2B4O7. Cách nhận biết các hợp chất của bo.
Cấu tạo tinh thể của axit boric (H3BO3)
• Cấu tạo nên bởi các lớp song song với nhau.Mỗi lớp gồm những phân tử H3BO3 liên kết
với nhau bằng liên kết H
• Trong các lớp, khoảng cách B-O là 1,37 Ao và O-O là 2,7 Ao
• Lớp này liên kết với lớp kia bằng lực van-de-van .Khoảng cách các lớp là 3,18 A0
Tinh thể axit boric có hình vẩy nhỏ , sờ vào thấy nhờn.
Tính chất lí của axit boric(H3BO3)
• Axit boric tan vừa phải trong nước,quá trình tan đó thu nhiệt nhiều cho nên độ tan của axit
tăng mạnh theo nhiệt độ → rất dễ kết tinh trong nước
• Bản thân axit boric không bay hơi nhưng khi đun nóng nó bay hơi cùng với hơi nước
• Khi đun nóng bị mất nước dần ở 100 0C biến thành axit metaboric H2BO2 ,ở nhiệt độ cao
hơn thì biến thành B2O3 . và ngược lại khi cho B2O3 kết hợp với nước.
Tính chất hóa học của axit boric(H3BO3)
• H3BO3 là axit một nấc,rất yếu yếu hơn H2CO3 H + 3BO3 + H2O ↔ [B(OH)4]- + H
• Khi trung hòa dung dịch axit boric trong nước bằng bazơ thu được các kiều muối borat khác nhau
4 H3BO3 + 2 NaOH = Na2B4O7 + 7 H2O
• Muối orthoborat được tạo nên khi nấu chảy axit boric với natri cacbonat
2 H3BO3 + 3 Na2CO3 = 2 Na3BO3 + 3 H2O + 3 H2O
• Muối orthoborat không thể tạo nên trong dung dịch vì bị thủy phân hoàn toàn
• Axit boric tương tác với rượu metylic , etylic khi có mặt H2SO4 đặc
H3BO3 + 3 CH3OH = B(OCH3)3 + 3H2O
• Axit boric được dùng để chế thủy tinh và men đồ sắt, còn được làm thuốc sát trùng trong y học.
Tính chất lí hoá học và công dụng của B2O3, Na2B4O7 B2O3 • Tính chất vật lí -
Oxit boric B2O3 có 2 dạng : dạng thủy tinh và dạng tinh thể. -
Dạng thủy tinh là chất ở dạng khối rắn không màu và dòn.khi đun nóng thì mềm
rồi tạo thành khối nhớt,có thể kéo sợi và hóa lỏng ở 600 oC -
Oxít boric nóng chảy ở 450 OC và sôi ở 2250 oC -
Hút ẩm mạnh và tan trong nước tạo thành axit boric B2O3 + 3 H2O = 2 H3BO3 • Tính chất hóa học -
Tan trong nước tạo axit boric, tỏa nhiệt -
ở trạng thái nóng chảy, B2O3 có thể hòa tan nhiều oxit kim loại tạo thành borat CaO + B2O3 = CaB2O4 -
oxit boric tác dụng với P4O10 khi đun nóng 2 B2O3 + P4O10 = 4 PBO4
• Công dụng : điều chế thủy tinh và men đồ sắt Borac (Na2B4O7.10H2O) • Tính chất vật lí -
Là chất dạng tinh thể , thuộc hệ tà phương,trong suốt, không màu -
Để trong không khí khô chúng bị vụn ra trên bề mặt vì bị mất bớt nước kết tinh -
Borac ít tan trong nước lạnh nhưng tan nhiều trong nước nóng nên rất dễ kết tinh lại từ dung dịch • Tính chất hóa học -
Tan trong nước, borac bị thủy phân
Na2B4O7 + 7 H2O = 4 H3BO3 + 2 NaOH -
Dung dịch borac có khả năng hấp thụ khá mạnh khí CO2 và khi đun nóng thì khí
CO2 lại được giải phóng. -
Borac khan nóng chảy có khả năng hòa tan oxit của các kim loại tạo thành muối borat
Na2B4O7 + CoO = NaBO2.Co(BO2)2 Màu xanh chàm
Na2B4O7 + Cr2O3 = 6NaBO2.2Cr(BO2)3 Màu lục
• Công dụng : dùng để điều chế thủy tinh quang học, men đồ sứ và đồ sắt và dùng để đánh
sạch kim loại trước khi hàn, chế bột giặt ...
Cách nhận biết các hợp chất của bo Sử dụng phản ứng :
H3BO3 + 3 CH3OH H2SO4đặc B(OCH3)3 Đốt ngọn lửa màu lục đậm (B2O3 +CO2+ H2O)
13. Các kim loại Be, Mg, và Al tác dụng như thế nào với dung dịch NaOH ? Viết phương
trình phản ứng. Tính chất lí, hóa học nhôm kim loại và phương pháp điều chế điều chế
nhôm kim loại từ quặng bôxit. Tại sao có thể dùng nhôm kim loại để điều chế một số kim
loại khác từ oxit của chúng.
Các kim loại Be, Mg, và Al tác dụng như thế nào với dung dịch NaOH ? Viết phương trình phản ứng
• Be và Al tan trong dung dịch NaOH
Be + 2 NaOH + 2 H2O = Na2[Be(OH)4] + H2
2Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2 • Mg tan ít rồi ngừng
Tính chất lí, hóa học nhôm kim loại và phương pháp điều chế điều chế nhôm kim
loại từ quặng bôxit. • Tính chất vật lí Al -
Là kim loại màu trắng bạc trong không khí có màu hơi xám. -
Có nhiệt độ sôi cao và nhiệt độ nóng chảy tương đối thấp. -
Al lỏng rất nhớt, độ nhớt giảm xuống do có thêm lượng nhỏ Mg hay Cu -
Ở nhiệt độ thường, Al tinh khiết khá mềm,dễ dát mỏng và dễ kéo sợi. -
Nhôm là kim loại dẫn điện, dẫn nhiệt tốt, rất nhẹ. -
Có khả năng tạo nên hợp kim với nhiều kim loại. • Tính chất hóa học -
Al là kim loại hoạt động. ở đk thường bề mặt nhôm được bao bọc bởi màng oxit rất
mỏng và bền làm cho nhôm trở nên kém hoạt động . -
Tác dụng với phi kim : Cl, Br ở nhiệt độ thường , I khi đun nóng, N,S,C ở nhiệt độ
khá cao .và không tương tác với H 2Al + 3/2 O2 = Al2O3 -
Phản ứng nhiệt nhôm để điều chế KL khó bị khử và khó nóng chảy như Cr,Fe,Mn, Ni, Ti, Zr, V -
Với hợp chất : có thể tác dụng với H2O, dung dịch kiềm, axit ( Al thụ động với
HNO3 và H2SO4 đặc nguội )
• Phương pháp điều chế từ quặng bôxit -
Bôxit (Al2O3.xH2O) có chứa tạp chất như Fe2O3, SiO2, CaO cần tinh chế bằng cách
đun nóng bột bôxit nghiền với NaOH 40% trong nồi áp suất ở nhiệt độ 150 oC và
áp suất 5-6 atm. Nhôm oxit tan trong dung dịch kiềm
Al2O3 + 2 NaOH + 3 H2O = 2 Na[Al(OH)4] -
Lọc lấy dung dịch và dùng nước pha loãng ,kết tủa Al(OH)3 sẽ lắng xuống Na[Al(OH)4] = Al(OH)3 + NaOH -
Lọc lấy kết tủa và nung ở nhiệt độ 1200 – 1400 oC sẽ thu được Al2O3 tinh khiết. 2Al(OH)3 = Al2O3 + 3 H2O -
Điện phân nóng chảy Al2O3 thu được Al Al2O3 = 2Al + 3/2 O2
Tại sao có thể dùng nhôm kim loại để điều chế một số kim loại khác từ oxit của chúng.
Do có ái lực lớn với oxi, nhôm là chất khử mạnh, ở nhiệt độ cao nhôm khử dễ dàng nhiều oxit kim
loại đến kim loại tự do
Chương V- Các nguyên tố nhóm IVA
Cacbon(C) – Silic(Si) – Gecmani(Ge) – Thiếc(Sn) – Chì(Pb)
14. Sự biến đổi tính chất của các nguyên tố nhóm IVA. Giải thích.
• tính kim loại của các nguyên tố mạnh dần đồng thời tính phi kim yếu dần. Từ C → Pb
Giải thích: theo chiều từ trên xuống dưới, điện tích hạt nhân tăng nhưng đồng thời số lớp electron
của các nguyên tử cũng tăng làm cho bán kính nguyên tử của các nguyên tố tăng nhanh và chiếm
ưu thế nên khả năng dễ nhường electron của các nguyên tố tăng lên, đồng thời khả năng thu electron giảm dần.
• Năng lượng ion hóa giảm dần từ C → Pb
Giải thích : theo chiều tăng của điện tích hạt nhân, khoảng cách giữa electron lớp ngoài cùng đến
hạt nhân tăng, lực liên kết giữa electron lớp ngoài cùng và hạt nhân giảm, do đó năng lượng ion hóa nói chung giảm.
15. Kiến trúc tinh thể và tính chất lí, hóa học của các dạng thù hình của cacbon: kim cương và than chì. Kim cương • Kiến trúc tinh thể -
Tinh thể kim cương thuộc hệ lập phương



