

Preview text:
1. Giới thiệu
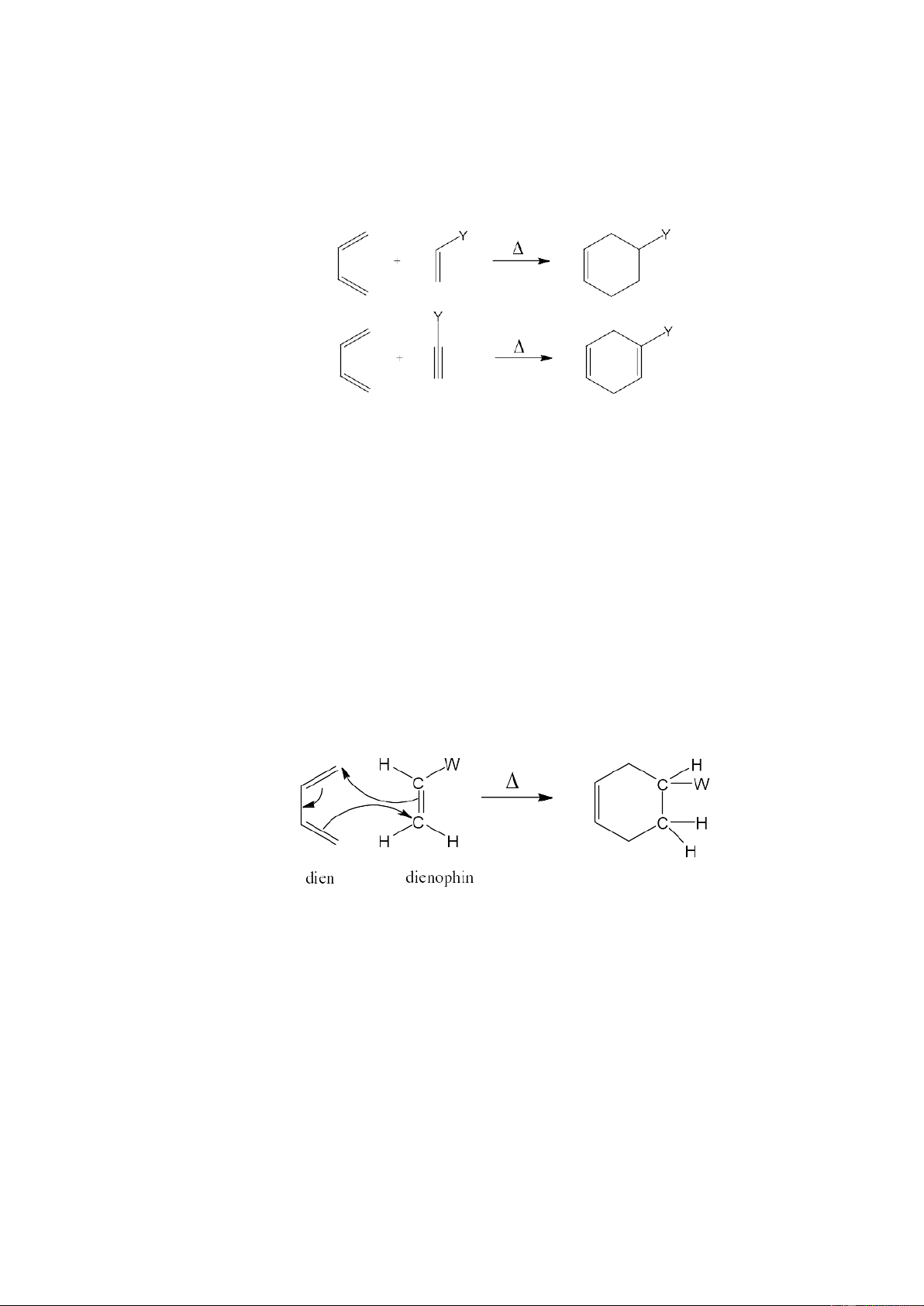
Phản ứng Diels-Alder được gọi là phản ứng cộng đóng vòng 1,4 [4+2] vì sản
phẩm vòng được tạo ra bởi tương tác của 4 electron pi (dien) và 2 electron pi
(dienophin) của anken hay ankin.
Khi một anken hay ankin “nghèo” electron có thiên hướng phản ứng với một
dien, nó được gọi là dienophin, còn thành phần chứa hai liên kết đôi liên hợp được gọi là thành phần dien.
Phản ứng Diels-Alder cũng giống như phản ứng nucleophin-electrophin. Các
dien là những chất “giàu” electron, còn các dienophin là những chất “nghèo” electron.
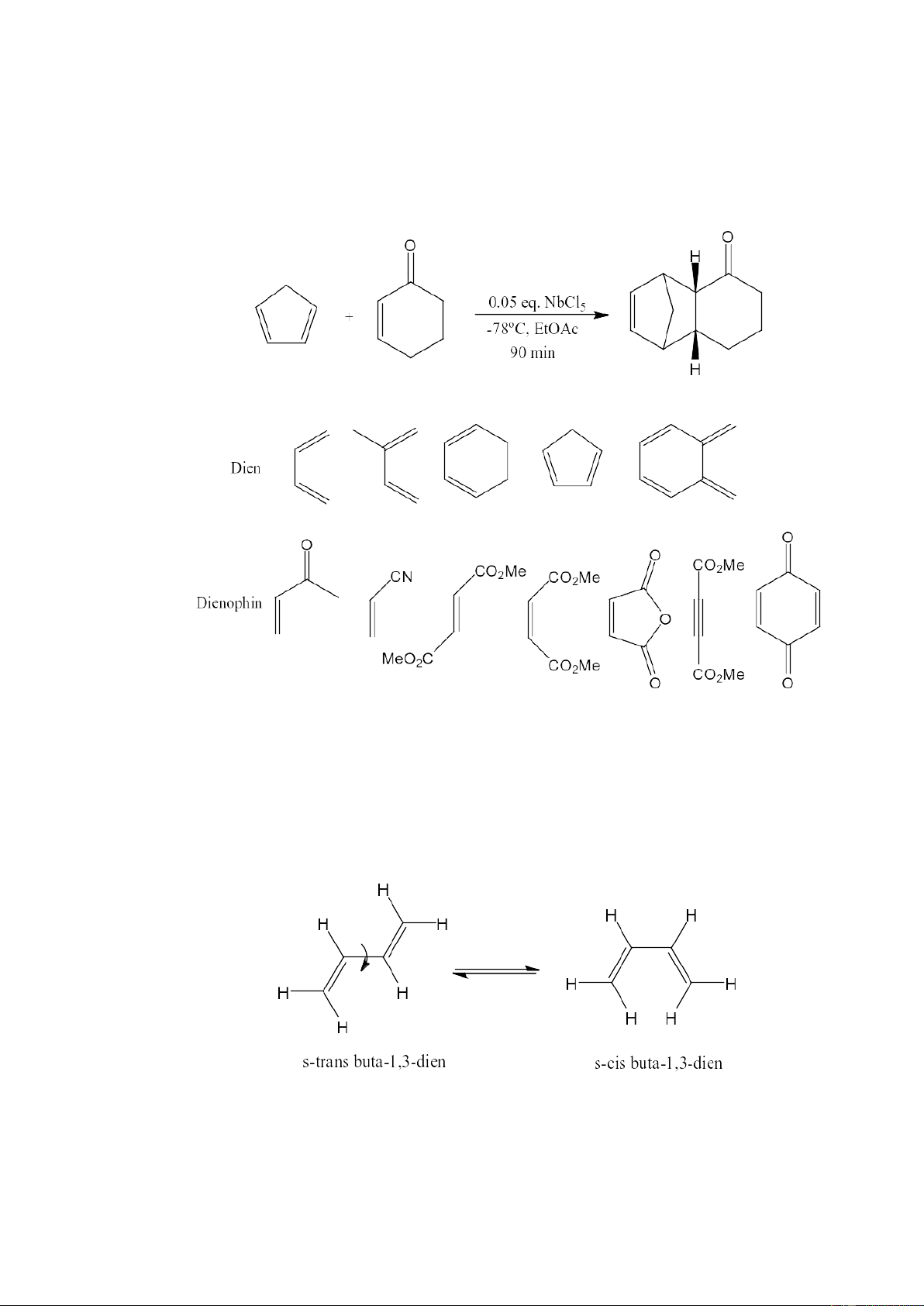
Một dien đơn giản là buta-1,3-dien. Sự có mặt của nhóm ankyl hay alkoxy (-OR) có
thể làm tăng khả năng phản ứng của dien. Các anken và ankin (dienophin) đơn giản là
eten và etin. Một dienophin thông thường có một hay nhiều nhóm thế hút electron
(-W) nhằm hút mật độ electron ra xa liên kết pi, (-W) có thể là nhóm cacbonyl chứa
(C=O) hay nhóm cyano (-C≡N):
Thành phần dien trong phản ứng Diels-Alder có thể là mạch hở hay vòng, cũng
có thể là một số các nhóm thế nhưng phải nằm trong giới hạn: Các dien phải tồn tại
trong cấu dạng s-cis. Nếu các nhóm thế lớn hơn hydro thì sự cản trở về mặt không
gian có thể ảnh hưởng đến độ bền của cấu dạng. Đặc biệt, các dien vòng có cấu
dạng s-cis tham gia phản ứng Diels-Alder, các dien như vậy được gọi là
Danishefsky’s dien (vd: cyclopentadien). Trong khi đó các dien vòng có cấu dạng s-
trans sẽ không tham gia phản ứng Diels-Alder. Hợp chất vòng benzen hiếm khi trải
qua phản ứng Diels-Alder và thường phải có dienophin hoạt tính cao. Các dienophin 1
có nhóm hút điện tử liên hợp gắn vào anken hay ankin. Nhưng đặc điểm này không
phải là riêng biệt của dienophin Diels-Alder. Có thể có nhiều hơn sự liên hợp, ít nhất
một nhóm phenyl hay nguyên tử clo. Dienophin có thể được hoạt hóa nhờ axit lewis (như NbCl5). Một số dien và dienophin
2. Cơ chế phản ứng Diels-Alder
Trong quá trình nghiên cứu, Alder đã rút ra các nguyên tắc về lập thể của phản
ứng - “Nguyên tắc Alder”
1) Chỉ các dien có cấu dạng cis mới có thể tham gia được vào phản ứng Diels-
Alder, còn cấu dạng trans không tham gia được phản ứng này
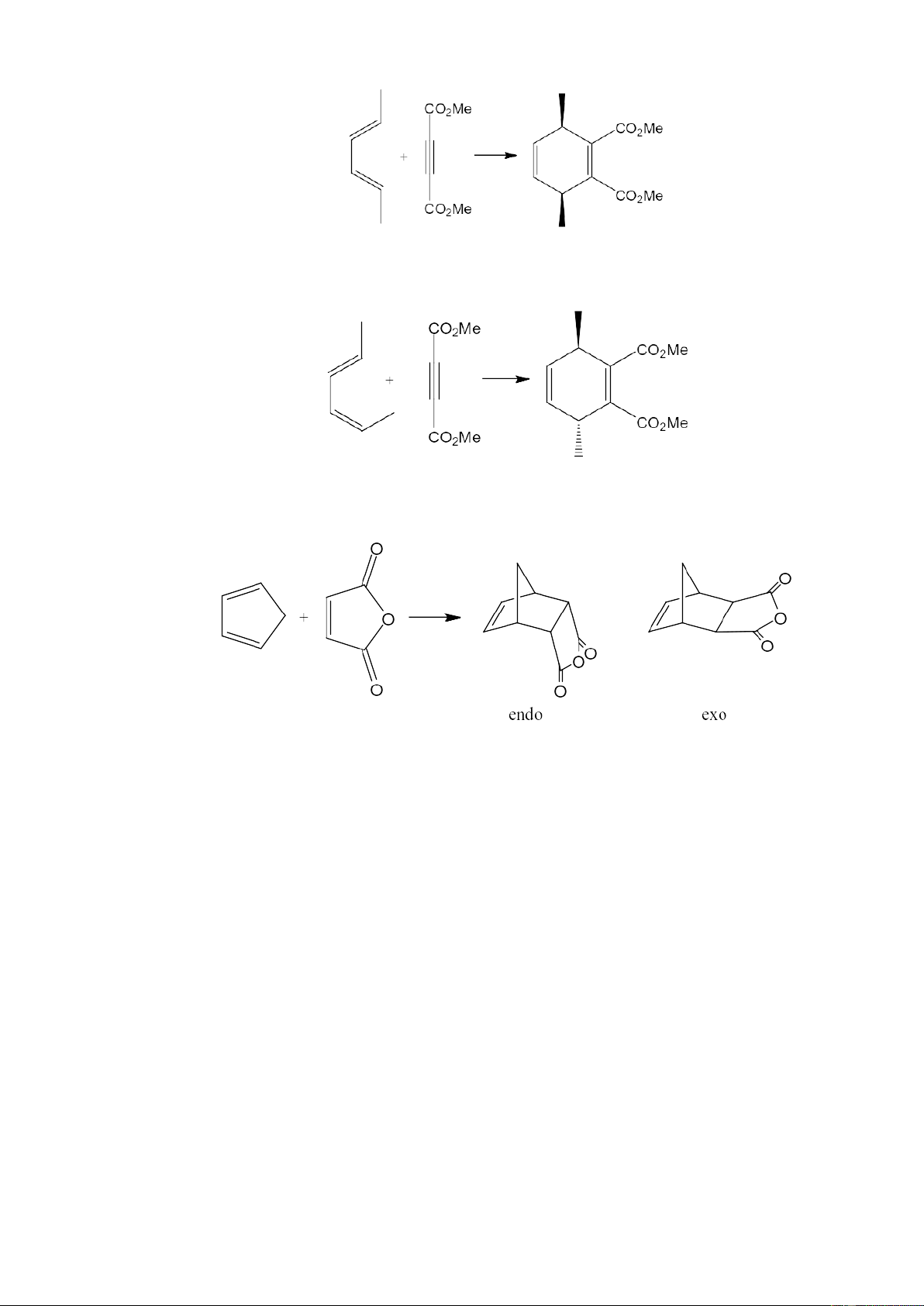
2) Sản phẩm của phản ứng cộng Diels-Alder luôn có cấu trúc dạng “endo”, nghĩa
là các nhóm thế của dienophin luôn hướng về phía liên kết đôi mới tạo ra. Ngược
hướng với “endo” là dạng “exo”, khi nối đôi mới hình thành nằm xa các nhóm thế: 2
Trạng thái chuyển tiếp dạng ENDO Sản phẩm ENDO (Ưu tiên)
Trạng thái chuyển tiếp dạng EXO Sản phẩm EXO (Không ưu tiên)
3) Trong sản phẩm cộng hợp các nhóm thế, các thành phần dienophin luôn giữ
nguyên dạng ban đầu mà nó đã có trong nguyên liệu, nếu nguyên liệu ban đầu có các
nhóm thế ở dạng trans hoặc cis thì trong sản phẩm cũng ở vị trí đó.
4) Các nhóm thế đẩy điện tử làm tăng khả năng phản ứng của thành phần dien,
còn các nhóm thế hút điện tử lại làm tăng khả năng phản ứng của thành phần
dienophin. Điều này cũng giải thích vì sao trong thành phần dienophile luôn có chứa ít
nhất một nhóm thế hút điện tử. 5) Chọn lọc lập thể
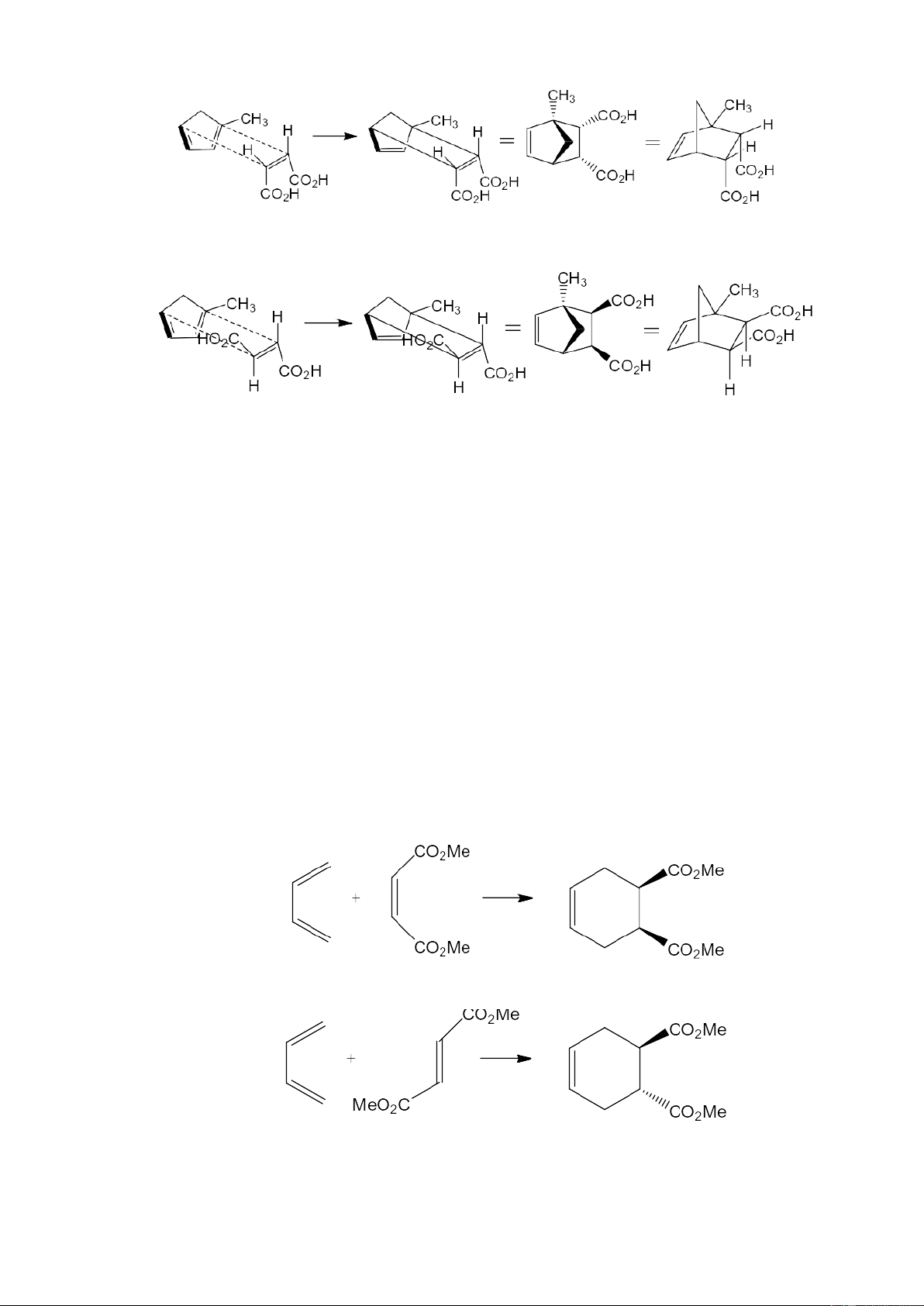
Phản ứng Diels-Alder có tính đặc thù lập thể (stereospecific) với cả dien lẫn dienophin
- Cis-dienophin cho nhóm thế cis ở sản phẩm
- Trans-dienophin cho nhóm thế trans ở sản phẩm
- Nếu nhóm thế ở dien có cùng hóa lập thể, thì 2 nhóm này nằm cùng phía ở sản phẩm 3
- Nếu nhóm thế ở dien không cùng hóa lập thể, thì 2 nhóm này nằm khác phía ở sản phẩm
- Dien vòng có thể cho sản phẩm đồng phân lập thể tùy thuộc vào dienophin hay dien
3. Các yếu tố ảnh hưởng đến phản ứng
Các yếu tố thường ảnh hưởng tới phản ứng là xúc tác, dung môi, nhiệt độ, tỷ lệ
mol giữa các chất tham gia phản ứng. 3.1. Xúc tác
Xúc tác axit Lewis có tác động mạnh đến hệ phản ứng cả về tốc độ lẫn chọn lọc
lập thể hơn là hệ không có xúc tác.
Ví dụ về khả năng chọn lọc vùng khi có mặt xúc tác axit Lewis, đó là phản ứng
của piperylen và metyl acrylat, sản phẩm chính ở vị trí ortho 4 Có mặt AlCl3 90% 10% Không có AlCl3 98% 2%
Một ví dụ khác mô tả tác dụng tăng tính chọn lọc lập thể, đó là phản ứng của
cyclopentadien và metyl acrylat Không có AlCl3 ở 0oC 88% 12% Có mặt AlCl3 ở 0oC 96% 4% Có mặt AlCl3 ở -80oC 99% 1% 3.2. Dung môi
Các dung môi được sử dụng trong phản ứng Diels-Alder thường là dung môi trơ,
với vai trò làm chất pha loãng, mặt khác, với độ sôi của dung môi có thể điều khiển
được nhiệt độ phản ứng. Các dung môi thường hay được dung là ete dầu hoả, hexan,
benzin (xăng), benzen, ligroin, clobezen toluen, ete, xylem, etyl axetat, nitrobenzen,
đôi khi cả nhũ tương trong nước.
3.3. Nhiệt độ
Thông thường phản ứng khởi đầu trong khoảng 30 đến 50oC và sau đó với nhiệt
độ toả ra của phản ứng, phản ứng tiếp tục cho đến khi kết thúc. Có một số trường hợp
nhiệt độ khơi mào của phản ứng cần cao hơn (từ 50 đến 250oC) trên nhiệt độ sôi của
các dung môi. Trường hợp các tác nhân có nhiệt độ sôi thấp phải tiến hành phản ứng
trong thiết bị kín chịu áp lực.
3.4. Tỷ lệ mol
Phần lớn trong các phản ứng dùng thừa thành phần dienophin, đối với các chất dễ
phản ứng thường được sử dụng theo tỷ lệ dien/dienophin bằng 1/1.
4. So sánh khả năng phản ứng của các dien và dienophin
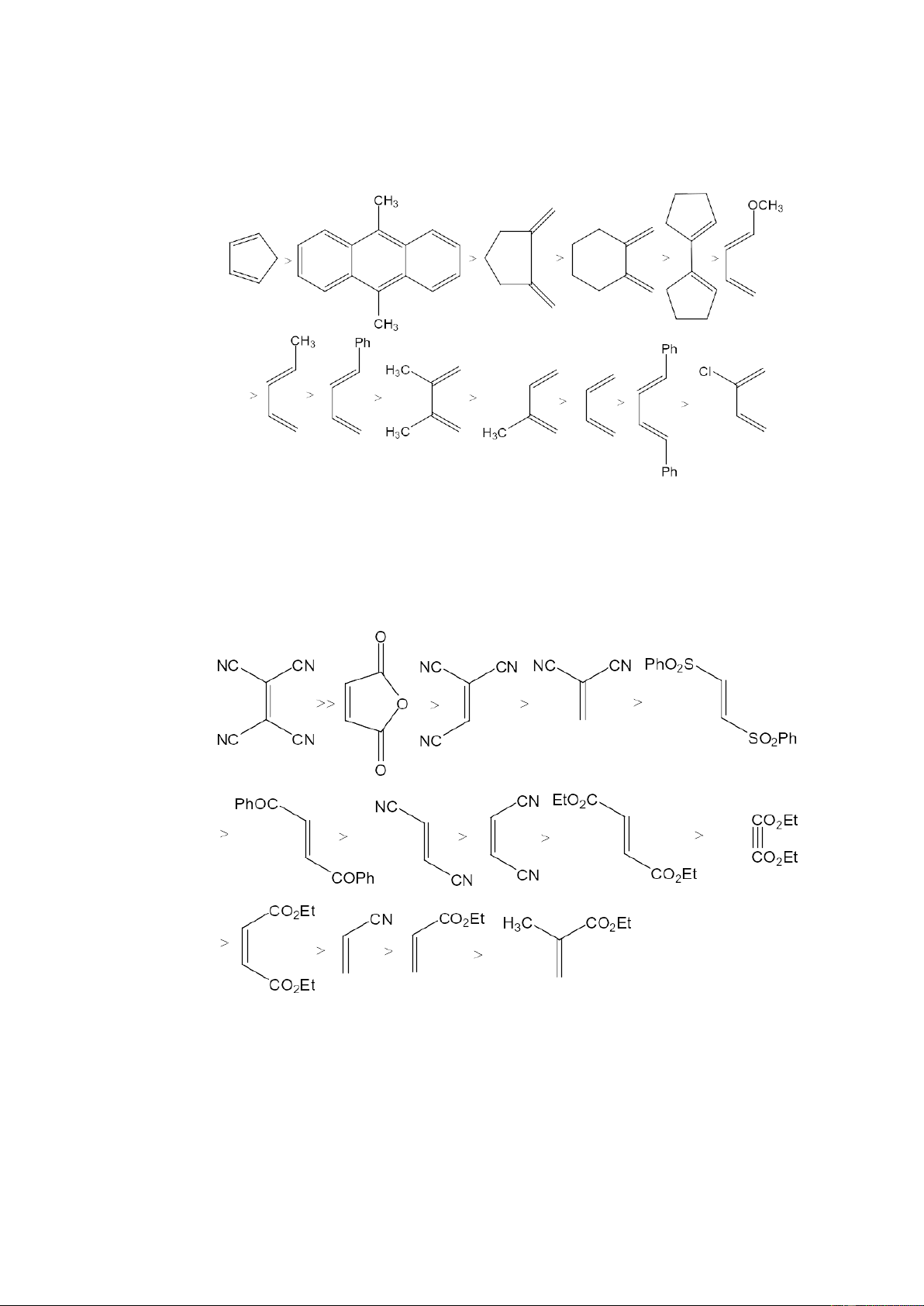
4.1. Khả năng phản ứng của các dien 5
Để so sánh khả năng phản ứng của các dien, người ta thường đo bằng việc cho
phản ứng với hai tác nhân dienophin mạnh nhất đó là anhydrit maleic và tetraxyan
etylen và sau đây là trình tự xếp hạng khả năng phản ứng của các dien:
4.2. Khả năng phản ứng của các dienophin
Khả năng phản ứng của các dienophin được đo bằng cách cho phản ứng với 2
dien mạnh là xiclopentadien và 9, 10-dimetyl antraxen. Sau đây là trình tự xếp hạng
khả năng phản ứng của các dienophin:
Ngoài các etylen thế thì tác dụng của các nhóm thế khác nhau tuân theo trình tự sau:
-COCl >> -SO2Ar >-COAr > -COCH3 > -CN > - CO2R > -Ph
5. Phạm vi ứng dụng
Phản ứng Diels – Alder được sử dụng khá phổ biến trong tổng hớp hữu cơ, đặc 6
biệt là trong lĩnh vực tổng hợp các hợp chất thiên nhiên. Có hàng ngàn phản ứng đóng
vòng, ghép vòng đã được nghiên cứu. Sau đây là một vài ví dụ cơ bản:
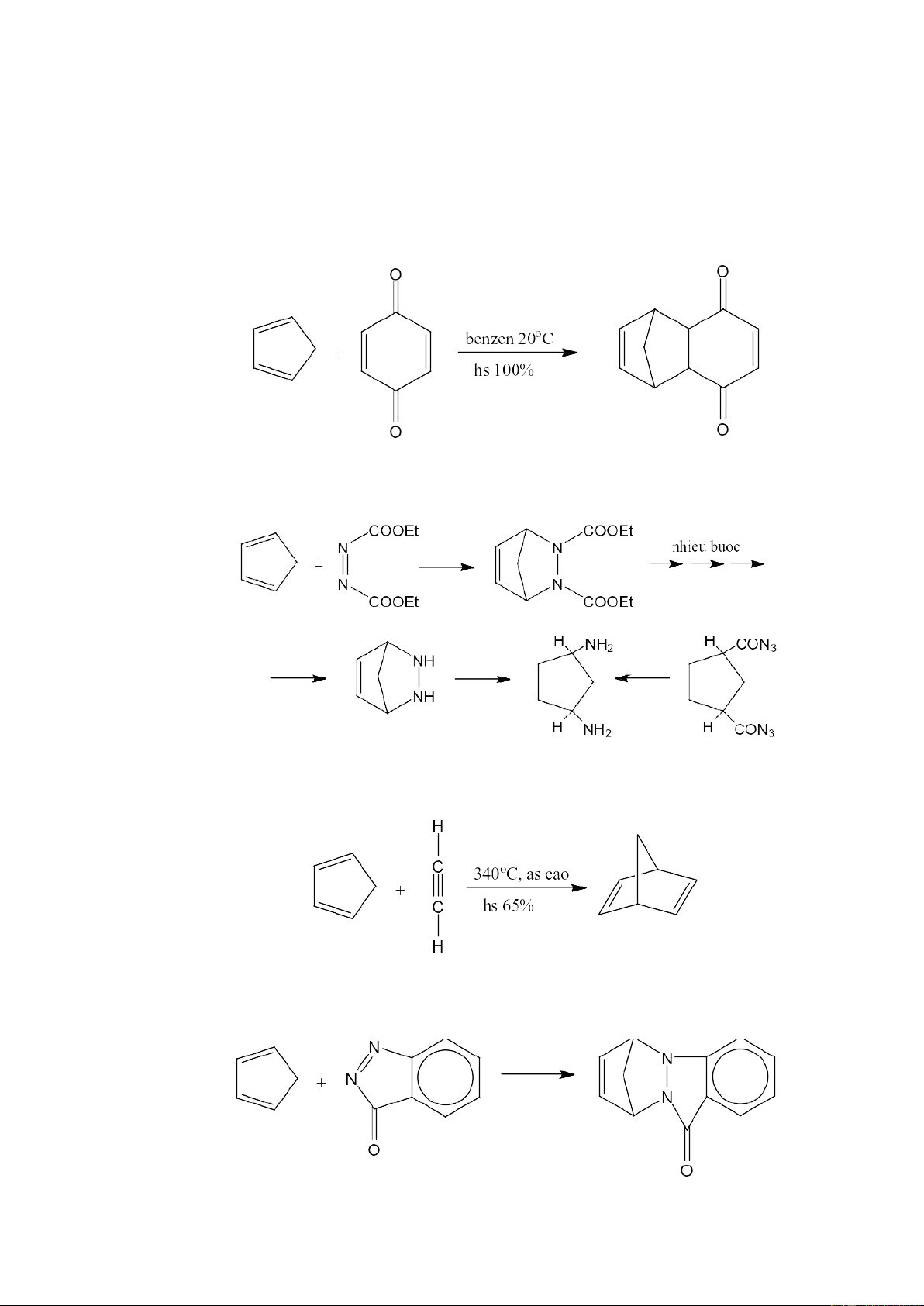
Phản ứng đầu tiên được nghiên cứu năm 1928, là phản ứng đóng vòng giữa
xyclo pentadien và benzoquinon. Đây là phản ứng Diels–Alder điển hình, trong thành
phần dienophin có nhóm hút điện tử liên hợp.
Xyclopentadien cũng phản ứng được với este azo-dicacbonxylic, phản ứng được
sử dụng trong quá trình điều chế diaminoxyclopentan
Để điều chế những hợp chất đa vòng, cho xyclopentadien tác dụng với axetylen ở
điều kiện nhiệt độ và áp suất cao:
Các dẫn xuất azo đóng vai trò như một dienophin khi phản ứng với xyclopentadien: 7
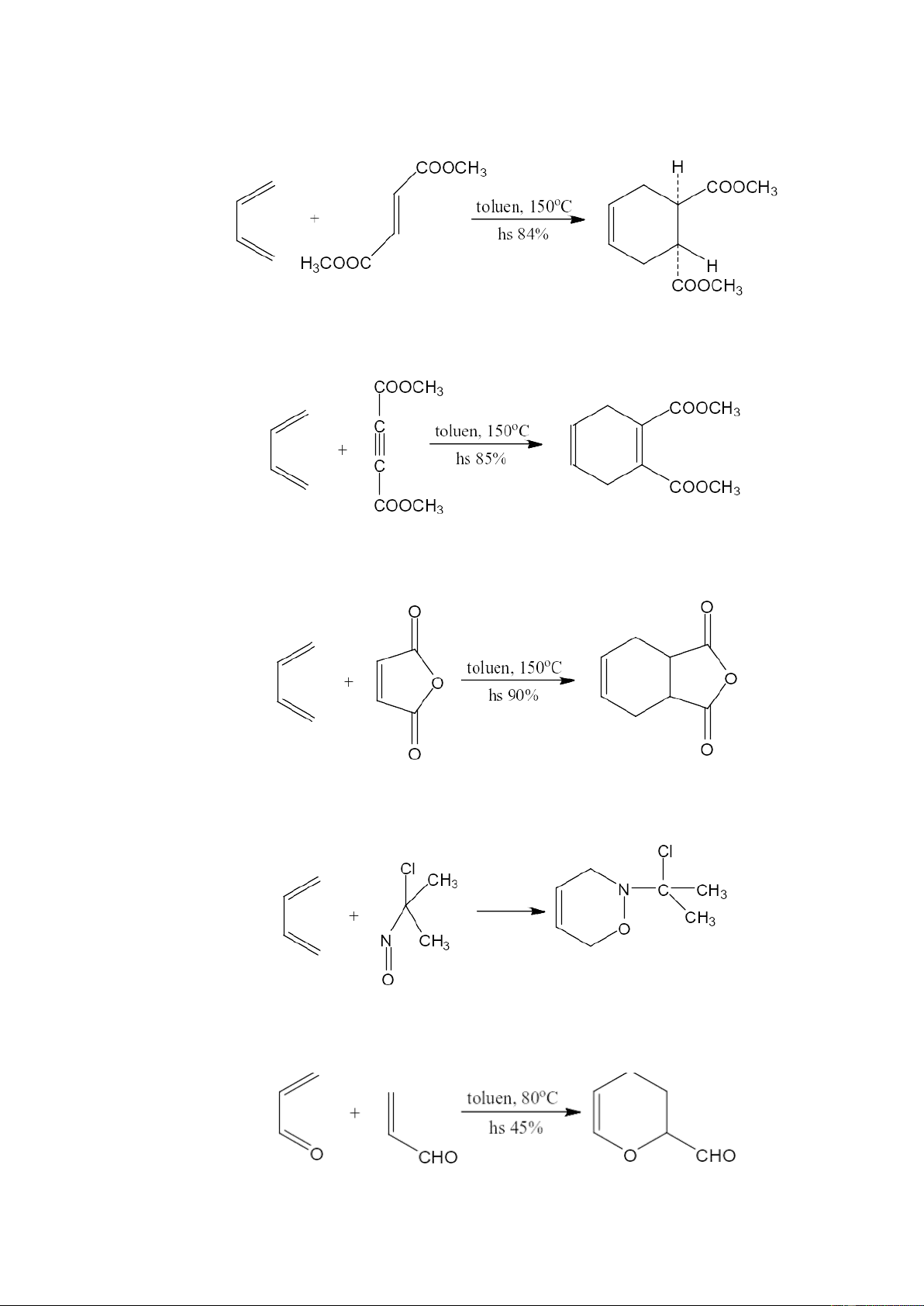
Các dien mạch thẳng tác dụng với dẫn xuất của axit fumaric (tuân theo quy tắc s-
cis) để được các dẫn xuất của xyclohexan:
Các dien mạch thẳng tác dụng với dẫn xuất axetylen để được các dẫn xuất của xyclohexadien:
Các dẫn xuất của butadien tác dụng với anhydrit maleic để cho các anhydrit tetrahydrophtalic:
Ngoài ra các nitrozo cũng phản ứng được với butadien như là một tác nhân dienophin:
Cũng tương tự như butadien, hai phân tử acrolein phản ứng với nhau (vửa đóng
vai trò dien lẫn dienophin) để tạo thành dẫn xuất vòng pyran: 8
TÀI LIỆU THAM KHẢO
1. Phan Đình Châu, Các quá trình cơ bản tổng hợp hóa dược, NXB Khoa học và kỹ thuật.
2. Đào Hùng Cường (2009), Đại cương hóa hữu cơ, NXB KHKT- Hà Nội.
3. Đào Hùng Cường (2007), Cơ sở hóa học hữu cơ, NXB Đà Nẵng.
4. TrịnhThanh Đoan, Nguyễn Đăng Quang, Hoàng Trọng Yêm (1992), Hóa hữu cơ, NXB Giáo dục.
5. Đặng Như Tại (1998), Cơ sở hóa học lập thể, NXB Giáo dục Hà Nội.
6. Nguyễn Minh Thảo, Tổng hợp hữu cơ, NXB Đại học Quốc gia Hà Nội. 9




