


Preview text:
LỜI MỞ ĐẦU
Khoa học cơ bản được xem là tiền đề cho sự phát triển kinh tế - xã hội của một
quốc gia. Do đó, việc xây dựng, bồi dưỡng nguồn nhân lực giỏi chuyên môn khoa học
đóng vai trò quan trọng cho sự phát triển bền vững lâu dài. Không chỉ dừng lại ở việc
đảm bảo về số lượng mà cái cốt lõi là chất lượng trình độ chuyên môn phải được nâng
cao cải thiện liên tục. Nhiều giải pháp được đưa ra nhằm rút ngắn được thời gian đào
tạo nguồn cán bộ chất lượng cao, trong đó giải pháp quan trọng nhất là đào tạo nguồn
nhân lực ngay trên ghế nhà trường thông qua việc bồi dưỡng học sinh giỏi.
Hóa học là một nhánh của khoa học tự nhiên chỉ mới phát triển từ thế kỉ 19
nhưng sự ảnh hưởng của nó lên đời sống, các ngành khoa học khác và nhất là trong
công nghiệp lại vô cùng to lớn. Đăc biệt, lĩnh vưc tổng hợp của Hóa học Hữu cơ đã
giúp tạo ra nhiều nguyên liệu đầu vào cho những ngành khoa học khác. Không chỉ
vậy, đây là hướng đi mới trong giải pháp tìm năng lượng thay thế trước sự cạn kiệt
ngày càng tăng của các nguồn năng lượng hóa thạch.
Việc đầu tư vào giáo dục ở bậc trung học phổ thông, nhất là ở khâu tổ chức bồi
dưỡng học sinh giỏi sẽ tạo ra động lực cho sự phát triển một đội ngũ cán bộ giỏi
chuyên môn. Riêng với bộ môn Hóa học, là một ngành có nhiều ứng dụng trong đời
sống, cần phải bồi dưỡng thêm những kiến thức sâu về mặt cơ chế, nhằm tạo cơ sở cho
khả năng sáng tạo, ứng dụng của các em học sinh sau này. Trong phạm vi bài tiểu
luận, em xin trình bày: ‘‘Phản ứng giảm mạch hợp chất hidrocacbon‘‘ một trong
những bước quan trọng của quá trình tổng hợp hóa hữu cơ, nhằm giúp cho các em học
sinh có được kiến thức cơ sở ứng dụng vào các quá trình tổng hợp. 1 NỘI DUNG
1. Phản ứng nhiệt phân và cracking của ankan
Các ankan tương đối bền vững với nhiệt cho tới khoảng 300÷4000C (metan có
thể bền tới 9000C). Trên khoảng nhiệt độ này, các liên kết C―C trong phân tử có thể
bị bẻ gãy tạo thành những phân tử nhỏ hơn. Ở 10000C, các ankan bị phân huỷ thành C và H.
Tuỳ thuộc vào nhiệt độ phản ứng ta phân biệt: phản ứng nhiệt phân (trên 6500C)
và phản ứng cracking (dưới 6500C).
Ở nhiệt độ cao không có oxy không khí, các phân tử ankan bị phân hủy hoặc bẽ
gãy mạch cacbon tạo thành ankan và các hydrocacbon chưa no có mạch cacbon ngắn
hơn. Quá trình đó gọi là quá trình cracking. CnH2n+2 → CxH2x+2 + CyH2y ( n= x+y)
Cracking (crack: bẻ gãy) có 2 phương pháp: cracking nhiệt và cracking xúc tác:
+ Cracking nhiệt: tiến hành trong pha khí ở nhiệt độ 6000C dưới áp suất thường
hoặc trong pha lỏng ở 5500C và áp suất vài chục atmostphere. Sản phẩm là hỗn hợp
các ankan và anken có mạch ngắn hơn do nhiều phản ứng xảy ra nối tiếp nhau hoặc xảy ra đồng thời.
Ví dụ: Cracking nhiệt hecxađecan C16H34: C → 16H34 C8H18 + C8H16 C8H18 → C4H10 + C4H8 C4H10 → C2H6 + C2H4 C4H10 → H2 + C4H8
Với metan, khi không có xúc tác có thể bền tới nhiệt độ 9000C. Khi có xúc tác,
ở nhiệt độ này xảy ra phản ứng:
+ Cracking xúc tác: có thể tiến hành ở nhiệt độ thấp hơn cracking nhiệt
(450÷5000C) vận tốc phản ứng nhanh hơn và sản phẩm tốt hơn (xăng). Xúc tác thường
dùng: các loại nhôm silicat thiên nhiên hoặc tổng hợp như zeôlithe hoặc aluminosilicat. 2
Trong phản ứng craking xúc tác, bên cạnh phản ứng bẻ gãy mạch còn xảy ra sự
đồng phân hoá chuyển các hiđrocacbon mạch thẳng thành cấu tạo phân nhánh.
Sản phẩm thu được có lượng hiđrocacbon chưa no ít hơn cracking nhiệt.
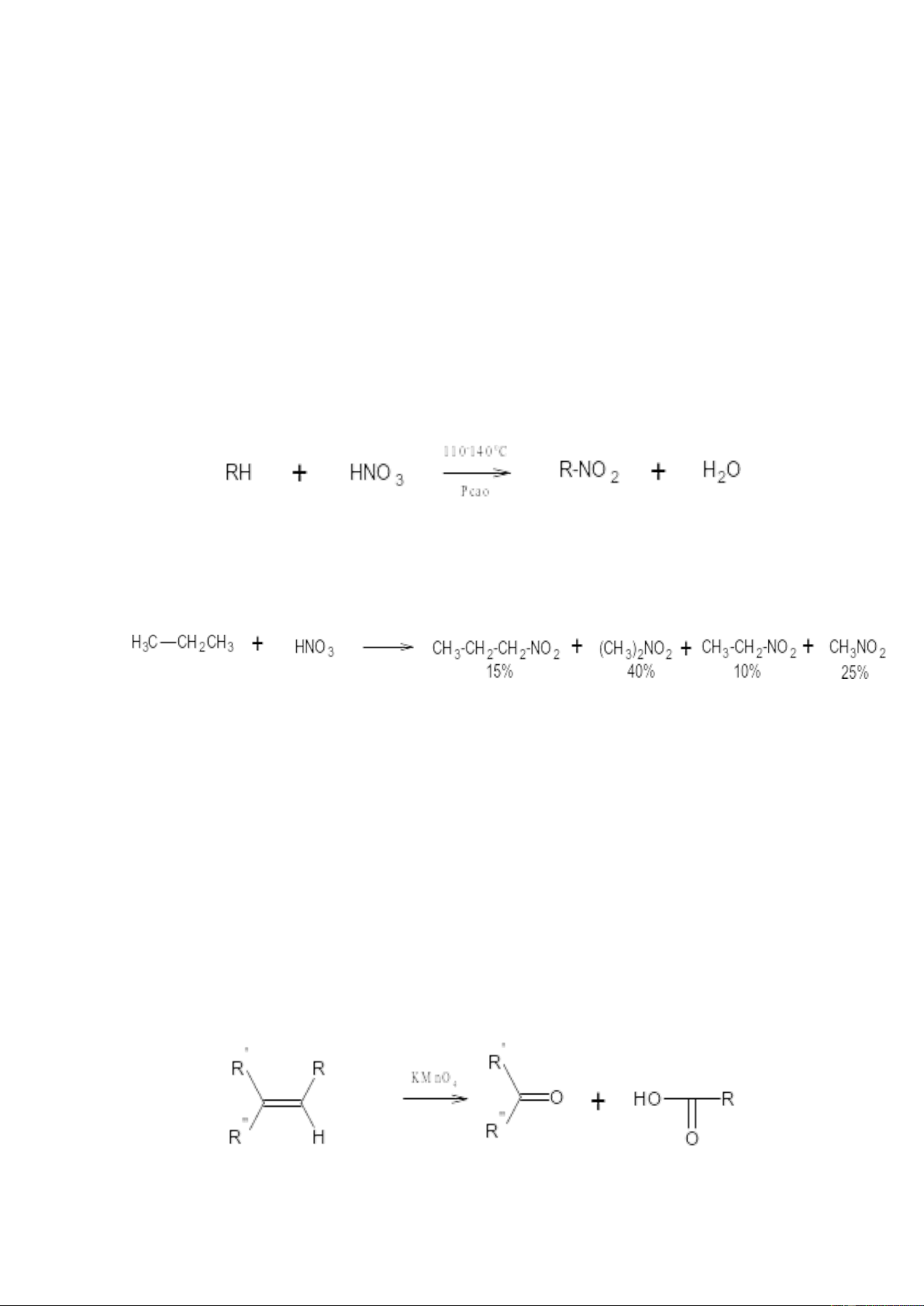
2. Phản ứng nitro hoá ankan
Phản ứng nitro hóa là phản ứng thế nguyên tử hydro của ankan bằng gốc NO2•.
Ankan không phản ứng với axit nitric đặc ở nhiệt độ thường, khi nâng nhiệt độ lên,
HNO3 đặc sẽ oxy hoá chậm các ankan bẽ gãy liên kết C―C và cho sản phẩm chính là các axit cacboxylic.
Tuy nhiên, dùng axit nitric loãng và tiến hành phản ứng ở nhệt độ cao, áp suất
cao thì có thể nitro hoá được ankan:
Phản ứng cũng xảy ra theo cơ chế gốc thường kèm theo sản phẩm oxy hoá cắt
mạch, do đó ngoài sản phẩm thế giữ nguyên mạch cacbon còn có sản phẩm mạch ngắn hơn.
3. Phản ứng oxi hóa anken
Các hiđrocacbon chứa liên kết đôi nhạy cảm hơn nhiều đối với các chất oxy hoá
so với các hiđrocacbon no. Điều kiện tiến hành phản ứng oxy hoá rất khác nhau, sản
phẩm phản ứng cũng khác nhau, tuỳ theo điều kiện tiến hành phản ứng và đặc tính của
tác nhân.Anken bị oxi hóa bởi các chất oxi hóa khác nhau.
3.1. Với kali permanganate KMnO4
Anken tác dụng mạnh với kali permanganate KMnO4. Sản phẩm tạo thành phụ
thuộc vào nồng độ của các chất phản ứng. Với dung dịch kali permanganate loãng thì
tạo thành điol cạnh nhat (glycol). Với dung dịch KMnO4 đậm đặc, liên kết đôi bị cắt và
tạo hỗn hợp xeton và axit carboxylic. 3
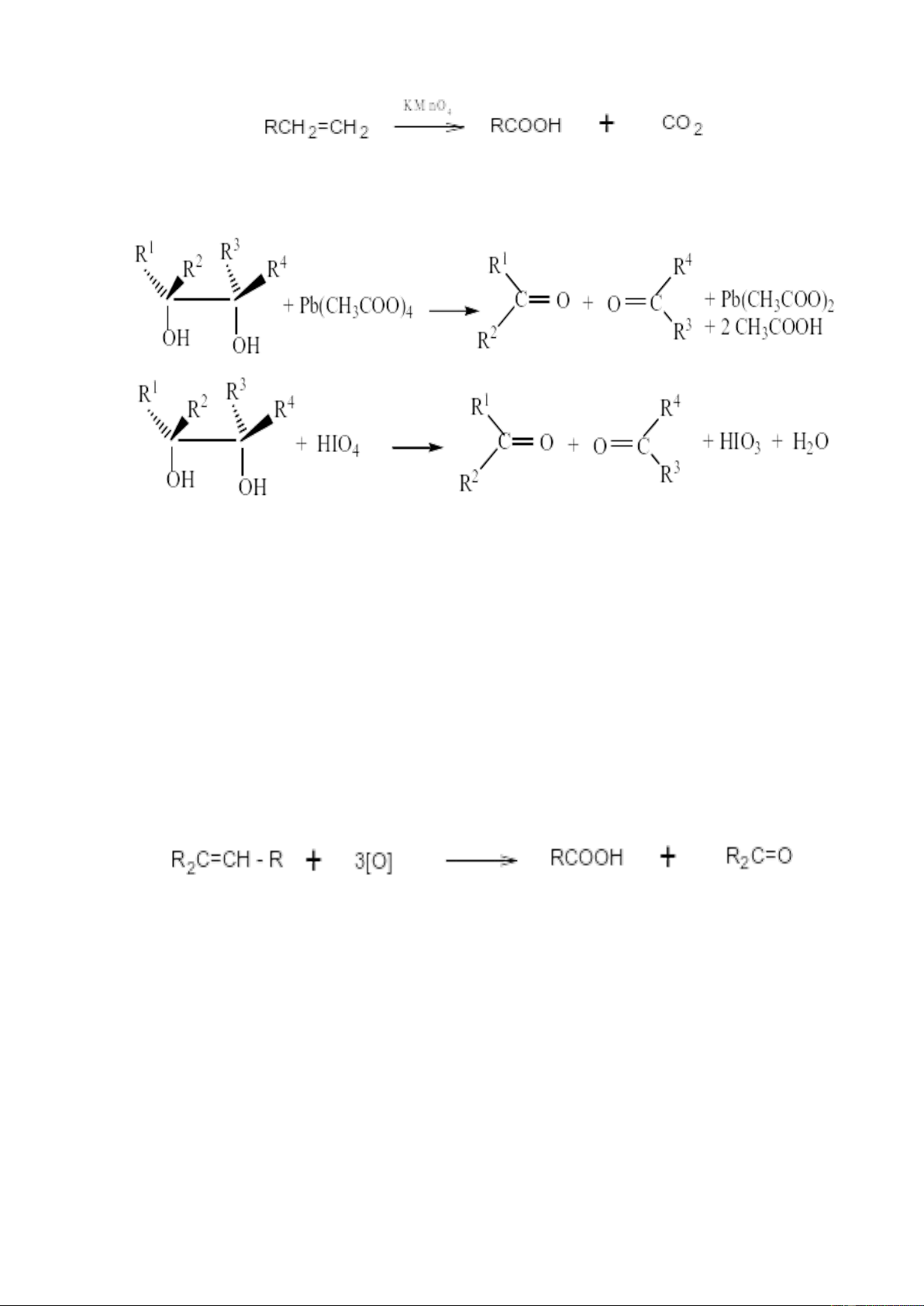
Phản ứng oxi hóa cắt mạch còn xảy ra khi hidroxyl hóa anken thành cis – diol
bằng dung dịch KMnO4(lạnh) và oxi hóa tiếp bởi Pb(CH3COO)4 hay NaIO4(HIO4):
Phản ứng oxy hoá các hợp chất olephin thường tạo thành các sản phẩm chứa
oxy là ancol hoặc andehyt tuỳ thuộc vào tác nhân oxy hóa.
3.2. Với axit cromic
Axit cromic được sử dụng rộng rãi để oxi hoá liên kết đôi hoặc dưới dạng dung
dịch Cr2O3 trong axit aetic đậm đặc có mặt H2SO4 hoặc không, hoặc dưới dạng dung
dịch natri hoặc kali bicromat. Phản ứng bẻ gãy liên kết đôi tạo ra xeton hoặc axit
cacboxilic. Sự tạo thành xeton chứng tỏ sự có mặt nhóm R2C=, còn sự tạo thành axit
cacboxilic chứng tỏ sự có mặt của nhóm R―CH=:
Nhờ phản ứng này có thể xác định vị trí của liên kết đôi trong anken.
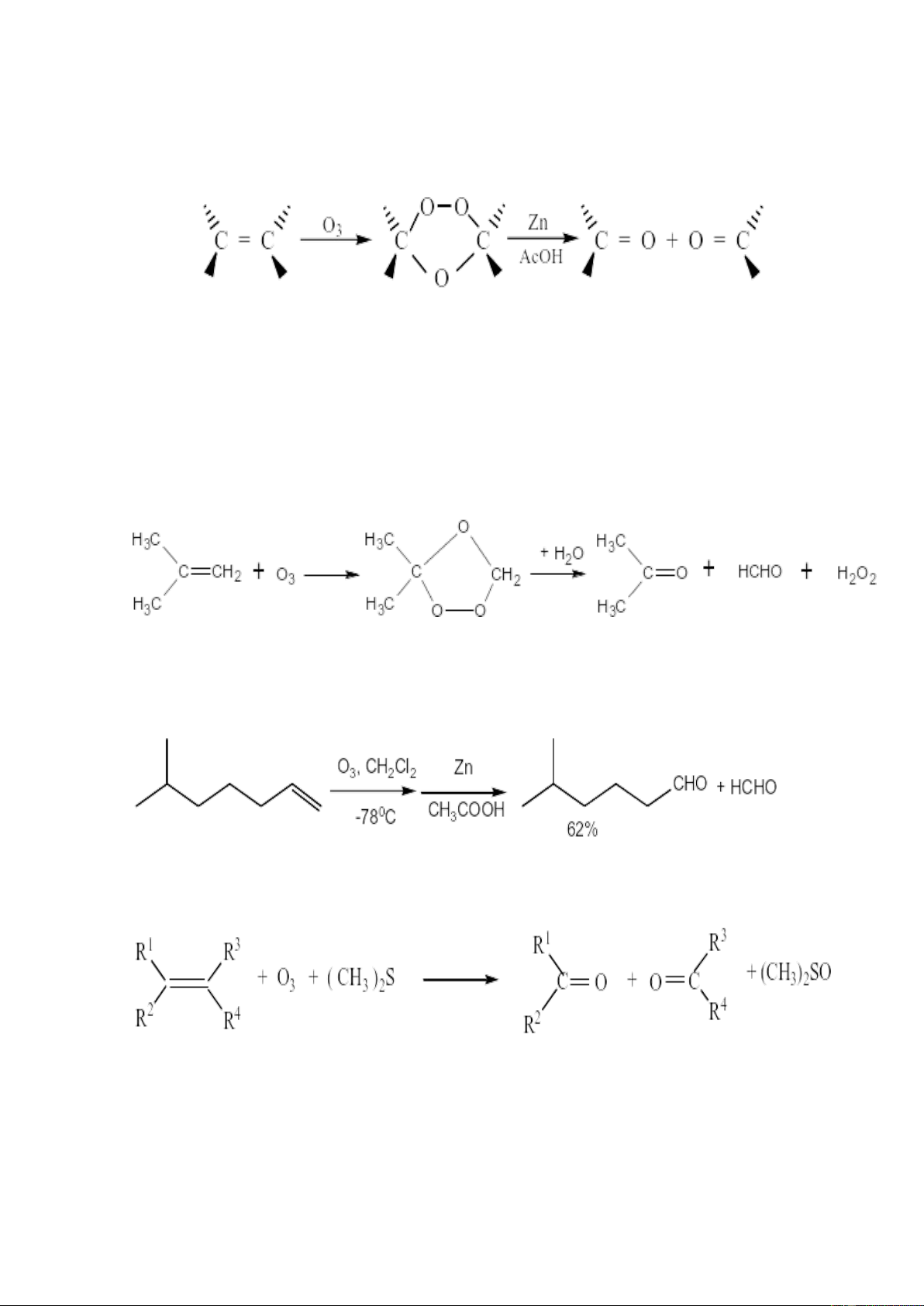
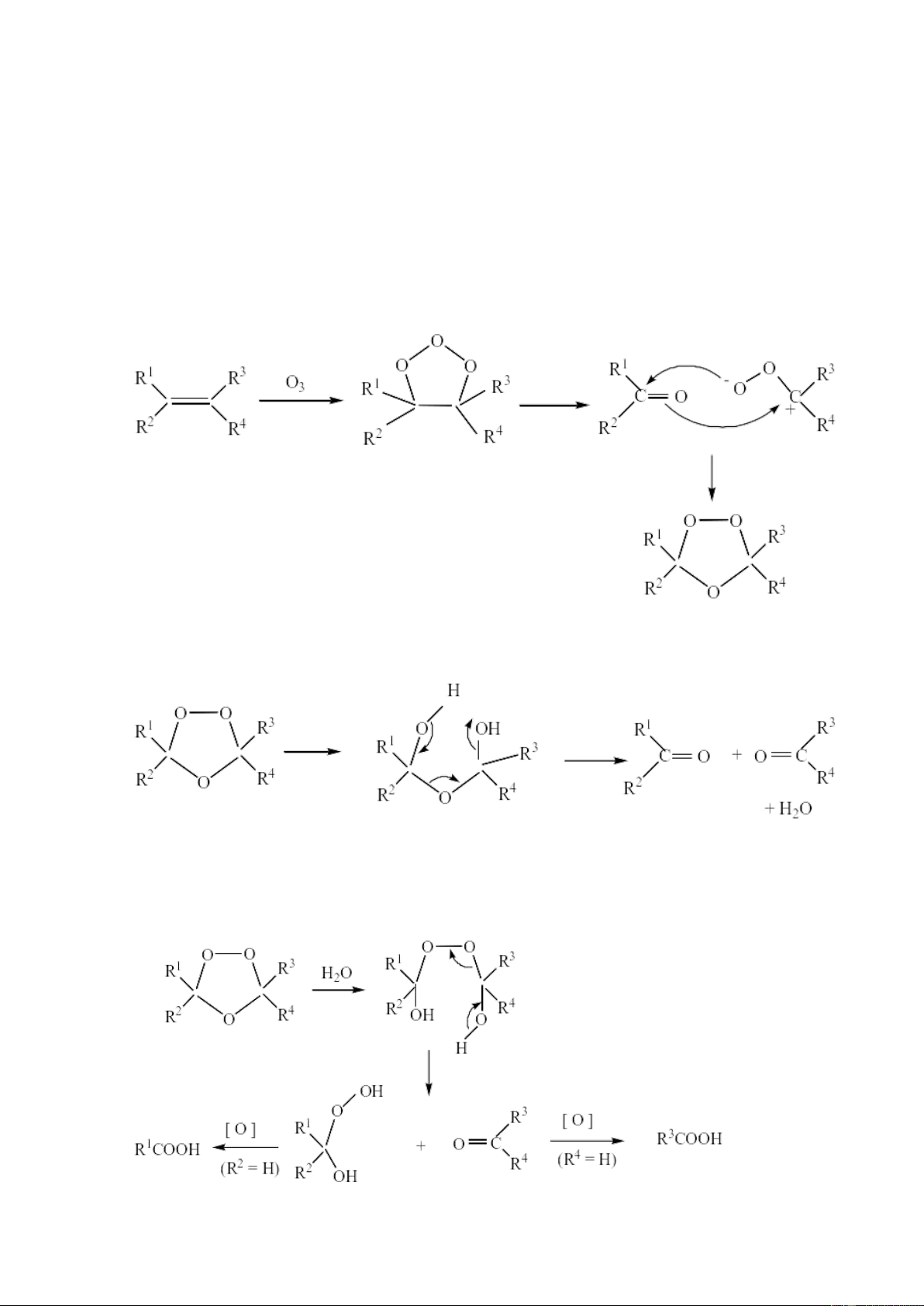
3.3. Với ozon phân
Phần lớn các anken tác dụng một cách dễ dàng với ozon, ngay cả khi ở nhiệt độ
thấp, liên kết đôi bị bẽ gãy, tạo ra sản phẩm gọi là ozonit. Phản ứng tiến hành hết sức
nhẹ nhàng so với khi dùng các chất oxi hoá thông thường và vì vậy được dùng rộng rãi
để thiết lập cấu tạo. 4
Ôzonit là những chất lỏng như dầu hoặc chất rắn vô định hình, rất dễ nổ và
không thể chưng cất được. Phản ứng với nước, ozonit sẽ bị phân huỷ thành andehyt
hoặc xeton, tuỳ theo cấu tạo của anken ban đầu:
Để loại trừ một số phản ứng phụ, người ta thay thế giai đoạn thuỷ phân
cuối cùng bằng cách khử, dùng natri bisunfit hoặc tốt hơn dùng hyđro có xúc tác. Có
thể phân lập được ôzônit, nhưng người ta thường đem phân huỷ nó bằng cách khử
thành hai phân tử hợp chất cacbônyl. Cũng có thể khử ôzônit thành hai phân tử alcol
(tác dụng của LiAlH4) hoặc ôxy hoá thành xêton và cacbôxylic (tác dụng của H2O2).
Ví dụ: + Khi ozon phân isobutilen, ta thu được sản phẩm là axeton và formandehyt:
Phản ứng ozon phân này có hiệu suất khá cao, từ 60-70%.
+ Khi ozon phân 6-metylhepten ta thu được sản phẩm là formanandehit và andehit.
Ozon hóa nối đôi anken thành ozonit rồi phân hủy ozonit bằng con đường khử
hóa sẽ cho andehit hoặc xeton:
(R1, R2, R3, R4 : gốc hidrocacbon hay H)
Có thể dùng chất khử khác ngoài (CH3)2S như: Zn + CH3COOH, hay Na2SO3,... Ví dụ: 5
Ozon hóa nối đôi anken rồi phân hủy ozonit bằng con đường oxi hóa
(H2O/H2O2) sẽ cho xeton hoặc axit cacboxylic: Ví dụ:
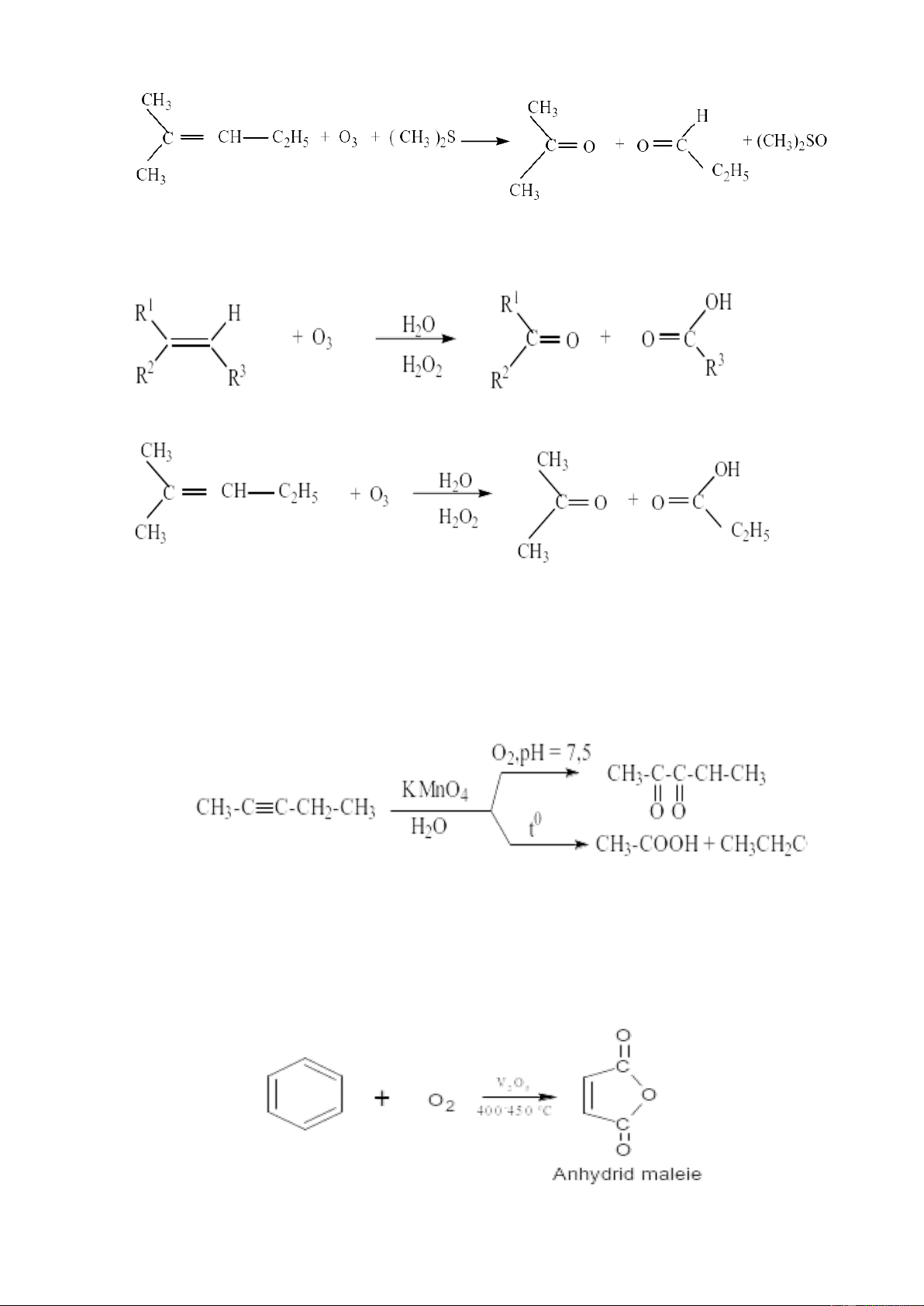
4. Phản ứng oxi hóa ankin
Ankin cũng bị oxi hóa bởi các tác nhân oxi hóa tại vị trí liên kết ba. Sản phẩm
thu được tùy thuộc vào điều kiện phản ứng, như môi trường, nhiệt độ...
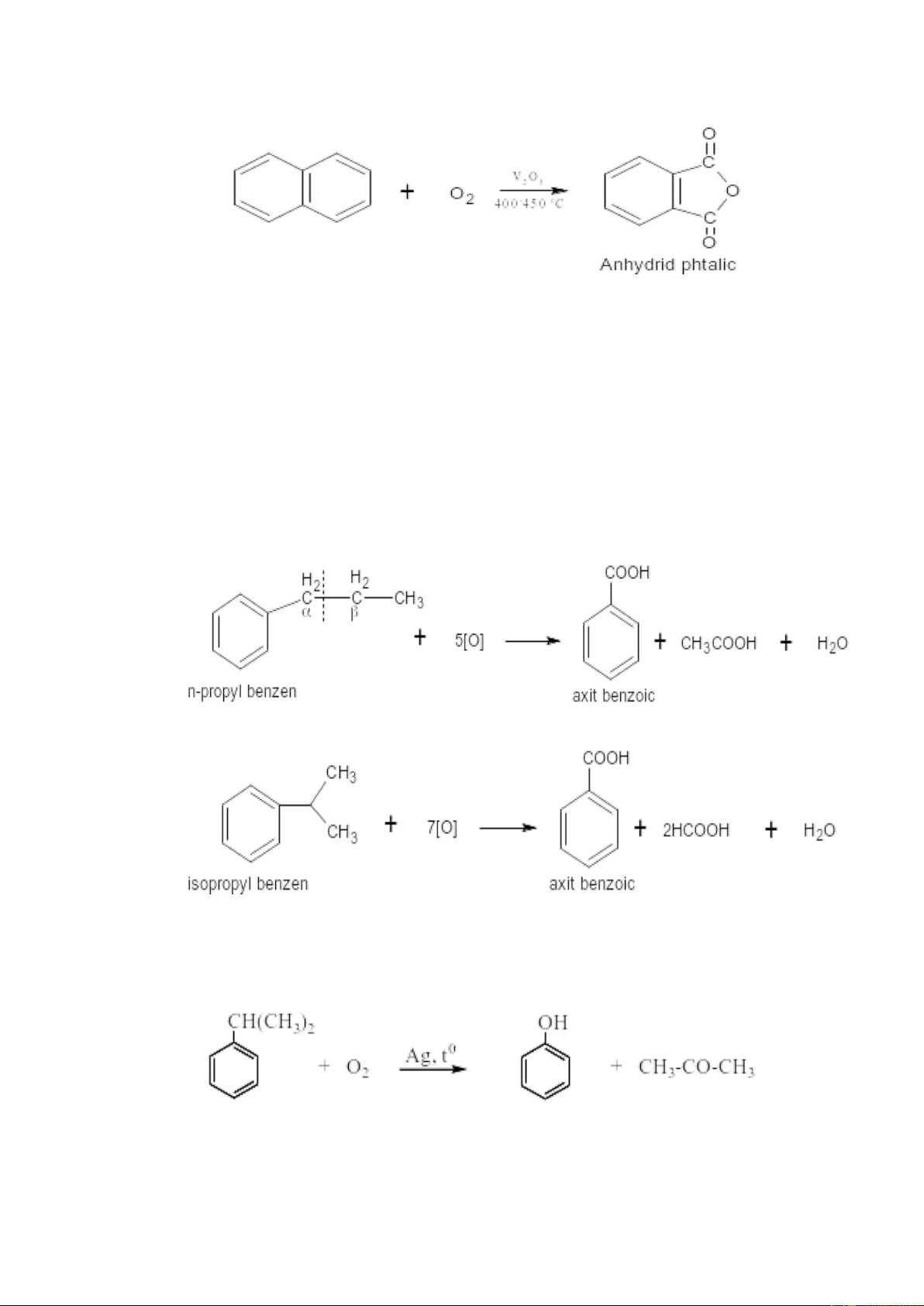
5. Phản ứng oxy hóa hydrocacbon thơm
Nhân benzene bền vững với các tác nhân oxy hóa. Các tác nhân oxy hóa như
HNO3, KMnO4, Cr2O3 đều không oxy hóa được vòng benzene. Chỉ ở nhiệt độ cao và
có xúc tác V2O5 vòng benzene bị oxy hóa thành anhydric maleic 6
Các đồng đẳng của benzene chỉ bị oxy hóa mạch nhánh. Tác dụng của chất oxi
hoá mạnh với các đồng đẳng của benzen thì nhân benzen bền vững hơn mạch nhánh
(các gốc ankyl). Kết quả của sự oxi hoá là dù mạch nhánh dài hay ngắn thế nào chúng
đều bị tách ra khỏi nhân benzen, chỉ nguyên tử cacbon gần nhân benzen nhất
(cacbon α) là còn tồn tại và biến thành nhóm cacboxyl cho axit cacboxylic
thơm. Phản ứng này dùng để xác định số mạch nhánh và vị trí của chúng trong nhân
benzen. Khi có một nhánh ta được axit benzoic, nếu có hai nhánh ta được axit
dicacboxylic thơm (octo, meta, para):
Đặc biệt, đối với cumen (iso-propyl benzen) bị oxy hoá bởi O2 không khí để tạo phenol và axeton:
6. Cơ chế một số phản ứng tiêu biểu
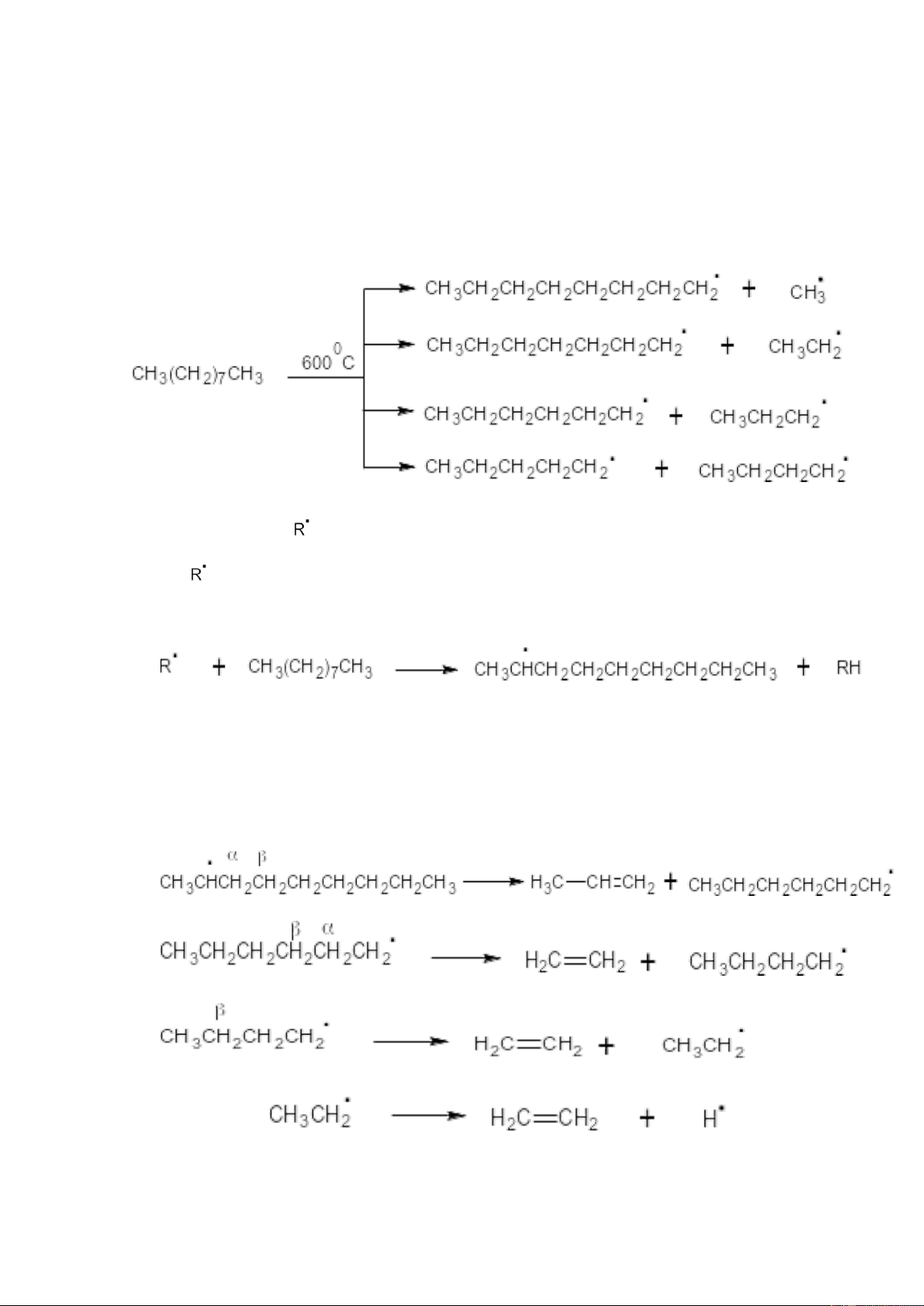
5.1. Cơ chế phản ứng cracking 7
a. Cơ chế phản ứng cracking nhiệt
Khi cracking nhiệt ankan thì phản ứng này xảy ra theo cơ chế gốc.
Ví dụ: Cơ chế phản ứng cracking nonan C9H20
+ Ở giai đoạn đầu, mọi liên kết C – C đều có thể bị bẻ gãy với xác xuất gần như nhau:
+ Các gốc tự do sinh ra có 2 hướng chính:
(1) ngắt lấy 1 nguyên tử H của một phân tử ankan nào đó tạo thành ankan mới và gốc tự do mới.
Các RH khác cũng có thể chịu những phản ứng như ankan ban đầu.
(2) Các gốc tự do chịu sự phân cắt β: đứt liên kết C – C ở vị trí β so với electron
độc thân tạo ra 1 anken và 1 gốc tự do khác. Quá trình này cứ tiếp diễn đến khi
tạo ra etilen và gốc metyl. 8
+ Sự tắt mạch xảy ra khi cho 2 gốc gặp nhau. Sản phẩm thu được gồm: H2; CH4; C2H6; C2H4; C3H6…
Cơ chế trên giải thích vì sao khi craching nhiệt ankan thu được hỗn hợp ankan,
anken không phân nhánh và trong thành phần khí cracking, etilen chiếm tỉ lệ khá cao (~27%).
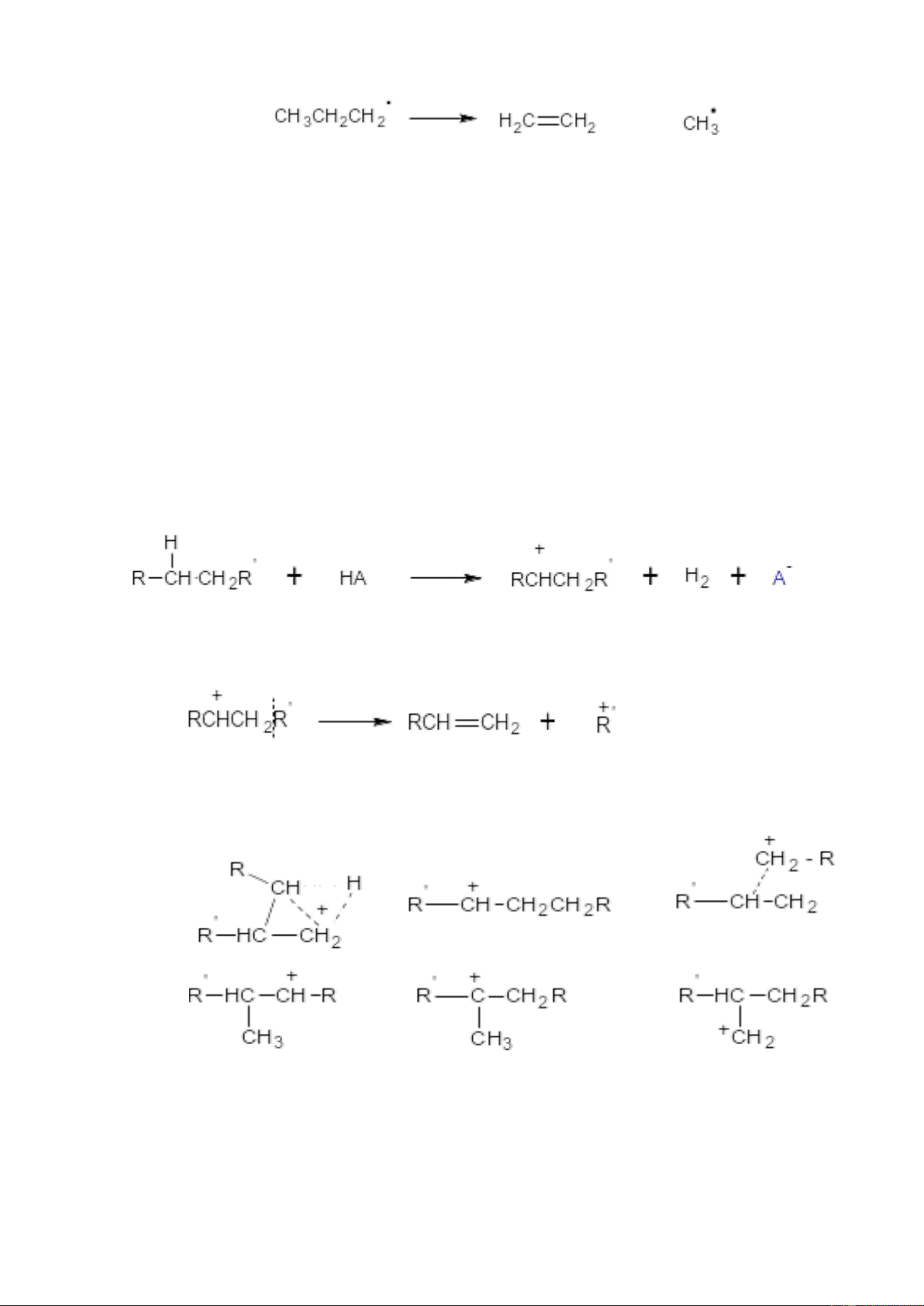
b. Cơ chế phản ứng cracking xúc tác
Cracking xúc tác thực hiện ở nhiệt độ 400-4500C, xúc tác thường dùng là
aluminosilicat thiên nhiên hoặc tổng hợp ( SiO2, Al2O3 đã được tẩm axit HA). Phản
ứng xảy ra theo cơ chế ion. Cơ chế:
+ Chất xúc tác HA tác dụng với ankan thu được cacbocation trung gian
+ Cacbocation sinh ra có các kiểu chuyển hóa: -
Phân cắt tạo anken và cacbocation mới -
Tự biến đổi thành cation kiểu ion metoni, rồi bị đồng phân hóa thành
cacbocation bậc III bền hơn: Cacbocation bậc II Cacbocation bậc III Cacbocation bậc I
- Ngắt lấy H- từ tiểu phân khác để trở thành phân tử trung hòa. 9
- Cacbocation cũng có thể bị tách proton H+ bởi anion A- tạo ra anken hoặc
khép vòng, hay xa hơn nữa có thể chuyển hóa thành vòng thơm.
Cracking xúc tác thu được sản phẩm có chứa nhiều ankan, anken phân nhánh và
một lượng đáng kể xicloankan và aren.
6.2. Cơ chế phản ứng ozon phân anken
Cơ chế phản ứng ozon phân:
Oxi hóa nối đôi anken bằng ozon thành ozonit:
Ozonit trung gian được chế hóa bằng con đường khử hóa sẽ thu được anđehit hoặc xeton:
Sự chế hóa ozonit bằng con đường oxi hóa sẽ qua giai đoạn peaxit và có thể dẫn
tới xeton hay axit cacboxylic: 10
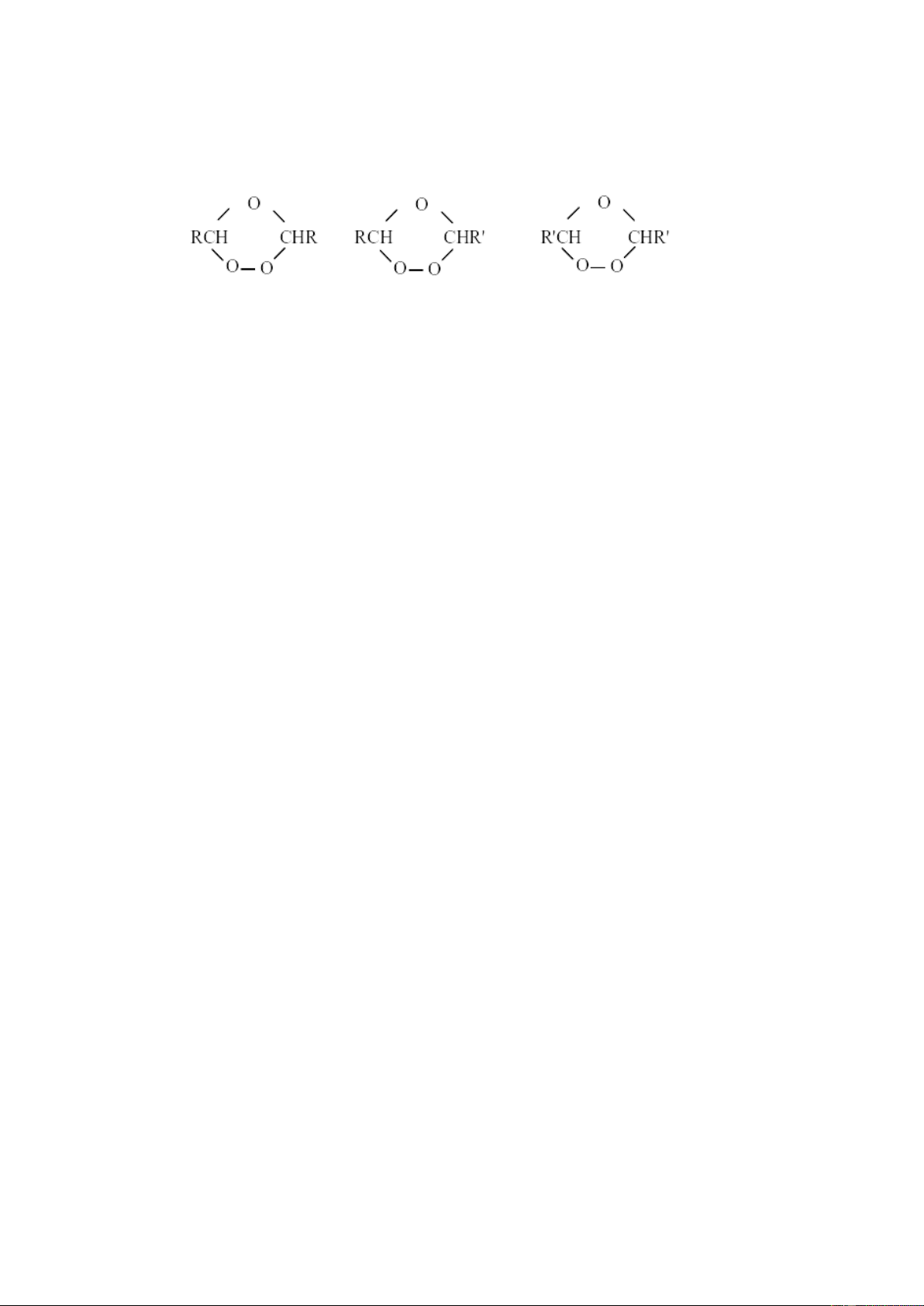
Một dẫn chứng nữa về cơ chế ôzôn hoá ở trên là sự tạo thành các sản phẩm
chéo: theo cơ chế đó nếu xuất phát từ một alken không đối xứng RCH = CHR’ ta phải
được 3 ôzônit khác nhau:
Trong thực tế, khi ôzôn hoá những hợp chất như pent-2-en, hex-2-en, ôlêat
mêtyl…người ta đã phân lập được cả ba loại ôzônit trên ở các dạng đồng phân cis- trans tương ứng.
Các hợp chất có nối ba C ≡ C và hợp chất thơm bị ôzôn hoá khó hơn alken.
TÀI LIỆU THAM KHẢO
1. Đào Hùng Cường (2009), Đại cương hóa hữu cơ,NXB KHKT- Hà Nội.
2. Trần Quốc Sơn (1997), Cơ sở lý thuyết hóa hữu cơ (tập 2), NXB Giáo dục
3. Thái Doãn Tĩnh (2000), Giáo trình Cơ sở lý thuyết hóa hữu cơ, NXB KHKT- Hà Nội. 11 12




