

Preview text:
BÀI TẬP ÔN TẬP HÓA LÝ DÀNH CHO SV THI OLYMPIC SINH VIÊN-2023
Câu 1: Trong khoảng nhiệt độ 500 đến 1500 K, phản ứng dây chuyền ở pha khí xảy ra giữa H2 và Br2
tạo ra HBr như sau: H2 + Br2 → 2HBr. Quy luật tốc độ phản ứng (R) thực nghiệm là:
Trong đó k, j là hằng số. Sinh viên đề xuất cơ chế phản ứng để giải thích biểu thức tốc độ phản ứng như sau:
Trong đó M là cấu tử mà phân tử Br2 có thể va chạm để nhận đủ năng lượng và xảy ra quá trình
phân ly thành 2 nguyên tử Br. Theo ý kiến của Anh/Chị, cơ chế đề xuất này có phù hợp không? giải
thích. Nếu không phù hợp, Anh/Chị đề xuất lại cơ chế phù hợp với thực nghiệm.
Câu 2: Tính entropy mol tuyệt đối của sulfur dioxide lỏng ở T = 200 K và ở áp suất điều kiện chuẩn
101,325 kPa. Biết: T1 = 15 K, C(S)pm = 3,77 J mol−1 K−1 tại T1, ∆S(s) = 84,2 J mol−1 K−1, Tfus =
197,64 K, ∆fusH = 7403 J.mol−1, C(l)pm = 87,2 J mol−1 K−1. Sulfur dioxide chỉ tồn tại dạng tinh thể.
Câu 3: Xây dựng công thức tính ∆H, ∆S và ∆G của quá trình đông đặc của một chất lỏng A siêu lạnh
ở T < Tfus và p = pfus, trong đó Tfus là nhiệt độ đông đặc và pfus là áp suất đông đặc. (Lưu ý: coi nhiệt
độ nóng chảy và nhiệt độ đông đặc là như nhau đối với các chất nguyên chất).
Câu 4: Tính q, w, ∆U, ∆H và ∆S của quá trình biến đổi thuận nghịch đoạn nhiệt của 1,00 mol một khí
lý tưởng đơn nguyên tử. Ban đầu, áp suất của khí là 5,00 bar và 298,2 K và giản nở đến áp suất cuối cùng là 1,00 bar.
Câu 5: Khi có nấm men, glucose chuyển thành ethanol.
C6H12O6 (s) → 2 CH3CH2OH (l) + 2 CO2 (g)
a. Tính biến thiên enthalpy, nếu một mol glucose chuyển thành ethanol ở 298,2 K.
b. Các sinh vật ưa nhiệt (thermophilic organisms) sống ở 80,0°C. Tính biến thiên enthalpy của phản ứng ở 80,0°C.
Câu 6: Calcium carbonate được tìm thấy trong tự nhiên ở dạng một số dạng: calcite,
aragonite, vaterite, ikaite. Ba dạng đầu tiên là calcium carbonate khan. Ikaite là canxi cacbonat ngậm
nước – khoáng chất, được tìm thấy ở vùng nước lạnh của Ikka-Vịnh hẹp ở Greenland.
Giả sử tất cả các khí và dung dịch là lý tưởng và enthalpy của tất cả các chất không phụ thuộc
vào nhiệt độ. Dữ liệu nhiệt động ở nhiệt độ 298 K và áp suất 1 bar 1
a. Khi đun nóng Ikaite CaCO3·xH2O rất dễ mất khoảng 52% khối lượng (so với khối lượng ban đầu).
Khi nung nóng ở nhiệt độ cao (1000°C), hỗn hợp mất thêm 21% khối lượng nữa (so khối lượng ban
đầu). Xác định x trong công thức CaCO3·xH2O.
b. Cho biết dạng thù hình nào (calcite hay aragonite) bền hơn ở nhiệt độ 298 K và áp suất 1 bar?
c. Tính hằng số cân bằng của phản ứng CaCO3(s, calcite) ⇌ CaO(s) + CO2(g) ở 25°C.
d. Tính hằng số cân bằng của phản ứng CaCO3(s, calcite) ⇌ CaO(s) + CO2(g) ở 1070 K.
Trong PTN, lò phản ứng có cấu trúc đặc biệt: kín, có khả năng làm nóng các mẫu trong lò. Lò
phản ứng được trang bị một thiết bị có khả năng nhập liệu từ bên ngoài (nạp chất rắn) mà không gây
sự thoát khí. Thể tích của lò phản ứng là 5,0 dm3. Ban đầu, lò phản ứng chứa đầy argon (25°C, p = 1,0 bar).
f) Tính áp suất (bar) trong lò phản ứng, khi nhiệt độ của lò tăng đến 1070 K.
e) Xét 05 mẫu calcite theo thứ tự liên tiếp được đưa vào lò phản ứng. Khối lượng của mỗi mẫu là 1,00
g. Nhiệt độ lò phản ứng duy trì 1070 K. Mẫu calcite mới chỉ được đưa vào lò sau khi áp suất của lò
không đổi theo thời gian. Tính áp suất tổng của khí trong lò phản ứng sau khi thêm từng mẫu calcite.
g) Sau khi thêm 5 mẫu, lò phản ứng được làm lạnh nhanh xuống 25°C và được rửa sạch pha hơi bằng
khí argon để loại tất cả khí carbon dioxide. Hỗn hợp chất rắn từ lò phản ứng được chuyển vào trong
nước và thêm nước được 0,6 dm3 dung dịch. Tính pH của dung dịch này (ở 25°C).
h) Tính độ tan của Ca(OH)2 ở 25oC và 10oC. Cho biết ảnh hưởng của nhiệt độ đến độ tan của Ca(OH)2
như thế nào?. Giải thích.
i) Sinh viên hòa tan 20gam CaO vào 200 mL nước. Sau khi hòa tan, SV hút 50,00 mL dung dịch
Ca(OH)2 cho vào 50,00 mL dung dịch dịch Na2CO3 a M và NaOH b M. Thu được kết tủa B, làm khô tự
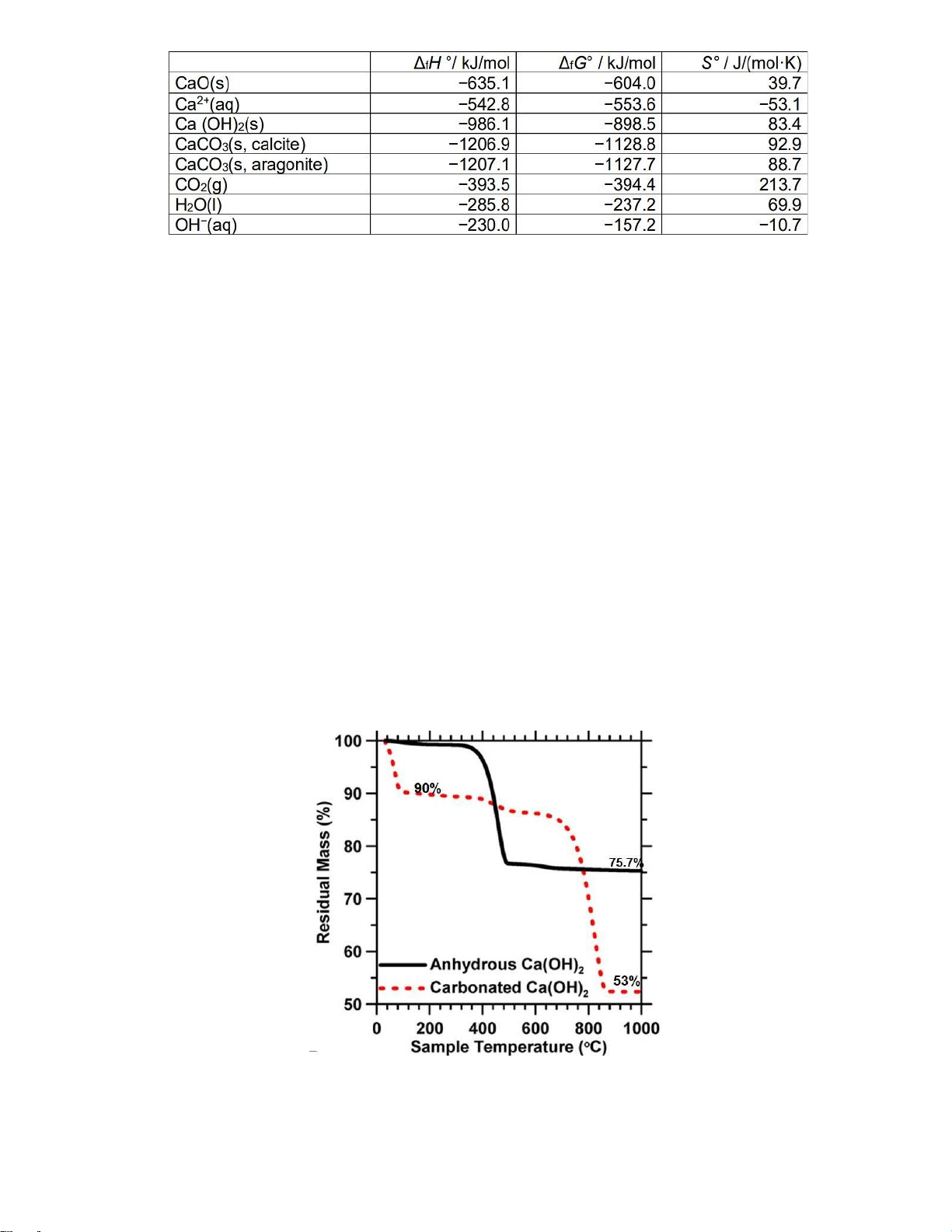
nhiên sau đó phân tích TGA của mẫu này (TGA: tăng nhiệt độ và ghi nhận khối lượng còn lại theo nhiệt
độ hoặc thời gian) của B như hình (đường màu đỏ). Từ kết quả phân tích TGA. Anh/Chị cho biết:
i. Có thể xác định % khối lượng các chất có trong rắn B được không?, giải thích. Nếu có, xác định công thức của rắn B.
ii. Có thể xác định a và b không? giải thích. 2
Câu 4: Liên quan kiểm soát đến đại dịch COVID-19, ở những nơi công cộng, nhà chức trách thường
đo nhiệt độ cơ thể kết hợp với thiết bị chụp ảnh nhiệt của người ở nơi công cộng. Đo bằng pyrometer
cung cấp thông tin nhanh về nhiệt độ của người, nhưng độ chính xác không cao so với khi đo nhiệt độ
bằng các loại nhiệt kế tiếp xúc (sử dụng rộng rãi nhất là nhiệt kế thủy ngân hoặc nhiệt kế rượu). Khi
tiếp xúc với vật đo, thể tích thủy ngân thay đổi do giãn nở nhiệt theo công thức: V = V0(1 + αΔT), trong
đó V0, V là thể tích ban đầu và thể tích sau của Hg, α là hệ số nhiệt độ của giãn nở thể tích, ΔT là hiệu
giữa nhiệt độ ban đầu và nhiệt độ cuối.
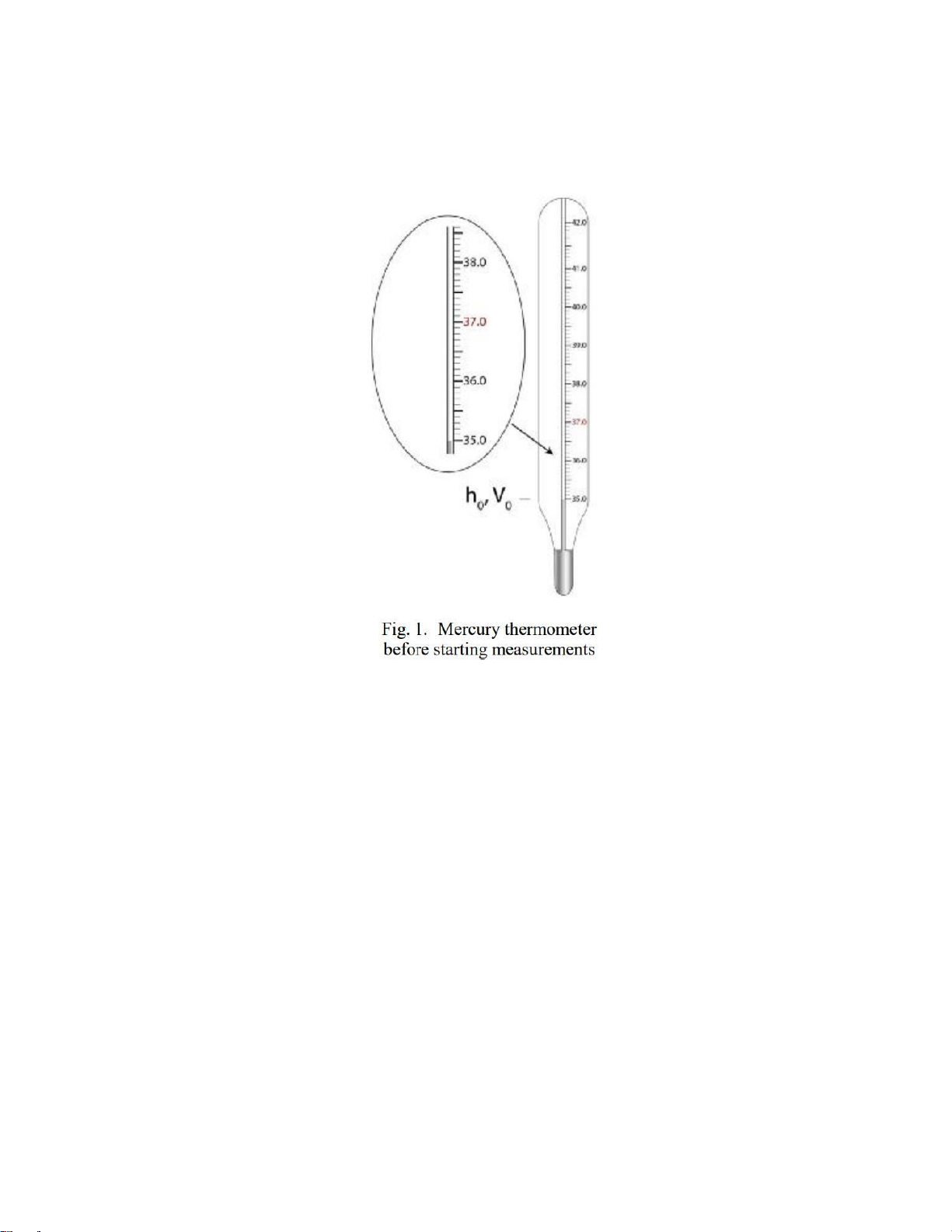
1. Cho biết một người có bị bệnh hay không, nếu khi đo nhiệt độ của người đó thì người đó truyền 115J
(dạng nhiệt) sang thủy ngân. Khối lượng riêng Hg là r = 13,55 g/cm3, nhiệt dung của Hg lỏng c = 27,88
J/mol∙K, α = 1,8×10-4 K–1. Độ chia theo tỷ lệ là 1 mm (Hình 1), nhiệt độ ban đầu của thủy ngân là 35,0°С.
Tín hiệu phát bệnh là 37,0°С. Đường kính cột thủy ngân d = 1 mm.
Nhiệt kế thủy ngân có một số nhược điểm như khó sử dụng ở những vùng có khí hậu lạnh.
2. Xác định nhiệt độ đông đặc của Hg; ΔmeltН = 2,29 kJ/mol, ΔmeltS = 0,034 J/K. Nhiệt kế chứa 0,7 g Hg.
3. Xác định biến thiên entropy của 0,7 g thủy ngân khi nhiệt độ tăng từ Ti = -60 đến Tf = +40°С, c(Hg,s) = 28,28 J/mol∙K.
Hỗn hống thủy ngân được tạo ra bằng phương pháp điện hóa để hạ điểm đông đặc của Hg.
4. a) Viết các phương trình quá trình;
b) Xác định thành phần w(wt %) của hỗn hống tali Tl∙nHg, thu được bằng cách điện phân dung dịch tali
fomat trong 5 phút với dòng điện 0,73 A sử dụng cực âm là thủy ngân (nặng 5 g);
c) Xác định khối lượng riêng của khí thoát ra ở anot ở 298 K và p = 1 atm.
Nhược điểm chính của nhiệt kế thủy ngân là độc tính cao của Hg, có thể dẫn đến ngộ độc thủy ngân
nếu nhiệt kế bị bể. Để loại bỏ những giọt thủy ngân nhỏ không thể thu thập bằng cơ học, người ta sử
dụng dung dịch thuốc tím với axit clohydric hoặc dung dịch sắt(III) clorua loãng.
5. Viết các phương trình phản ứng xảy ra. Biết R = 8,314 J/mol∙K, hằng số Faraday F = 96.485 C/mol. 3




