


Preview text:
BÁO CÁO THÍ NGHIỆM BÀI 1
CÂN BẰNG LỎNG – LỎNG
Ngày thí nghiệm: 26/02/2024 ĐIỂM: Lớp: 221281A Nhóm: 1 Tên: Lê Viết Vinh MSSV: 22128205 Chữ ký GVHD: Tên: Nguyễn Quốc Tuấn MSSV: 22128201 Tên: Trần Thanh Nam MSSV: 22128151
A. CHUẨN BỊ BÀI THÍ NGHIỆM: 1. Mục tiêu thí nghiệm
Sinh viên cần nắm vững các vấn đề trọng tâm sau đây:
• Nắm được nguyên tắc của phương pháp đa nhiệt.
• Hiểu được khái niệm nhiệt độ hòa tan tới hạn.
• Khảo sát được độ tan của hai chất lỏng hòa tan hạn chế vào nhau (phenol – nước).
• Thiết lập được giản đồ pha “nhiệt độ - thành phần” của hệ.
• Nắm vững qui tắc đòn bẩy. 2. Lý thuyết
Xét hệ phenol – nước ở nhiệt độ cố định.
Khi thêm dần phenol vào nước thì lúc đầu phenol hòa tan hoàn toàn trong nước, hệ tạo
thành một pha duy nhất (đồng thể). Nếu tiếp tục cho phenol vào tới một nồng độ nào đó,
nó không tan nữa và hệ phân ra làm hai lớp (pha): lớp phenol bão hòa nước (ở dưới) và lớp
nước bão hòa phenol (ở trên). Hai lớp chất lỏng này được gọi là liên hợp nhau, khi lắc
mạnh thì trộn lẫn vào nhau gây đục. 1
Ở mỗi nhiệt độ, sự hòa tan của phenol trong nước và của nước trong phenol có giá trị xác
định. Khi nhiệt độ tăng, độ tan lẫn tăng. Đồ thị biểu diễn ảnh hưởng của nhiệt độ tới độ tan
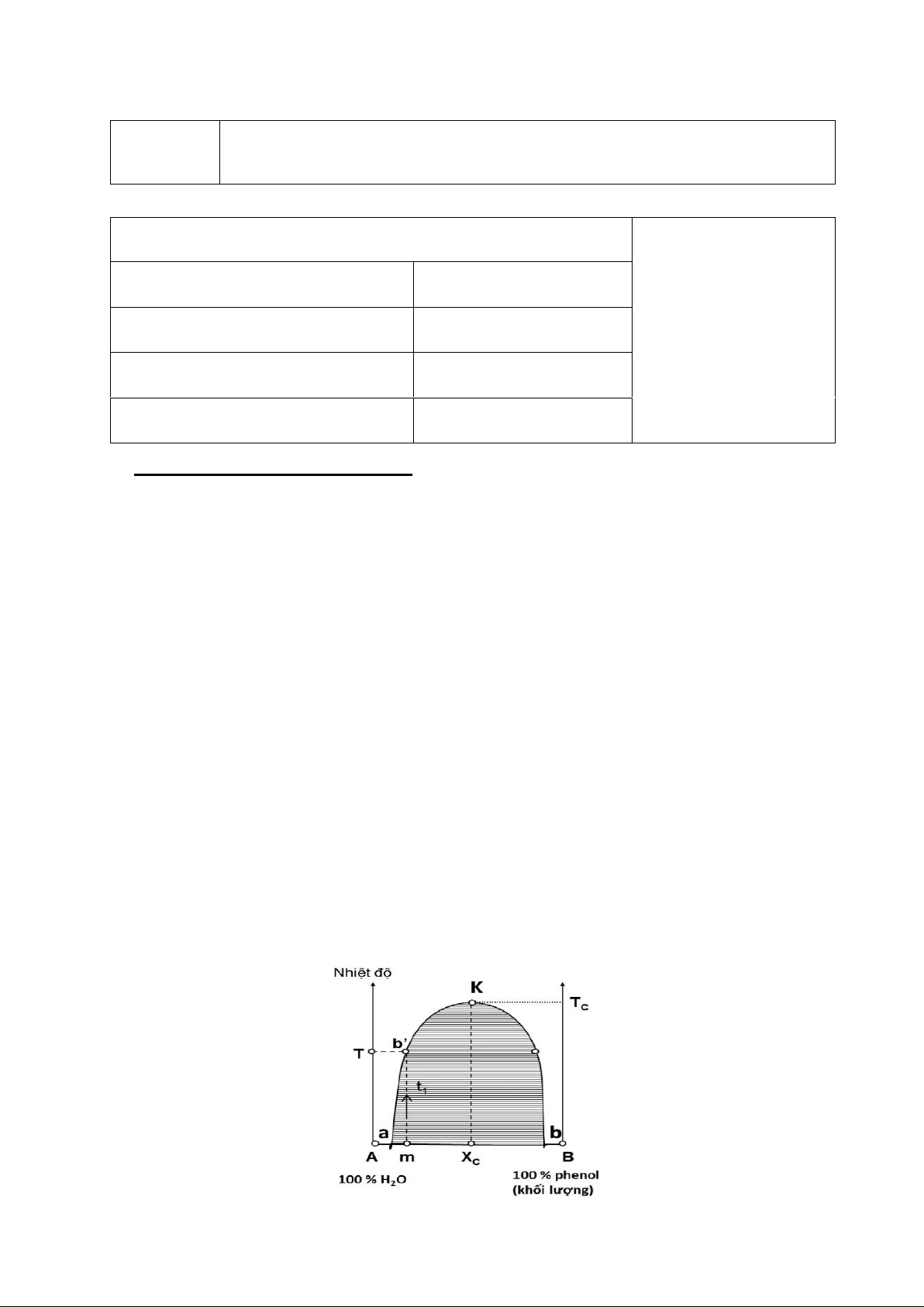
lẫn (giản đồ nhiệt độ - thành phần) có dạng như hình.
- aK và bK lần lượt biểu diễn ảnh hưởng của nhiệt độ đến độ tan của phenol trong nước
(lớp nước) và của nước trong phenol (lớp phenol).
- K là điểm hòa tan tới hạn, tại đó thành phần của hai pha bằng nhau.
TC được gọi là nhiệt độ hòa tan tới hạn. Đường cong aKb chia giản đồ thành hai miền,
miền trong (ghạch chéo) ứng với hệ dị thể (hai pha); miền ngoài là hệ đồng thể.
Có thể thiết lập giản đồ “nhiệt độ - thành phần” bằng hai cách:
a) Phương pháp đẳng nhiệt
Giữ nhiệt độ của hệ không đổi, thay đổi thành phần của hệ (chẳng hạn thêm dần phenol
vào nước). xác định điểm hệ chuyển từ đồng thể sang dị thể và ngược lại.
Lắc mạnh lọ đừng hai chất lỏng này rồi ngâm trong bình điều nhiệt đã cố định nhiệt độ,
cho đến khi phân hoàn toàn thành hai pha (lớp). Sau đó phân tích định lượng hai pha này.
b) Phương pháp đa nhiệt
Với hỗn hợp có thành phần m chẳng hạn nằm trong vùng dị thể (hệ vẫn đục) (Hình 1), tăng
dần nhiệt độ. Đến nhiệt độ T thì hỗn hợp vẫn còn trong. Nhiệt độ tiếp tục tăng, hỗn hợp
vẫn trong. Vậy căn cứ vào nhiệt dộ bắt đầu trong hay bắt đầu đục để xác định điểm b’.
Làm thí nghiệm với những hỗn hợp có thành phần khác nhau sẽ xác định được đường cong aKb. B. THỰC NGHIỆM:
1. Quy trình thí nghiệm
Chú ý: không được rửa dụng cụ bằng nước trước khi tiến hành thí nghiệm.
Cho nước và phenol riêng rẽ vào các burette (nếu phenol đóng rắn thì nhúng lọ phenol vào
cốc nước nóng 40 – 50 C cho phenol chảy ra. Tuyệt đối không đun trực tiếp phenol trên bếp).
Pha các hỗn hợp có thành phần theo bảng dưới đây trong 11 ống nghiệm, khối lượng riêng của phenol 1,07 g/cm3. 2 Ống 1 2 3 4 5 6 7 8 9 10 11 Phenol 0.6 0.9 1.2 1.5 1.8 2.1 2.4 2.7 3.0 3.3 3.6 (mL) Nước 5.4 5.1 4.8 4.5 4.2 3.9 3.6 3.3 3.0 2.7 2.4 (mL)
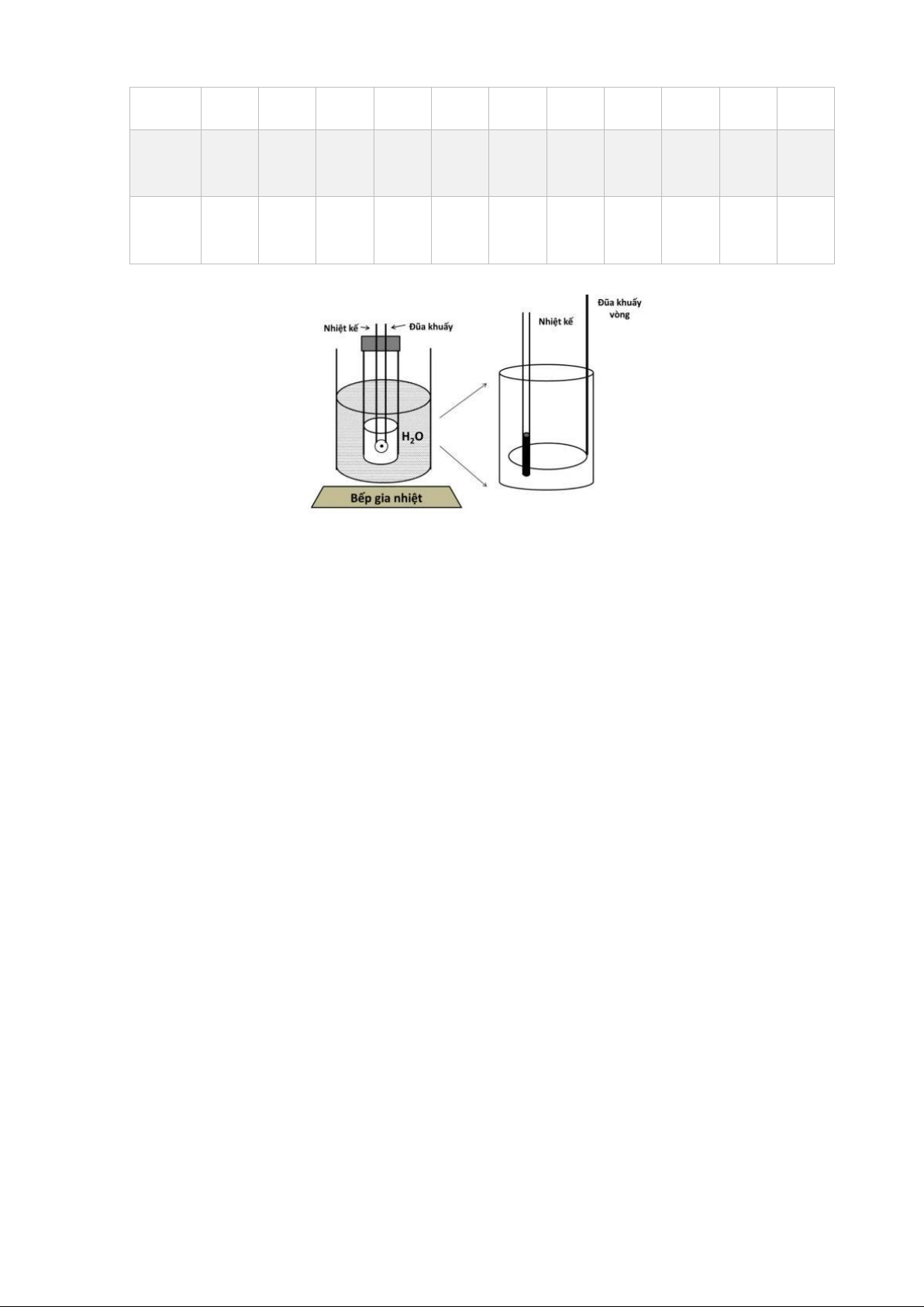
Lắp nhiệt kế và đũa khuấy vào ống nghiệm theo hình. Lưu ý không để bầu nhiệt kế chạm
đáy ống nghiệm. Nút kín ống nghiệm.
Nhúng ống nghiệm vào cốc nước và đun nóng dần. Lúc đầu, khi hệ còn đục nhiều, có thể
cho nhiệt độ tăng nhanh và khuấy nhẹ. Quan sát sự thay đổi nhiệt độ và sự biến đổi của
hỗn hợp. Khi hỗn hợp sắp trong phải cho nhiệt độ tăng rất chậm (không nhúng ống nghiệm
quá lâu trong cốc nước) và khuấy mạnh hơn. Giữ nhiệt độ cốc nước không quá 70 C.
Ghi nhiệt độ khi hỗn hợp bắt đầu trong: sau đó cho t hạ từ từ (bằng cách nhấc ống nghiệm
ra khỏi cốc, tiếp tục khuấy). Ghi nhiệt độ lúc bắt đầu phát hiện vết vẩn đục. Hai nhiệt độ
này phải không được chênh lệch nhau nhiều hơn 0,5 C.
Thực hiện trên mỗi ống nghiệm ba lần, lấy giá trị trung bình.
Làm thí nghiệm xong rửa sạch dụng cụ và cho vào tủ sấy. Chú ý:
- Các thể tích phenol và nước cất phải được lấy thật chính xác.
- Nhiệt kế luôn được ngâm trong hỗn hợp.
- Phải lắc mạnh ống nghiệm trước khi quan sát hiện tượng.
- Khi nhiệt độ hạ xuống khoảng 35 C mà chưa xuất hiện vẩn đục thì phải ngâm ống nghiệm vào nước đá. 3
2. Kết quả và bàn luận ❖ Kết quả thô
Bảng 1: Bảng thành phần khối lượng của các ống nghiệm đã chuẩn bị. Ống
Phần trăm khối lượng phenol
Phần trăm khối lượng nước (%) (%) 1 10.6 89.4 2 15.9 84.1 3 21.1 78.9 4 26.3 73.7 5 31.4 68.6 6 36.6 63.4 7 41.6 58.4 8 46.7 53.3 9 51.7 48.3 10 56.7 43.3 11 61.6 38.4
Để thu được bảng 1 ta dùng các công thức sau:
Ta có: d phenol = 1.07 g/cm3 , d nước = 1 g/cm3
Phần trăm khối lượng phenol (%): 4 ❖ Kết quả tính
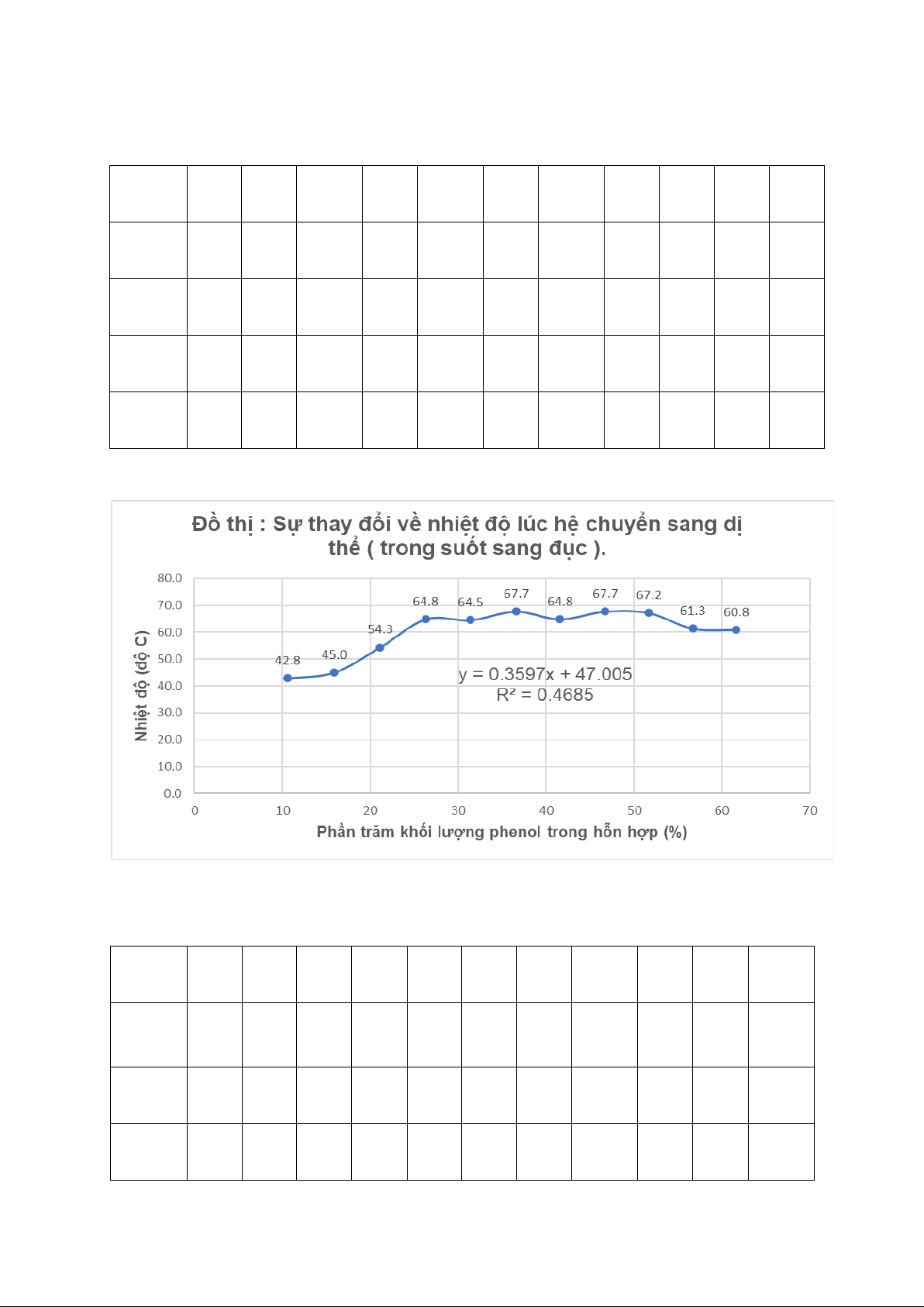
Bảng 2: Bảng đo giá trị nhiệt độ lúc hệ chuyển sang dị thể ( trong suốt sang đục ). Ống 1 2 3 4 5 6 7 8 9 10 11
Lần 1 42.5 45.5 56.5 64.5 64.5 67.5 64.5 67 66.5 61.5 60 Lần 2 43.5 45.5 53.5 64.5 65 68 65 67.5 67.5 61.5 61.5 Lần 3 42.5 44 53 65.5 64 67.5 65 68.5 67.5 61 61
Trung 42.8 45.0 54.3 64.8 64.5 67.7 64.8 67.7 67.2 61.3 60.8 bình Đồ thị 1:
Bảng 3: Bảng đo giá trị nhiệt độ lúc hệ chuyển sang đồng thể ( đục sang trong suốt). Ống 1 2 3 4 5 6 7 8 9 10 11 Lần 1 43 46 57 65 65 68 65 67.5 67 62 60.5 Lần 2 44 46 54 65 65.5 68.5 65.5 68 68 61 62 Lần 3 43 44.5 53.5 66 64.5 68 65.5 69 62.5 61.5 61.5 5
Trung 43.3 45.5 54.8 65.3 65 68.2 65.3 68.2 62.3 61.3 61.3 bình Đồ thị 2:
Đồ thị : Sự thay đổi về nhiệt độ lúc hệ chuyển sang dị
thể ( đục sang trong ). 80.0 68.2 68.2 67.7 65.3 65.0 65.3 70.0 61.8 61.3 54.8 60.0 C) 45.5 50.0 43.3 độ ộ ( 40.0 đ y = 0.3597x + 47.505 30.0 hiệt R² = 0.4685 N 20.0 10.0 0.0 0 10 20 30 40 50 60 70
Phần trăm khối lượng phenol trong hỗn hợp (%)
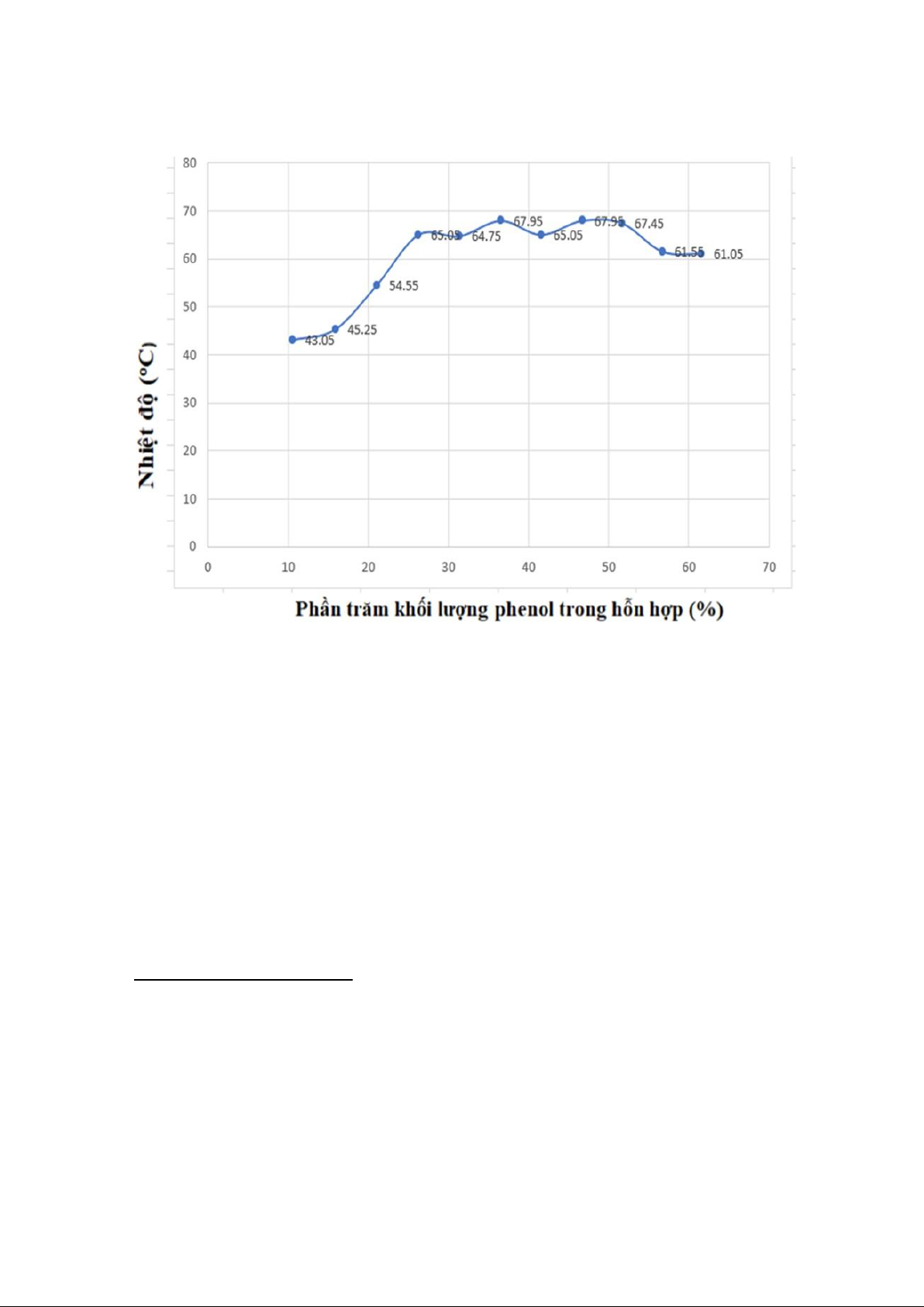
Bảng 4: Bảng nhiệt độ trung bình của sự hòa tan phenol trong nước. Ống 1 2 3 4 5 6 7 8 9 10 11 Nhiệt độ đục 42.8 45.0 54.3 64.8 64.5 67.7 64.8 67.5 67.2 61.3 60.8 trung bình Nhiệt độ trong 43.3 45.5 54.8 65.3 65.0 68.2 65.3 67 67.7 61.8 61.3 trung bình Nhiệt độ
43.05 45.25 54.55 65.05 64.75 67.95 65.05 67.25 67.45 61.55 61.05 trung bình 6
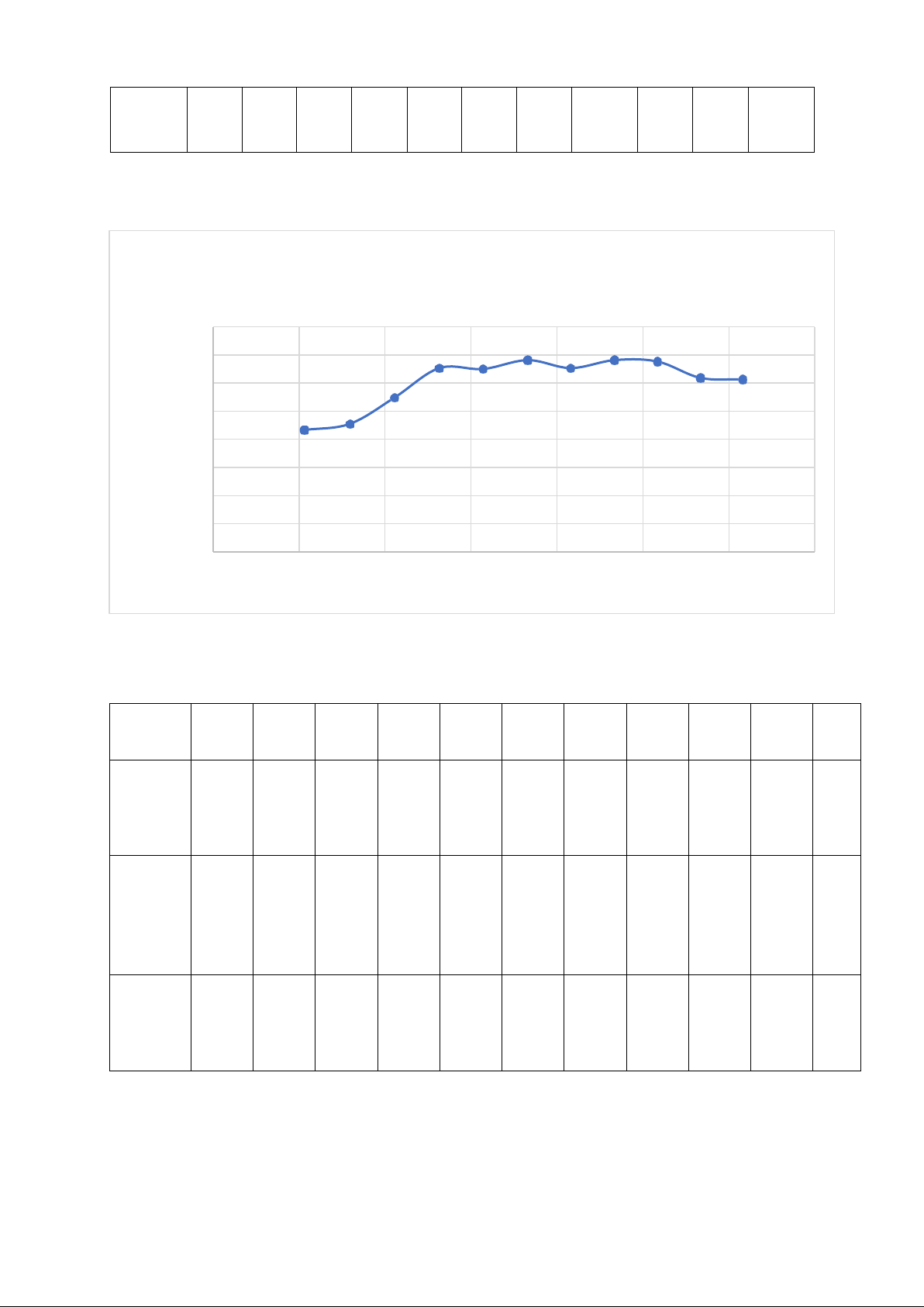
Đồ thị 3: Sự thay đổi về nhiệt độ tới hạn Tc của hệ phenol – nước theo các thành phần
khối lượng khác nhau. Nhận xét:
- Phương pháp được dùng để xác định nhiệt độ hòa tan tới hạn của phenol trong nước
trong bài thí nghiệm này là phương pháp đa nhiệt.
- Từ giản đồ trên ta xác định được nhiệt độ hòa tan tới hạn của phenol trong nước là t=67.95℃.
- Thành phần (%) tới hạn của phenol trong nước là 36.6% và thành phần (%) tới hạn của
nước trong phenol là 64.4% ứng với ống số 6.
C. CÂU HỎI THẢO LUẬN:
Câu 1: Tính số bậc tự do của hệ thống trong các vùng, nêu rõ ý nghĩa.
- Dựa vào quy tắc pha Gibbs: C= k – f + n
k: số cấu tử, f: số pha, n: số thông số bên ngoài tác động vào hệ
- Xét vùng đồng thể: C= k – f + n= 2 – 2 + 1= 1
- Ý nghĩa: Là trong vùng đồng thể chúng ta có thể thay đổi tự do 1 thông số ( nhiệt độ hoặc
thành phần) bên ngoài mà không làm thay đổi số và bản chất các pha. Nếu thay đổi cả nhiệt 7
độ và thành phần cùng một lúc thì sẽ thay đổi thông số pha (f=1) thì phenol và nước sẽ hòa tan vào nhau.
- Xét vùng dị thể: C= k – f + n = 2 – 1 + 1= 2
- Ý nghĩa: Cho biết vùng dị thể của hệ phenol – nước sẽ không thay đổi khi tự do thay đổi
cả thành phần và nhiệt độ.
Câu 2: Nêu các sai số có thể xảy ra trong thí nghiệm và cách khắc phục.
Một số lí do ảnh hưởng đến kết quả:
- Bếp gia nhiệt không đều.
- Thành phần của hỗn hợp chưa chính xác có thể do dụng cụ sai số hoặc thao tác thí nghiệm.
- Đọc thông số nhiệt độ trên nhiệt kế chưa thật sự chính xác.
- Khó quan sát độ trong và đục của hỗn hợp. Cách khắc phục:
- Cần gia nhiệt cẩn thận từ từ để giữ cho thí nghiệm được ổn định
- Đọc bài thí nghiệm kỹ để thao tác chuẩn.
- Đọc nhiệt kế phải để ngang tầm mắt với nhiệt kế để đọc chính xác nhất.
- Cần biết được tiêu chuẩn đục trong để xác định chính xác. 8




