







Preview text:
I. YÊU CẦU
Trước khi tiến hành thí nghiệm, sinh viên cần
- Trình bày được các khái niệm độ dẫn điện, độ dẫn điện riêng, độ dẫn điện đương
lượng, độ dẫn điện mol và mối liên hệ giữa chúng
- Nguyên tắc xác định bằng thực nghiệm các đại lượng
- Diễn giải và vận dụng hệ thức Onsager-Kohlrauch cho chất điện ly mạnh
- Trình bày mối liên hệ giữa độ điện ly với độ dẫn điện đương lượng của chất điện ly yếu
- Xác định được hằng số phân ly của chất điện ly yếu bằng phương pháp đo độ dẫn điện II. Lý thuyết
Điện trở của dung dịch được xác định theo định luật Ohm: I = U/R, trong đó I – cường độ
dòng điện truyền qua dung dịch (A); U – hiệu điện thế giữa hai điện cực(V) ; R – điện trở của dung dịch (Ω).
Độ dẫn điện của dung dịch là đại lượng bằng nghịch đảo của điện trở dung dịch: L = 1/R
Đơn vị của điện trở trong hệ SI là Siemen (S). 1S = 1/Ω = 1 kg-1. m-2 .c2 .A2
Độ dẫn điện riêng của dung dịch là độ dẫn điện của lớp dung dịch dài nằm giữa hai điện
cực với diện tích 1 cm2 và đặt song song, cách nhau 1 cm:
Trong đó ρ là điện trở riêng của dung dịch (Ω/cm); l – khoảng cách giữa hai điện cực
(cm); S – diện tích bề mặt mỗi điện cực (cm2); k – hằng số bình đo độ dẫn (1/cm). Trong
hệ SI, đơn vị của độ dẫn điện riêng là S/m nhưng các thiết bị đo độ dẫn điện riêng thường
dùng đơn vị S/cm hay Ω-1.cm-1.
Độ dẫn điện đương lượng là độ dẫn điện của lớp dung dịch nằm giữa hai điện cực song
song cách nhau 1 cm và có diện tích sao cho thể tích lớp dung dịch này chứa đúng 1 mol đương lượng chất tan.
Trong đó χ là độ dẫn điện riêng của dung dịch chất điện ly (S/cm); N là nồng độ đương
lượng của chất điện ly trong dung dịch (mol đl/L). Đơn vị của độ dẫn điện đương lượng
là S.cm2.mol đl-1 hoặc trong hệ SI là S.m2.mol đl-1. Với chất điện ly loại 1-1 thì đơn vị này là S.m2.mol -1.
Lưu ý: cần thật cẩn thận khi lựa chọn đơn vị của các loại độ dẫn điện này. Việc sử dụng
các công thức , các con số nhưng không nói rõ đơn vị có thể dẫn tới tính toán sai. Khi tra
cứu các bảng số liệu cần chú ý tới đơn vị được sử dụng.
Độ dẫn điện đương lượng của dung dịchbằng tổng độ dẫn điện đương lượng của các ion
có trong dung dịch: λ = λ+ + λ-
Độ dẫn điện đương lượng của dung dịch chất điện ly tăng lên khi tăng độ pha loãng, và với
độ pha loãng vô cùng lớn (nồng độ vô cùng nhỏ) thì đạt giá trị giới hạn λo, gọi là độ dẫn
điện đương lượng tới hạn.
Với dung dịch loãng chất điện ly mạnh, định luật kinh nghiệm Kohlrauch được tuân theo:
, trong đó λ và λo lần lượt là độ dẫn điện đương lượng của dung dịch với
nồng độ đương lượng N và độ dẫn điện đương lượng tới hạn. A là hằng số phụ thuộc vào
điện tích, nhưng không phụ thuộc bản chất ion của chất điện ly.
Lý thuyết Debye-Huckel-Osanger, trong đó xét đến tương tác giữa các ion đối với chất điện ly mạnh loại 1-1: hay
Với dung dịch nước của chất điện ly mạnh, trong khoảng nồng độ 0,001 – 0,1 mol/L, mối
liên hệ giữa λ và C có dạng
III. THỰC NGHIỆM
1. DỤNG CỤ VÀ HÓA CHẤT Dụng cụ Số lượng Hóa chất Cốc 50 mL 06 HCl 0,1 M Cốc 100 mL 02 CH3COOH 0,1 M Buret 25 mL 02 CH3COONa 0,1 M Pipet 5 mL 03 NaOH 0,1 M Máy đo độ dẫn 01 Acid oxalic (chất rắn) Máy khuấy từ 01 Cá từ 01 Bình định mức 100 mL 01
2. TH䤃Ā NGHIỆM
- Đọc hướng dẫn sử dụng và ý nghĩa của các thông số hiển thị trên màn hình máy đo độ dẫn.
- Pha 100 mL dung dịch chuẩn acid oxalic 0,05 M (4 chữ số sau dấu phẩy) và sử
dụng để chuẩn độ lại dung dịch NaOH. Dùng dung dịch NaOH để chuẩn độ lại HCl và CH3COOH.
- Pha 50 mL dung dịch CH3COONa 0,1 M (đến 4 chữ số sau dấu phẩy)
- Với mỗi dung dịch HCl, CH3COOH, CH3COONa gốc ở trên, pha loãng với các hệ
số 6, 62, 63, 64 bằng cách như sau: dùng pipet lấy 5 mL dung dịch gốc vào cốc 50
mL, rồi lấy thêm 25 mL từ buret, lắc trộn đều, sẽ được dung dịch đã pha loãng 6
lần từ dung dịch gốc. Sau đó lấy dung dịch đã pha loãng này làm gốc để pha loãng
tiếp 6 lần bằng cách tương tự. Cứ như thế làm đến khi pha loãng 64 lần dung dịch gốc ban đầu.
- Dùng máy đo độ dẫn để đo độ dẫn điện, điện trở và nhiệt độ của từng dung dịch.
IV. K쨃ĀT QU䄃ऀ VÀ BÀN LUẬN
1. K Āt qu愃ऀ chu ऀ n độ dung d椃⌀ch NaOH bằng dung d椃⌀ch acid oxalic 0,05N:
Khối lượng acid oxalic.2H2O = 0.63g 0.63
CM acid oxalic = 126.05 = 0.05 M 0.1
Chuẩn độ lại NaOH bằng dung dịch acid oxalic
B愃ऀ ng 1: B愃ऀ ng gi愃Ā tr椃⌀ chu ऀ n độ NaOH bằng acid oxalic
Th ऀ t椃Āch Vacid oxalic VNaOH V1 10 ml 6.5 V2 10 ml 6.5 Vtb 10 ml 6.5 0.05× 10 C
CM acid oxalic∗V acid oxalic∗2 × 2 M NaOH = =¿0.1538M V NaOH = 6.5
2. K Āt qu愃ऀ chu ऀ n độ dung d椃⌀ch HCl bằng dung d椃⌀ch NaOH 0.1538 M:
B愃ऀ ng 2: B愃ऀ ng gi愃Ā tr椃⌀ chu ऀ n độ HCl bằng NaOH
Th ऀ t椃Āch VHCl VNaOH V1 10 ml 6 V2 10 ml 6 Vtb 10 ml 6 C
CM NaOH∗V NaOH 0.1538× 6 = M HCl = =0.09228 M V HCl 10
3. K Āt qu愃ऀ chu ऀ n độ dung d椃⌀ch CH3COOH bằng dung d椃⌀ch NaOH 0.1538 M:
B愃ऀ ng 3: B愃ऀ ng gi愃Ā tr椃⌀ chu ऀ n độ CH3COOH bằng NaOH
Th ऀ t椃Āch VCH3COOH VNaOH V1 10 ml 22.4 V2 10 ml 22.3 Vtb 10 ml 22.35
C M CH3COOH = CM NaOH∗V NaOH 0.1538× 22.35 = = 0.3437 M
V CH 3COOH 10
4. B愃ऀ ng s Ā liệu về nhiệt độ, độ d ̀ n điện riêng, điện trở c甃ऀ a
từng dung d椃⌀ch: HCl Hệ s Ω
Ā pha lo愃̀ng χ ( μS ) ρ ( ) to(oC) cm cm 6 4630 216 31,1 62 318 3144,7 30,5 63 47,5 21052,63 28,8 64 10 100000 28,4 CH3COONa
Hệ s Ā pha lo愃̀ng Ω χ ( μS ) ρ ( ) to(oC) cm cm 6 995 1005,02 30,1 62 191 5235,6 30,2 63 37,8 26455,02 30 64 11,5 86956,52 29,7 CH3COOH
Hệ s Ā pha lo愃̀ng Ω χ ( μS ) ρ ( ) to(oC) cm cm 6 304 3289,5 29,2 62 172,9 5783,7 30,1 63 69,2 14450,9 30,3 64 28 35714,3 30,5 5. Kết quả tính:
- Nồng độ đương lượng của các chất lần lượt là: HCl: 0,09228 N CH3COOH: 0,3437 N CH3COONa: 0,1 N
- Độ dẫn điện đương lượng: λ χ∗1000 = N
B愃ऀ ng 4: Độ d ̀ n diện đương lượng c甃ऀ a HCl theo hệ s Ā pha lo愃̀ng
Hê s Ā pha χ ( μS ) C(N)
√ C ( √N ) cm2 λ (S . đl) lo愃̀ng cm mol 6 4630 0.09228 0.3037 50.173 62 318 0.01538 0.124 20.676 63 47,5 0.002563 0.0506 18.532 64 10 0.0004272 0.0207 23.41 60 ) l 50 đ)lo 40
f(x) = 106.580668106359 x + 14.9018116537317 m R² = 0.837416815823045 / 30 2^ m 20 c(* 10 S(λ 0 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 √C(√N)
B愃ऀ ng 5: Độ d ̀ n điện đương lượng c甃ऀ a CH3COONa theo hệ s Ā pha lo愃̀ng Hệ số pha χ ( μS ) C(N)
√ C ( √N ) cm2 λ (S . đl) loãng cm mol 6 995 0.1 0.316 9.95 62 191 0.0167 0.129 11.437 63 37.8 0.0027 0.052 14 64 11.5 0.00046 0.0214 25 30 25 ) l đ)l 20 o m
f(x) = − 37.0387305638 263 x + 19.8969 694810719 / 15 2 R² = 0. 5173024115881 66 ^ mc 10 (* S(λ 5 0 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 √C(√N) cm 2
Từ phương trình hồi quy λ0= 19.897 ( S . đl ) mol
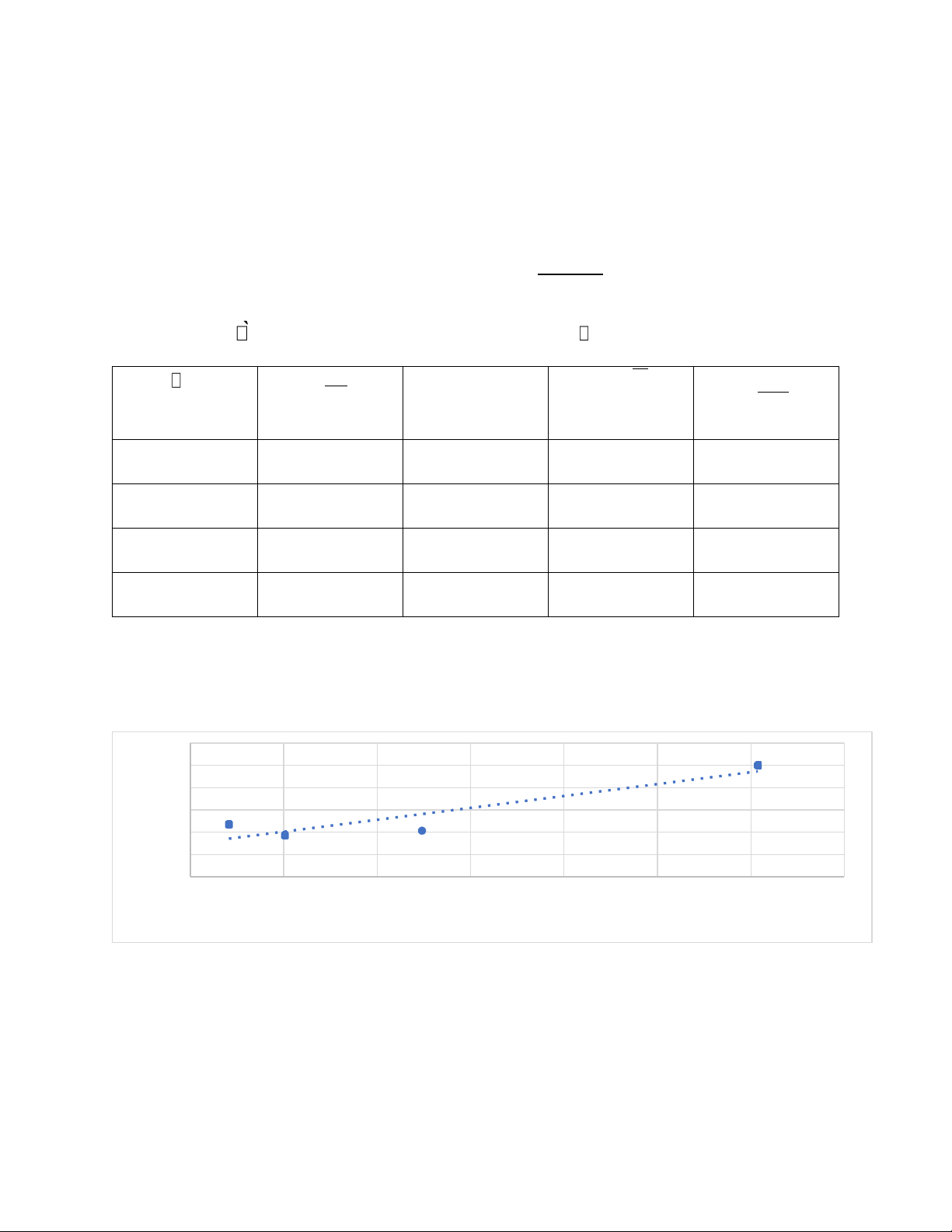
B愃ऀ ng 6: Độ d ̀ n điện đương lượng c甃ऀ a CH3COOH theo hệ s Ā pha lo愃̀ng Hê số pha χ ( μS ) C(N)
√ C ( √N ) cm2 λ (S . đl) loãng cm mol 6 650 0.3437 0.586 1.89 62 172.9 0.0573 0.239 3.017 63 69.2 0.00955 0.0977 7.246 64 28 0.0016 0.04 17.5
- với chất điện ly yếu ta có: Phương trình hồi quy:
Từ đó ta có bảng như sau: C(N) cm2 λ.C 1 λ (S . đl) mol λ 0.3437 1.89 0.649 0.5291 0.0573 3.017 0.1729 0.3315 0.00955 7.246 0.069 0.138 0.0016 17.5 0.028 0.057 0.6
f(x) = 0.689575337699051 x + 0.105487305547085 0.5
R² = 0.874223791517808 0.4 λ / 0.3 1 0.2 0.1 0 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 λC
- Từ phương trình hồi quy λ0= 9.48 Hê số C(N) cm2 K Log(K λ λ C= C) √αC (S . đl) α = pha mol λ2. C λ0 loãng λ . 0 ( λ0− λ) 6 0.3437 1.89 0.0171 -1.767 0.2 0.262 62 0.0573 3.017 6.78×10-3 -2.169 0.318 0.135 63 0.00955 7.246 4.64×10-3 -2.333 0.764 0.0852 64 0.0016 17.5 2.66×10-3 -2.575 1.846 0.0543 0.3 0.25
f(x) = 0.265214277463324 x + 0.72051376747141 R² = 0.969679177258237 0.2 ) cK 0.15 (go L 0.1 0.05 0 -2.7 -2.6 -2.5 -2.4 -2.3 -2.2 -2.1 -2 -1.9 -1.8 -1.7 √αC
- Từ phương trình hồI quy Log(KC)=
❖ Nhận x攃Āt
- Từ kết quả trên, ta có thể thấy được sự ảnh hưởng của nồng độ đến các giá trị độ dẫn điện riêng,
độ dẫn điện tương đương….
- số liệu không được đồng đều. ❖ Nguyên nhân - do sai số dụng cụ
- Do thao tác của ngườI thực hiện trong việc pha hóa chất và trong quá trình chuẩn độ.
- Thực hiện quy trình không chính xác
- Đọc và ghi sai số liệu V.
CÂU H伃ऀ I TH䄃ऀ O LUẬN
1) Trình bày khái niệm và các công thức liên quan giữa các đ愃⌀i lượng điện
trở, độ d̀ n điện, độ d̀ n điện riêng, độ d̀ n điện đương lượng, độ d̀ n điện
đương lượng giới h愃⌀n c甃ऀ a dung d椃⌀ch chất điện ly.
- Điện trở của dung dịch được xác định theo quy luật Ohm: I=U/R, trong đó I- cường độ dòng
điện truyền qua dung dịch (A); U- hiệu điện thế giữa hai điện cực(V) ; R- điện trở của dung dịch (Ω).
- Độ dẫn điện của dung dịch là đại lượng bằng nghịch đảo của điện trở dung dịch: L= 1/R
- Đơn vị của điện trở trong hệ SI là Siemen (S). 1S=1/Ω=1㎏-1.m-2.c2.A2
- Độ dẫn điện riêng của dung dịch là độ dẫn điện của lớp dung dịch dài nằm giữa hai điện cực
với diện tích 1cm2 và đặt song song, cách nhau 1cm:
Trong đó p là điện trở riêng của dung dịch (Ω/cm); 1- Khoảng cách giữa hai điện cực (cm); S-
diện tích bề mặt mỗi điện cực (cm2); k -hằng số bình đo độ dẫn (1/cm). Trong hệ SI, đơn vị của
độ dẫn điện riêng là S/m nhưng các thiết bị đo độ dẫn điện riêng thường dùng đơn vị S/cm hay Ω-1.cm-1.
- Độ dẫn điện đương lượng là độ dẫn điện của lớp dung dịch nằm giữa hai điện cực song song
cách nhau 1cm và có diện tích sao cho thể tích lớp dung dịch này chứa đúng 1 mol đương lượng chất tan
Trong đó χ là độ dẫn điện riêng của dung dịch chất điện ly (S/cm); N là nồng độ đương lượng
của chất điện ly trong dung dịch (mol dl/L). Đơn vị của độ dẫn điện đương lượng là S.cm2.mol
đl-1 hoặc trong hệ SI là S.m2.mol đl-1. Với chất điện ly loại 1-1 thì đơn vị này S.m2.mol-1.
- Độ dẫn điện đương lượng của dung dịch bằng tổng độ dẫn điện đương lượng của các ion có trong dung dịch: λ=λ++λ-
- Độ dẫn điện đương lượng của dung dịch chất điện ly tăng lên khi tăng độ pha loãng, và với độ
pha loãng vô cùng lớn (nồng độ vô cùng nhỏ) thì đạt giá trị giới hạn λ0, gọi là độ dẫn điện đương lượng tới hạn.
2) Khi tăng dần nồng độ chất điện ly thì các đ愃⌀i lượng ở câu 1 bi Ān đổi như th Ā nào?
-Khi tăng nồng độ chất điện ly thì độ dẫn điện riêng của dung dịch tăng, điện trở riêng giảm, độ
dẫn điện đương lượng giảm




