








Preview text:
BÁO CÁO BÀI TẬP LỚN Môn: Tên môn học
Đề tài: BÀI TẬP LỚN HÓA LÝ 1
GVHD: Ngô Trần Hoàng Dương Lớp: L02 Nhóm: 05 Họ và tên MSSV Email Phân công Lê Đình Nam 2212128 nam.ledinh270201@hcmut.edu.vn Câu 1 Thái Trần Thanh Ngân 2212195 ngan.thaii934@hcmut.edu.vn Câu 1 Lương Phú Ngân 2212178
ngan.luongphungan@hcmut.edu.vn Câu 2 Trần Kim Ngân 2212196
ngan.tranwiwai1710@hcmut.edu.vn Câu 2 Huỳnh Nhật Nam 2212126 nam.huynhnhat@hcmut.edu.vn Câu 2 Nguyễn Xuân Mai
2211987 mai.nguyenxuan1002@hcmut.edu.vn Câu 3 Lê Hà Mi 2212014 mi.leha18112004@hcmut.edu.vn Câu 3 Trần Thị Ngọc Mỹ 2212116 my.tranthingoc@hcmut.edu.vn Câu 3 Câu hỏi 1 Chu trình Rankine
Hơi nước đi vào turbine của một nhà máy điện ở 500C và 10 MPa rồi được ngưng tụ ở 125 kPa.
Giả sử nhà máy vận hành theo chu trình Rankine lý tưởng. Bài làm
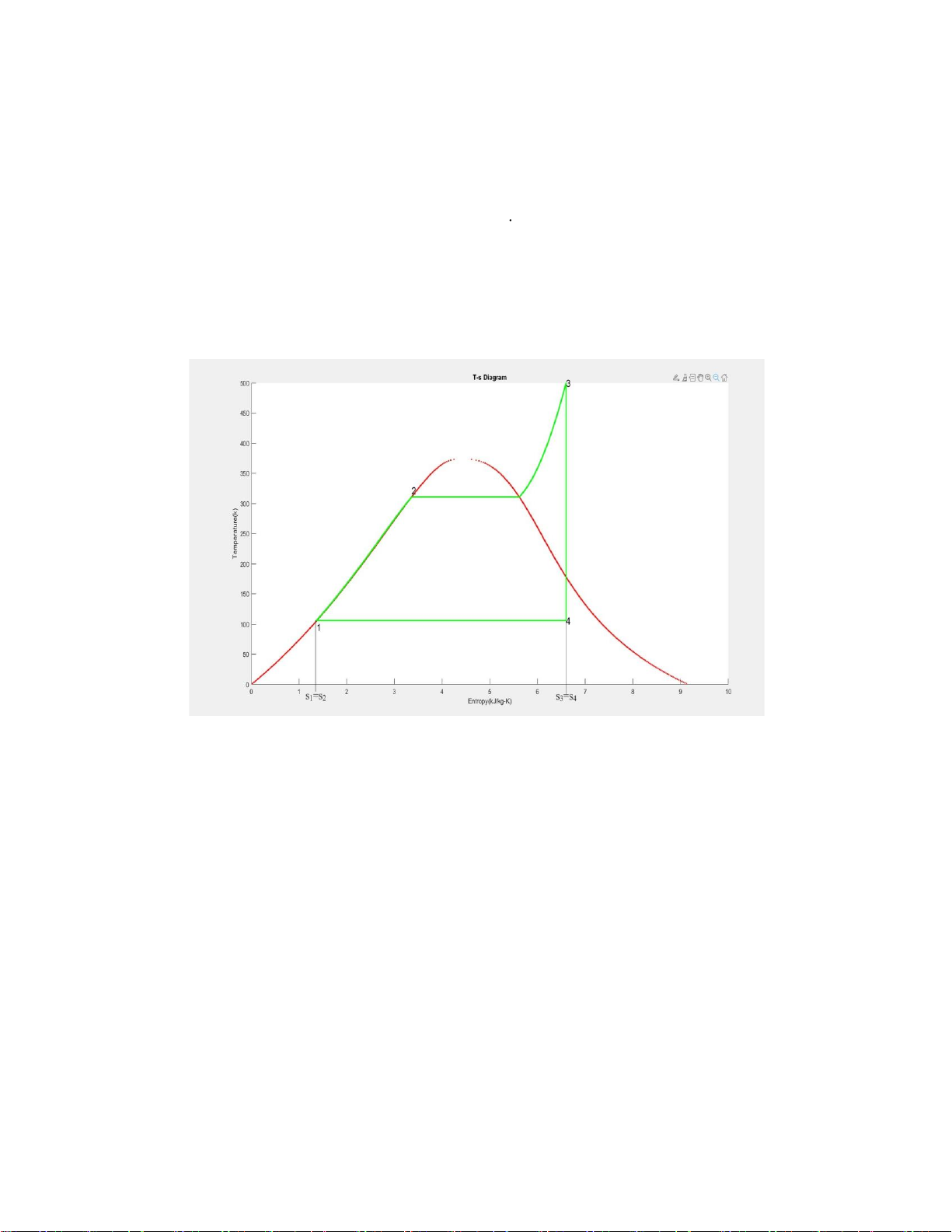
a) Vẽ giản đồ T-s của chu trình
Hình 1.Giản đồ T-s của chu trình Rankine
b) Công sinh ra trên mỗi kg nước: X=600; Y=5; Z=75; H=84
Công sinh ra trên mỗi kg nước là tổng công sinh ra của toàn chu trình Rankine (wnet ¿ Được tính bằng:
Wnet = Wt - Wp = ( h3 – h4 ) – Wp
với Wp = v1 ( P2 – P1 )
h1, h2, h3, h4 của nước tương ứng với các giai đoạn trong giản đồ sau: 2
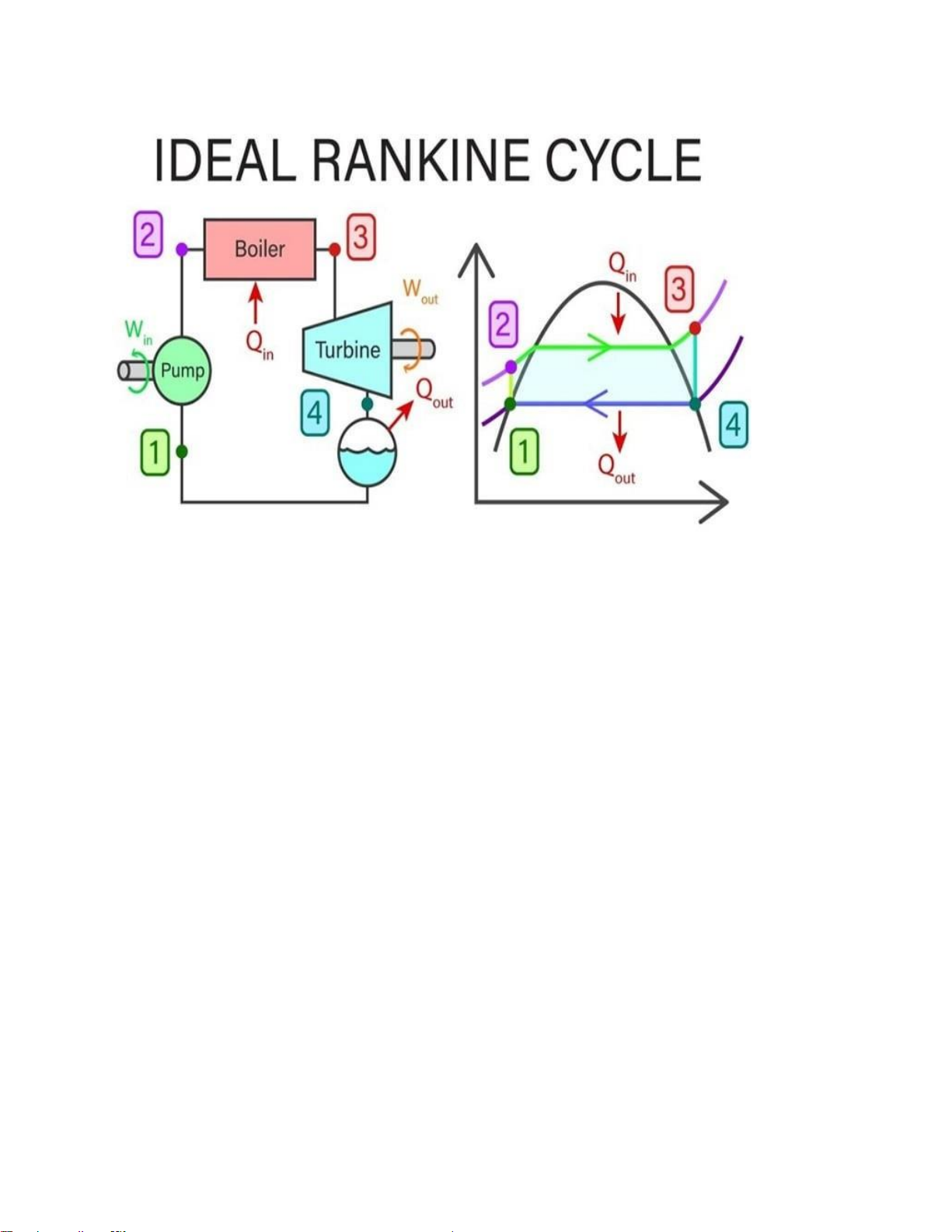
Hình 2. Giản đồ chu trình Rankine cơ bản
{ P1=P4=125 kPa
Ta có: P2=P3=10 MPa T 3=500 ℃ Ở 10 MPavà 500℃: •
h3=¿3375.1 kJ/kg ( bảng A-6 )
h1=444.36 kJ / kg 3 1 (bảng A-5) Ở 125 kPa: {v =0.001048m
h4=2684.9 kJ / kg
wp = h2 – h1 = v (P2 – P1) = 0.001048 (10x103 – 125) = 10.349 kJ/kg
=> h2 = wp + h1 = 875 + 444.36 = 1319.36 kJ/kg
wt = h3 – h4 = 3375.1 – 2684.9 = 690.2 kJ/kg
wnet = wt – wp = 690.2 – 10.349 = 679.851 kJ/kg 3
c) Tỷ lệ công cần trích từ turbine để nén lưu chất được tính như sau: Wt 690.2 = =65.69 W p 10.349
{ P 2=P3=5 MPa
d) Tính hiệu suất nhiệt của chu trình: X=600; Y=5; Z=75; H=84 P1=P 4=75 kPa T 3=600 ∘ C
Trạng thái 1 (Bảng A-5): kJ h1 = hf = 384,44 kg m3 v1 = vf = 0,001037 kg kJ
Wp = v1 ( P2 – P1 ) = 0,001037 ( 5000 – 75 ) = 5,1072 = h – h kg 2 1 kJ
=> h2 = h1 + Wp = 384,44 + 5,1072 = 389,5472 kg
Trạng thái 3 (Bảng A-6) : kJ h = 3666,9 3 kg kJ S = 7,2605 3 kg . K
Trạng thái 4 (Bảng A-6):
S4 = S3 => Sf < S4 < Sg S4 = Sf + x4 .sfg
(=) 7,2605 = 1,2132 + x4 . 6,2426 =) x4 = 0,9687 kJ
h = h + x .h = 384,44 + 0,9687. 2278 = 2591,1386 4 f 4 fg kg
* Hiệu suất của chu trình W net 1070,6542 ƞ = = = 32,67% q∈¿¿ 3277,3528
Wnet = Wt - Wp = ( h3 – h4 ) – Wp = 1075,7614 – 5,1072 = 1070,6542
qin = h3 – h2 = 3666,9 – 389,5472 = 3277,2582 4
e) So sánh hiệu suất nhiệt vừa tính được với hiệu suất nhiệt của chu trình Carnot. Giải
thích: X=600; Y=5; Z=75; H=84 Th = 600oC = 873oK Tc = 91,76oC = 364,76oK Tc 364,76 ƞ = 1 - = 1- = 58,21% Th 873
Hiệu suất nhiệt của chu trình Carnot được tính dựa trên lý thuyết hoàn hảo và không có mất
mát nhiệt. Nó đạt được khi quá trình nhiệt xảy ra một cách lý tưởng, không có mất mát nhiệt và
không có mất mát ma sát. Do đó, hiệu suất Carnot là một giới hạn lý thuyết và thường cao hơn so
với các chu trình thực tế.
Trong khi đó, chu trình Rankine là một chu trình công nghiệp thực tế được sử dụng trong nhà
máy điện nhiệt. Nó sử dụng nguyên lý hoạt động của máy quay turbine. Chu trình Rankine bao
gồm các quá trình như nhiệt mở rộng trong turbine, ngưng tụ trong bình ngưng tụ và nén trong
bơm. Chu trình này thường bị mất mát nhiệt và có mất mát ma sát, do đó hiệu suất nhiệt của chu
trình Rankine thường thấp hơn so với hiệu suất Carnot.
Vì vậy, sự khác nhau giữa hiệu suất nhiệt của chu trình Carnot và chu trình Rankine nằm ở
mức độ mất mát nhiệt và mất mát ma sát trong quá trình hoạt động thực tế. Chu trình Carnot
không có mất mát nhiệt và mất mát ma sát, trong khi chu trình Rankine thường có mất mát nhiệt
và mất mát ma sát, dẫn đến hiệu suất nhiệt thấp hơn.
f) Tính lại công tổng và hiệu suất nhiệt của chu trình Rankine nếu hiệu suất đẳng entropy
của turbine và bơm cùng là 83%: X=600; Y=5; Z=75; H=84 ƞp = ƞT = 84%
Trạng thái 1 : { h 1=384,44 kJ kg m3 v 1=0,001037 kg 5 kJ h 3=3666,9 kg kJ S 3=7,2605 Trạng thái 3 : { kg. K
Trong thực tế sẽ có tổn thất do ma sát, tổn thất truyền nhiệt trong turbine hoặc máy bơm . Xác
định những tổn thất đó thông qua hiệu suất đẳng entropy. Ký hiệu h2 , h4 ( lý tưởng ) ; h2’ và h4’ ( thực tế ) Máy bơm :
v 1( P2−P1) 5,1072 kJ Ƞ = 0,84 = h = 390,52 p 2’
h2' −h1 (=)
h 2'−384,44 => kg Turbine : h 3 3666,9−h 4 ' kJ ƞ −h 4 ' = 2763,26 T = 0,84 = => h h 3 4’ −h 4 (=) 3666,9−2591,1386 kg
Hiệu suất nhiệt của chu trình : Wnet 897.56 ƞ = = = 27,39 % q∈¿¿ 3276,38 kJ
Wnet = WT – Wp = ( h3 – h4’ ) – ( h2’ – h1 ) = 897,56 kg kJ
qin = h3 – h2’ = 3666,9 – 390,52 = 3276,38 kg Câu hỏi 2
Hydrogen là nguồn nhiên liệu sạch để sản xuất điện, có thể được tổng hợp từ phản ứng phân huỷ ethanol:
CH3CH2OHg ↔ CH3CHOg + H2 g
a) Tính hằng số cân bằng áp suất của phản ứng ở nhiệt độ thường:
Ở nhiệt độ thường, T = 298K, P = 1 bar
Hằng số cân bằng áp suất KP của phản ứng ở nhiệt độ thường: ΔG0T = - R P TlnK (μ0 + μ0 CH CHO H −μ0 ) = - RTlnK C H OH P 3 2 2 5
(-128,86 + 168,49). 103 = - 8,314. 298. lnKP 6 KP = 1,13.10-7
b) Tính hằng số cân bằng áp suất của phản ứng ở 390oC và 1 bar, nếu Δ H 0 được xem là rxn không đổi: X=390
- Theo định luật Hess, ta có:
Δ H 0 = ∑ v . Δ H 0 rxn i
sản phẩm −∑ v . Δ H 0 i phảnứng
= (- 166,19 + 235,10).103 = 68,91.103 (J/mol)
- Hằng số cân bằng áp suất của phản ứng ở 390oC và 1 bar: K P, T ΔH0 ln 1 2 rxn . 1 − K = - T T ) P, T R ( 2 1 1 ln K 68,91.103 1 P,T 2 1 −7 . = - 1,13.10 8,314 ( − 390+ 273 ) 298
K P,T = 0,505 2
c) Tính độ chuyển hoá của ethanol và thành phần của hệ khi đạt trạng thái cân bằng ở 390° C và 1 bar: X=390
Hằng số cân bằng áp suất của phản ứng ở 390°C, 1 bar: KP = 0,505
Giả sử có 1 mol CH3CH2OH ban đầu x mol CH3CH2OH phản ứng
CH3CH2OHg ↔ CH3CHOg + H2 g 1 0 0 (mol) x x x 1-x x x ( P ∆n
Ta có: Kp = Kn ∑ i) n cb ∆ n = 2-1 = 1
∑ ni = 1 – x + x + x = 1 + x 1 1 => 0,505 = Kn ( ) 1+ x 7 x2
=> Kn = 0,505×(1+ x) = 1−x => x = 0,579 0,579 => Độ chuyển hóa = ×100 %=59,7 % 1
d) Tính độ chuyển hoá của ethanol và thành phần của hệ khi đạt trạng thái cân bằng ở 390
°C và 0,50 bar: X=390; Y=0,50
Do hằng số cân bằng áp suất chỉ phụ thuộc vào nhiệt độ nên K Pở 390℃, 0,5 bar cũng bằng 0,505 ( P ∆n
Ta có: Kp = Kn ∑ i) n cb 0,5 1
Thay P = 0,5 ta được: 0,505 = Kn ( ) 1+ x x2
=> Kn = 1,01×(1+ x) = 1−x => x = 0,709 0,709 => Độ chuyển hóa = ×100 %=70,9 % 1
e) Tính hằng số cân bằng áp suất của phản ứng ở 390°C và 1 bar, nếu Δ H 0 thay đổi theo rxn nhiệt độ: X=390 T ❑ rxn , T rxn ,298 i p i Δ H 0 = Δ H 0 + 298 ∫ i
(∑ v ( c ) )dT 663 ❑ rxn , 663 rxn ,298 i p i Δ H 0 =Δ H 0 + 298 ∫ i
(∑ v ( c ) )dT (1)
Theo bảng tra A.2.1, ta có A, B, C, D, E Ta có: - CH3CH2OH 8
c p = 3, 518 + 20,001.10-3.663+(-6,002).106.6632 = 14,1404 => c =117,57 R p - CH3CHO
c p =1, 693 + 17,978.10-3.663 - 6,158.10-6.6632 = 10,91 => c = 90,67 R p - H2
c p = 3,249 + 0,442.10-3.663 +_0,083.10-5.663-2 = 3,54 =>c = 29,45 R p 663 (1) Δ H 0 =Δ H 0
+∫ (117,57+90,67+29,45 )dT rxn , 663 rxn ,298 298
= 68,91 + 86758,11914 = 86827,03 (kJ/mol)
Hằng số cân bằng áp suất của phản ứng ở 390°C và 1 bar, nếu Δ H r 0xn thay đổi theo nhiệt độ: K P, T Δ H 0 ln 1 1 2 rxn ,663 . − K = - R (T T ) P, T 2 1 1 K P,T ln 2 86827,03 1 = - . 1,13.10−7 8,314 ( 1 − 390+273 ) 298
K P,T = 4,726.10-16 2 Câu hỏi 3 9
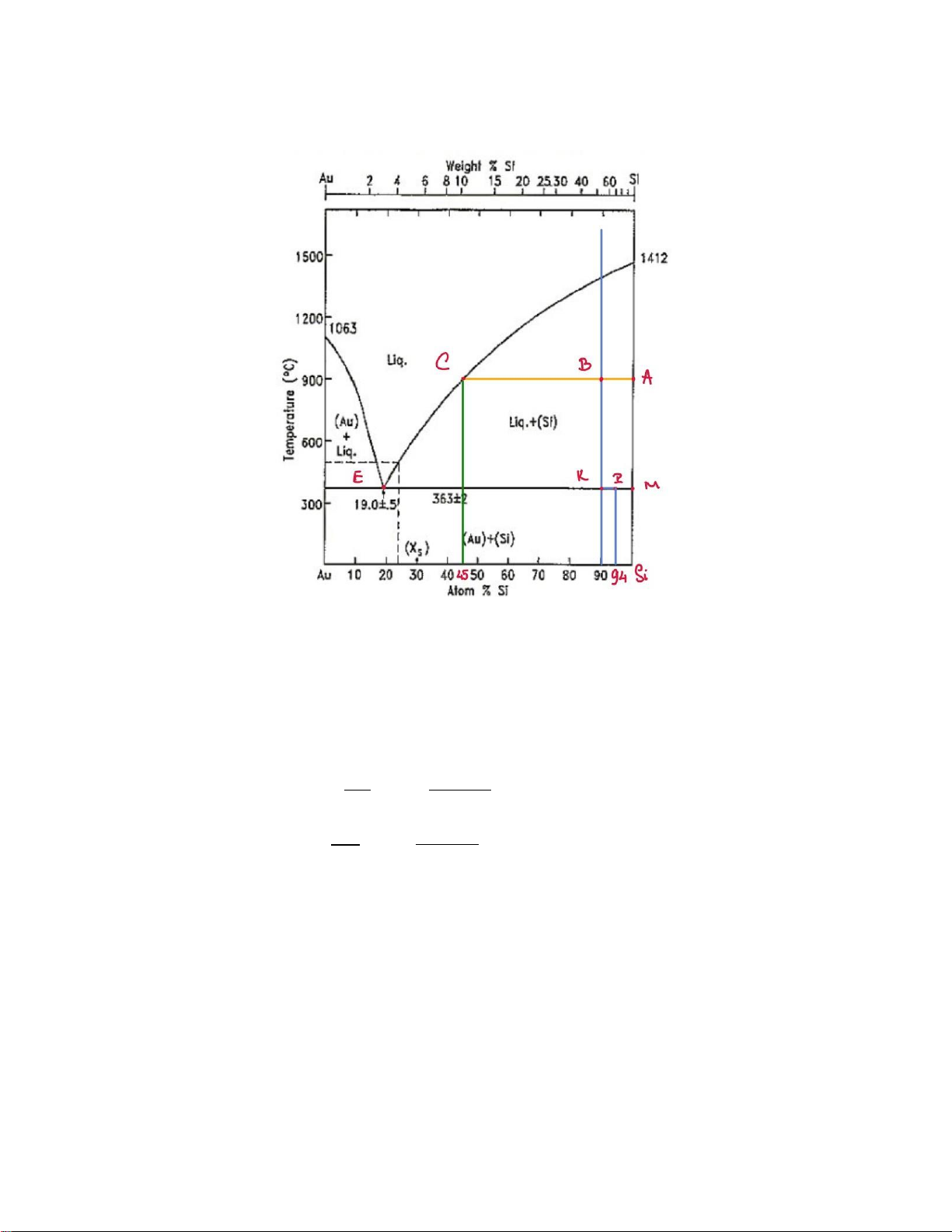
Xét giản đồ nhiệt độ – thành phần ở 1 atm của hệ cân bằng lỏng – rắn gồm 2 cấu tử Au và Si:
a) Xác định những pha cân bằng khi trộn 2 mol Au và 18 mol Si ở 1200o C: X=2; Y=18; Z=900
Tính số mol của từng cấu tử trong mỗi pha.
- Tại 2 mol Au và 18 mol Si ở nhiệt độ 1200o C gồm 2 pha: lỏng và Si rắn.
- Số mol tổng: ntổng=2+18=20 (mol) BC 90−45
- Lượng mol rắn Si: n = ∗n = ∗20=16,36 (mol ) A AC tổng 100−45 AB 100−90
- Lượng mol lỏng: n = ∗n = ∗20=3,64 (mol ) C AC tổng 100−45
- Tại C, Si chiếm 45% và Au chiếm 55% ¿{ > nSi =n (C )
C∗0,45=3,64∗0,68=1,638( mol) nAu =n (C )
C∗0,55=3,64∗0,32=2,002(mol) 10 E(19,363) K (90,363 ) P (94,363 )
- Tọa độ các điểm:{ M (100,363)
b) Tính khối lượng lớn nhất có thể có của pha lỏng eutectic?
Khối lượng eutectic tối đa khi P trùng với M tại E 100−90
Lượng mol lỏng e: n K M ×20=2,47 mol = ×n = E ME tổng 100−19
Tại E: Si chiếm 19% và Au chiếm 81% n
=n × 0,19=2,47 × 0,19=0,4693 mol
Lượng mol pha lỏng eutectic : Si( E) E
{ n =n × 0,81=2,47 × 0,81=2,0007 mol Au( E) E m =n
× 28,09=0 , 4693 ×28,09=13,18 g Khối lượng: ⇒ Si (E ) Si(E ) {m ×196,97 Au =n
=2,0007 ×196,97=393,48 g ( E ) Au ( E )
Vậy khối lượng lớn nhất mà pha lỏng eutectic có thể nhận là
393,48 + 13,18 ¿ 406,66g
c) Tính khối lượng của pha lỏng eutectic và các pha rắn khi MP/MK = 60% (H=60)
- Điểm hệ tại K: Hệ K= lỏng e + rắn chung P
MP =0,6 ⇒ MP=0,6. MK =0,6.(100−90)=6 MK - Tọa độ P: (94,363) KE 90−19 •
Lượng mol Rắn chung: n = ×n = × 20=18,93 mol P PE tổng 94−19
- Tại P: Si chiếm 94% và Au chiếm 6%
=n × 0,94=18,93 × 0,94 ≈ 17,79 mol
Lượng mol pha rắn P: nSi (P) P { n ×0,06 Au =n
=18,93 ×0,06 ≈ 1,14 mol (P) P =n
×28,09=17,79 ×28,09 ≈ 499,72 g
Khối lượng pha rắn P: mSi(P ) Si(P) { m ×196,97 Au =n
=1,14 ×196,97 ≈ 224,55 g (P) Au (P) KP • 94
Lượng mol lỏng e: n = ×n −90 = ×20=1,07 mol e PE tổng 94−19
- Tại E: Si chiếm 19% và Au chiếm 81% 11 n
=n × 0,19=1,07 × 0,19 ≈ 0,21mol
Lượng mol pha lỏng eutecric : Si (E) E {n × 0,81 Au =n
=1,07 ×0,81 ≈ 0,86 mol ( E) E =n
×28,09=0,21× 28,09 ≈5,90 g Khối lượng: ⇒
mSi( E) Si( E) { m × 196,97 Au =n
=0,86× 196,97 ≈ 169,39 g (E ) Au( E )
Khối lượng lỏng eutectic⇒ me=5,90+169,39=175,29 g 12




