









Preview text:
BÁO CÁO THÍ NGHIỆM HÓA LÝ
BÀI 3: HẤP PHỤ TRÊN BỀ MẶT CHẤT RẮN
Ngày thí nghiệm: 10/04/2024
GVHD: Trần Thị Nhung Lớp: 221282B Nhóm: 7 Tên thành viên Mã số sinh viên Lê Trung Hội 22128127 Lê Thị Mây 22128147 Huỳnh Như An Phúc 22128165
I. MỤC TIÊU THÍ NGHIỆM
- Phân biệt được hấp phụ với hấp thụ và trình bày được phương trình hấp
phụ đẳng nhiệt Langmuir và Freundlich.
- Trình bày được nguyên tắc và xác định được bằng thực nghiệm lượng
chất bị hấp phụ trên bề mặt chất hấp phụ.
- Dựng được các đường hấp phụ và xác định được các hệ số trong
phương trình Langmuir và phương trình Freundlich. II. GIỚI THIỆU
Những vật có bề mặt tiếp xúc lớn với pha khí hay pha lỏng
thường có khả năng thu hút các chất khí hay chất tan trong
pha lỏng. Nếu sự thu hút đó chỉ xảy ra trên bề mặt của vật
thì gọi là sự hấp thụ. Ví dụ, khi cho than hoạt tính vào dung
dịch acid acetic thì một số phân tử acid acetic sẽ tập trung (bị hấp phụ) lên
trên bề mặt của than hoạt tính. Than hoạt tính được gọi là chất hấp phụ,
acid acetic là chất bị hấp phụ, nước là môi trường trong đó sự hấp phụ
xảy ra. Bằng cách đo nồng độ acid acetic trong nước trước và sau khi hấp
phụ, biết khối lượng chất hấp phụ m gam ta có thể biết được lượng acid
acetic đã bị hấp phụ trên bề mặt 1 gam than hoạt tính.
Có nhiều phương trình thực nghiệm hoặc lí thuyết đã đuợc đưa ra để mô tả
sự hấp phụ đẳng nhiệt. Ở đây nêu ra một số phương trình hay gặp:
1. Phương trình Langmuir
Đây là phương trình có chứng minh lí thuyết dựa vào việc nghiên
cứu động học của sự hấp phụ. Phương trình này được rút ra từ giả
thiết về sự hấp phụ đơn lớp; bề mặt chất hấp phụ là đồng nhất;
không có sự tương tác giữa các phân tử sau khi bị hấp phụ. Phương trình có dạng: K . C K .C
θ= A = L hay A=A . L (1) Amax 1+ KL . C max 1+ K L . C
A là lượng chất bị hấp phụ bởi một gam chất hấp phụ (mol/g).
C là nồng độ chất bị hấp phụ trong môi trường lúc đạt cân bằng hấp phụ (mol/L).
Amax là hằng số, có ý nghĩa là lượng chất có thể bị hấp phụ
tối đa trên 1 gam chất hấp phụ (mol/g).
KL là hằng số Langmuir (L/mol).
Để tìm các hằng số trong phương trình Langmuir, người ta dùng
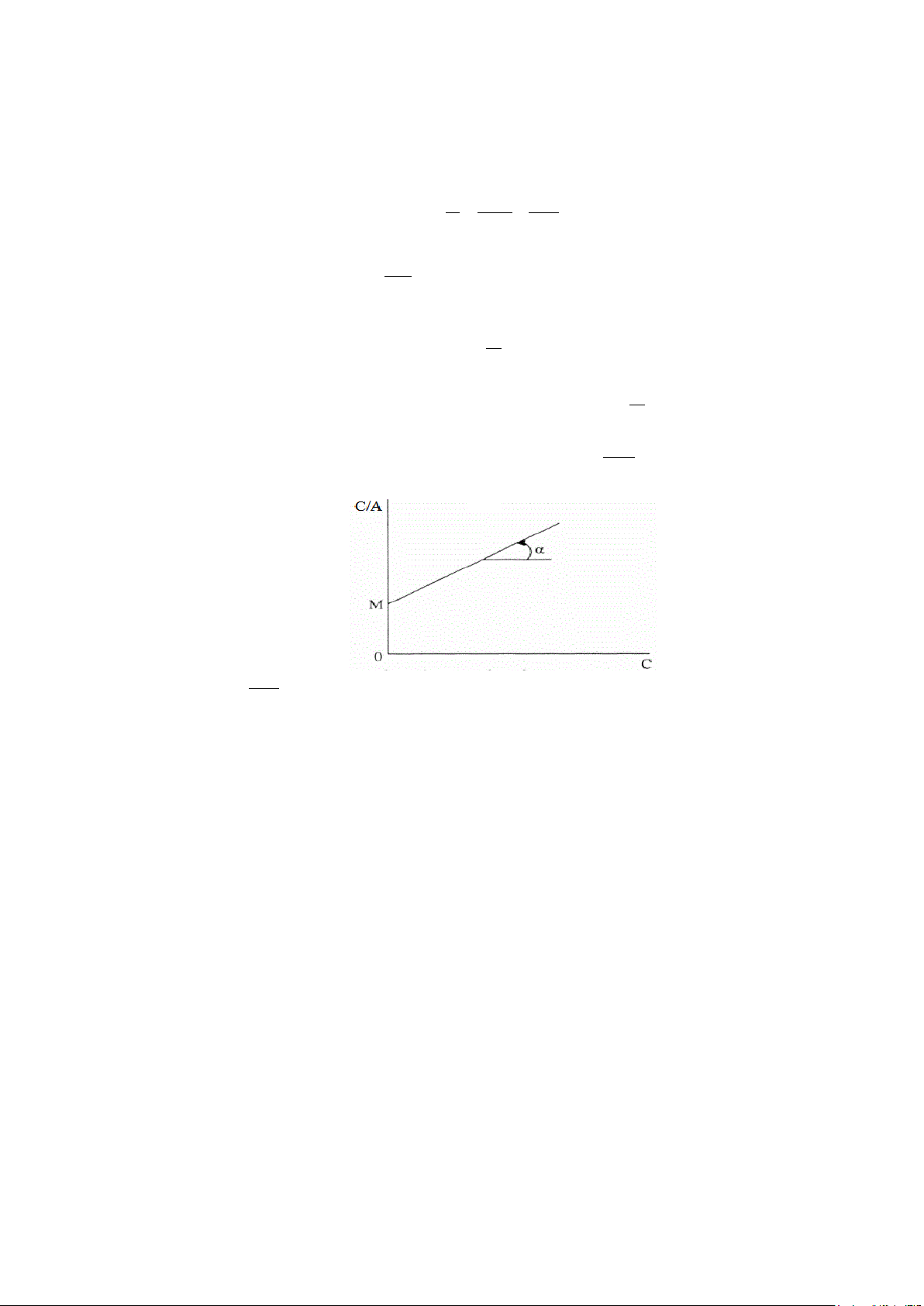
phương pháp đồ thị. Muốn vậy ta biểu diễn phương trình (1) dưới dạng khác:
C = α + C A A A max max 1 Trong đó
được thay bằng α là một hằng số. K L
Theo phương trình này C phụ thuộc bậc nhất vào C. A
Phương trình hồi quy tuyến tính C =f (C) có dạng A 1
y=mx+n, trong đó hệ số góc m= A và đoạn chắn max n= α Amax
Đồ thị để tìm các hằng số trong phương trình Langmuir
2. Phương trình Freundlich
Đây là phương trình thực nghiệm áp dụng cho sự hấp phụ khí
hoặc chất tan lên chất hấp phụ rắn: A = K.Cα
A là lượng chất bị hấp phụ bởi một gram chất hấp phụ (mol/g).
C là nồng độ chất bị hấp phụ trong môi trường khi đã đạt cân bằng
hấp phụ (mol/L). K và α đều là hằng số tại một nhiệt độ nhất định, α thường bé hơn 1.
Ở nồng độ cao, α = 0, tức A = K, nghĩa là chất hấp phụ bị bão hòa
chất bị hấp phụ và không thể hấp phụ thêm nữa dù có tăng thêm nồng độ.
Để tính các hằng số trong phương trình Frendlich, người ta cũng
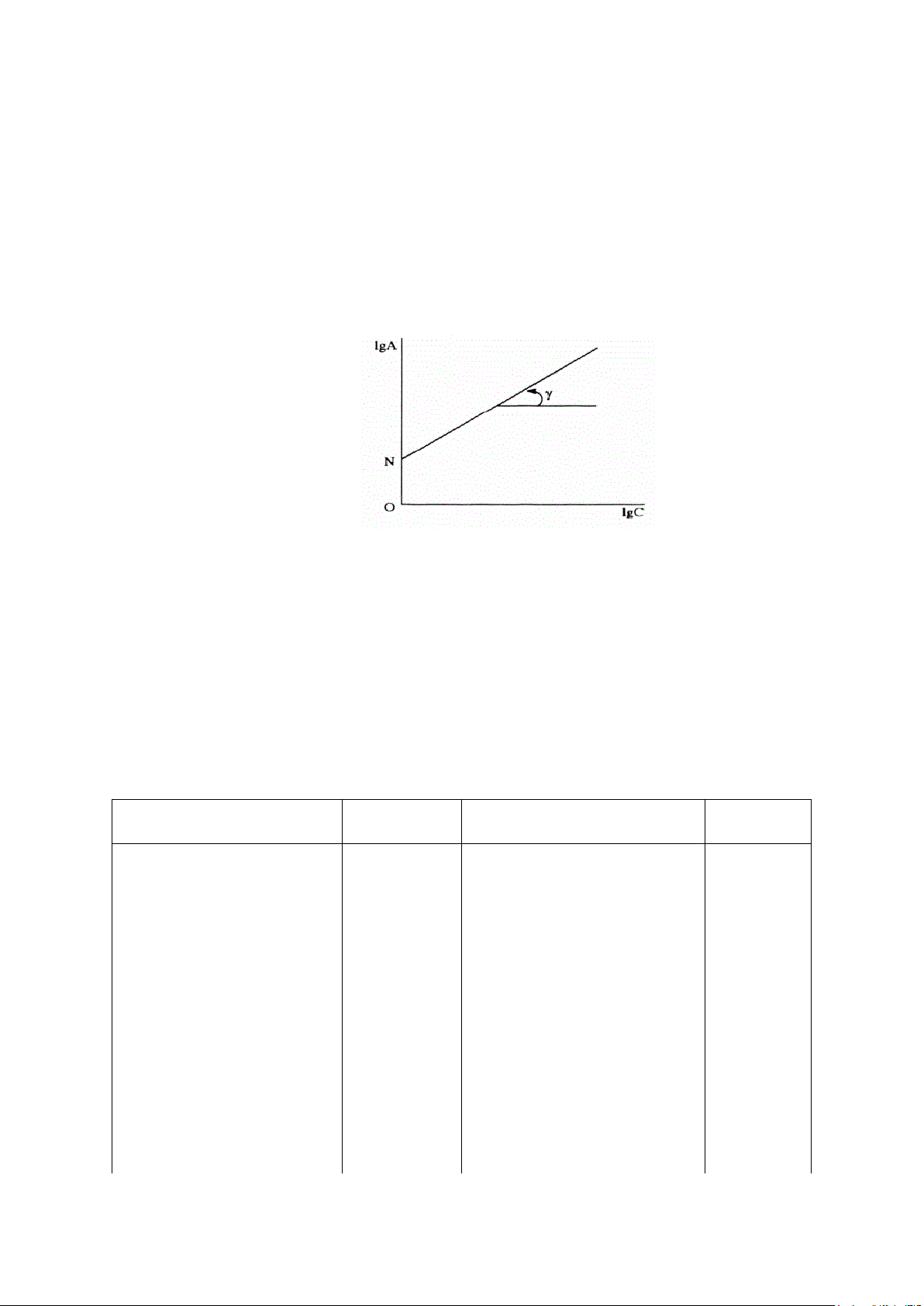
dùng phương pháp đồ thị. Phương trình Frendlich có dưới dạng: lgA = lgK + αlgC
Đồ thị để tìm các hằng số trong phương trình Freunlich
Như vậy lgA tỉ lệ bậc nhất với lgC. Đường hồi quy tuyến tính
lgA=f(lgC) có dạng y= mx + n, trong đó hệ số góc m = α và đoạn chắn n = lgK. III. THỰC NGHIỆM
1. Hóa chất và dụng cụ Dụng cụ Số lượng Hóa chất Số lượng Buret 25mL 3 CH3COOH 1M 1L Bình định mức 100mL 1 Acid oxalic rắn ống đong 100mL 3 NaOH rắn Pipet 10mL 7 Dung dịch chỉ thị phenolphtalein Bình tam giác 250mL 6 Bình tam giác 100 m L 3 Cốc 100mL 6 Chai đựng hóa chất 1 NaOH Phễu lọc 6 Cốc đựng dung dịch 1 thải
2. Quy trình thí nghiệm a. Định phân NaOH
b. Định phân CH3COOH
IV. KẾT QUẢ VÀ BÀN LUẬN 1. Kết quả thô a. Chuẩn độ NaOH m =0,3154 g acid oxalic C =0,05 N N acid oxalic Lần Vacid oxalic (mL) VNaOH (mL) 1 10 9,75 2 10 9,85 3 10 9,80 Trung bình 10 9,80 C = 0,05.10 =0,051 N N NaOH 9,8
b. Chuẩn độ acid acetic khi chưa có than hoạt tính Erlen VNaOH (mL) Vacid oxalic (mL) CN acid acetic 1 10,875 20 0,0277 2 21,000 20 0,0535 3 22,060 10 0,1125 4 21,125 5 0,2154 5 16,775 2 0,4278 6 20,925 2 0,5336 V . C NaOH N NaOH Với C = N acid acetic V acid acetic
c. Chuẩn độ acid acetic khi có than hoạt tính Với Erlen VNaOH (mL) Vacid oxalic (mL) CN acid acetic 1 9,025 20 0,023 2 16,100 20 0,041 3 16,950 10 0,086 4 17,350 5 0,177 5 14,350 2 0,366 6 20,175 2 0,514 V . C NaOH N NaOH C = N acid acetic V acid acetic
2. Kết quả sau xử lí
a. Hãy lập công thức và tính số milimol acid (x) đã bị than
hoạt tính hấp phụ
x=(C −C ) .0,05.1000=(C −C ).50 mmol 0 0 Erlen C0 (M) C (M) x (mmol) 1 0,0277 0,023 0,235 2 0,0535 0,041 0,625 3 0,1125 0,086 1,325 4 0,2154 0,177 1,92 5 0,4278 0,366 3,09 6 0,5336 0,514 0,98
b. Tính xem mỗi gam than hoạt tính hấp phụ bao nhiêu
milimol acid: A = x/m (mmol/g), trong đó m là khối lượng
chính xác của mẫu than hoạt tính Erlen x (mmol) m (g) A (mmol/g) 1 0,235 1,2013 0,196 2 0,625 1,1102 0,563 3 1,325 1,1034 1,2 4 1,92 1,2131 1,583 5 3,09 1,2102 2,553 6 0,98 0,9785 1,002
c. Lập bảng số liệu theo bảng mẫu như sau: Erlen C0 (M) C (M) x m (g) A lgC lgA C/A (mmol) (mmol/g) 1 0,0277 0,023 0,235 1,2013 0,196 -1,638 -0,638 0,1173 2 0,0535 0,041 0,625 1,1102 0,563 -1,387 -0,209 0,0729 3 0,1125 0,086 1,325 1,1034 1,2 -1,065 0,095 0,0716 4 0,2154 0,177 1,92 1,2131 1,583 -0,752 0,265 0,1118 5 0,4278 0,366 3,09 1,2102 2,553 -0,436 0,498 0,1433 6 0,5336 0,514 0,98 0,9785 1,002 -0,289 0,00087 0,513
d. Vẽ các đồ thị như trong hình 2 và hình 4 để xác định các hệ số
trong phương trình đẳng nhiệt Langmuir và Freundlich.
▪ Theo phương trình Langmuir ta có:
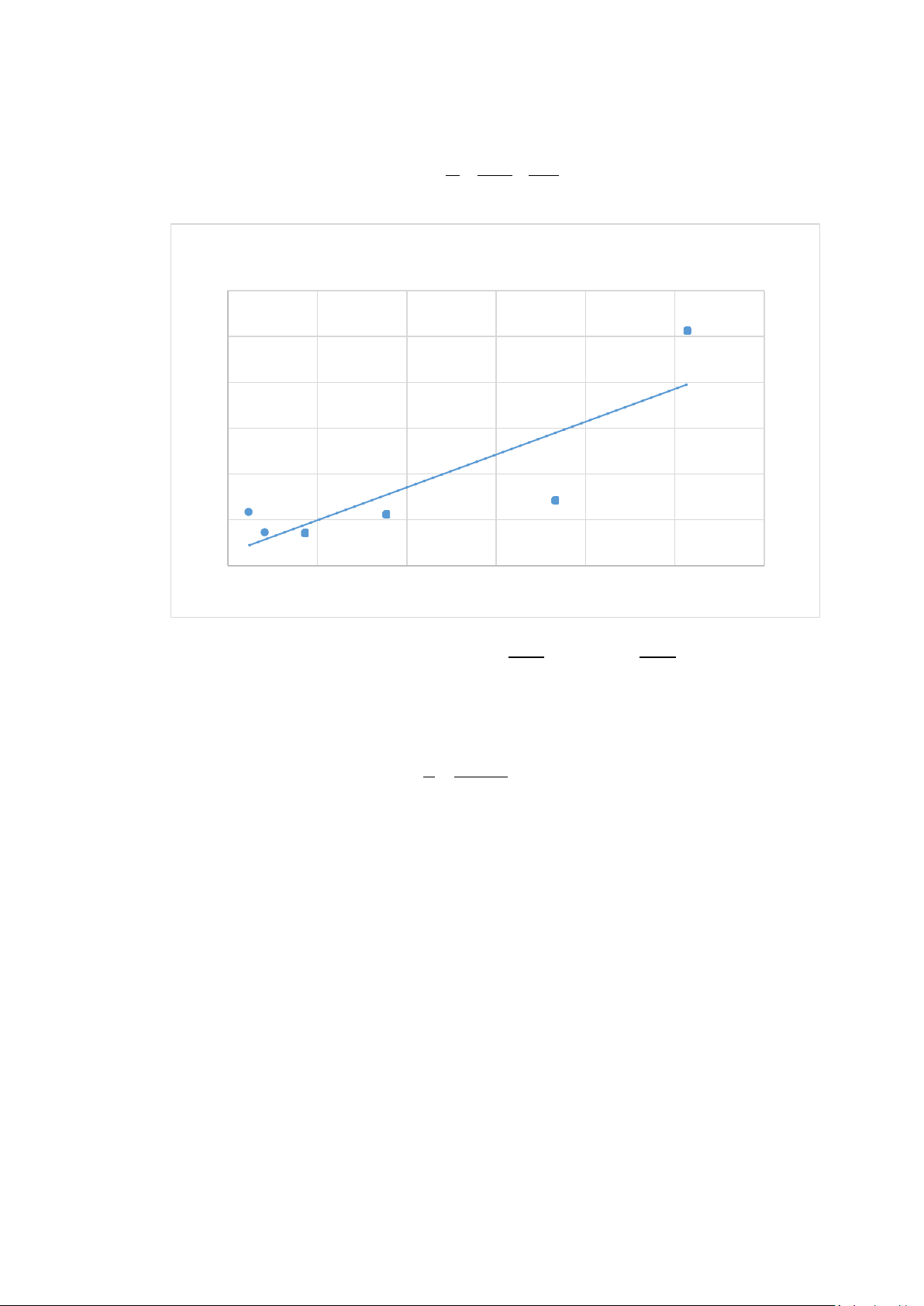
C = α + C A A A max max ĐỒ THỊ LANGMUIR C/A 0.6 0.513 0.5 0.4
f(x) = 0.716232349726962 x + 0.0275679256465929 R² = 0.701072966042851 0.3 0.2 0.1433 0.1173 0.1118 0.1 0.0729 0.0716 0 C (M) 0 0.1 0.2 0.3 0.4 0.5 0.6 1 α
Dựa vào đồ thị Langmuir, ta có =0,7162 và =0,0276 A A max max
Suy ra Amax = 1,3963 mmol/g và α = 0,0385 K 1 1 Hằng số Langmuir = = =25,95 α 0,0385
▪ Theo phương trình Freundlich, ta có: lgA = lgK + αlgC ĐỒ THỊ FREUNDLICH 0.6 0.4
f(x) = 0.585270769123849 x + 0.545012061952078 R² = 0.622999291083641 0.2 0 -1.8 -1.6 -1.4 -1.2 -1 -0.8 -0.6 -0.4 -0.2 -0.2 -0.4 -0.6
Dựa vào đồ thị Freundlich, ta có: α = 0,5853 và lgK = 0,545
Suy ra hằng số Freundlich K = 3,5075
▪ Vẽ đồ thị thực nghiệm, đồ thị Langmuir và đồ thị Freundlich: K .C
− Phương trình Langmuir lý thuyết: A=A . L max 1+ K L . C
− Phương trình Freundlich lý thuyết: lgA = lgK + αlgC
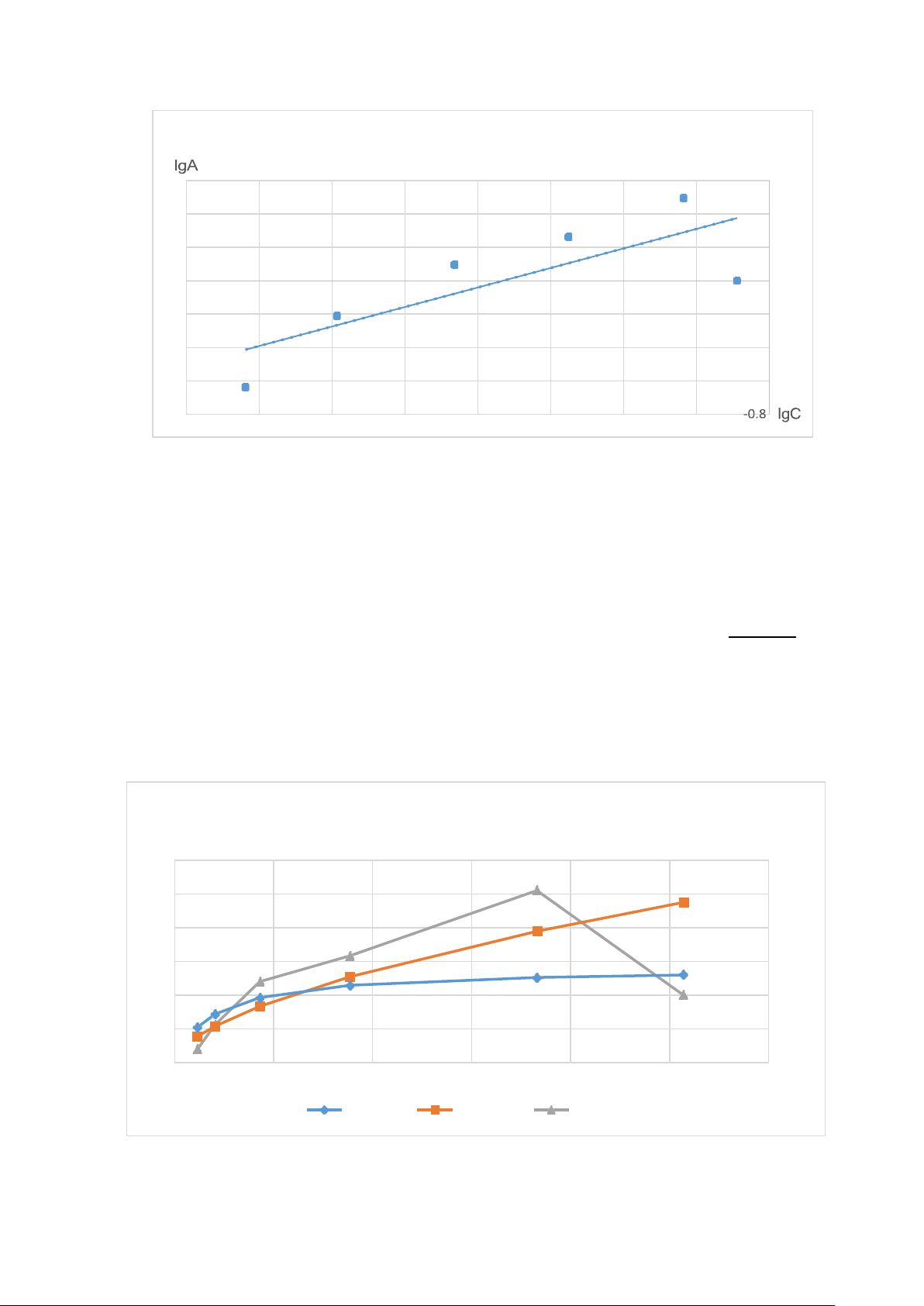
Đ Ồ THỊ Đ ƯỜN G PHƯƠN G TRÌN H Đ ẲNG N HIẸT HẤP PHỤ A 3 2.5 2 1.5 1 0.5 0 C (M) 0 0.1 0.2 0.3 0.4 0.5 0.6 Langmuir Freundlich thực tế 25,95. C A=1,3963. (Langmuir)
A=3,5075.C 0,5853 (Freundlich) 1 +25,95. C Nhận xét
+ Hai đồ thị của phương trình đường đẳng nhiệt Langmuir và
Freundlich có xu hướng tăng khi tăng nồng độ.
+ Tuy nhiên đường đẳng nhiệt thực nghiệm có xu hướng tăng và giảm sau đó.
+ Càng tăng nồng độ thì sự chênh lệch của đường đẳng nhiệt của 2
phương trình có sự chênh lệch rõ rệt.
+ Đường thực nghiệm là đường cong không theo quy luật, gần với
đường Freundlich hơn so với đường Langmuir.
3. Nhận xét kết quả
− So sánh R2 của 2 đồ thị hai đồ thị của phương trình đẳng nhiệt
Langmuir và Freundlich ta thấy R2 của phương trình
Langmuir cao hơn phương trình Freundlich, qua đó ta thấy
mức độ tin cậy của đồ thị theo phương trình Langmuir đáng
tin cậy hơn phương trình Freundlich.
− Nhìn chung, theo đường thực nghiệm thì A tăng và giảm
nhiều so với đường Freundlich và đường Langmuir. Cả ba
đường biến đổi có sự chênh lệch khác biệt. Kết quả thực
nghiệm có vẻ chưa phù hợp so với lý thuyết. Các nguyên nhân
dẫn đến việc này có thể là do than hoạt tính hấp phụ chưa đều,
cân và pha chất chuẩn gốc chưa đúng, kĩ thuật chuẩn độ chưa
đúng và sai số trong quá trình tính toán.
Các khó khăn gặp phải trong quá trình thực nghiệm và biện pháp khắc phục
+ Do thao tác chuẩn độ sai, cảm quan khác nhau khi chuẩn độ,
thao tác với dụng cụ chưa hợp lý, kỹ năng xử lý số liệu chưa tốt
→ Sai số lớn trong kết quả.
+ Than hoạt tính hấp phụ khác nhau ở mỗi bình, mỗi bình có khối
lượng than hoạt tính khác nhau.
+ Pha dung dịch có nồng độ chưa chính xác, thao tác sai, cân hóa
chất có sự sai lệch so với lượng tính toán lý thuyết.
+ Dung dịch NaOH tiếp xúc với không khí gây sai lệch nồng độ.
+ Lấy thể tích dung dịch acid acetic chưa chính xác do dùng dụ cụ đo có sai số lớn.
+ Sai số do môi trường: nhiệt độ, độ ẩm ảnh hưởng đến dụng cụ, sai số chuẩn độ.
Biện pháp khắc phục:
+ Chuẩn bị bài kỹ trước khi đến lớp, nắm rõ các thao tác trong thí nghiệm.
+ Rèn luyện thêm kỹ thuật chuẩn độ, rèn luyện thêm kỹ năng như
lấy nữa giọt, lấy giọt cuối cùng để hạn chế thấp nhất sai số.
+ Nên thực nghiệm thí nghiệm nhiều lần để giảm thiểu sai số.
+ Cân thực hiện cẩn thận, ránh vội vàng dẫn đến sai sót trong quá trình thí nghiệm.
+ Rèn luyện thêm kỹ năng cân hóa chất để cân hóa chất được độ
chính xác cao, gần với lý thuyết.
+ Đậy kín dung dịch NaOH bằng đĩa petri hoặc các dụng dụ khác
để tránh NaOH tiếp xúc với không khí.
V. TRẢ LỜI CÂU HỎI
1. Phân biệt hấp phụ và hấp thụ. Cho ví dụ cụ thể.
− Hấp phụ là sự tích lũy chất trên bề mặt phân cách các pha
(khí – rắn, lỏng – rắn, khí – lỏng, lỏng – lỏng). Chất có trên
bề mặt, trên đó xảy ra sự hấp phụ gọi là chất hấp phụ,
còn chất được tích lũy trên bề mặt gọi là chất bị hấp phụ.
VD: Khi cho than hoạt tính tiếp xúc với O2 thì các phân tử
O2 tập trung lên bề mặt của than hoạt tính, ta nói than hấp
phụ O2. Trong quá trình trên, than hoạt tính được gọi là chất
hấp phụ, O2 là chất bị hấp phụ.
− Hấp thụ là hiện tượng các chất bị hút khuếch tán qua mặt
phân cách vào trong toàn bộ vật lỏng hoặc rắn. Khác với
hấp phụ chỉ bám trên bề mặt.
VD: Hấp thụ khí CO2 vào soda để sản xuất nước ngọt có gas.
2. Trình bày cách rút ra phương trình đẳng nhiệt
Langmuir. Ý nghĩa của các đại lượng trong phương trình này.
Đây là phương trình có chứng minh lí thuyết dựa vào việc
nghiên cứu động học của sự hấp phụ. Phương trình này được
rút ra từ giả thiết về sự hấp phụ đơn lớp; bề mặt chất hấp phụ
là đồng nhất; không có sự tương tác giữa các phân tử sau khi
bị hấp phụ. Phương trình có dạng: K . C K .C
θ= A = L hay A=A . L (1) Amax 1+ KL . C max 1+ K L . C
A là lượng chất bị hấp phụ bởi một gam chất hấp phụ (mol/g).
C là nồng độ chất bị hấp phụ trong môi trường lúc đạt
cân bằng hấp phụ (mol/L).
Amax là hằng số, có ý nghĩa là lượng chất có thể bị hấp
phụ tối đa trên 1 gam chất hấp phụ (mol/g).
KL là hằng số Langmuir (L/mol).
3. Trình bày cách rút ra phương trình đẳng nhiệt
Freundlich. Ý nghĩa của các đại lượng trong phương trình này.
Đây là phương trình thực nghiệm áp dụng cho sự hấp
phụ khí hoặc chất tan lên chất hấp phụ rắn: A = K.Cα (4)
A là lượng chất bị hấp phụ bởi một gram chất hấp phụ (mol/g).
C là nồng độ chất bị hấp phụ trong môi trường khi
đã đạt cân bằng hấp phụ (mol/L). K và α đều là
hằng số tại một nhiệt độ nhất định, α thường bé hơn 1.
Ở nồng độ cao, α = 0, tức A = K, nghĩa là chất hấp phụ
bị bão hòa chất bị hấp phụ và không thể hấp phụ thêm nữa
dù có tăng thêm nồng độ.




