




Preview text:
PHÒNG GD&ĐT ……..
MA TRẬN ĐỀ KIỂM TRA GIỮA KÌ I TRƯỜNG …….
MÔN KHOA HỌC TỰ NHIÊN 8 1. Ma trận.
- Thời điểm kiểm tra: Kiểm tra giữa học kì I khi kết thúc nội dung: Tiết 24 bài 7: Tốc độ phản ứng và chất xúc tác và tiết
8 bài 16: Áp suất chất lỏng. Áp suất khí quyển.
- Thời gian làm bài: 90 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 50% trắc nghiệm, 50% tự luận). - Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 5,0 điểm, (gồm 20 câu hỏi: nhận biết: 16 câu, thông hiểu: 4 câu), mỗi câu 0,25 điểm;
+ Phần tự luận: 5,0 điểm (Nhận biết: 0 điểm; Thông hiểu: 2,0 điểm; Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm).
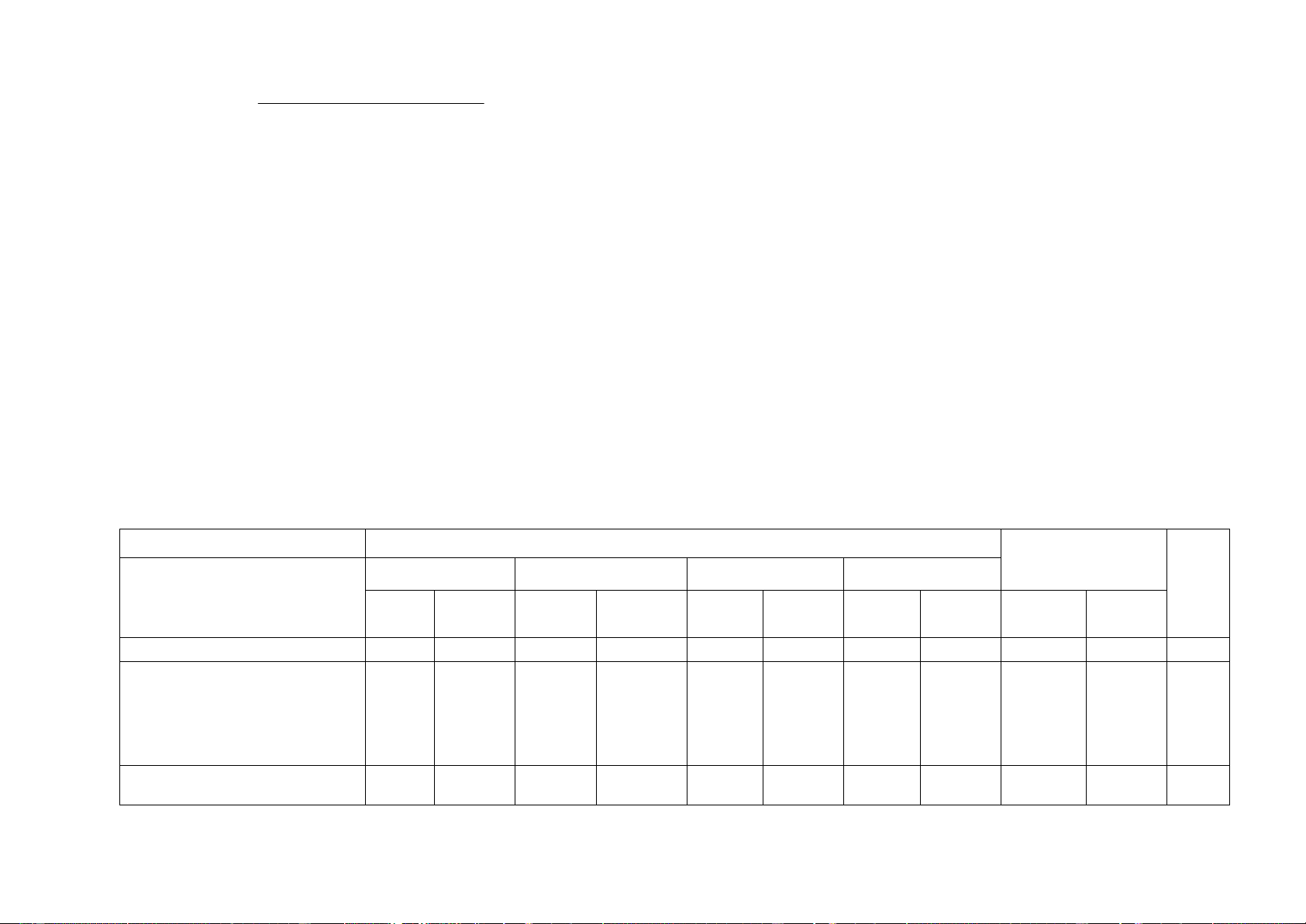
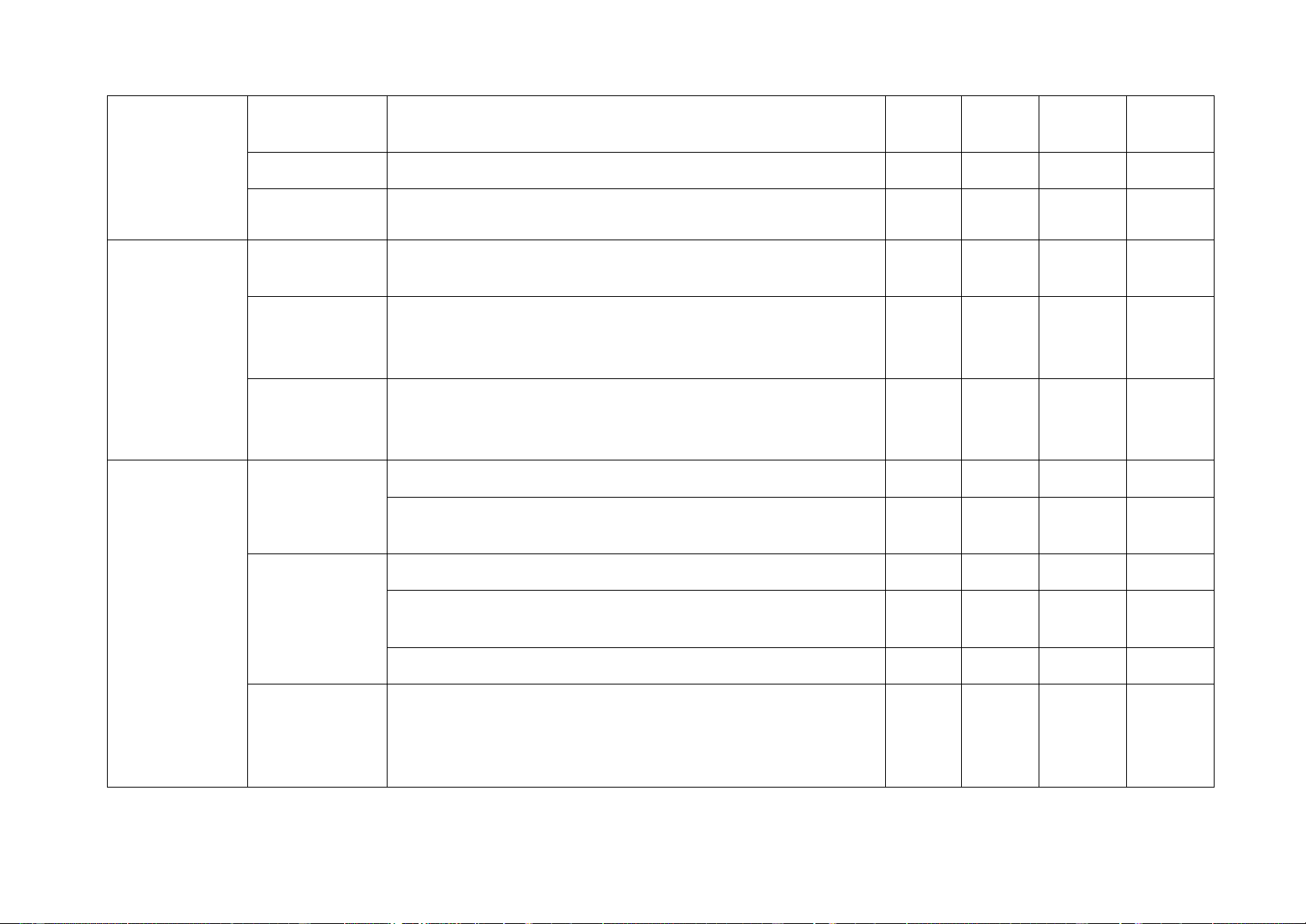
+ Nội dung nửa đầu học kì I: 100% (10 điểm) Chủ đề MỨC ĐỘ Tổng số ý/câu Nhận biết Thông hiểu Vận dụng Vận dụng cao Điểm số Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 1 2 3 4 5 6 7 8 9 10 11 12
1. Sử dụng một số hoá
chất, thiết bị cơ bản 4 1
trong phòng thí nghiệm
2. Phản ứng hóa học 2 1 1 (2đ) 2,75 2 Chủ đề MỨC ĐỘ Tổng số ý/câu Nhận biết Thông hiểu Vận dụng Vận dụng cao Điểm số Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 1 2 3 4 5 6 7 8 9 10 11 12
Mol và tỉ khối chất khí.
Dung dịch và nồng độ.
3. Định luật bảo toàn khối
lượng và phương trình hóa học.
Tính theo phương trình 4 1 (2đ) 3 3,75 hóa học
Tốc độ phản ứng và chất xúc tác.
4. Khối lượng riêng 3 0,75
5. Áp suất trên một bề 2 1 (1đ) 1,5 mặt
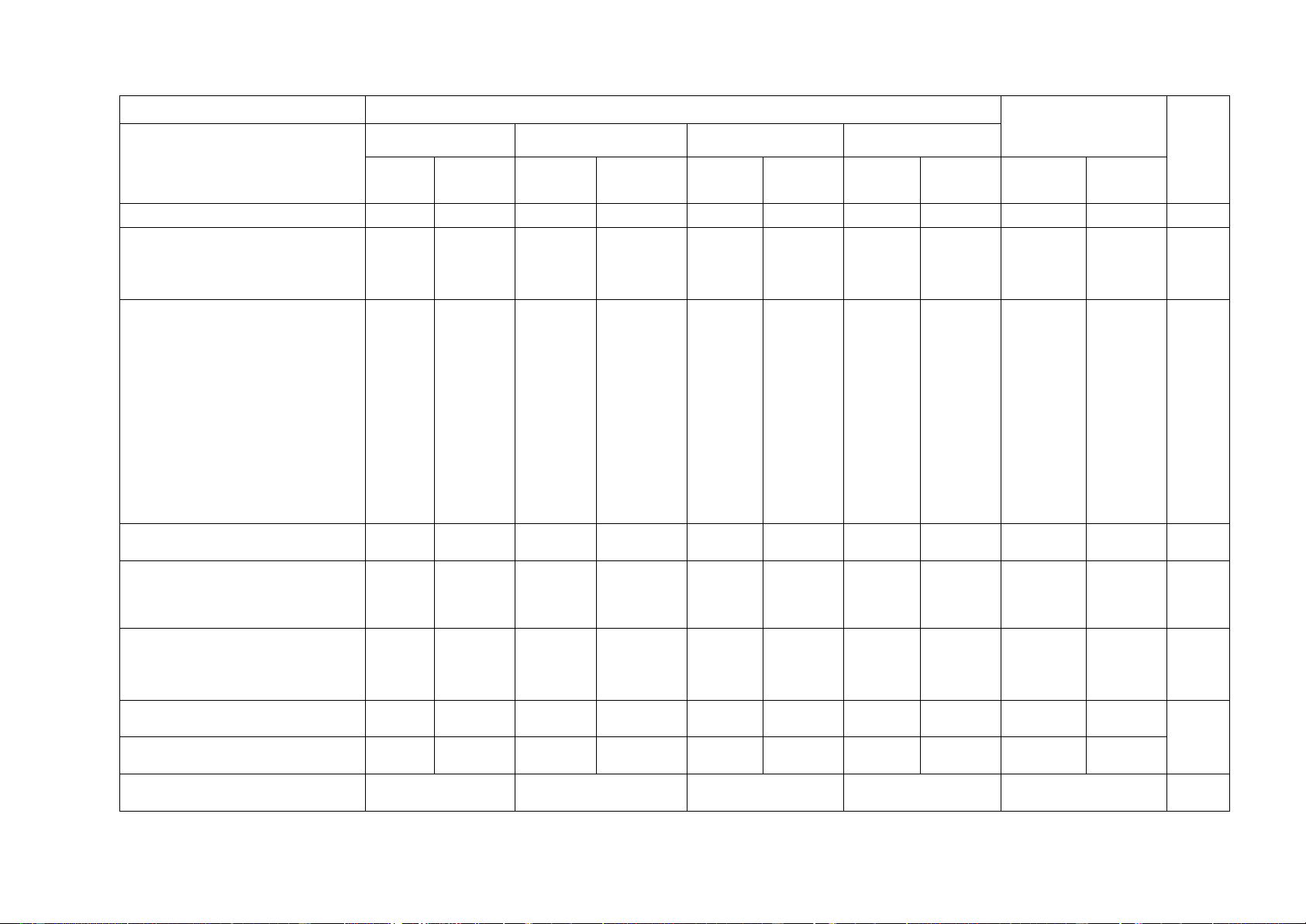
6. Áp suất chất lỏng. Áp 1 0,25 suất khí quyển Số câu 16 1 4 1 0 1 0 3 20 Điểm số 0 4 2 1 2 0 1 0 5 5 Tổng số điểm 4 điểm 3 điểm 2 điểm 1 điểm câu 10đ 3 Số ý TL/số câu hỏi TN Câu hỏi Nội dung Mức độ
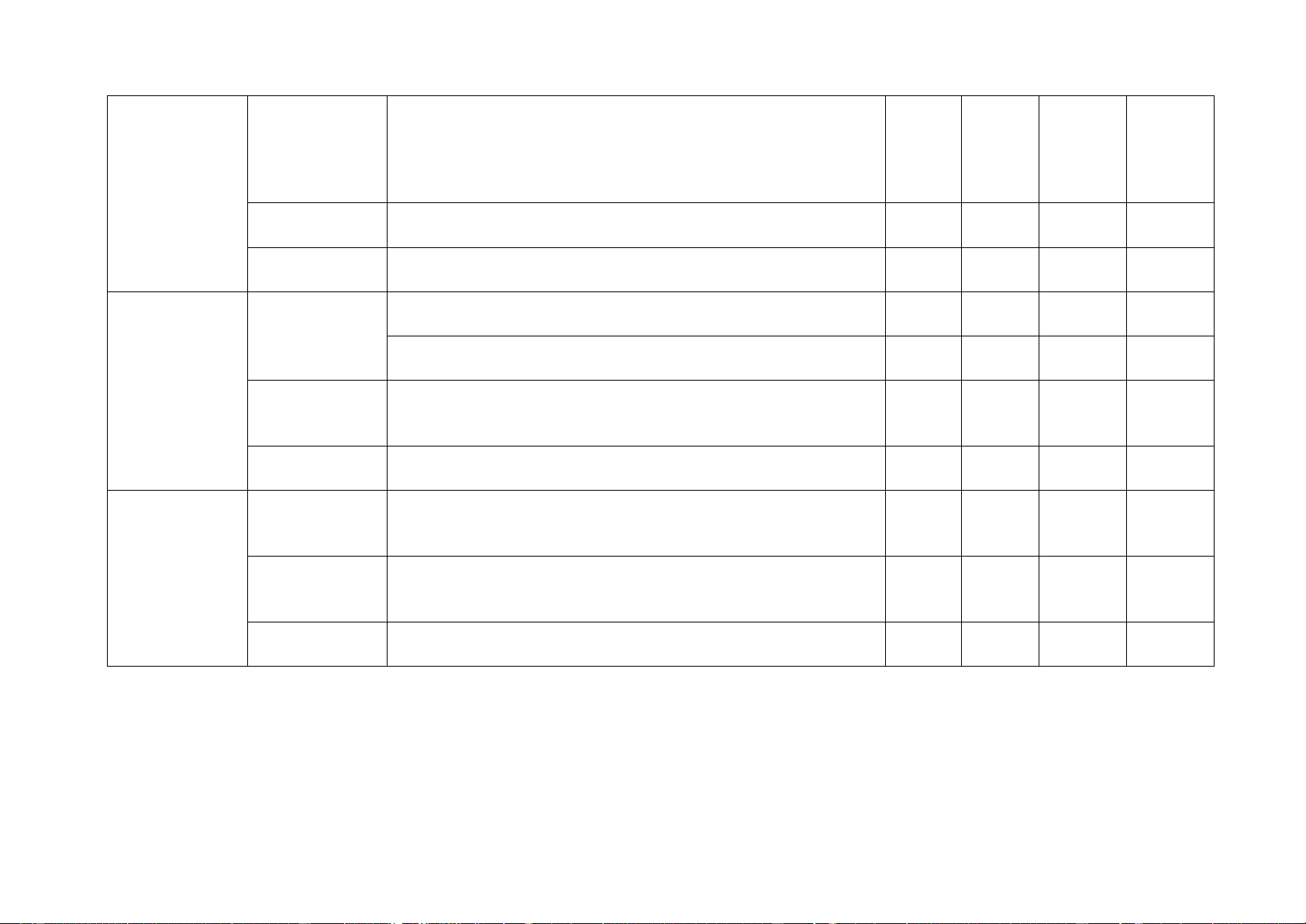
Yêu cầu cần đạt TN TN TL TL (Số (Số câu) (Số ý) (Số ý) câu) 1. Sử dụng Nhận biết
- Nhận biết được một số dụng cụ, hóa chất. 2 C1, C3 một số hóa
- Nêu được quy tắc sử dụng hóa chất an toàn. 1 C2 chất, thiết bị cơ bản trong
- Nhận biết được các thiết bị điện trong môn KHTN. 1 C4 PTN
Thông hiểu - Trình bày được cách sử dụng điện an toàn. 2. Phản ứng Nhận biết
- Nêu được khái niệm, đưa ra được ví dụ minh họa và 1 C6 hóa học
phân biệt được biến đổi vật lý, biến đổi hóa học.
- Nêu được khái niệm phản ứng hóa học, chất đầu và sản phẩm
- Nêu được sự sắp xếp khác nhau của các nguyên tử
trong phân tử chất đầu và sản phẩm.
- Nêu được khái niệm về phản ứng thu nhiệt, tỏa nhiệt.
Thông hiểu - Chỉ ra được một số dấu hiệu chứng tỏ có phản ứng 1 C5 hóa học xảy ra. Vận dụng
- Tiến hành được một số thí nghiệm về biến đổi vật lý và biến đổi hóa học.
- Ứng dụng phản ứng thu nhiệt, tỏa nhiệt vào đời sống. 3. Mol và tỉ Nhận biết
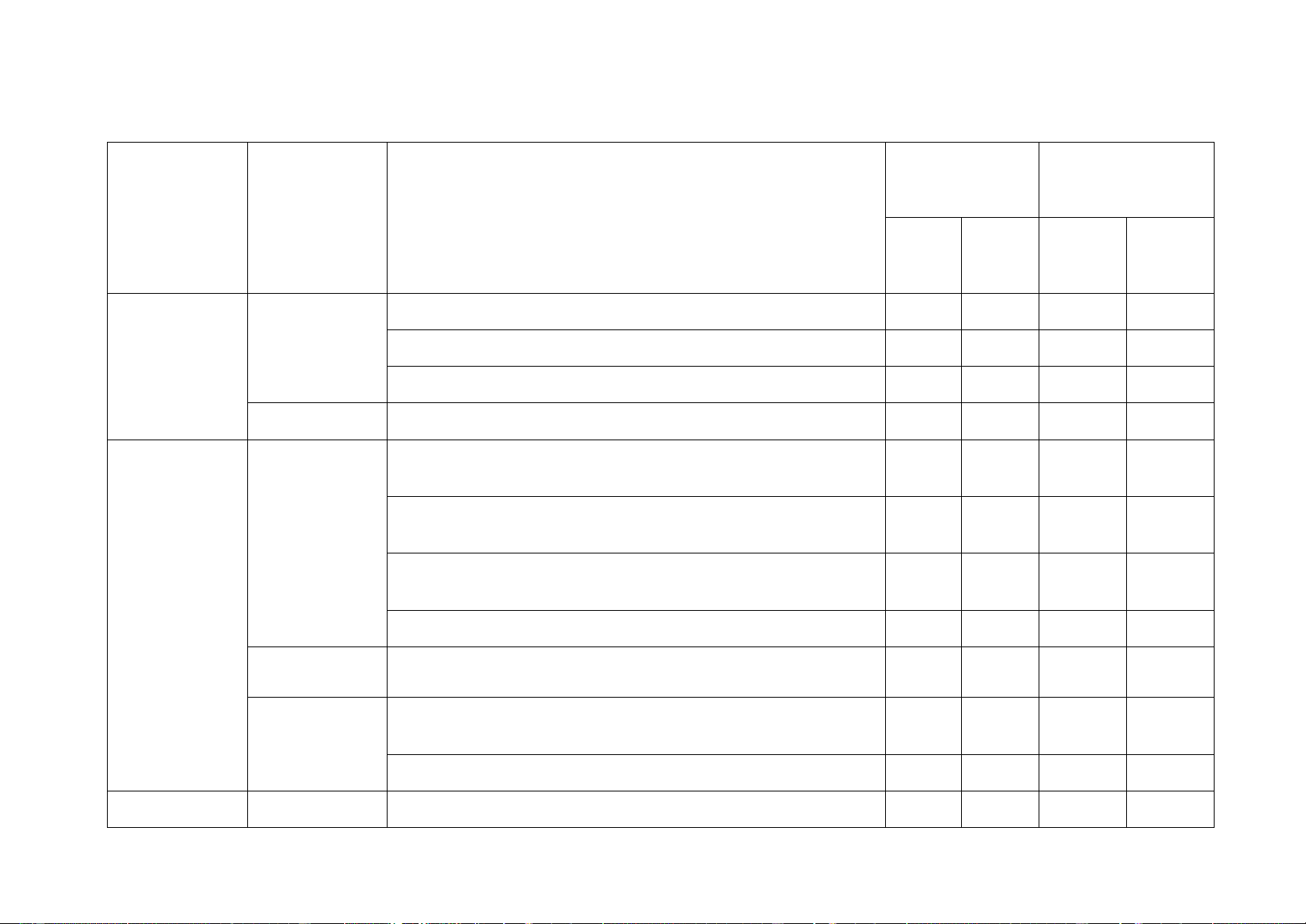
- Nêu được khái niệm mol (nguyên tử, phân tử). 4 khối chất khí
- Nêu được khái niệm tỉ khối, viết được công thức tính
tỉ khối của chất khí.
- Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25oC. Thông hiểu
- Tính được khối lượng mol và chuyển đổi được giữa số mol và khối lượng.
- So sánh được chất khí này nặng hay nhẹ hơn chất khí
khác dựa vào công thức tính tỉ khối. Vận dụng
- Sử dụng được các công thức để chuyển đổi giữa số
mol và thể tích chất khí ở điều kiện chuẩn: 1 bar và 25oC. 4. Dung dịch Nhận biết
- Nêu được dung dịch là hỗn hợp đồng nhất cả các chất và nồng độ đã tan trong nhau.
- Nêu được định nghĩa độ tan của một chất trong nước, 1 C7
nồng độ %, nồng độ mol.
Thông hiểu - Tính được độ tan, nồng độ %, nồng độ mol theo công thức. Vận dụng
- Tiến hành được thí nghiệm pha một dung dịch theo 1 C2
một nồng độ cho trước. Vận dụng
- Tính được khối lượng dung dịch đã biết nồng độ cao
dùng để pha dung dịch mới với nồng độ khác. 5. Định luật Nhận biết
- Phát biểu được định luật bảo toàn khối lượng. 1 C11 bảo toàn khối lượng
- Áp dụng định luật bảo toàn khối lượng và phương 1 C12
trình hóa học để tìm khối lượng chất chưa biết. 5 và phương
- Nêu được khái niệm phương trình hóa học và các 1 C14 trình hóa
bước lập phương trình hóa học. học
Thông hiểu - Trình bày được ý nghĩa của phương trình hóa học. 1 C8 Vận dụng
- Lập được sơ đồ phản ứng hóa học dạng chữ và
phương trình hóa học của một số phản ứng cụ thể. 6. Tính theo Nhân biết
- Nêu được khái niệm, công thức tính của hiệu suất phương phản ứng. trình hóa
Thông hiểu - Tính được lượng chất trong phương trình hóa học 1 C1 học
theo số mol, khối lượng hoặc thể tích ở điều kiện 1 bar và 25oC. Vận dụng
- Tính được hiệu suất một phản ứng dựa vào lượng sản
phẩm thu được theo lý thuyết và lượng sản phẩm thu được theo thực tế. 7. Tốc độ Nhận biết
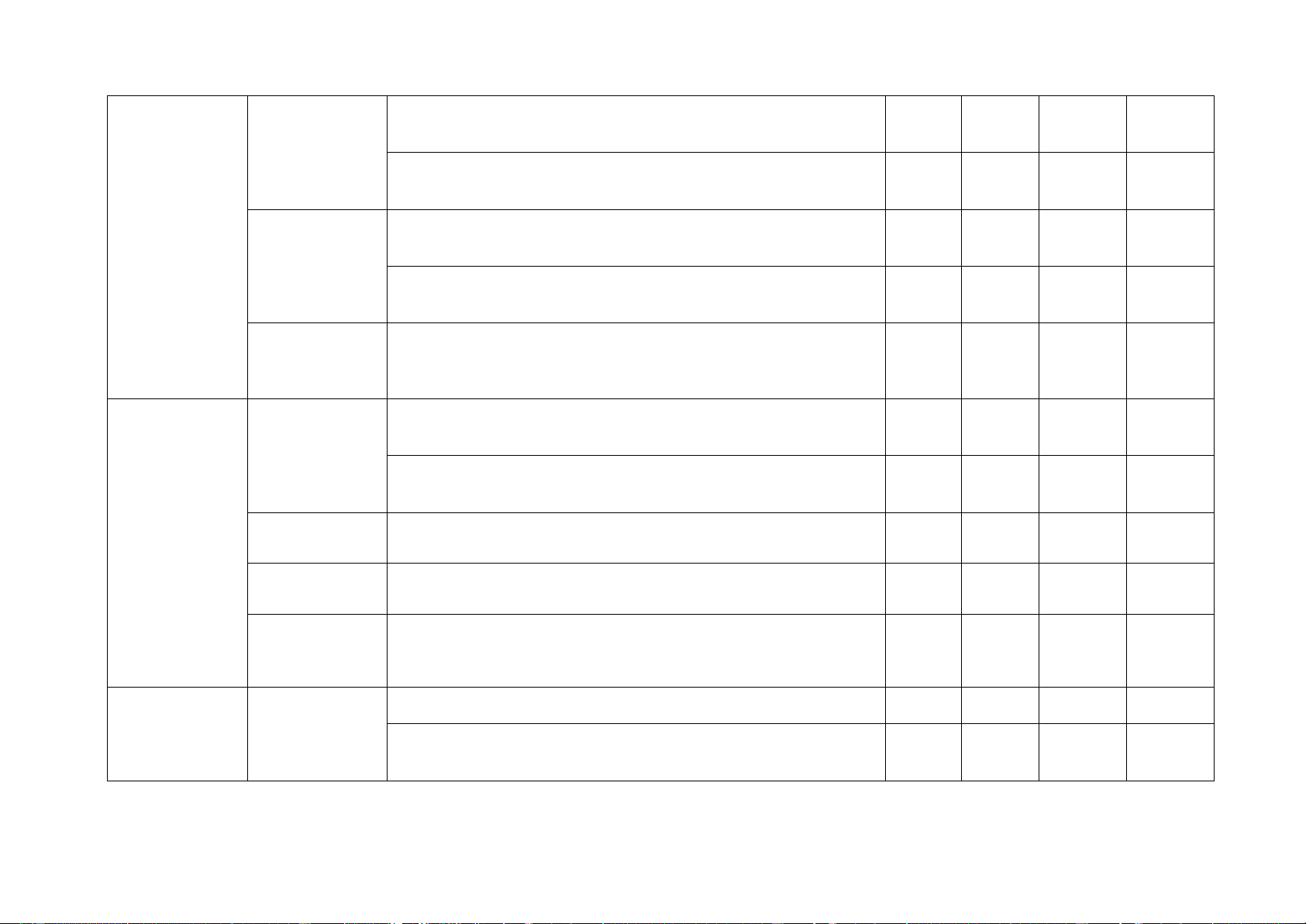
- Nêu được khái niệm về tốc độ phản ứng. 1 C13 phản ứng và chất xúc tác
- Trình bày được một số yếu tố ảnh hưởng đến tốc độ
phản ứng và nêu được một số ứng dụng thực tế.
Thông hiểu - So sánh được tốc độ của một số phản ứng hóa học
- Trình bày được các yếu tố làm thay đổi tốc độ phản 2 C9, C10 ứng.
- Nhận biết được các loại chất xúc tác. Vận dụng
Tiến hành được thí nghiệm và quan sát thực tiễn:
- So sánh được tốc độ một số phản ứng hoá học;
- Nêu được các yếu tố làm thay đổi tốc độ phản ứng. 6 8. Khối
- Biết được công thức tính khối lượng riêng, trọng lượng C15, lượng riêng riêng. 3 C16, Nhận biết
- Biết được đơn vị đo khối lượng riêng. C17 Thông hiểu
- Hiểu được ý nghĩa của khối lượng riêng. Vận dụng
- Vận dụng được công thức tính khối lượng riêng. 9. Áp suất
- Biết được công thức tính áp suất trên một bề mặt. 1 C18 trên một bề Nhận biết mặt
- Biết được đơn vị đo áp suất. 1 C19 Thông hiểu
- Hiểu được đặc điểm của áp suất lên một bề mặt. cách làm tăng giảm áp suất.
Vận dụng cao - Vận dụng được công thức tính khối lượng riêng. 1 C3 10. Áp suất Nhận biết
- Biết được đặc điểm của áp suất chất lỏng, công thức tính 1 C20 chất lỏng. lực đẩy Ác si mét. Áp suất khí quyển Thông hiểu
- Giải thích được một số hiện tượng liên quan đến áp suất chất lỏng. Vận dụng
- Vận dụng được công thức tính lực đẩy Ác si mét. 7
I. Phần trắc nghiệm. (5 điểm)
Chọn đáp án đúng trong các câu sau
Câu 1. Dụng cụ nào dùng để khuấy khi hòa tan chất rắn? A. Thìa thủy tinh. C. Kẹp gắp. B. Đũa thủy tinh.
D. Dụng cụ bất kì có thể khuấy được.
Câu 2. Có được dùng tay lấy trực tiếp hóa chất hay không? A. Có.
C. Có thể với những hóa chất dạng bột.
B. Có thể khi đã sát trùng tay. D. Không.
Câu 3. Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở vị trí như thế nào?
A. Ở khoảng 1/2 ống nghiệm tính từ miệng ống.
B. Ở khoảng 1/3 ống nghiệm tính từ miệng ống.
C. Ở khoảng 1/4 ống nghiệm tính từ miệng ống.
D. Ở khoảng 2/3 ống nghiệm tính từ miệng ống.
Câu 4. Thiết bị nào dung để đo điện? A. Ampe kế. B. Dây nối. C. Bóng đèn. D. Biến trở.
Câu 5. Nhỏ giấm ăn vào đá vôi, dấu hiệu cho biết đã có phản ứng hóa học xảy ra là:
A. Có phát sáng. B. Có tỏa nhiệt. C. Tạo thành chất khí.
D. Tạo thành chất kết tủa.
Câu 6. Quá trình nào sau đây xảy ra hiện tượng hóa học? 8
A. Bóng đèn phát sáng kèm theo tỏa nhiệt.
B. Đốt cháy than trong không khí.
C. Hòa tan đường vào nước để được nước đường.
D. Nước đá để ngoài không khí bị tan ra.
Câu 7. Nồng độ phần trăm của một dung dịch cho ta biết
A. số mol chất tan trong dung dịch.
B. số gam chất tan có trong một lít dung dịch.
C. số mol chất tan có trong 150 gam dung dịch.
D. số gam chất tan có trong 100 gam dung dịch.
Câu 8. Cho biết tỉ lệ số phân tử giữa các chất tham gia phản ứng trong phương trình hóa học sau: 2NaOH + H2SO4 → Na2SO4 + 2H2O A. 1:1. B. 1:2. C. 2:1. D. 2:3.
Câu 9. Tốc độ phản ứng không phụ thuộc vào yếu tố nào sau đây?
A. Thời gian xảy ra phản ứng.
B. Diện tích bề mặt tiếp xúc. C. Chất xúc tác.
D. Nồng độ của các chất phản ứng.
Câu 10. Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào được sử dụng để làm tăng tốc độ phản ứng? A. Nhiệt độ. B. Nồng độ. C. Chất xúc tác. D. Diện tích tiếp xúc.
Câu 11. Cho phản ứng: A + B → C + D. Biểu thức về công thức khối lượng của các chất nào sau đây là đúng? A. mA + mB + mC = mD. B. mA + mB = mC + mD. 9 C. mA + mB - mC = mD. D. mA = mB + mC + mD.
Câu 12. Sulfur cháy theo sơ đồ phản ứng sau: Sulfur + khí oxygen → Sulfur dioxide. Nếu đốt cháy 48 gam sulfur và thu được 96 gam
sulfur dioxide thì khối lượng khí oxygen đã phản ứng là A. 40 gam. B. 44 gam. C. 48 gam. D. 52 gam.
Câu 13. Tốc độ phản ứng là đại lượng đặc trưng cho A. sự biến đổi chất.
B. sự thay đổi trạng thái của chất.
C. sự thay đổi liên kết trong một phản ứng hóa học.
D. sự nhanh, chậm của một phản ứng hóa học.
Câu 14. Có mấy bước để lập một phương trình hóa học? A. 2 bước. B. 3 bước. C. 4 bước. D. 5 bước.
Câu 15. Công thức tính khối lượng riêng là m V D D A. V B. m D m m V C. V D. D
Câu 16. Công thức tính trọng lượng riêng là V P d d A. P B. V 10 d P D. V Pd C. V
Câu 17. Đơn vị đo khối lượng riêng là A. kg/m B. kg/m2 C. kg/m3 D. m3/kg
Câu 18. Công thức tính áp suất là S B. S = pF p A. F F p p F C. S D. S
Câu 19. Đơn vị đo áp suất là A. N/m. B. N/m3. C. N/m2. D. m2/N.
Câu 20. Phát biểu nào sau đây là sai khi nói về đặc điểm của áp suất chất lỏng?
A. Chất lỏng gây áp suất theo mọi phương lên các vật ở trong lòng nó.
B. Chất lỏng chỉ gây áp suất theo một phương nhất định.
C. Vật càng ở sâu trong lòng chất lỏng thì chịu tác dụng của áp suất chất lỏng càng lớn.
D. Áp suất tác dụng vào chất lỏng sẽ được chất lỏng truyền đi nguyên vẹn theo mọi hướng.
II. Phần tự luận. (5 điểm)
Câu 1. (2 điểm)
Đốt cháy hết 5,4 gam aluminium (Al) trong không khí thu được aluminium oxide (Al2O3). 11
a) Tính khối lượng aluminium oxide thu được.
b) Tính thế tích khí oxygen tham gia phản ứng ở điều kiện chuẩn. Câu 2. (2 điểm)
Từ muối Copper (II) sulfate CuSO , nước cất và những dụng cụ cần thiết, em hãy trình bày cách pha chế 75 ml dung dịch 4 CuSO4 có nồng độ 2M? Câu 3. (1 điểm)
Một người có trọng lượng 600N, diện tích một bàn chân khi đứng trên mặt đất là 0,025m2. Tính áp suất mà người đó tác dụng
lên mặt đất trong các trường hợp sau:
a) Khi người đó đứng bằng một chân.
b) Khi người đó đứng bằng hai chân.
---------------Hết---------------- 12
Đáp án và Hướng dẫn chấm
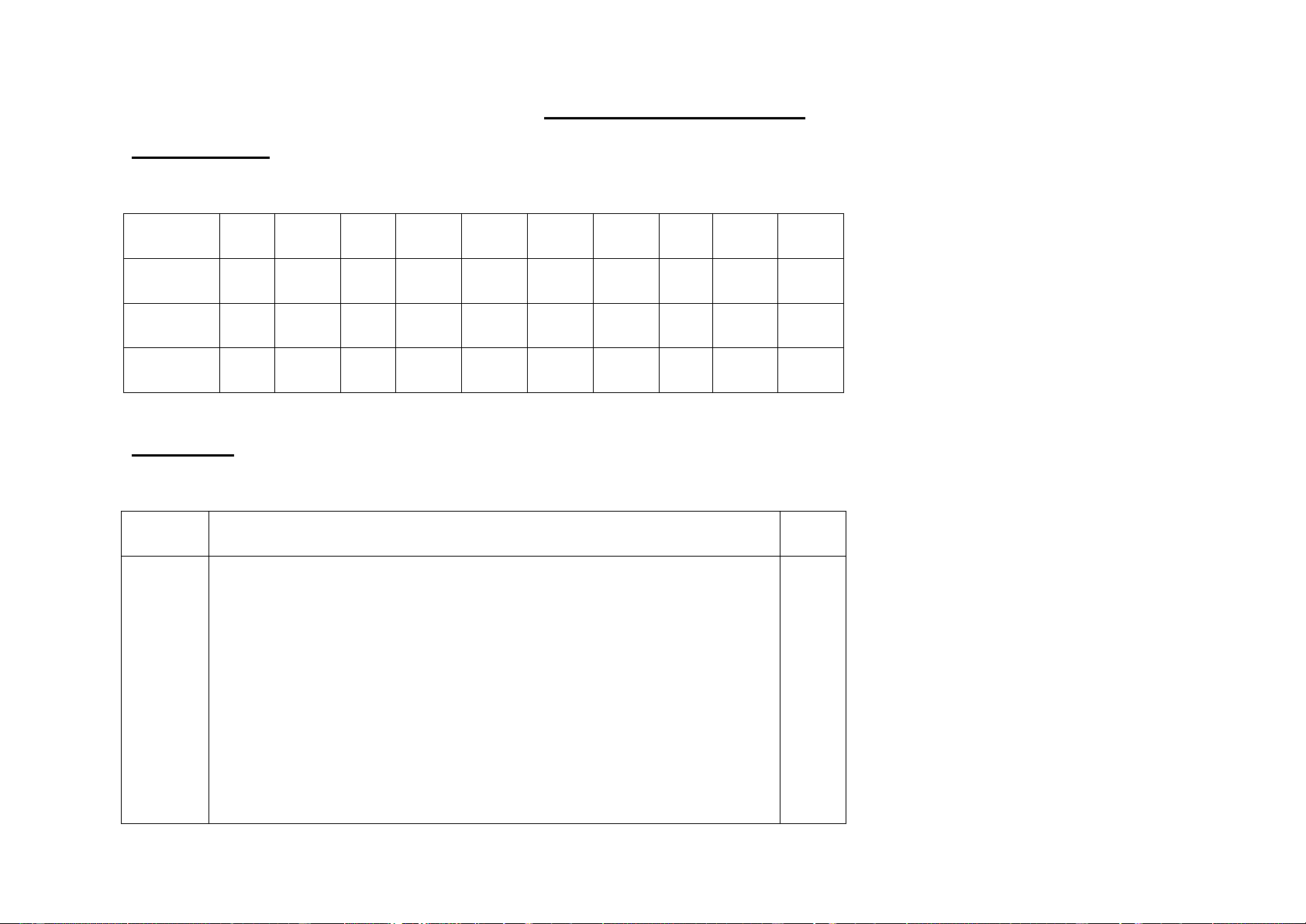
I.Trắc nghiệm. (5 điểm) Mỗi đáp án đúng được 0,25 điểm. Câu 1 2 3 4 5 6 7 8 9 10 Đáp án B D B A C B D C A B Câu 11 12 13 14 15 16 17 18 19 20 Đáp án B C D B A B C C C B
II. Tự luận. (5 điểm) Câu Đáp án Điểm 1
Phương trình hóa học xảy ra: (2 đ) o 4Al + 3O t 0,5 2 2Al2O3 a)
Số mol Al tham gia phản ứng là: n 0,5 Al = m/M = 5,4/27 = 0,2 (mol)
Theo phương trình hóa học ta có: n 0,25 Al2O3 = 1/2nAl = 0,1 mol
Khối lượng aluminium oxide thu được là: 13
mAl2O3 = n . M = 0,1 . 102 = 10,2 (g). 0,25 b)
Theo phương trình hóa học ta có: nO2 = 3/4nAl = 0,15 mol 0,25
Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn là:
nO2 = n . 24,79 = 0,15 . 24,79 = 3,7185 (L). 0,25 2 * Tính toán: (2 đ)
Số mol chất tan là: nCuSO4 = CM.V = 2 . 0,075 = 0,15 (mol) 0,5
Khối lượng chất tan là: mCuSO4 = 160 . 0,15 = 24 (g) 0,5
* Pha chế: Cân lấy 24 gam CuSO4 cho vào cốc thủy tinh có
dung tích 100 ml. Đổ dần dần nước vào cốc và khuấy nhẹ cho 1
đủ 75 ml dung dịch ta thu được 75 ml dung dịch CuSO4 2M. 3 Tóm tắt (1 đ) F = 600N 0,25 S1 = 0,025m2 a. P1 = ? b. P2 = ? Bài giải
a. Áp suất người đó tác dụng lên mặt đất khi đứng bằng một 0,25
chân là: p1 = F/S1 = 600/0,025 = 24000 (Pa)
b. Khi đứng bằng hai chân thì điện tích bị ép là: 0,25 S2 =S1.2 = 0,025.2 =0,05 (m2) 14
Áp suất người đó tác dụng lên mặt đất khi đứng bằng hai chân 0,25
là: p2 = F/S2 = 600/0,05 = 12000 (Pa).
(Học sinh làm theo cách khác, nếu đúng vẫn cho điểm tối đa.)




