





Preview text:
ĐỀ CƯƠNG ÔN TẬP HỌC KỲ II
MÔN: HÓA HỌC LỚP 10 I. TRẮC NGHIỆM
Câu 1. [CTST - SBT] Số oxi hóa của nguyên tử S trong hợp chất SO2 là A. +2. B. +4. C. +6. D. −1.
Câu 2. Số oxi hóa (SOH) của iron, oxygen, hydrogen, sodium trong Fe, O2, H2, Na lần lượt là
A. +3, -2, +1, +1. B. 0, 0, 0, 0.
C. +2, -2, +1, +1. D. +3, -2, 0,0.
Câu 3. Số oxi hóa của F trong F2, HF và OF2 lần lượt là A. 0, 0, 0. B. 0, -1, -1. C. -1, -1, -1. D. 0, -1, +1.
Câu 4. Số oxi hóa của S trong SO 2- 2-
3 và SO4 lần lượt là A. +2, +4. B. -2, -4. C. +4, +6. D. -4, +6.
Câu 5. Cho quá trình Al → Al3+ + 3e, đây là quá trình A. khử. B. oxi hóa.
C. tự oxi hóa – khử. D. nhận proton.
Câu 6. Cho quá trình Fe2+ → Fe 3++ 1e, đây là quá trình A. oxi hóa. B. khử.
C. nhận proton.
D. tự oxi hóa – khử.
Câu 7. Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
A. HCl + NH3 → NH4Cl.
B. HCl + NaOH → NaCl + H2O.
C. 4HCl + MnO2 → MnCl2 + Cl2 + H2O.
D. 2HCl + Fe → FeCl2 + H2.
Câu 8. Cho phản ứng: 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Trong phản ứng trên, chất oxi hóa và chất khử lần lượt là
A. K2Cr2O7 và FeSO4. B. K2Cr2O7 và H2SO4.
C. H2SO4 và FeSO4. D. FeSO4 và K2Cr2O7.
Câu 9. Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
A. là chất oxi hóa. B. là chất khử.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 10. Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
A. chất oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Câu 11. Cho phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl. Trong đó, NH3 đóng vai trò
A. là chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. là chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 12. (C.08): Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu.
Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự oxi hóa Cu.
B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự oxi hóa Fe và sự khử Cu2+.
Câu 13. Số oxi hóa của H trong NaH, CaH2, BaH2 lần lượt là A. +1, +1, +1. B. -1, -1, -1. C. 0, 0, 0. D. -1, +1, 0.
Câu 14. Số oxi hóa của O trong O2, Na2O, Na2O2, NaOH lần lượt là
A. 0,-2, -1, -2. B. 0, -2, -2, -2.
C. -2, -2, -2, -2. D. 0, -1, -1, -2.
Câu 15. Số oxi hóa của O trong H2O, H2O2, OF2 lần lượt là A. 0, -2, -1. B. -2, -1, +2. C. -2, -2, -2. D. 0, -1, +2.
Câu 16. Số oxi hóa của S trong H2S, S, SO2, H2SO4 lần lượt là
A. -1, 0, +1, +3. B. -2, 0, +4, +6.
C. -2, 0, +2, +6. D. +2, 0, +4, +6.
Câu 17. Số oxi hóa của N trong NH3, N2, N2O, NO, NO2 lần lượt là
A. -3, 0, +1, +2, +4.
B. -3, 0, +2, -2, +4.
C. -3, 0, 0, +2, +4. D. -3, +1, +1, +2, +4.
Câu 18. Số oxi hóa của S trong SO 2- - 2- -
3 , HSO3 , SO4 và HSO4 lần lượt là
A. +4, +4, +6, +6.
B. -2, -1, -2, -1.
C. +4, +4, +4, +4. D. +6, +6, +6, +6.
Câu 19. Phát biểu nào dưới đây không đúng?
A. Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
B. Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
C. Phản ứng oxi hoá - khử là phản ứng có sự thay đổi số oxi hoá của tất cả các nguyên tố.
D. Phản ứng oxi hoá - khử là phản ứng có sự chuyển electron giữa các chất phản ứng.
Câu 20. Trong phản ứng oxi hóa – khử
A. chất bị oxi hóa nhận e và chất bị khử cho e.
B. quá trình oxi hóa và quá trình khử xảy ra đồng thời.
C. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận e gọi là quá trình oxi hóa.
Câu 21. Chất khử là chất
A. cho e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 22. Chất oxi hoá là chất
A. cho e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 23. (M.15): Cho phương trình hóa học: aFe + bH ↑
2SO4 → cFe2(SO4)3 + dSO2 + eH2O Tỉ lệ a: b là A. 1: 3. B. 1: 2. C. 2: 3. D. 2: 9
Câu 24. (C.14): Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O Tỉ lệ a: b là A. 1: 1. B. 2: 3. C. 1: 3. D. 1: 2.
Câu 25. (A.13): Cho phương trình phản ứng aAl + bHNO ⎯⎯ → 3
cAl(NO3)3 + dNO + eH2O. Tỉ lệ a: b là A. 1: 3. B. 2: 3. C. 2: 5. D. 1: 4.
Câu 26. Tốc độ phản ứng là
A. độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thể tích.
B. độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
C. độ biến thiên số mol của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thể tích.
D. độ biến thiên thể tích của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Câu 27. [CTST- SBT] Khi tăng nồng độ chất tham gia, thì
A. tốc độ phản ứng tăng.
B. tốc độ phản ứng giảm.
C. thông ảnh hưởng đến tốc độ phản ứng.
D. có thể tăng hoặc giảm tốc độ phản ứng.
Câu 28. Nhận định nào dưới đây đúng?
A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng.
B. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng.
C. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm.
D. Sự thay đổi nồng độ chất phản ứng không làm ảnh hưởng đến tốc độ phản ứng.
Câu 29. Tốc độ phản ứng tăng lên khi:
A. Giảm nhiệt độ
B. Tăng diện tích tiếp xúc giữa các chất phản ứng
C. Tăng lượng chất xúc tác
D. Giảm nồng độ các chất tham gia phản ứng
Câu 30. Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn?
A. Nhiệt độ. B. Áp suất.
C. Diện tích tiếp xúc. D. Chất xúc tác.
Câu 31. [CTST- SBT] Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
A. Nhiệt độ chất phản ứng.
B. Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ....).
C. Nồng độ chất phản ứng.
D. Tỉ lệ mol của các chất trong phản ứng.
Câu 32. [CTST- SBT] Tốc độ của một phản ứng hóa học
A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
B. tăng khi nhiệt độ phản ứng tăng.
C. càng nhanh khi giá trị năng lượng hoạt hóa càng lớn.
D. không phụ thuộc vào diện tích bề mặt.
Câu 33. Đối với phản ứng có chất khí tham gia thì nhận định nào dưới đây đúng?
A. Khi áp suất tăng thì tốc độ phản ứng giảm.
B. Khi áp suất tăng thì tốc độ phản ứng tăng.
C. Khi áp suất giảm thì tốc độ phản ứng tăng.
D. Áp suất không ảnh hưởng đến tốc độ phản ứng.
Câu 34. Nhận định nào dưới đây đúng?
A. Khi nhiệt độ tăng thì tốc độ phản ứng tăng.
B. Khi nhiệt độ tăng thì tốc độ phản ứng giảm.
C. Khi nhiệt độ giảm thì tốc độ phản ứng tăng.
D. Sự thay đổi nhiệt độ không làm ảnh hưởng đến tốc độ phản ứng.
Câu 35. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được
nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ.
B. Chất xúc tác.
C. Nồng độ. D. Áp suất. o
Câu 36. Cho phản ứng: 2KClO MnO ,t 2 ⎯⎯⎯⎯ → 3 (s)
2KCl(s) + 3O2 (g). Yếu tố không ảnh hưởng đến tốc độ của
phản ứng trên là:
A. Kích thước các tinh thể KClO3. B. Áp suất.
C. Chất xúc tác. D. Nhiệt độ.
Câu 37. Thực hiện phản ứng: 2H2O2 (l) → 2H2O (l) + O2 (g)
Cho các yếu tố: (1) tăng nồng độ H2O2, (2) giảm nhiệt độ, (3) thêm xúc tác MnO2. Những yếu tố làm tăng tốc độ phản ứng là A. 1, 3. B. chỉ 3. C. 1, 2. D. 1, 2, 3.
Câu 38. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi
dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ.
B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng. D. Dạng nhôm dây.
Câu 39. Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau. (1) Dùng nồi áp suất
(3) Chặt nhỏ thịt cá.
(2) Cho thêm muối vào.
(4) Nấu cùng nước lạnh.
Cách làm cho thịt cá nhanh chín hơn là: A. 1, 2, 3. B. 1, 3, 4. C. 2, 3, 4. D. 1, 2, 4.
Câu 40. Chọn câu đúng trong các câu dưới đây?
A. Bếp than đang cháy trong nhà cho ra ngoài trời sẽ cháy chậm hơn.
B. Sục CO2 vào Na2CO3 trong điều kiện áp suất thấp sẽ khiến phản ứng nhanh hơn.
C. Nghiền nhỏ vừa phải CaCO3 giúp phản ứng nung vôi xảy ra dễ dàng hơn.
D. Thêm MnO2 vào quá trình nhiệt phân KClO3 sẽ làm giảm lượng O2 thu được.
Câu 41.Cho phản ứng sau: X + Y → Z + T. Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng ?
A. Nhiệt độ.
B. Nồng độ Z và T.
C. Chất xúc tác.
D. Nồng độ X và Y.
Câu 42. Người ta thường sử dụng nhiệt độ của phản ứng đốt cháy than đá để nung vôi. Biện pháp kĩ thuật nào
sau đây không sử dụng để làm tăng tốc độ của phản ứng nung vôi?
A. Đập nhỏ đá vôi với kích thước khoảng 10 cm.
B. Tăng nhiệt độ của phản ứng lên khoảng 900oC.
C. Tăng nồng độ khí cacbonic.
D. Thổi khí nén vào lò nung vôi.
Câu 43. Cho một mẩu đá vôi nặng 10 gam vào 200 ml dung dịch HCl 2 M. Tốc độ phản ứng ban đầu sẽ giảm khi
A. nghiền nhỏ đá vôi trước khi cho vào.
B. thêm 100 ml dung dịch HCl 4 M.
C. giảm nhiệt độ của phản ứng.
D. cho thêm 500 ml dung dịch HCl 1 M vào hệ ban đầu.
Câu 44. Trong các cặp phản ứng sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như
nhau thì cặp nào có tốc độ phản ứng lớn nhất?
A. Fe + dung dịch HCl 0,1 M.
B. Fe + dung dịch HCl 0,2 M.
C. Fe + dung dịch HCl 0,3 M.
D. Fe + dung dịch HCl 0,5 M.
Câu 45. Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25o). Tốc độ của
phản ứng không đổi khi
A. thay 5 gam kẽm viên bằng 5 gam kẽm bột.
B. thêm 50 ml dung dịch H2SO4 4M nữa.
C. thay 50 ml dung dịch H2SO4 4M bằng 100 ml dung dịch H2SO4 2M.
D. đun nóng dung dịch.
Câu 46. Cho 5,6 gam lá sắt kim loại vào 50ml dung dịch axit HCl 3M ở nhiệt độ 30oC. Trường hợp nào sau đây
sẽ không làm tăng tốc độ phản ứng
A. thay 5,6 gam lá sắt bằng 2,8 gam lá sắt.
B. tăng nhiệt độ phản ứng lên 50oC.
C. thay 5,6 gam lá sắt bằng 5,6 gam bột sắt.
D. thay axit HCl 3M thành axit HCl 4M.
Câu 47. So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ):
(1) Zn (bột) + dung dịch CuSO 1M 1M 4
(2) Zn (hạt) + dung dịch CuSO4
Kết quả thu được là:
A. (1) nhanh hơn (2).
B. (2) nhanh hơn (1). C. như nhau.
D. không xác định được.
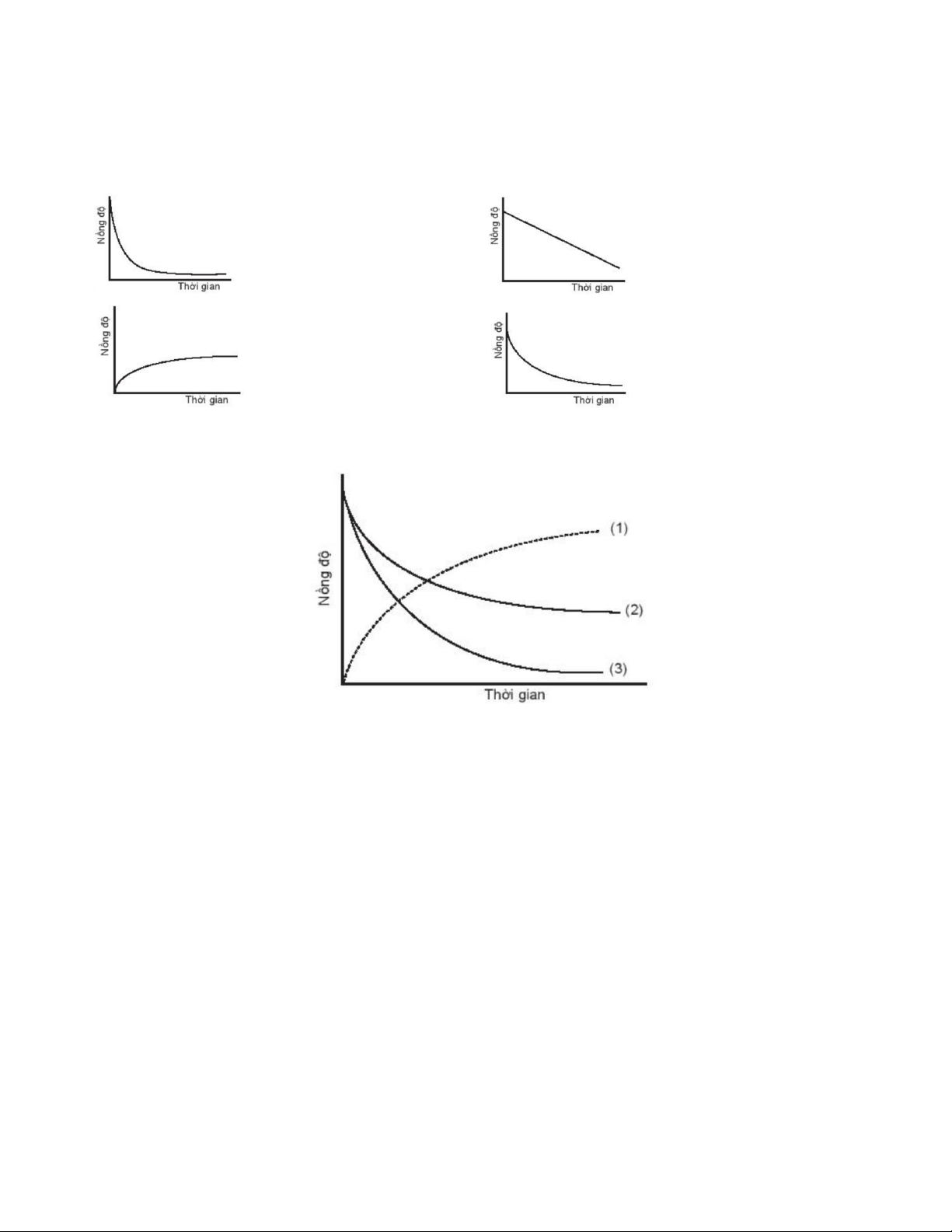
Câu 48. [CTST - SBT] Biểu đồ nào sau đây không biểu diễn sự phụ thuộc nồng độ chất tham gia với thời gian A. B. C. D.
Câu 50. [CTST - SBT] Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành
nước, O2(g) + 2H2(g) → 2H2O(g). Đường cong nào của hydrogen?
A.Đường cong số (1).
B. Đường cong số (2).
C.Đường cong số (3).
D. Đường cong số (2) hoặc (3) đều đúng.
Câu 51. [CTST - SBT] Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là A. ns2np2. B. ns2np3. C. ns2 np5. D. ns2np6.
Câu 52. [CTS - SBT] Trong bảng tuần hoàn các nguyên tố hoá học, halogen thuộc nhóm A. IA. B. IIA. C. VIIA. D. VIIIA.
Câu 53. (M.15): Nguyên tố hóa học nào sau đây thuộc nhóm halogen? A. Chlorine. B. Oxygen. C. Nitrogen. D. Carbon.
Câu 54. [CTST - SBT] Halogen tồn tại ở thể lỏng ở điều kiện thường là A. fluorine. B. bromine. C. Iodine. D. chlorine.
Câu 55. [CTST - SBT] Đơn chất halogen tồn tại ở thể khí, màu vàng lục là A. chlorine. B. Iodine. C. bromine. D. fluorine.
Câu 56. Khi nung nóng, iodine rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. Sự thăng hoa. B. Sự bay hơi.
C. Sự phân hủy. D. Sự ngưng tụ.
Câu 57. Trong bảng tuần hoàn, nguyên tố có độ âm điện lớn nhất là A. Chlorine.
B. Sodium (natri). C. Iodine. D. Fluorine.
Câu 58. [CTST - SBT] Liên kết trong phân tử đơn chất halogen là
A. liên kết van der Waals.
B. liên kết cộng hóa trị.
C. liên kết ion.
D. liên kết cho nhận.
Câu 59. Trong hợp chất, nguyên tố fluorine chỉ thể hiện số oxi hóa là A. 0. B. +1. C. -1. D. +3.
Câu 60. Trong hợp chất chlorine có các số oxi hóa nào sau đây?
A. -2, 0, +4, +6.
B. -1, 0, +1, +3, +5, +7.
C. -1, +1, +3, +5, +7.
D. -1, 0, +1, +2, +3, +5, +7.
Câu 61. [CTST - SBT] Nguyên tố có tính oxi hoá yếu nhất thuộc nhóm VIIA là A. chlorine. B. Iodine. C. bromine. D. fluorine.
Câu 62. Phản ứng giữa hydrogen và chất nào sau đây thuận nghịch? A. Fluorine. B. Chlorine. C. Iodine. D. Bromine.
Câu 63. Sản phẩm tạo thành khi cho iron (sắt) tác dụng với khí chlorine là A. FeCl2. B. AlCl3. C. FeCl3. D. CuCl2.
Câu 64. Chlorine chỉ thể hiện tính oxi hóa khi tác dụng với chất nào sau đây? A. O2. B. H2O. C. Fe. D. NaOH.
Câu 65. Trong phản ứng: Cl2 + H2O ⎯⎯ → ⎯
⎯ HCl + HClO. Chlorine thể hiện tính chất nào sau đây?
A. Tính oxi hóa. B. Tính khử. C. Tính acid.
D. Vừa có tính oxi hóa vừa có tính khử.
Câu 66. Trong dung dịch nước chlorine có chứa các chất nào sau đây?
A. HCl, HClO, Cl2. B. Cl2 và H2O. C. HCl và Cl2.
D. HCl, HClO, Cl2 và H2O.
Câu 67. Sục Cl2 vừa đủ vào dung dịch NaOH loãng, ở nhiệt độ thường thu được dịch X. Trong X chứa chất tan nào sau đây? A. NaCl. B. NaClO. C. NaCl, NaClO. D. NaCl, NaClO3
Câu 68. Cho phản ứng: Cl2+ 2 NaBr → 2 NaCl + Br2. Trong phản ứng trên chlorine
A. chỉ bị oxi hóa.
B. chỉ bị khử.
C. vừa bị oxi, vừa bị khử.
D. không bị oxi hóa, không bị khử.
Câu 69. Cho phản ứng: SO2 + Cl2 + 2H2O → 2HCl + H2SO4. Trong phản ứng trên, chlorine là chất A. oxi hóa. B. khử.
C. vừa oxi hóa, vừa khử.
D. Không oxi hóa khử
Câu 70. Chlorine không phản ứng với chất nào sau đây? A. NaOH. B. NaCl. C. Ca(OH)2. D. NaBr.
Câu 71. Trong thiên nhiên, chlorine chủ yếu tồn tại dưới dạng
A. đơn chất Cl2.
B. muối NaCl có trong nước biển.
C. khoáng vật carnalite (KCl.MgCl2.6H2O).
D. khoáng vật sylvinite (KCl.NaCl).
Câu 72. [CTST - SBT] Halogen nào được dùng trong sản xuất nhựa Teflon? A. Chlorine. B. Iodine. C. Fluorine. D. Bromine.
Câu 73. [CTST - SBT] Nguyên tố halogen được dùng trong sản xuất nhựa PVC là A. chlorine. B. bromine. C.phosphorus. D. carbon.
Câu 74. [CTST - SBT] Halogen được điều chế bằng cách điện phân có màng ngăn dung dịch muối ăn là A. fluorine. B. chlorine. C. bromine. D. Iodine.
Câu 75. [CTST - SBT] Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật
trí tuệ là A. chlorine. B. iodine. C. bromine. D. fluorine. II. TỰ LUẬN
Câu 1. Hoàn thành các phương trình hóa học sau và chỉ rõ vai trò (chất oxi hóa hay chất khử) của halogen trong từng phản ứng: (1) Cu + Cl 0 2 → (6) Br 70 C ⎯⎯⎯→ 2 + KOH (2) Al + Br2 → (7) Cl2 + Ca(OH)2 → (3) Na + I2 → (8) Cl2 + KBr → (4) Fe + Cl2 → (9) Br2 + NaI → (5) H2 + Cl2 → (10) F2 + H2O →
Câu 2. Hoàn thành chuỗi phản ứng sau: (a) (b) MnO2 (1) ⎯⎯→ Cl2 (2) ⎯⎯→ FeCl3 (3) ⎯⎯→ NaCl (4) ⎯⎯→ Cl2 (5) ⎯⎯→ CuCl2 (6) ⎯⎯→ AgCl
Câu 3. [CTST - SGK] Cho phản ứng đơn giản sau: H2 (g) + Cl2 (g) → 2HCl (g)
(a) Viết biểu thức tốc độ tức thời của phản ứng trên.
(b) Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
Câu 4. [CTST - SGK] Cho phản ứng đơn giản xảy ra trong bình kín: 2NO (g) + O2 (g) → 2NO2 (g)
(a) Viết biểu thức tốc độ tức thời của phản ứng.
(b) Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi:
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- Nồng độ NO và O2 đều tăng 3 lần?
Câu 5. [CTST - SBT] Cho phương trinh hóa học của phản ứng: CO(g) + H2O(g) → CO2(g) + H2(g)
Viết biểu thức tốc độ của phản ứng trên. Khi nồng độ CO tăng 2 lần, lượng hơi nước không thay đổi, tốc độ
phản ứng thay đổi như thế nào?
Câu 6. Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất.
Phản ứng tổng hợp phosgen như sau: CO + Cl2 ⎯⎯ → COCl2.
Biểu thức tốc độ phản ứng có dạng: 3/2 v = k.C .C CO Cl2
Tốc độ phản ứng thay đổi như nào nếu:
(a) Tăng nồng độ CO lên 2 lần.
(b) Giảm nồng độ Cl2 xuống 4 lần.
Câu 7. [CTST - SBT] Phương trình hóa học của phản ứng: CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g).
Khi nồng độ của CHCl3 giảm 4 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ
A. Tăng gấp đôi.
B. Giảm một nửa.
C. Tăng 4 lần.
D. Giảm 4 lần.
Câu 8. Cho một lượng đơn chất halogen tác dụng hết với magie thu được 19g magie halogenua. Cũng lượng đơn
chất halogen đó tác dụng hết với nhôm tạo ra 17,8g nhôm halogenua. Xác định tên halogen trên.
Câu 9 : Khi cho m (g) kim loại Ca tác dụng hoàn toàn với 17,92 lít khí X2 (đktc) thì thu được 88,8g muối halogenua.
a. Viết PTPƯ dạng tổng quát.
b. Xác định công thức chất khí X2 đã dùng. c. Tính giá trị m.
Câu 10. Đốt cháy hoàn toàn 0,48 gam Mg bằng khí X2 thu được 1,9 gam muối. Xác định tên halogen.
Câu 11. Cho một lượng halogen X2 tác dụng hết với kim loại kẽm thì thu được 13,6 gam muối. Cũng lượng X2
đó đem tác dụng với kali thì thu được 14,9 gam muối. Xác định công thức của X2.




