





































Preview text:
lOMoARcPSD| 38841209
B Ộ GIÁO DỤC VÀ ĐÀO TẠ O B Ộ Y T Ế
ĐẠ I H ỌC Y DƯỢC THÀNH PHỐ H Ồ CHÍ MINH NGUYỄN LÊ BẢ O NGHI TỔ ỢP CA LÂM SÀNG NG H
HÓA ĐẠI CƯƠNG VÀ HỮU CƠ lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
ĐIỀU TRỊ UNG THƯ TUYẾN GIÁP BẰNG IOD-131
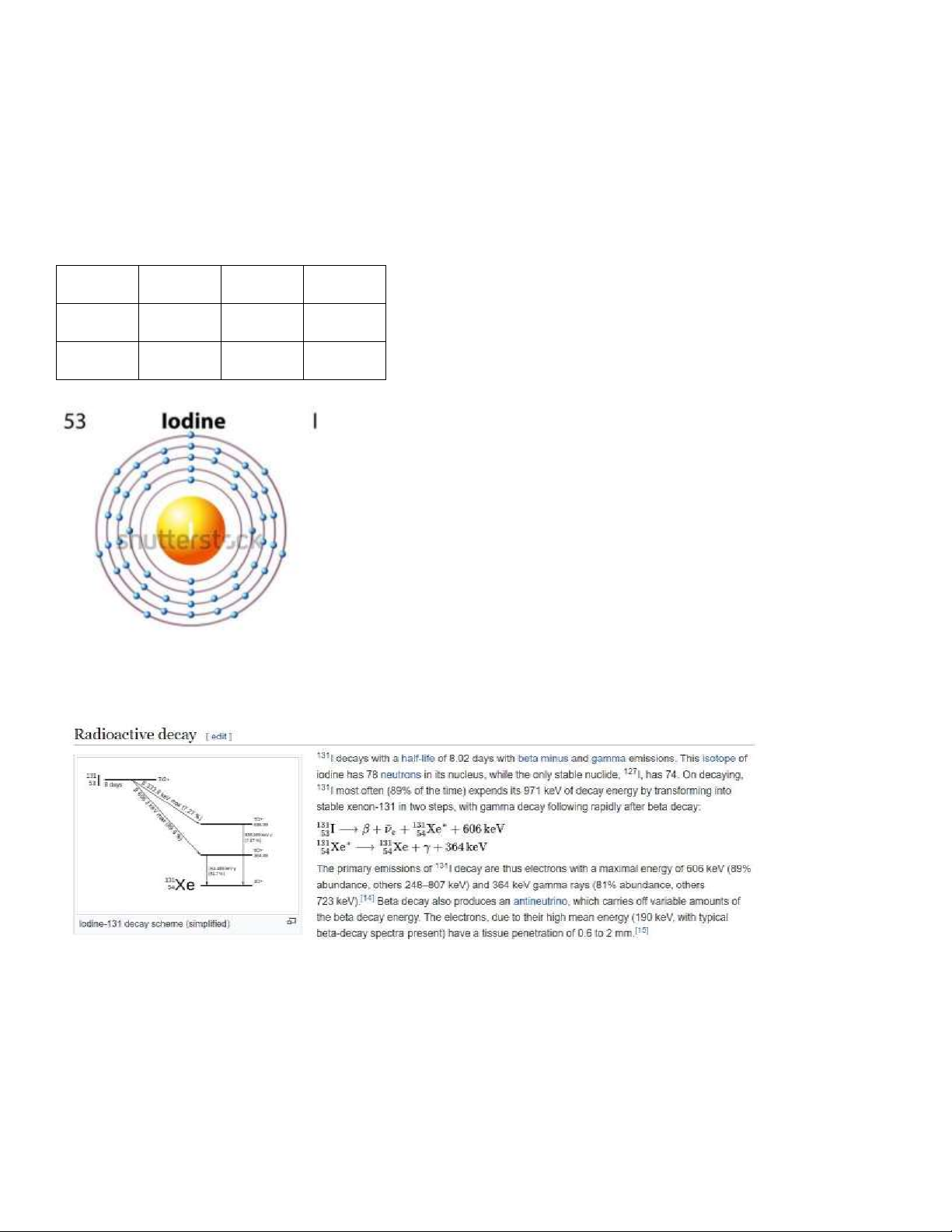
Câu 1: Vẽ sơ ồ cấu trúc nguyên tử của I 127 và I 131. So sánh I 127 và I 131 Iod: [Kr] 4d105s25p5 Số p Số n Số e Iod 127 53 74 53 Iod 131 53 78 53
Số n của I 127 và I 131 khác nhau, dẫn ến tỉ lệ N/P khác nhau. Chính vì thế, trong khi I 127 là ồng vị bền, nhưng I 131 thì
có tính phóng xạ và ược sử dụng trong hủy mô tuyến giáp.
I 131 không bền, tự phân hủy thành Xe 131, ồng thời phát ra cả tia beta và tia gamma.
Câu 2: Tại sao I 131 ược sử dụng trong iều trị hủy mô tuyến giáp?
- Sau khi phẫu thuật, bệnh nhân ược cho uống I 131 ể:
+ Hủy mô giáp lành còn lại sau phẫu thuật
+ Diệt những ổ di căn nhỏ sau phẫu thuật
+ Diệt tổ chức ung thư tái phát, di căn
+ Tăng ộ nhạy, ộ ặc hiệu của các xét nghiệm theo dõi sau iều trị: xạ hình toàn thân với I-131 lOMoAR cPSD| 38841209
- Tế bào tuyến giáp hấp thụ hầu như tất cả Iod trong cơ thể. Khi I 131 có tính phóng xạ ến với tế bào tuyến giáp, nó có khả
năng tác ộng ến các tế bào, ặc biệt là tế bào ang sinh trưởng nhanh (tế bào ung thư) và giết chết tế bào.
- So sánh với việc xạ trị hoặc dùng dược chất khác, Iod 131 ít gây biến chứng, chu kì bán rã ngắn (8 ngày), không làm cho
người bệnh bị rụng tóc, ít ảnh hưởng ến các cơ quan lân cận (vì tia beta phát ra từ hạt nhân I 131 i ược trong mô khoảng
1-2 mm, nó truyền hầu hết năng lượng (gần 95%) cho các tế bào trên quãng ường i, cho nên nó chỉ tác ộng chủ yếu ở mô
ích mà hầu như không tác ộng ến mô lành lân cận)
Câu 3: Sau khi iều trị với I 131, người bệnh ược cho chụp xạ hình toàn thân. Giải thích cơ chế của việc chụp xạ hình toàn thân với I 131
- Trước khi chụp xạ hình, thông thường bệnh nhân sẽ ược tiêm vào mạch máu một lượng I 131 gắn với một dược chất.
Các hợp chất này phát ra bức xạ Gamma. Hai ầu dò (Detector) của máy chụp sẽ thu nhận bức xạ này cùng lúc phát ra từ
cơ thể bệnh nhân và tái tạo thành hình ảnh thông qua các phần mềm chuyên biệt.
- Sau khi xử lý ảnh, kết quả sẽ thể hiện các tổn thương trên cơ thể dưới dạng hình ảnh giải phẫu và chức năng. Từ ó, bác sĩ
có thể kiểm tra xem các tế bào ung thư có di căn hay không, và ưa ra chỉ ịnh có nên sử dụng tiếp tục Iod 131 ể tiêu diệt
các tế bào còn sót lại hay không,...
Câu 4: Sau khi uống I 131, người bệnh ược dặn dò giữ khoảng cách với những người xung quanh. Hãy giải thích lời dặn
dò này. So sánh giữa I 131 với chụp X quang ngực và siêu âm bụng
- Sau khi iều trị bằng I 131, chất phóng xạ không ào thải khỏi cơ thể ngay lập tức mà phải tốn thời gian ể bài tiết qua nước
tiểu, mồ hôi,... trong vòng vài ngày. Trong khoảng thời gian ó, cơ thể người bệnh vẫn còn những tia phóng xạ.
Chính vì thế, họ phải cách li với những người xung quanh ể những người khác không bị ảnh hưởng bởi tia phóng xạ phơi nhiễu.
- Thời gian cách li: 3-7 ngày (tùy thuộc vào liều lượng Iod mà bệnh nhân ã uống) Iod 131 Chụp X-quang bụng Siêu âm bụng -
Phát ra bức xạ tia beta - Sử dụng tia X (sóng iện từ) - Tia - Sử dụng sóng siêu âm và gamma (sóng iện từ)
X có bước sóng ngắn (nhưng dài (sóng âm)
hơn tia gamma), năng lượng cao, - Tia gamma có bước - Sóng siêu âm có bước
sóng ngắn, năng lượng rất cao, có có khả năng tương tác với ADN sóng dài, mang năng lượng
khả năng ion hóa, âm xuyên và ion hóa tế bào, gây hại cho cơ ngắn, không có khả năng ion hóa
mạnh. Tia gamma ặc biệt hữu ích thể
nên không gây hại cho cơ thể
trong ghi o chẩn oán. Tuy nhiên,
khi sử dụng cần phải bảo quản an toàn
Câu 5: Đôi khi, người bệnh có thể ược cho chụp xạ hình tuyến giáp với I123 ể ánh giá mô giáp còn sót lại sau phẫu thuật
và quyết ịnh liều I 131. I123 ược cho là có ít ộc tính tế bào. Giải thích cơ chế của việc chụp xạ hình tuyến giáp với I 123
- Sau khi cho tiêm (I-123), Iod sẽ tập trung về tuyến giáp làm hiện hình tuyến giáp, ược phát hiện qua một ầu ghi. Ngoài
ra, Iod tập trung về tuyến giáp nhiều hay ít cũng còn phản ánh tuyến giáp hoạt ộng mạnh hay yếu. Nhờ ó, bác sĩ sẽ kiểm
tra hình ảnh giải phẫu và chức năng của tuyến giáp sau iều trị.
- Do I-123 có thời gian bán hủy ngắn hơn nên an toàn hơn và ược ưa dùng trong xạ hình tuyến giáp. I-123 còn có ưu iểm
khác là hoàn toàn không gây hại cho cơ thể và không cần lưu ý gì ặc biệt sau khi làm xạ hình tuyến giáp. lOMoARcPSD| 38841209 IOD 131 IOD 123 -
Thời gian bán hủy lâu hơn -
Thời gian bán hủy ngắn hơn -
Có khả năng giết chết tế bào tuyến giáp -
An toàn, không gây hại ến tế bào tuyến
giáp (nhưng vẫn có tia gamma, không có tia beta -
Sử dụng cho cả chẩn oán và iều trị
nên không phá hủy tế bào tuyến giáp)
(10% năng lượng và liều bức xạ là tia gamma: chẩn
oán, 90% năng lượng và liều bức xạ là tia beta: gây -
Chỉ ược sử dụng cho chẩn oán (chụp xạ
tổn thương mô, dùng ể iều trị chứ không có chức hình), ưu tiên sử dụng trong tình huống chỉ cần năng chẩn oán) chụp ảnh hạt nhân -
Có mức năng lượng cao, có thể gây nhiễu hình ảnh -
Mức năng lượng phù hợp -
Chi phí thấp, phương pháp sản xuất dễ
dàng (bắn phá neutron của Tellurium tự nhiên
trong lò phản ứng hạt nhân, sau ó tách I -
Chi phí cao, phương pháp sản xuất phức -131 ra
bằng nhiều phương pháp ơn giản khác nhau)
tạp hơn (bức xạ lò phản ứng của các viên nang khí xenon ắt tiền) lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
NGỘ ĐỘC TETRODOTOXIN
Câu 1: Phân tích liên kết hóa học khi VGSC tương tác với H2O và Na+ State 1:
- Liên kết hidrogen giữa H2O và O- của VGSC
- Liên kết hidrogen giữa H2O và H (NH+)
- Liên kết giữa N+ và O- State 2: liên kết giữa Na+
và O- Câu 2: Phân tích cấu trúc hóa học của Guanidinium và Tetrodotoxin GUANIDINIUM TETRODOTOXIN lOMoARcPSD| 38841209 - Liên kết CHT phân cực -
Nhiều liên kết CHT phân cực
- C lai hóa sp2, góc liên kết 120 ộ -
C lai hóa sp2, góc liên kết 120 ộ -
Nhiều nhóm OH, NH nên có khả năng tạo
nhiều liên kết hidrogen, ít tan trong dung môi hữu cơ -
N+ có khả năng tạo liên kết ion - Tan trong axit mạnh
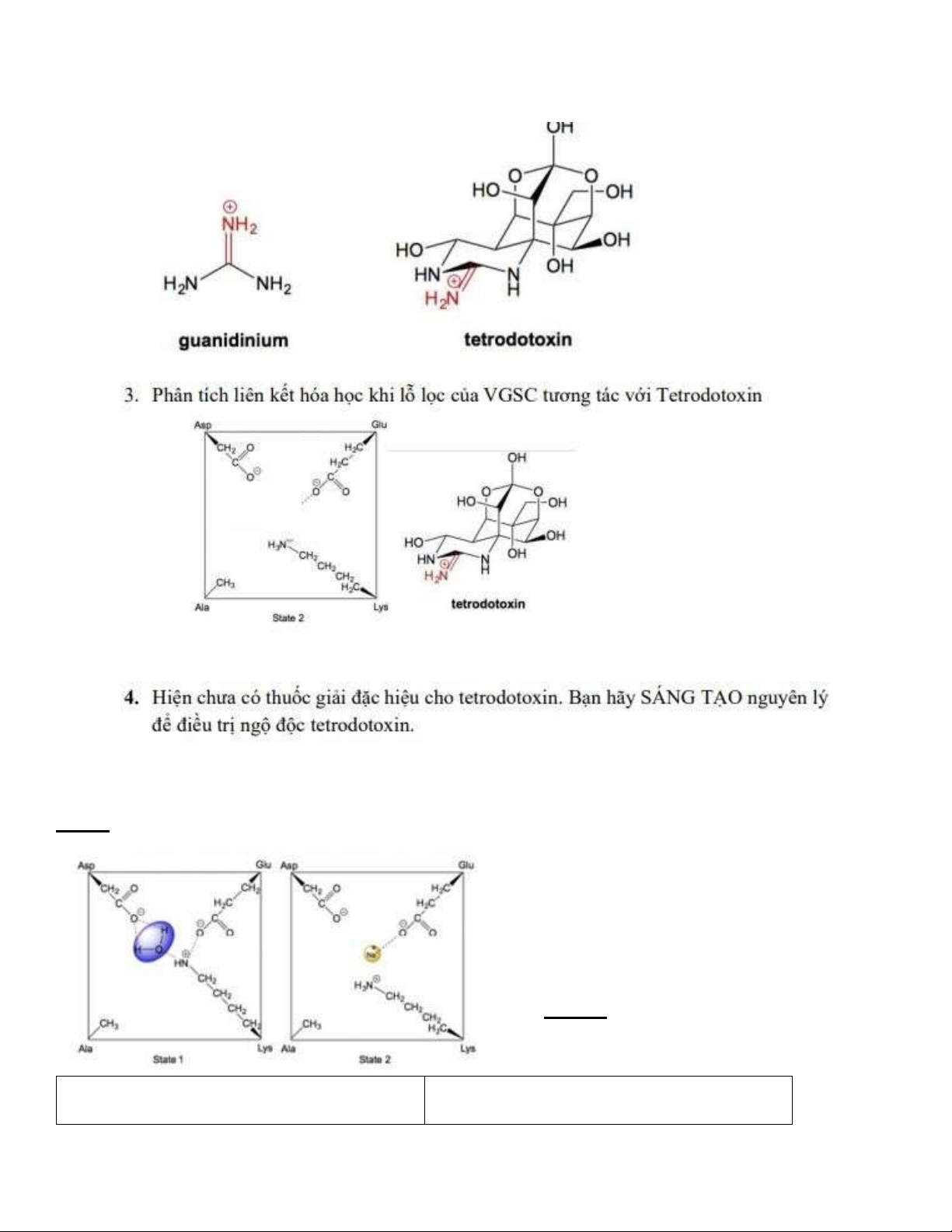
Câu 3: Phân tích liên kết hóa học khi lỗ lọc của VGSC tương tác với Tetrodotoxin
- Liên kết ion giữa N+ và O- của VGSC
- Liên kết hidrogen giữa NH của TTX và O- của VGSC
- Liên kết hidrogen giữa N của TTX và NH3+ của VGSC
TTX lớn, bịt lỗ lọc của VGSC Na+ không di chuyển qua ược hệ thống thần kinh bị tê liệt tê liệt cơ, suy hô hấp, dễ tử vong
Câu 4: Nguyên lý ể iều trị ngộ ộc tetrodotoxin
- Phải có tác nhân dễ tạo liên kết với VGSC hơn TTX, liên kết hóa học phải ủ lớn ể ẩy TTX ra khỏi lỗ kênh -
Tác nhân có kích thước ủ nhỏ ể không bít lỗ kênh, giúp ion Na+ dễ dàng i qua lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 h BỆNH BÉO PHÌ
Câu 1: Dựa vào yếu tố nào ể xác ịnh Maria béo phì?
- Dựa vào chỉ số BMI (chỉ số khối cơ thể): cân nặng (kg)/ chiều cao
(m) x chiều cao (m). Từng khoảng số BMI sẽ thể hiện mức ộ gầy hay béo của mỗi người.
- Trong trường hợp này, Maria nặng 90,78 kí và cao 1,73 (m) nên có
chỉ số BMI là 30,33, thuộc cấp ộ béo phì.
Câu 2: Tại sao Maria ăn cam thay cho khoai tây chiên, không dùng nước ngọt có ga nữa. Bố Maria chuẩn bị bữa ăn cho có ít cơm cho Maria?
- Cơ thể chúng ta lấy năng lượng cung cấp cho các hoạt ộng sống thông qua thức ăn. Các loại thực phẩm khác
nhau (glucid, lipid, protein,...) sẽ thông qua các quá trình chuyển hóa khác nhau trong tế bào (thực chất là phản
ứng oxy hóa sinh năng lượng) ể tạo nên chất chuyển hóa và năng lượng (nhiệt + ATP)
- Khi chúng ta cung cấp cho cơ thể quá nhiều thức ăn, phần năng lượng dư thừa sẽ dự trữ dưới dạng mỡ và gây nên
béo phì. Chính vì thế, nên cắt giảm lượng thức ăn nạp vào trong cơ thể ể giảm tình trạng béo phì. lOMoARcPSD| 38841209
Một quả cam lớn nặng 250 gr chỉ chứa 90kcalo
10-12 miếng khoai tây chiên sẽ cung cấp 125kcalo
Nước lọc không chứa calo
100 ml nước ngọt có ga chứa 42kcalo 100 gam cơm chứa 130kcalo
Câu 3. Dựa vào ịnh luật bảo toàn khối lượng giải thích mối liên quan giữa thực phẩm và béo phì?
- Cân nặng của cơ thể phụ thuộc vào 2 thứ: năng lượng lấy vào và năng lượng sử dụng.
+ Năng lượng lấy vào: bằng thực phẩm (carbohydrate, fat, alcohol, protein) + Năng lượng sử dụng:
Hiệu suất nhiệt của thực phẩm (TEF): năng lượng ể tiêu hóa thức ăn
Trao ổi chất khi nghỉ ngơi (RMR): năng lượng ể thực hiện các chức năng cơ bản nhất khi cơ thể nghỉ ngơi (tim ập, hít thở,
lưu thông máu, não hoạt ộng,...)
Các hoạt ộng thể chất: i bộ, chạy nhảy, i xe ạp,...
- Khối lượng của cơ thể sẽ bảo toàn nếu năng lượng lấy vào = năng lượng sử dụng => Khi ăn nhiều, thực phẩm
sẽ cung cấp năng lượng nhiều cho cơ thể.
Nếu chúng ta không hoạt ộng thường xuyên thì năng lượng sử dụng < năng lượng lấy vào => năng lượng dư thừa tích lũy
trong mô mỡ => béo phì
Câu 4: Maria tập thể thao, bơi, và i cầu thang bộ ể iều trị béo phì, giải thích?
- Tập thể thao, bơi và i cầu thang bộ là các hoạt ộng cần năng lượng nhiều. Khi ấy, lượng mỡ dự trữ sẽ trải qua quá
trình chuyển hóa ể cung cấp năng lượng dạng ATP cung cấp cho các hoạt ộng ó. Vì vậy, Maria có thể tăng năng
lượng lấy ra, kết hợp với ăn kiêng, Maria sẽ giảm ược cân.
Câu 5: Biết enthalpy phản ứng oxy hóa glucose là 2802 kJ/mol ở 25 oC, nếu leo lên cầu thang 3m của nhà 5 tầng với 2
lần mỗi ngày thì lượng gam glucose cần là bao nhiêu. Giả sử rằng 25% enthalpy chuyển thành công có ích?
Công ể leo cầu thang: A=F.s=m.g.s= 3x5x2x90,78x10 = 27234 (J)
Enthalpy ể phản ứng oxi hóa glucoso: 𝛥H = 27234x4 = 108936 (J)
Số mol glucoso bị oxi hóa: 108936/2802000= 0,039 (mol) lOMoARcPSD| 38841209
Khối lượng glucoso bị oxi hóa: 0,039x180 = 7(g)
Câu 6: Một người sau khi bơi bước lên bờ thì cần bao nhiêu năng lượng ể nước bốc hơi hết ở 25 oC, giả sử lượng nước
trên cơ thể sau bơi là 18g. Tính biến ổi nội năng của sự bay hơi?
Số mol nước bốc hơi: 18/18 = 1 (mol) 𝛥H = 𝛥U + P.𝛥V
1x 44,01x1000 = 𝛥U + 𝛥n.R.T
44010 = delta U + 1x 8,314x298
𝛥U = 41,5 (kJ) Câu 7: Một người trong phòng ấm, ăn 100 g cheese (năng lượng từ cheese là 15,52 kJ/g), giả thiết các
cơ quan không tiêu thụ năng lượng này. Hỏi cần bao nhiêu ml nước uống vào ể bù lại lượng nước bay hơi làm giảm nhiệt
ộ cơ thể bằng nhiệt ộ trước khi ăn cheese?
Năng lượng từ cheese: 100.15,52 = 1552 (kJ)
Số mol nước bốc hơi: 1552/44,01 = 35,26 (mol)
Khối lượng nước bốc hơi: 35,26 x18 = 634,8 (g)
=> Cần uống vào 634,8 ml nước ể bù lại lượng nước bay hơi lOMoARcPSD| 38841209
CHUYỂN HÓA NĂNG LƯỢNG TRONG GÃY XƯƠNG CASE LÂM SÀNG Ký hiệu: ATP: Adenosine TriPhosphate ADP: Adenosine DiPhosphate H: Enthalpy S: Entropy G: Gibbs free energy
Nghiên cứu o nồng ộ adenosine triphosphate tại mô tổn thương gãy xương chày trong suốt giai oạn liền xương ở những
khoảng thời gian khác nhau ối với những ối tượng ược nghiên cứu bị gãy xương chày. Kế quả thu ược thì ược so sánh
với nồng ộ ATP trong mô bình thường, ã cho thấy sự chuyển hóa năng lượng với tốc ộ cao trong giai oạn sớm của sự liền
xương gãy, giai oạn liền xương kéo dài cho tới khi hình thành mô sẹo và hồi phục. Nồng ộ ATP có thể cung cấp chỉ số ể
theo dõi sự lành vết xương gãy và hổ trợ cho việc ánh giá nhu cầu cung cấp chất dinh dưỡng cho bệnh nhân gãy xương.
ATP là hợp chất giàu năng lượng và quan trọng tham gia vào các quá trình chuyển hóa năng lượng, nên có thể xem ATP
là giá trị hiển thị tốt của hoạt ộng liên quan ến năng lượng trong quá trình lành xương.
Chất liệu và phương pháp thực hiện trên ối tượng bị gãy xương chày:
- Mẫu xương gãy ược theo dõi bằng chụp CT 2, 4, 6 và 12 tuần.
- Phẫu thuật lấy mẫu rửa với nước muối sinh lý, rồi ông lạnh trong nitrogen lỏng – 70 oC.
- Mẫu trong nitrogen lỏng ược xay thành bột, trộn 2 ml perchloric acid 0,9 M và ể trong nước á 24 giờ ể chiết xuất.
- Dịch chiết ược ly tâm ở 4 oC, trong 20 phút với tốc ộ 3500 vòng/phút, thu lấy phần dung dịch ở trên, thêm tiếp 2
ml perchloric acid và ly tâm lại lần nữa.
- Dịch sau ly tâm ược iều chỉnh pH từ 6,8 ến 7,4 bằng dung dịch KOH 0,2 M.
- Sau khi ly tâm lần 3 thì thu ược dịch trong và dung ể o nồng ộ ATP. Kết quả:
Phim chụp tất cả xương chày bị gãy ở tuần thứ 2, thứ 4, thứ 6 và tuần thứ 12 cho kết quả hồi phục tốt. Kết
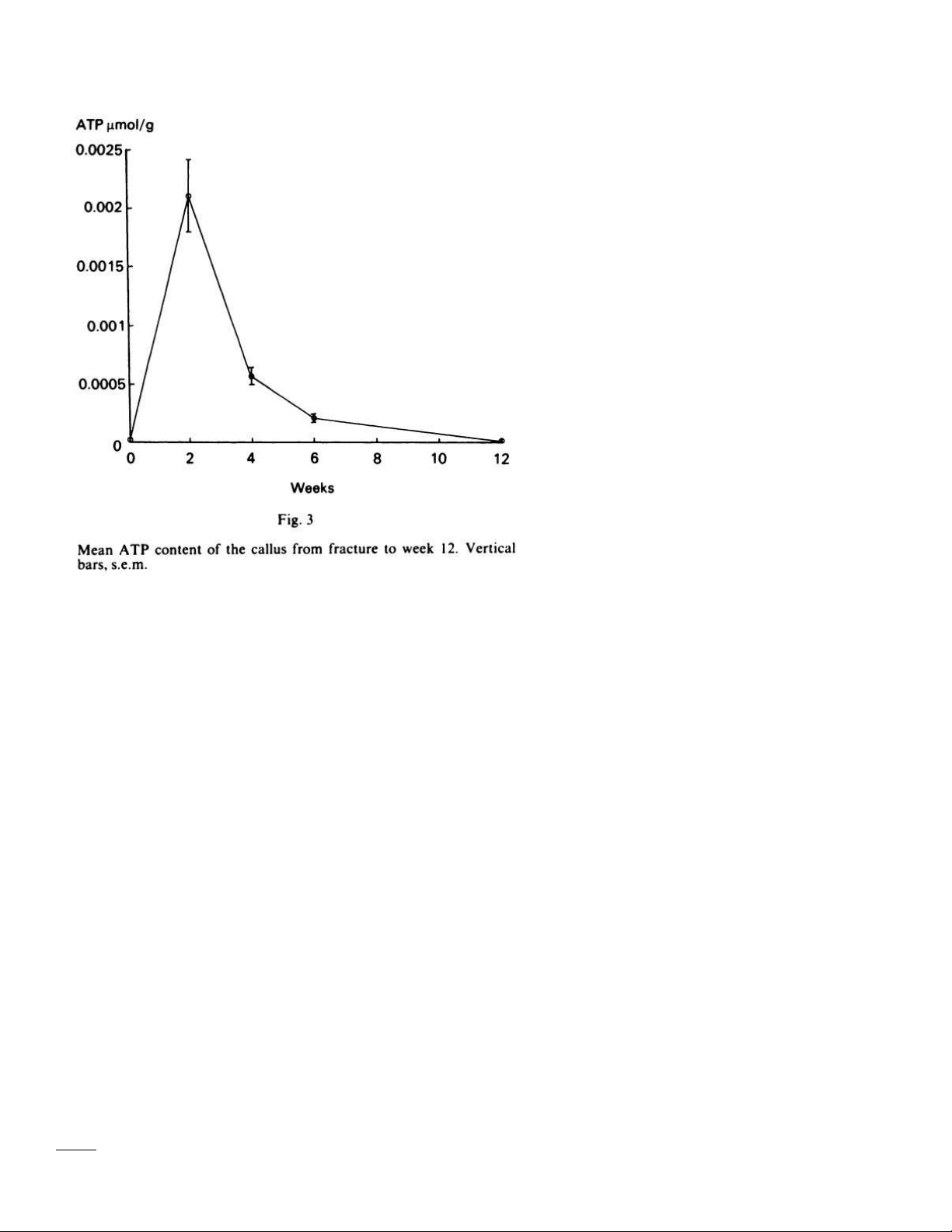
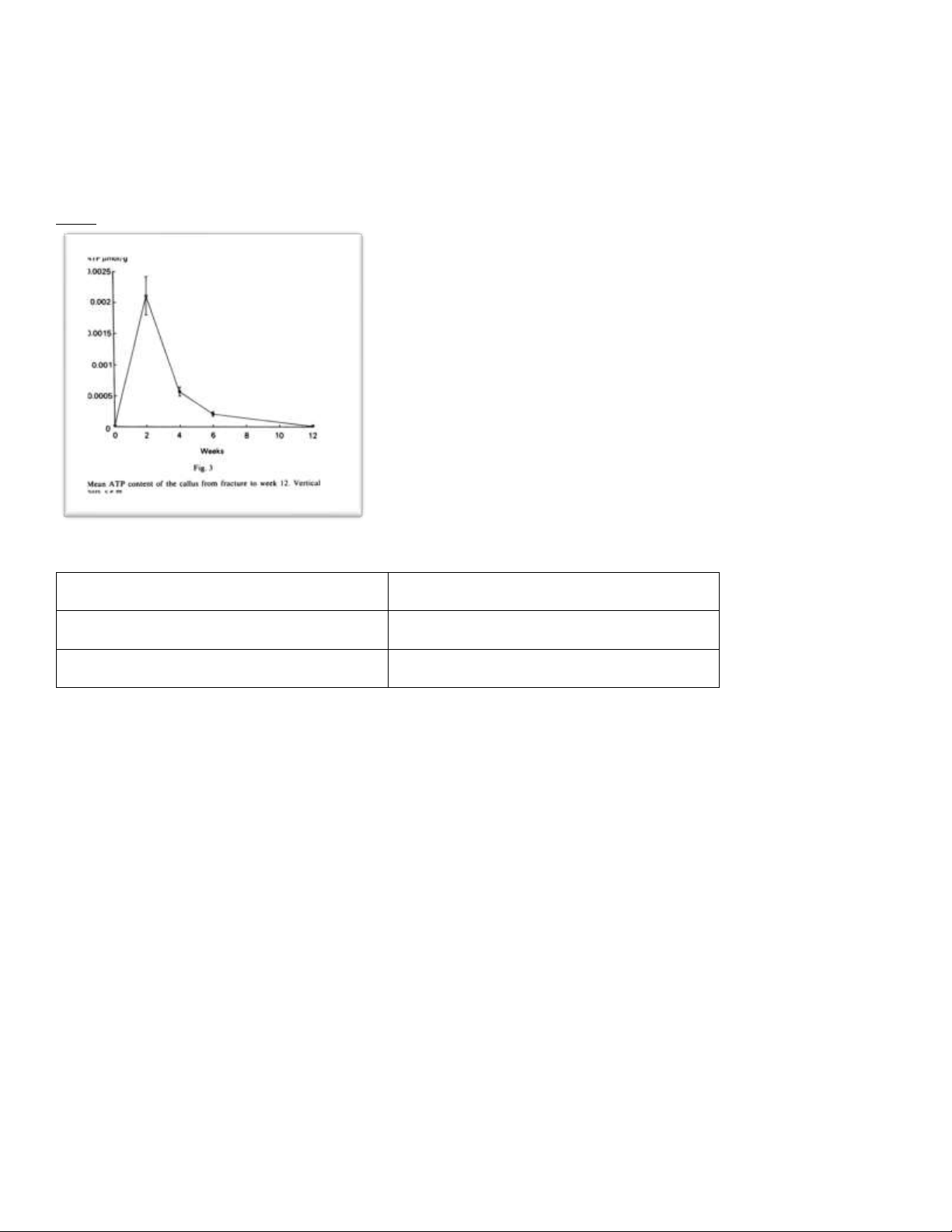
quả nồng ộ ATP thay ổi o ược thể hiện trong bảng 1 và ồ thị 1 Bảng 1 Mô xương ATP (µmol/g) Bình thường 0,0000094 Sau 2 tuần 0,002108 Sau 4 tuần 0,000568 Sau 6 tuần 0,000209 Sau 12 tuần 0,000083 Đồ thị 1 lOMoARcPSD| 38841209
Câu hỏi thảo luận:
Câu 1. Tại sao ATP là chất giàu năng lượng?
Câu 2. Từ cấu trúc của ATP hãy xác ịnh vị trí năng lượng cao?
Câu 3. Trình bày các phản ứng chuyển hóa trong cơ thể có sự cung cấp năng lượng từ ATP?
Câu 4. Dựa vào bảng 1 kết quả o ược hãy biện luận kết quả?
Câu 5. Dựa vào ồ thị 1 hãy so sánh và ánh giá kết quả ạt ược trong nghiên cứu?
Câu 6. Kết quả nghiên cứu có ý nghĩa gì trong iều trị?
Câu 7. ATP + H2O ↔ ADP + Pi
Thủy phân 1 mol ATP tạo ra ADP ở 37,15 oC, ΔGo = - 35 kJ/mol ;
Biến ổi năng lượng tự do ΔG bằng bao nhiêu? tại thời iểm [ATP]/[ADP] = 100 : 1. Giả thiết nồng ộ phosphate Pi và nước
thay ổi không áng kể. cho R = 8,3143 J/mol.K.
CASE CHUYỂN HÓA NĂNG LƯỢNG TRONG GÃY XƯƠNG
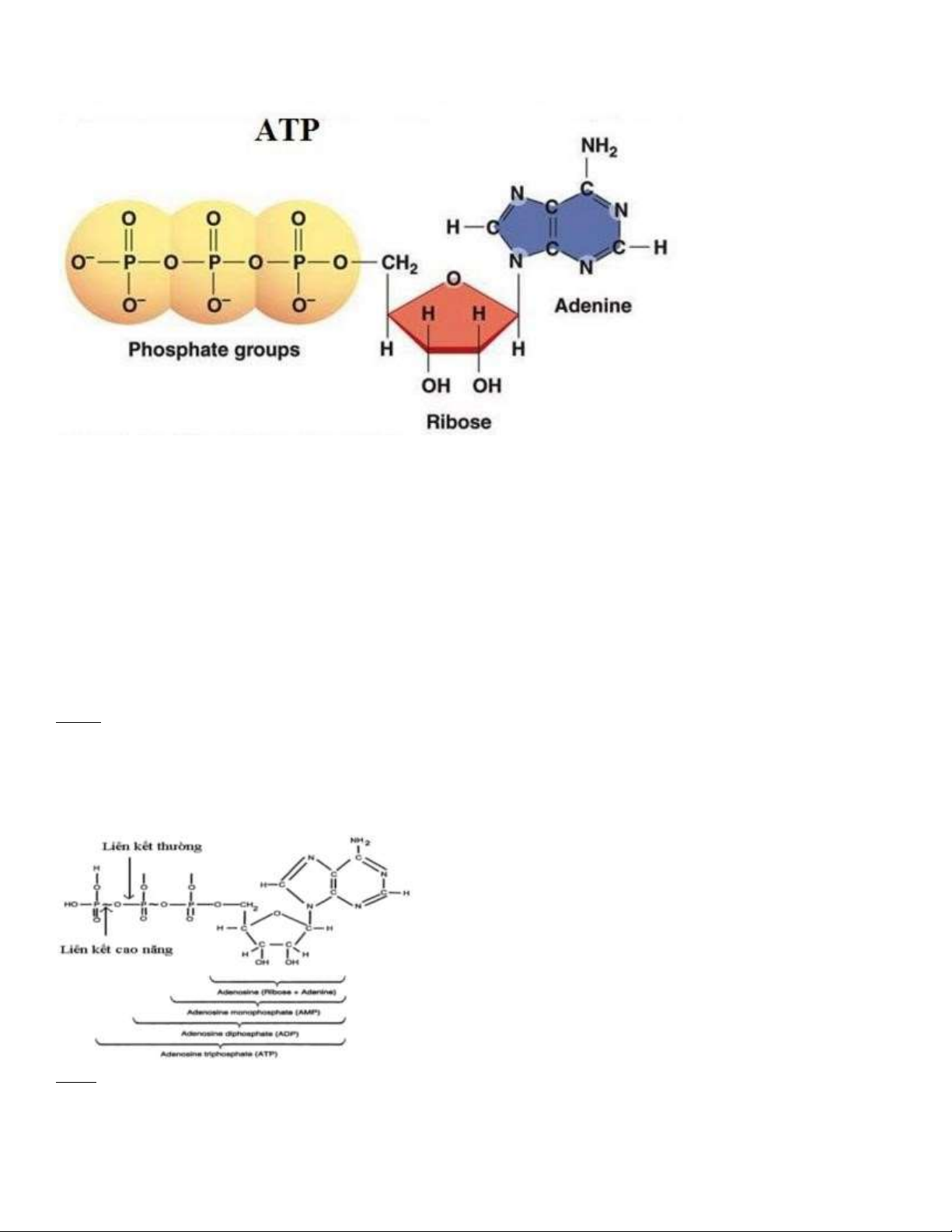
Câu 1: Tại sao ATP là chất giàu năng lượng? lOMoARcPSD| 38841209
- ATP là chất ược cấu tạo gồm bazơ a ênin, ường ribôzơ và ba nhóm phôtphat. Năng lượng ược lưu trữ trong các liên kết
hóa trị giữa các nhóm photphate, với số tiền lớn nhất của năng lượng (khoảng 7.3 kcal/mol) trong mối quan hệ giữa các
nhóm photphate thứ hai và thứ ba.
- Khi ATP bị phân giải nhờ enzim thì nhóm phôtphat không mất i mà sẽ liên kết với chất thực hiện chức năng (prôtêin
hoạt tải, prôtêin co cơ…) và khi hoạt ộng chức năng hoàn thành thì nhóm phôtphat lại liên kết với ADP ể tạo thành ATP
nhờ nguồn năng lượng tạo ra từ các phản ứng giải phóng năng lượng.
Quá trình ATP cung cấp năng lượng: ATP ==> ADP + năng lượng + Pi
Quá trình tổng hợp lại ATP: ADP + Pi + năng lượng ==> ATP
- ATP là một loại năng lượng ược tế bào sản sinh ra ể dùng cho mọi phản ứng của tế bào và ược gọi là ồng tiền năng lượng của tế bào
Câu 2. Từ cấu trúc của ATP hãy xác ịnh vị trí năng lượng cao?
- 2 liên kết cuối cùng ở 2 nhóm photphate cuối rất giàu năng lượng
- Phân tử ATP phân giải, nhả năng lượng như sau: với sự có mặt của nước, khi gãy liên kết giữa oxy sau: với sự có mặt
của nước, khi gãy liên kết giữa oxy với nguyên tử phospho (P) cuối cùng thì tách ra một phân tử phosphat vô cơ (Pi),
còn lại là Adenosi Diphosphat (ADP) và có 7kcal/mol ược giải phóng
Câu 3. Trình bày các phản ứng chuyển hóa trong cơ thể có sự cung cấp năng lượng từ ATP? Vận
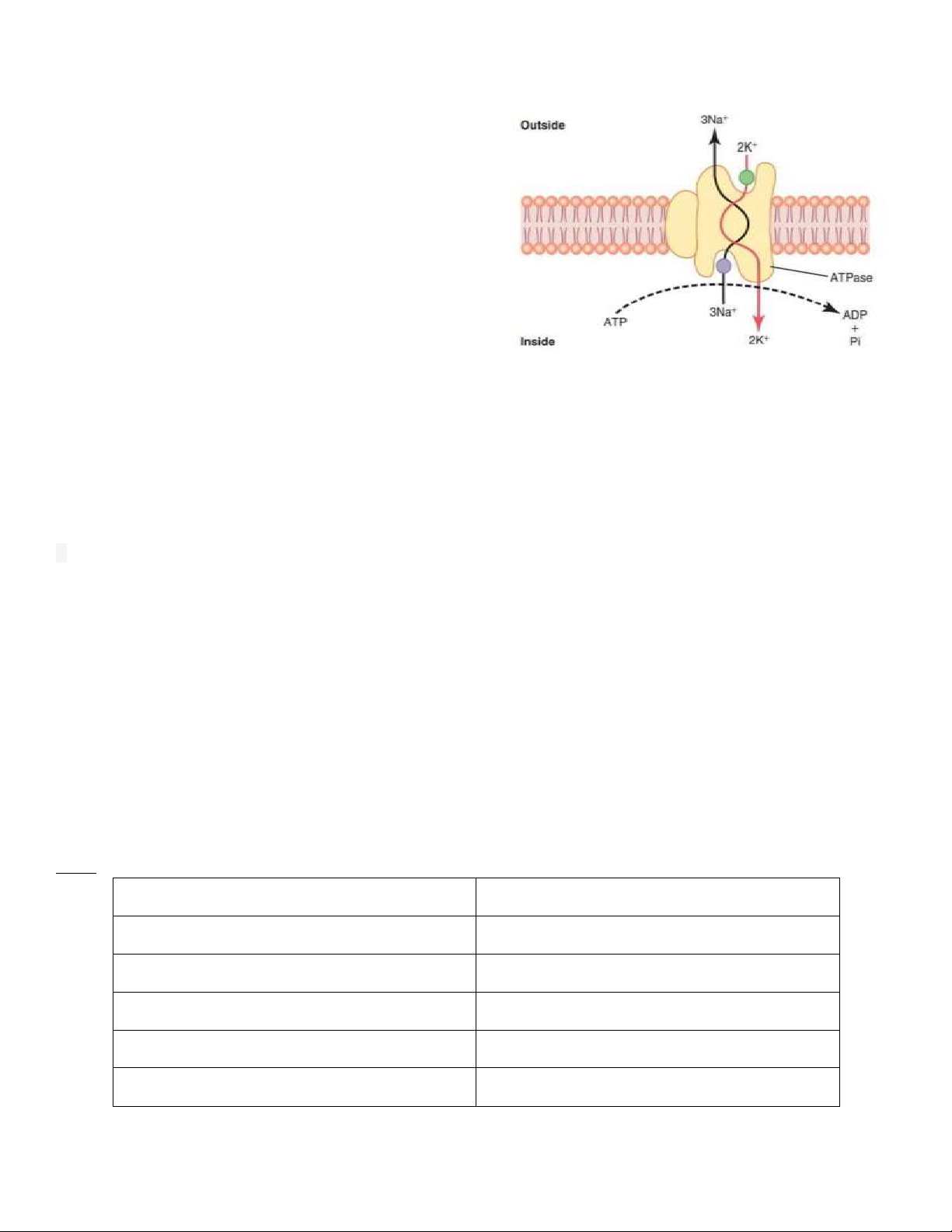
chuyển chủ ộng nguyên phát lOMoARcPSD| 38841209
Cơ chế: khi 2 ion K gắn vào bên ngoài của protein mang có 3
ion Na gắn vào bên trong, chức năng của ATPase bắt ầu hoạt
ộng. Nó cắt 1 liên kết phosphat cao năng của ATP biến thành
ADP và 1 phosphat, iều này giúp thay ổi cấu hình của bơm và
giúp ưa 3Na ra bên ngoài và 2K vào trong tế bào. Và cũng
giống như những enzym khác, Bơm Na-K-ATPase cũng có thể
tạo ATP từ ADP và phosphat khi thang iện hóa của Na và K
chênh lệch ở 2 bên màng ủ lớn ể thắng lại quá trình bình thường của bơm. Tổng hợp AND/ ARN
Tổng hợp DNA và RNA òi hỏi ATP. ATP là một trong bốn monome nucleotide-triphosphate cần thiết trong quá trình tổng
hợp RNA. Tổng hợp DNA sử dụng một cơ chế tương tự, ngoại trừ trong tổng hợp DNA, ATP lần ầu tiên trở nên biến ổi
bằng cách loại bỏ một nguyên tử oxy từ ường ể mang lại deoxyribonucleotide, dATP.
Dẫn truyền xung thần kinh
Tại ầu tận cùng trước synap, ATP là cần thiết ể thiết lập các gradient ion ưa chất dẫn truyền thần kinh vào các túi và ể
mồi các túi ể giải phóng thông qua quá trình xuất bào. Quá trình này phụ thuộc vào việc ATP phục hồi nồng ộ ion trong
sợi trục sau mỗi iện thế hoạt ộng, cho phép một tín hiệu khác xảy ra. Vận chuyển tích cực chịu trách nhiệm thiết lập lại
nồng ộ ion natri và kali về giá trị ban ầu sau khi iện thế hoạt ộng xảy ra thông qua Na / K ATPase. Trong quá trình này,
một phân tử ATP bị thủy phân, ba ion natri ược vận chuyển ra khỏi tế bào, và hai ion kali ược vận chuyển trở lại tế bào,
cả hai ều di chuyển ngược lại với gradient nồng ộ của chúng.
Co cơ Hầu hết năng lượng cần thiết cho sự co cơ ược sử dụng ể vận hành cơ chế i bộ dọc theo ó các cầu nối chéo kéo
các sợi actin, nhưng một lượng nhỏ là cần thiết cho (1) bơm các ion canxi từ cơ tương vào lưới cơ tương sau khi co bóp
kết thúc và (2) bơm các ion natri và kali qua màng sợi cơ ể duy trì một môi trường ion thích hợp cho sự lan truyền iện
thế hoạt ộng của sợi cơ.
Nồng ộ của ATP trong sợi cơ, vào khoảng 4mmol, là ủ ể duy trì ầy ủ sự co bóp cho nhiều nhất chỉ trong 1-2 giây. ATP bị
tách ra ể hình thành ADP, cái mà truyền năng lượng từ phân tử ATP tới bộ máy co bóp của sợi cơ. Sau ó, ADP ược tái
phosphoryl hóa ể hình thành ATP mới trong một phần nhỏ của một giây, iều này cho phép cơ tiếp tục sự co bóp của nó.
Câu 4. Dựa vào bảng 1 kết quả o ược hãy biện luận kết quả? Mô xương ATP (µmol/g) Bình thường 0,0000094 Sau 2 tuần 0,002108 Sau 4 tuần 0,000568 Sau 6 tuần 0,000209 Sau 12 tuần 0,000083 lOMoARcPSD| 38841209
- Trong 2 tuần ầu: ATP ã cho thấy sự chuyển hóa năng lượng với tốc ộ cao (tăng hơn 200 lần) nhằm nhanh chóng phục
hồi nhanh các chức năng sau khi bị gãy xương chày.
- Từ tuần 2 trở i, ATP chuyển hóa năng lượng dần dần trở về quỹ ạo cũ cung cấp nguồn năng lương như bình thường sau
khi ở nơi bị gãy xương ang ược hồi phục.
Câu 5: Dựa vào ồ thị 1 hãy so sánh và ánh giá kết quả ạt ược trong nghiên cứu? 0 - 2 tuần
Lượng ATP tăng nhanh, ặt ỉnh sau 2 tuần 2 - 4 tuần Lượng ATP giảm dần 4 - 12 tuần
Lượng ATP giảm ến gần bằng lượng ban ầu
Quá trình liền xương là một quá trình phức tạp liên quan tới nhiều yếu tố từ mức phân tử, tế bào tới vùng tổn thương tới
toàn cơ thể. Về tổ chức học, quá trình liền xương bình thường diễn ra qua 3 giai oạn như sau:
- Giai oạn viêm tấy nhằm làm tiêu sạch các mô hoại tử.
- Giai oạn phục hồi mô hàn gắn vùng xương bị gián oạn.
- Giai oạn tạo hình xương, mô tái tạo ược thêm các chất vô cơ trở thành mô xương chính thức.
Trong ó, giai oạn viêm và tạo can xương mềm kéo dài từ 1-3 tuần và cần tiêu tốn nhiều năng lượng ATP nhất. lOMoARcPSD| 38841209
Câu 6. Kết quả nghiên cứu có ý nghĩa gì trong iều trị?
Dựa vào nồng ộ ATP ể ánh giá quá trình phục hồi
- Nếu trong 0-2 tuần ầu, lượng ATP không tăng cao nghĩa là có sự rối loạn trong quá trình chuyển hóa. Lúc này, bác sĩ cần
phải ưa ra những biện pháp phù hợp
Cung cấp chất dinh dưỡng cho bệnh nhân
- Trong pha viêm, cần phải cung cấp một lượng lớn ATP cho cơ thể ể phục vụ các quá trình chuyển hóa. Chính vì vậy,
bệnh nhân cần phải ược cung cấp ầy ủ các chất dinh dưỡng giàu năng lượng (protein, cacbohydrat, lipid,..), các vitamin
và khoáng chất (vitamin D ể tăng khả năng hấp thu canxi ở ruột, canxi cấu tạo nên thành phần xương, magie giúp cơ thể
hấp thu vitamin D và canxi tốt hơn, phục vụ cho các quá trình sinh hóa tạo xương mới)
- Bệnh nhân cần phải tránh sử dụng các chất kích thích (rượu, bia, caffein,..) Vì caffein sẽ làm giảm khả năng hấp thụ
canxi, và các chất kích thích sẽ làm rối loạn quá trình chuyển hóa trong cơ thể.
Câu 7. ATP + H2O ↔ ADP + Pi
Thủy phân 1 mol ATP tạo ra ADP ở 37,15 oC, ΔGo = - 35 kJ/mol;
Biến ổi năng lượng tự do ΔG bằng bao nhiêu? tại thời iểm [ATP]/[ADP] = 100 : 1. Giả thiết nồng ộ phosphate Pi và nước
thay ổi không áng kể. cho R = 8,3143 J/mol.K. lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
ĐỘ ĐÀO THẢI THUỐC THEO THỜI GIAN
Câu 1: Động hóa học là gì? Dược ộng học là gì?
Động hóa học là ngành khoa học nghiên cứu về vận tốc phản ứng, cơ chế phản
ứng và các yếu tổ ảnh hưởng ến phản ứng
Dược ộng học là ngành khoa học tập trung vào xác ịnh sự thay ổi của các chất
ược cung cấp từ bên ngoài vào một sinh vật sống (làm cách nào thuốc ược ưa
vào cơ thể, thuốc sẽ i âu, cơ thể ào thải thuốc như thế nào,…?)
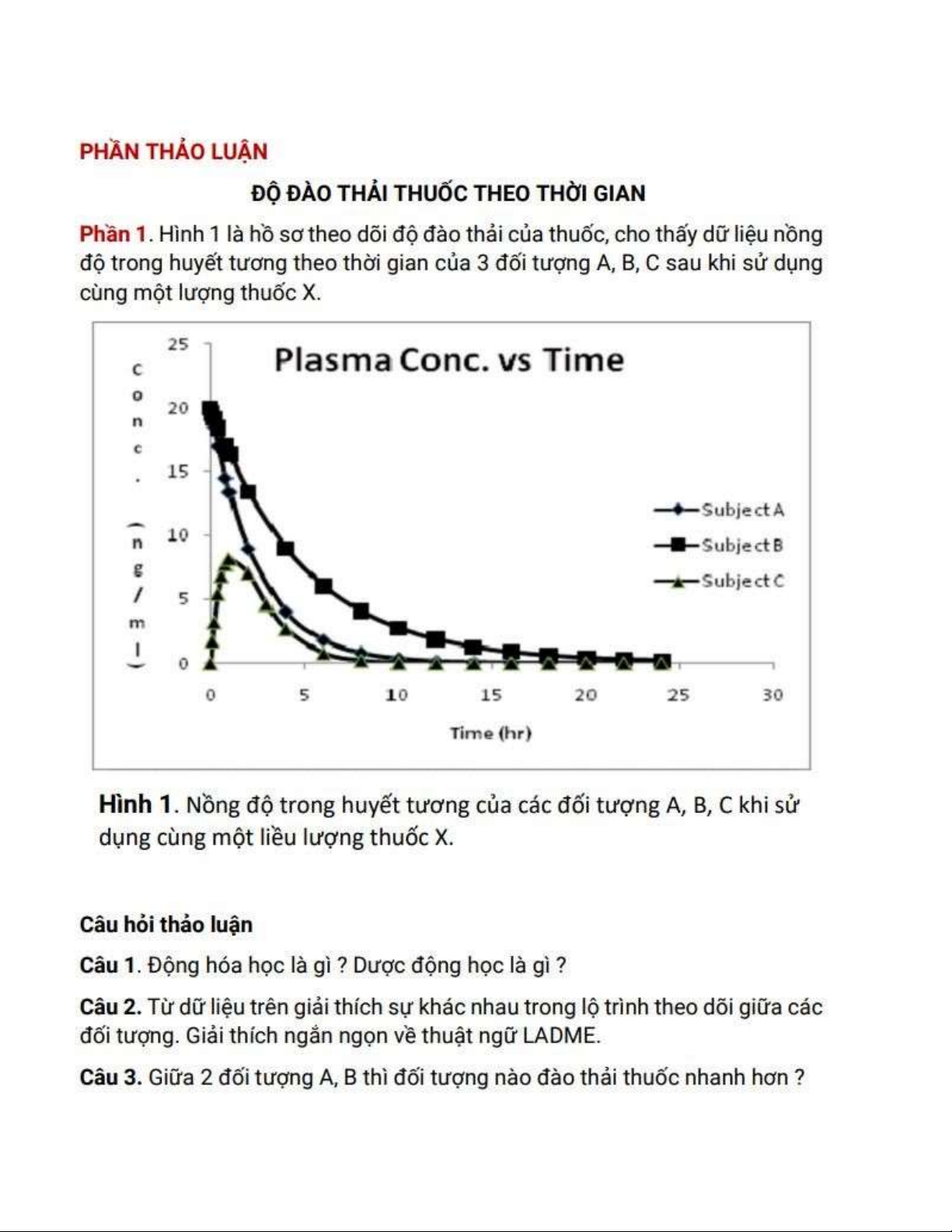
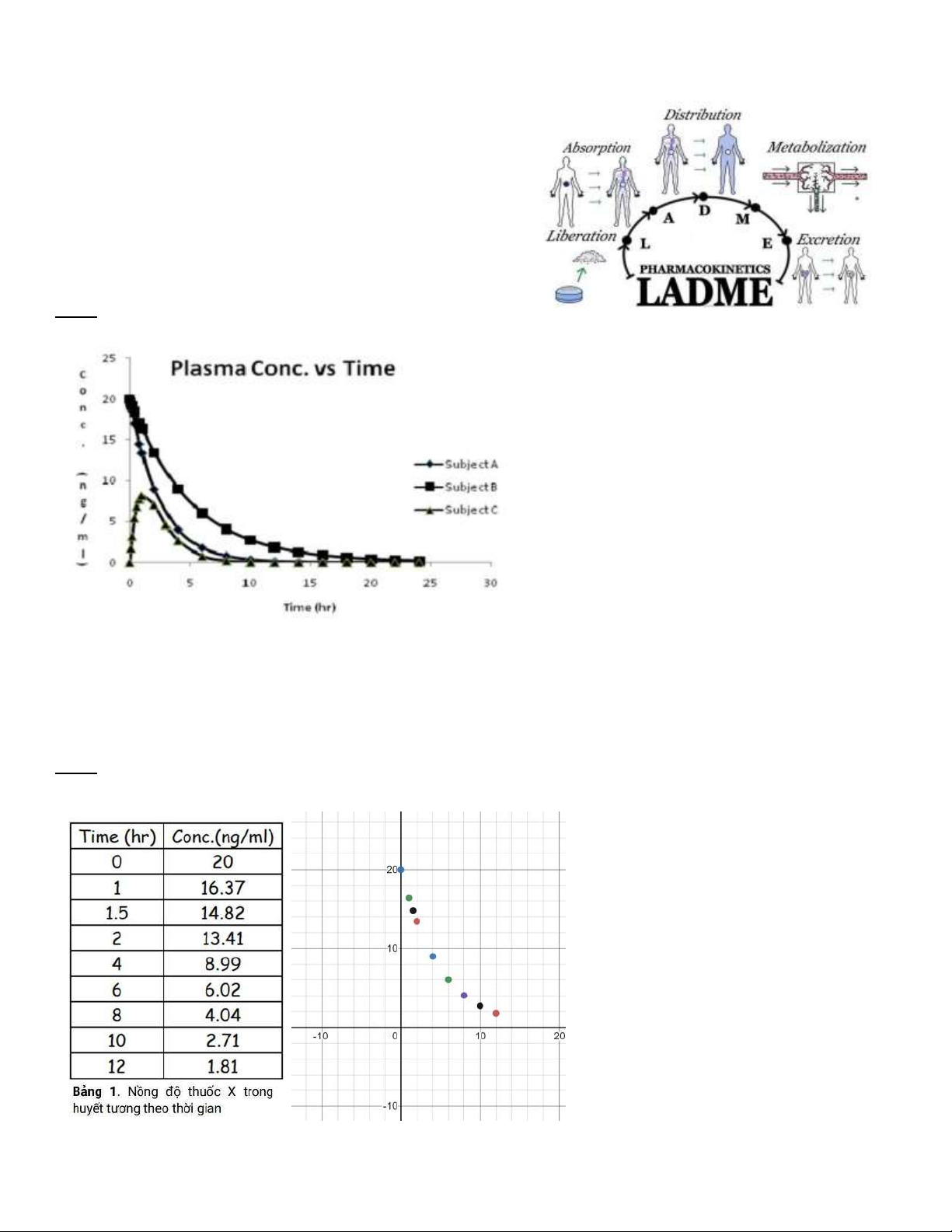
Câu 2: Chúng ta có thể chia 3 người A, B, C thành 2 nhóm ối tượng.
+ Đối tượng 1: A và B có nồng ộ thuốc ngay tại thời t=0 là tối a và sau ó nồng ộ thuốc giảm dần. Như vậy ối tượng A và
B ã tiếp nhận thuốc một cách trực tiếp vào huyết tương ối tượng ược tiêm truyền thuốc. Chính nhờ vậy, nhóm ối tượng
1 có tốc ộ ào thải thuốc nhanh hơn hẳn nhóm ối tượng còn lại.
+ Đối tượng 2: C có nồng ộ thuốc ngay tại thời iểm ầu tiên là bằng 0 sau ó mới ược cơ thể hấp thu, phân bố và ào thải.
Như vậy ối tượng C có trải qua giai oạn giải phóng thuốc C ã sử dụng thuốc qua ường uống Đối tượng A Đối tượng B Đối tượng C
Nồng ộ thuốc trong huyết 20 ng/ml 20 ng/ml 8 ng/ml tương ạt ỉnh (C max)
Rất nhanh, trong vòng 1 Rất nhanh, trong vòng 1 Hơn 1 tiếng rưỡi Thời gian ạt ỉnh tiếng ầu tiên tiếng ầu tiên (T max)
Thời gian bán hủy (T ½) Sau 2 tiếng Gần 3 tiếng Gần 3 tiếng LADME: lOMoARcPSD| 38841209
L: liberation (giải phóng các thành phần hoạt ộng của thuốc dược
phẩm, tách ra tá dược mà nó ược trộn lẫn trong quá trình sản xuất)
A: absorption (làm cách nào thuốc ược ưa vào cơ thể?)
D: distribution (thuốc sau khi vào cơ thể sẽ ược phân bố ến âu?)
M: metabolism (làm cách nào cơ thể biến ổi cấu trúc hóa học của thuốc?)
E: excretion (làm cách nào cơ thể ào thải thuốc?)
Câu 3: Giữa 2 ối tượng A và B thì ối tượng nào ào thải thuốc nhanh hơn?
A chỉ cần khoảng 10 tiếng ể có thể ào thải hết thuốc, trong khi B phải mất gần 20 tiếng
Hệ số góc của ồ thị A có trị tuyệt ối lớn hơn hệ số góc của ồ thị B ( ồ thị A dốc hơn B)
Hầu hết các phần ồ thị A ều nằm dưới ồ thị B
Đối tượng A có tốc ộ ào thải thuốc nhanh hơn ối tượng B
Câu 4: Xác ịnh các iểm tọa ộ trên giấy kẻ ô li (nồng ộ theo thời gian) lOMoARcPSD| 38841209
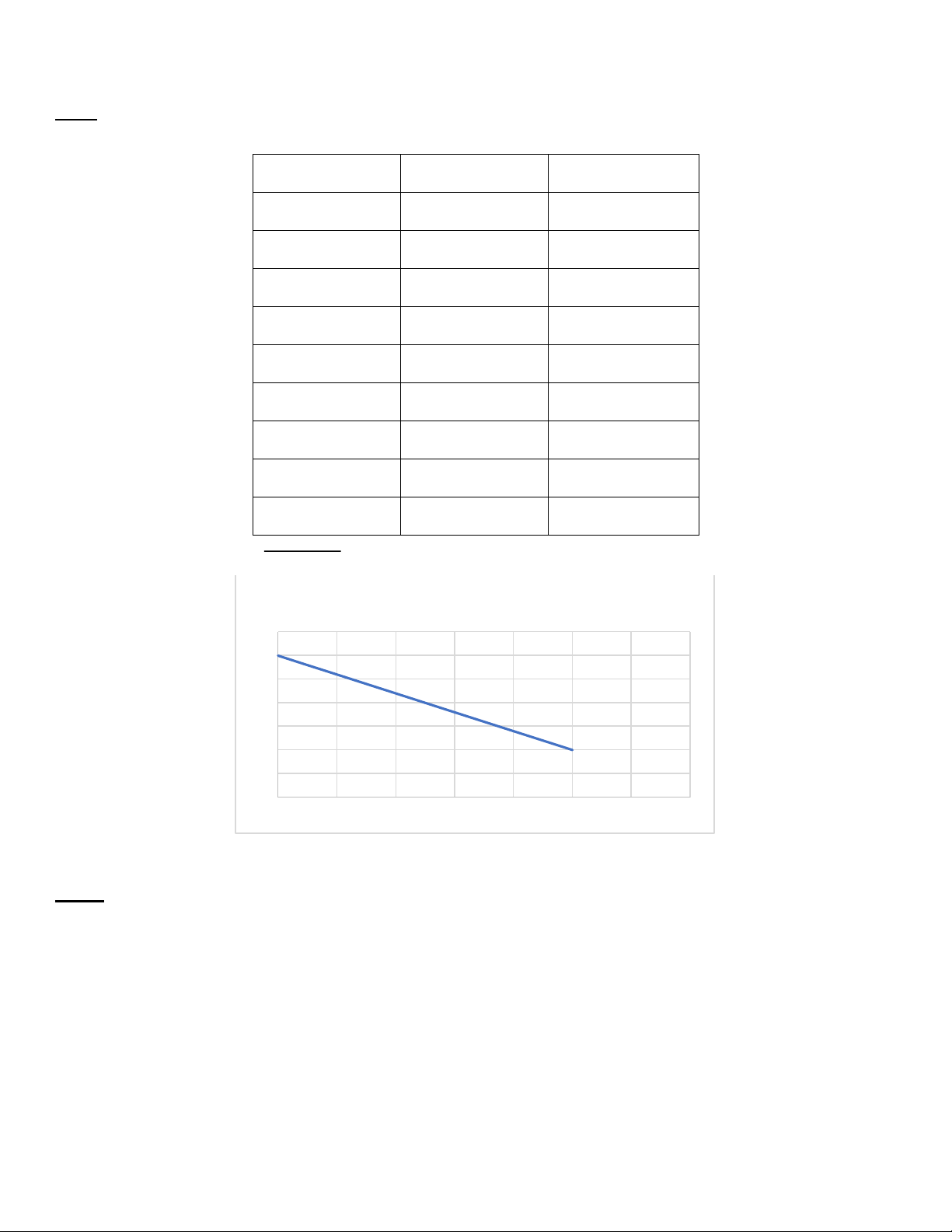
Câu 5: Xác ịnh quá trình ào thải của thuốc là bậc không hay bậc một? Thời gian [X] ln[X] 0 20 2.99 1 16.37 2.79 1.5 14.82 2.69 2 13.41 2.59 4 8.99 1.19 6 6.02 1.79 8 4.04 1.39 10 2.71 0.99 12 1.81 0.59
∆ln ( 𝑛ồ𝑛𝑔 độ )
D ựa vào bả ng s ố li ệ u, ta th ấ y
= 𝑐𝑜𝑛𝑠𝑡 (𝑘=0.2) nên sự ào thả i c ủ a thu ốc là bậ c m ộ t. ∆𝑡
Đồ thị hàm số của ln[X] và t t 3 5 , 3 2, 5 2 1 5 , 1 0 5 , 0 0 2 4 6 8 10 12 14
Câu 6: Tính hằng số ào thải thuốc (K) và thời gian bán thải thuốc (t1/2)
Hằng số ào thải thuốc:
𝐥𝐧([𝑨]𝒕) = 𝐥𝐧([𝑨]𝒐) − 𝒌𝒕
Lấy 𝑡 = 1, ln([𝐴]𝑡) = 2.79, ln([𝐴]𝑜) = 2.99 𝑘 = 0.2 (hoặc dựa vào ồ thị, có thể dễ dàng tính máy ược k = 0.2)
Thời gian bán thải thuốc: 𝑙𝑛2 lOMoARcPSD| 38841209 𝑡1/2 = = 3.46 (𝑔𝑖ờ) 𝑘
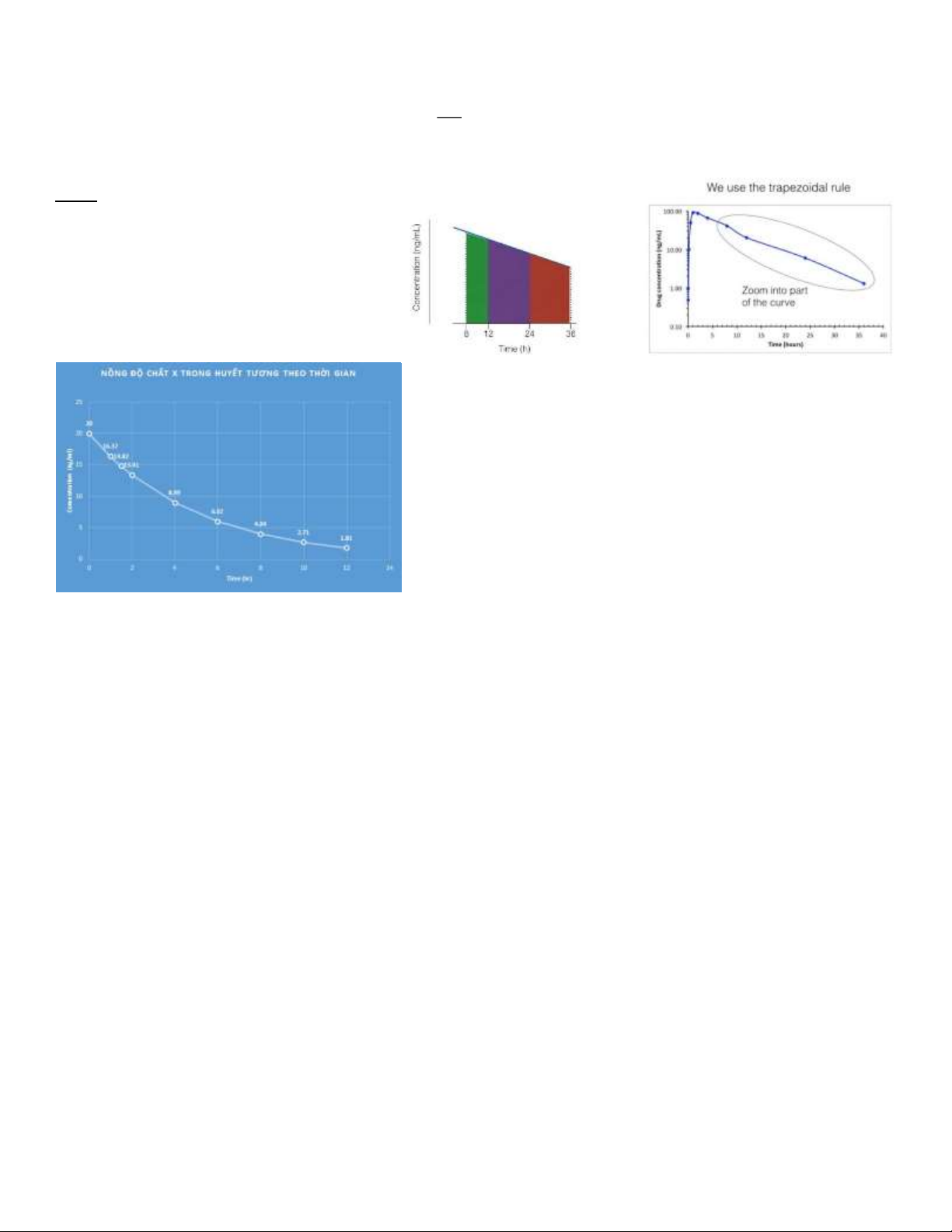
Câu 7: Tính AUC0-last ; AUClas-inf ; AUC0-
inf bằng quy tắc hình thang Quy tắc hình
thang: S = (A+B).(C-D)/2
Áp dụng quy tắc hình thang vào trong dữ liệu: lOMoAR cPSD| 38841209 Thời Nồng độ gian AUC (0-last)= Σarea= AUC 0 20 0 AUC (last-inf)= [X]12/k= 1 16.37 18.185 AUC (0-inf)= ΣAUC= 1.5 14.82 7.7975 2 13.41 7.0575 4 8.99 22.4 6 6.02 15.01 8 4.04 10.06 10 2.71 6.75 12 1.81 4.52 91.78 9.05 100.83 lOMoARcPSD| 38841209
Câu 8: Tính nồng ộ của thuốc lúc 5,0 giờ và 7,0 giờ. Cho nhận xét
Nồng ộ thuốc lúc 5 giờ: ln[A]5 = ln[A]0 – kt ln[A]5 = 2.99 – 5x0.2 = 1.99 [A]5 = 7.31 (ng/ml)
Nồng ộ thuốc lúc 7 giờ: ln[A]7 = ln[A]0 – kt ln[A]7 = 2.99 – 7x0.2 = 1.59 [A]7 = 4.9 (ng/ml)
Câu 9: Tính % của thuốc X còn lại lúc t bằng 5 lần t1/2; và t = 7 lần t1/2
Nồng ộ của thuốc lúc t = 5 x t1/2 : ln[A]17.3 = ln[A]0 – k x17.3 ln[A]17.3 = -0.47 [A]17.3 = 0.63 (ng/ml)
Nồng ộ của thuốc lúc t = 7 x t1/2 : ln[A]24.22 = ln[A]0 – k x24.22 ln[A]24.22 = -1.85 [A]17.3 = 0.16 (ng/ml)
Trong thực hành iều trị, người ta sử dụng thời gian t1/2 ể dự oán nồng ộ của thuốc còn trong máu. Thời gian 5.t1/2 và
7.t1/2 ể xác ịnh khoảng cách các liều cũng như ộ ào thải thuốc ra khỏi cơ thể.
Câu 10: Cho nhận xét về mối quan hệ giữa [A]0 và t1/2 của các loại phản ứng bậc 0, bậc một, bậc 2.
Phản ứng bậc 0: 𝑡1/2 =
[2𝐴.𝑘]0 Đối với từng chu kì, thời gian ể thuốc còn lại ½ so với chu kì trước càng ngày càng giảm
Phản ứng bậc 1: 𝑡1/2 =
𝑙𝑛2𝑘 Đối với từng chu kì, thời gian ể thuốc còn lại ½ so với chu kì trước là giống nhau
Phản ứng bậc 2: 𝑡1/2 = [
𝐴]10.𝑘 Đối với từng chu kì, thời gian ể thuốc còn lại ½ so với chu kì trước càng ngày càng tăng PHẦN ĐÚNG SAI
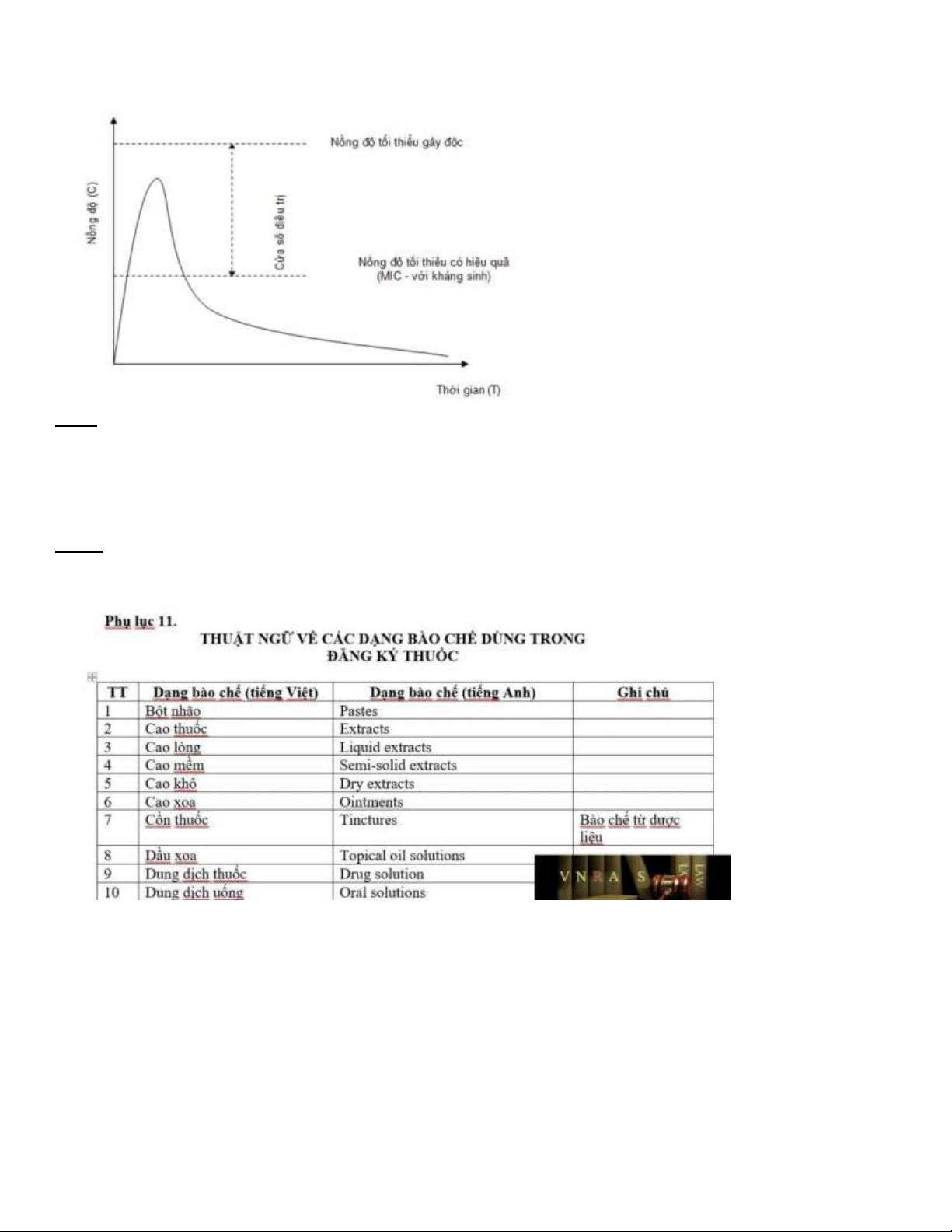
Câu 1: Theo dõi iều trị ở từng bệnh nhân khác nhau ối với những thuốc có chỉ số iều trị hẹp là hết sức quan trọng ĐÚNG
Cửa sổ iều trị là khoảng cách giữa hai ường thẳng song song ược vẽ biểu thị cho ngưỡng iều trị (nồng ộ tối thiểu có tác
dụng, với kháng sinh nó tương ứng với nồng ộ ức chế tối thiểu (MIC) và nồng ộ tối thiểu gây ộc (nồng ộ thuốc tối a mà cơ
thể có thể dung nạp ược trước khi xuất hiện tác dụng phụ gây ộc của thuốc).
Từ nồng ộ thuốc trong huyết tương Cp/ thời gian dưới ường cong và cửa sổ iều trị, chúng ta có thể suy ra các thông số
khác, ví dụ như thời iểm bắt ầu có tác dụng, thời gian ạt ược tác dụng tối a và thời gian kéo dài tác dụng của thuốc.
Đối với những thuốc có chỉ số iều trị hẹp, chúng ta cần phải tính toán ưa thuốc sao cho nồng ộ thuốc trong huyết tương
nằm trong khoảng cửa sổ iều trị. Có nghĩa rằng chúng ta dùng thuốc với liều có thể ạt ược nồng ộ có hiệu quả iều trị
nhưng phải tránh gây ra các tác dụng không mong muốn và ộc tính. lOMoARcPSD| 38841209
Câu 2: Khi liều lượng thuốc trong cơ thể thay ổi, nếu sự thay ổi có mối liên hệ với phương trình ộng học dX/dt
=k.X0 với X là hàm lượng thuốc tại thời iểm t, thì ta nói quá trình ào thải là bậc 0 ĐÚNG dX/dt là ạo hàm của V
X0 là một hằng số không ổi (=1)
V = k phản ứng bậc không ối với thuốc quá trình ào thải thuốc là quá trình bậc 0
Câu 3: Thông tin (dữ liệu) về nồng ộ trong huyết tương theo thời gian của một loại thuốc cụ thể thì nó phụ thuộc
vào dạng bào chế. ĐÚNG
Các dạng bào chế thuốc khác nhau sẽ ảnh hưởng ến khả năng giải phóng dược chất (L), khả năng hấp thụ của cơ thể (A).
Chính những yếu tố này sẽ gây ảnh hưởng ến sự ào thải thuốc trong cơ thể và từ ó làm cho nồng ộ thuốc trong huyết
tương giữa những thuốc có dạng bào chế khác nhau có thể thay ổi.
Tuy nhiên, cần lưu ý rằng không chỉ dạng bào chế thuốc là yếu tố duy nhất gây ảnh hưởng ến nồng ộ thuốc trong huyết
tương. Những chỉ số khác như: cơ ịa mỗi người, khả năng trao ổi chất,… cũng sẽ gây ảnh hưởng ến dữ liệu chung. lOMoARcPSD| 38841209
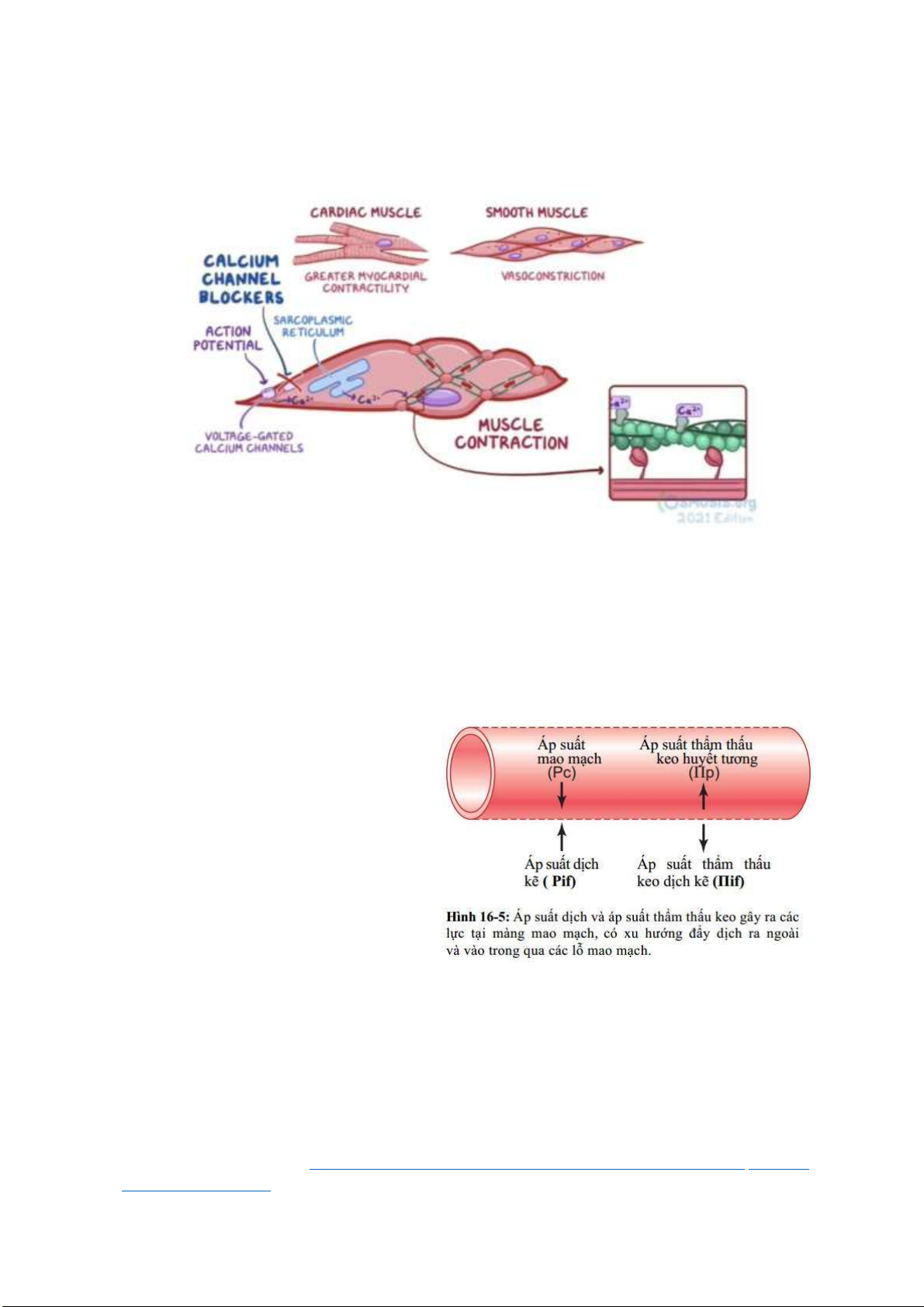
CHƯƠNG 5. BÀI 1 - DUNG DỊCH LÝ DO
Mục ích của buổi học nhóm này là giúp SV hiểu rõ về dung dịch, áp suất thẩm thấu, sự chênh lệch áp suất thẩm thấu và
vai trò của hệ thống ệm trong iều hòa pH máu thông qua một trường hợp trạng thái tăng ường huyết tăng áp suất thẩm thấu (HHS).
MỤC TIÊU HỌC TẬP
Sau khi học xong sinh viên có thể áp dụng những kiến thức về dung dịch, áp suất thẩm thấu, sự chênh lệch áp suất thẩm
thấu và vai trò của hệ thống ệm trong iều hòa pH máu ể:
Vận dụng ịnh luật Van’t Hoff ể tính áp suất thẩm thấu của huyết tương và một số dung dịch ược sử dụng trong y khoa. Áp
dụng sự chênh lệch áp suất thẩm thấu và áp suất thủy tĩnh giữa huyết tương và dịch kẽ ể giải thích một số hiện tượng bình
thường trong cơ thể và cơ chế bệnh sinh của một số bệnh lý.
Phân tích vai trò của hệ thống ệm trong iều hòa pH máu. HƯỚNG DẪN
Sinh viên phải học những tài liệu hướng dẫn dưới ây trước khi vào buổi học nhóm:
Nội dung bài giảng phần “Dung dịch” trên elearning.
Chương 5: Dung dịch – Điện hóa từ trang 110 – 150 trong sách Hóa học ại cương và hữu cơ, chủ biên: PGS.TS.DS. Đặng Văn Hoài.
Sinh viên hãy ọc tài liệu và tìm hiểu : Đái tháo ường là bệnh gì ? Đái tháo ường tuýp 2 là bệnh gì ? Trạng thái tăng ường
huyết tăng áp suất thẩm thấu là gì ?
Đái tháo ường là một tình trạng rối loạn chuyển hóa do nhiều nguyên nhân gây ra, với biểu hiện là tình trạng tăng glucose
máu mạn tính i kèm với các rối loạn chuyển hóa carbohydrate, mỡ, protein do hậu quả của khiếm khuyết tiết insulin,
khiếm khuyết hoạt ộng insulin hoặc cả hai.
Thông tin dành cho nhân viên y tế : Trạng thái tăng ường huyết tăng áp suất thẩm thấu
Tăng áp lực thẩm thấu do tăng ường huyết (HHS) - Rối loạn nội tiết và chuyển hóa - Cẩm nang MSD - Phiên bản dành
cho chuyên gia (msdmanuals.com) CA LÂM SÀNG
HÔN MÊ DO TÌNH TRẠNG TĂNG ĐƯỜNG HUYẾT, TĂNG ÁP SUẤT THẨM THẤU
Ông K. 52 tuổi, nhà ở Q.8 TP.HCM
Lý do nhập viện: lơ mơ Bệnh sử : Bệnh nhân cảm thấy ột ngột yếu i nhanh chóng trong vòng một tháng qua. Ông cảm
thấy rất yếu, ôi khi như sắp ngất i. Ông cảm thấy khát nước và uống nước nhiều. Lượng nước tiểu cũng tăng theo, không
au khi i tiểu và không có tiền căn nhiễm trùng tiểu. Ông không au ngực, không rối loạn thị giác, buồn nôn, tiêu chảy hay ngất.
Người nhà ưa ông tới phòng cấp cứu lOMoAR cPSD| 38841209
Tiền căn: Sỏi thận, tăng huyết áp, phì ại tiền liệt tuyến
Thuốc ang sử dụng: Lisinopril (thuốc hạ huyết áp), Alfuzosin (thuốc iều trị phì ại tiền liệt tuyến)
Xã hội: Không thuốc lá, không uống rượu
Khám: Hỏi không trả lời. Da khô, và kém àn hồi. Niêm mạc miệng khô.
Giá trị của người bệnh Khoảng bình thường Huyết áp Tâm thu: 71mmHg Tâm thu: 90-120 mmHg Tâm trương: 36mmHg Tâm trương: <80 mmHg Tần số tim 115 60-100 Tần số hô hấp 22 12-26 Thân nhiệt 36,9 36,1 – 37,2 oC
Khám các cơ quan không phát hiện bất thường.
Giá trị của người bệnh
Khoảng bình thường Na+ 107 135-145 mEq/L K+ 5,8 3,5-5 mEq/L Cl- 68 96-108 mEq/L 32 7-18 mg/dL BUN
(Ure máu, ánh giá chức năng thận) 3,2 0,8-1,2 mg/dL Creatinine (chức năng thận) Glucose >2100 65-110 mg/dL lOMoARcPSD| 38841209 12,4 4,4-6,4% HbA1C
(sẽ tăng cao trong bệnh nhân ái tháo ường) Ketone Âm tính Âm tính
Bạch cầu (tăng cao, gợi 礃Ā nhi m tr甃ng) 15 4,0-10,0 K/mm3 Hồng cầu 6 4,50-5,90 K/mm3
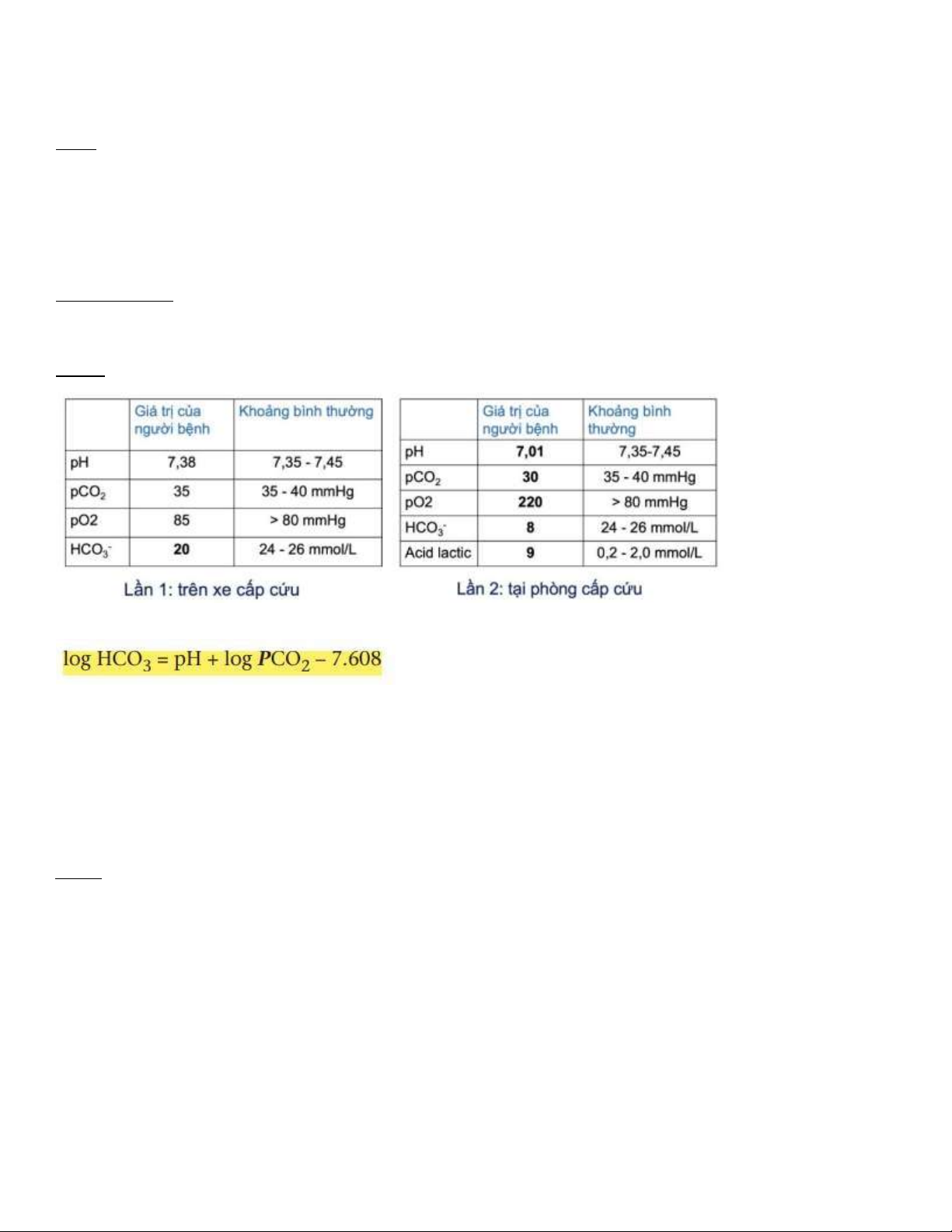
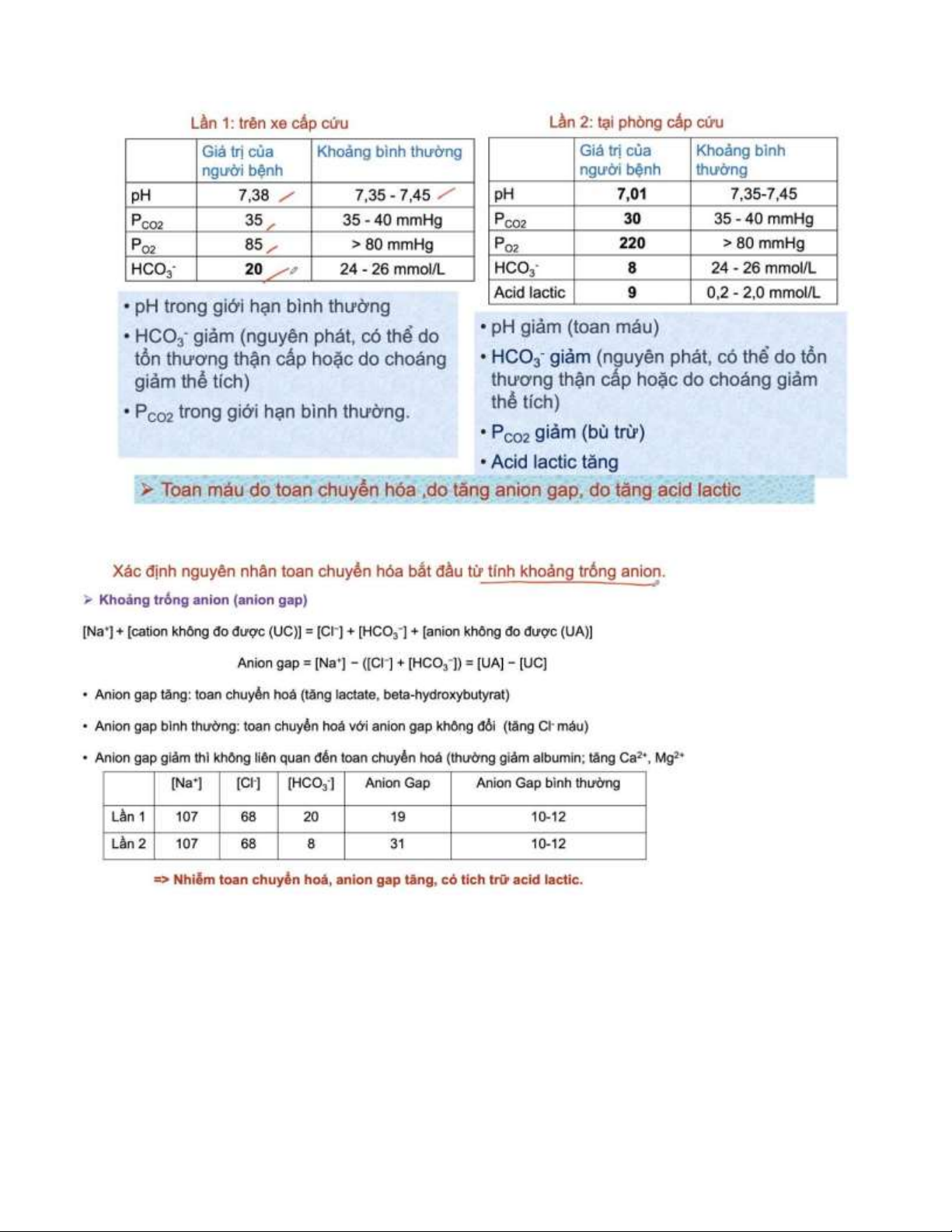
Khí máu ộng mạch trên xe cấp cứu (lần 1)
Giá trị của người bệnh Khoảng bình thường pH 7,38 7,35-7,45 pCO2 35 35-40 mmHg pO2 85 >80mmHg HCO - 3 20 24-26 mEq/L
Khí máu ộng mạch tại phòng cấp cứu (lần 2)
Giá trị của người bệnh Khoảng bình thường pH 7,01 7,35-7,45 pCO2 30 35-40 mmHg pO2 220 >80mmHg HCO - 3 8 24-26 mEq/L Acid lactic 9 0,2-2,0 mmol/L Câu hỏi
1) Bác sĩ chẩn oán: Hôn mê do tình trạng tăng ường huyết tăng áp suất thẩm thấu. Hãy ước tính nồng ộ thẩm thấu huyết thanh của người bệnh?
2) Hãy giải thích hiện tượng tiểu nhiều và hôn mê? lOMoARcPSD| 38841209
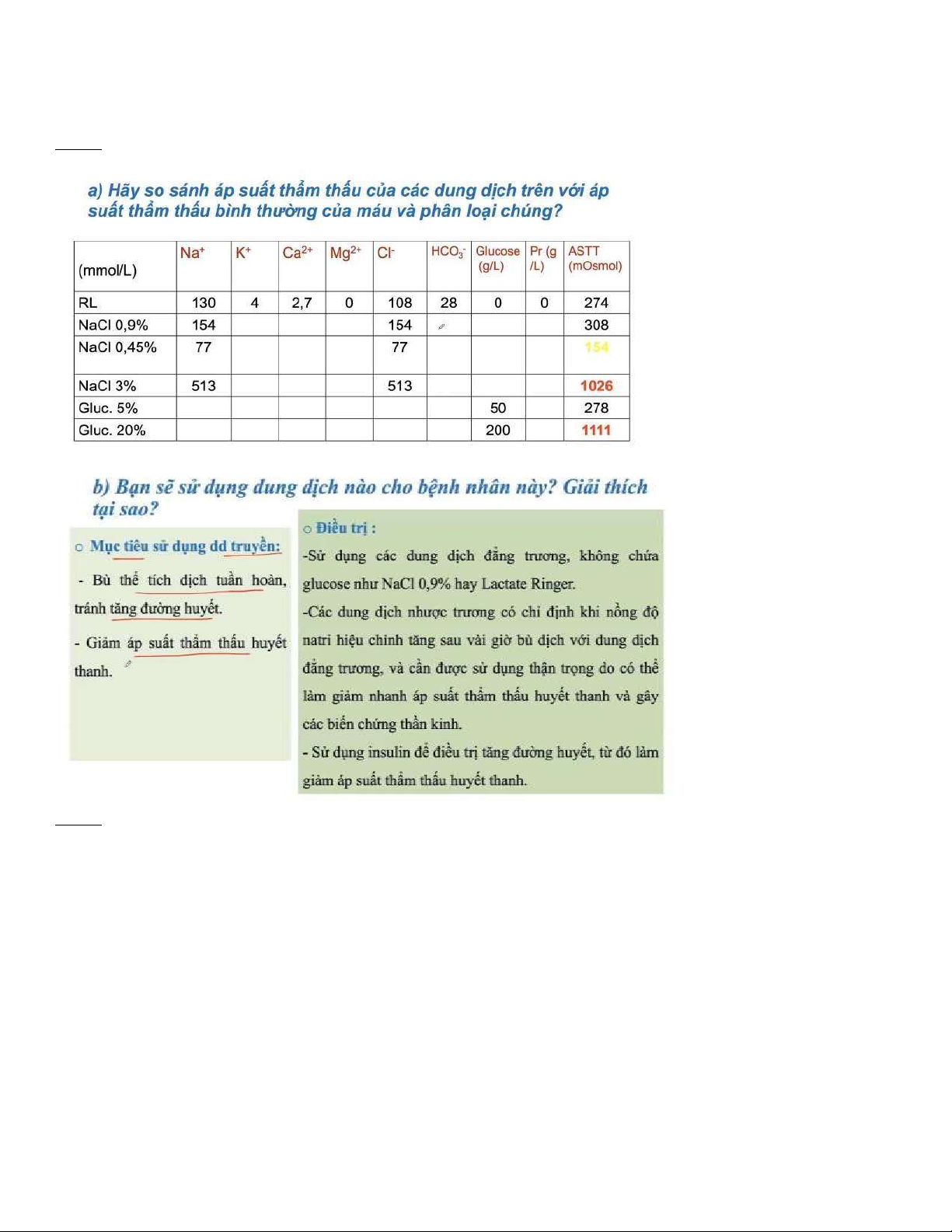
3) Bệnh nhân cần truyền dịch. Khoa cấp cứu có các dung dịch sau: NaCl 0.9% (Normal saline), NaCl 0.45% (Half
saline), NaCl 3%, Lactate ringer (Na+ 130 mmol/L, Cl- 108 mmol/L, K+ 4 mmol/L, Ca2+ 2,7 mmol/L, Lactat 28
mmol/L), Glucose 5%, Glucose 20%
4) Hãy so sánh áp suất thẩm thẩu của các dung dịch trên với áp suất thẩm thấu bình thường của máu và phân loại chúng?
5) Bạn sẽ sử dụng dung dịch nào cho bệnh nhân này? Giải thích tại sao ?.
6) Hãy giải thích sự thay ổi giữa kết quả khí máu ộng mạch lần 2 và lần 1?.
TĂNG ĐƯỜNG HUYẾT
Câu 1: Bác sĩ chẩn oán: Hôn mê do tình trạng tăng ường huyết tăng áp suất thẩm thấu. Hãy ước tính nồng ộ thẩm thấu huyết thanh của người bệnh?
Công thức tính nồng ộ thẩm thấu huyết thanh (mOsm/kg)
(natri huyết thanh ược tính bằng mEq/L, và glucose và BUN ược tính bằng mg/dL)
Nồng ộ thẩm thấu huyết thanh của người bệnh >2 x 107 + + = 342,1 (mOsm/kg)
Đây là nồng ộ cao so với người bình thường chỉ vào khoảng 285-295 mOsm/kg vì thế bệnh nhân ược chẩn
oán là tăng áp suất thẩm thấu.
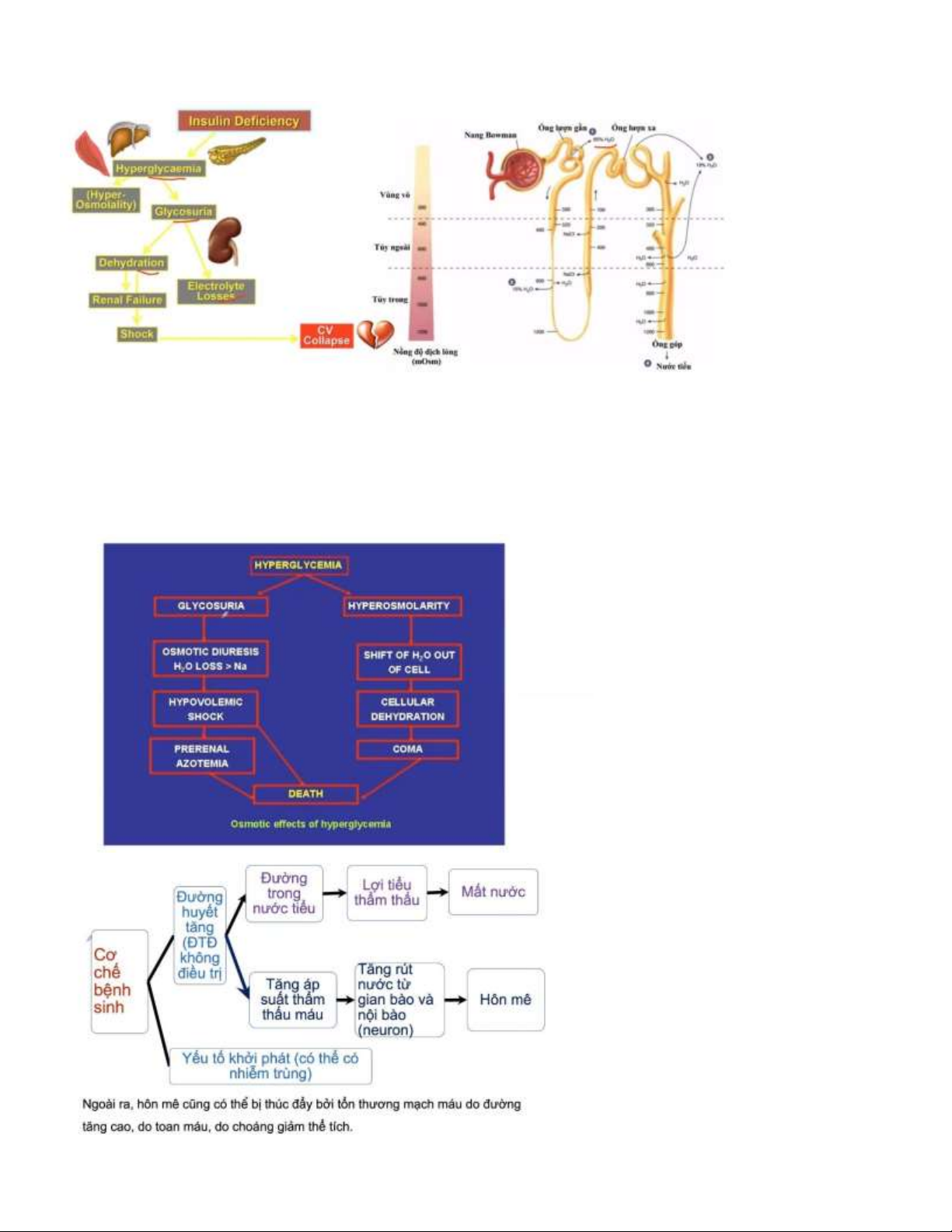
Câu 2: Hãy giải thích hiện tượng tiểu nhiều và hôn mê? •
Giải thích hiện tượng tiểu nhiều: -
Đái tháo ường (hay tiểu ường) là bệnh mạn tính khiến cơ thể gặp rắc rối trong việc sản sinh hoặc sử dụng
hormone insulin. Đây là hormone ược cơ thể dùng ể ưa ường từ máu vào tế bào, nơi chúng ược chuyển hóa thành năng lượng. -
Tuy nhiên, do không có ủ hoặc không sử dụng ược insulin, nồng ộ ường trong máu sẽ tăng lên, thường xuyên ở
mức cao. Điều này có thể gây ra nhiều áp lực cho thận, buộc cơ quan này phải hoạt ộng vất vả hơn ể loại bỏ bớt ường dư
thừa trong máu qua nước tiểu. Khi chức năng thận bị suy yếu, khả năng tái hấp thu nước tiểu cũng sẽ giảm i, khiến nước
tiểu tăng lên dẫn ến tình trạng i tiểu nhiều. -
Quá trình này không chỉ ào thải ường huyết mà còn khiến người bệnh ái tháo ường thường xuyên bị mất nước,
thiếu nước. Người bệnh ái tháo ường sẽ hay thấy khát và phải uống nước thường xuyên ể bù lại lượng nước ã mất.
Điều này vô tình tạo thành một vòng lặp, khiến họ có nhu cầu i tiểu thường xuyên hơn, ặc biệt là về êm. •
Giải thích hiện tượng lơ mơ:
- Khi tình trạng mất nước xảy ra trầm trọng, áp lực thẩm thấy của máu sẽ tang lên. Khi APTT tăng > 320 mOsm/kg, nước
từ khoảng kẽ và trong tế bào trong ó có các tế bào thần kinh trung ương bị kéo vào trong lòng mạch làm chức năng não
suy giảm gây ra tình trạng hôn mê và lơ mơ ở bệnh nhân. Câu 3:
1) Dung dịch NaCl 0.9%: 100ml dung dịch có 0.9 gam NaCl
100 ml dung dịch có mol NaCl CM = (mol/ l) lOMoARcPSD| 38841209
Áp dụng ịnh luật Van’t Hoff: = 2 x x 0.082 x (273 + 37) = 7.82 (atm)
2) Dung dịch NaCl 0.45%: 100ml dung dịch có 0.45 gam NaCl 100 ml dung dịch có mol NaCl CM = (mol/ l)
Áp dụng ịnh luật Van’t Hoff: = 2 x x 0.082 x (273 + 37) = 3.91 (atm)
3) Dung dịch NaCl 3%: 100ml dung dịch có 3 gam NaCl
100 ml dung dịch có mol NaCl CM = (mol/ l)
Áp dụng ịnh luật Van’t Hoff: = 2 x x 0.082 x (273 + 37) = 26.1 (atm)
4) Lactate ringer (Na+ 130 mmol/L, Cl- 108 mmol/L, K+ 4 mmol/L, Ca2+ 2,7 mmol/L, Lactat 28 mmol/L)
Áp dụng ịnh luật Van’t Hoff: = ( x 1 + x 1 + x 1 + x 1 +
x 1) x 0.082 x (273 + 37) = 6.93 (atm)
5) Dung dịch Glucoso 5%: 100ml dung dịch có 5 gam glucoso 100 ml dung dịch có mol glucoso CM = (mol/ l)
Áp dụng ịnh luật Van’t Hoff: = 1 x x 0.082 x (273 + 37) = 7.06 (atm)
6) Dung dịch Glucoso 20%: 100ml dung dịch có 20 gam glucoso
100 ml dung dịch có mol glucoso CM = (mol/ l)
Áp dụng ịnh luật Van’t Hoff: = 1 x x 0.082 x (273 + 37) = 28.24 (atm)
ÁP SUẤT THẨM THẤU BÌNH THƯỜNG TRONG MÁU 7.65 atm ở 37oC NaCl NaCl NaCl Lactate Glucoso Glucoso 0.9% 0.45% 3% Ringer 5% 20% Ưu trương x X Đẳng trương x x x Nhược trương x lOMoARcPSD| 38841209
b) Nếu là em, em sẽ truyền cho bệnh nhân các dung dịch NaCl 0.9% ( ẳng trương) hoặc Lactate ringer Lý do:
- Không dung dung dịch ưu trương vì sẽ làm tăng nồng ộ áp suất thẩm thấu
- Không chọn dung dịch nhược trương ngay từ ầu vì lúc ầu, cơ thể cần phải thích ứng bằng cách giảm áp suất thẩm
thấu từ từ. Dung dịch nhược trương có thể làm cho bệnh nhân bị sốc áp suất thẩm thấu và gây các biến chứng thần
kinh - Không ưa dung dịch Glucoso vì lượng ường trong máu của bệnh nhân ang tăng cao
Phương án ưa ra: Điều trị bằng truyền muối 0,9% ( ẳng trương) với tốc ộ từ 15 ến 20 ml/kg/h, trong vài giờ ầu tiên. Sau ó,
natri hiệu chỉnh phải ược tính toán. Nếu natri hiệu chỉnh < 135 mEq/L, thì tiếp tục truyền muối ẳng trương với tốc ộ từ
250 ến 500 mL/h. Nếu natri hiệu chỉnh bình thường hoặc tăng thì nên truyền dung dịch muối 0,45% (nhược trương). Câu 4: a)
Tính [HCO3-] từ pH và pCO2
(source: harvardapparatus.com/media/harvard/pdf/OT20.pdf)
Khí máu ộng mạch lần 1: log [HCO3-] = 7.38 + log(35) – 7.608 [HCO3-] = 20.7
Khí máu ộng mạch lần 1: log [HCO3-] = 7.01 + log(30) – 7.608 [HCO3-] = 7.57 b)
Hãy so sánh giữa kết quả khí máu ộng mạch lần 2 và lần 1? c)
SLIDE CỦA CÔ TRONG BUỔI HỌC LÂM SÀNG Câu 2: lOMoARcPSD| 38841209 -
Khi nồng ộ ường trong máu bình thường, dịch kẽ có thể kéo dịch từ trong ống thận nước ược tái hấp thu. Tuy
nhiên, khi nồng ộ ường trong máu tăng lên, áp suất dịch kẽ không ủ lực ể hấp thu nước từ ống thận tăng lượng nước tiểu. -
Đường trong máu tăng cao tăng áp lực thẩm thấu trong gian bào và cả trong tế bào trong ó có các tế bào thần
kinh cũng bị mất nước lơ mơ, hôn mê. lOMoARcPSD| 38841209 Câu 3: Câu 4: lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 CHƯƠNG 5.
BÀI 2 – ĐIỆN HOÁ LÝ DO
Mục ích của buổi học nhóm này là giúp SV hiểu rõ về iện thế
màng, iện thế nghỉ, iện thế hoạt ộng, cách tính iện thế màng.
MỤC TIÊU HỌC TẬP
Sau khi học xong sinh viên có thể áp dụng những kiến thức về iện
thế màng, iện thế nghỉ, iện thế hoạt ộng ể:
CHƯƠNG 1: Tính ược iện thế màng nghỉ của tế bào cơ tim.
CHƯƠNG 2: Phân tích ảnh hưởng của nồng ộ ion K+ và Ca2+ ến hoạt ộng iện của tế bào cơ tim. HƯỚNG DẪN
Sinh viên phải học những tài liệu hướng dẫn dưới ây trước khi vào buổi học nhóm:
1. Nội dung bài giảng phần “Điện hoá” trên elearning.
2. Chương 5: Dung dịch – Điện hóa từ trang 154 – 165 trong sách Hóa học ại cương và hữu cơ, chủ biên:
PGS.TS.DS. Đặng Văn Hoài. lOMoARcPSD| 38841209
Sinh viên hãy ọc tài liệu và tìm hiểu thêm: Điện thế hoạt ộng của tế bào cơ tim ? Tăng kali máu ?
Thông tin dành cho nhân viên y tế :
Điện thế hoạt ộng của tế bào cơ tim
Tăng kali máu – Rối loạn nội tiết và tiêu hoá – MSDmanuals
CA LÂM SÀNG: TĂNG KALI MÁU •
Ông Tuấn, 68 tuổi, nam giới. •
Tiền căn: ái tháo ường, tăng huyết áp, bệnh mạch vành và bệnh thận mạn ến Khoa Cấp cứu (ED). •
Suy nhược toàn thân, mệt mỏi và choáng váng sau khi bị bệnh kéo dài một tuần. Ăn kém. •
Bệnh nhân nói rằng thực hiện chụp CT tại một bệnh viện khác và ược thông báo rằng kết quả bình thường.
Điện tâm ồ tại cấp cứu
Bác sĩ nghi ngờ có tình trạng tăng Kali máu • Nồng ộ ion trong máu • Na+ : 140 mmol/L lOMoARcPSD| 38841209 • K+ : 7 mmol/L (BT: 4mmol/L) • Cl- : 110 mmol/L • Chức năng thận giảm • K+ (lần 2): 8.0 mmol/L Câu hỏi
Câu 1: Điện thế màng lúc nghỉ tại tế bào cơ tim của bệnh nhân thay ổi như thế nào?
Câu 2: Có thể tính ược chính xác iện thế màng của tế bào cơ tim của người bệnh này không? Câu 3:
a. Thay ổi nồng ộ kali máu lại làm thay ổi hoạt ộng iện của cơ tim như thế nào?
b. Tại sao lại có sự thay ổi về hoạt ộng iện tế bào cơ tim như vậy?
c. Diễn tiến nếu không iều trị?
Câu 4: BS xử trí cấp cứu bằng Canxi gluconate tĩnh mạch. Giải thích cơ chế tác ộng?
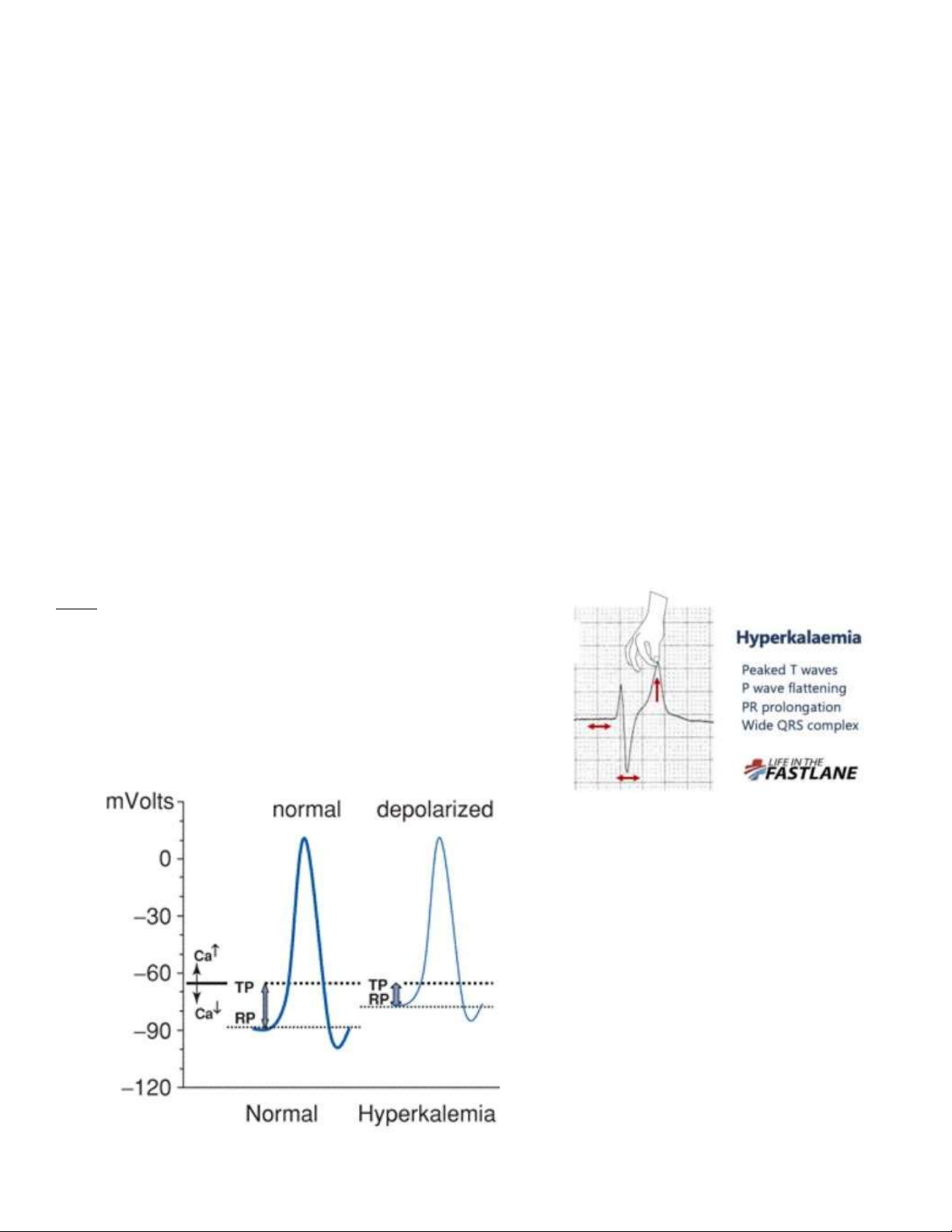
Câu 1: Điện thế màng lúc nghỉ tại tế bào cơ tim của bệnh nhân thay ổi như thế nào?
• Các tế bào thần kinh, dẫn truyền tim và cơ ặc biệt nhạy cảm với những
thay ổi của iện thế xuyên tế bào và do ó bị ảnh hưởng nhiều nhất
bởi tăng kali máu. Hình bên dưới cho thấy tình trạng tăng kali
máu có thể gây ra yếu cơ như thế nào. lOMoARcPSD| 38841209
• Sự khử cực và tăng phân cực tế bào phụ thuộc vào kali ngoại bào. Điện thế hoạt ộng ược tạo ra khi tế bào khử cực
từ iện thế nghỉ (RP) ến iện thế ngưỡng (TP). Tăng kali máu di chuyển RP ến gần TP và dẫn ến liệt cơ khử cực.
Canxi làm tăng TP, cải thiện tác ộng của tăng kali máu.
• Tăng kali máu làm giảm iện thế nghỉ tức là tế bào trở nên kém âm hơn. Sau khi khử cực, tế bào không thể tái phân
cực ầy ủ và trở nên ít bị kích ộng. Tăng kali máu nặng gây ra khối khử phân cực và liệt mềm. Các biểu hiện lâm
sàng bao gồm mệt mỏi, au cơ và yếu cơ ( ặc biệt là chi dưới), giảm khả năng vận ộng, dị cảm, chuột rút cơ, thay ổi
iện tâm ồ (ECG) và rối loạn nhịp tim. Yếu cơ có thể tiến triển ến liệt dần dần, giảm thông khí và suy hô hấp.
Câu 2: Có thể tính ược chính xác iện thế màng của tế bào cơ tim của người bệnh này không? Câu 3:
a. Thay ổi nồng ộ kali máu lại làm thay ổi hoạt ộng iện của cơ tim như thế nào?
- Sóng T cao nhọn, QRS dãn rộng
- Để có sự xung ộng trong cơ tim thì phải có iện thế màng tế bào.
- Điện thế ược hình thành do có sự chênh lệch gradient nồng ộ của 1 số chất và ion giữa dịch nội bào và dịch ngoại
bào. Sự chênh lệch này tạo thành 1 hiệu iện thế giữa trong và ngoài màng tế bào, bên trong âm tính hơn bên
ngoài và o ược trong khoảng -70mV ến -90mV.
- Do ó, thay ổi nồng ộ Kali trong máu sẽ ảnh hưởng ến iện thế nghỉ của màng tế bào cơ tim, làm thay ổi khả năng
co bóp của cơ tim và dẫn ễn thay ổi nhịp tim, trong ó nếu [K+] tăng thì nhịp tim sẽ tăng. lOMoARcPSD| 38841209
b. Tại sao lại có sự thay ổi về hoạt ộng iện tế bào cơ tim như vậy?
- Điện thế hoạt ộng của tế bào cơ tim sẽ có 3 giai oạn là giai
oạn nghỉ, giai oạn khử cực và giai oạn tái cực.
- Giai oạn nghỉ: là iện thế màng trước khi iện thế hoạt ộng
xuất hiện, giá trị o ược là khoảng -90mV như trên. - Giai
oạn khử cực: khi có tác nhân kích thích làm khử cực màng
ến trong khoảng -50mV ến -70mV, tính thấm của
Na+ cao hơn K+, khi ó kênh Na+ mở ra và có dòng ion Na+ i
vào làm iện thế trong màng tiến tới 0mV và dương tính +20mV so với bên ngoài
- Giai oạn tái cực: kênh Na+ óng và kênh K+ mở, Kali
khuếch tán ra ngoài tế bào theo chiều gradient nồng ộ, ưa
iện thế màng trở về trạng thái ban ầu.
- Nếu tăng nồng ộ K+ trong huyết thanh cân bằng Nernst
thay ổi do tỉ số log (Ki/Ko) cân bằng Nernst của Kali sẽ
dương hơn (khoảng -70mV ến -80mV) khử cực giai oạn
mở trở nên dễ dàng hơn khởi phát iện thế trở nên dễ dàng
làm tăng khả năng co bóp của tế bào cơ tim
c. Di n tiến nếu không iều trị? Nếu không iều trị
thì tăng kali máu sẽ gây ra rối loạn nhịp tim và có thể dẫn
ến hiện tượng ngừng tim gây tử vong:
• Giai oạn tái cực lượng K+ ra ngoài tế bào giảm kích thích tế bào ến gần ngưỡng.
• Điện thế màng tế bào tiếp tục tăng cho ến khi iện thế màng luôn dương không thể xảy ra hiện tượng tái cực
iện thế màng ở trạng thái bất hoạt không vận chuyển Na+, K+ nữa tế bào cơ tim ngừng co bóp ngừng tim.
Câu 4: BS xử trí cấp cứu bằng Canxi gluconate tĩnh mạch. Giải thích cơ chế tác ộng?
- Đối với bất kì bệnh nhân bị tăng kali máu, bước ầu tiên là phải xử trí cấp cứu Canxi gluconate ể ổn ịnh tế bào cơ
tim. Sau ó, chúng ta cần sử dụng các phương pháp ể thải kali ra máu (sử dụng thuốc ể thải kali qua ường nước
tiểu, ường phân, lọc máu,…)
- Canxi làm tăng iện thế ngưỡng (threshold), di chuyển nó ra xa iện thế nghỉ ổn ịnh màng tế bào lOMoARcPSD| 38841209
Tăng canxi kích thích mở kênh Natri, giúp Natri di chuyển vào tế bào nhanh hơn (trong khi tăng Kali máu thì ã hạn
chế sự di chuyển của Natri và làm rối loạn nhịp tim)
- Canxi gluconat ược sử dụng như một chất bảo vệ tim mạch ở những người có nồng ộ kali trong máu cao, với một
phương pháp thay thế là sử dụng canxi clorua. Nên dùng khi nồng ộ kali cao (> 6,5 mmol/ l) hoặc khi iện tâm ồ
(ECG) cho thấy những thay ổi do kali trong máu cao. Mặc dù nó không ảnh hưởng ến nồng ộ kali trong máu,
nhưng nó làm giảm sự hưng phấn của các tế bào cơ tim, do ó làm giảm khả năng rối loạn nhịp tim.
- Trong số các loại canxi ược dùng cho iều trị tăng kali máu, calcium gluconate là lựa chọn ầu tiên vì nó có thể ược
iều chỉnh một cách dễ dàng và ít nguy cơ nhiễm ộc hơn, ví dụ như trong trường hợp có thể sử dụng canxi clorua.
Calcium gluconate thường ược tiêm tĩnh mạch trong khoảng từ 2 ến 3 phút. Tác dụng của nó kéo dài trong 30 ến
60 phút, có thể cho bác sĩ một khoảng thời gian ể xác ịnh nguyên nhân gây tăng kali máu và ể iều trị thêm bằng
các biện pháp như chạy thận ể iều chỉnh lượng kali. lOMoARcPSD| 38841209 lOMoAR cPSD| 38841209
TĂNG KALI MÁU (TỰ TÌM HIỂU)
- Tổng lượng Kali trong cơ thể ược chia làm 2 phần: Kali nội bào (98%) và Kali ngoại bào (2%)
- Sự khác biệt về nồng ộ K+ trong và ngoài tế bào tạo thành một bậc thang iện hóa qua màng tế bào
Sự cân bằng Kali nội bào ược duy trì bởi bơm Natri-kali (cứ 2 ion Kali ược i vào sẽ có 3 ion Kali i
ra), có các kênh rò rỉ Kali và kênh chỉnh lưu nhập bào phân bố rải rác qua màng tế bào. Sự cân bằng
Kali ngoại bào: Kali nhập vào mỗi ngày từ 50-150 mmEq/l có thể thải Kali ược thải ra bằng ống
thận (nước tiểu), ống tiêu hóa, mồ hôi. - Tăng Kali máu:
+ Mất cân bằng ngoại bào: giảm bài xuất kali ở thận, tăng mức K+ trong máu
• Truyền nhanh, quá mức Kali vào máu (tĩnh mạch)
• Thận: lọc, tái hấp thu, bài tiết. Kali ược lọc tự do từ máu vào nước tiểu tại cầu thận. Sau ó 67% ược
tái hấp thu tại ống lượn gần, 20% ược tái hấp thu tại oạn dày nhánh lên quai Henle, vậy có khoảng
13% kali ược bài tiết. Aldosterone nếu không ủ trong cơ thể (suy giảm chức năng thận) làm giảm
khả năng bài tiết Kali khỏi cơ thế, Kali bị ứ lại làm tăng Kali máu.
+ Mất cân bằng nội bào: kali di chuyển ra khỏi tế bào ể i vào khoảng kẽ và máu
• NN1: Thiếu insulin. Sau khi ăn, nồng ộ glucoso tăng trong máu insulin ược giải phóng và gắn kết
vào tế bào ể giúp tế bào tăng sử dụng glucoso lấy năng lượng. Insulin cũng kích thích kênh bơm
Natri-kali, kéo kali vào tế bào. Nếu thiếu insulin, lượng Kali ở lại trong máu mà không ược bơm vào tế bào tăng Kali máu
• Toan hóa máu : khi nồng ộ H+ trong máu tăng. Cơ thể giảm nồng ộ H+ bằng cách ẩy H+ vào trong
tế bào bằng một kênh ion ặc biệt, trao ổi H+ với K+ qua màng tế bào giúp ích cho toan hóa máu
nhưng tăng Kali máu. (nhưng khi toan hô hấp thì K+ không ảnh hưởng vì CO2 có thể tan tự do
trong chất lỏng mà không cần trao ổi ion trong tế bào)
• Catechilamines: thụ thể Beta-2 Adrenergic và Alpha Adrenergic. Khi hoạt hóa, thụ thể Beta kích
thích bơm natri-kali kéo natri từ máu vào tế bào. Thụ thể Alpha gây nên sự thay ổi kali ra khỏi tế
bào, qua các kênh kali phụ thuộc canxi. các chất ối vận beta (chẹn beta) và ồng vận alpha làm
tăng lượng Kali ra khỏi tế bào và i vào máu
• Tăng áp suất thẩm thấu: kéo nước từ trong tế bào ra, làm tăng nồng ộ Kali, ẩy them nhiều Kali từ
trong tế bào ra mô kẽ và máu.
• Ly giải tế bào: Khi tế bào chết i, Kali ược ly giải giải phóng vào máu ồ ạt (ly giải cơ vân, bỏng nặng,
ly giải khối u trong quá trình hóa trị liệu)
• Tập thể dục: ATP tế bào ược tiêu thụ nhiều hơn. Sự suy giảm ATP thúc ẩy mở kênh Natri-kali mở
ra cho phép Kali từ trong ra ngoài tế bào ể làm giảm bậc thang iện hóa.
- Nồng ộ Kali bên trong và bên ngoài tế bào vô cùng quan trọng ể duy trì iện thế màng lúc nghỉ ể cuối
cùng cho phép tế bào khử cực và cơ cơ (cơ vân, cơ trơn, cơ tim). Nếu có nhiều Kali máu, iện thế
màng trở nên dương nhiều hơn, thậm chí có thể ủ ể ạt mức co cơ. Khởi ầu của tình trạng này có thể
là cơn au quặn ruột nhẹ. Nhưng khi màng iện thế lúc nghỉ tăng lên quá cao vượt quá ngưỡng iện thế
Khi cơ khử cực và co, nó sẽ không cho phép cơ tái cực ể cho phép một ợt co cơ khác xảy ra.
- Đối với cơ vân, có thể gây nên yếu cơ và liệt mềm bắt từ chi dưới và lan lên trên.
- Đối với cơ tim rối loạn nhịp, ngừng tim lOMoARcPSD| 38841209 CURCUMIN
"Ah! My favorite!” Leroy thốt lên khi vừa mở cửa nhà, một mùi thơm của súp ậu lăng thoang thoảng
thật tuyệt. Anh cởi chiesc áo khoác và chạy nhanh chóng ến bàn, nơi có một bát súp ang chờ anh.
Anh ấy háo hức nhấp một ngụm, và sau ó dừng lại khi anh nhận thấy một hương vị tinh tế nhưng bất
thường. "Món súp thế nào?" Mona hỏi. "Ngon! Nhưng có một gia vị gì ó khác ã cho vào súp. Từ màu
sắc có vẻ như bạn ã thêm safron vào súp, ” Leroy quan sát. “Không phải safron; Tôi ã thêm một ít bột
nghệ vào”. "Bạn ã nói nghệ?" Leroy hỏi với vẻ khó hiểu. “Vâng, tôi ã thêm một chút nghệ. Tôi ọc
rằng nó là tốt cho bạn. Trong thực tế, tôi ã thêm nhiều hơn một nhúm. tôi ọc thông tin Nghệ có chứa
một chất hóa học gọi là curcumin, ược cho là mang lại nhiều lợi ích cho sức khỏe. Nó có thể có lợi
trong việc iều trị bệnh Alzheimer và viêm khớp dạng thấp và trong việc ngăn ngừa một số dạng ung
thư và thậm chí trong việc kiểm soát bệnh tiểu ường. Tuy nhiên màu của chén súp không giống màu của nghệ tươi. Leroy nhận xét.
“Chà, ể tôi giải thích chuyện gì ã xảy ra. Tôi bắt ầu nấu súp theo cách truyền thống. Tôi ã thêm tất cả
các thành phần và rắc nghệ. Nhưng tôi nhận ra rằng ậu lăng vẫn chưa nấu chín! Vì vậy, tôi ã thêm một
ít muối nở. Tôi ã ọc ở âu ó rằng baking soda tăng tốc ộ nấu chín thức ăn. Như tôi ã thêm Tôi nhận
thấy rằng súp ã chuyển màu từ vàng sang cam, ”Mona giải thích. "Lạ lùng. Không biết có phải hóa
chất tăng cường sức khỏe trong nghệ ã bị baking soda phá hủy hay không? Mặc dù vậy, món súp rất
áng yêu! ” Leroy thốt lên giữa từng thìa súp.
Câu hỏi thảo luận:
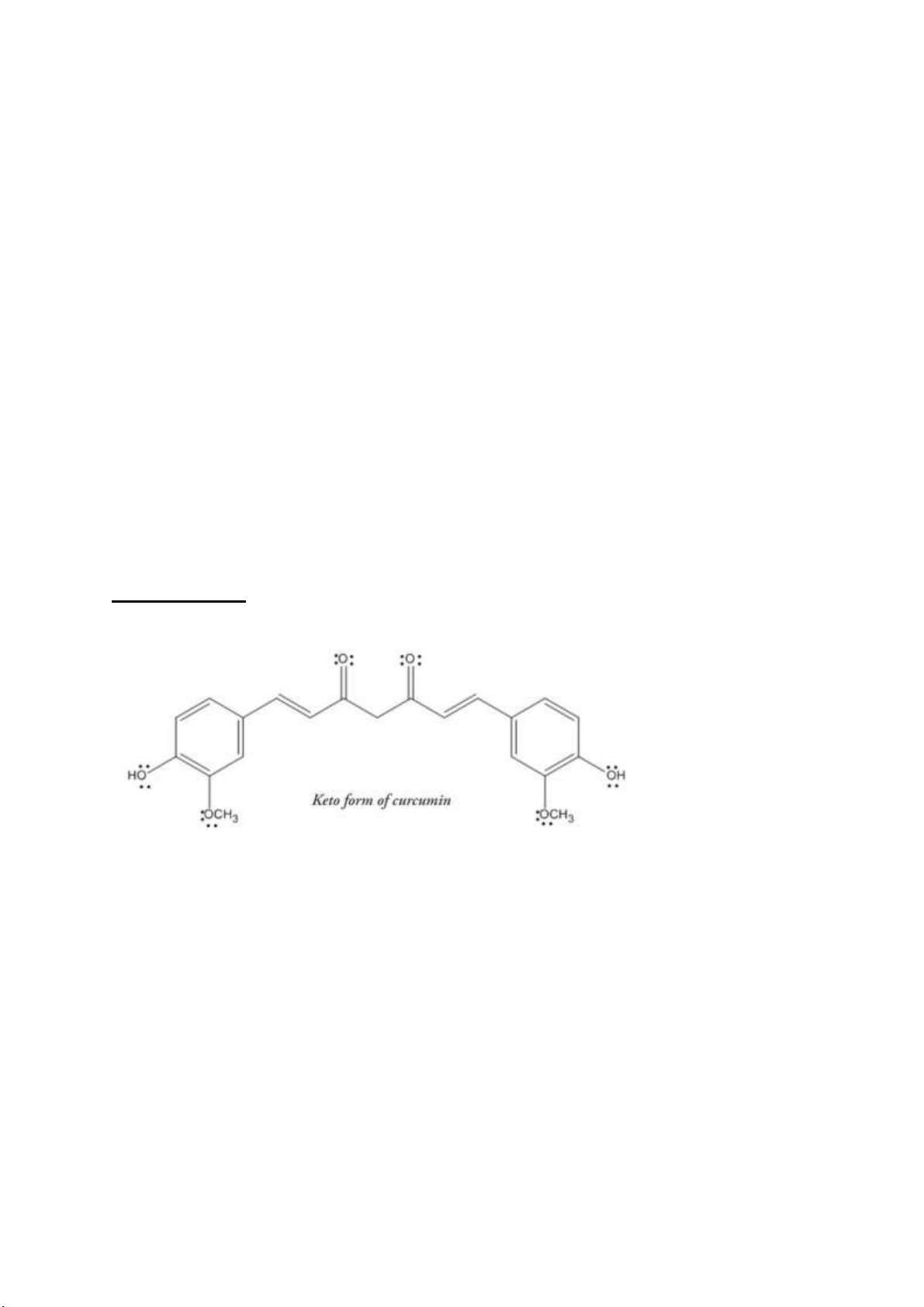
Câu 1. Curcumin là một polyphenol tự nhiên, nó tồn tại như hỗn hợp của 2 dạng là ketone và enol
a) Ứng dụng hiệu ứng iện tử, bạn hãy vẽ các mũi tên thể hiện chiều dịch chuyển electron ể
chuyển từ dạng ketone sang enol
b) Trong 2 dạng tồn tại enol và ketone, dạng enol chiếm ưu thế hơn, theo bạn lý do vì sao?
Câu 2. Phản ứng xảy ra như thế nào khi cho baking soda (NaHCO3) tiếp xúc với curcumin? Bạn hãy
vẽ cơ chế của phản ứng này? Giải thích sự chuyển màu khi curcumin tiếp xúc với baking soda
Câu 3. Theo bạn trường hợp của Leroy, có thể sử dụng thí nghiệm ơn giản nào có thể thực hiện ược
trong nhà bếp ể chứng minh sự giải thích ở câu 2 là úng?
Câu 4. Nhiều lợi ích sức khỏe của curcumin ược ề nghị do curcumin có tính chống oxy hóa, khi nó
tiếp xúc với gốc tự do, nó sẽ “bắt” các gốc tự do này. Bạn hãy vẽ trạng thái cộng hưởng bền của trường hợp này.
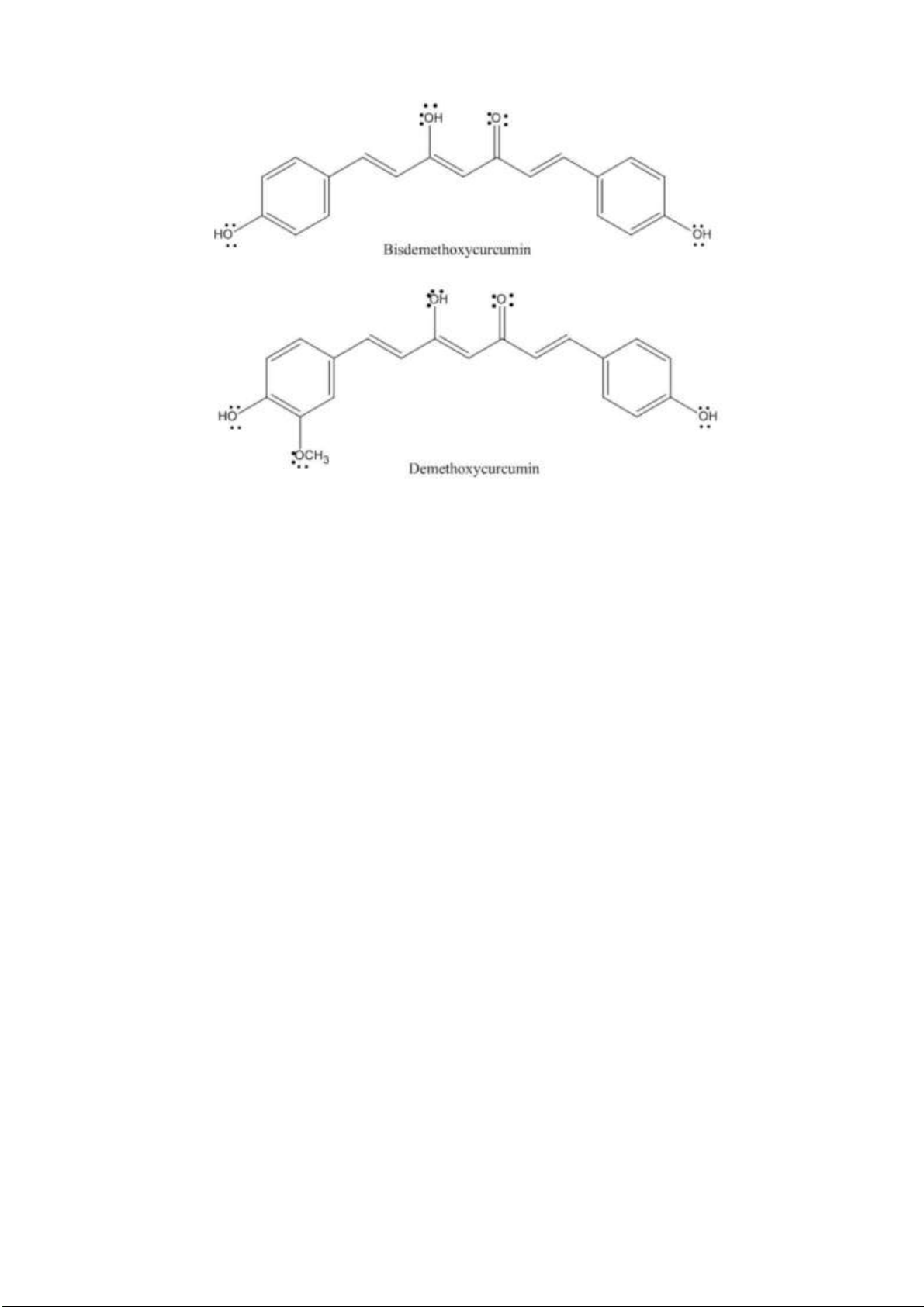
Câu 5. Trong nghệ, ngoài curcumin còn có 2 dẫn xuất tương tự curcumin là bisdemethoxycurcumin
(BDMC) and demethoxycurcumin (DMC). Cả 3 hợp chất này ều có tác dụng chống oxy hóa, nhưng
curcumin ược cho là có khả năng “bắt” gốc tự do mạnh mẽ hơn BDMC và DMC, theo bạn lý do vì sao? lOMoARcPSD| 38841209
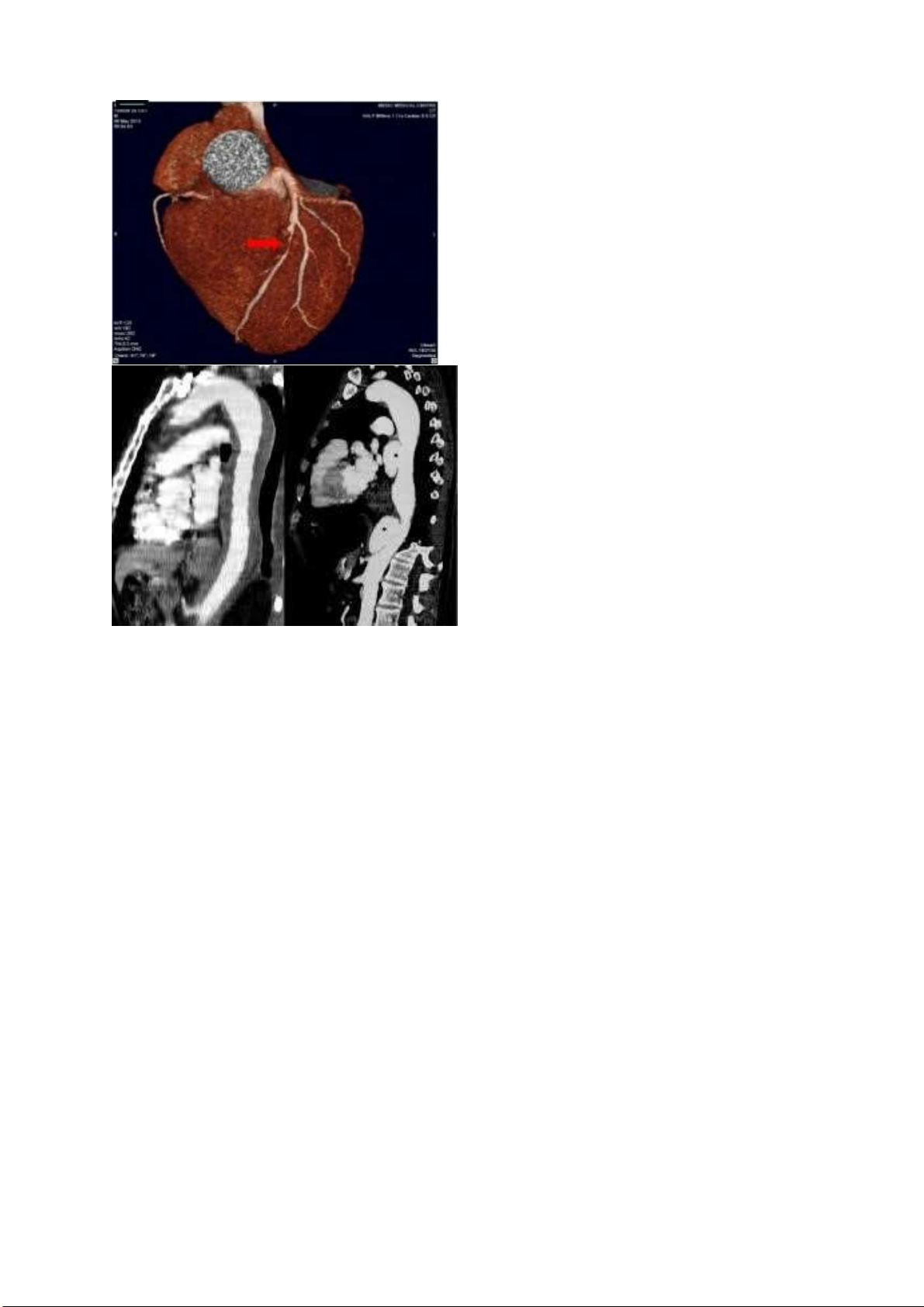
TÁC DỤNG GÂY PHÙ CỦA THUỐC ĐIỀU TRỊ CAO HUYẾT ÁP CASE LÂM SÀNG Ký hiệu: AM: Amlodipine: CCB: Calcium Channel Blockers HTN: Hypertention
Một người àn ông 56 tuổi có tiền sử cao huyết áp 3 năm rồi, 6 tháng trước ông ấy ược iều trị bằng thuốc
hạ huyết áp amlodipine viên 5 mg, thăm khám huyết áp 135/77 mmHg, chân bị phù bàn chân và mắt cá.
Điều trị: Bệnh nhân ược cho dùng S-amlodipine. Tình trạng phù giảm.
Câu hỏi thảo luận:
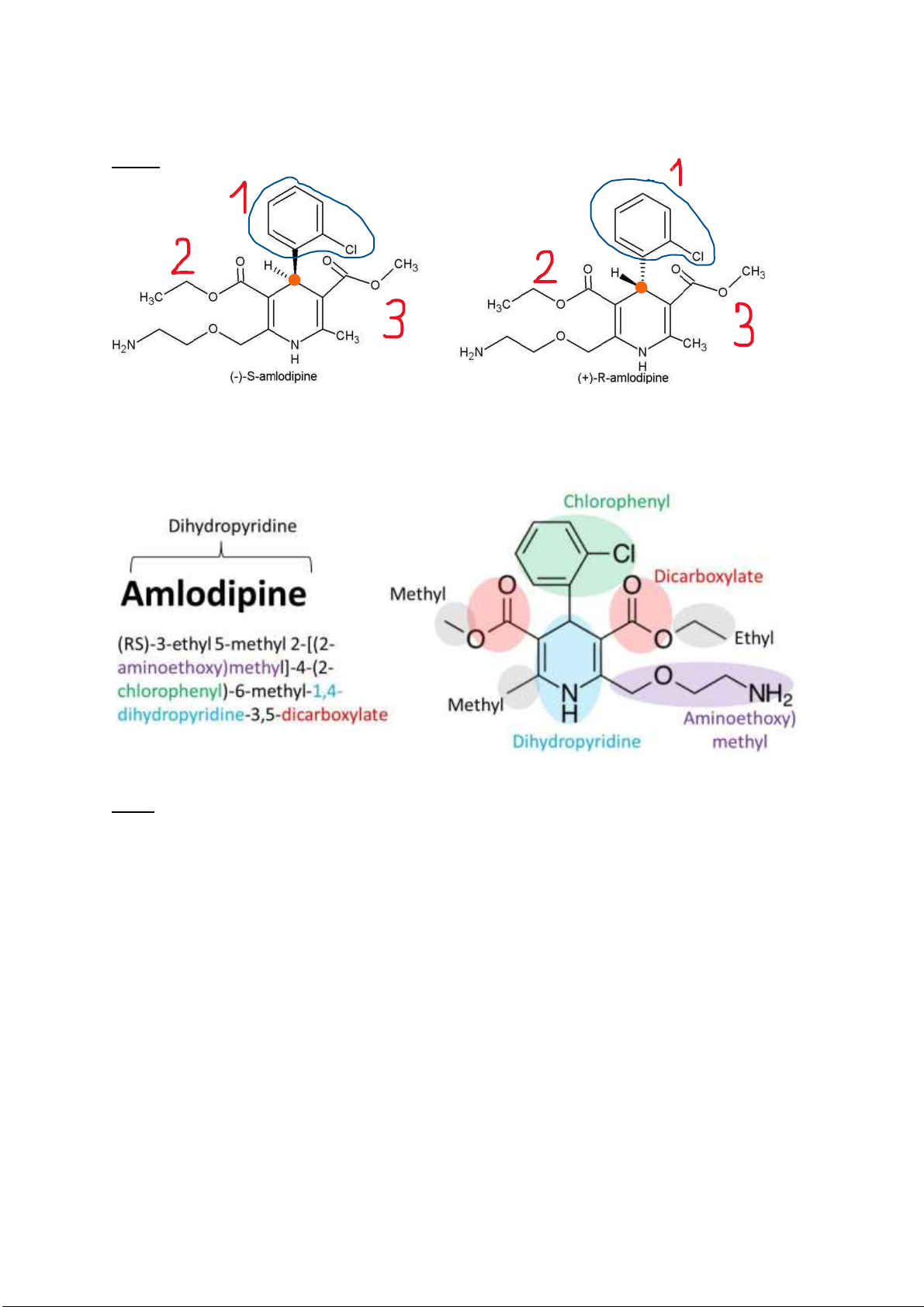
Câu 1. Trình bày cấu trúc lập thể của amlodipine. Xác ịnh carbon bất ối trong cấu trúc và phân biệt ồng phân R, S amlodipine?
Câu 2. Làm thế nào sinh viên xác ịnh ược góc quay cực của amlodipine là – 20,83 và góc quay cực
của S-amlodipine là – 20,10?. Hãy cho biết % e.e và % R-amlodipine trong hỗn hợp. Câu 3. Phát
biểu 1 câu dự oán sự gắn của amlodipine lên receptor gây tác dụng sinh học.
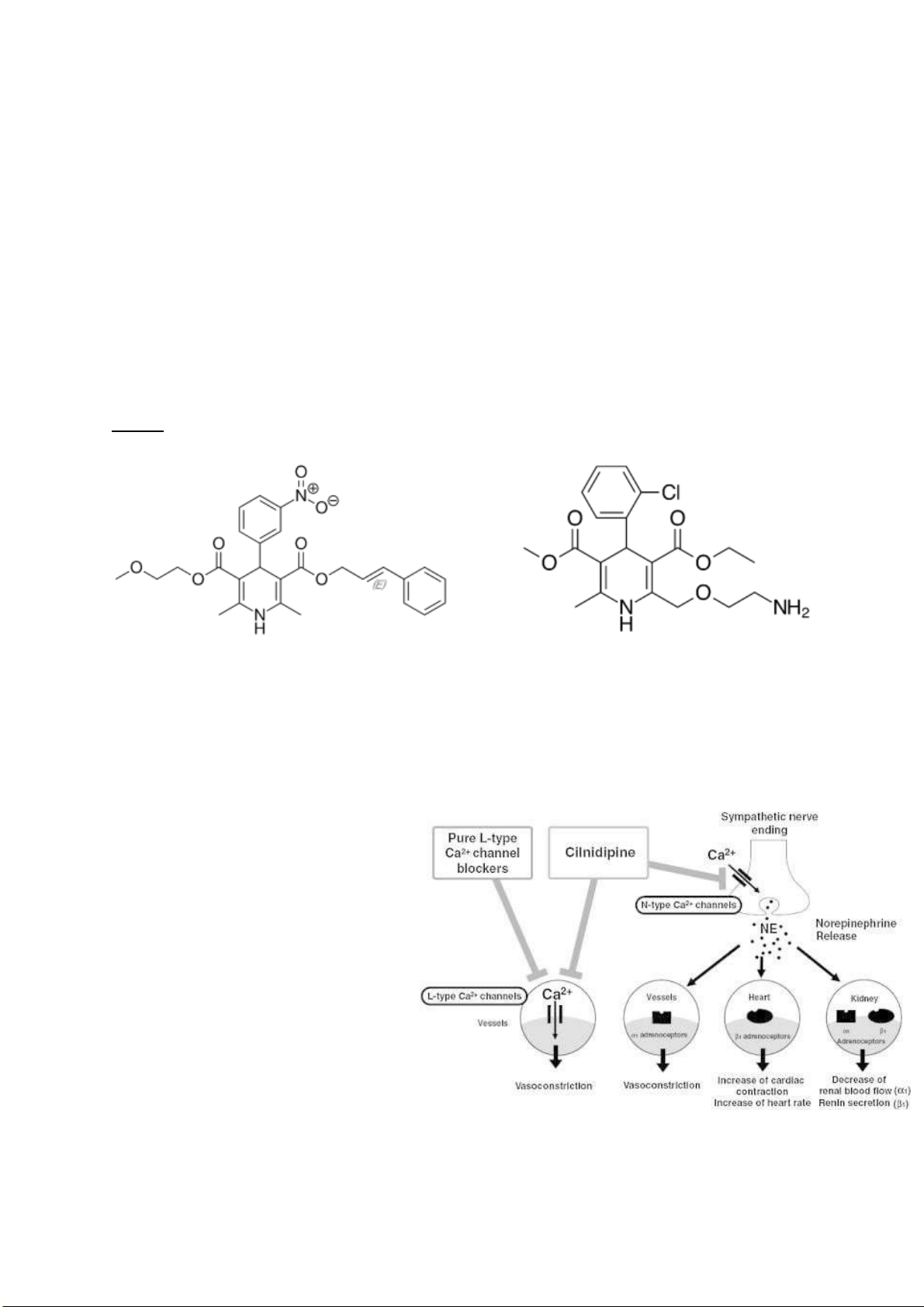
Câu 4. Cilnidipine một thuốc ược dùng thay thế amlodipine ể giảm tác dụng gây phù ngoại vi? So
sánh iểm khác biệt về cấu trúc của amlodipine và cilnedipine?
Câu 5. Phân tích tác dụng gây phù của amlodipine?
Câu 6. Cơ chế gây phù của các thuốc nhóm dihydropyridine? lOMoARcPSD| 38841209
Câu 7. Liên hệ case trong bài Nhiệt ộng lực học hóa học.
Câu 1:
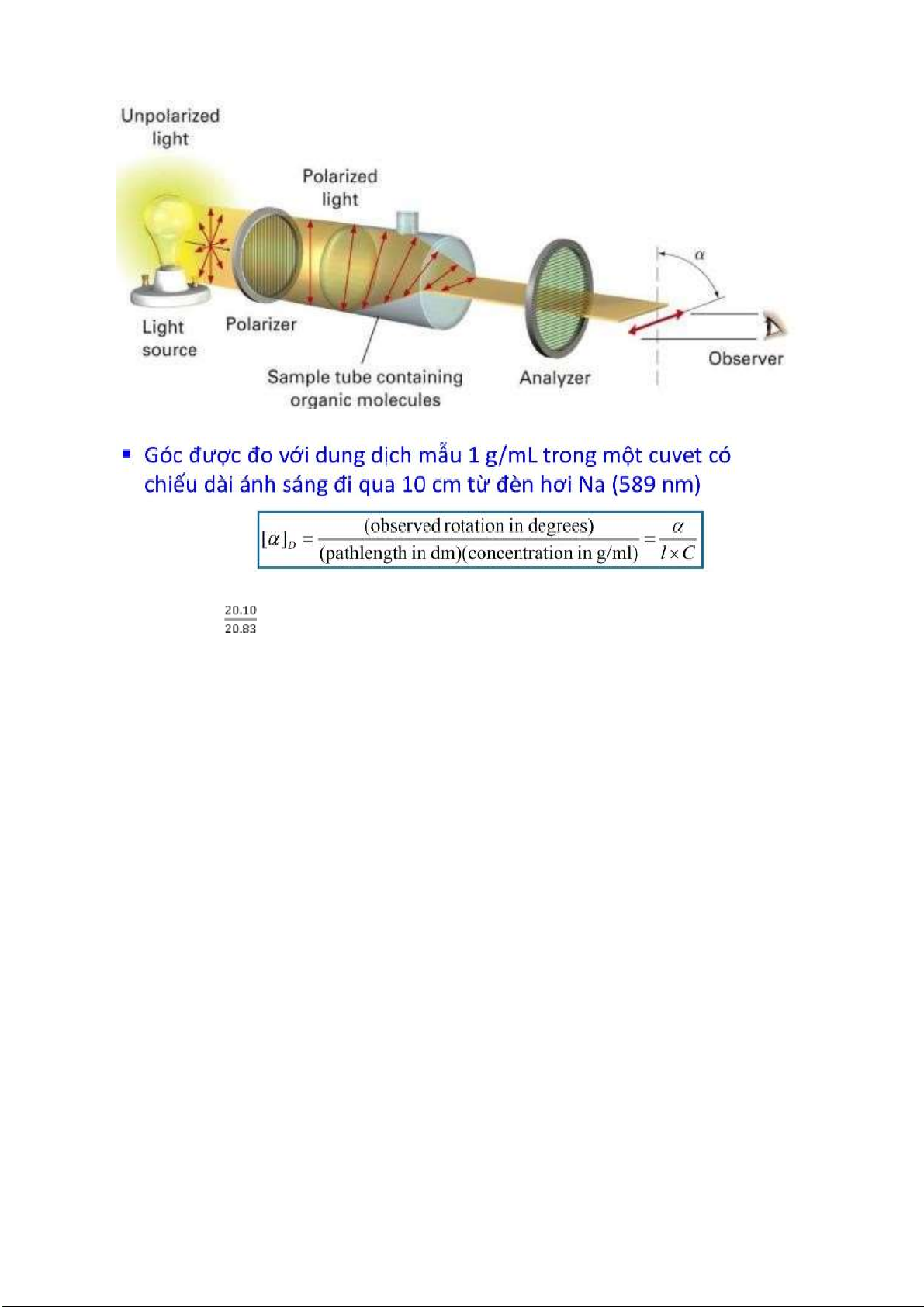
Câu 2: Sử dụng Triền quang kế (phân cực kế) ể o góc quay của mặt phẳng ánh sáng phân cực. -
Bao gồm: nguồn sáng ơn sắc, một kính phân cực ể tạ ra ánh sáng phân cực phẳng, ống chứa mẫu, kính phân tích. -
Nếu không có hướng dẫn riêng, góc quay cực a ược xác ịnh ở nhiệt ộ 20 °C và với chùm tia ơn
sắc có bước sóng ứng với vạch D (589,3 nm) của èn natri qua lớp chất lỏng hay dung dịch có bề dày 1 dm. -
Góc quay cực riêng [a]20D của một chất lỏng là góc quay cực o ược khi chùm ánh sáng D truyền
qua lớp chất lỏng ó có bề dày là 1 dm ở 20 °C chia cho tỷ trọng tương ối của chất ở cùng nhiệt ộ. -
Góc quay cực riêng [a]20D của một chất rắn là góc quay cực o ược khi chùm ánh sáng D truyền
qua lớp dung dịch có bề dày là 1 dm và có nồng ộ là 1 g/ml, ở 20 °C. Góc quay cực riêng của chất
rắn luôn ược biểu thị cùng với dung môi và nồng ộ dung dịch o. lOMoARcPSD| 38841209 % e.e = = 96.4%
% S = 96.4% + (1 – 96.4%)/2 = 98.2% % R = 1.8% lOMoARcPSD| 38841209
Câu 3:
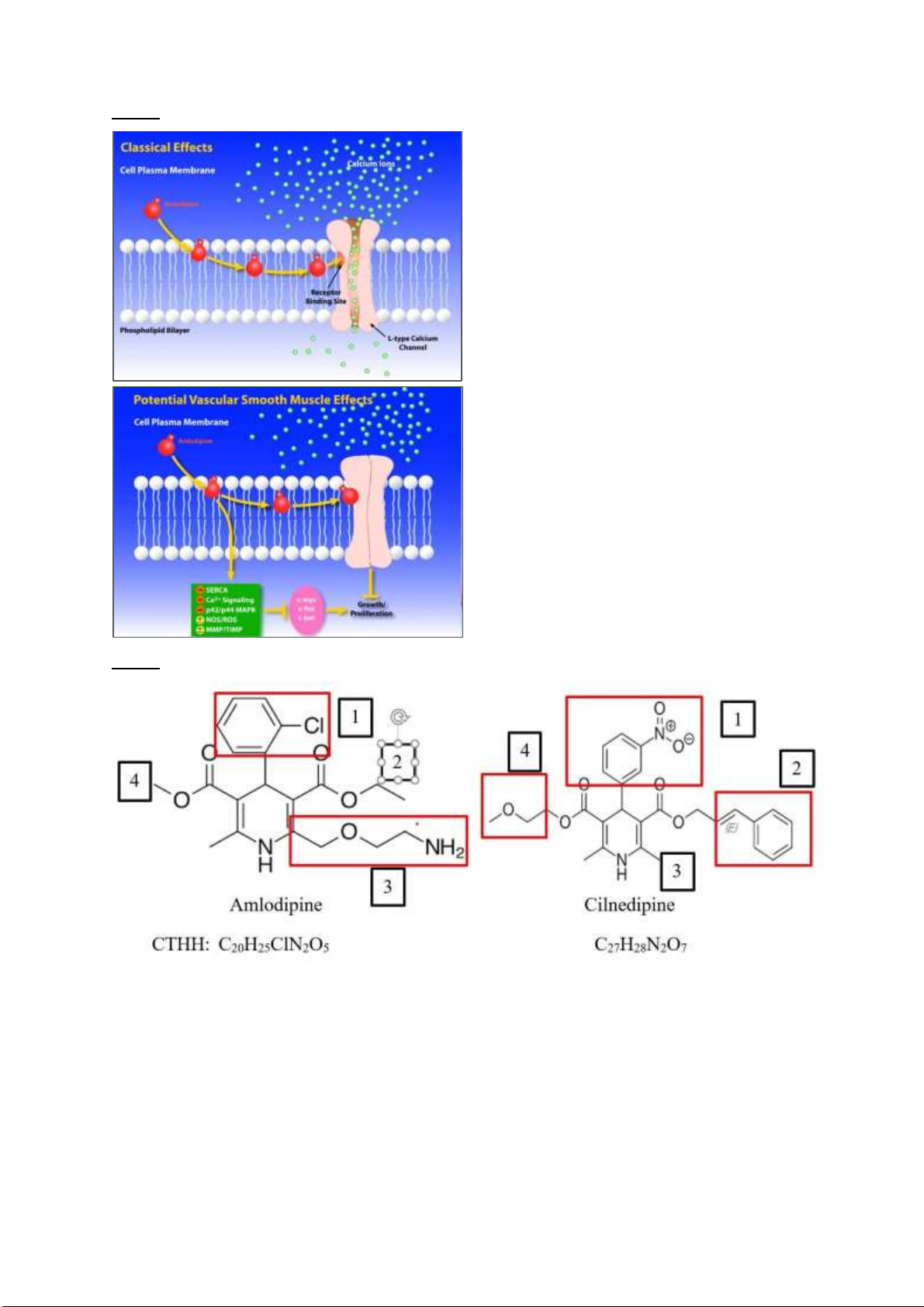
Câu 4: Danh pháp IUPAC: -
Amlodipine: (RS)-3-ethyl 5-methyl 2-[(2-aminoethoxy)methyl]-4-(2-chlorophenyl)-6-methyl1,4-
dihydropyridine-3,5-dicarboxylate -
Cilnedipine : 6-Dimethyl-4-(3-nitrophenyl)-3,5-pyridinedicarboxylic Acid 2-Methoxyethyl (2E)- 3-Phenyl-2-propenyl Ester lOMoARcPSD| 38841209
Các vị trí khác nhau Amlodipine Cilnedipine 1 2-chlorophenyl 3-nitrophenyl 2
Chức este có phần ancol là
Chức este có phần ancol là ancol etylic Methoxyethyl (2E)-3-Phenyl- 2-propenol 3 2-aminoethoxy Metyl 4
Chức este phần ancol là ancol
Chức este phần ancol tạp chức metylic là 2-Methoxyethol lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 Câu 5: -
Công dụng của Amlodipine là chẹn kênh canxi. Kênh canxi có tác dụng co giãn các thành cơ trơn
(mà cơ của mạch máu là cơ trơn)
+ Nhịp tim phụ thuộc vào tốc ộ mà các tế bào tạo nhịp trong xoang và nút nhĩ-thất tạo ra iện thế hoạt ộng.
+ Các iện thế hoạt ộng này bắt ầu hoạt ộng khi các kênh natri từ từ cho dòng ion Natri vào iện thế
màng của tb tạo nhịp tim trở nên dương hơn.
+ Khi ạt ến ngưỡng iện thế màng, ây là dấu hiệu cho các kênh canxi mở ra, cho một dòng lớn các ion
Canxi vào, làm khử cực nó hơn nữa.
+ Sau ó, kênh canxi óng lại, kênh kali mở ra, ưa ion Kali từ trong ra ngoài tế bào, làm iện thế giảm xuống (tái phân cực)
+ Mỗi quá trình khử cực và tái phân cực sẽ ại diện cho một nhịp tim, và quá trình này xảy ra nhanh
như thế nào trong 1 phút sẽ xác ịnh nhịp tim. lOMoARcPSD| 38841209
+ Kênh canxi mở ra khi nhận t hoạt ộng, giúp canxi i vào tế bào. Canxi ngoại bào gây giải phóng
canxi nội bào trong mạng lưới nội chất. Các canxi này sau ó liên kết với protein iều hòa, thay ổi hình
dạng, giải phóng các sợi mỏng trong sợi cơ. Cho phép sợi mỏng liên kết với sợi dày giúp co cơ (tim, mạch máu)
- Huyết tương hay nước trong mạch máu luôn thông với bên ngoài, dịch bên ngoài gọi là dịch kẽ.
Mạch máu nó có những cái lỗ lọc mà chỉ có nước, hay những chất iện giải nhỏ nhỏ mới qua ược,
trong khi máu hay protein huyết tương ều không qua ược.
- Nếu mà mạch máu giãn tăng tính thấm thành mạch albumin thoát ra ngoài nhiều hơn tăng
áp suất keo dịch kẽ tạo ra một cân bằng mới mà ở ây dịch kẽ nó chứa nhiều nước hơn bình
thường. Dịch kẽ chứa nhiều nước, không lưu thông ược thì sẽ ứ ọng và gây phù.
- Cơ chế gây phù bao gồm:
1. Tăng áp lực thủy tĩnh
2. Giảm áp lực keo huyết tương
3. Tăng thẩm thấu mao mạch
4. Tắc nghẽn hệ bạch huyết
Cơ chế ược cho gây giãn mạch, trong ó gây
giãn các tiểu ộng mạch trước mao mạch, làm
tăng tính thấm của thành mạch và thoát dịch từ
lòng mạch ra khoảng kẽ. Tuy nhiên, nước và
các chất iện giải có thể qua lại thành mạch tự
do, tại sao lại gây phù? Một cơ chế khác ược
nêu ra kèm theo hiện tượng giãn mạch và tăng tính thấm thành mạch là có hiện tượng thoát các phân tử
albumin từ trong lòng mạch ra ngoài khoảng kẽ, làm tăng áp lực keo của khoảng kẽ và gây tăng giữ
nước tại ây. Ngoài ra, giãn các tiểu ộng mạch trước mao mạch là tăng áp lực thủy tĩnh của tĩnh mạch
(sau mao mạch) do ó gây cản trở dịch từ khoảng kẽ trở về mao tĩnh mạch.
- Một nghiên cứu khác chỉ ra rằng: oxit nitric (NO) ược giải phóng bởi tổng hợp oxit nitric cảm ứng là
một trong những nguyên nhân gây ra chứng phù nề. R (+) amlodipine tham gia vào quá trình hình
thành NO tại chỗ và iều này có thể dẫn ến mất co mạch phản xạ tiền mao mạch và phát triển phù khi
sử dụng hỗn hợp racemic. (S-Amlodipine: An Isomer with Difference—Time to Shift from Racemic Amlodipine (nih.gov)) lOMoARcPSD| 38841209 Câu 6: Câu 7:
- Trẻ trong ộ tuổi 13 - 15: Có chỉ số huyết áp trung bình 95/60 mmHg, chỉ số huyết áp cao nhất là 104/70 mmHg.
- Trong khi ó, HA của Maria là 130/80 mmHg Maria bị cao huyết áp.
Nguyên nhân là do chế ộ ăn uống và lối sống không lành mạnh dẫn ến béo phì. Có thể iều trị bằng các
biện pháp phù hợp mà không cần sự can thiệp của thuốc nhóm dihydropyridine.
- Bên cạnh ó người àn ông 56 tuổi có tiền sử bị cao huyết áp 3 năm là do vấn ề tuổi tác. Do ó, người
này phải ược iều trị bằng thuốc nhóm dihydropyridine. lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
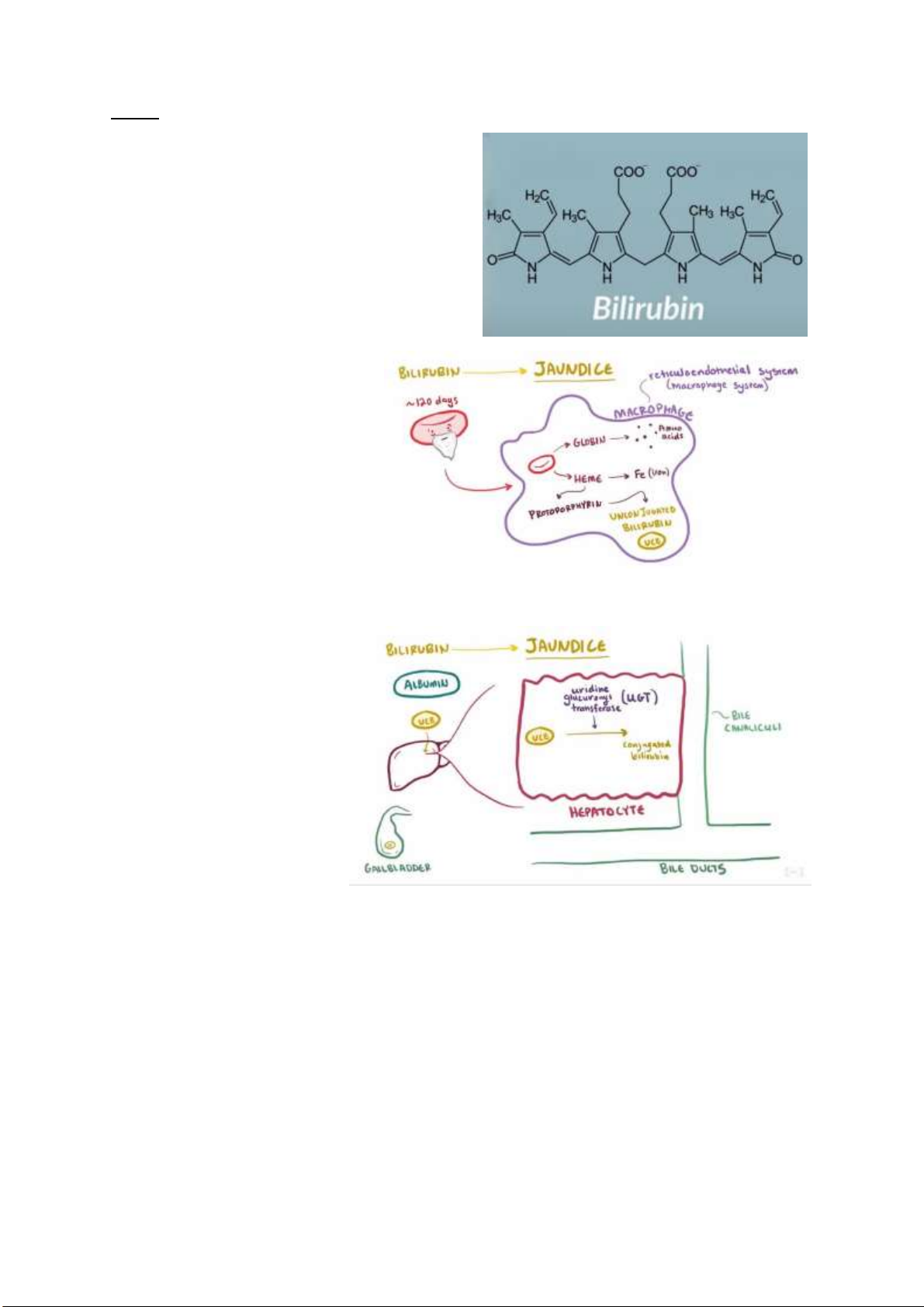
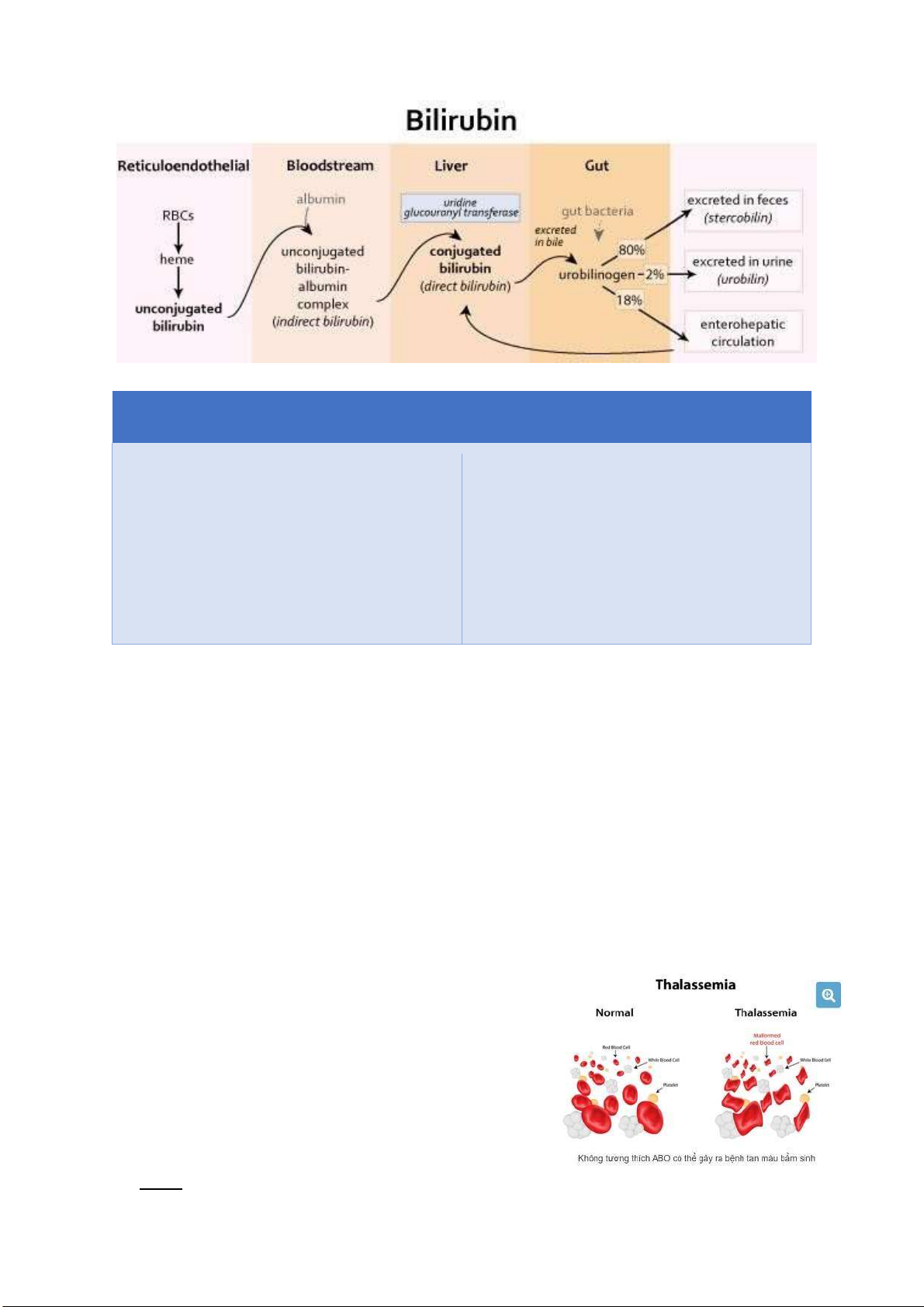
Câu 1: Nguyên nhân chủ yếu gây vàng da trẻ sơ sinh
Bilirubin dư thừa (tăng bilirubin trong
máu) là nguyên nhân chính gây ra
vàng da, là một phần bình thường của
sắc tố ược giải phóng từ sự phân hủy
của các tế bào hồng cầu ã hết tuổi thọ.
Khi chu kì các tế bào hồng cầu gần kết
thúc (khoảng 120 ngày), chúng bị
“ăn” bởi các ại thực bào trong hệ
thống nội mô (hay hệ thống ại thực
bào). Đầu tiên, các tế bào hồng cầu
hemoglobin ược phân tách thành
heme và globin. Trong khi các globin
ược bẻ gãy thành các amino acids,
heme ược chia nhỏ thành Fe và
Protoporphyrin. Protoporphyrin sau ó ược chuyển ổi thành các
Bilirubin gián tiếp không liên hợp (loại bilirubin Z,Z tan trong lipid chứ không tan trong nước).
Albumin trong máu gắn với
bilirubin không liên hợp và vận
chuyển nó ến gan. Ở gan, nó
ược tế bào gan thu nhận và ược
liên hợp với enzim uridine glucuronyl transferase (UGT)
làm nó tan ược trong nước.
Sau ó, bilirubin ược dẫn vào ống dẫn mật và lưu trữ trong túi mật. Khi chúng ta ăn, túi mật tiết ra mật
có chứa bilirubin di chuyển qua ống mật chủ ể ến tá tràng. Và bilirubin ược chuyển thành
urobilinogen bởi vi khuẩn trong ường ruột. Một lượng urobilinogen ược khử thành stercobilin và tạo
thành màu nâu của phân. Tuy nhiên, một số urobilinogen ược tái sử dụng, hấp thụ lại vào máu và
chuyển hóa thành urobilin (hầu hết i ến gan, một số i ến thận rồi ược bài tiết tạo thành màu vàng của nước tiểu). lOMoARcPSD| 38841209 VÀNG DA SINH LÝ VÀNG DA BỆNH LÝ -
Xuất hiện sau 24 giờ tuổi -
Xuất hiện sớm (trong vòng 24h sau sinh) -
Vàng da ơn thuần (chỉ ở vùng mặt, cổ,
ngực, vùng bụng trên rốn) -
Vàng da toàn thân, lòng bàn tay, bàn chân, kết mạc mắt -
Không kèm theo các triệu chứng bất thường -
Trẻ lừ ừ, bỏ bú, co giật,.. -
Nồng ộ Bilirubin/máu <= 12mg/dl
-Nồng ộ Bilirubin/máu lớn hơn 12mg/dl
• So sánh với ca lâm sàng: - Xuất hiện sớm -
Lượng bilirubin là 15mg/dl Vàng da bệnh lý
• Nguyên nhân gây vàng da bệnh lý ở trẻ : -
Tăng sản xuất bilirubin (do sự gia tăng phân hủy tế bào hồng cầu, ời sống hồng cầu ngắn) -
Giảm hấp thu ở gan do hàm lượng enzim UGT không ủ -
Giảm khả năng liên hợp của albumin với bilirubin không liên hợp, giảm khả năng vận chuyển bilirubin -
Bất ồng nhóm máu giữa mẹ và bé: Đây là tình trạng
xảy ra khi mẹ có nhóm máu O và bé là A, B hoặc AB.
Điều này sẽ kích hoạt hệ thống miễn dịch của mẹ,
xem các kháng nguyên A hoặc B trong máu của thai
nhi là các chất lạ và gây ra phản ứng miễn dịch, tấn công và tiêu hủy chúng.
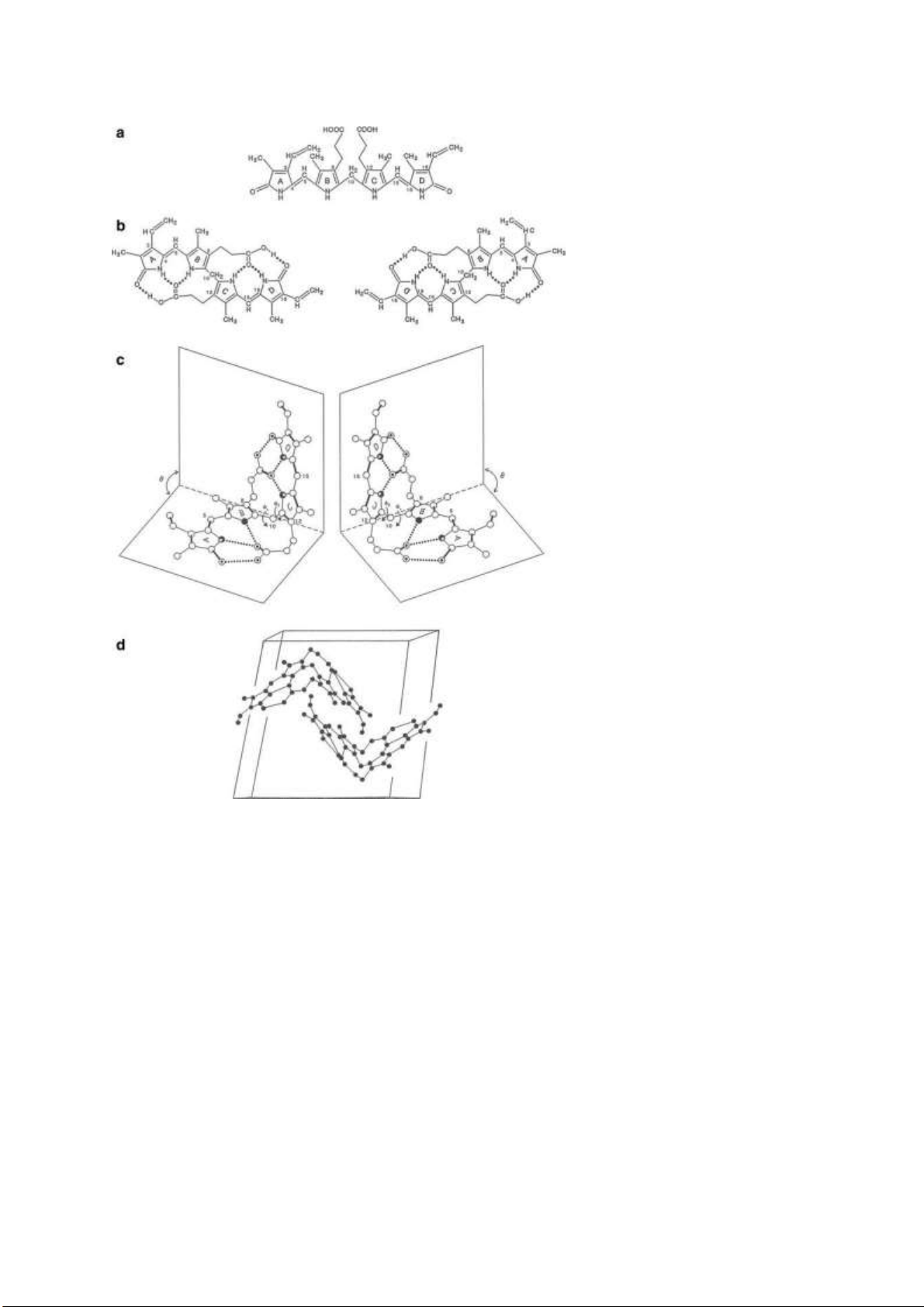
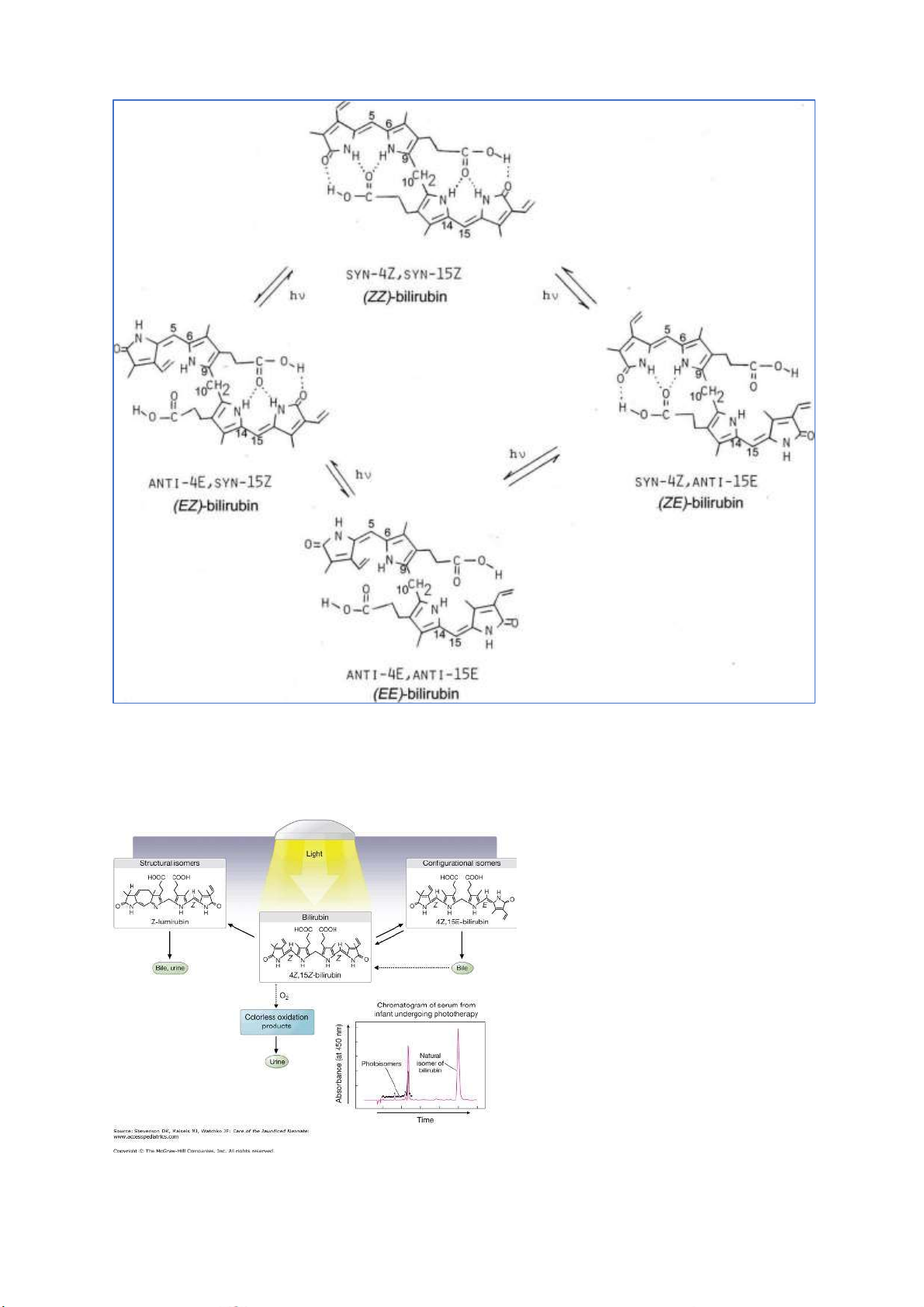
Câu 2: Phân tích sự khác nhau về cấu trúc của các bilirubin tự do, xác ịnh các ồng phân cấu
hình có thể có của bilirubin tự do. lOMoARcPSD| 38841209 • ĐỒNG PHÂN QUANG HỌC
Có ồng phân quang học không phải vì có
C thủ tính, mà là do sự xuất hiện của liên
kết hidro giữa các vòng A, B, C, D => làm
quay mặt phẳng ánh sáng phân cực
Chỉ có Z,Z mới có ĐPQH; 3 ĐPHH còn
lại không có ĐPQH (vì số lượng liên kết hidro)
Nito thủ tính trong trường hợp này không
gây ra hiện tượng quang hoạt vì electron
tự do của nito chịu ảnh hưởng của hiệu
ứng cộng hưởng => electron không nằm yên một chỗ trên nito.
• ĐỒNG PHÂN HÌNH HỌC VÀ ĐỒNG PHÂN CẤU TRÚC lOMoARcPSD| 38841209
ĐPHH hình thành nhờ sự quay liên kết pi
Các cacbon có cấu hình Z sẽ hình thành ược liên kết hidro nội phân tử với nhóm -COOH, giảm sự
hình thành liên kết hidro giữa bilirubin và nước (Z,Z) – bilirubin là khó tan trong nước nhất khó
ào thải nhất trong các ồng phân của bilirubin. lOMoARcPSD| 38841209 ĐỒNG PHÂN HÌNH HỌ C ĐỒNG PHÂN CẤU TRÚC
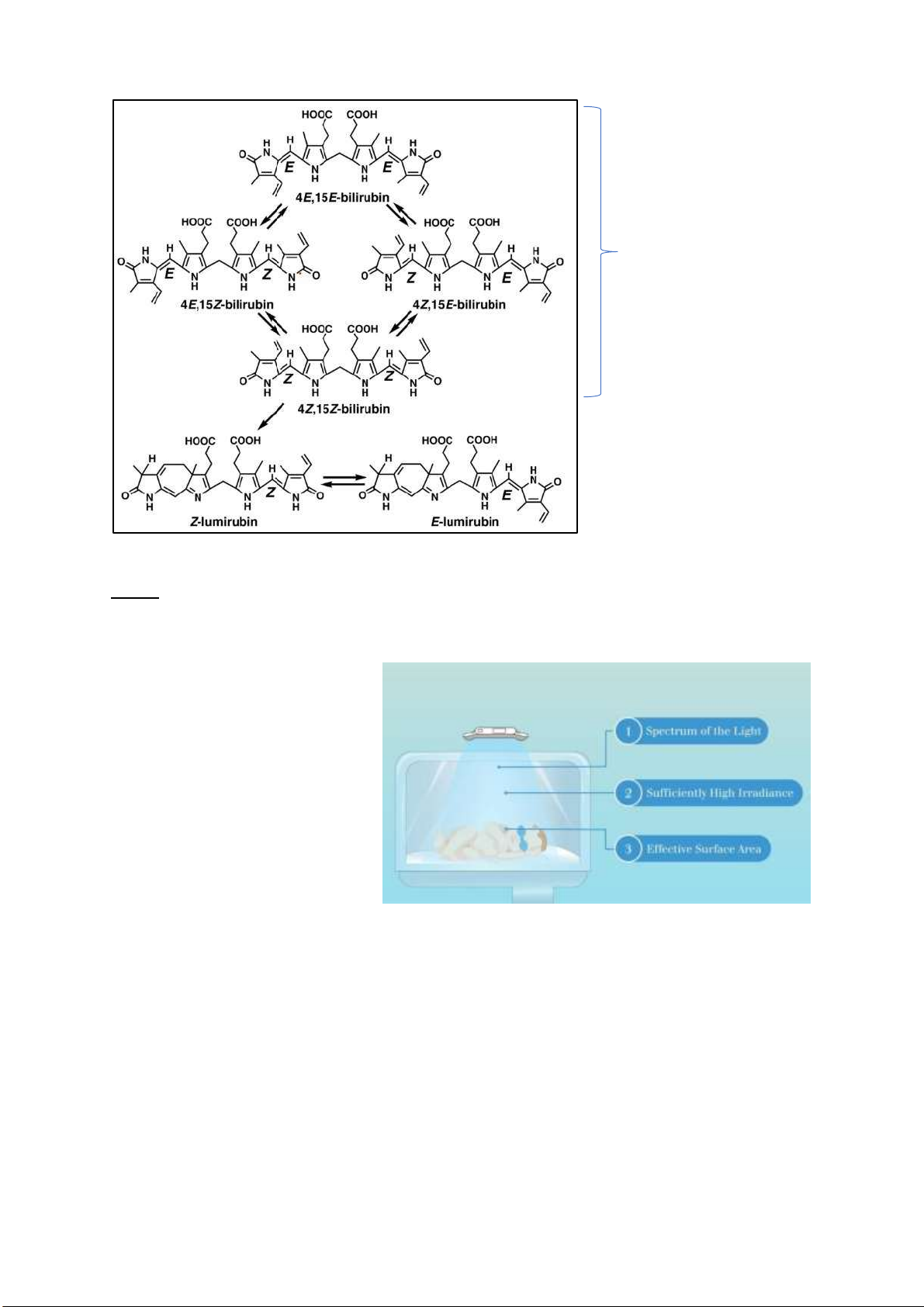
Câu 3: Quang trị liệu là lựa chọn ầu tiên ể iều trị bệnh vàng da trẻ sơ sinh. Vậy liệu pháp này có tác dụng gì?
Sử dụng ánh sáng có bước sóng từ
400-500nm, cực iểm 450-460nm
tương ứng với ỉnh hấp thụ của
Bilirubin (ánh sáng màu xanh dương).
Năng lượng ánh sáng xuyên qua da ể
tác ộng lên các phân tử Bilirubin nằm
trong lớp mỡ dưới da ể biến ổi các
phân tử Bilirubin không liên hợp ( ộc
cho não của trẻ) thành các sản phẩm
ồng phân hay các sản phẩm quang oxy
hoá tan ược trong nước, không ộc và
sẽ ược ào thải qua gan (qua mật) và thận (qua nước tiểu)
Liệu pháp ánh sáng chuyển bilirubin không liên hợp gián tiếp khó tan trong nước (Z,Z) bilirubin
không liên hợp gián tiếp dễ tan trong nước (Z,E; E,Z; E,E) (chứ không phải bilirubin liên hợp, vì
bilirubin chỉ ược gọi là liên hợp khi nó ược gắn với gluconic nhờ enzim UGT) không cần albumin vận
chuyển, không cần UGT gắn gluconic, mà i thẳng xuống mật ể ào thải trực tiếp ra khỏi cơ thể, giảm áp lực cho gan. lOMoARcPSD| 38841209
Đây là một phương pháp không xâm lấn, rẻ tiền và dễ dàng ể phân hủy bilirubin không liên hợp bằng
quá trình oxy hóa quang nên ược trở thành sự lựa chọn ầu tiên ể iều trị vàng da ở trẻ sơ sinh. Thay
máu, thường ược thực hiện sau khi thất bại với liệu pháp quang trị liệu, có thể dẫn ến các biến chứng
nghiêm trọng, chẳng hạn như tắc mạch, nhiễm trùng huyết, viêm ruột hoại tử hoặc thậm chí tử vong.
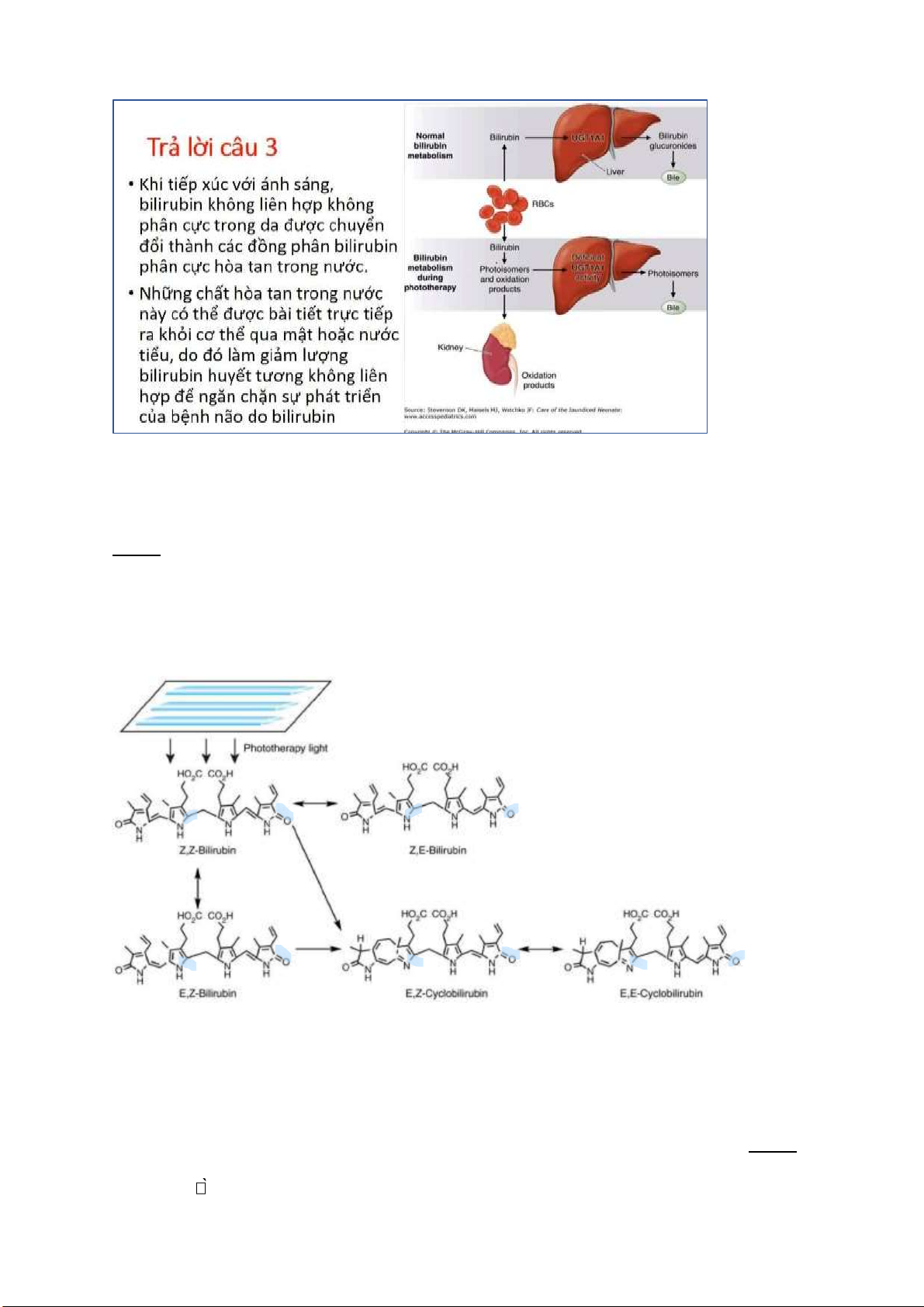
Câu 4: Giải thích tại sao mỗi ồng phân của bilirubin lại có sự ào thải khác nhau trong cơ thể. Từ
ó giải thích cơ chế giải ộc bilirubin bằng phương pháp chiếu èn.
Các ồng phân phân cực của bilirubin sẽ tan ược trong dung môi phân cực (nước) nên ược ào thải dễ
dàng qua ường nước tiểu và phân. Trong khi các ồng phân không phân cực của bilirubin sẽ chỉ tan trong
dầu và không thể ào thải ra khỏi cơ thể, có thể ứ ọng trong hạch nền của não bộ gây nguy hiểm cho cơ thể.
Khi tiếp xúc với ánh sáng, bilirubin không liên hợp không phân cực (Z, Z ‑ bilirubin) trong da ược
chuyển ổi thành các ồng phân bilirubin không liên hợp hòa tan trong nước, bao gồm Z, E ‑ bilirubin,
E, Z ‑ bilirubin, E, E ‑ bilirubin, E, Z - cyclobilirubin và E, E ‑ cyclobilirubin.
Z, Z-bilirubin là ồng phân có nhiều liên kết hidro nội phân tử nhất làm giảm ộ tan của nó trong
dung môi phân cực và làm cho nó khó ược ào thải ra khỏi cơ thể. Trong ó, E,Z; Z,E; E,E có rất ít
hoặc không có liên kết hidro nội phân tử dễ tan và dễ ào thải qua ường nước tiểu và phân. Câu 5:
Đề xuất 1 cơ chế hợp l礃Ā về sự phân giải ồng phân khó ào thải của bilirubin biến ổi thành
ồng phân d ào thải. Vài giải thích tại sao có sự thay ổi này có thể xảy ra. lOMoARcPSD| 38841209
Bilirubin là sắc tố hấp thụ ánh sáng. Quang phổ nhìn thấy ược, từ 420 ến 480 nanomet, ược hấp thụ tốt nhất bởi bilirubin.
Khi một phân tử cảm quang hấp thụ ánh sáng, nó sẽ nhận ược một lượng năng lượng sáng xác ịnh.
Sau khi nhận ược một photon, một electron sẽ ngay lập tức di chuyển ến một quỹ ạo có năng lượng
cao hơn, do ó bị kích thích. Phân tử này sau ó có thể phản ứng hai lần, tạo thành các sản phẩm quang.
Quang trị liệu gây ra hai loại phản ứng:
1 - PHOTO-OXIDATION, gây ra sự phân mảnh trong cấu trúc của phân tử bilirubin.
2 - PHOTOISOMERIZATION, biến ổi phân tử bilirubin không thay ổi thành các ồng phân hòa tan trong nước.
Trong PHOTO-OXIDATION, bilirubin ược kích thích (sau khi photon hấp thụ) bao bọc một phân tử
oxy, sau ó ược chuyển hóa thành một gốc tự do có khả năng phá hủy bilirubin tự nhiên, tạo ra năm sản
phẩm bài tiết qua thận. Đây là một phản ứng chậm và xảy ra với số lượng nhỏ.
PHOTOISOMERIZATION diễn ra nhanh hơn, và có thể hình thành hai sản phẩm khác nhau ược gan
loại bỏ: ồng phân cấu trúc (lumirubin) và ồng phân cấu hình.
- Lumirubin ược hình thành bởi các liên kết mới giữa các nhóm CH-CH2 của một vòng và vòng lân cận
liên quan ến các nguyên tử từ vị trí 2 và 7. Lumirubin là một sản phẩm ổn ịnh với sự hình thành chậm
và bài tiết nhanh, vì vậy một lượng lớn không tích tụ trong lưu thông (thay ổi từ 1 ến 14 phần trăm);
tuy nhiên, nó dường như là yếu tố hiệu quả chính của èn chiếu. trục của nó, ể lộ phân cực của nó (NH
và COOH) ra bên ngoài phân tử. Điều này thường liên quan ến cacbon 4 và 15, trong khi cacbon 15
tham gia nhiều hơn một trăm lần so với cacbon 4, và sản phẩm của loại ồng phân hóa này hầu như chỉ
là ồng phân 4Z, 15E. Đồng phân này ược hình thành nhanh chóng, bài tiết chậm và tích tụ trong tuần
hoàn. Nó có thể ược o bằng sắc ký lỏng áp suất cao và tương ứng với khoảng 15 - 20 phần trăm của
tổng số bilirubin. Sự hình thành của ồng phân này không phụ thuộc vào cường ộ sáng. Tuy nhiên, ồng
phân này không ổn ịnh, và có thể trở lại dạng bilirubin tự nhiên, ặc biệt là trong các kênh mật.
(lý do hồng cầu khi phân hủy sẽ tạo ồng phân Z,Z) lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
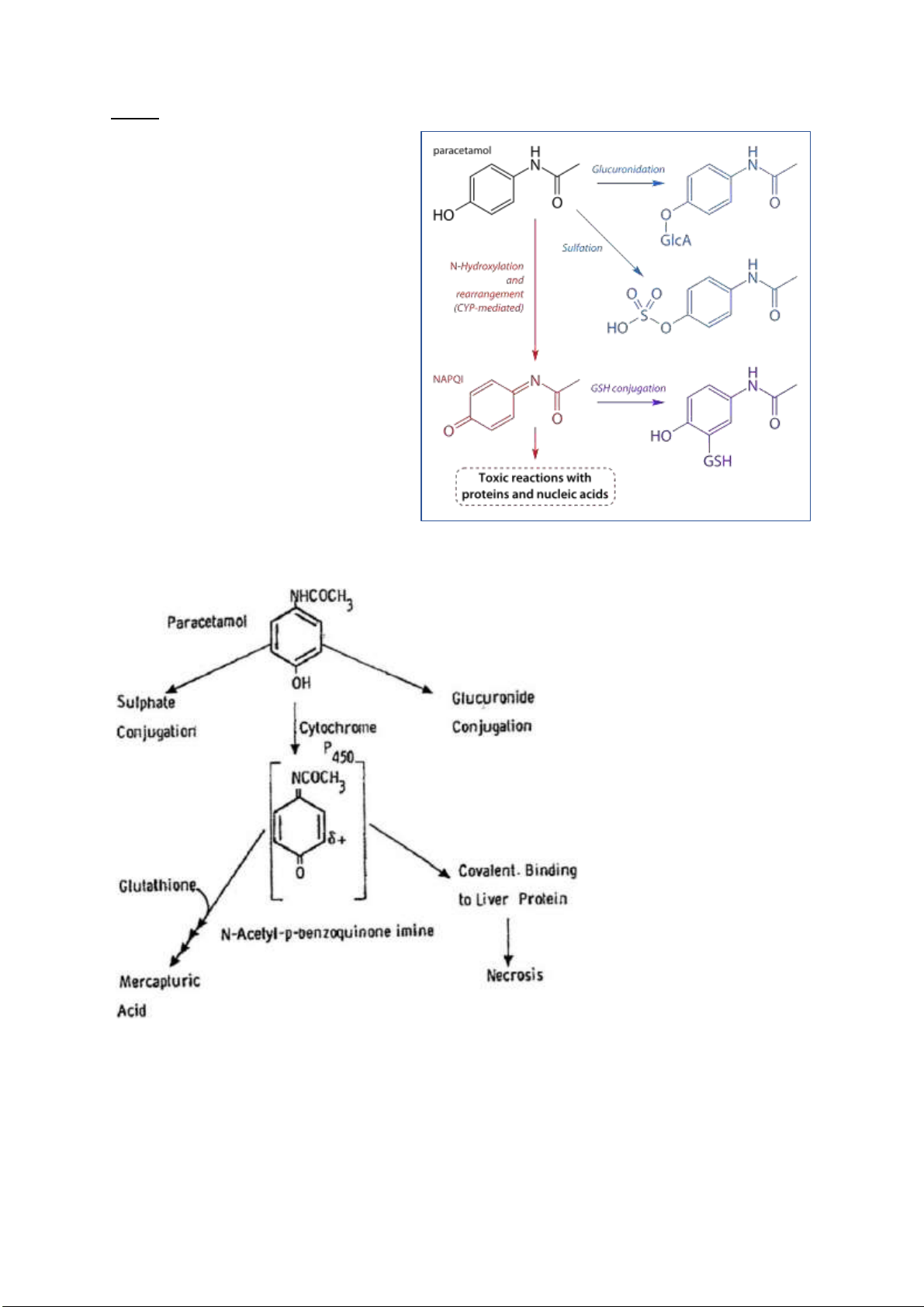
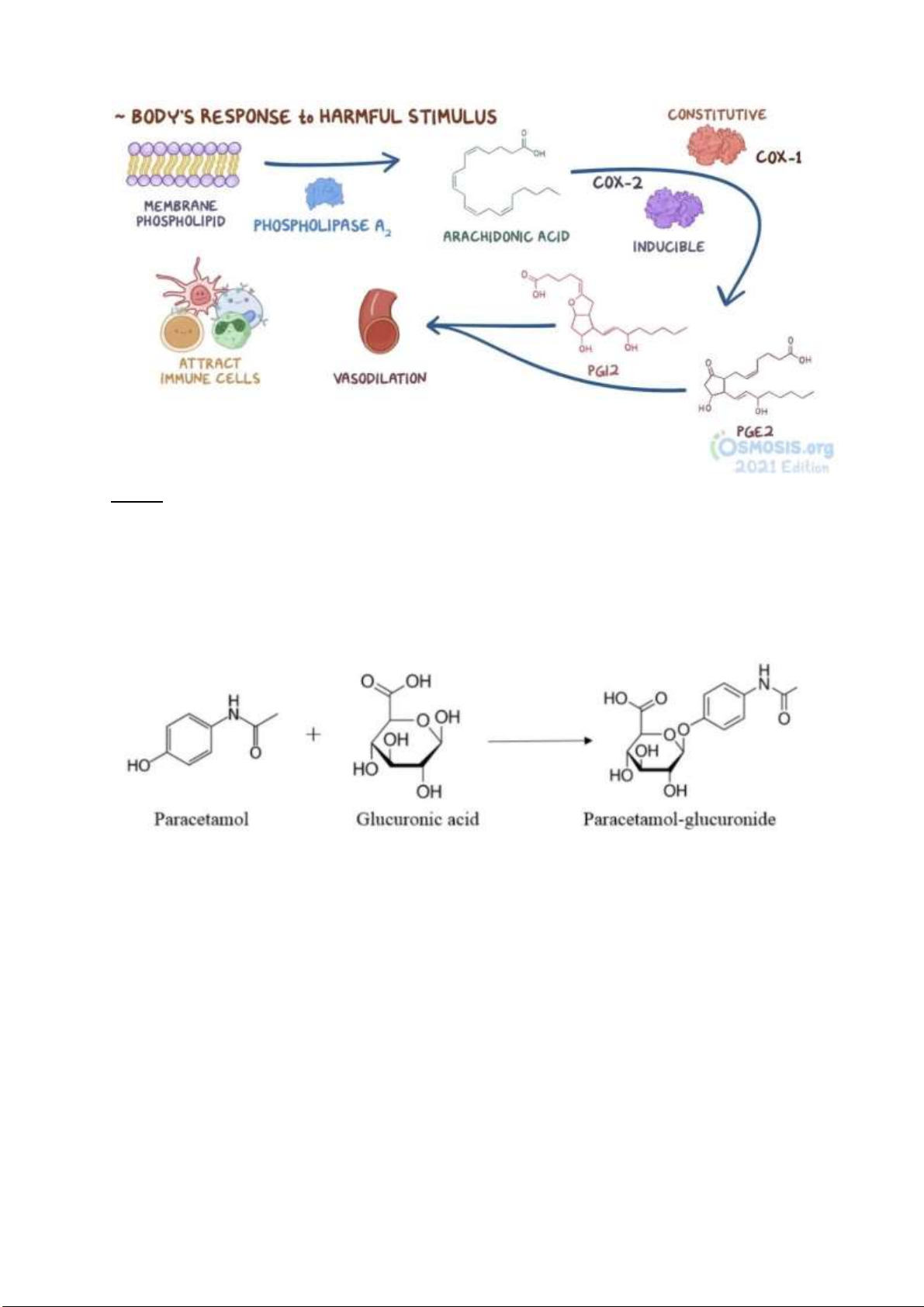
Câu 1: Quá trình chuyển hóa Paracetemol (Acetaminophen) trong cơ thể.
Paracetamol ược chuyển hóa tại gan.
95% lượng paracetamol ược chuyển thành
sản phẩm sulfat và glucuronide và ược bài tiết bởi thận.
5% lượng paracetamol bị oxi hóa bởi hệ
enzim cytochrome P450 ở gan, tạo ra
Nacetyl-p-benzo-quinone imine, viết tắt là
NAPQI. Chất này dễ phản ứng với protein
gây tổn thương tế bào. Tuy nhiên,
glutathion sẽ vô hiệu hóa chất ộc này thông
qua phản ứng cộng nhân hạch vào một imin liên hợp tạo ra sản phảm
glutathione+paracetamol vô hại. Sau ó sản
phẩm này sẽ ược ào thải qua thận.
Tuy nhiên, nếu sử dụng quá liều
paracetamol, cơ thể không có ủ glutathion
ể giải ộc các chất chuyển hóa. Điều này
gây ứ ộng NAPQI, tổn thương tế bào, ặc biệt là gan. lOMoARcPSD| 38841209
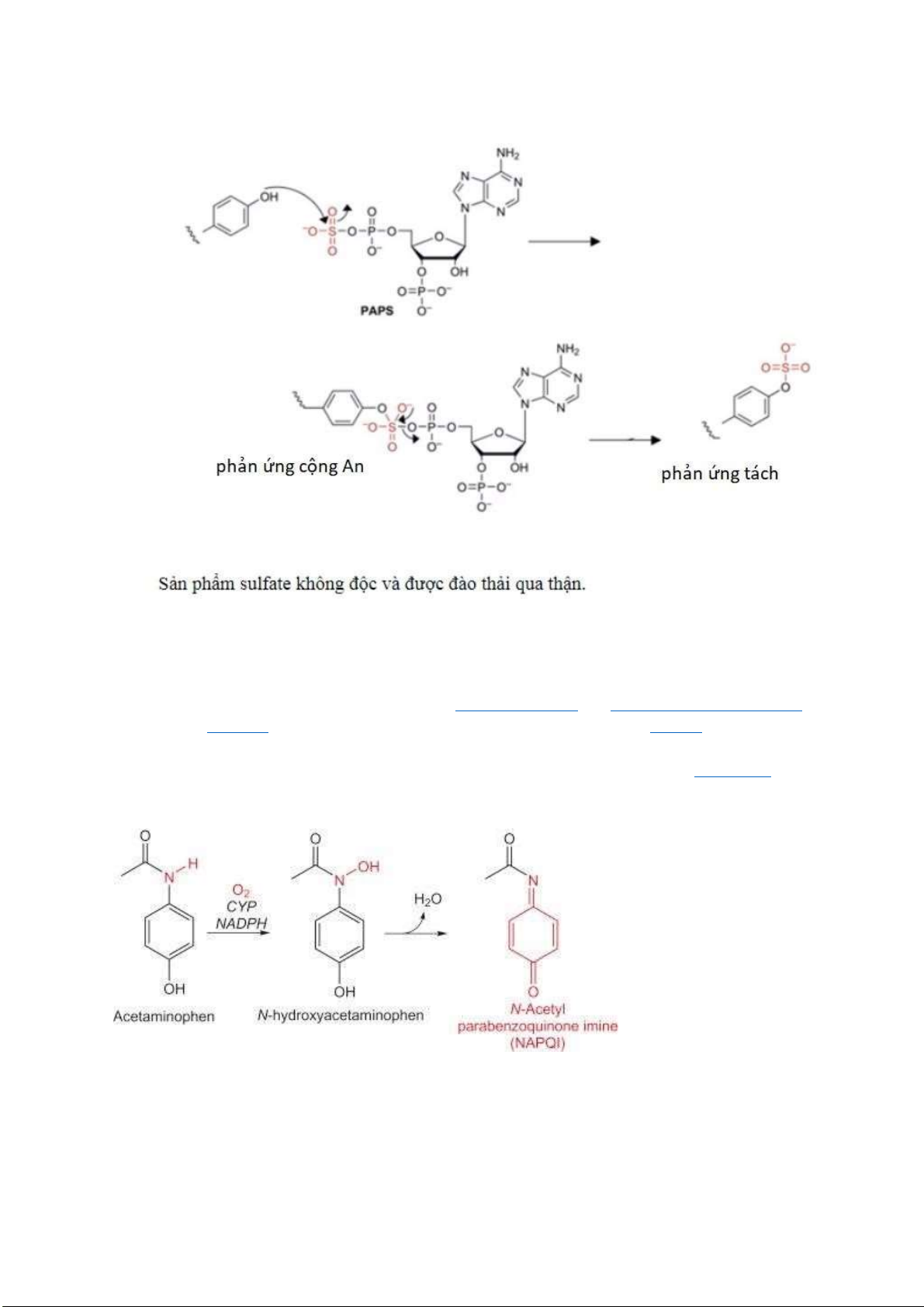
Câu 2: Viết cơ chế phản ứng ào thải paracetamol của cơ thể? -
Glucuronidation: phản ứng thế Sn2
APAP-glucuronid chiếm 55–60% lượng thuốc dùng sau liều iều trị ở người. Glucuronid hóa ược xúc
tác bởi UDP-glucuronosyl transferase (UGT). Các enzym này chuyển nhóm glucuronosyl của axit
uridine 5'-diphospho-glucuronic (axit UDP glucuronic) ến các phân tử ích, làm cho chúng dễ tan trong nước hơn. -
Sulfation: phản ứng cộng
Quá trình sulfat hóa ược xúc tác bởi các enzym sulfotransferase (SULT). Nói chung, các enzym này
chuyển một nhóm sulfo từ 3'-phosphoadenosine-5'-phosphosulfate (PAPS) sang chất nhận (APAP) lOMoARcPSD| 38841209 - Tạo NAPQI:
Enzyme cytochrome P450 xúc tác quá trình oxy hóa acetaminophen thành chất chuyển hóa phản ứng
NAPQI. Một con ường chuyển hóa nhỏ (5-10%) quá trình oxy hóa bởi các enzym cytochrom P450 ,
chủ yếu bởi CYP2E1, tạo thành một chất chuyển hóa ộc hại ược gọi là NAPQI ( N -acetyl- p
benzoquinone imine). NAPQI là nguyên nhân gây ra ộc tính trên gan của paracetamol. Ở liều
paracetamol thông thường, NAPQI ược giải ộc nhanh chóng bằng cách kết hợp với glutathione. Liên
hợp không ộc APAP-GSH ược ưa vào mật và tiếp tục bị phân hủy thành liên hợp mercapturic và
cysteine ược bài tiết qua nước tiểu. lOMoARcPSD| 38841209 -
NAPQI và Glutathion: phản ứng cộng ái nhân
Câu 3: Áp dụng cơ chế phản ứng hóa học ể giải thích nguyên nhân gây ộc của paracetamol cho
gan khi uống quá liều?
Khi qua gan, có khoảng 4% lượng paracetamol chuyển thành N-acetyl benzoquinonimin là chất ộc gây
hoại tử gan không hồi phục. Nhờ có glutathion của gan, N-acetyl benzoquinonimin ược chuyển hóa
thành chất không ộc ào thải ra ngoài. Do ó, mỗi lần dùng paracetamol (dù ở liều thông thường), cơ thể
sẽ mất một lượng glutathion. Khi dùng quá liều paracetamol (người lớn 6 - 10g/ngày), gan không ủ
lượng glutathion ể giải ộc, N-acetyl benzoquinonimin tích lại sẽ phân hủy tế bào gan, dẫn ến hoại tử
không hồi phục, nhiễm toan chuyển hóa, hôn mê có thể dẫn ến tử vong.
NAPQI và protein: phản ứng cộng ái nhân
Câu 4: Xác ịnh loại rối loạn cân bằng? Giải thích? lOMoARcPSD| 38841209
Lactate tăng nhiễm toan chuyển hóa acid lactic
Abnormal accumulation of endogenous organic acids is one broad mechanism that gives rise to
metabolic acidosis, which is differentiated from other mechanisms by being associated with high anion
gap. The most common endogenous organic acid metabolic acidosis are: lactic acidosis (accumulation
of lactic acid) and ketoacidosis (accumulation of ketoacids).
Rarer causes of high anion gap metabolic acidosis due to organic acid accumulation are those that result
from ingestion of a toxic substance whose metabolism involves production of an organic acid. For
example, the toxicity of ethylene glycol is due in part to its metabolism to oxalic acid and the metabolic
acidosis that results from accumulating oxalic acid.
Việc tiêu thụ khối lượng lớn acetaminophen (N-acetyl-
paminophenol; APAP) ược ặc
trưng bởi sự khởi phát nhanh chóng
của rối loạn chức năng ty thể. Ở ti
thể, Oxy hóa glucose và lactate tạo
ra pyruvate trong tế bào chất. Trong
cơ tim khỏe mạnh, sự tổng hợp
pyruvate từ 2 nguồn oxy hóa
glucose và oxy hóa lactate là ngang
nhau Ty thể rối loạn nên giảm i
khả năng oxy hóa lactate và glucozo
dẫn ến bị tích tụ lại dẫn ến chỉ số cao.
Khi cơ thể một người xuất hiện tình
trạng tăng áng kể nồng ộ acid lactic trong máu (hay tăng lactate) có thể tiến triển thành nhiễm acid
lactic. Tình trạng nhiễm acid lactic nghiêm trọng có thể dẫn ến sự phá vỡ cân bằng của axit và bazo, gây
ra các triệu chứng như buồn nôn, nôn, ổ mồ hôi, thậm chí hôn mê.
Với tình trạng Glucose máu tăng kéo dài có thể xuất hiện các biến chứng nguy hiểm ến nhiều cơ quan
trong cơ thể, gây nên một số bệnh lý như: Các bệnh về tim: xơ vữa ộng mạch, nhồi máu cơ tim, ột
quỵ,… Suy thận: bởi lượng Glucose quá cao làm làm tổn thương cầu thận, dần dần gây viêm cầu thận
mạn dẫn tới suy thận.
Chỉ số AST và ALT là chỉ số men gan. Khi chỉ số này cao thường là do gan bị tổn thương do nhiều
nguyên do. Chỉ số ALT cao cho thấy gan bị tổn thương do chất ộc. giảm khả năng chuyển hóa acid lactic lOMoARcPSD| 38841209
Câu 5: Giải thích các tác dụng iều trị của IV NAC, 4-MP và HD trong case này? - NAC:
• (1) thúc ẩy chuyển hóa paracetamol theo con ường sulfat (con ường không gây ộc) ể giảm quá
trình chuyển hóa theo con ường NAPQI
• (2) là tiền chất của glutathione (tạo ra cysteine là 1 trong 3 amino acid tạo thành glutathione)
• (3) giống như glutathione trong việc chuyển NAPQI thành chất không ộc (vì NAC cũng có nhóm -SH) lOMoARcPSD| 38841209
• (4) có lợi cho tình trạng suy gan bằng các
cơ chế không ặc hiệu, ví dụ cải thiện vi tuần hoàn của gan
- 4-MP: Là chất ối kháng cạnh tranh của alcohol
dehydrogenase và chất ức chế mạnh CYP450 2E1
ược sử dụng trong iều trị ngộ ộc ethylene glycol và
methanol. Sử dụng 4-MP dẫn ến ức chế sự hình
thành các liên hợp APAP-glutathione, làm giảm sự
suy giảm dự trữ glutathione ở gan và ngăn ngừa sự
chết tế bào gan người do APAP gây ra. 4-MP ức chế
CYP450 giảm quá trình hình thành NAPQI.
Các lợi ích bao gồm chế ộ dùng thuốc ơn giản,
không cần theo dõi nồng ộ trong huyết thanh, chỉ số
iều trị rộng hơn, thời gian tác dụng dài hơn và ộng học dễ oán hơn.
- HD: HD tăng gấp ôi ộ thanh thải APAP, và giảm
thời gian bán thải của APAP giảm từ 5,2 giờ xuống 1,9 giờ.
HD còn giải quyết ược rối loạn chuyển hóa các chất
khác trong cơ thể. Độ thanh thải của NAC cũng
tăng lên khi HD và do ó, tốc ộ truyền khuyến cáo
ược tăng lên hai ến ba lần khi bệnh nhân ang sử dụng HD.
Câu 6: Giải thích tại sao phải d甃ng liều cao NAC?
Các yếu tố ảnh hưởng tốc ộ phản ứng:
+ Nồng ộ: Khi tăng nồng ộ chất phản ứng, tốc ộ phản ứng tăng.
+ Áp suất: Đối với phản ứng có chất khí, khi tăng áp suất, tốc ộ phản ứng tăng.
+ Nhiệt ộ: Khi tăng nhiệt ộ, tốc ộ phản ứng tăng.
+ Diện tích bề mặt: Khi tăng diện tích bề mặt chất phản ứng, tốc ộ phản ứng tăng. Chất xúc tác (xúc
tác dương) là chất làm tăng tốc ộ phản ứng, nhưng giữ nguyên sau khi phản ứng kết thúc.
NAC là một loại thuốc giải ộc hiệu quả ối với ngộ ộc APAP. Khi ược quản lý sớm sau một quá liều
APAP cấp tính, NAC cung cấp cysteine ể bổ sung và duy trì dự trữ glutathione ở gan, tăng cường con
ường ào thải sulfat và có thể trực tiếp giảm NAPQI trở lại acetaminophen. Các tác dụng có lợi khác bao
gồm loại bỏ các loại oxy và nitơ phản ứng và cải thiện sản xuất năng lượng của ty thể.
Dùng liều cao chính là tăng nồng ộ dẫn ến tốc ộ phản ứng tăng, bệnh nhân ang trong tình trạng
nguy kịch nên cần chữa trị một cách nhanh chóng ể tránh kết quả áng tiếc, bên cạch ó ể trung hòa
hoàn toàn lượng dư chất ộc trong gan.
Khi dùng kết hợp với chạy thận, bên cạnh ào thải APAP thì chạy thận còn ào thải NAC phải tăng
liều NAC ể duy trì nồng ộ cần thiết trong iều trị lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 THUỐC GIÃN CƠ
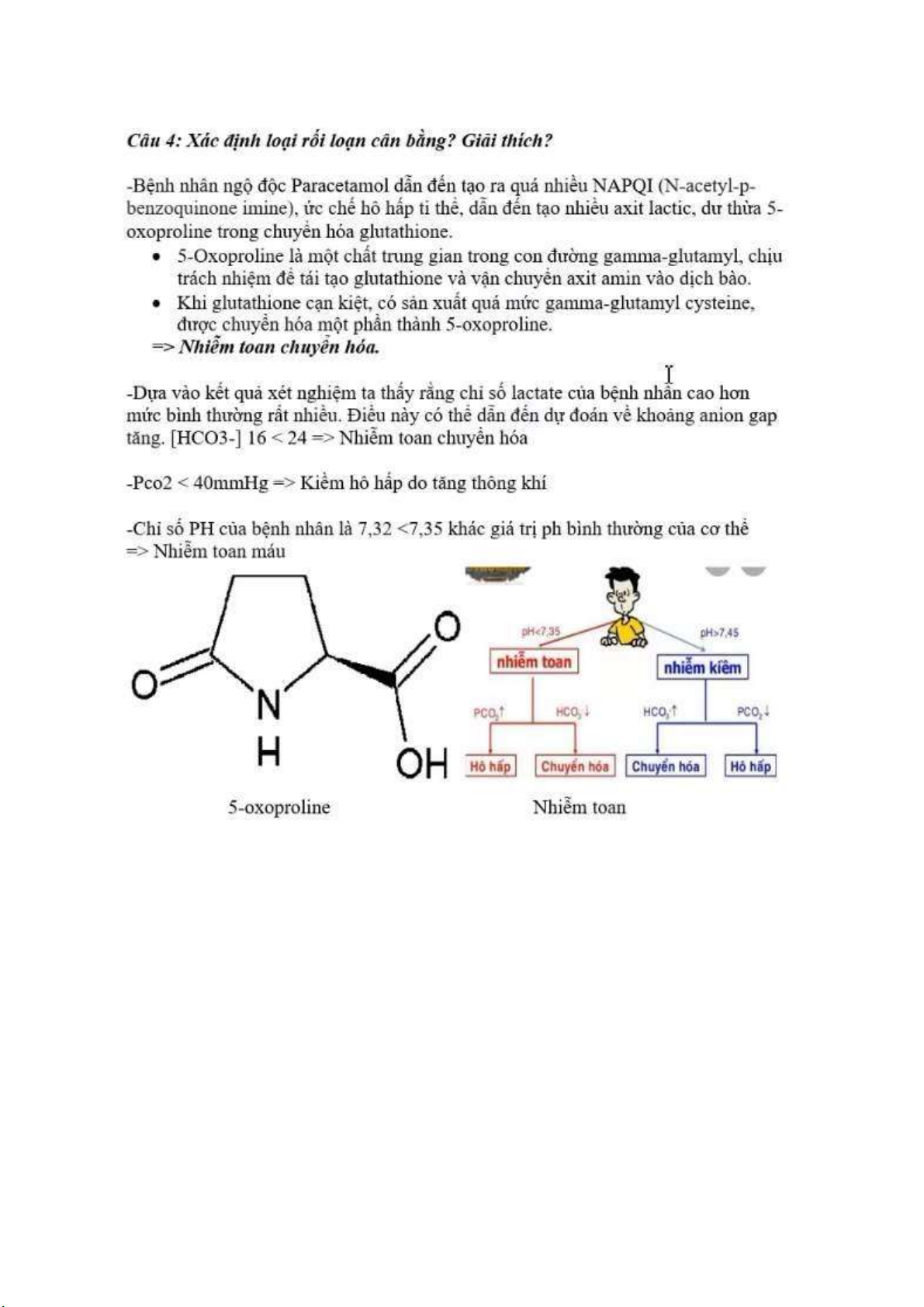
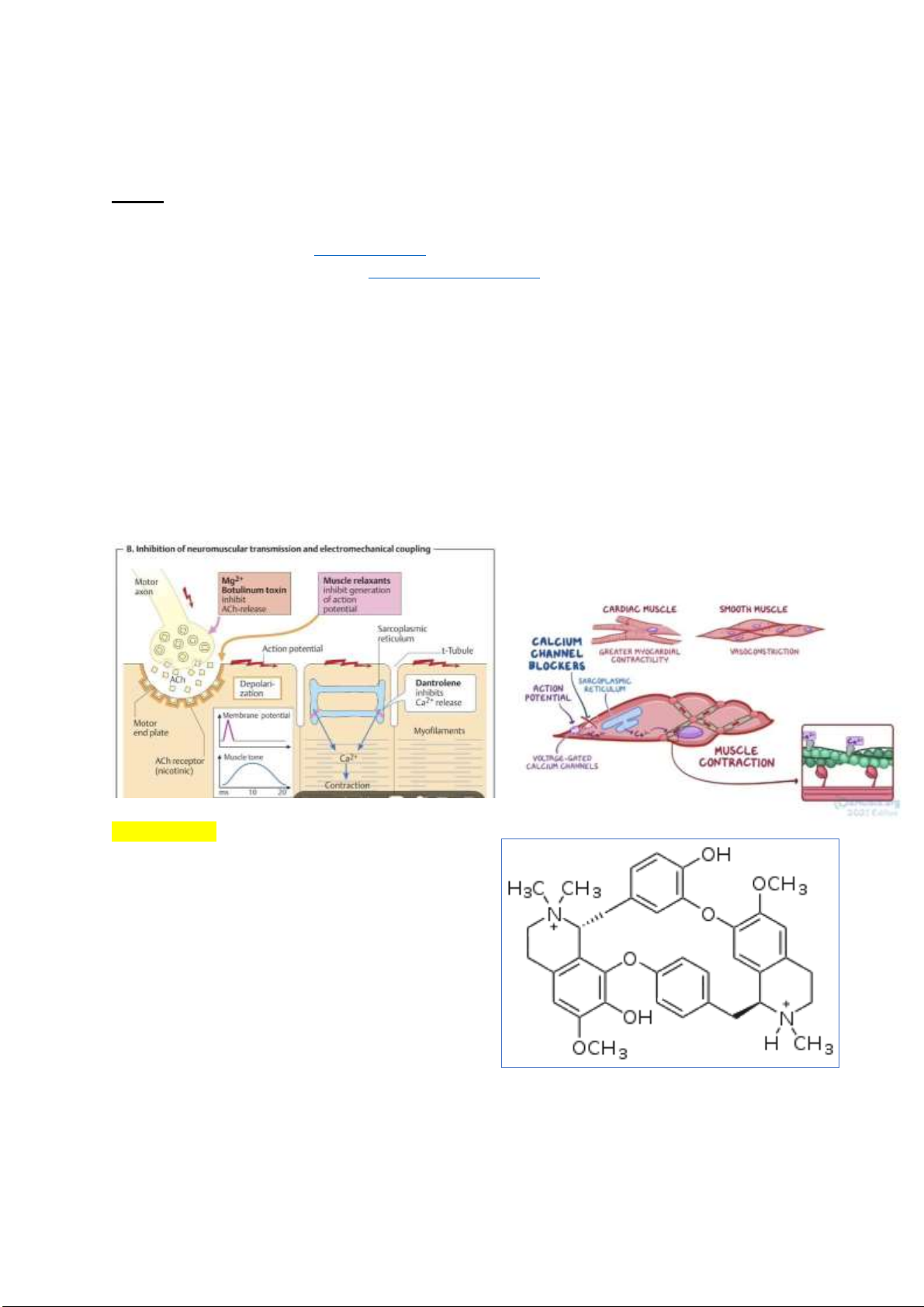
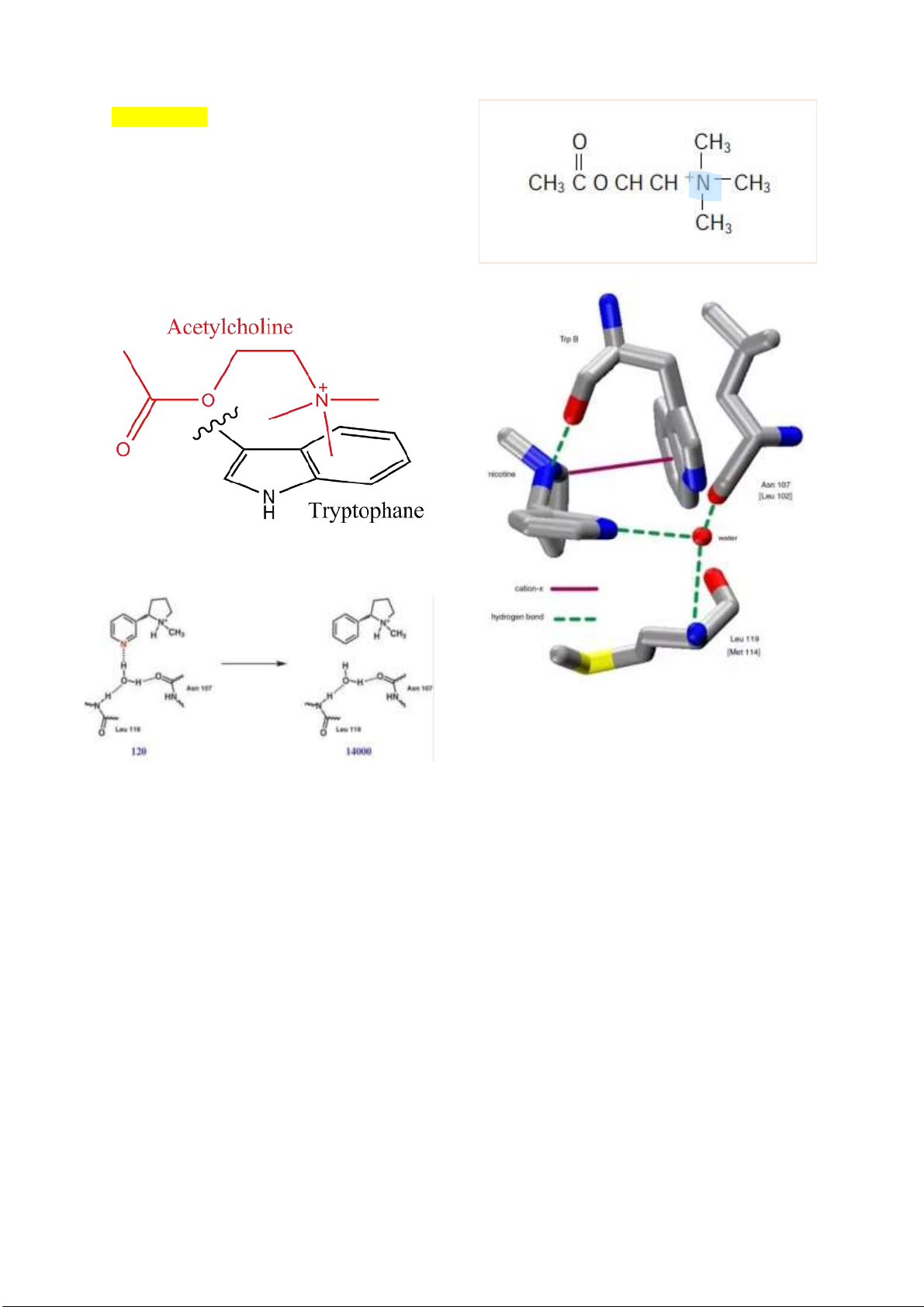
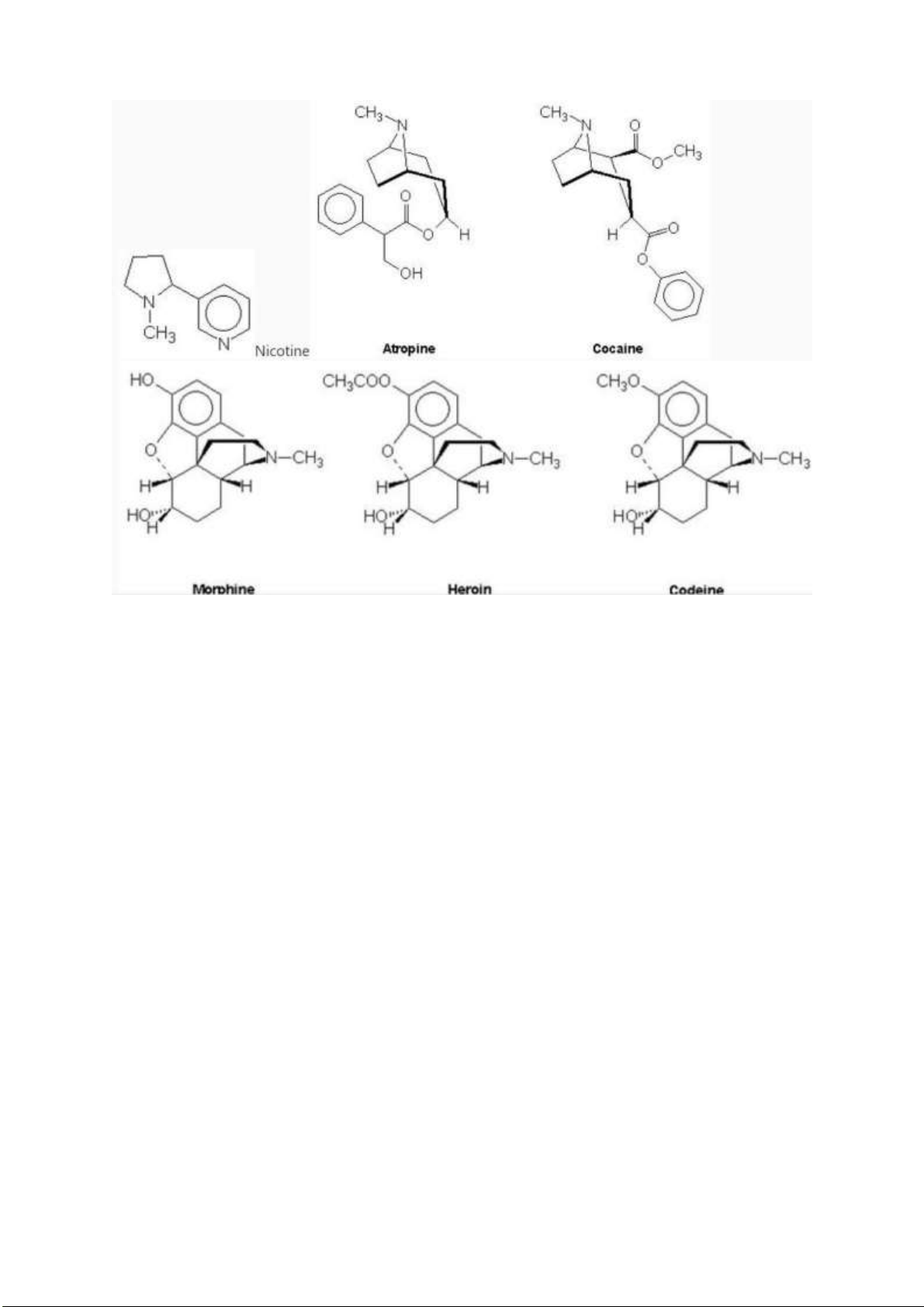
Câu 1: Vai trò của acetyl choline là gì? Xác ịnh cấu trúc của các hợp chất trên. So sánh cấu trúc của
các chất này với cấu trúc của acetylcholine, từ ó nhận xét gì về hoạt tính giãn cơ của chúng?
Acetylcholine (ACh) là một hợp chất hữu cơ có trong não và cơ thể của nhiều loại ộng vật, bao gồm
cả con người, nó có chức năng là một chất dẫn truyền thần kinh—một hóa chất ược các tế bào thần kinh
giải phóng ra ể gửi tín hiệu ến các tế bào khác.
Khi xung thần kinh tới ĩa synapse trước, ACh ược tiết ra từ các nang và khuếch tán vào khe synapse.
Tới ĩa synapse sau, ACh ược gắn vào các trung tâm thụ cảm (receptor) ở ĩa này và làm tăng tính thấm
của màng ối với các tế bào ion, do ó iện trở của màng giảm i và dòng Ion Na+ sẽ i vào trong tế bào,
làm màng synapse sau bị khử cực. Mức ộ khử cực của màng synapse sau ủ ể sinh ra một dòng iện tại
chỗ có giá trị lớn hơn ngưỡng cần thiết ể gây nên trạng thái hưng phấn các tế bào lân cận. Do ó, iện thế
hoạt ộng ược lan truyền trên sợi thần kinh ã ược truyền sang tế bào cơ và tiếp tục lan theo mọi hướng,
kết quả là gây ra hiện tượng co cơ.
Kênh canxi mở ra khi nhận t hoạt ộng, giúp canxi i vào tế bào. Canxi ngoại bào gây giải phóng canxi
nội bào trong mạng lưới nội chất. Các canxi này sau ó liên kết với protein iều hòa, thay ổi hình dạng,
giải phóng các sợi mỏng trong sợi cơ. Cho phép sợi mỏng liên kết với sợi dày giúp co cơ. D-tubocurarine
Là chất ức chế cạnh tranh với acetylcholine
acetylcholine không thể bám vào receptor và không
thể gây ra hiện tượng khử cực, co cơ. D-tucocurarin
bám vào nicotin acetylcholine receptor tốt hơn
acetylcholine. Tuy nhiên, nó không kích thích mở
kênh ion cho Na+ i vào nên không gây ra ược hiện
tượng khử cực không thể co cơ. lOMoARcPSD| 38841209 Acetylcholine Trong NACR, có tryptophan ể liên kế t
acetylcholine. Tryptophan có một nhóm chức thơm,
v ớ i m ật ộ iệ n t ử cao. Do ó, iện tích dương trên
nitơ cation của phân tử ều có ái lự c v ớ i tryptophan
m ật ộ iệ n t ử cao, do ó góp phần vào. Đây ượ c
g ọi là tương tác cation– π .
Xanh dương: nito; Đỏ: Oxi; Vàng: lưu h u ỳ nh lOMoARcPSD| 38841209 lOMoARcPSD| 38841209
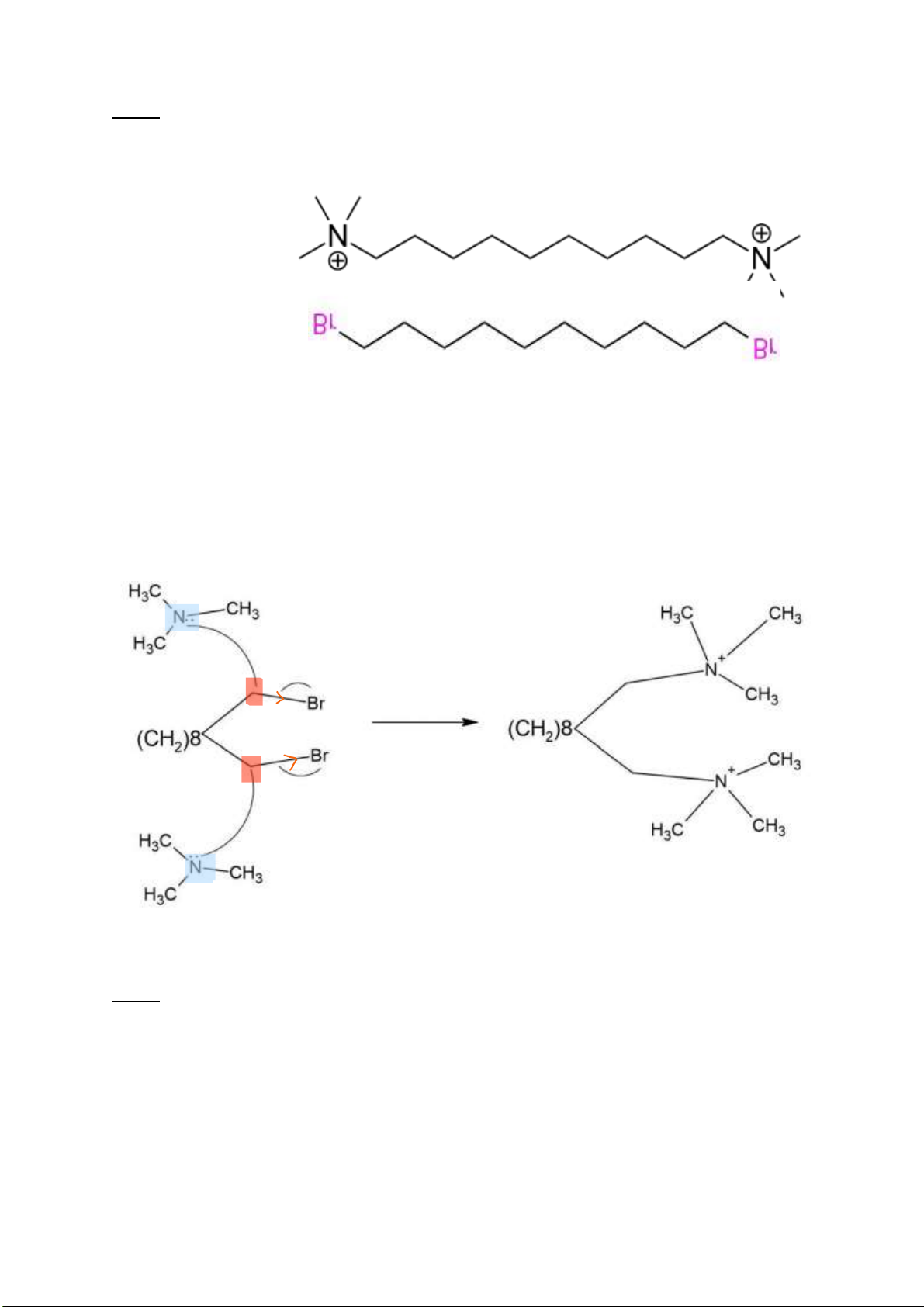
Câu 2: Xác ịnh cấu trúc của decamethonium? Viết phản ứng tổng hợp decamethonium từ
(CH2)10Br2. Phản ứng này thuộc loại phản ứng nào? Chỉ ra trung tâm phản ứng, tác nhân phản ứng? Decamethonium (CH2)10Br2 Br Br
Phản ứng tổng hợp decamethonium từ (CH2)10Br2
Hiệu ứng cảm làm Br hút electron của Cacbon các tác nhân Nu có khuynh hướng tấn công vào
Cacbon là trung tâm dương iện.
Ở trimetylamin, trên Nito còn 1 cặp e chưa liên kết (tác nhân Nu) nên dễ dàng tham gia phản ứng thế SN
Chất nền ban ầu bậc 1 ưu tiên xảy ra SN2
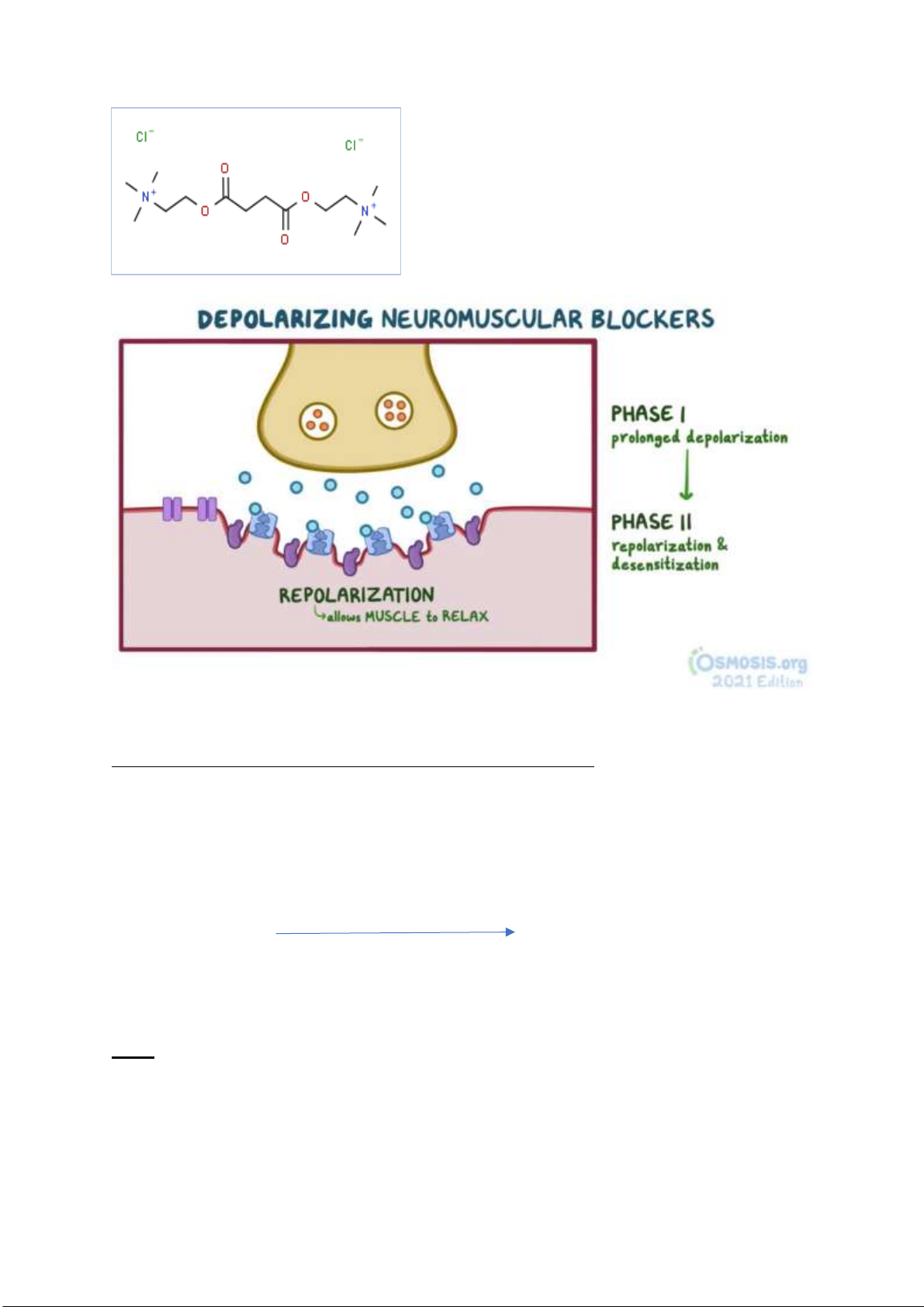
Câu 3: Xác ịnh cấu trúc của suxamethonium? Phân tích ặc iểm cấu trúc của suxamethonium và
decamethonium ể giải thích ưu iểm “tác dụng ngắn, dễ loại bỏ” của suxamethonium so với
decamethonium (viết phản ứng nếu có)?
Suxamethonium là thuốc chẹn thần kinh - cơ khử cực. lOMoARcPSD| 38841209
Các thuố c ch ẹ n th ầ n kinh - cơ khử c ự c c ạ nh tranh v ớ i
acetylcholin ở th ụ th ể cholinergic t ạ i b ả n v ận ộng và
cũng như acetylcholin, chúng gắn vào các thụ th ể ó gâ y
nên khử c ực. Tuy nhiên, do ái lự c cao v ớ i th ụ th ể
cholinergic và tính kháng acetylcholinesterase, thuốc gây
kh ử c ực kéo dài hơn acetylcholin.
Chúng kháng acetylcholinesterase nên không chuyển hóa
và vẫ n b ị ràng buộ c. K ế t qu ả là, quá trình khử c ự c c ủa cơ
sẽ tồn tại trong một thời gian dài hơn mà không ể cho lớp cuối tái cực. Nó dẫn ến co cứng cơ và tê liệt
của bệnh nhân. Cuối cùng, cơ trở nên thư giãn.
Tác dụng ngắn, dễ loại bỏ của suxamethonium so với decamethonium:
Suxamethonium có cấu trúc hầu như giống với Decamethonium nhưng có một iểm khác biệt quan
trọng ó là Suxamethonium có 2 gốc thủy phân ược là 2 gốc este. Trong khi ó nối este có thể dễ dàng
thủy phân trong cơ thể với tốc ộ nhanh
Suxamethonium butyrylcholinesterase Succinylmonocholine
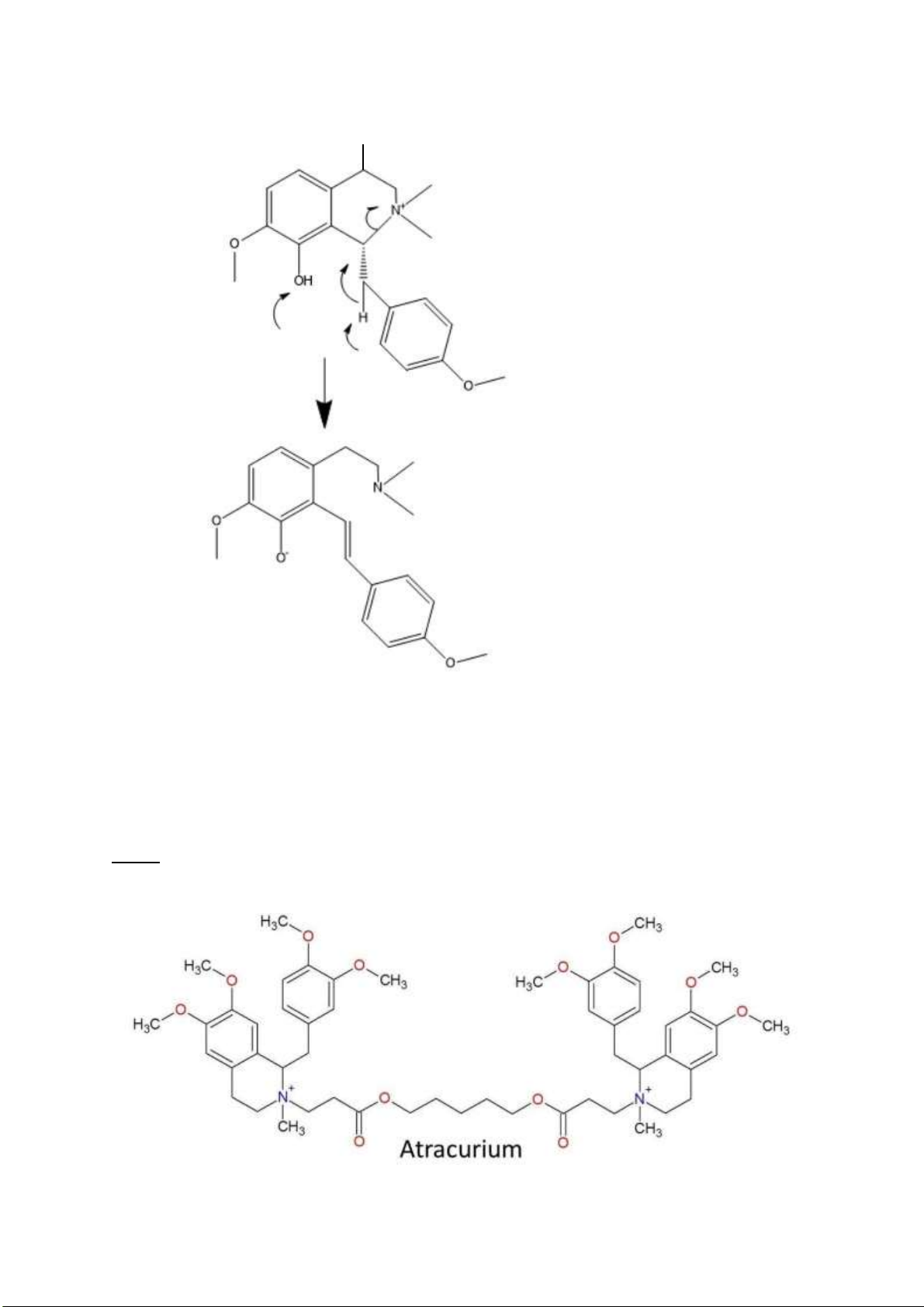
Câu 4: Petaline có cấu trúc như thế nào? Tại sao có thể tự phân hủy Hofmann trong iều kiện kiềm nhẹ
(viết phản ứng nếu có)? lOMoARcPSD| 38841209 H* trên *
Ha có hiệu ứng siêu liên hợp lên vòng benzen H trở nên linh ộng hơn rất nhiều xảy ra phản ứng
tách Hoffmann trong iều kiện kiềm nhẹ.
Tấn công vào H ở phía dưới tạo hệ liên hợp dài và bền hơn ưu ãi tách H phía dưới hơn H phía trên.
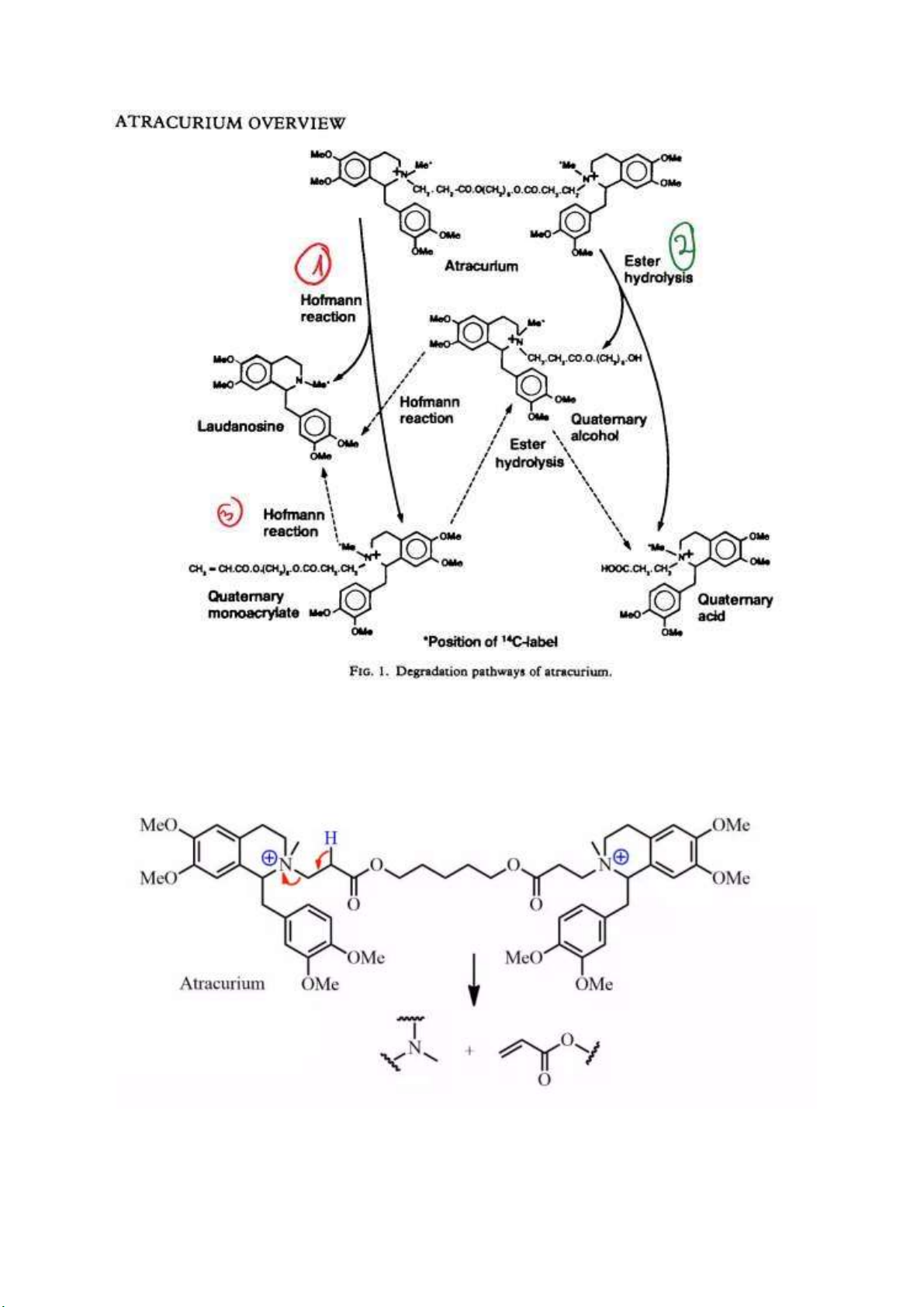
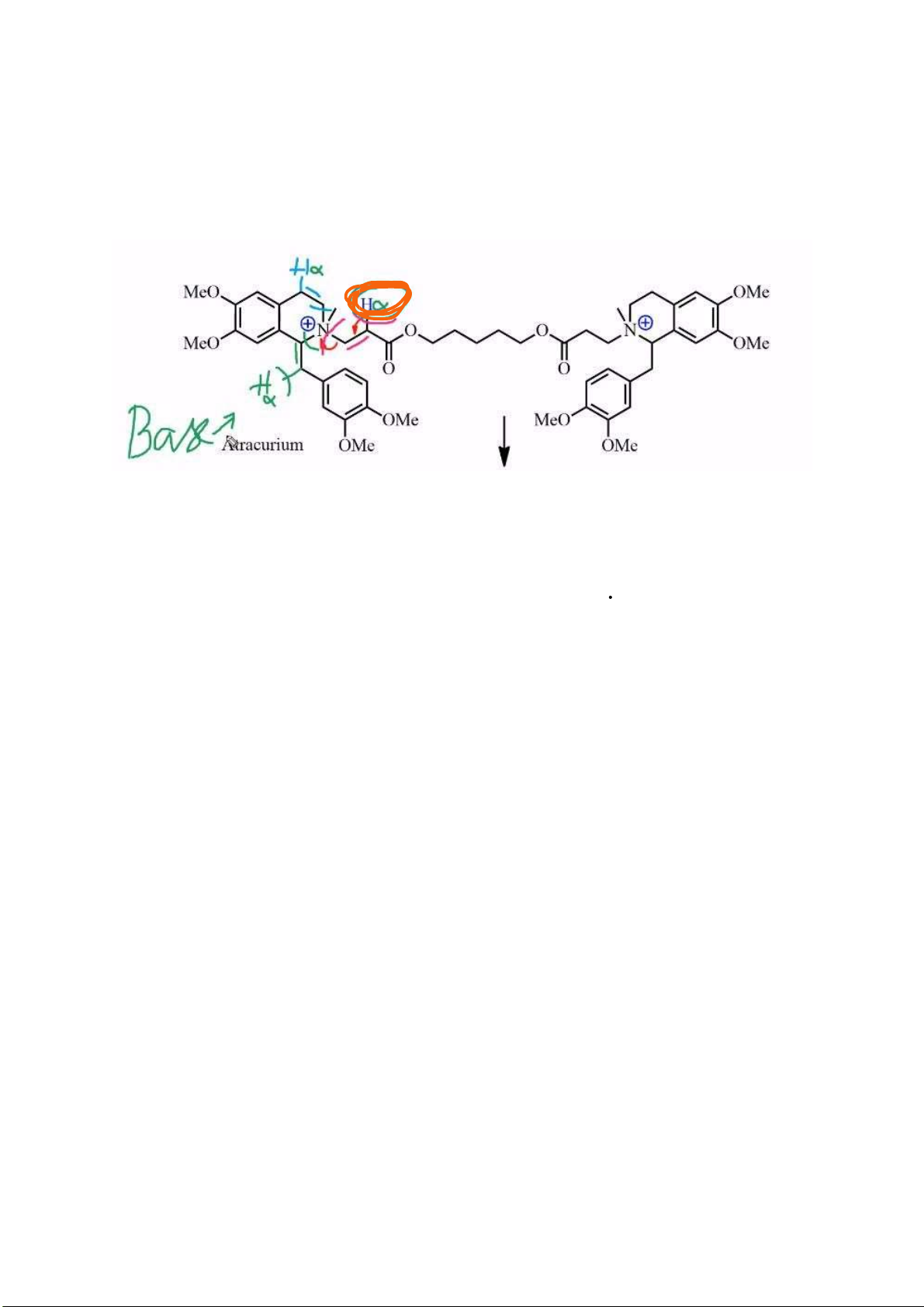
Câu 5: Atracurium có cấu trúc như thế nào? Phân tích cấu trúc, viết phản ứng ào thải của atracurium
từ ó giải thích ưu iểm “tác dụng ngắn, dễ loại bỏ không bị ảnh hưởng bởi bệnh nhân bị suy gan hoặc
suy thận” của atracurium? lOMoARcPSD| 38841209
Có hiệu ứng siêu liên hợp C=O nên H rất linh ộng
So sánh với Pentaline: siêu liên hợp vòng benzene (là chỉ có Cacbon) làm cho H ít linh ộng hơn
C=O iều kiện cần kiềm nhẹ trong khi atracurium thì có phân hủy Hoffmann trong iều kiện sinh lý
bình thường của cơ thể. lOMoARcPSD| 38841209
Atracurium không bị ảnh hưởng bởi bệnh nhân suy gan, suy thận vì Atracurium có thể ào thải theo 2
con ường: tách loại Hoffman (không phụ thuộc vào enzim, men, cơ ịa); thủy phân este (phụ thuộc vào
enzim esterase, men,…). Bệnh nhân bị suy gan, suy thận thì lượng men không ủ ể thủy phân este
vẫn ào thải bằng con ường Hoffman iểm nổi bật của Atracurium.
*Có 3 H alpha có thể tách Hoffmann (bên cạnh cái trên còn có H xanh dương và H xanh lá, nhưng
xanh dương và xanh lá muốn tách thì cần base nhẹ giống trường hợp pentalene).
XƠ VỮA ĐỘNG MẠCH LÝ DO HỌC
Xơ vữa ộng mạch là một tình trạng bệnh lý trong ó thành các ộng mạch bị tổn thương dẫn tới tạo
thành các mảng xơ vữa gây hẹp lòng các ộng mạch. Hẹp ộng mạch vành nuôi tim, hẹp ộng mạch não,
ộng mạch thận, hẹp các ộng mạch ngoại biên nếu nặng sẽ gây những hậu quả nghiêm trọng. Ban ầu có
thể người bệnh không có triệu chứng nhưng theo thời gian sẽ dẫn ến bệnh ộng mạch vành (thiếu máu,
nhồi máu cơ tim), cao huyết áp, ột quỵ, suy thận, bệnh ộng mạch ngoại biên.
Tháng 12/2020 Tổ chức y tế thế giới công bố 10 nguyên nhân gây tử vong hàng ầu trên thế giới kể
cả Việt nam. Hai nguyên nhân xếp hạng thứ 1 và 2 là bệnh ộng mạch vành và ột quỵ. Điều này cho
thấy xơ vữa ộng mạch là một bệnh lý rất quan trọng ối sức khoẻ con người và là mối quan tâm hàng ầu của ngành y tế.
Ca lâm sàng xơ vữa ộng mạch ược chọn là ca lâm sàng cơ bản ược học trong nhiều năm, bắt ầu từ
năm 1 ến năm 6. Trong phạm vi module 1: Từ phân tử ến tế bào của năm thứ 1, sinh viên sẽ vận dụng
những kiến thức cơ bản về lý sinh, hoá, hoá sinh, sinh học di truyền ể hiểu ược nguyên nhân gây
bệnh, giải thích sinh bệnh học, giải thích các triệu chứng lâm sàng, cận lâm sàng (kết quả xét
nghiệm), và hiểu ược những iều trị liên quan ến bệnh này.
MỤC TIÊU HỌC TẬP
Sau khi học tình huống lâm sàng này, sinh viên có thể áp dụng kiến thức hoá học vào giải thích cơ chế
tác dụng và hiệu quả của thuốc iều trị dựa trên cấu tạo hoá học của thuốc. lOMoARcPSD| 38841209
TÀI LIỆU HỌC TRƯỚC TẠI NHÀ
1. MMR Siddiqui, SS Binte Mosharraf, RS Giasuddin, N Islam, S Mirza. What is new in
new generation clacium blocker. AKMMC J 2019; 10(1) : 77-83.
2. Coronary angiography. Lesson 1: coronary artery anatomy. Xem ường link:
https://www.youtube.com/watch?v=dHFENbh1tKM
3. Lipid and Lipoprotein Basics Thomas Dayspring MD, FACP, FNLA
https://www.lipidcenter.com/pdf/Lipid_and_Lipoprotein_Biochemistry.pdf
4. Cilnidipine: A New Generation Ca2+ Channel Blocker with Inhibitory Action on
Sympathetic Neurotransmitter Release. Akira Takahara Department of
Pharmacology, Toho University Faculty of Pharmaceutical Sciences, 2-2-1 Miyama,
Funabashi, Chiba 274-8510, Japan.
5. High-density lipoprotein metabolism and reverse cholesterol transport: strategies for
raising HDL cholesterol. Katerina Tosheska Trajkovska, Sonja Topuzovska Institute
of Medical and Experimental Biochemistry, Medical Faculty-Skopje University,
SS.Cyril and Methodius; Skopje-Republic of Macedonia.
6. Identification and Ligand-based Virtual screening of 1, 4- Dihydropyridine Analogues
as Novel Calcium Channel Blockers. International Journal of Research
Studies in Biosciences (IJRSB). Santosh Kumar Singh , Pradeep Kumar Naik , Naveen
Kumar Vishwakarma , Vineeta Dixit , A. K. Tiwari , Dhananjay Shukla.
7. SpO2 https://www.facebook.com/hoai.dangvan.77
8. Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca2+
Channel. Yanyu Zhao, Gaoxingyu Huang, Jianping Wu, Qiurong Wu, Shuai Gao, Zhen
Yan, Jianlin Lei, and Nieng Yan.
CÁC KHÁI NIỆM CẦN TÌM HIỂU
1. Xơ vữa ộng mạch (artheroslerosis)
2. Bệnh ộng mạch vành (coronary artery disease: CAD) 3. Đột quỵ (stroke)
4. Thiếu máu cơ tim (myocardial ischemia)
5. Phình ộng mạch chủ (aortic aneurysm)
6. Thuốc ức chế kênh calium (CCB = Calcium Chanel Blocker) CA LÂM SÀNG
Bà C 56 tuổi i khám vì nhức ầu và yếu toàn thân. Bà bị cao huyết áp 6 năm nay. Bà nói ã uống thuốc
hạ huyết áp Amlodipine, huyết áp có giảm nhưng bà ngừng vì các tác dụng phụ nhức ầu,phù khiến bà
khó chịu. Sau ó huyết áp bà vẫn cao dao ộng từ 150-155/100-110 (bình thường < 140/90 mmHg).
Thỉnh thoảng au ngực trái thoáng qua khoảng 1 phút khi làm việc gắng sức, nghỉ ngơi thì hết.
Bà làm nghề thợ may. Mẹ và ông bà ngoại của bà cũng cao huyết áp, mẹ bà mất năm 56 tuổi vì cao
huyết áp và bệnh ộng mạch vành. Bà có chồng và 2 con ã lớn 18 và 15 tuổi. Trong nhà không ai hút thuốc. lOMoARcPSD| 38841209
Bà C không tập thể dục, vì cho rằng ã làm việc nhà nhiều, không hút thuốc, ăn uống thoải mái, không kiêng cử.
Bà cao 155 cm, nặng 68 kg, BMI = 28,3 (bình thường < 25). Mạch 80 lần/phút, ều rõ ở chi trên và
dưới. Huyết áp 160/100 mmHg. Nhiệt ộ 37oC. Thở ều 18 lần/phút (bình thường < 20 lần/phút).
SpO2 = 98% (bình thường > 95%). Nghe ược âm thổi ở vùng cạnh cổ bên trái bằng ống nghe. Khám
các cơ quan bình thường. Xét nghiệm máu
- Natri 138 mEq/L (bình thường 135-147 mEq/L)
- Kali 3,4 mEq/L (bình thường 3,5-5 mEq/L)
- Urea nitrogen (BUN) 19 mg/dL (bình thường 10-20 mg/dL)
- Calcium 9,8 mg/dL (8,8-10 mg/dL)
- Creatinine 0,9 mg/dL (0,35 to 0,93 mg/dL)
- Total cholesterol 268 mg/dL (bình thường < 245 mg/dL), LDL (low density lipoprotein) =
190 mg/dL (bình thường < 100 mg/dL)
- Triglycerides 230 mg/dL (bình thường < 160 mg/dL)
- Glucose 105 mg/dL (70-110 mg/dL).
Tổng phân tích nước tiểu bình thường.
Điện tâm ồ cho thấy hình ảnh thiếu máu cơ tim thất trái.
X quang ngực cho thấy phổi bình thường, và bóng tim bất thường với cung ộng mạch chủ phồng.
Siêu âm tim: có hình ảnh giảm ộng vùng vách liên thất oạn giữa. lOMoARcPSD| 38841209 LC RC Cx LA
Hình phân bố máu từ ộng mạch vành nuôi các vùng cơ tim ược mã hoá màu tương xứng.
RCA: right coronary artery ( ộng mạch vành phải)
LCA: left coronary artery ( ộng mạch vành trái)
LAD: left anterior descending (nhánh trước xuống trái xuất phát từ ộng mạch vành trái) Cx:
circumflex (nhánh ộ mũ xuất phát từ ộng mạch vành trái)
Siêu âm mạch máu v甃ng cổ 2 bên, mạch máu bụng thấy có một mảng xơ vữa d = 5 x 6 mm ở ộng
mạch cảnh bên trái và 4 mảng xơ vữa d # 5 mm ở ộng mạch chủ bụng.
Chụp iện toán cắt lớp nhiều lát cắt mạch vành và mạch máu ngực thấy: hẹp nhánh ộng mạch
trước xuống trái # 70% và hẹp nhánh ộng mạch vành trái 30%; túi phình ở ộng mạch chủ ngực oạn
xuống, kích thước d = 25 mm. lOMoARcPSD| 38841209 Bác sĩ chẩn oán
Béo phì + Tăng cholesterol máu
Cao huyết áp – Phình ộng mạch chủ ngực
Bệnh ộng mạch vành – Thiếu máu cơ tim Bác sĩ iều trị
- Giải thích cho bà C rằng các mảng xơ vữa ộng mạch ã gây hẹp ộng mạch vành, dẫn tới giảm
tưới máu nuôi cơ tim, cơ tim vùng thiếu máu nuôi giảm co bóp; hẹp ộng mạch cảnh dẫn ến
thiếu máu lên não, hẹp ộng mạch chủ bụng.
- Tham vấn cho bà C chế ộ ăn uống của người béo phì, cao huyết áp và chế ộ tập luyện, vận ộng.
- Cho thuốc hạ huyết áp: Enalapril và Furosemide.
- Cho thuốc hạ mỡ máu, thuốc dãn mạch vành.
Sau 3 tháng iều trị, huyết áp bệnh nhân không cải thiện, tình trạng au ngực có chiều hướng tăng lên,
nhiều cơn au hơn và cơn au kéo dài hơn lan ra sau lưng, bác sĩ cho kiểm tra lại các xét nghiệm thấy
total cholesterol và LDL giảm nhẹ, CT scan mạch máu ngực cho thấy kích thước túi phình ộng mạch chủ ngực tăng lên.
Bác sĩ ổi thuốc hạ áp Enalapril sang thuốc hạ áp ức chế calcium thế hệ IV là Cilnidipine và hội chẩn
với bác sĩ tim mạch can thiệp và ngoại lồng ngực. lOMoARcPSD| 38841209
CÂU HỎI THẢO LUẬN
1. Dựa trên cấu tạo hoá học giải thích sự khác biệt giữa 2 thuốc ức chế calcium thế hệ III
(Amlodipine) và thế hệ IV (Cilnidipine), dẫn ến sự khác biệt trong iều trị hạ huyết áp cho bệnh nhân.
2. Cấu trúc hoá học của Cilnidipine có giúp bệnh nhân tránh ược các tác dụng phụ không?
3. Trình bày cấu trúc hóa học, tính chất vai trò của LDL và HDL trong cơ thể. Nhận xét chỉ số
LDL trong kết quả xét nghiệm cận lâm sàng của bệnh nhân.
4. Trình bày nội dung liên quan SpO2.
5. Tại sao có mảng xơ vữa ở ộng mạch cảnh và ộng mạch chủ bụng.
Câu 1: Dựa trên cấu tạo hoá học giải thích sự khác biệt giữa 2 thuốc ức chế calcium thế hệ III
(Amlodipine) và thế hệ IV (Cilnidipine), dẫn ến sự khác biệt trong iều trị hạ huyết áp cho bệnh nhân. Cilnidipine Amlodipine
Amlodipine cũng có ái lực lên kênh L-type Ca ở cơ tim giảm nhịp tim cũng như sự co bóp của cơ
tim kích thích phản xạ giao cảm tiết norepinephrine ể tăng nhịp tim tăng lượng máu bom i kết
hợp với sự dãn phía trước mao mạch càng tăng lượng dịch kẽ gây phù nề nặng hơn.
Cilnidipine gây chẹn kênh Canxi loại N.
Các kênh canxi loại N ược phân phối
trong các tế bào thần kinh và có một vai
trò quan trọng trong việc iều chỉnh sự hoạt ộng giao cảm (ngăn chặn giải phóng catecholamine norepinephrine).
Các dây thần kinh giao cảm ược tìm thấy
trong các tiểu tĩnh mạch, vì vậy thuốc ngăn
chặn kênh canxi loại N có thể gây ra sự giãn
tĩnh mạch giảm áp suất thủy tĩnh mao
mạch giảm ưa dịch ra ngoài khoảng kẽ giảm phù. lOMoARcPSD| 38841209 lOMoARcPSD| 38841209 Câu 2:
Cấu trúc hoá học của Cilnidipine có giúp bệnh nhân tránh ược các tác dụng phụ không? lOMoARcPSD| 38841209 Câu 3:
Trình bày cấu trúc hóa học, tính chất vai trò của LDL và HDL trong cơ thể. Nhận xét chỉ số LDL
trong kết quả xét nghiệm cận lâm sàng của bệnh nhân. lOMoARcPSD| 38841209 Câu 4:
Trình bày nội dung liên quan SpO2. lOMoAR cPSD| 38841209 Câu 5:
Tại sao có mảng xơ vữa ở ộng mạch cảnh và ộng mạch chủ bụng.
Lớp nội mạc có hai tác dụng chính: bảo vệ thành
mạch máu, tiết ra protein giúp máu không bị óng cục.
Lớp nội mạc có thể bị phá vỡ bởi sự gia tăng
LDL, khói thuốc lá, huyết áp cao,…
Khi lớp nội mạc bị hư hại, các LDL có thể thâm nhập vào thành nội mô. Khi ó, loại bạch cầu ơn nhân i
theo LDL vào trong mô ể trở thành ại thực bào nhằm phân hủy LDL qua quá trình oxi hóa.
Khi có quá nhiều LDL, ại thực bào ăn
quá nhiều LDL, bị “bội thực” và tạo
thành bạch cầu ơn nhân chết. Sau ó,
xác ại thực bào (tế bào bọt) chứa ầy
LDL ược chứa ầy trong lớp nội mạc.
Khi các ại thực bào chết, nó thải ra các
chất hấp dẫn them các bạch cầu ơn
nhân ể tiêu hủy LDL cũng chết vì
bội thực vòng luẩn quẩn. Khi càng
nhiều tế bào bọt tụ lại, chúng tạo thành
vết thương chứa ầy chất béo (vệt chất béo).
Vệt chất béo có khả năng gây ông
máu. Tiểu cầu sẽ tập trung tại các nội
mạc bị hư hỏng và tiết ra yếu tố tăng
trưởng dẫn xuất, kích thích sự tăng
trưởng của các tế bào cơ trơn (thường
nằm trong lớp giữa của mạch máu),
kéo các tế bào cơ trơn từ lớp áo giữa
vào lớp áo trong và sinh sôi gấp bội. lOMoAR cPSD| 38841209 Câu 6:
Các cơ trơn ang tăng trưởng tiết ra collagen, proteoglycans, elastic quện vào nhau, hình thành bức
tường xung quanh vệt béo không cho máu óng cục.
Mảng bọc xơ + Vệt chất béo = Mảng xơ vữa lOMoARcPSD| 38841209
Sự hiện diện của vệt béo làm cho các tế bào cơ trơn trong mảng xơ vữa bắt ầu kết tụ calcium làm mảng
xơ vữa trở nên cứng cứng thành ộng mạch.
Nếu mảng bọc xơ bị nứt ra các tế
bào bọt có khả năng ông máu sẽ ược
tiếp xúc trực tiếp với máu. lOMoARcPSD| 38841209
Đây là các nơi chịu áp lực của máu cao khiến lớp nội mạc dễ bị tổn thương. Dòng máu chảy không thành
lớp hay chảy xoáy (ví dụ, tại các iểm chi nhánh ộng mạch) dẫn ến rối loạn chức năng nội mạc và ức chế
sản sinh oxit nitric, một chất làm giãn mạch mạnh và có khả năng chống viêm. Dòng máu này cũng kích
thích các tế bào nội mạc tạo ra các phân tử bám dính làm triệu tập và gắn các tế bào viêm.