






Preview text:
lOMoARcPSD| 38841209
SỐ LƯỢNG TỬ CỦA ELECTRON A- LÍ THUYẾT:
I. Các số lượng tử của electron:
Trạng thái của electron trong nguyên tử được xác định bằng tổ hợp các số lượng tử:
- Số lượng tử chính (n)
- Số lượng tử phụ (l)
- Số lượng tử từ (ml) - Số lượng tử spin (ms) 1. Số lượng tử chính, n:
- Số lượng tử chính n nhận các giá trị nguyên, từ 1,2,3,…,n tương ứng với số thứ tự của lớp n 1 2 3 4 … Lớp electron K L M N …
- Giá trị n càng lớn, lớp electron càng xa hạt nhân
- Kích thước mây electron: n càng lớn thì kích thước mây electron càng lớn và mật độelectron càng loãng.
- Đối với nguyên tử H và ion giống hidro (có một electron), n xác định mức năng lượng (E)
của electron trong nguyên tử hoặc ion: Z2 (eV) E = -13,6. n2
Khi n có giá trị nhỏ nhất có thể có thì electron có mức năng lượng thấp nhất (trạng thái cơ
bản). Khi n có giá trị càng lớn, electron có mức năng lượng càng cao và liên kết với hạt nhân càng kém chặt chẽ.
2. Số lượng tử phụ, l (hay số lượng tử obitan): cho biết hình dạng của obitan trong không
gian và xác định số phân lớp trong mỗi lớp .
- l nhận giá trị từ 0 đến n – 1
- Giá trị của l 0 1 2 3 … - Kiểu obitan s p d f …
Ứng với mỗi giá trị của n (một lớp electron) có n giá trị của l và do đó có n phân lớp electron hay kiểu obitan . Ví dụ:
Ở lớp thứ I (n = 1) l có 1 giá trị (l = 0) 1 kiểu obitan s
Ở lớp thứ II (n = 2) l có 2 giá trị (l = 0 và l = 1) 2 kiểu obitan s và p
Ở lớp thứ III (n = 3) l có 3 giá trị (l = 0, l = 1 và l = 2) 3 kiểu obitan s, p và d
Ở lớp thứ IV (n = 4) l có 4 giá trị (l = 0, l = 1, l = 2 và l = 3) 4 kiểu obitan s, p, d và f -
Phân mức năng lượng của các phân lớp trong một lớp electron tăng dần theo thứ tự: ns < np < nd < nf
- Hình dạng mây electron (AO)
Mây electron s có dạng hình cầu
Mây electron p có dạng hình số 8 nổi (quả tạ) lOMoARcPSD| 38841209
Mây electron d có dạng hình hoa thị
Mây electron f,… có dạng hình dạng phức tạp
3. Số lượng tử từ ml. -
Số lượng tử từ ml xác định sự định hướng các mây electron (AO) trong không gian, nó
quy định số AO trong cùng một phân lớp -
Số lượng tử từ nhận các giá trị nguyên dương và âm từ -1 đến + 1 kể cả 0. Nghĩa là
ứng với một giá trị của l có (2l + 1) giá trị của ml (mỗi giá trị của ml ứng với một AO) - các giá trị: -l, 0, +l Ví dụ:
Khi l = 0 => ml = 0 => có 1AO-s: 0
Khi l = 1 => ml = -1, 0, +1 => có 3AO-p: -1 , 0, +1
Khi l = 2 => ml = -2, -1, 0, +1, +2 => có 5AO-d: -2 -1 0 +1 +2
Khi l = 3 => ml = -3, -2, -1, 0, +1, +2, +3 => có 7AO- f: -3 -2 -1 0 +1 +2 +3
4. Số lượng tử spin ms
Không liên quan đến sự chuyển động của electron xung quanh hạt nhân mà liên quan đến sự
chuyển động riêng của electron
Số lượng tử spin ms có hai giá trị là ms = +1/2 (kí hiệu ) và ms = -1/2 (kí hiệu )
*Tóm lại: n: số lớp l: 0 đến n-1
ml: 2l+1 giá trị (-l đến +l) ms: +1/2, -1/2
II. Các nguyên lí và quy tắc phân bố electron trong nguyên tử: 1. Nguyên tử Pauli: a) Ô lượng tử:
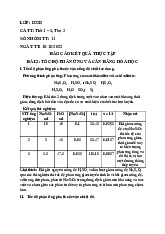
Mỗi obitan nguyên tử được biểu diễn bằng 1 ô vuông, gọi là ô lượng tử
Ví dụ: với n = 1, có 1AO-1s, ta vẽ 1ô vuông lOMoARcPSD| 38841209
Với n = 2, có 1AO-2s, 3AO-2p 2s 2px 2py 2pz b) Nguyên lí Pauli:
Trên một AO chỉ có thể có nhiều nhất là hai electron và 2 electron này chuyển động tự
quay khác chiều nhau xung quanh trục riêng của mỗi electron ( ) 2) Nguyên lí vững bền:
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt những AO có mức
năng lượng từ thấp đến cao 1s2s2p3s3p….. 3) Quy tắc Hun:
Trong cùng một phân lớp, các electron sẽ phân bố trên các AO sao cho số electron độc thân là
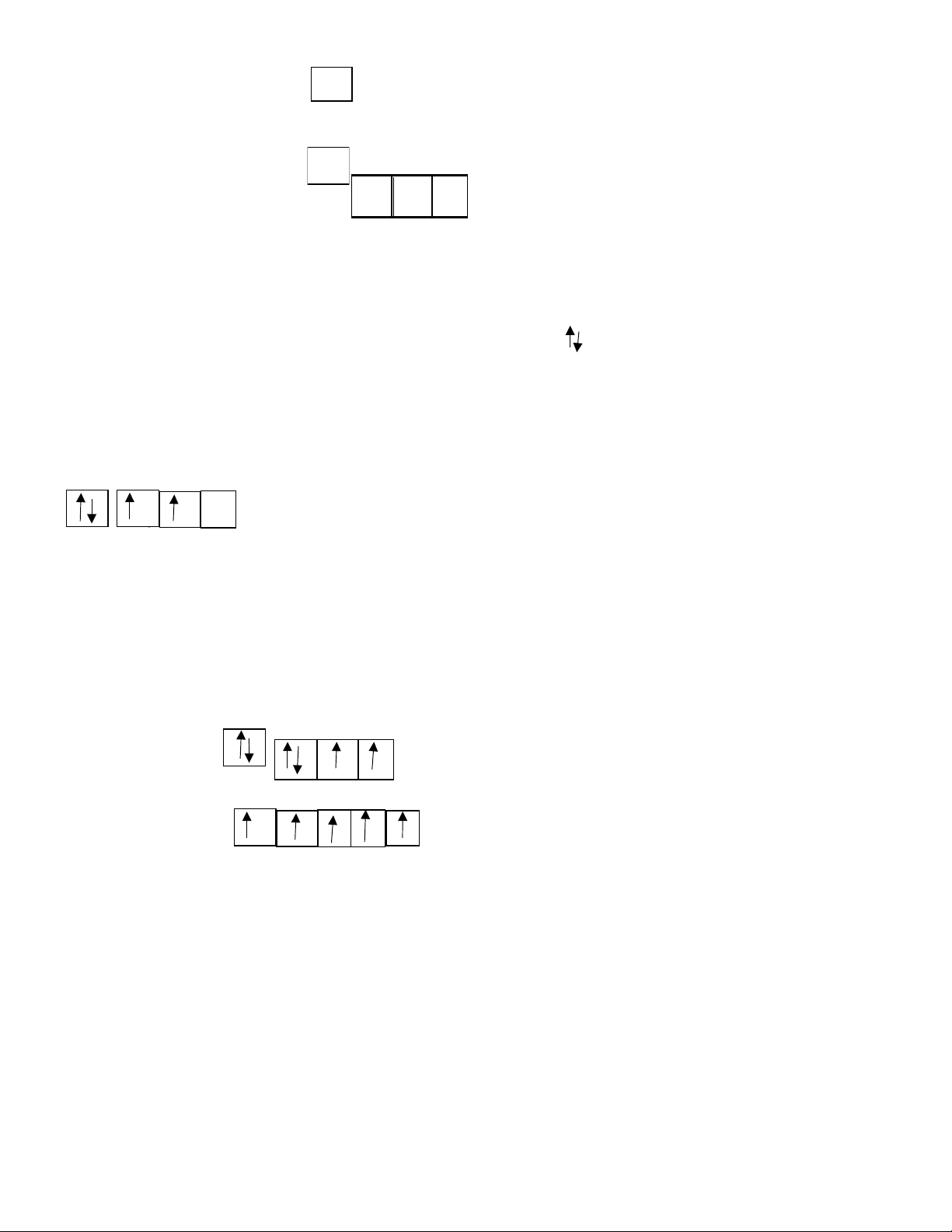
tối đa và các electron này phải có chiều tự quay giống nhau Ví dụ: C (Z=6) 2s 2p B-BÀI TẬP:
Câu 1. Cho biết bộ 4 số lượng tử ứng với electron chót cùng của: a) O (Z=8): 1s22s22p4 b) Fe3+ (Z=26) Giải a) O (Z=8):
n = 2, l = 1, ml = -1, mS = -1/2 b) Fe3+[Ar]3d5 n=3, l=2, ml=+2, ms = +1/2
Câu 2. Viết cấu hình electron của nguyên tử, trong đó electron cuối cùng có bộ 4 số lượng tử như sau:
a) n = 2, l = 0, ml = 0, ms = +1/2 b) n=2, l=1, ml=0, ms=+1/2 c) n=3, l=1, ml=0, ms=-1/2 d) n=4, l=2, ml=+2, ms=+1/2 e) n=4, l=2, ml=-2, ms=+1/2 lOMoARcPSD| 38841209 Giải a)
n = 2=> 2 lớp l=0 => phân lớp ngoài
cùng s m =0=> có 1 electron ở AO l -s ms=+1/2
=> electron cuối cùng có spin => electron cuối cùng:
0 => Cấu hình electron: 1s22s1 b)
n = 2 => 2 lớp l = 1 => phân lớp
ngoài cùng p ml = 0 => electron cuối cùng ở
AO-2py ms = +1/2 => electron cuối cùng có
spin => electron cuối cùng:
=> Cấu hình electron: 1s22s22p2 c) n = 3
=> 3 lớp l = 1=> phân lớp ngoài cùng p ml = 0
=> electron cuối cùng ở AO-2py ms = -1/2 =>
electron cuối cùng có spin => electron cuối cùng:
=> cấu hình electron: 1s22s22p63s23p5 d) n = 3 => 3 lớp
l = 2 => electron cuối cùng ở phân lớp d ml
= +2 => electron cuối cùng ở AO-d thứ 5
ms = +1/2 => e cuối cùng có spin
=> cấu hình e cuối cùng:
=> Cấu hình electron: 1s22s22p63s23p63d54s2 e)
n = 3 => e cuối cùng ở lớp thứ 3 l = 2=>
electron cuối cùng ở phân lớp d
ml = -2 => electron cuối cùng ở AO-d thứ 1
ms = +1/2 => cuối cùng có spin
=> cấu hình e cuối cùng: lOMoARcPSD| 38841209
=> Cấu hình electron: 1s22s22p63s23p63d14s2 Câu 3.
a) Viết cấu hình electron nguyên tử của các nguyên tố có Z < 20 và có 2 electron độc thân. Cho biết tên nguyên tố.
b) Viết các số lượng tử đối với electron sau cùng của nguyên tử các nguyên tố trên. Giải a) C: 1s22s22p1 1 0 x2py 2pz Si: 1s22s22p63s23p2 O: 1s22s22p4 S: 1s22s22p63s23p4 b)
C: n = 2, l = 1, ml = 0, ms=+1/2
Si: n = 3, l = 1, ml = 0, ms = +1/2
O: n = 2, l = 1, ml = -1, ms = -1/2
S: n = 3, l = 1, ml = -1, ms = -1/2 Câu 4.
a) Nguyên tử của nguyên tố X, electron cuối cùng có 4 số lượng tử: n=3, l=1, m=-1, ms=-1/2.
Xác định tên nguyên tố X?
b) X có các mức oxi hóa nào? Trong chất nào? Giải thích tại sao X có các mức oxi hóa đó? Giải a) n = 3 => 3 lớp
l = 1 => phân lớp ngoài cùng là p
ml = -1 => e cuối cùng ở AO-2px ms = -
1/2 => e cuối cùng có spin => electron cuối cùng:
=> Cấu hình e của X: 1s22s22p63s23p43d => X là S b)
S có các số oxi hóa -2, 0, +4, +6
Câu 5. Cho nguyên tử của 2 nguyên tố A, B có electron cuối cùng có bộ 4 số lượng tử như sau: lOMoARcPSD| 38841209 A: n = 3, l=1, ml=-1, ms=+1/2 B: n=3, l=1, ml=0, ms=-1/2
a) Xác định vị trí A, B trong BTH
b) Cho biết loại liên kết và công thức cấu tạo của phân tử AB3 Giải a) A: 1s22s22p63s23p1 B: 1s22s22p63s23p5 b) A là Al, B là Cl
AlCl3: liên kết giữa Al và Cl là liên kết CHT có cực Cl Cl – Al Cl
Câu 6. Xác định nguyên tử mà electron cuối cùng có 4 số lượng tử thõa mãn điều kiện: n+l=3 và ml + ms = +1/2 Giải
ml + ms = +1/2 => ml = 0, mS = +1/2 hoặc ml = 1, ms = -1/2 TH1: ml = 0, mS = +1/2
=> l = 1, n = 2 n = 2 => 2 lớp l =
1 => e cuối cùng ở phân lớp p ml
= 0 => e cuối cùng ở AO-2py ms
= +1/2 => cuối cùng có spin
=> Cấu hình e cuối cùng: 2p2
=> Cấu hình electron của X: 1s22s22p2 (C) TH2: ml = 1, ms = -1/2
=> l = 1, n=2 n=2 => 2 lớp l = 1
=> e cuối cùng ở p ml = 1 => e
cuối cùng ở 2pz mS = -1/2 => e cuối cùng có spin
=> cấu hình e cuối cùng 2p6
=> cấu hình e của X : 1s22s22p6 (Ne)
Câu 7. Xét nguyên tử mà nguyên
tố có electron cuối cùng có 4 số lượng tử
a) n = 3 , l = 2 , ml = -1 , ms =
b) n = 3 , l = 2 , ml = -1 , ms =
Có tồn tại cấu hình này hay không? Giải thích tại sao? lOMoARcPSD| 38841209 Giải a)
n = 3 => e cuối cùng ở lớp thứ 3 l= 2 => e cuối cùng ở d ml =
-1 => e cuối cùng ở AO-d thứ 2 ms = +1/2 => e cuối cùng có spin => [Ar]3d24s2 (Ti) b) [Ar]374s2 (Co)
Câu 8. Tổ hợp các obitan nào sau đây là đúng? Tổ hợp nào không đúng? Vì sao?
(1) n = 3 , l = 3 , ml = 0 (sai)
(2) n = 2 , l = 1 , ml = 0 (đúng)
(3) n = 6 , l = 5 , ml = -1 (đúng)
(4) n = 4 , l = 3 , ml = -4 (sai)
Câu 9. Nguyên tử của nguyên tố X, Y, Z có cấu hình electron cuối cùng ứng với 4 số lượng tử như sau: n l m l m s X 3 1 -1 -1 / 2 Y 2 1 1 +1 / 2 Z 2 1 -1 -1 / 2 Nguyên tố a) Tìm X, Y, Z?
b) So sánh năng lượng ion hóa thứ 1 của X, Y, Z. Giải thích? Giải a) X là S: [Ne]3s23p4 Y là N: [He]2s22p3 Z là O: [He]2s22p4 b) S < N < O
Câu 10. Nguyên tử A có electron sau cùng với tổng đại số 4 số lượng tử bằng 4,5. Hiệu
số lượng tử phụ và số lượng tử từ bằng 0. Viết cấu hình electron của A? Giải n l ml ms 4,5 n l ml ms 4,5
Theo đề bài ta có: l ml 0 l ml
Mà 0 l n 1 => 0 ml n 1
*Nếu ms = +1/2 => 2l + n =4 => n 4 => n + 2(n-1) 4 => n 2 n 2 3 4 l=m Loại l 1 0 lOMoARcPSD| 38841209
TH1. n = 2, l=1, ml=1, ms=+1/2
=> e cuối cùng 2p1 => A: 1s22s22p1 TH2. n=4, l=0, ml=0, ms=+1/2
=> e cuối cùng 4s1 => A[Ar]4s1 *Nếu
ms=-1/2 => n+l+ml=5 =>n+2l=5 =>n 5 => n + 2(n-1) 5 => n 2,3 3 4 5 Loại l 1 0 s n l=m TH1. n=3, l=1, ml=1, m =-1/2
=> e cuối cùng 3p1 => A: [Ne]3s23p1 TH2. n=5, l=0, ml=0, ms=-1/2
=> e cuối cùng 5s2 => A: [Kr]5s2
Câu 11. Cho 2 nguyên tố A, B đứng kế tiếp nhau trong BTH, có tổng số lượng tử (n+l) bằng
nhau, trong đó số lượng tử chính của A lớn hơn số lượng tử chính của B. Tổng đại số của bộ
4 số lượng tử của electron cuối cùng của nguyên tử B là 4,5. Viết cấu hình electron nguyên tử của A, B? Giải
Hai nguyên tố A, B đứng kế tiếp nhau trong BTH có tổng (n+l) bằng nhau và số lượng tử chính nA>nB
=> Cấu hình electron lớp ngoài cùng của A, B B: np6 A: (n+1)s1
=> e cuối cùng của B có bộ số lượng tử: l=1, ml = 1, ms = -1/2
Theo bài ra: n+l+ml+ms = n+1+1-1/2=4,5 => n=3
=> e cuối cùng của B có n = 3, l = 1, ml = 1, mS = -1/2
Cấu hình e của B: 1s22s22p63s23p6
Electron cuối cùng của A có n = 4, l = 0, ml = 0, ms = +1/2
=> cấu hình e của A: 1s22s22p63s23p64s1
Câu 12. Một phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt
mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12.
a) Hãy xác định kí hiệu hóa học của X, Y và công thức phân tử XY2?
b) Viết cấu hình electron của nguyên tử X, Y và xác định các số lượng tử của electron cuối cùng được điền vào? lOMoARcPSD| 38841209 Giải a) Ta có: 2ZX + 4ZY + NX + 2NY = 178 2ZX + 4ZY – NX – 2NY = 54 4ZY – 2ZX = 12 => ZY = 16, ZX = 26
Vậy X là Fe, Y là S, XY2 là FeS2 b) Cấu hình electron: Fe: [Ar]3d64s2 S: [Ne]3s23p4
Bộ 4 số lượng tử của X: n = 3, l = 2, ml = -2, mS = -1/2
Y: n = 3, l = 1, ml = -1, ms = -1/2
Câu 13. Xác định 2 nguyên tử
mà electron cuối cùng có các số lượng tử
a) n = 3 ; l = 1 ; ml =-1 ; ms = => S: [Ne]3s23p4
b) n = 2 ; l = 1 ; ml = +1 ; ms = => N: 1s22s223
Câu 14. Cho nguyên tử của 2 nguyên tố A và B có electron ngoài cùng có 4 số lượng tử lần lượt sau : n = 4 , l = 0 , ml =
0 , ms = => [Ar]4s1 => K n = 3 , l = 1 , ml = -1 , ms = => [Ne]3s23p4 => S
Viết cấu hình electron của nguyên tử, xác định nguyên tố kim loại, phi kim?
Câu 15. Hợp chất M được tạo nên từ cation X+ và anion Y3-. Mỗi ion đều do 5 nguyên tử của
hai nguyên tố phi kim tạo nên. Biết tổng số proton trong X+ là 11 và trong Y3- là 47. Hai
nguyên tố trong Y3- thuộc hai chu kì kế tiếp nhau trong BTH và có số thứ tự cách nhau 7 đơn
vị. Xác định công thức phân tử của hợp chất M và cho biết 4 số lượng tử của electron cuối
cùng trong nguyên tử các nguyên tố tạo nên hợp chất M (Giá trị từ -l đến +l) Giải
+Với X+ có số proton trung bình = 11 : 5 = 2,2
=> X+ có nguyên tố H (vì H có điện tích hạt nhân 1 < 2,2) => X+: HnT+
=> n.1+ZT = 11 => n = 4, ZT = 7 lOMoARcPSD| 38841209 => X+ là NH + 4
+Với ion Y3- có số proton trung bình = 47:5 = 9,4 Y3- : A 3-
mBn có ZB = ZA + 7 và ZA < 9,4 < ZB => ZA = 8, ZB = 15 => Y3- là PO 3Vậy 4 M là (NH4)3PO4
H: n = 1, l = 0, ml = 0, ms = +1/2
N: n = 2, l = 1, ml = +1+, ms = +1/2
O: n = 2, l = 1, ml = -1, ms = -1/2
P: n = 3, l = 1, ml = +1, ms = +1/2