














Preview text:
lOMoAR cPSD| 47207194 1
ĐẠIHỌCYDƯỢCTHÀNHPHỐHỒCHÍMINH
Lương Lê Anh Văn (Biên soạn)
HÓAHỌCĐẠICƯƠNG–PHỨCCHẤT ỨNGDỤNGTRONGYHỌC
(Dùng cho sinh viên ngành Dược học) - NHÀ XUẤT BẢN - lOMoAR cPSD| 47207194 2 Mục lục
Chương 1. Nguyên từ ………………………………………………………………Trang 5
Chương 2. Liên kết hóa học………………………………………………….……..Tramg 7
Chương 3. Nhiệt hóa học – Động Hóa học – Cân bằng hóa học………….............Trang 11
Chương 4. Dung dịch – Pin Điện hoá……………..……………………………….Tramg 15
Chương 5. Phức chất – Kim loại chuyển tiếp……………………………………...Trang 20
Ôn tập nguyên tố nhóm A …………………………………...…………………….. Trang 23 lOMoAR cPSD| 47207194 3 lOMoAR cPSD| 47207194 4
Chương 1: Nguyên tử 1. Cấu tạo nguyên tử
- Mô hình Thompson → Rutherford → Lớp vỏ theo Niels Bohr
- Ứng dụng của đồng vị phóng xạ trong chẩn đoán Iodine – 131: Kiểm tra chức năng tuyến giáp.
Phosphorus – 32: Phát hiện tế bào ung thư trong xương.
Chromium – 51: Phân tích tế bào hồng cầu. Ferrum
– 59: Đánh giá nồng độ sắt / cơ thể.
- Tia beta dùng trong điều trị bệnh và tia gamma dùng trong chẩn đoán bệnh.
- Năng lượng nhảy từ quỹ đạo này sang quỹ đạo khác là: ……………………………..
- Năng lượng của một nguyên tử (Z, n): ……………………………………………….
2. Cơ học lượng tử
2.1. Quang phổ vạch của nguyên tử hydro
- Vùng tử ngoại:…………………………………………………………………….
- Vùng hồng ngoại: …………………………………………………………………
- Vùng khả kiến: ……………………………………………………………………
2.2. Biểu thức năng lượng theo thuyết photon ánh sáng
là:…………………………........
2.3. Bước sóng kết hợp khi vật có khối lượng m di chuyển với vận tốc V là…………….
2.4. Ứng dụng của sóng điện tử: Loại tia Ứng dụng Bức xạ gamma Chẩn đoán, dao mổ Tia X Chẩn đoán (X – Quang) Tia tử ngoại UVA: gây đỏ da UVB: tổng hợp vitamin D
UVC: diệt khuẩn, phân hủy proteins Tia hồng ngoại
Giãn mạch, tăng lưu thông máu, tái tạo mô Ánh sáng nhìn thấy
Tia laser, kích thích thần kinh, trị vàng da (trẻ em) Sóng
Sóng viba: đốt u, trị ung thư gan.
Sóng vô tuyến: chẩn đoán MRI Sóng âm: siêu âm lOMoAR cPSD| 47207194 5
3. Bộ 4 số lượng tử
- Số lượng tử chính n: Đặc trưng cho mức năng lượng K, K, M, N, O… của electron trong nguyên tử.
- Số lượng tử phụ l: Đặc trưng cho phân mức năng lượng s, p, d, f và hình dạng của orbital trong nguyên tử.
- Số lượng tử từ ml: Đặc trưng cho sự định hướng của orbital nguyên tử.
- Số lượng tử spin ms: Đặc trưng cho chiều quay electron của nguyên tử.
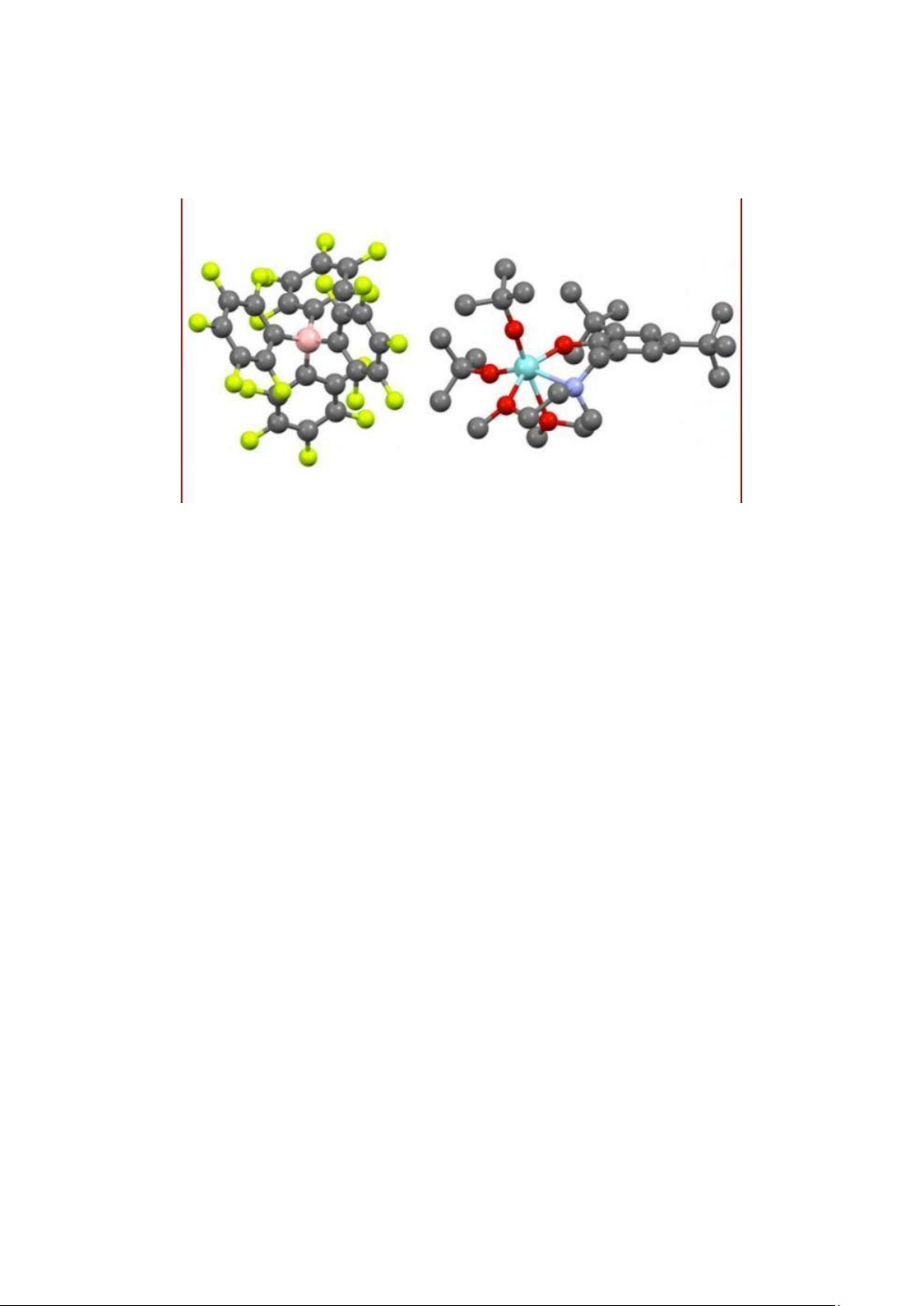
Số lượng tử trên vân đạo cuối cùng của Fe (Z = 26) là……………………………………
Hình 1.1. Ví dụ minh họa về cách tính hằng số chắn đối với nguyên tử Fe (Z = 26)
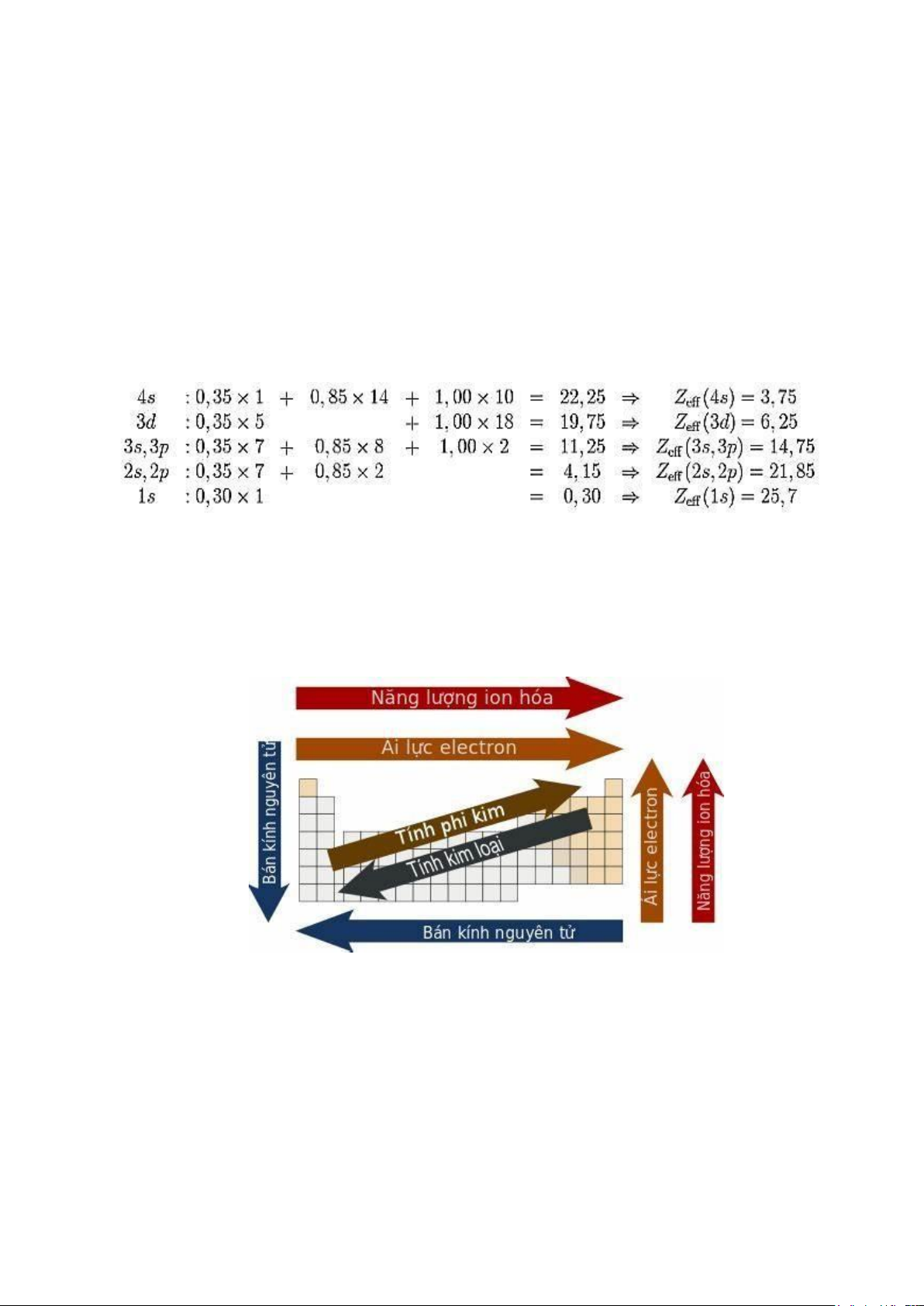
4. Bảng tuần hoàn các nguyên tố hóa học
- Xét bảng tuần hoàn các nguyên tố hóa học theo chiều tăng dần điện tích hạt nhân nguyên
tử trong một chu kỳ và trong một nhóm có sự thay đổi trái ngược nhau.
Hình 1.2. Nhận xét về sự biến thiên các tính chất của các nguyên tố hóa học trong
bảng tuần hoàn các nguyên tố hóa học
- Kích thước ion đẳng điện tử, có độ lớn về bán kính cấu tử như sau
Cấu tử mang điện dương < Cấu tử trung hòa < Cấu tử mang điện âm lOMoAR cPSD| 47207194 6
- Trong dãy S2-, N3-, Mg2+, Na+, Al3+. Thứ tự sắp xếp đúng về bán kính đẳng điện tử của
các cấu tử là……………………………………………………………………………
Chương 2: Liên kết hóa học I.
Một số khái niệm 1. Các liên kết trong một hợp chất
1.1. Liên kết ion là liên kết có bản chất chuyển electron từ nguyên tử này sang nguyên tử
khác. Liên kết ion không có tính định hướng và không có tính bão hòa.
1.2. Liên kết cộng hóa trị là sự dùng chung của các cặp electron nguyên tử, có tính định
hướng và bão hòa. Liên kết cho – nhận là trường hợp đặc biệt của liên kết CHT.
+ Liên kết sigma: liên kết bền, hình thành khi các orbital xen phủ dọc (đối xứng trục). +
Liên kết pi: liên kết kém bền, hình thành khi các orbital xen phủ song song (đối xứng theo mặt phẳng).
Tính chất của liên kết cộng hóa trị
- Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học.
+ Năng lượng liên kết càng lớn thì liên kết càng bền.
+ Năng lượng liên kết càng lớn thì độ dài liên kết càng nhỏ.
- Độ dài liên kết là khoảng cách của hai hạt nhân giữa các nguyên tử liên kết với nhau.
Nguyên tử tham gia liên kết như nhau khi độ dài liên kết càng nhỏ thì liên kết càng bền.
Ví dụ: Độ dài liên kết của C-C trong CH4 lớn hơn C-C trong C2H2, ta nói liên kết C-C trong
CH4 bền hơn C2H2. - Bán kính cộng hóa trị - Góc liên kết
Ví dụ 1. Góc liên kết H – O – H của phân tử H2O lớn hơn góc liên kết H – S – H của
phân tử H2S, vì trong cùng một phân nhóm, khi so sánh góc liên kiết giảm theo chiều
tăng điện tích hạt nhân của nguyên tử trung tâm.
Ví dụ 2. Góc liên kết H – N – H trong phân tử NH3 nhỏ hơn góc liên kết H – O – H trong
phân tử H2O, vì trong cùng một chu kỳ, khi so sánh góc liên kết tăng theo chiều tăng
điện tích hạt nhân của nguyên tử trung tâm.
Ví dụ 3. Góc liên kết H – N – H trong phân tử NH3 lớn hơn góc liên kết F – N – F trong
phân tử NF3, vì sự chênh lệch độ âm điện của N-F và N – H. Trong khi đó, Góc liên
kết H – P – H trong phân tử PH3 nhỏ hơn góc liên kết F – P – F trong phân tử PF3, do
phân tử PF3 có đặc tính nhường lại pi của các electron từ orbital p của nguyên tử F sang lOMoAR cPSD| 47207194 7
orbital d trống của phosphorus, điều này làm tăng lực đẩy và giúp cho góc liên kết lớn
hơn, còn trong PH3 thì không có tính chất này.
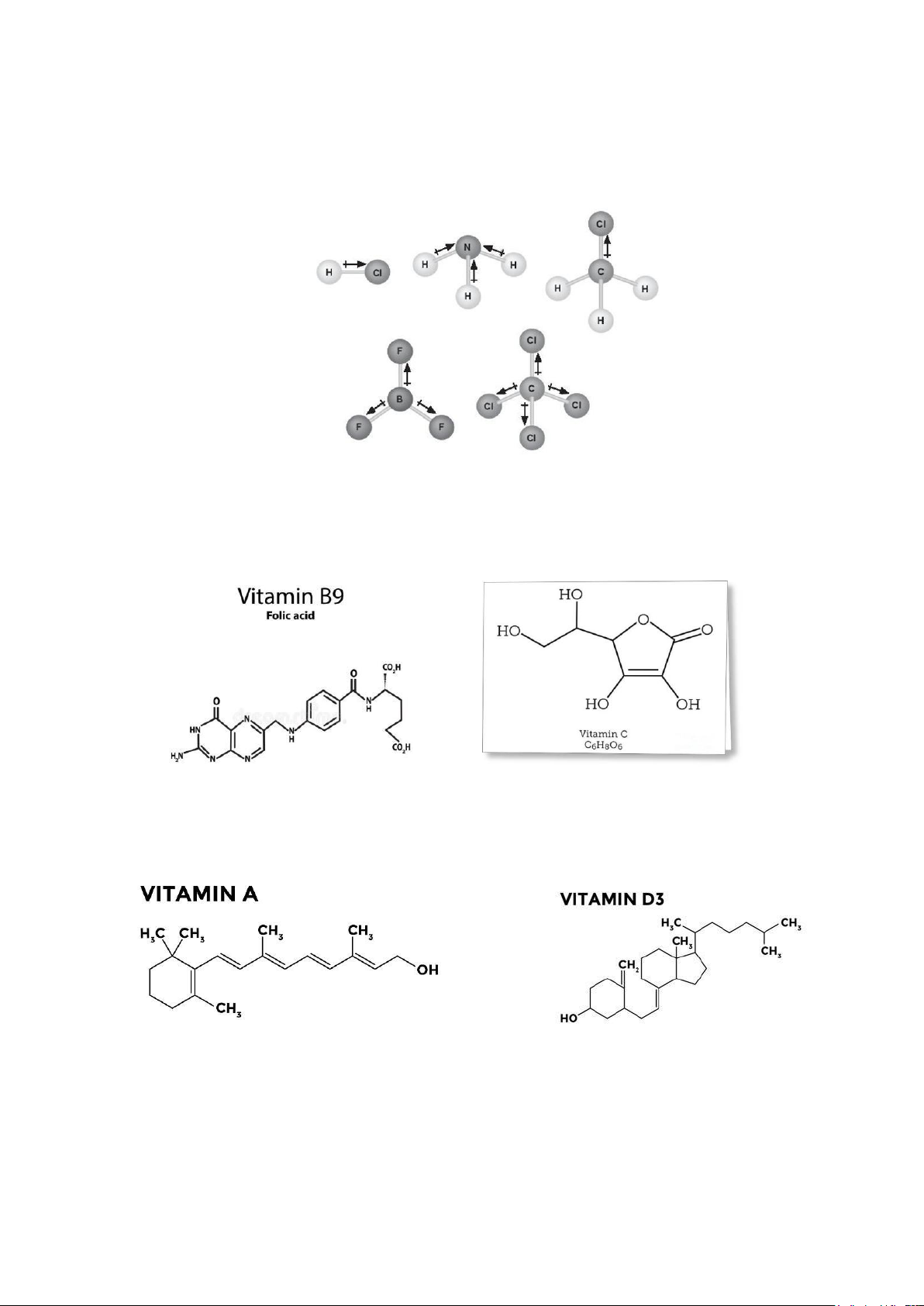
- Sự phân cực và phân cực hóa liên kết CHT
Hình 2.1. Mô tả các moment lưỡng cực của các phân tử HCl, NH3, CH3Cl, BF3 và CCl4
Khả năng phân cực của các vitamin
- Các vitamin tan được trong nước là: vitamin B9, vitamin C.
Hình 2.2. Cấu trúc của vitamin B9 và vitamin C
- Các vitamin tan được trong dầu là: vitamin A, vitamin E, vitamin D, vitamin K.
Hình 2.3. Cấu trúc của vitamin A và vitamin D3 -
Vitamin D3 thường được tiêm bắp, không tiêm tĩnh mạch. lOMoAR cPSD| 47207194 8 2. Liên kết yếu
2.1. Liên kết vander waals
- Là liên kết yếu giữa các phân tử, có bản chất tĩnh điện, là loại liên kết yếu nhất trong 4
loại liên kết được học.
- Bao gồm 3 dạng lực liên kết: tương tác lưỡng cực – lưỡng cực, tương tác lưỡng cực –
lưỡng cực cảm ứng, tương tác lưỡng cực cảm ứng – lưỡng cực cảm ứng.
Ví dụ: Acetyl Choline gắn vào receptor M-cholinergic bằng liên kết vander waals.
2.2. Liên kết hydrogen
- Là liên kết có năng lượng yếu, trong đó có một nguyên tử giàu điện tử như O, F, N kết hợp với hydrogen (H).
- Bao gồm: liên kết hydrogen liên phân tử và liên kết hydrogen nội phân tử.
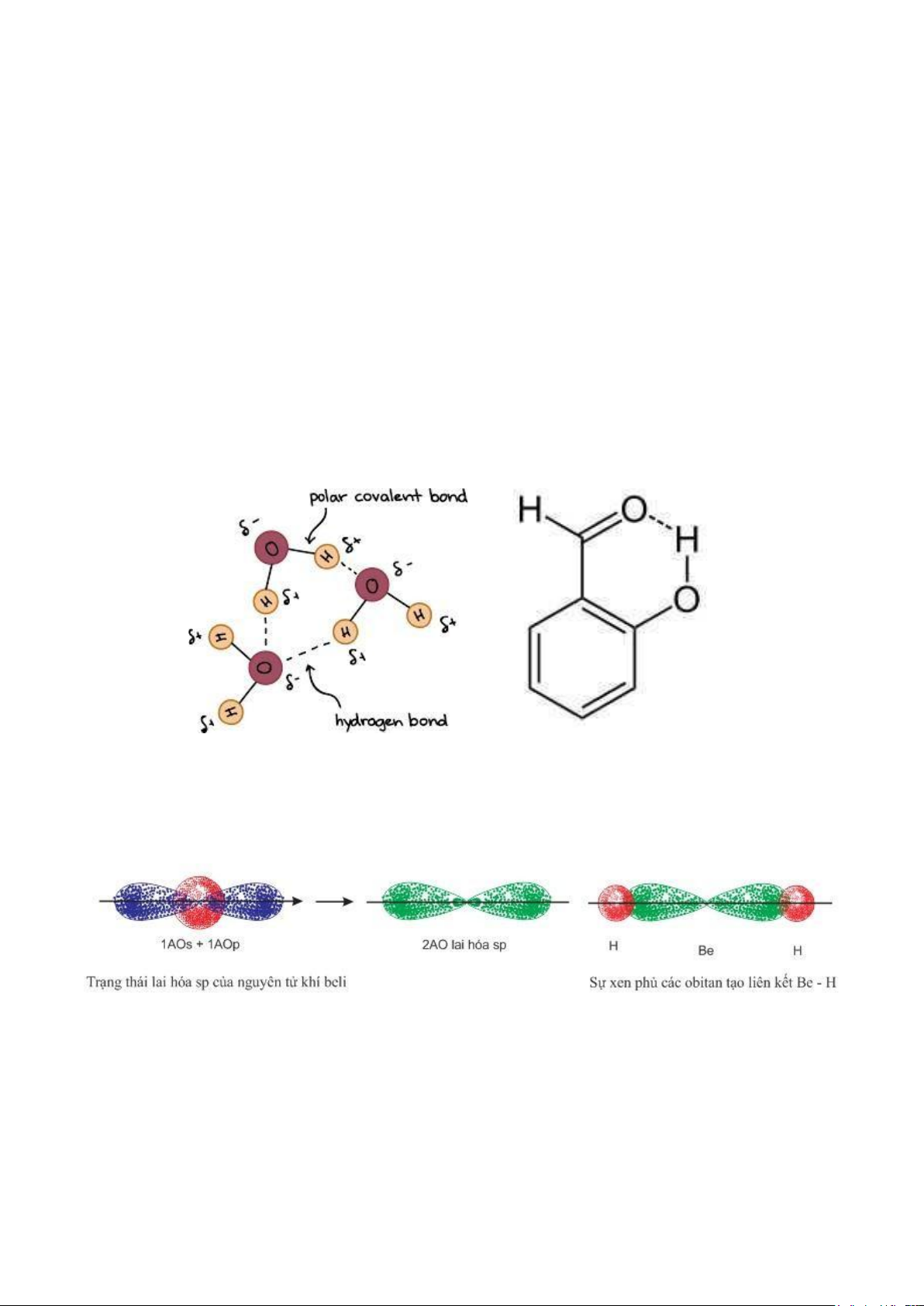
Hình 2.4. Minh họa cho liên kết hydrogen liên phân tử (bên trái) và liên kết hydrogen nội phân tử (bên phải) II.
Thuyết lai hóa – trạng thái lai hóa
Hình 2.5. Mô tả lai hóa sp của phân tử BeH2 - Trạng thái lai hóa: sp
- Góc liên kết chuẩn: 1800
- Một số hợp chất: hợp chất của beri (BeCl2, BeF2…), magie (MgH2), C2H2, CO2, HCN
- Cách sắp xếp: đường thẳng lOMoAR cPSD| 47207194 9
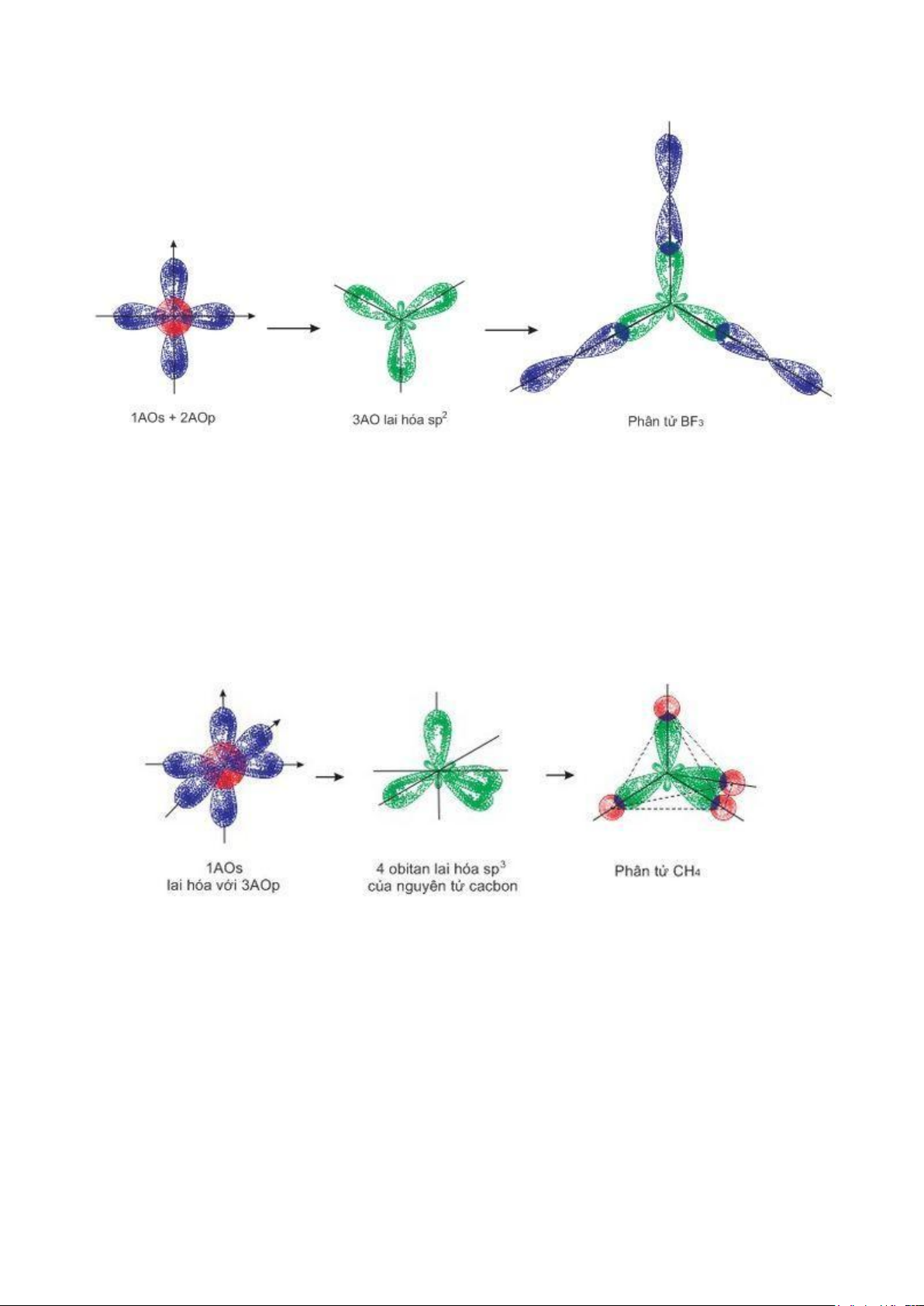
Hình 2.6. Mô tả lai hóa sp2 của phân tử BF3 - Trạng thái lai hóa: sp2
- Góc liên kết chuẩn: 1200
- Một số hợp chất của boron (BCl 2- -
3, BF3,…), nhôm (AlCl3), SO3, CO3 , NO3 , C2H4, SO2, NO2, NOCl,...
- Cách sắp xếp: tam giác điều
Hình 2.7. Mô tả lai hóa sp3 của phân tử CH4 - Trạng thái lai hóa: sp3
- Góc liên kết chuẩn: 109,50
- Một số hợp chất của C (CH 2- 3-
4, CCl4,…), PCl3, Al2Cl6, SO4 , PO4 …
- Cách sắp xếp: tứ diện -
Chương 3: Nhiệt hóa học - Động hóa học - Cân bằng hóa học
Bài tập 1. Phản ứng đốt cháy khí hydro sulfur được mô tả theo phản ứng sau đây lOMoAR cPSD| 47207194 10
H2S (k) + O2 (k) → 2H2O (k) + 2SO2 (k)
Các giá trị nhiệt động được phân bố trong bảng dưới đây Hóa chất (298K, 1atm) ΔH0s (kJ.mol-1) ΔG0 (kJ) H2S -20,20 -33,00 SO2 -296,80 -340,20 H2O -241,80 -228,60
a. Xác định điều kiện chuẩn, phản ứng thu nhiệt hay tỏa nhiệt ? Giải thích sự lựa chọn của anh/ chị.
b. Phản ứng trên có tự diễn biến ở điều kiện chuẩn không ? Tính hằng số cân bằng của
phản ứng tại điều kiện chuẩn này.
c. Tại nhiệt độ nào phản ứng bắt đầu diễn ra theo chiều thuận ? Giả thiết các giá trị nhiệt
động thay đổi không đáng kể.
d. Tính năng lượng hoạt hóa của phản ứng khi nâng nhiệt độ từ 250C lên 350C.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Bài tập 2. Nhận xét về giá trị entropy, enthalpy, enthalpy tự do của các phản ứng dưới đây
a. CH4 (k) + O2 (k) → CO2 (k) + H2O (l) b. H2O (l) → H2O (k)
c. 2H2O (k) → 2H2 (k) + O2 (k) d. H2O (k) → H2O (l) Nhận xét
………………………………………………………………………………………………… lOMoAR cPSD| 47207194 11
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài tập 3. Đơn chất không có nhiệt sinh bằng 0 là những đơn chất nào dưới đây? a. N2 (k) b. O2 (k) c. I2 (k) d. O2 (r) Nhận xét
….………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài tập 4. Viết biểu thức tốc độ phản ứng phân hủy của N2O5 và biểu thức tốc độ phản ứng hóa học theo NO2, O2 và N2O5.
….………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Bài tập 5. Viết biểu thức tính năng lượng hoạt hóa, khi tăng nhiệt độ, năng lượng hoạt hóa thay đổi như thế nào ?
….………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài tập 6. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học – cân bằng hóa học
Xét phản ứng của amonia (k) là phản ứng có
N2 (k) + 3H2 (k) ⇌ 2NH3 (k) ΔH = -92kJ.mol-1
Khi tăng nồng độ của khí nitrogen lên 2 lần thì tốc độ phản ứng hóa học sẽ:…………………..
Khi tăng nồng độ của amonia trong hệ, cân bằng hóa học sẽ chuyển dịch sang………………..
Khi tăng nồng độ hydrogen (k) trong hệ lên 4 lần thì tốc độ phản ứng hóa học:……………….
Khi tăng nhiệt độ của phản ứng thì, tốc độ phản ứng……………………cân bằng hóa học sẽ
chuyển dịch theo chiều………………………………………………………………………….
Khi tăng áp suất của phản ứng thì cân bằng hóa học chuyển dịch theo chiều .............................
……………………………………… Còn tốc độ phản ứng sẽ………………………………... lOMoAR cPSD| 47207194 12
Khi thêm bột Fe xúc tác cho phản ứng thì tốc độ phản ứng sẽ…………………………………. Kết luận
1. Các yếu tố ảnh hưởng đến tốc độ phản ứng
………………………………………………………………………………………………
2. Các yếu tố ảnh hưởng đến cân bằng hóa học
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
Bài tập 7. Tính nhiệt lượng cần thiết để chuyển 10,00 grams nước đá (ice) ở nhiệt độ -100C đến
trạng thái hơi 1500C. Biết:
- Nhiệt dung riêng của nước đá là 0,5 cal.(g.0C)-1
- Nhiệt dung riêng của hơi nước là 1,0 cal.(g.0C)-1
- Nhiệt tan chảy của nước đá là 76,4 cal.(g.0C)-1
- Nhiệt bay hơi của nước đá là 539 cal.(g.0C)-1
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài tập 8. Hiệu ứng nhiệt của phản ứng hóa học
1. Khử 80,00 grams Fe2O3 (rắn) bằng bột nhôm kim loại (Al) phóng thích một năng lượng
426,3kJ. Mặt khác, đốt cháy hoàn toàn 5,400grams bột nhôm kim loại (Al) giải phóng
167,3kJ. Tính nhiệt tạo thành của iron (III) oxide rắn.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
2. Khi đốt cháy amonia (khí) trong không khí thì thu được nitrogen (khí) và nước lỏng. Biết
rằng ở 250C, cứ 1 atm tạo thành 4,89 lít khí nitrogen (N2) thì thoát ra nhiệt lượng 153,06kJ.
Cho nhiệt tạo thành nước lỏng là -285,84kJ.mol-1.
- Tính hiệu ứng nhiệt của phản ứng hóa học.
- Tính nhiệt tạo thành của amonia (k). lOMoAR cPSD| 47207194 13
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Bài tập 9. Một người dùng 2 tay để giữ cục băng 20 g(nước đá) ở nhiệt độ 00C và giữ liên
tục đến khi tan chảy thành nước và tiến tới cân bằng nhiệt độ với cơ thể người. Nếu chỉ xét
riêng quá trình này hãy tính sự thay đổi entropy của cơ thể người? Cho biết nhiệt dung riêng
của nước là 4200 J/kg.C và nhiệt nóng chảy của băng đá là 333 kJ/kg.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài tập 10. Thả một viên nước đá có khối lượng 10,00 grams có nhiệt độ -25oC vào 300,00
mL dung dịch ancol ethylic 39,5o ở nhiệt độ phòng 25oC đến khi hệ đạt cân bằng nhiệt. Tính
biến thiên entropy của quá trình trên?
- Khối lượng riêng của nước và ethanol lần lượt là 1 g/mL và 0,6 g/mL.
- Nhiệt dung đẳng áp của nước đá là 37,66 J.mol.K, nước lỏng là 75,31 J/mol.K và ethanol là 113 J/mol.K.
- Nhiệt nỏng chảy của nước đá là 6,009 kJ/mol.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Chương 4: Dung dịch – Pin điện hóa Bài tập 1. Pha trộn dung dịch 1.
Cần bao nhiêu m (gam) tinh thể NaOH khan để pha thành 1000ml dung dịch NaOH có nồng độ 10% (w/w). lOMoAR cPSD| 47207194 14
…………………………………………………………………………………………………..
………………………………………………………………………………………………….
…………………………………………………………………………………………………
………………………………………………………………………………………………… 2.
Muốn pha 500ml dung dịch Na2S2O3 có nồng độ 5% (w/v). Hãy tính lượng m (gam) tinh
thể Na2S2O3.5H2O cần dùng?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………. 3.
Để pha thành 2000ml dung dịch HCl có nồng độ 7% (v/v) thì cần bao nhiêu V(ml) dung
dịch HCl đậm đặc 37% (d=1,19 g/ml).
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… 4.
Cần bao nhiêu m (gam) tinh thể Na2SO4 khan để pha thành 100ml dung dịch Na2SO4 có nồng độ 5% (w/w).
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… 5.
Muốn pha 800ml dung dịch CuSO4 có nồng độ 10% (w/v). Hãy tính lượng m (gam) tinh thể CuSO4.5H2O cần dùng?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………. 6.
Để pha 1000ml dung dịch CH3COOH có nồng độ 7% (v/v) thì cần bao nhiêu V(ml) dung
dịch CH3COOH đậm đặc 99% (d=1,09 g/ml).
………………………………………………………………………………………………..
………………………………………………………………………………………………… lOMoAR cPSD| 47207194 15
………………………………………………………………………………………………….
………………………………………………………………………………………………….
Bài tập 2. pH dung dịch acid – base
1. Tính pH của dung dịch HCl ứng với các nồng độ sau: 10-4M và 10-7M.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
2. Tính pH của dung dịch amonia (NH3) có nồng độ 0,15M. Biết rằng pKa (NH3) = 9,24.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
3. Tính pH và xác định sự tồn tại các cấu tử của dung dịch H2S có nồng độ 0,1M.
Cho H2S có pKa1 = 6,99 và pKa2 = 12,92.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
4. Tính pH của dung dịch NH4Cl 0,1M và NH3 0,16M. (pKa = 9,24)
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
5. Tính pH của dung dịch KHS 0,1M.
…………………………………………………………………………………………………
………………………………………………………………………………………………… lOMoAR cPSD| 47207194 16
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………..
………………………………………………………………………………………………….
Bài tập 3. Định luật Raoult
1. Hòa tan 36,0 grams một chất tan không điện li có công thức chung nhất là (CH2O)m trong
1,2 kilograms nước. Dung dịch đông đặc ở -0,93 0C, hằng số nghiệm đông của nước là
1,860C. Xác định công thức phân tử của chất tan này, viết các đồng phân thỏa điều kiện của công thức này.
......................................................................................................................................................
......................................................................................................................................................
......................................................................................................................................................
......................................................................................................................................................
................................................................................................................................................
………………………………………………………………………………………………….
2. Ở áp suất 1,00 atm độ tan của oxygen khí trong nước Nhiệt độ (0C) Khả năng tan 00C 2,18.10-3M 250C 1,26.10-3M
- Xác định thể tích oxygen khí đo ở 250C và 1,00 atm bị đẩy ra khi 515,00mL nước bão hòa
oxygen được đung nóng từ 0 lên 250C.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
3. Khối lượng mol chất này là bao nhiêu ? Biết rằng 1 lít dung dịch nước chứa 2,00grams chất
tan không điện li, không bay hơi có áp suất thẩm thấu 0,20atm tại 250C.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………… lOMoAR cPSD| 47207194 17
4. Ở 25oC, áp suất hơi của nước nguyên chất là 23,76 mmHg, áp suất hơi của dung dịch urê là
22,98mmHg. Tính nồng độ molan của dung dịch urê?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………..
5. Trong 4450g nước có chứa 1kg chất chống đông etylen glycol (C2H6O2). Cho biết nhiệt độ
sôi, nhiệt độ đông đặc của dung dịch này. Nước có Ks = 0,512, Kđ = 1,86.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………..
6. Nhiệt độ đông đặc của dung dịch chứa 0,224g acid benzoic trong 20g benzen tinh khiết là
5,2320C. Cho biết Kđ của benzen là 4,90 và nhiệt độ đông đặc của benzen tinh khiết là
5,4780C. Hãy xác định dạng tồn tại của acid benzoic trong dung dịch ?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………..
7. Tính nồng độ thẩm thấu của các dung dịch NaCl 0,9% và dung dịch glucose 5%?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Bài tập 4. Hãy thử xác định nồng độ đương lượng của oxalic aicd H2C2O4 khi -
Dung dịch tinh khiết đến 95%, có nồng độ 0,1M.
- Hòa tan tinh thể H2C2O4.2H2O có nồng độ C%(w/w) là 10% và D = 1,65g/mL.
…………………………………………………………………………………………………
………………………………………………………………………………………………… lOMoAR cPSD| 47207194 18
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
…………………………………………………………………………………………………..
Bài tập 5. Cho phản ứng:
KMnO4 + H2C2O4 + H2SO4 → MnSO4 + CO2 + K2SO4 + H2O
Hoà tan hoàn toàn 12,600 g H2C2O4.2H2O bằng nước cất vừa đủ 1,0 lít. a.
Tính nồng độ đương lượng của dung dịch H2C2O4 vừa pha ?
b. Lấy 10,00 ml dung dịch H2C2O4 vừa pha đem phản ứng vừa đủ với 9,50 ml dung dịch
KMnO4 trong môi trường H2SO4. Tính nồng độ đương lượng và nồng độ mol của dung dịch KMnO4?
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Chương 5: Phức chất – Kim loại chuyển tiếp I.
Trạng thái lai hóa, cấu trúc hình học không gian của phức chất Phức chất Trạng thái Cấu trúc hình học Màu sắc Từ tính lai hóa NTTT [Ag(NH3)2]Cl sp Thẳng Không màu Nghịch từ K2[NiCl4] sp3 Tứ diện Có màu Thuận từ K2[Ni(CN)4] dsp2 Vuông phẳng Có màu Nghịch từ Na2[Zn(OH)4] sp3 Tứ diện Không màu Nghịch từ Fe(CO)5 dsp3 Lưỡng tháp tam giác Có màu Nghịch từ [Co(NH3)6]Cl3 d2sp3 Bát diện Có màu Nghịch từ [Cu(NH3)4](NO3)2 dsp2 Vuông phẳng Có màu Nghịch từ K2PtCl4 dsp2 Vuông phẳng Có màu Nghịch từ lOMoAR cPSD| 47207194 19 [FeF6]Br3 sp3d2 Bát diện Có màu Thuận từ Nhận xét
- Từ tính của phức chất dựa vào sự có mặt của electron độc thân trong phức chất. Nếu phức
chất có electron độc thân thì thuận từ và không có electron độc thân thì nghịch từ.
- Màu sắc của phức chất dựa vào số electron trên orbital, nếu từ 1 – 9 thì phức chất có màu
và 10electron (Cu+, Ag+, Zn2+) thì phức chất không màu.
- Các phối tử trường mạnh thường là: OH-, NH3, CN-, CO.
- Các phối tử trường yếu thường là: halide (F, Cl, Br) II.
Nhận xét khái quát về phức chất
Hằng số bền của phức chất càng lớn thì phức chất càng bền, hằng số phân ly càng nhỏ thì
phức chất càng kém bền
1. Thuyết trường tinh thể
• Phức bền do lực tương tác tĩnh điện giữa ion trung tâm và phối tử
• Phức chất đa diện và có tính đối xứng.
• Phối tử có vai trò là 1 trường tĩnh điện bên ngoài.
2. Sự khác biệt về năng lượng các orbital d
- Phụ thuộc vào bản chất của kim loại và phối tử.
- Xác định màu sắc và tính chất của từ tính.
- Năng lượng tách delta tăng khi trạng thái oxyd hóa tăng. III.
Tính chất của nguyên tố d Đặc điểm Số oxi hóa thấp Số oxi hóa cao Bán kính ion Lớn (tính kim loại)
Nhỏ (tính không kim loại) Điện tích Nhỏ Lớn Tác dụng phân cực Nhỏ Lớn Tính liên kết Ion – cộng hóa trị Cộng hóa trị phân cực Dẫn xuất Base, lưỡng tính Acid
- Nguyên tố d sớm là nguyên tố từ nhóm IIIB đến nhóm VIIB.
- Nguyên tố d muộn là nguyên tố từ nhóm VIIIB, IB và IIB. lOMoAR cPSD| 47207194 20
- Các nguyên tố d sớm và phân nhóm VIIIB dễ dàng đạt số oxy hóa dương cao nhất hơn các
nguyên tố d muộn. Các nguyên tố d muộn không đạt số oxy hóa cao nhất bằng số thứ tự của phân nhóm.
- Trong cùng một phân nhóm, theo chiều tăng điện tích hạt nhân thì độ bền số oxy hóa
dương cao tăng dần, ngược lại độ bền số oxy hóa dương thấp giảm dần.
Ví dụ: Cu, Ag đều có số oxy hóa +1, +2 vì chúng cùng một phân nhóm, tuy nhiên độ bền
của Cu2+ > Ag2+ và độ bền của Cu+ < Ag+. IV.
Tính chất của kim loại chuyển tiếp
Tính chất của Chromium (III) hydroxide
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
……………………………………………………………………………………………….
Cơ thể hấp thu chromium dưới dạng………………………………………………………...
Tính chất của Cu(I)
…………………………………………………………………………………………………
………………………………………………………………………………………………….
Tính chất của mangan và các hợp chất có Mn
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
……………………………………………………………………………………………….
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
……………………………………………………………………………………………….
Cân bằng hóa học của Mn(VII)
………………………………………………………………………………………………..
………………………………………………………………………………………………….
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..