













Preview text:
HỆ THỐNG HÓA LÝ 2 CUỐI KỲ_ĐIỆN (Trắc nghiệm)
CHƯƠNG 3: TƯƠNG TÁC ION – ION TRONG DUNG DỊCH ĐIỆN LY
1. Cân bằng nhiệt động trong dung dịch điện ly – Hoạt độ - Hệ số hoạt độ
- Nồng độ - Hoạt độ - Hệ số hoạt độ
- Hoạt độ trung bình và hệ số hoạt độ - Lực ion
- Phương trình Lewis – Randall – Bronsted
2. Thuyết tĩnh điện Debye – Huckel
- Thuyết Debye – Huckel và hệ số hoạt độ
- Định luật giới hạn Debye – Huckel thứ nhất / gần đúng bậc 2 / gần đúng bậc 3
- Hằng số phân ly biểu kiến & nhiệt động
- Độ phân ly, pH và độ tan biểu kiến
CHƯƠNG 4: TÍNH DẪN ĐIỆN CỦA DUNG DỊCH ĐIỆN LY
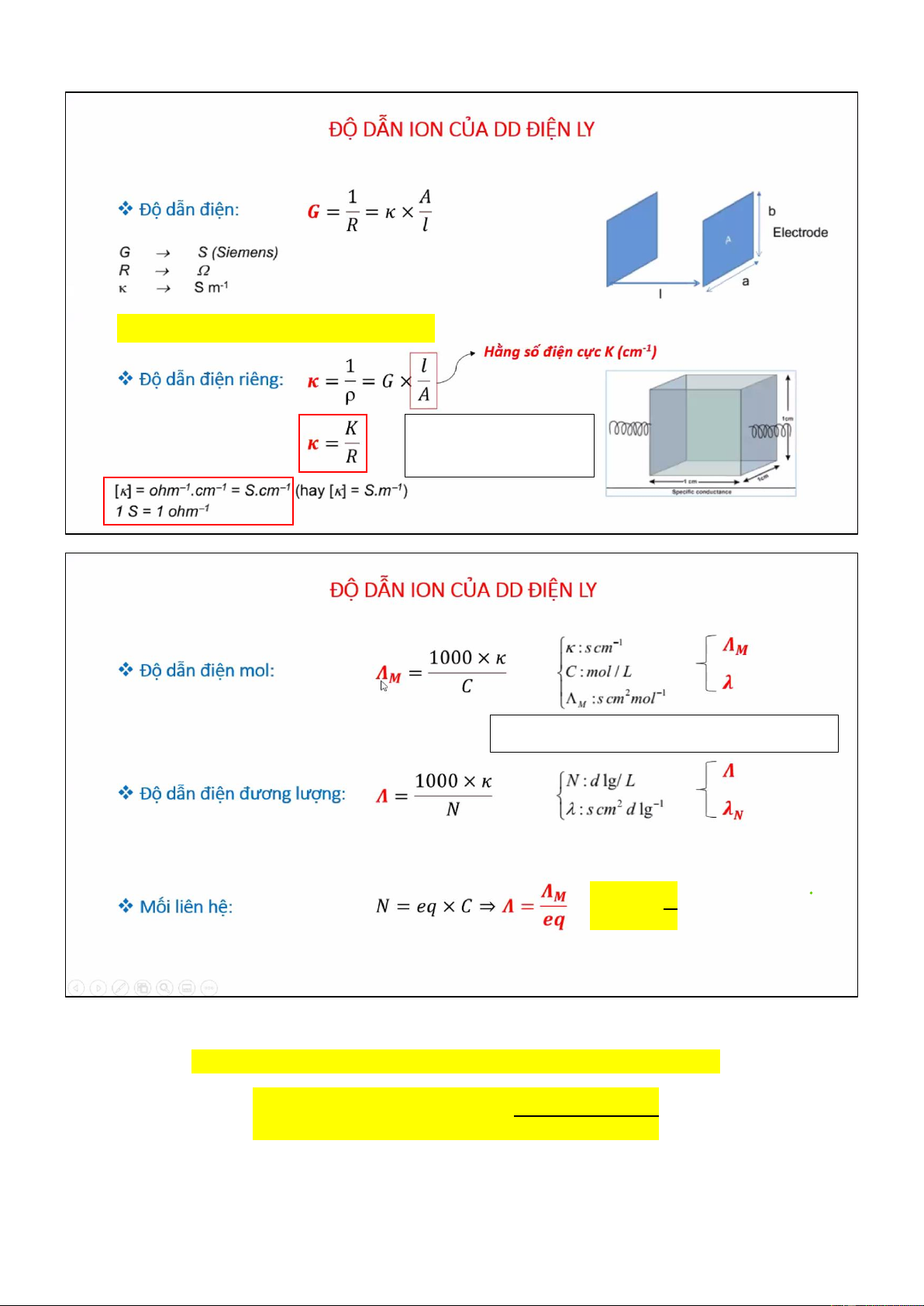
1. Độ dẫn ion của dung dịch điện ly - Độ dẫn điện G -
Độ dẫn điện riêng Kappa κ -
Độ dẫn điện mol λM, độ dẫn điện đương lượng λN -
Mối liên hệ của độ dẫn điện mol và độ dẫn điện đương lượng
2. Linh độ ion – Độ dẫn điện ion
3. Định luật Kohlrausch
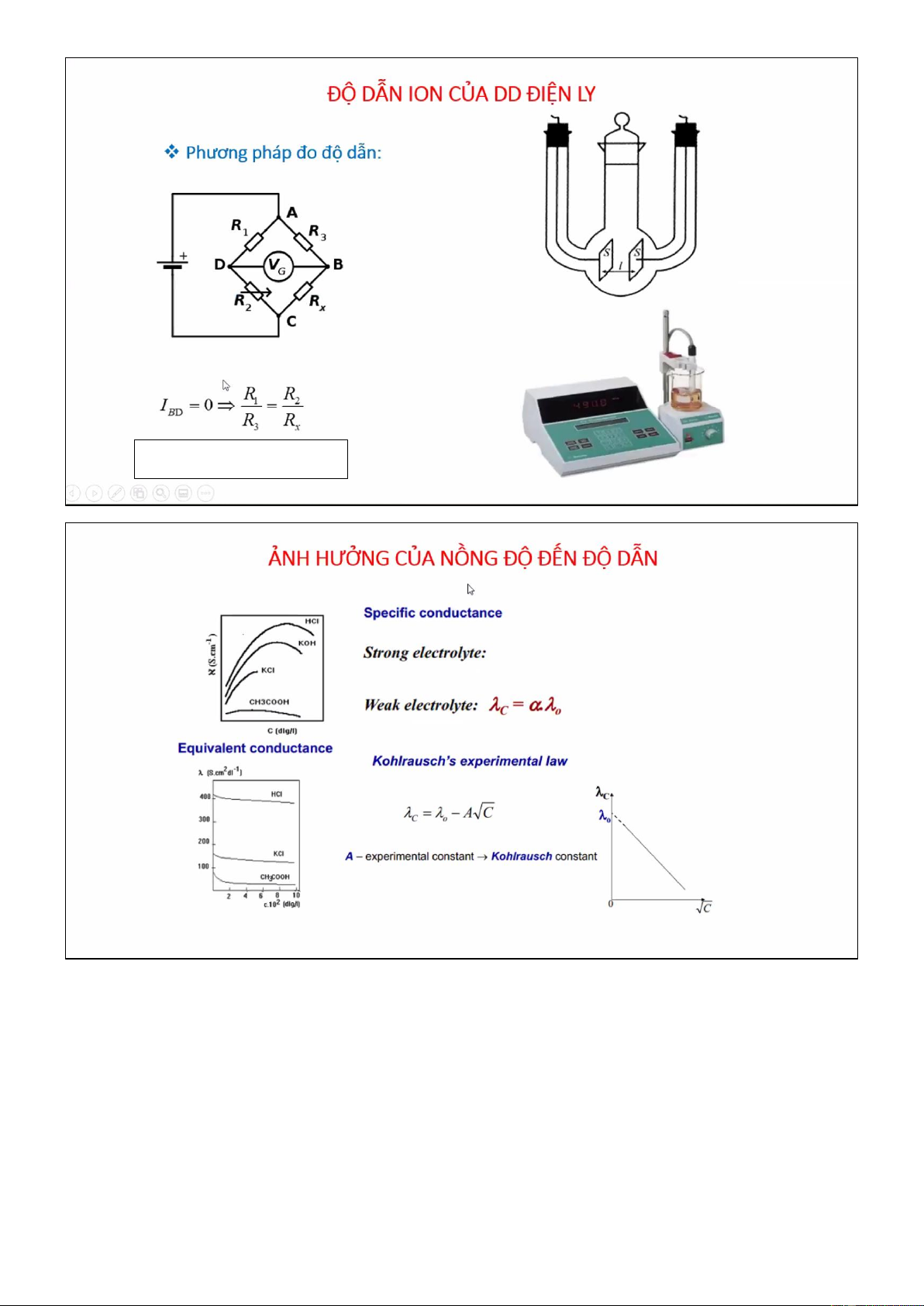
4. Phương pháp đo độ dẫn
5. Xác định độ dẫn điện đương lượng tới hạn
6. Ảnh hưởng của nồng độ đến độ dẫn (PT kinh nghiệm Kohlrausch)
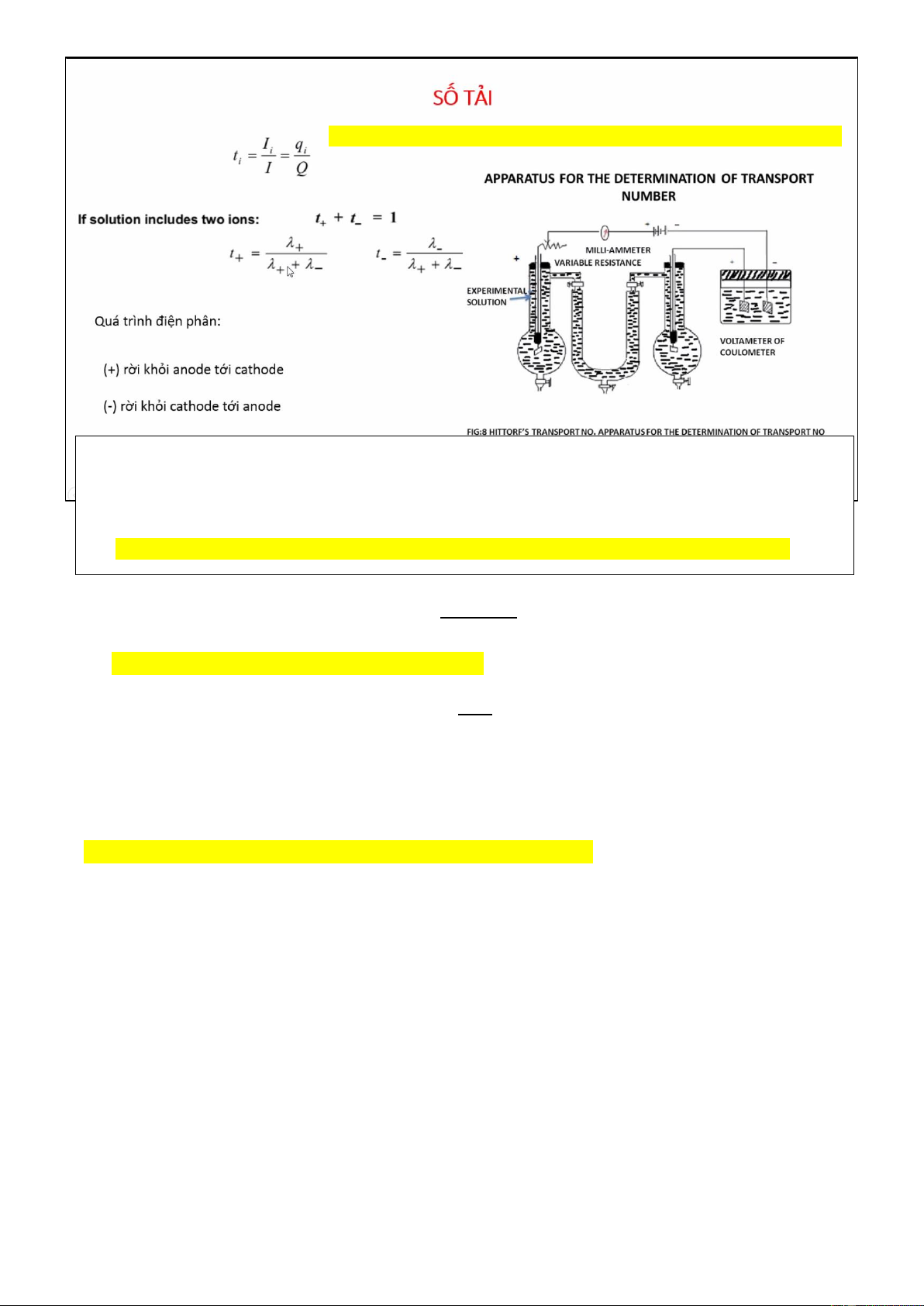
7. Ảnh hưởng của nhiệt độ đến độ dẫn 8. Số tải
CHƯƠNG 5: CÂN BẰNG ĐIỆN CỰC VÀ PIN ĐIỆN HÓA
1. Pin điện hóa (Pin Galvani) - Sơ đồ pin - Tính thế khử 2. Điện cực -
Điện cực loại 1 (M | Mn+) -
Điện cực loại 2 (M, MX | X) -
Điện cực oxy hóa khử (Pt | OXD, RED) -
Điện cực khí (Pt, gas | ion)
3. Phương trình Nernst 4. Điện phân Các dạng bài tập
CHƯƠNG 3: TƯƠNG TÁC ION – ION TRONG DUNG DỊCH ĐIỆN LY h = -0.507
CHƯƠNG 4: TÍNH DẪN ĐIỆN CỦA DUNG DỊCH ĐIỆN LY
A = a x b là thiết diện (cm2)
l là khoảng cách (cm)
𝜿𝒅𝒅 𝒃ã𝒐 𝒉ò𝒂 đ𝒊ệ𝒏 𝒍𝒚 𝒚ế𝒖 = 𝜿𝒅𝒅 − 𝜿𝒏ướ𝒄 1 m = 100 cm 1 m-1 = 1/100 cm-1
LƯU Ý: dùng đúng đơn vị quy ước 𝟏 𝐃𝐨 𝝀 ~ 𝑪 MỐI LIÊN HỆ
𝑁ồ𝑛𝑔 độ đươ𝑛𝑔 𝑙ượ𝑛𝑔 = 𝑁ồ𝑛𝑔 độ 𝑚𝑜𝑙 × 𝑆ố đươ𝑛𝑔 𝑙ượ𝑛𝑔
Độ 𝑑ẫ𝑛 đ𝑖ệ𝑛 𝑚𝑜𝑙
Độ 𝑑ẫ𝑛 đ𝑖ệ𝑛 đươ𝑛𝑔 𝑙ượ𝑛𝑔 =
𝑆ố đươ𝑛𝑔 𝑙ượ𝑛𝑔
Khi tính tổng độ dẫn điện, nên dùng độ dẫn điện đương lượng vì không nhân số eq
LƯU Ý: khi tính độ điện ly và hằng số cân bằng,
ta phải dùng nồng độ đương lượng và độ dẫn điện
đương lượng (S.cm2.dlg-1)
LƯU Ý: bảng giá trị là độ dẫn điện
đương lượng (S.cm2.dlg-1)
Xác định độ dẫn điện đương lượng tới hạn (triệt tiêu ion)
𝝀𝒐𝑪𝑯𝟑𝑪𝑶𝑶𝑯 = 𝝀𝒐𝑪𝑯𝟑𝑪𝑶𝑶𝑵𝒂 + 𝝀𝒐𝑯𝑪𝒍 − 𝝀𝒐𝑵𝒂𝑪𝒍
Ảnh hưởng của nhiệt độ đến độ dẫn điện đương lượng (bỏ qua −𝜷(𝒕 − 𝒕𝒐)𝟐)
𝝀𝒕 = 𝝀𝒐[𝟏 + 𝜶(𝒕 − 𝒕𝒐)]
Độ dẫn điện mol thì nhân eq, còn độ
dẫn điện đương lượng thì không nhân
Mạch cầu cân bằng
Dung dịch chứa Cu2+ thì nhớ nhân Z = 2, còn Ag+ thì ko cần nhân
➢ Cation đi từ trái (anode) sang phải (cathode)
➢ Anion đi từ phải (cathode) sang trái (anode)
Dựa vào đề nói nằm ở cực nào mà liên quan đến ion đó, từ đó tính được các giá trị liên quan
➔ Lượng ion di chuyển/giảm đi/tăng lên/hình thành hợp chất là lượng tải đi |𝑛 𝑡 𝑜 − 𝑛𝑡| ± = 𝑛
1. Tổng lượng tải đi của A+ và B- trong hệ là kí hiệu n 𝐼𝑡 𝑛 = 𝑛𝑒𝐹
Trong đó: ne là số e trao đổi (bằng Z)
2. no là lượng/số mol ban đầu trong dung dịch
3. nt là lượng/số mol lúc sau
4. Lượng/số mol thay đổi |no - nt| là lượng tải của ion
CHƯƠNG 5: CÂN BẰNG ĐIỆN CỰC VÀ PIN ĐIỆN HÓA
PIN ĐIỆN HÓA (PIN GALVANI)
𝑬𝒐𝒑𝒊𝒏 = 𝑬𝒐𝒄𝒉ấ𝒕 𝒐𝒙𝒉 − 𝑬𝒐𝒄𝒉ấ𝒕 𝒌𝒉ử
Định luật Faraday cho điện phân: 𝒒 𝑰𝒕 𝒎 = × 𝑨 =
× 𝑨, 𝑣ớ𝑖 𝐴: 𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑚𝑜𝑙, 𝐼: 𝑐ườ𝑛𝑔 độ 𝑑ò𝑛𝑔 đ𝑖ệ𝑛 (𝐴), 𝑡: 𝑡ℎờ𝑖 𝑔𝑖𝑎𝑛 𝒏𝒆𝑭 𝒏𝒆𝑭 𝐴 𝑚 𝑘 = =
: đươ𝑛𝑔 𝑙ượ𝑛𝑔 đ𝑖ệ𝑛 ℎó𝑎 (𝑔/𝐶) 𝑛𝑒𝐹 𝑞 𝐼𝑡 𝑞 𝑞𝐹 = =
: đ𝑖ệ𝑛 𝑙ượ𝑛𝑔 𝑡ℎ𝑒𝑜 đơ𝑛 𝑣ị 𝐹𝑎𝑟𝑎𝑑𝑎𝑦 (𝐹) 𝐹 𝐹
ĐIỆN PHÂN – pethaict@gmail.com PHÂN BIỆT Pin điện hóa: anode (-) cathode (+) Điện phân: anode (+) cathode (-)
Cathode – quá trình khử - chất oxh/cation nhận e-
Anode – quá trình oxh - chất khử/anion nhường e
Dương cực tan: Nồng độ ở cathode phải lớn hơn ở anode thì pứ mới xảy ra
VIẾT PHƯƠNG TRÌNH ĐIỆN CỰC KHI CÓ CHẤT ÍT TAN
- Xuất hiện chất ít tan ở TÁC CHẤT → có điện cực loại 2 ở CATHODE
- Xuất hiện chất ít tan ở SẢN PHẨM → có điện cực loại 2 ở ANODE
HỆ THỐNG HÓA LÝ 2 CUỐI KỲ_ĐỘNG (Tự luận)
CHƯƠNG 1: CÁC KHÁI NIỆM VÀ QUY LUẬT CƠ BẢN
1. Các điều kiện để phản ứng xảy ra
2. Khái niệm tốc độ phản ứng
3. Phân loại các loại phản ứng
- Phản ứng đơn giản
- Phản ứng phức tạp
GIAI ĐOẠN TỐC ĐỊNH: giai đoạn chậm quyết định tốc độ phản ứng
➔ Biểu thức động học
4. Một số khái niệm khác
CHƯƠNG 2: TỐC ĐỘ PHẢN ỨNG
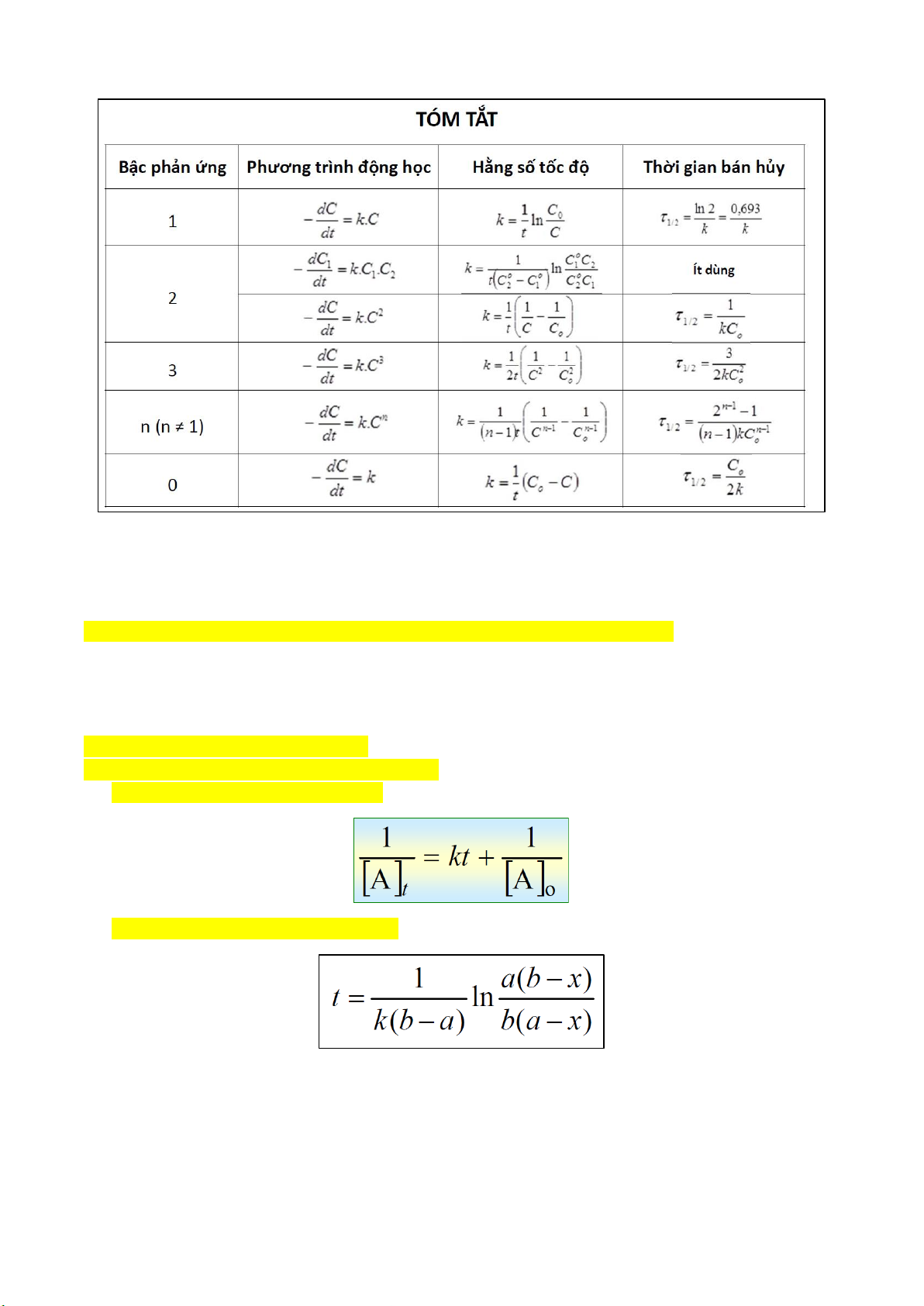
1. PHẢN ỨNG ĐƠN GIẢN Bậc 1 A → sp Bậc 2 2A → sp A + B → sp Bậc 3
A + B + C → sp 2A + B → sp Bậc n Bậc 0
2. PHƯƠNG PHÁP XÁC ĐỊNH N,K
3. PHẢN ỨNG PHỨC TẠP Bậc 1 Thuận nghịch Bậc 2 Nối tiếp Song song
CHƯƠNG 3: CÁC THUYẾT VỀ PHẢN ỨNG CƠ BẢN
1. ẢNH HƯỞNG CỦA NHIỆT ĐỘ
- Quy tắc Van’t Hoff
- Mối liên hệ giữa hằng số tốc độ phản ứng với nhiệt độ
2. THUYẾT VA CHẠM HOẠT ĐỘNG
3. THUYẾT TRẠNG THÁI CHUYỂN TIẾP ĐỊNH LƯỢNG
CHƯƠNG 4: PHẢN ỨNG DÂY CHUYỀN
1. NGUYÊN LÝ NỒNG ĐỘ ỔN ĐỊNH
2. PHẢN ỨNG DÂY CHUYỀN KO PHÂN NHÁNH – PHƯƠNG TRÌNH ĐỘNG HỌC
3. PHẢN ỨNG DÂY CHUYỀN PHÂN NHÁNH – GIỚI HẠN NỔ (đọc thêm)
CHƯƠNG 5: PHẢN ỨNG QUANG HÓA (QUANG HÓA HỌC)
1. CÁC KHÁI NIỆM VÀ QUY LUẬT CƠ BẢN
- Định luật quang hóa – đơn vị Einstein
- Hiệu suất lượng tử - Chất cảm quang
- Năng lượng photon
- Phản ứng quang hợp
2. Động học các quá trình quang hóa (đọc thêm) CÁC DẠNG BÀI TẬP
CHƯƠNG 1: CÁC KHÁI NIỆM VÀ QUY LUẬT CƠ BẢN
1. Xác định bậc n phản ứng, tính k dựa vào bảng số liệu (lập tỉ lệ tốc đầu)
𝒍𝒐𝒈𝑾 𝒐 − 𝒍𝒐𝒈𝑾 𝒐 𝒏 𝟐 𝟏 𝑨 = 𝒍𝒐𝒈𝑪 𝒐 𝒐
𝑨,𝟐 − 𝒍𝒐𝒈𝑪𝑨,𝟏
2. Viết biểu thức tốc độ phản ứng phức tạp W = k….. (giai đoạn tốc định) CHƯƠNG 2: 1. Phản ứng bậc 1:
- Tính t, k dựa vào dữ kiện đề bài
- Lượng còn lại (At = A - x), lượng phản ứng (x) - Thời gian bán hủy
- Giả sử đây là phản ứng bậc 1, tính ki → HẰNG SỐ → KẾT LUẬN 2. Phản ứng bậc 2:
- Tính t, k dựa vào dữ kiện đề bài
- Lượng còn lại (At = A - x), lượng phản ứng (x) - Thời gian bán hủy
- Trộn 2 chất (thủy phân ester)
➔ Tính lại nồng độ → áp vào công thức
+ Nồng độ đầu giống: 2A → sp
+ Nồng độ đầu khác: A + B → sp
3. Phản ứng bậc 3: (chưa thấy bài tập)
- Tính t, k dựa vào dữ kiện đề bài
- Lượng còn lại (At = A - x), lượng phản ứng (x) - Thời gian bán hủy 4. Phản ứng bậc n:
- Thời gian bán hủy t1/2 theo n (tổng quát) 5. Phản ứng bậc 0: - Thời gian bán hủy
6. Phương pháp xác định n, k
a) Tốc độ đầu (chương 1) b) Thế (giả sử…) c) Đồ thị (vẽ excel)
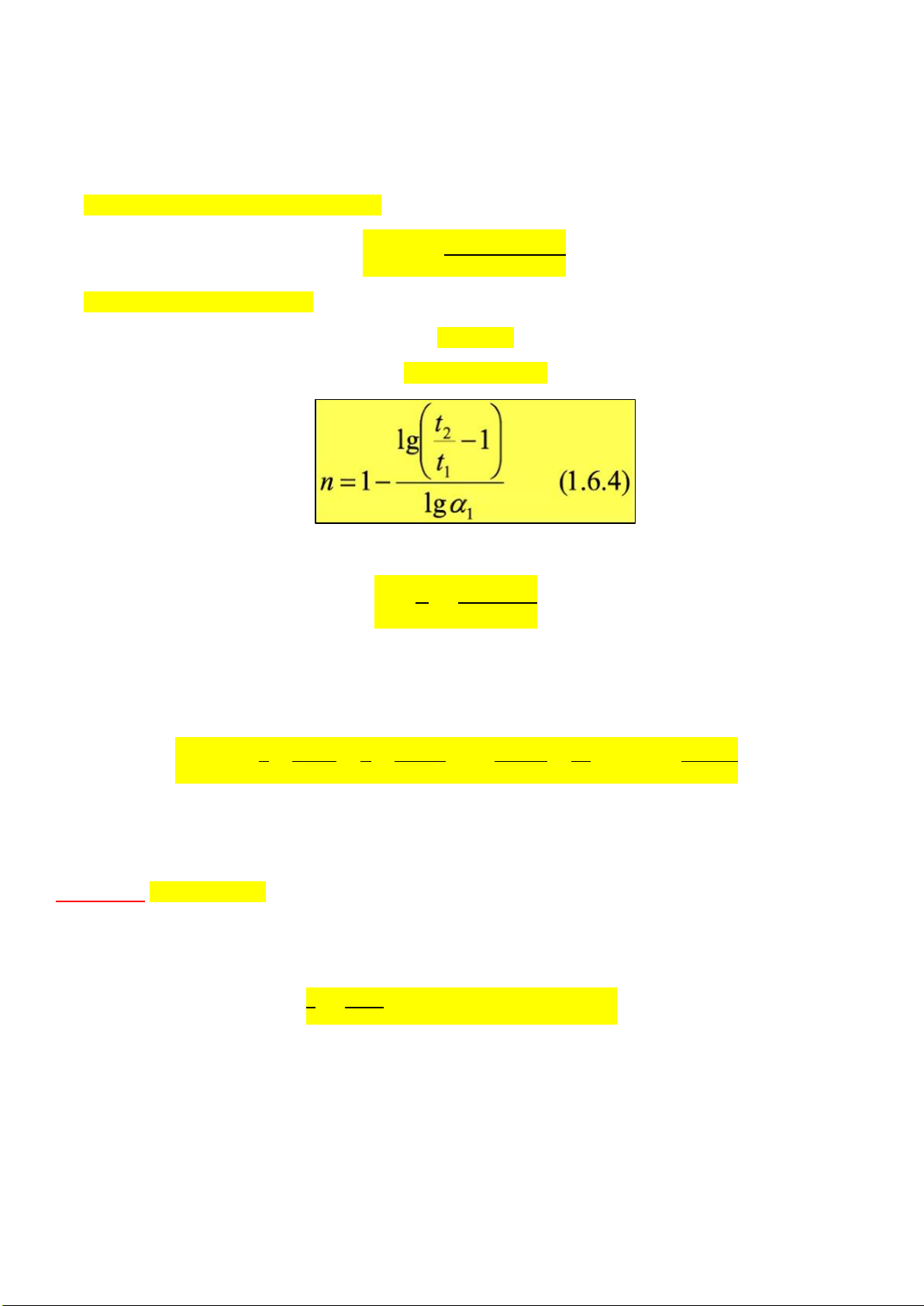
d) Thời gian bán hủy (công thức) 𝐥𝐨𝐠 (𝐭𝟏 𝒏 = 𝟏 +
𝟏/𝟐/𝐭𝟐𝟏/𝟐)
𝐥𝐨𝐠 (𝑪𝒐,𝟐/𝑪𝒐,𝟏)
e) Đường cong động học α = C/Co α 2
2 = α1 → TÌM t2 7. Dạng vô cùng: 𝟏 𝑽 𝒌 =
𝒍𝒏 ∞ − 𝑽𝒐 𝒕 𝑽∞ − 𝑽𝒕
(PHẢN ỨNG BẬC 1)
8. Phản ứng thuận nghịch bậc 1 1A = 1B 1 𝐴 1 𝑥 𝑏 + 𝑥 𝑘 𝐾𝑎 − 𝑏 𝑘 𝐶 𝐶 𝑡 𝑡 + 𝑘𝑛 = 𝑙𝑛 = 𝑙𝑛 ; 𝐾 = = ; 𝐴 = 𝑥 𝑡 𝐴 − 𝑥 𝑡 𝑥 𝐶 = 𝐶 − 𝑥 𝑎 − 𝑥𝐶 𝑘𝑛 𝐾 + 1 - Tính kt và kn
- Tính lượng còn lại (a-x), lượng phản ứng (x)
- Tính thời gian đạt cân bằng (tìm t∞, x = 0,99xC hoặc x = 0,999xC)
Cách làm: K, a, b, xC = A (t = vô cùng) → Giải hệ phương trình tìm các dữ kiện đề yêu cầu 1A = 2B
(tìm lại phương trình động học mới) 𝟏 𝒂 𝒍𝒏 = 𝒌 𝟑 𝒂−𝟑𝒙
𝒕(𝐤𝐡𝐢 𝐤𝐭 = 𝐤𝐧 = 𝐤)
9. Phản ứng thuận nghịch bậc 2 (coi sơ)
10. Phản ứng nối tiếp
A ⟶ B ⟶ C
- [B]max khi nào, tìm tmax ? [B]max là bao nhiêu ?
➔ Đạo hàm vi phân hàm [B] cho bằng 0 → tmax
➔ Thay tmax vào hàm [B] được [B]max 𝒍𝒏𝒌 𝟏 𝒌 𝒕 𝟏 − 𝒍𝒏𝒌𝟐 𝟏 [𝑩] = = 𝒍𝒏 𝒎𝒂𝒙 𝒌𝟏 − 𝒌𝟐 𝒌𝟏 − 𝒌𝟐 𝒌𝟐 𝒌
[𝑩] = 𝒙 − 𝒚 = 𝒂 ( 𝟏
) (𝒆−𝒌𝟏𝒕 − 𝒆−𝒌𝟐𝒕) 𝒌𝟐 − 𝒌𝟏
11. Phản ứng song song Song song bậc 1:
A ⟶ C1, A ⟶ C2
- Tính k1 và k2 (giải hệ phương trình) 𝟏 [𝑨 𝒌 𝒐] 𝟏 + 𝒌𝟐 = 𝒍𝒏
(𝒕á𝒄 𝒄𝒉ấ𝒕) 𝒕 [𝑨𝒕] 𝒌𝟏 [𝑪 =
𝟏] (𝒕ỉ 𝒍ệ 𝒔ả𝒏 𝒑𝒉ẩ𝒎) 𝒌𝟐 [𝑪𝟐]
Song song bậc 2: (xem thêm)
Song song bậc trộn lẫn (1 và 2): (xem thêm)
CHƯƠNG 3: CÁC THUYẾT VỀ PHẢN ỨNG CƠ BẢN
1. Quy tắc Van’t Hoff (áp dụng khi t < 100oC) 𝒗𝟐 𝒌 𝒕 𝒕𝟐−𝒕𝟏 𝟏
= 𝟐 = 𝟏 (𝒕𝒉ờ𝒊 𝒈𝒊𝒂𝒏) = 𝜸 (𝒏𝒉𝒊ệ𝒕 độ) 𝟏𝟎 (𝒗~ ) 𝒗𝟏 𝒌𝟏 𝒕𝟐 𝒕
2. Mối liên hệ giữa hằng số tốc độ phản ứng và nhiệt độ −𝑬 𝒌 = 𝑨. 𝒆−𝑬 𝒂
𝒂/𝑹𝑻 𝒉𝒂𝒚 𝒍𝒏𝒌 = + 𝒍𝒏𝑨 𝑹𝑻
Trong đó: R = 8,314 J/mol.K = 1,987 cal/mol.K = 0,082 L.atm/mol.K −𝑬
a) Phương pháp đồ thị: Hệ số góc là
𝒂, tung độ gốc là lnA 𝑹
b) Phương pháp đại số: 𝒌 𝑬 𝟏 𝟏 𝒍𝒏 𝟐 = 𝒂 ( − ) 𝒌 𝑹 𝑻 𝑻 𝟏 𝟏 𝟐
Phản ứng thuận nghịch: ∆E = ∆H = Ea (thuận) – Ea (nghịch)
3. Thuyết va chạm hoạt động
MA, MB: khối lượng của một nguyên tử/phân tử A, B = khối lượng mol / Số Avogrado
𝐤𝐁 = 𝟏, 𝟑𝟖 × 𝟏𝟎−𝟐𝟑𝐉/𝐊 = 𝟏, 𝟑𝟖 × 𝟏𝟎−𝟐𝟑 × 𝟏𝟎𝟑𝐠 × 𝟏𝟎𝟒𝐜𝐦𝟐/𝐬𝟐. 𝐊
𝟏𝐉 = 𝟏𝐤𝐠. 𝐦𝟐/𝐬𝟐 = 𝟏𝟎𝟑𝐠 × 𝟏𝟎𝟒𝐜𝐦𝟐/𝐬𝟐
4. Thuyết trạng thái chuyển tiếp định lượng 𝒌 −∆𝑮# 𝒌 𝑩𝑻 𝑳𝑻 = . 𝒆 𝑹𝑻 𝒉 𝑘 −∆𝐻# ∆𝑆# 𝑘 −𝐸𝑎 ∆𝑆# 𝑘 𝐵𝑇 𝐵𝑇 𝐿𝑇 = . 𝑒 𝑅𝑇 . 𝑒 𝑅 =
. 𝑒𝑛. 𝑒 𝑅𝑇 . 𝑒 𝑅 ℎ ℎ −𝐸𝑎
𝑘 = 𝐴. 𝑒 𝑅𝑇 𝒌 ∆𝑺#
𝑨 = 𝑩𝑻 . 𝒆𝒏. 𝒆 𝑹 𝒉
n = 1 (đơn), n = 2 (nhị), n = 3 (tam), n = 0 (Ea = deltaH#) Trong đó:
𝒉 = 𝟔, 𝟔𝟐𝟓 × 𝟏𝟎−𝟑𝟒 𝑱. 𝒔 𝑹 𝟖, 𝟑𝟏𝟒 𝒌𝑩 = =
= 𝟏, 𝟑𝟖 × 𝟏𝟎−𝟐𝟑𝑱/𝑲 𝑵𝑨
𝟔, 𝟎𝟐 × 𝟏𝟎𝟐𝟑
CHƯƠNG 4: PHẢN ỨNG DÂY CHUYỀN
1. Nguyên lý nồng độ ổn định
Khi tốc độ ổn định thì [R●] được xem là không đổi 𝒅[𝐑●] = 𝟎 𝒅𝒕 aA + bB → cC + dD 𝑑𝐴 𝑑𝐵 𝑑𝐶 𝑑𝐷 𝑊 = − = − = + = + 𝑎. 𝑑𝑡 𝑏. 𝑑𝑡 𝑐. 𝑑𝑡 𝑑. 𝑑𝑡
A + B → 𝐑● k1 𝒅[𝐑●] 𝑾 = = 𝒌𝟏[𝑨][𝑩] 𝒅𝒕
C + D → 𝐑● k2 𝒅[𝐑●] 𝑾 = = 𝒌𝟐[𝑪][𝑫] 𝒅𝒕
A + 𝐑● → C k3 𝒅[𝐑●] 𝒅[𝐑●] 𝑾 = − = 𝒌𝟑[𝑨][𝐑●] →
= −𝒌𝟑[𝑨][𝐑●] 𝒅𝒕 𝒅𝒕
𝐑●+ 𝐑●→ E k4 𝟏 𝒅[𝐑●] 𝟐 𝒅[𝐑●] 𝟐 𝑾 = − = 𝒌𝟒[𝐑●] →
= −𝟐𝒌𝟒[𝐑●] 𝟐 𝒅𝒕 𝒅𝒕
A + B → 𝐑●+ 𝐑● k5 → k5. 𝟏 𝒅[𝐑●] 𝒅[𝐑●] 𝑾 = = 𝒌𝟓[𝐀][𝐁] →
= 𝟐𝒌𝟓[𝐀][𝐁] 𝟐 𝒅𝒕 𝒅𝒕 Cách viết: 𝒅[𝐑●] = ±𝒌 𝒅𝒕
𝒊[𝒕á𝒄 𝒄𝒉ấ𝒕 𝟏][𝒕á𝒄 𝒄𝒉ấ𝒕 𝟐] …
- R● nằm ở tác chất → dấu trừ
- R● nằm ở sản phẩm → dấu cộng
- Nếu R● ở tác chất có hệ số tỉ lượng a ≠ 1 → nhân thêm a và mũ a ngoài dấu trừ
- Nếu R● ở sản phẩm có hệ số tỉ lượng a ≠ 1 → nhân thêm a (không mũ a) ngoài dấu cộng
2. Phương trình động học
Các bước thực hiện:
- Viết phương trình động học theo phương trình ban đầu của đề bài (quy tắc tương tự
khi viết d[R●]/dt), KHÔNG viết theo các gốc tự do của cơ chế phản ứng
- Cộng các biểu thức nguyên lý nồng độ ổn định để triệt tiêu các ẩn số và rút ẩn cần
thiết dựa trên phương trình động học đã viết
➔ CHÚ Ý: phương trình động học có thể còn nồng độ gốc tự do hoặc không
CHƯƠNG 5: QUANG HÓA HỌC
1. Định luật quang hóa – đơn vị Einstein
1 Einstein = 1 mol photon = NA số photon (NA = 6,02.1023: số Avogradro)
2. Định luật Lambert-Beer
3. Hiệu suất lượng tử CHÚ THÍCH:
+ Phản ứng tổng cộng thể hiện số phân tử phản ứng
∆𝑵 = 𝒏. 𝑵𝑨 Trong đó:
- n là số mol chất phản ứng (mol)
- NA = 6,02.1023 mol-1: số Avogradro
+ Giai đoạn hấp thụ photon (Giai đoạn đầu) thể hiện số photon bị hấp thụ
+ Năng lượng bức xạ hấp thụ:
∆𝑰 = 𝑰. 𝒕. 𝑯% Trong đó:
- I (hoặc P) là cường độ/công suất của ánh sáng (W = J/s)
- t là thời gian chiếu sáng (s)
- H% là hiệu suất hấp thụ (%) 4. Chất cảm quang
5. Năng lượng photon
6. Phản ứng quang hợp
- Năng lượng mặt trời = quang năng hấp thu = I.S.t
- Hóa năng tích lũy của chất hữu cơ = ∆H.m
- Hiệu suất chuyển quang năng thành hóa năng
𝒏ă𝒏𝒈 𝒍ượ𝒏𝒈 𝒕í𝒄𝒉 𝒍ũ𝒚 𝒉ó𝒂 𝒏ă𝒏𝒈 𝜽 = =
𝒏ă𝒏𝒈 𝒍ượ𝒏𝒈 𝒉ấ𝒑 𝒕𝒉𝒖
𝒒𝒖𝒂𝒏𝒈 𝒏ă𝒏𝒈
7. Động học các quá trình quang hóa (đọc thêm)

