






Preview text:
1
KIỂM TRA GIỮA KÌ I
Môn học : KHOA HỌC TỰ NHIÊN; lớp : 7
Thời gian làm bài: 90 phút
I. MỤC ĐÍCH CỦA ĐỀ KIỂM TRA : 1. Kiến Thức
- Đánh giá được kết quả học tập của HS về kiến thức, kĩ năng, khả năng vận dụng các nội
dung kiến thức về: Nguyên tử. Sơ lược về bảng tuần hoàn các nguyên tố hoá học, Phân tử. 2. Năng lực 2.1. Năng lực chung
- Năng lực tự chủ và tự học.
- Năng lực giải quyết vấn đề và sáng tạo.
2.2. Năng lực khoa học tự nhiên
- Nhận thức, tìm hiểu, vận dụng. 3. Phẩm chất :
- Chăm học, chịu khó.
- Có trách nhiệm trong khi thực hiện nhiệm vụ.
- Trung thực, cẩn thận trong khi làm bài, ghi chép cẩn thận.
II. HÌNH THỨC ĐỀ KIỂM TRA : Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 30% trắc nghiệm, 70% tự luận).
III. THIẾT LẬP MA TRẬN, BẢN ĐẶC TẢ ĐỀ KIỂM TRA :
3.1. Khung ma trận tra giữa kì 1 môn Khoa học tự nhiên, lớp 7
- Thời điểm kiểm tra: Kiểm tra giữa học kì 1 ( vào tuần học thứ 9), khi kết thúc nội dung:
Chương II. Phân tử. Liên kết hóa học.
- Thời gian làm bài: 90 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 30% trắc nghiệm, 70% tự luận). - Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 3,0 điểm, gồm 12 câu hỏi ở mức độ nhận biết
+ Phần tự luận: 7,0 điểm ( Nhận biết : 1 điểm, Thông hiểu : 3 điểm, Vận dụng: 2,0
điểm; Vận dụng cao: 1,0 điểm). Mỗi ý 0,5 điểm.
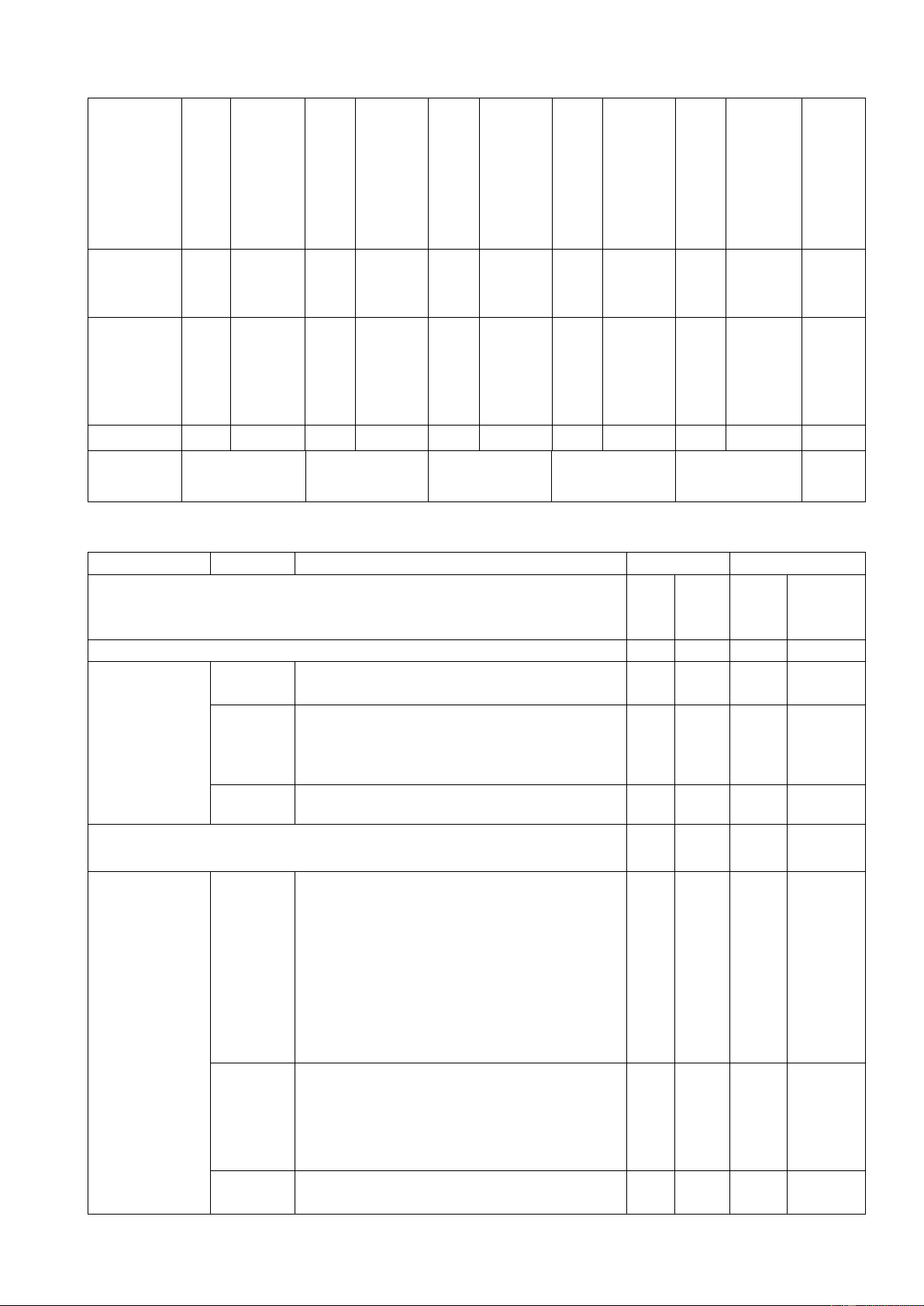
+ Nội dung giữa học kì 1: 100% (10 điểm, Chương I, II : 34 tiết). Chủ đề MỨC ĐỘ
Tổng số đơn Điểm Nhận biết Thông hiểu Vận dụng Vận dụng vị kiến thức số cao Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc
luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 0,5đ / số câu ý 1 2 3 4 5 6 7 8 9 10 11 12 1. Mở đầu 4 4 1 ( 4 tiết ) 2. 1 4 1 1 3 4 4,5 Nguyên 2 tử. Sơ lược về bảng tuần hoàn các nguyên tố hoá học ( 14 tiết ) 3. Phân 4 1 1 2 4 4,5 tử ( 16 tiết ). Số câu 1 12 2 1 1 5 12 TN/ Số ý TL (Số YCCĐ) Điểm số 1,0 3,0 3,0 2,0 1,0 7 3 Tổng số 4 điểm 3 điểm 2 điểm 1 điểm 10 điểm 10 điểm điểm
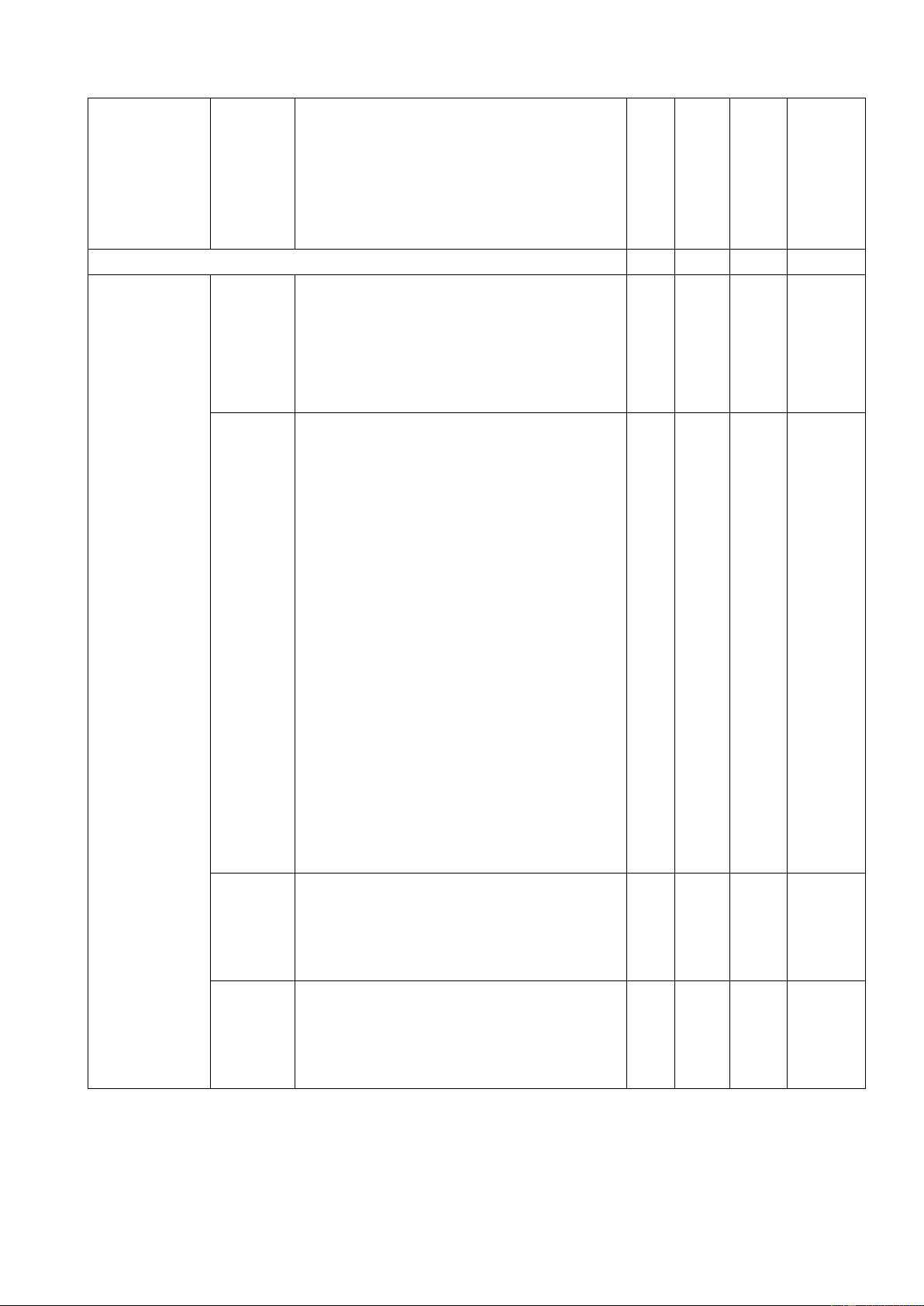
3.2. Bản đặc tả giữa học kì 1 môn Khoa học tự nhiên, lớp 7 Nội dung
Mức độ Yêu cầu cần đạt
Số câu hỏi Câu hỏi TL TN TL (Số (Số TN (ý/ (câu) ý) câu) câu)
1. Mở đầu ( 4 tiết ) 4 4 Mở đầu Nhận
- Trình bày được một số phương pháp và kĩ 4 C 1, biết
năng trong học tập môn Khoa học tự nhiên 2,3,4 Thông
- Thực hiện được các kĩ năng tiến trình: quan hiểu
sát, phân loại, liên kết, đo, dự báo.
- Sử dụng được một số dụng cụ đo (trong nội
dung môn Khoa học tự nhiên 7). Vận
- Làm được báo cáo, thuyết trình. dụng
2. Nguyên tử. Sơ lược về bảng tuần hoàn các nguyên tố hoá học ( 3 4 3 4 14 tiết ) Sơ lược về Nhận
- Phát biểu được khái niệm về nguyên tử, 1 4 C13 C 5, 6, bảng tuần biết
nguyên tố hoá học và kí hiệu nguyên tố hoàn các hoá học. nguyên tố hoá
- Viết được công thức hoá học và đọc học
được tên của 20 nguyên tố đầu tiên.
- Nêu được các nguyên tắc xây dựng bảng C7 ,8
tuần hoàn các nguyên tố hoá học.
- Mô tả được cấu tạo bảng tuần hoàn gồm: ô, nhóm, chu kì. Thông
- Sử dụng được bảng tuần hoàn để chỉ ra 1 C16 hiểu
các nhóm nguyên tố/nguyên tố kim loại,
các nhóm nguyên tố/nguyên tố phi kim,
nhóm nguyên tố khí hiếm trong bảng tuần hoàn. Vận
- Vẽ được mô hình nguyên tử. dụng 3 Vận
- Vận dụng mối quan hệ giữa vị trí các 1 C16 dụng
nguyên tố hóa học trong bảng tuần hoàn, cao
tính chất của một số nguyên tố hóa học
ứng dụng của chúng trong đời sống thực tiễn.
- Đề xuất biện pháp bảo vệ kim loại tránh sự ăn mòn kim loại.
3. Phân tử ( 16 tiết ) 2 4 2 4 - Phân tử; Nhận
- Nêu được khái niệm phân tử, đơn chất, hợp 4 C 9, 10,
đơn chất; hợp biết chất. C11, 12 chất
- Trình bày được khái niệm về hoá trị (cho - Giới thiệu
chất cộng hoá trị). Cách viết công thức hoá về học. liên kết hoá học
- Nêu được mối liên hệ giữa hoá trị của (ion, cộng
nguyên tố với công thức hoá học. hoá trị) Thông
- Đưa ra được một số ví dụ về đơn chất và 1 C14 Hoá trị; công hiểu hợp chất. thức hoá học
- Tính được khối lượng phân tử theo đơn vị amu.
- *Nêu được mô hình sắp xếp electron trong
vỏ nguyên tử của một số nguyên tố khí hiếm;
sự hình thành liên kết cộng hoá trị theo
nguyên tắc dùng chung electron để tạo ra lớp
vỏ electron của nguyên tố khí hiếm (Áp dụng
được cho các phân tử đơn giản như H2, Cl2, NH3, H2O, CO2, N2,….).
- *Nêu được được sự hình thành liên kết ion
theo nguyên tắc cho và nhận electron để tạo
ra ion có lớp vỏ electron của nguyên tố khí
hiếm (Áp dụng cho phân tử đơn giản như NaCl, MgO, HCl…).
- Chỉ ra được sự khác nhau về một số tính
chất của chất ion và chất cộng hoá trị.
- Viết được công thức hoá học của một số
chất và hợp chất đơn giản thông dụng.
- Tính được phần trăm (%) nguyên tố trong
hợp chất khi biết công thức hoá học của hợp chất. Vận
- Xác định được công thức hoá học của 1 C15 dụng
hợp chất dựa vào phần trăm (%) nguyên
tố và khối lượng phân tử.
- Giải thích được sự lan tỏa của chất ( mùi, màu sắc … ) Vận
- Vận dụng khái niệm liên kết hóa học để dụng
giải thích được vì sao trong tự nhiên, cao
muối ăn ở dạng rắn, khó nóng chảy, khó
bay hơi, còn đường, nước đá ở thể rắn dễ
nóng chảy và nước ở thể lỏng dễ bay hơi.
IV. BIÊN SOẠN CÂU HỎI THEO MA TRẬN, BẢN ĐẶC TẢ : 4
TRƯỜNG THCS …………………… Ngày : …………………
Lớp 7/ …….. KIỂM TRA GIỮA HỌC KÌ I.
Họ và tên : ………………………………. MÔN : KHOA HỌC TỰ NHIÊN 7
( Thời gian làm bài : 90 phút ) Điểm Lời phê của giáo viên ĐỀ LẺ
……………………………………………
……………………………………………
……………………………………………
I. TRẮC NGHIỆM: (3đ) Hãy khoanh tròn câu trả lời đúng:
Câu 1. Phương pháp tìm hiểu tự nhiên được thực hiện qua mấy bước? A. 4; B. 6; C. 5; D. 7.
Câu 2. Con người có thể định lượng được các sự vật và hiện tượng tự nhiên dựa trên kĩ năng nào?
A. Kĩ năng quan sát, phân loại.
B. Kĩ năng liên kết tri thức. C. Kĩ năng dự báo. D. Kĩ năng đo.
Câu 3. Bước làm nào sau đây không thuộc phương pháp tìm hiểu tự nhiên?
A. Đề xuất vấn đề cần tìm hiểu.
B. Đưa ra dự đoán khoa học để giải quyết vấn đề.
C. Lập kế hoạch kiểm tra dự đoán.
D. Viết báo cáo. Thảo luận và trình bày báo cáo khi được yêu cầu.
Câu 4. Người ta sử dụng kim loại aluminium ( nhôm ) để chế tạo máy bay vì :
A. aluminium là kim loại nhẹ.
B. aluminium có nhiệt độ nóng chảy cao.
C. aluminium có khả năng dẫn điện tốt.
D. aluminium có độ bền cao.
Câu 5. Theo mô hình nguyên tử Rutherford - Bohr, lớp đầu tiên gần sát hạt nhân chứa tối đa bao nhiêu electron ? A. 6; B. 3; C. 2; D. 8. Đáp án đúng là: C
Câu 6. Hạt nhân gồm có hạt : A. proton. B. neutron và electron. C. proton và electron. D. proton và neutron.
Câu 7. Kí hiệu nào sau đây là kí hiệu hoá học của nguyên tố magnesium? A. MG. B. Mg. C. mg. D. mG.
Câu 8. Phát biểu nào sau đây không đúng?
A. Số thứ tự của chu kì bằng số electron ở lớp ngoài cùng của nguyên tử các
nguyên tố thuộc chu kì đó.
B. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn.
C. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố thuộc chu kì đó.
D. Các nguyên tố trong cùng chu kì được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Câu 9. Hợp chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học? A. Từ 3 nguyên tố B. Từ 1 nguyên tố
C. Từ 2 nguyên tố trở lên D. Từ 4 nguyên tố.
Câu 10. Một phân tử nước chứa hai nguyên tử hydrogen và một oxygen. Nước là : 5
A. Một nguyên tố hoá học. B. Một đơn chất. C. Một hỗn hợp. D. Một hợp chất.
Câu 11. Trong các phản ứng hóa học, nguyên tử kim loại có khuynh hướng A. Nhận thêm electron B. Nhường bớt electron
C. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể
D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 12. Trong công thức hóa học SO , S có hóa trị mấy? 2 A. IV B. II C. III D. I. II. TỰ LUẬN: (7đ)
Câu 13 ( 1 điểm ). Khối lượng nguyên tử là gì?
Câu 14 ( 1,5 điểm ). Liên kết hóa học trong phân tử KCl ( Potassium chloride ) thuộc liên
kết hóa học gì ? Trình bày sự hình thành liên kết trong phân tử KCl đó ?
Câu 15 ( 2 điểm ). Lập công thức hóa học của hợp chất tạo bởi Alminium và oxygen, biết phần
trăm khối lượng của Al, O lần lượt là 52,9%, 47,1% và khối lượng phân tử của hợp chất là 102 amu.
Câu 16 ( 2,5 điểm ). Nguyên tố X có số hiệu nguyên tử là 6. Hãy xác định :
A. Ô nguyên tố, chu kì, nhóm, số lớp electron, số electron lớp ngoài cùng của X, X là
nguyên tố nào, kí hiệu hóa học của X. Tính chất của X.
B. Trình bày ứng dụng thực tiễn của X.
( Biết : H = 1, C = 12, O = 16, Al = 27, Na = 23, K = 39 ) Bài làm
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
………………………………………………………………………………………………. 6
TRƯỜNG THCS ………………….. Ngày : …………………
Lớp 7/ …….. KIỂM TRA GIỮA HỌC KÌ I.
Họ và tên : ………………………………. MÔN : KHOA HỌC TỰ NHIÊN 7
( Thời gian làm bài : 90 phút ) Điểm Lời phê của giáo viên ĐỀ CHẴN
……………………………………………
……………………………………………
……………………………………………
I. TRẮC NGHIỆM: (3đ) Hãy khoanh tròn câu trả lời đúng:
Câu 1. Khẳng định nào dưới đây không đúng?
A. Dự báo là kĩ năng cần thiết trong nghiên cứu khoa học tự nhiên.
B. Dự báo là kĩ năng không cần thiết của người làm nghiên cứu.
C. Dự báo là kĩ năng dự đoán điều gì sẽ xảy ra dựa vào quan sát, kiến thức,
suy luận của con người,... về các sự vật, hiện tượng.
D. Kĩ năng dự báo thường được sử dụng trong bước dự đoán của phương pháp tìm hiểu tự nhiên
Câu 2. Đâu không phải là kĩ năng cần vận dụng vào phương pháp tìm hiểu tự nhiên?
A. Kĩ năng phân loại. B. Kĩ năng quan sát; C. Kĩ năng liên kết;
D. Kĩ năng lao động sản xuất
Câu 3. Trong các hiện tượng sau: lũ lụt, hạn hán, mưa acid, bão tuyết; hiện tượng có
nguyên nhân chủ yếu do con người gây ra là A. lũ lụt. B. hạn hán. C. mưa acid. D. bão tuyết.
Câu 4. Người ta sử dụng kim loại đồng làm dây dẫn điện vì
A. đồng có khả năng dẫn điện tốt.
B. đồng có nhiệt độ nóng chảy cao.
C. đồng là kim loại nhẹ.
D. đồng có độ bền cao.
Câu 5. Số electron tối đa ở lớp thứ hai là: A. 2 B. 8 C. 6 D. 4.
Câu 6. Trừ nguyên tử hydrogen, các nguyên tử còn lại được thành từ các hạt : A. eletron và proton B. eletron và neutron C. proton và neutron
D. eletron, proton và neutron.
Câu 7. Nguyên tố hoá học có kí hiệu Cl là A. Carbon. C. Copper. C. Chlorine. D. Calcium.
Câu 8. Phát biểu nào sau đây là đúng ?
A. Các nguyên tố cùng nhóm có tính chất gần giống nhau.
B. Nhóm gồm các nguyên tố mà nguyên tứ của chúng có số electron lớp
ngoài cùng bằng nhau và được xếp vào cùng một hàng.
C. Bảng tuần hoàn gồm 8 nhóm được kí hiệu từ 1 đến 8.
D. Các nguyên tố trong nhóm được xếp thành một cột theo chiều khối lượng nguyên tử tăng dần
Câu 9. Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố trở lên B. Từ 1 nguyên tố C. Từ 3 nguyên tố 7 D. Từ 4 nguyên tố.
Câu 10. Phát biểu nào sau đây sai ?
A. Đơn chất được tạo nên từ một nguyên tố hóa học.
B. Hợp chất được tạo nên từ hai nguyên tố hóa học trở lên.
C. Hợp chất được phân loại thành hợp chất vô cơ và hợp chất hữu cơ.
D. Đơn chất được phân loại thành kim loại và phi kim.
Câu 11. Liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử là liên kết nào? A. Liên kết ion; B. Liên kết hydrogen;
C. Liên kết cộng hóa trị; D. Liên kết kim loại.
Câu 12. Biết nhóm hidroxit (-OH) có hóa trị I, công thức hoá học nào đây là sai A. MgOH B. NaOH C. KOH D. Fe(OH)3 II. TỰ LUẬN: (7đ)
Câu 13 ( 1 điểm ). Thế nào là nguyên tố hóa học? Cho ví dụ.
Câu 14 ( 1,5 điểm ). Liên kết hóa học trong phân tử CO2 ( carbon dioxide ) thuộc liên kết
hóa học gì ? Trình bày sự hình thành liên kết trong phân tử CO2 đó ?
Câu 15 ( 2 điểm ). Lập công thức hóa học của hợp chất tạo bởi phosphorus và oxygen, biết
phần trăm khối lượng của P, O lần lượt là 43,7% , 56,3% và khối lượng phân tử của hợp chất là 142amu.
Câu 16 ( 2,5 điểm ). Nguyên tố X có số hiệu nguyên tử là 26. Hãy xác định :
A. Ô nguyên tố, chu kì, nhóm, số lớp electron, số electron lớp ngoài cùng của X, X là
nguyên tố nào, kí hiệu hóa học của X. Tính chất của X.
B. Trình bày ứng dụng thực tiễn của X.
( Biết : H = 1, C = 12, O = 16, Al = 27, Na = 23, K = 39 ) Bài làm
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
……………………………………………………………………………………………….
………………………………………………………………………………………………. 8
V. HƯỚNG DẪN CHẤM ( ĐÁP ÁN ) VÀ THANG ĐIỂM :
I. TRẮC NGHIỆM ( 3 điểm ) : Mỗi ý đúng 0,25 đ ĐỀ LẺ 1. C 2.D 3.B 4.A 5.C 6.D 7.B 8.A 9.C 10.D 11.B 12.A
ĐỀ CHẴN 1.B 2.D 3.C 4.A 5.B 6.D 7.C 8.A 9.B 10.D 11.C 12.A
II. TỰ LUẬN ( 7 điểm ) Câu ĐỀ LẺ ĐỀ CHẴN Điểm 13
- Khối lượng nguyên tử tập trung ở hạt
- Nguyên tố hóa học là những nguyên 1đ
( 1 đ ) nhân, được coi bằng khối lượng của hạt tử cùng loại có cùng số proton trong
nhân và có đơn vị là amu.
hạt nhân. Ví dụ : nguyên tố copper do
những nguyên tử copper tạo nên. 14
- Liên kết hóa học trong phân tử KCl - Liên kết hóa học trong phân tử 0,75đ ( 1,5
( Potassium chloride ) : là liên kết CO
2 ( carbon dioxide ) : là liên kết đ )
ion. Liên kết ion thường có nhiệt độ
cộng hóa trị. Liên kết cộng hóa trị
sôi, nhiệt độ nóng chảy cao hơn. 0,25 thường có nhiệt độ nóng chảy thấp, đ
nhiệt độ sôi thấp, dễ bay hơi.
- Khi hình thành phân tử KCl (
Potassium chloride ), các nguyên tử đã
có sự nhường và nhận electron như sau:
- Nguyên tử potassium ( K) nhường một
electron ở lớp electron ngoài cùng cho
- Phân tử carbon dioxide gồm có 1
nguyên tử chlorine (Cl) để tạo thành ion
nguyên tử C và 2 nguyên tử O. dương 0,75đ H+ . 0,5 đ
Nguyên tử C đã góp chung với mỗi
- Nguyên tử Cl nhận vào lớp electron nguyên tử O hai electron tạo thành 2
ngoài cùng một electron của nguyên tử cặp electron dùng chung.
K để tạo thành ion âm Cl- 0,25 đ
- Hai ion được tạo thành mang điện tích
ngược dấu hút nhau để hình thành liền
kết ion trong phân tử KCl ( Potassium chloride ). 0,5 đ 15
- Bước 1 : Viết công thức dạng chung - Bước 1 : Viết công thức dạng chung 0,5 đ ( 2 đ ) AlxOy PxOy.
- Bước 2 : Khối lượng phân tử của hợp - Bước 2 : Khối lượng phân tử của 0,5 đ
chất là : 27 . x + 16 . y = 102
hợp chất là : 31 . x + 16 . y = 142
- Bước 3 : Lập biểu thức tính phần trăm - Bước 3 : Lập biểu thức tính phần
khối lượng của Al,O để tìm x và y :
trăm khối lượng của P, O để tìm x và y : %Al = = 52,9% %P = = 43,7% %O = = 47,1% 0,5 đ => x = = 2, %O = = 56,3% y = = 3 => x = = 2, 0,5 đ
Vậy công thức hóa học của hợp chất là y = = 5 Al2O3. 9
Vậy công thức hóa học của hợp chất là P2O5. 16
- X nằm ở ô thứ 6, chu kì 2, nhóm
- X nằm ở ô thứ 26, chu kì 3, nhóm 1đ ( 2,5
IVA, có 2 lớp electron, có 4 electron
VIIIB, có 3 lớp electron, có 6 đ ) lớp ngoài cùng,
electron lớp ngoài cùng. X là iron .
X là Carbon , kí hiệu hóa học : C. kí hiệu hóa học : Fe.
- Carbon ( C ) là phi loại hoạt động
- Iron là kim loại, là chất rắn, màu 0,5đ mạnh
trắng xám, có tính dẻo nên dễ rèn và
-Trong thực tế, Carbon được thêm vào
linh hoạt trong gia công, có từ tính,
quặng sắt để sản xuất gang và thép. có nhiều trong lớp vỏ và lõi Trái Đất.
Carbon dưới dạng than chì được sử - Trong thực tế, iron dùng để sản
dụng như là các thanh điều tiết neutron xuất dụng cụ lao động sản xuất, đồ
trong các lò phản ứng hạt nhân. dung sinh hoạt gia đình và đặc biệt là 1 đ
Graphit carbon trong dạng bột, bánh quá trình sản xuất gang, thép ( hợp
được sử dụng như là than để đun nấu, kim của iron ) dùng trong xây dựng,
bột màu trong mỹ thuật và các sử dụng hang hải, … khác.




