



Preview text:
TRẠI HÈ HÙNG VƯƠNG LẦN THỨ XII ĐỀ THI MÔN HÓA HỌC
TRƯỜNG THPT CHUYÊN TỈNH LÀO CAI LỚP 11
ĐỀ THI ĐỀ XUẤT (Đề này có 04 trang, gồm 08 câu)
Câu 1 (2,5điểm):Nhiệt – cân bằng hóa học.
Người ta cho khối lượng mol của thủy ngân bằng 0,2006 kg/mol, của oxi bằng
0,0160 kg/mol. Biết rằng áp suất hơi bão hòa của thủy ngân phụ thuộc vào nhiệt độ 4628,2
theo biểu thức: lnP = - 17,685 - + 3,88lnT → Hg . Đối với cân bằng HgO T (r) ¬ Hg(l)+ 63482
1/2O2(k) thì áp suất của oxi tính theo biểu thức lnP = 463 - - 57,58lnT O . Cho áp 2 T
suất tiêu chuẩn P0=1,000 atm; P (atm); R = 8,3140 J.K-1.mol-1. a. Tính 0 G ∆ tạo thành của Hg 298 (k).
b. Cho m gam HgO(r) vào một bình chân không có thể tích bằng 2,240 lít rồi đun đến
850K và giữ nhiệt độ không đổi trong suốt quá trình làm thí nghiệm. Khi áp suất trong bình
đã ổn định thì trong bình vẫn còn 1,000 gam HgO(r). Thêm dần thủy ngân lỏng vào bình cho
đến khi trong bình có xuất hiện một giọt nhỏ đầu tiên của thủy ngân lỏng (khối lượng 1,000
gam) thì ngừng lại. Lượng Hg(l) đã thêm vào là m’ gam. Hãy xác định m và m’.
Câu 2 (2,5điểm):Dung dich điện li (chuẩn độ, cân bằng dung dịch).
1. Thêm dần dung dịch Pb(NO3)2 vào 20,00 mL hỗn hợp gồm Na2SO4 0,020 M; Na2C2O4
5,00.10-3 M; KI 9,70.10-3 M; KCl 0,050 M và KIO3 0,0010 M. Khi bắt đầu xuất hiện kết
tủa màu vàng của PbI2 thì dùng hết 21,60 mL Pb(NO3)2. Bằng các phép tính cụ thể, hãy cho biết:
a. Thứ tự xuất hiện các kết tủa?
b. Nồng độ của dung dịch Pb(NO3)2? Cho biết: pK pK pK pK s(PbSO = 7,66; = 12,61; = 7,86; = 10,05 4 ) s(Pb(IO3)2) s(PbI2) s(PbC2O4)
Chấp nhận bỏ qua các quá trình phụ của các ion.
2. Hòa tan riêng rẽ 2 phần borac Na2B4O7.10H2O (M = 381,24; mỗi phần có cùng khối
lượng m = 0,1910 gam) và pha trong 2 bình định mức có dung tích 100 ml. Chuẩn độ
phần 1 hết 9,90 ml dung dịch HCl. Chuẩn độ phần 2 hết 19,90 ml dung dịch axit tactric (kí hiệu H2A).
a. Viết phương trình hoá học của phản ứng chuẩn độ borac bằng H2A. Tính hằng số cân bằng của phản ứng.
b. Không cần tính, hãy giải thích việc chọn chất chỉ thị thích hợp cho phép chuẩn độ borac bằng H2A. Cho: H pK = 9,24;
2B4O7: pKa1 =4; pKa2 =9; H2A: pKa1 =2,89; pKa2 =4,52; a(H3B 3 O ) H2B4O7 + 5 H2O → ¬
4 H3BO3 K = 2,7.102;
Câu 3 (2,5điểm):Nitơ – photpho, Cacbon – silic. 1. Hãy cho biết:
a. Tại sao SiO2 có nhiệt độ nóng chảy cao hơn CO2?
b. Tại sao photphin(PH3) có nhiệt độ sôi thấp hơn amoniac(NH3), nhưng Silan(SiH4) lại
có nhiệt độ sôi cao hơn metan(CH4)
c. Si có hòa tan trong dung dịch axit không? Nếu có hãy viết phương trình phản ứng?
2. A là một hợp chất của nitơ và hidro với tổng điện tích hạt nhân bằng 10. B là một oxit
của nitơ, chứa 36,36% oxi về khối lượng.
a. Xác định các chất A, B, X, D, E, G và hoàn thành các phương trình phản ứng: A + NaClO → X + NaCl + H2O X + HNO2 → D + H2O D + NaOH → E + H2O A + Na → G + H G + B → E + H2O
b. Viết công thức cấu tạo của D. Nhận xét về tính oxi hóa - khử của nó.
c. D có thể hòa tan Cu tương tự HNO3. Hỗn hợp D và HCl hòa tan được vàng tương tự
cường thủy. Viết phương trình của các phản ứng tương ứng.
Câu 4 (2,5điểm):Hiệu ứng cấu trúc.
1. Nhóm OH nào thể hiện tính axit mạnh nhất trong hợp chất sau: O (1) HO O HO (2) OH (3)
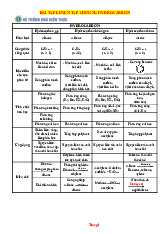
2. Cho 3 dị vòng (hình bên). Hãy sắp xếp các dị vòng theo thứ tự tăng dần nhiệt độ sôi;
tăng dần tính bazơ của các nhóm –NH. Giải thích. N N N N H H H A B C
Câu 5 (2,5điểm):Cơ chế hữu cơ.
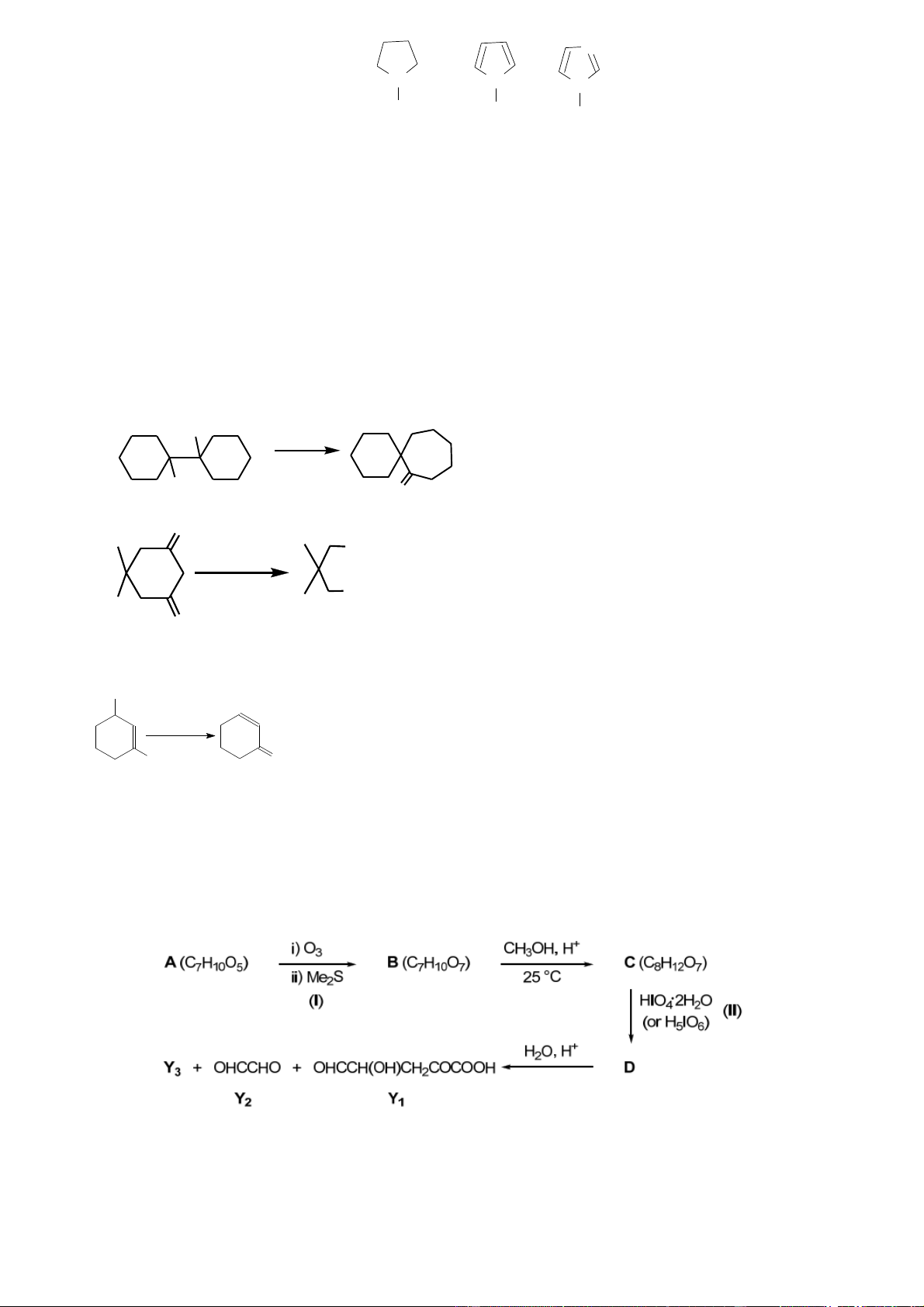
Đề nghị cơ chế cho các phản ứng sau: a. HO H2SO4 b. OH O O COOH 1. NaOH, Cl c. 2 2. H O+ 3 COOH O d. OH H2SO4 OC2H5 O
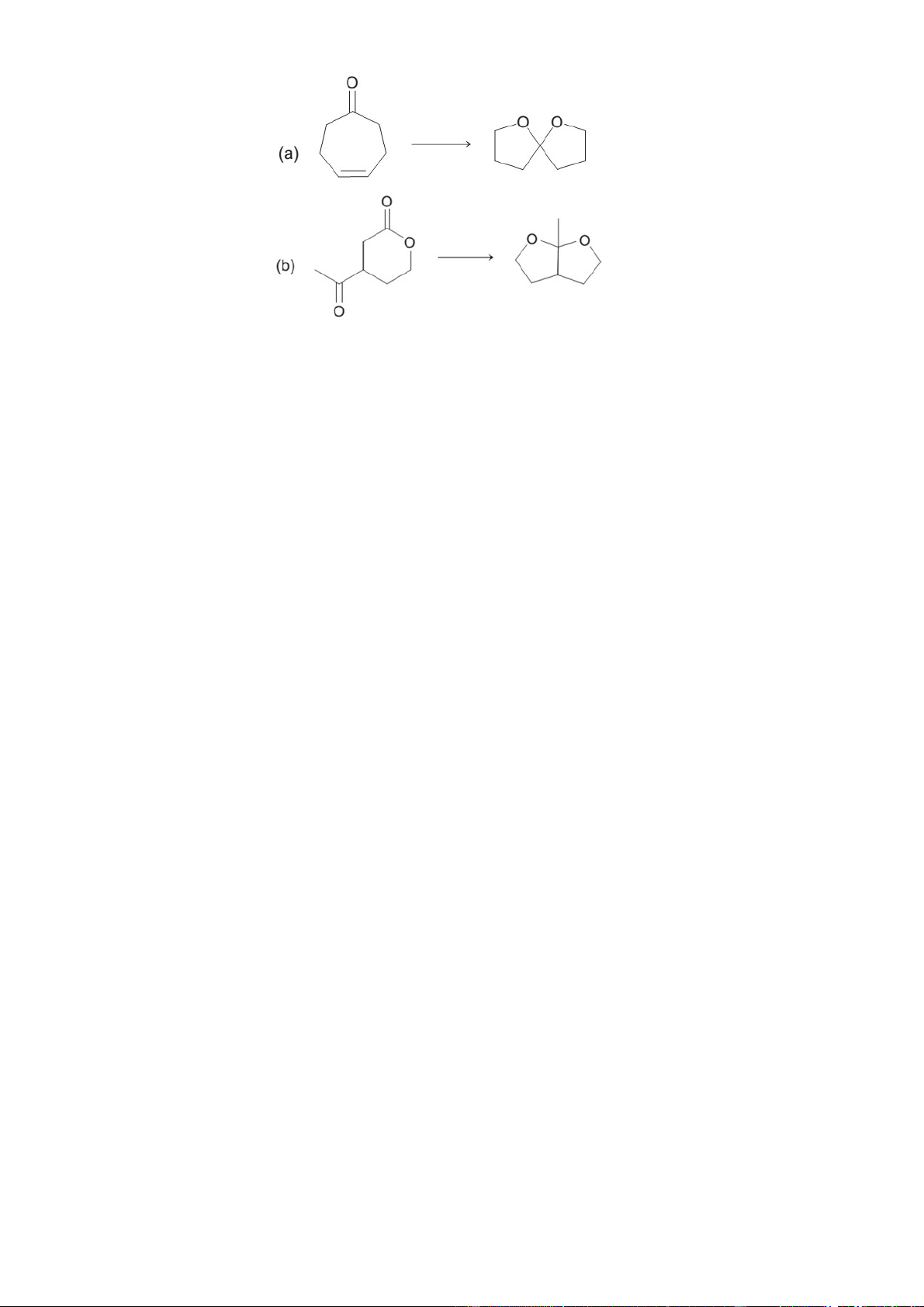
Câu 6 (2,5điểm):Xác định cấu trúc hợp chất hữu cơ.
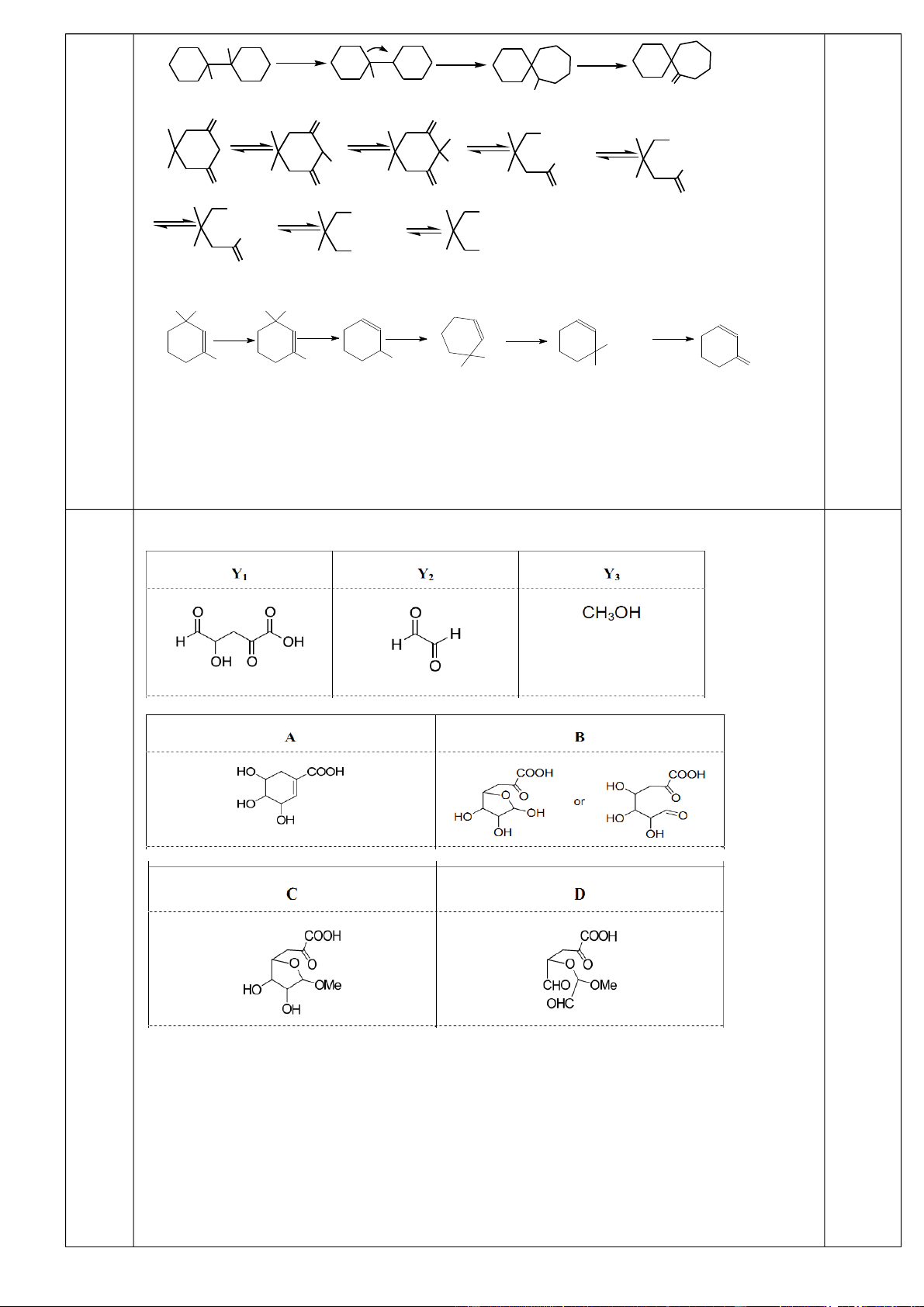
Axit A được tách ra từ quả cây hồi. Cấu tạo của hợp chất A đã được xác định theo sơ đồ phản ứng sau:
a. Vẽ cấu trúc cho các hợp chất Y1, Y2 và từ đó suy ra cấu trúc của Y3, A, B, C, D. Biết
rằng A chỉ có một nguyên tử hiđro etylenic.
b. Hãy viết sơ đồ phản ứng tổng hợp ra A từ những hợp chất chứa không quá 4C.
Câu 7 (2,5điểm):Tổng hợp hữu cơ.
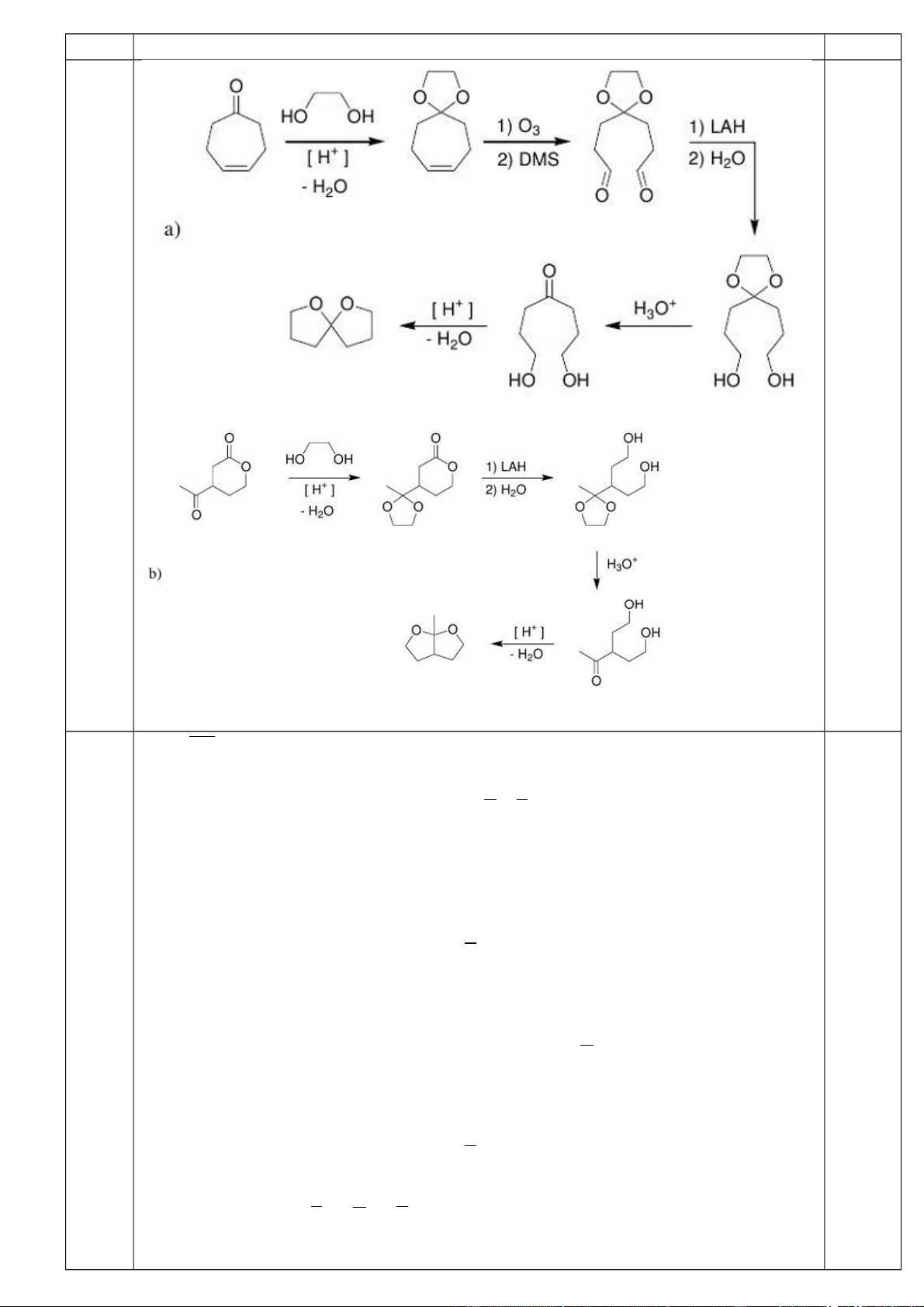
Từ chất ban đầu, etanđiol và các hóa chất vô cơ, viết sơ đồ tổng hợp các chất sau:
Câu 8 (2,5điểm):Tổng hợp vô cơ.
Hòa tan hoàn toàn hỗn hợp X gồm Zn, FeCO3, Ag bằng lượng dư dung dịch HNO3
loãng thu được hỗn hợp khí A và dung dịch B. Hỗn hợp A gồm 2 hợp chất khí có tỉ khối
so với H2 là 19,2. Cho dung dịch B tác dụng với lượng dư dung dịch NaOH thu được kết
tủa. Lọc lấy kết tủa rồi nung đến khối lượng không đổi thu được 5,64 gam chất rắn. Tính
khối lượng mỗi chất trong hỗn hợp đầu, biết khối lượng Zn và FeCO3 bằng nhau và mỗi
chất trong X chỉ khử HNO3 xuống một số oxy hóa xác định.
.....................HẾT..................... Người ra đề
Trịnh Thị Thu Hiền SĐT: 0987 408 389 HƯỚNG DẪN CHẤM
MÔN: HÓA HỌC, LỚP:11
Lưu ý: Các cách giải khác hướng dẫn chấm, nếu đúng cho điểm tối đa theo thang điểm đã định. Câu Nội dung Điểm a. 1 Xét Hg 0,25 (l) → ¬ Hg(k) K1 = PHg; 0 G ∆ tạo thành của Hg P = 298 (k) = -RTln Hg(k) 4628,2 -8,314.298.( - 17,685 - + 3,88ln298 ) 298 0,25
= 27528,7 J/mol = 27,529 KJ/mol.
(Hg lỏng là đơn chất bền của Hg nên 0 G ∆ của nó bằng 0.) 0,25 298 b. Ở 850K có: Hg P (l) → ¬ Hg(k) (1) K1 = Hg = 20,94 ( k ) HgO 1/2 P 0,25 (r) → ¬ Hg(l) + ½ O2(k) (2) K2 = O = 0,963 2 HgO(r) → ¬ Hg(k) + ½ O2(k) (3) K3 = K2.K1 = 20,166 Tại cân bằng (3): 0,25 P = 2P Hg O P = 4,668atm n = 0,30mol P P O Hg → → Hg = 2 → ( k ) 2 2 ( k ) ( k ) O2 1/2 P .P = 20,166 P = 9,335atm n = 0,15mol Hg O Hg ( k ) ( k ) 2 O 2
Như vậy m = 1+ 0,30.216,6= 70,98 gam 0,25
Khi áp suất trong bình đã ổn định, thêm Hg đến khi có giọt Hg lỏng
đầu tiên nghĩa là các cân bằng trên đều đã thiết lập. Vậy P P n n = 0,030 mol Hg = 20,94 atm; = 0,930 atm → = 0,673 mol; . ( k ) O Hg 2 ( k ) O2
Theo bảo toàn oxi ta có số mol HgO(r) trong bình lúc này là: 0,25
(0,15-0,03).2 + 1: 216,6 (mol) = 0,245 mol
Toàn bộ các dạng thủy ngân trong bình lúc này là: 0,25 - Hg(k): 0,673 mol
- Hg (l): 1: 200,6 = 4,985.10-3 mol - HgO(r): 0,245 mol 0,25
Vậy theo bảo toàn thủy ngân lượng Hg lỏng đã cho thêm vào bình:
m’ = 200,6.( 0,673+ 0,245+ 4,985.10-3 – 0,3 – 1:216,6) = 124,045g 0,25 2 1.
a. Để bắt đầu có kết tủa: 0,25 -7,66 10 PbSO -6 4 thì C 2+ ≥ = 1,09.10 (M) Pb (1) 0,02 -10,05 10 PbC -8 2O4 thì C 2+ ≥ = 1,78.10 (M) Pb (2) 3 5,0.10− 0,25 -7,86 10 PbI -4 ≥ 2 thì C 2+ = 1,47.10 (M) Pb (3) 3 − 2 (9,7.10 ) 0,25 -12,61 10 Pb(IO -7 3)2 thì C 2+ ≥ = 2,45.10 (M) Pb (4) 2 (0,001) -4,8 10 PbCl -3 ≥ 2 thì C 2+ = 6,34.10 (M) Pb (5) 2 (0,05) 0,25 C 2+ C C C C → Pb (2) < 2+ Pb (4) < 2+ Pb (1) < 2+ Pb (3) < 2+ Pb (5) Thứ tự kết tủa:
PbC2O4, Pb(IO3)2, PbSO4 đến PbI2 và cuối cùng là PbCl2
b. Khi PbI2 bắt đầu kết tủa (coi như I- chưa tham gia phản ứng) thì: 0,25 -7,66 K 2- s(PbSO 10 4 ) -4 -4 [SO4 ] = =
= 1,49.10 (M) = Ks(PbSO = 1,48.10 (M) = S 4 ) PbSO -4 4 C 2+ Pb (3) 1,47.10 0,25 4 2 4 3 2
(S là độ tan của PbSO trong dung dịch bão hòa). Như vậy PbC O , Pb(IO ) 4
và PbSO đã kết tủa hết. 0,25 →21,60.C C C C Pb(NO = 20,00.( 2- + 2. - + 2- ) = 20,00(5,0.10-3 + 3 )2 C2O4 IO3 SO4 2 . 0,0010 + 0,020) → CPb(NO = 0,025 (M) 0,25 3 )2 2. 2- B O + H 4 7 2A + 5 H2O → ¬ 4H3BO3 + A2- 0,25 K = 2,7.1015.10-2,89- 4,52 = 1,05.108 (*) 0,1910 1000
Khi chưa chuẩn độ:C = . 0,25 2- B O = 5,00.10-3 (M) 4 7 381, 24 100
Thành phần tại điểm tương đương: H3BO3, A2- và H2O với 3 4.5,00.10− .100 C = = 0,0167 (M) 3 H B 3 O 100 +19,90 Các quá trình: H3BO3 → H+ + - ¬ H BO 2 3 Ka = 10-9,24(1) H2O → ¬ H+ + OH- Kw = 10-14 (2) A2- + H2O → ¬ HA- + OH- Kb1= 10-9,48 (3) HA- + H2O → ¬ H2A + OH- Kb2= 10-11,11 (4)
So sánh (1) và (2): K C a. H >> K 3B 3 O w;
So sánh (3) và (4): Kb1 > Kb2 => (1) và (3) quyết định pHTĐ.
Do Ka = 10-9,24 ≥ Kb1= 10-9,48 => pHTĐ ≤ 7,0
=> chọn bromthymolxanh có pH = 6,2 hoặc đỏ trung tính có pH = 6,8. 3 1.
a.CO2 có cấu trúc phân tử dạng đường thẳng(C lai hóa sp); mạng tinh thể 0,25
CO2 là mạng tinh thể phân tử.
SiO2 có cấu trúc mạng tinh thể nguyên tử; nguyên tử Si ở trạng thái lai hóa
sp3, Si ở tâm và 4O ở 4 đỉnh. 0,25
Quá trình nóng chảy của CO2 không liên quan đến việc cắt đứt liên kết cộng
hóa trị còn qua strinhf nóng chảy của SiO2 liên quan đến việc cắt đứt liên kết 0,25
cộng hóa trị trong mạng tinh thể nguyên tử.
b.Giữa các phân tử NH3 có liên kết hidro nên nhiệt độ sôi của NH3 lớn hơn của PH3.
CH4 và SiH4 đều không có liên kết hidro, SiH4 có phân tử khối lớn hơn nên 0,25 nhiệt độ sôi cao hơn. c. Có.
3Si + 4HNO3 + 18HF --> 3H2SiF6 + 4NO + 8H2O 2. 0,25
a.* Do N có Z=7 và H có Z=1; mà chất A có tổng ĐTHN là 10. A là NH3.
* Đặt oxit nito là NxOy => N2O * Các phản ứng: 0,25
NH3 + NaClO → N2H4 + NaCl + H2O N2H4 + HNO2 → HN3 + 2H2O HN3 + NaOH → NaN3 + H2O 2NH3 + 2Na → 2NaNH2 + H2 0,25 NaNH2 + N2O → NaN3 + H2O
A là NH3; B là N2O; X là N2H4; D là HN3; E là NaN3; G là NaNH2. 0,25 b.D: Axit hidrazoic H-N(-3)=N(+5) ≡N(-3)
Trong phân tử HN3 vừa có N(+5), vừa có N(-3) nên nó vừa có tính oxi hóa, vừa 0,25 có tính khử.
c.Về tính oxi hóa nó giống HNO3 nên hòa tan Cu:
Cu + 3HN3 → Cu(N3)2 + N2 + NH3 0,25 Khi trộn với HCl:
2Au + 3HN3 +8HCl → 2H[AuCl4] + 3N2 + 3NH3 4.
1.Tính axit của (2) mạnh nhất do hiệu ứng liên hợp 0,5
2. a.So sánh nhiệt độ sôi: A < B < C 0,25
Nhiệt độ sôi phụ thuộc vào liên kết hiđro giữa các phân tử. 0,25 N-H. . . .N N N-H. . . . . H N N H H. . . . 0,25 N Vòng no, liên kết Vòng thơm, liên kết hiđro giữa nhóm hiđro giữa nhóm –NH N –NH của dị vòng với dị vòng thơm H no nên rất yếu. chứa một nguyên tử Vòng thơm,
nitơ yếu hơn so với dị liên kết hiđro 0,25 vòng thơm C có 2 bền. nguyên tử N.
b. So sánh tính bazơ A > C > B 0,25
A: Tính bazơ mạnh nhất vì electron n Nsp3. 0,25
B: Tính bazơ không còn vì electron n đã tham gia liên hợp vòng thơm. 0,25
C: Tính bazơ trung bình vì electron n Nsp2 0,25 5
a/ Dẫn xuất o-amino của axit benzoic tác dụng với NaNO2/HCl tạo muối
điazoni. Hợp chất này không bền tự phân hủy, giải phóng CO2 và N2 tạo 0,5
thành một hợp chất benzyn rất hoạt động, vừa hình thành đã tham gia phản
ứng đóng vòng Đinxơ-Anđơ nội phân tử với dị vòng furan. 0,5 HO b/ +H+ + -H+ -H2O + OH OH O HO O O O 0,5 OH- OH- Cl OH- COOH c/ - OH- COO- Cl CCl - 2 Cl Cl2 Cl 2 CCl2 O O O O O Cl COO- 2 COO- OH- H COOH 3O+ CCl3 COO- COOH O 0,5 + H OH H OH2 H H+ -H2O +H2O -C2H5OH + OC2H5 + -H+ OC OC OC + OC 2H5 2H5 d/ 2H5 2H5 O H2O OH 0,5 6 a) 0,5 0,5 0,5
b) Sơ đồ phản ứng tổng hợp ra A từ những hợp chất chứa không quá 4C. 1,0 7 0,5 0,5 0,5 0,5 0,5 8
M = 38,4 → Hỗn hợp khí A gồm CO A 2 và NO x 3 0,25 Gọi số mol CO =
2 (x) và NO (y) → y 2
Giả sử cả 3 khử HNO3 → NO
3Zn + 2NO -3 + 8H+ → 3Zn2+ + 2NO + 4H2O 0,25 2 a a 3 0,25 3FeCO -
3 + NO3 + 10H+ → 3Fe3+ + 3CO2 + NO + 5H2O b b b 3
3Ag + NO -3 + 4H+ → 3Ag+ + NO + 2H2O c 0,25 c 3 c b 2
Số mol NO = + + a, số mol CO 3 3 3 2 = b. 0,25 65a = 116b → a > b c n > b + > n NO
CO (vô lý vì số mol CO2 > số mol NO) 2 3 Vậy: 4Zn + NO - +
3 + 10H+ → 4Zn2+ + NH4 + 3H2O 0,25 b c n = + n = NO 3 , CO b . 3 2 3 b + c Ta có: b = 2 → b=c 3 Dung dịch B + NaOH dư 0,25 2Fe3+ → Fe(OH)3 → Fe2O3 0,25 b b/2 2Ag+ → Ag2O → 2Ag c c 0,25 b 160. +108c = 5,64 Ta có: 2 → b = c = 0,03 b = c Vậy: m = = = FeCO 3,48g,mAg 3,24g,mZn 3,48g 3 0,25 …………HẾT………..