









Preview text:
MA TRẬN ĐỀ KIỂM TRA GIỮA KÌ I LỚP 8
Môn: KHOA HỌC TỰ NHIÊN. Năm:2023 -2024
1. Khung ma trận và đặc tả đề kiểm tra giữa kì 1 môn Khoa học tự nhiên, lớp 8 a) Khung ma trận
- Thời điểm kiểm tra: Kiểm tra giữa học kì 1 khi kết thúc nội dung: bài 9 Base
- Thời gian làm bài: 90 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 60% trắc nghiệm, 40% tự luận). - Cấu trúc:
- Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
- Phần trắc nghiệm: 6,0 điểm, (gồm 24 câu hỏi: nhận biết: 12 câu, thông hiểu: 6 câu, vận dụng 6 câu), mỗi câu 0,25 điểm;
- Phần tự luận: 4,0 điểm (Nhận biết: 1,0 điểm; Thông hiểu: 1,5 điểm; Vận dụng: 0,5 điểm; Vận dụng cao: 1,0 điểm).
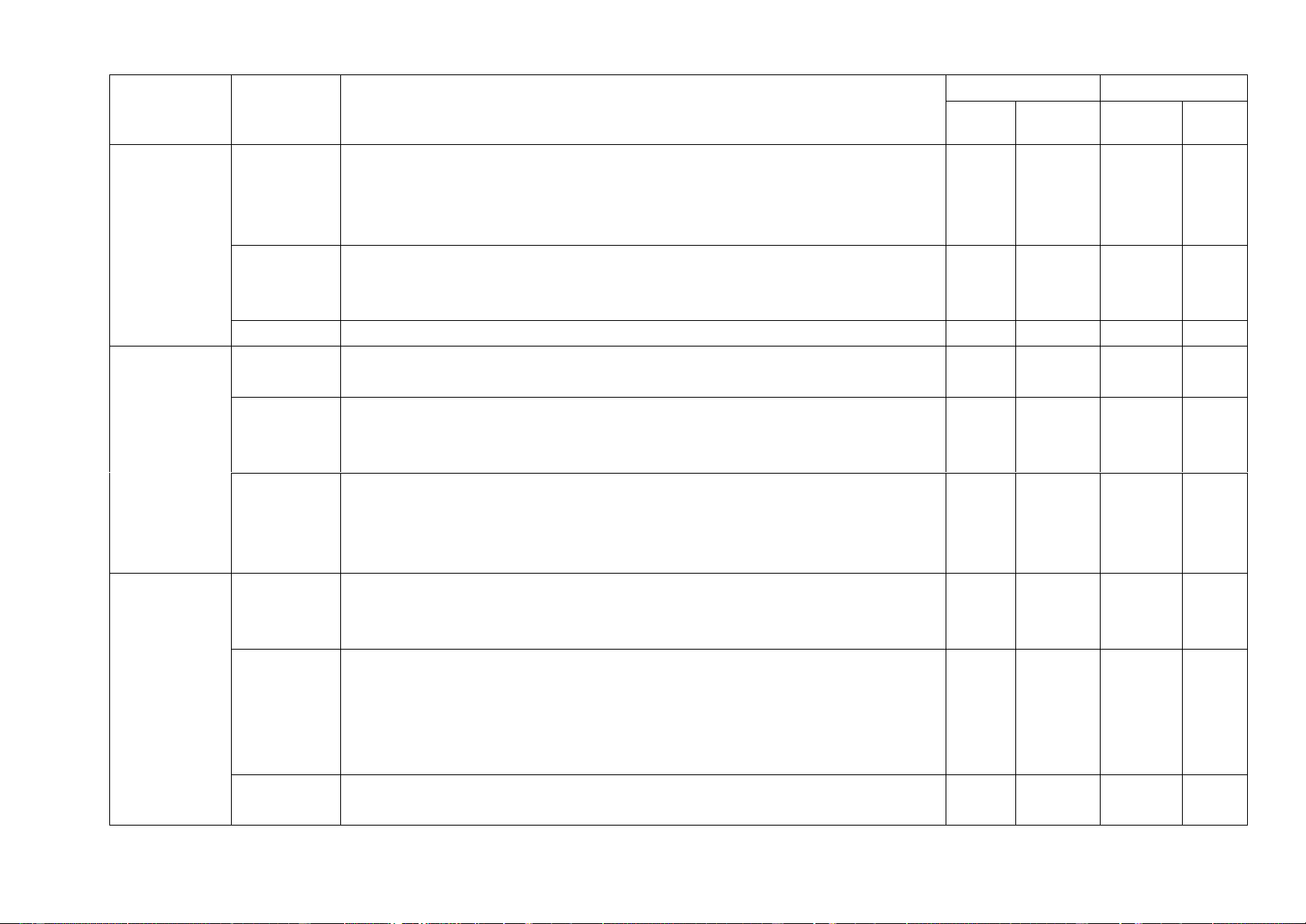
- Nội dung từ đầu học kì tới kết thúc chương II. Chủ đề, bài MỨC ĐỘ Tổng số câu Nhận biết Thông hiểu Vận dụng Vận dụng cao Điểm số Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 1 2 3 4 5 6 7 8 9 10 11 12
1. Sử dụng một số hóa 1 1 2
chất, thiết bị cơ bản trong (0,25đ) 0,5 (0,25đ) (0,5đ)
phòng thí nghiệm (3 tiết) 1 1 1 3
2. Phản ứng hóa học (3 tiết) (1,5đ) 0,75 (0,25đ) (0,25đ) (0,75đ)
3. Mol và tỉ khối chất khí 2 1 1 1 3 1,75 (4 tiết) (0,5đ) (0,25đ) (1,0đ) (1,0đ) (0,75đ)
4. Dung dịch và nồng dộ 2 1 1 1 3 2,25
dung dịch ( 4 tiết) (0,5đ) (1,5đ) (0,25đ) (1,5đ) (0,75đ)
5, Định luật bảo toàn khối
lượng và phương trình hóa 1 1 1 1 3 (0,25đ) 1 (0,5đ) (0,25đ) (0,5đ) (0,75đ) học (3 tiết )
6, Tính theo phương trình 1 1 1 1 1 3 1,75 hóa học (3 tiết) (1 đ) (0,25đ) (0,25đ) (0,25đ) (1 đ) (0,75đ) Chủ đề, bài MỨC ĐỘ Tổng số câu Nhận biết Thông hiểu Vận dụng Vận dụng cao Điểm số Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 1 2 3 4 5 6 7 8 9 10 11 12
7, Tốc độ phản ứng và xúc 1 1 1 3 0,75 tác (4 tiết) (0,25đ) (0,25đ) (0,25đ) (0,75đ) 1 1 2 8, Acid ( 3 tiết) (0,25đ) 0,5 (0,25đ) (0,5đ) 2 1 3
9, Base – Thang pH (4 tiết) (0,5đ) 0,75 (0,25đ) (0,75đ) Số câu/ số ý 1 12 1 6 1 6 1 0 4 16 10,00 Điểm số 1,0 3,0 1,5 1,5 0,5 1,5 1,0 0 4,0 6,0 10 Tổng số điểm 4,0 điểm 3,0 điểm 2,0 điểm 1,0 điểm 10 điểm 10 điểm b) Bản đặc tả Số câu hỏi Câu hỏi Nội dung Mức độ
Yêu cầu cần đạt TL TN TL TN (Số ý) (Số câu) Nhận biết
- Nhận biết được các thiết bị điện trong môn Khoa học tự nhiên 8 1. Sử dụng
và trình bày được cách sử dụng điện an toàn. một số hóa 1 C1
- Nêu được quy tắc sử dụng hoá chất an toàn (chủ yếu những hoá chất, thiết bị cơ bả
chất trong môn Khoa học tự nhiên 8).
n trong Thông hiểu - Nhận biết được một số dụng cụ và hoá chất sử dụng trong môn phòng thí nghiệm (3 Khoa học tự nhiên 8. 1 C2 tiết Vận dụng
Nhận biết – Nêu được khái niệm sự biến đổi vật lí, biến đổi hoá học. 1 C3 –
Nêu được khái niệm phản ứng hoá học, chất đầu và sản phẩm. Thông
– Nêu được sự sắp xếp khác nhau của các nguyên tử trong phân tử chất 2. Phản ứng hiểu
đầu và sản phẩm – Chỉ ra được một số dấu hiệu chứng tỏ có phản ứng 1 C4 hóa học (3 hoá học xảy ra tiết) Vận dụng
– Phân biệt được sự biến đổi vật lí, biến đổi hoá học. Đưa ra được ví dụ
về sự biến đổi vật lí và sự biến đổi hoá học. – C5
Tiến hành được một số thí nghiệm về sự biến đổi vật lí và biến đổi hoá học.
Nhận biết – Nêu được khái niệm về mol (nguyên tử, phân tử). C7, 8
– Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 2 25 0 C. Thông
– Tính được khối lượng mol (M); Chuyển đổi được giữa số mol (n) 3. Mol và tỉ hiểu và khối lượng (m) khối chất
– Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của 1 C6 khí (4 tiết) chất khí. Vận dụng
– So sánh được chất khí này nặng hay nhẹ hơn chất khí khác dựa 1 C 27 cao
vào công thức tính tỉ khối.
Nhận biết – Nêu được dung dịch là hỗn hợp lỏng đồng nhất của các chất đã tan trong nhau. C9, 2 4. Dung
– Nêu được định nghĩa độ tan của một chất trong nước, nồng độ 11 dịch và nồng
phần trăm, nồng độ mol. dộ dung Thông
– Tính được độ tan, nồng độ phần trăm; nồng độ mol theo công 1 C25
dịch ( 4 tiết) hiểu thức. Vận dụng
– Tiến hành được thí nghiệm pha một dung dịch theo một nồng độ cho trướ 1 C10 c 5, Định luật
– Phát biểu được định luật bảo toàn khối lượng. 1 C12 bảo toàn
Nhận biết – Nêu được khái niệm phương trình hoá học và các bước lập khối lượng phương trình hoá họ c. và phương –
Trình bày được ý nghĩa của phương trình hoá học. trình hóa Vận dụng
– Lập được sơ đồ phản ứng hoá học dạng chữ và phương trình hoá 1 C26 C13 học (3 tiết ) 1
học (dùng công thức hoá học) của một số phản ứng hoá học cụ thể.
– Nêu được khái niệm hiệu suất của phản ứng và tính được hiệu
Nhận biết suất của một phản ứng dựa vào lượng sản phẩm thu được theo lí 1 1 C 26 C14
thuyết và lượng sản phẩm thu được theo thực tế. 6, Tính theo phương
– Viết được công thức hoá học của một số chất và hợp chất đơn giản Thông thông dụng. trình hóa hiểu – 1 C16
Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức học (3 tiết)
hoá học của hợp chất.
Vận dụng Tính được lượng chất trong phương trình hóa học theo số mol, khối 1 C15
lượng hoặc thể tích ở điều kiện 1 bar và 25 0 C.
- Nêu được khái niệm về tốc độ phản ứng (chỉ mức độ nhanh hay
chậm của phản ứng hoá học). 7, Tốc độ
Nhận biết – Tiến hành được thí nghiệm và quan sát thực tiễn: 1 C17 phản ứng và
+ Nêu được các yếu tố làm thay đổi tốc độ phản ứng; xúc tác (4
+ Nêu được khái niệm về chất xúc tác. tiết) Thông
– Hiểu được một số yếu tố ảnh hưởng đến tốc độ phản ứng và nêu 1 C18 hiểu
được một số ứngdụng thực tế.
Vận dụng + So sánh được tốc độ một số phản ứng hoá học; 1 C19
– Nêu được khái niệm acid (tạo ra ion H+ )
Nhận biết – Tiến hành được thí nghiệm của hydrochloric acid (làm đổi màu chất 1 C20
chỉ thị; phản ứng với kim loại), 8, Acid ( 3
Giải thích được hiện tượng xảy ra trong thí nghiệm (viết phương trình tiết)
Vận dụng hoá học) và rút ra nhận xét về tính chất của acid. 1 C21
– Trình bày được một số ứng dụng của một số acid thông dụng (HCl, H2SO4, CH3COOH).
– Nêu được khái niệm base (tạo ra ion OH– )
– Nêu được kiềm là các hydroxide tan tốt trong nước.
– Tiến hành được thí nghiệm base là làm đổi màu chất chỉ thị, phản C22,
Nhận biết ứng với acid tạo muối, nêu và giải thích được hiện tượng xảy ra 2 9, Base – 23
trong thí nghiệm (viết phương trình hoá học) và rút ra nhận xét về Thang pH (4 tính chất của base. tiết)
– Tra được bảng tính tan để biết một hydroxide cụ thể thuộc loại Thông
kiềm hoặc base không tan. 1 C24 hiểu
- Liên hệ được pH trong dạ dày, trong máu, trong nước mưa, đất.
PHÒNG GD&ĐT HUYỆN ………
KIỂM TRA GIỮA KÌ I TRƯỜNG PTDTBT THCS……..
NĂM HỌC: 2023 - 2024
MÔN: KHTN 8 - TIẾT 33, 34
Họ tên : ..................................... Lớp……
Thời gian làm bài : 90 Phút
( không kể thời gian giao đề) ĐIỂM
NHẬN XÉT CỦA GIÁO VIÊN
...................................................................................................................
...................................................................................................................
I.Trắc nghiệm: (6 điểm) Chọn đáp án đúng nhất trong các câu sau:
Câu 1: Thiết bị cung cấp điện là A. ampe kế.
B. pin 1,5 V. C. công tắc. D. vôn kế.
Câu 2: Nồng độ phần trăm của một dung dịch cho ta biết
A. số gam chất tan có trong dung dịch. B. số mol chất tan có trong 150 gam dung dịch.
C. số gam chất tan có trong 100 gam dung dịch. D. số mol chất tan trong một lít dung dịch.
Câu 3: Thang pH được dùng để biểu thị
A. độ acid, base của dung dịch.
B. độ mặn của dung dịch
C. độ base của dung dịch D. độ acid của dung dịch.
Câu 4: Cho phản ứng hóa học sau: 2
Số mol H2SO4 phản ứng hết với 6 mol Al là A. 3 mol. B. 5 mol. C. 6 mol. D. 9 mol.
Câu 5: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng đốt cháy than.. B. Phản ứng đốt cháy khí hydrogen.
C. Phản ứng đốt cháy cồn. D. Phản ứng nung đá vôi .
Câu 6: Khi tính toán theo phương trình hóa học, cần thực hiện mấy bước cơ bản? A. 1 bước. B. 2 bước. C. 3 bước. D. 4 bước
Câu 7: Thể tích mol chất khí khi ở cùng điều kiện nhiệt độ và áp suất thì như thế nào?
A. Thay đổi tuần hoàn. B. Bằng nhau. C. Khác nhau. D. Chưa xác định được.
Câu 8: Cho các chất sau: H2SO4, HCl, NaCl, CuSO4, NaOH, Mg(OH)2. Số chất thuộc loại axit là A. 2 . B. 1. C. 4 . D. 3.
Câu 9: Hòa tan 50 gam muối ăn (sodium chloride: NaCl) vào nước thu được dung dịch có nồng độ 20%. Khối lượng dung dịch muối ăn pha chế được là
A. 350 gam. B.300 gam.. C. 250 gam. D. 200 gam.
Câu 10: Base là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu sau đây? A. Vàng. B. Tím. C. Xanh. D. Đỏ
Câu 11: Kí hiệu nồng độ mol là A. MC. B. CM. C. CM. D. MC
Câu 12: Để nhận biết dd KOH và dung dịch Ba(OH)2 ta dùng thuốc thử là
A. quỳ tím. B. dung dịch H2SO4. C. dung dịch HCl. D. phenolphtalein.
Câu 13: Chọn khẳng định đúng trong các khẳng định sau?
A. Tổng khối lượng sản phẩm nhỏ hơn tổng khối lượng các chất tham gia phản ứng.
B. Tổng khối lượng sản phẩm nhỏ hơn hoặc bằng tổng khối lượng các chất tham gia phản ứng.
C. Tổng khối lượng sản phẩm lớn hơn tổng khối lượng các chất tham gia phản ứng.
D. Tổng khối lượng sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
Câu 14: Cho phương trình hóa học : N2 + 3H2 → 2NH3. Tỉ lệ mol của các chất N2 :H2: NH3 lần lượt là A. 2:3:1. B. 1:2:3. C. 2:1:3. D. 1:3:2.
Câu 15: Quá trình nào sau đây thể hiện sự biến đổi vật lí?
A. Cơm bị ôi thiu. B. Hòa tan đường ăn vào nước.
C .Gỗ cháy thành than. D. Đun nóng đường đến khi xuất hiện chất màu đen.
Câu 16: Dấu hiệu nhận ra có chất mới tạo thành là A. xuất hiện kết tủa.
B. sự thay đổi về màu sắc. C. xuất hiện chất khí. D. cả 3 dấu hiệu trên.
Câu 17. Tốc độ phản ứng là đại lương đặc trưng cho
A. sự nhanh chậm của phản ứng hóa học.
B. thể tích chất đã tham gia phản ứng. C. thời gian phản ứng.
D. khối lượng chất đã tham gia phản ứng.
Câu 18. Để lấy một lượng nhỏ dung dịch (khoảng 1 mL) thường dùng dụng cụ nào sau đây?
A. Ống hút nhỏ giọt.
B. Phễu lọc. C. Ống đong có mỏ. D. Ống nghiệm.
Câu 19: Than (carbon) cháy trong bình khí oxygen nhanh hơn cháy trong không khí. Yếu tố nào ảnh hưởng đến tốc độ của phản ứng đốt cháy than? A. Không khí.
B. Hóa chất. C. Nồng độ. D. Vật liệu.
Câu 20: Acid là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu sau đây? A. Đỏ. B. Xanh. C. Vàng. D. Tím.
Câu 21: Công thức tính khối lượng mol? A. (m.n)/2 (mol) B. m/n (g/mol). C. m.n (g). D. n/m (mol/g).
Câu 22: Có thể thu khí N2 bằng cách nào
A. Đặt úp bình. B. Đặt ngang bình. C. Đặt đứng bình. D. Cách nào cũng được.
Câu 23: Ở cùng một nồng độ, phản ứng nào dưới đây có tốc độ phản ứng xảy ra chậm nhất.
A . Al + dd NaOH ở 40oC. B. Al + dd NaOH ở 50oC. C. Al + dd NaOH ở 25oC . D. Al + dd NaOH ở 30oC.
Câu 24. Lưu huỳnh cháy theo sơ đồ phản ứng sau:
Sulfur + khí oxygen → sulfur dioxide
Nếu đốt cháy 48 gam sulfur và thu được 96 gam sulfur dioxide thì khối lượng oxygen đã tham gia vào phản ứng là: A. 52 gam. B. 40 gam . C. 44 gam. D. 48 gam. II. Tự luận: 4 điểm
Câu 25: (1,0 điểm) Hòa tan 40 gam KNO3 vào 3600 gam nước thu được dung dịch KNO3. Tính nồng độ phần trăm của dung dịch KNO3 thu được.
Câu 26: (2,0 điểm) Khi cho 6,5g kim loại Zn phản ứng với dung dịch axit sunfuric loãng như sau: Zn+ H2SO4 →ZnSO4 + H2.
Tính khối lượng muối ZnSO4 thu được sau phản ứng.
Câu 27: ( 1điểm) Xác định khối lượng mol của khí A biết tỉ khối của khí A so với khí B là 1,8 và khối lượng mol của khí B là 30.
------------------------------ Hết --------------------------
PHÒNG GD&ĐT ………….
HƯỚNG DẪN CHẤM KIỂM TRA GIỮA KÌ I
TRƯỜNG PTDTBT THCS …. NĂM HỌC 2023-2024
Môn: KHOA HỌC TỰ NHIÊN
I. Trắc nghiệm: Mỗi ý đúng được 0,25 điểm Câu 1 D 2 B 3 B 4 D 5 B 6 D 7 B 8 B 9 C 10 A 11 C 12 B 13 D 14 D 15 A 16 D 17 A 18 A 19 A 20 A 21 C 22 C 23 C 24 D II. Tự luận: Câu Hướng dẫn chấm Điểm 25 0,5 Áp dụng công thức; 0, 5 26
Số mol Fe là: nfFe = 5,6/56 = 0,1 mol 0.25 PT: Fe+ H2SO4 →FeSO4 + H2 0. 5 Theo Pt: 1 1(mol) 0.25 Theo bài: 0,1 → 0,1(mol) 0.25
Từ pt: nFeSO4 = nFe = 0,1 mol 0.25
Khối lượng muối FeSO4 là:
MFeSO4 = nFeSO4.MFeSO4 = 0,1.161 = 16,1 g 0.5 27
Tỉ khối của khí A so với khí B là: M d = A =1,8 0.25 A/B MB
Suy ra MA = 1,8.MB = 1,8.30 = 54 (g/mol). 0. 5
Vậy khối lượng mol của khí A là 54 g/mol. 0.25
Document Outline
- MA TRẬN ĐỀ KIỂM TRA GIỮA KÌ I LỚP 8
- 1. Khung ma trận và đặc tả đề kiểm tra giữa kì 1 môn Khoa học tự nhiên, lớp 8
- C. độ base của dung dịch D. độ acid của dung dịch.
- A. Tổng khối lượng sản phẩm nhỏ hơn tổng khối lượng các chất tham gia phản ứng.
- A. Không khí. B. Hóa chất. C. Nồng độ. D. Vật liệu.
- A. (m.n)/2 (mol) B. m/n (g/mol). C. m.n (g). D. n/m (mol/g).
- A . Al + dd NaOH ở 40oC. B. Al + dd NaOH ở 50oC.
- 1. Khung ma trận và đặc tả đề kiểm tra giữa kì 1 môn Khoa học tự nhiên, lớp 8




