Preview text:
PHÒNG GD&ĐT..........
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1 NĂM 2023 - 2024 TRƯỜNG THPT........
MÔN: HÓA HỌC LỚP 11
Thời gian làm bài: 45 phút
I. PHẦN TRẮC NGHIỆM (7 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1. Điền vào chỗ chấm hoàn thành câu sau: “… của phản ứng thuận
nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.” A. trạng thái cân bằng. B. trạng thái ban đầu. C. trạng thái kết thúc.
D. trạng thái phản ứng.
Câu 2. Cho đáp án đúng: Ở trạng thái cân bằng
A. tốc độ phản ứng thuận lớn hơn tốc độ phản ứng nghịch.
B các chất không phản ứng với nhau.
C. nồng độ các chất sản phẩm luôn lớn hơn nồng độ chất đầu.
D. nồng độ các chất không thay đổi.
Câu 3. Hằng số cân bằng KC phụ thuộc vào bản chất của yếu tố nào? A. Nồng độ. B. Áp suất. C. Nhiệt độ. D. Chất xúc tác.
Câu 4. Dung dịch nào sau đây không dẫn điện được ? A. Ca(OH)2 B. CH3OH C. HCl D. Al2(SO4)3
Câu 5 Dãy chất nào dưới đây chỉ gồm những chất tan và điện li mạnh?
A. HNO3, Cu(NO3)2, Ca3(PO4)2, H3PO4
B. H2SO4, NaCl, KNO3, Ba(NO3)2 C. CaCl2, CuSO4, CaSO4, HNO3 D. KCl, H2SO4, H2O, CaCl2
Câu 6. Theo thuyết Br nsted – Lowry chất nào dưới đây là acid? A. NH3. B. H2SO4. C. NaOH. D. HS-.
Câu 7. Ở khoảng pH >8, phenolphthalein có màu A. Đỏ B. Tím C. Hồng D. Không màu
Câu 8. Nitrogen là nguyên tố phổ biến chiếm 75,5% khối lượng (hoặc 78,1% thể tích) ở đâu?
A. Trong khí quyển Trái Đất. B. Trong vỏ Trái Đất.
C. Trong cơ thể động vật.
D. Trong cơ thể thực vật.
Câu 9. N2 phản ứng với O2 tạo thành NO ở điều kiện A. Điều kiện thường.
B. Nhiệt độ cao khoảng 500℃.
C. Nhiệt độ cao khoảng 1000℃.
D. Nhiệt độ cao khoảng 3000℃.
Câu 10. Khi làm thí nghiệm với dung dịch HNO3 đặc thường sinh ra khí
nitrogen dioxde gây ô nhiễm không khí. Công thức của nitrogen dioxide là A. NH3 B. NO C. N2O D. NO2
Câu 11. Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là một chất oxi hóa? A. 2NH3+ 3Cl2→ N2+ 6HCl B. 4NH3+ 5O2 → 4NO+ 6H2O C. 2NH3+ 2Na → 2NaNO3+ H2
D. 2NH3+ H2O2+ MnSO4→ MnO2 + (NH4)2SO4
Câu 12. Tính khử của NH3 do
A. trên N còn cặp electron tự do
B. phân tử có 3 liên kết cộng hóa trị phân cực
C. trong phân tử N có số oxi hóa -3.
D NH3 tác dụng với nước tạo NH4OH.
Câu 13. Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước A. P2O5 B. H2SO4đặc C. CuO bột D. NaOH rắn
Câu 14. Nguyên nhân hình thành prompt – NOx trong không khí là
A. nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen trong không khí.
B. nitrogen trong núi lửa tác dụng với các gốc tự do (gốc hydrocarbon, gốc hydroxyl).
C. nitrogen trong không khí tác dụng với các gốc tự do (gốc hydrocarbon, gốc hydroxyl).
D. nhiệt độ rất cao (trên 3000oC) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa.
Câu 15. Tên gọi của NO2 là A. Dinitrogen oxide. B. Nitrogen monoxide C. Nitrogen dioxide. D. Ninitrogen tetroxide.
Câu 16. Công thức cấu tạo của nitric acid là A. HNO₃ B. HNO5 C. HNO6 D. HNO7
Câu 17. Cho cân bằng hóa học:
H2 (k) + I2 (k) ⇌ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. tăng nhiệt độ của hệ B. giảm nống độ HI C. tăng nồng độ H2
D. giảm áp suất chung của hệ.
Câu 18. Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào
sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Câu 19. Cho các cân bằng hóa học sau:
(1) 2SO2 (k) + O2 (k) ⇌ 2SO3 (k) (2) N2 (k) + 3H2 ⇌ 2NH3 (k)
(3) 3CO2 (k) + H2 (k) ⇌ CO (k) + H2O (k)
(4) 2HI (k) ⇌ H2 (k) + I2 (k)
Khi thay đổi áp suất, các cân bằng hóa học đều không bị chuyển dịch là A. (1) và (3). B. (2) và (4). C. (1) và (2). D. (3) và (4).
Câu 20. Trộn 200 ml dung dịch H2SO4 0,05M với 300ml dung dịch HCl 0,1M
thu được dung dịch Y. pH của dung dịch Y là A 1 B. 1,3 C. 4 D. 3
Câu 21. Dung dịch có pH > 8 là: A. NH4Cl. B. CH3COONa. C. CH3COOH D. Mg(OH)2.
Câu 22. Ở những thửa ruộng chua, dung dịch đất có pH luôn luôn: A. Lớn hơn 7. B. Bằng 7. C. Nhỏ hơn 7. D. Nhỏ hơn 14.
Câu 23. Ở nhiệt độ thường, khí nitrogen khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kém hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Câu 24. Chọn đáp án sai. Nitrogen có những đặc điểm tính chất sau:
A. Nitrogen là phi kim tương đối hoạt động ở nhiệt độ cao.
B. Nguyên tử nitrogen có 5 electron ở lớp ngoài cùng nên chỉ khi có khả năng
tạo hợp chất cộng hóa trị trong đó nitrogen có số oxi hóa +5 và -3.
C. Nitrogen thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
D. Nitrogen tương đối trơ ở nhiệt độ thường.
Câu 25. Chỉ dùng dung dịch nào dưới đây để phân biệt các dung dịch mất
nhãn không màu: NH4NO3, NaCl, (NH4)2SO4, Mg(NO3)2, FeCl2 ? A. NaOH. B. BaCl2. C. AgNO3. D. Ba(OH)2.
Câu 26. Muối được làm bột nở trong thực phẩm là A. (NH4)2CO3. B. Na2CO3. C. NH4HCO3. D. NH4Cl.
Câu 27. Nhận xét nào dưới đây sai?
A. Hiện tượng phú dưỡng làm tăng sự quang hợp của thực vật thủy sinh.
B. Hiện tượng phú dưỡng gây cản trở sự hấp thụ ánh sáng mặt trời vào nước.
C. Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa dinh dưỡng.
D. Sự dư thừa thức ăn chăn nuôi tại nhiều đầm nuôi trồng thủy sản tạo ra sự dư thừa dinh dưỡng.
Câu 28. Phản ứng nào sau đây mô tả ứng dụng tính acid của nitric acid?
A. Fe2O3 + HNO3(đặc nóng). B. ZnS + HNO3(đặc nóng). C.Fe + HNO3(loãng).
D. Al2O3 + HNO3(đặc nóng).
II. PHẦN TỰ LUẬN (3 điểm)
Câu 1. (1 điểm) Cho phản ứng sau:
CO (k) + Cl2 (k) ⇋ COCl2 (k)
Thực hiện trong bình kín dung tích 1 lít ở nhiệt độ không đổi. Khi hệ đạt trạng
thái cân bằng thì [CO] = 0,02M; [Cl2] = 0,01M; [COCl2] = 0,02M. Bơm thêm
vào bình 1,42 gam Cl2. Tính nồng độ mol của CO; Cl2 và COCl2 ở trạng thái cân bằng.
Câu 2. (1 điểm) Viết các phương trình hóa học minh họa quá trình hình tạo và
cung cấp đạm nitrate cho đất từ nước mưa trong tự nhiên xuất phát từ nitrogen.
Câu 3 (1 điểm) Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ
được giữ không đổi. Sau thời gian phản ứng, áp suất của các khí trong bình
giảm 6,5% so với áp suất lúc đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là
12,5%. Tính thành phần % số mol N2 và H2 trong hỗn hợp ban đầu?
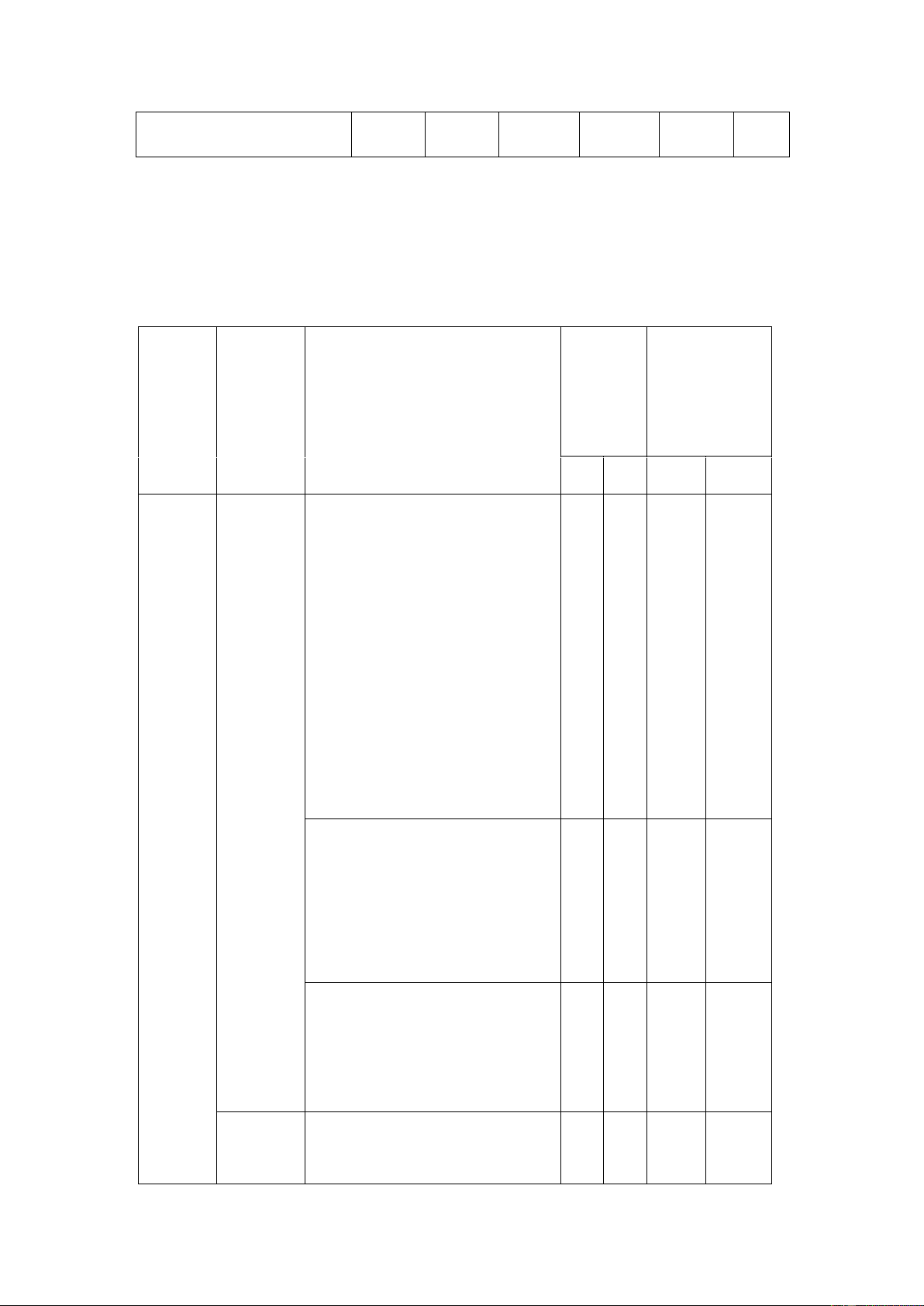
Ma trận đề thi giữa kì 1 Hóa học 11 MỨC ĐỘ Tổng CHỦ NỘI DUNG Nhận Thông Vận Điểm số câu VD cao ĐỀ KIẾN THỨC biết hiểu dụng số
TN TL TN TL TN TL TN TL TN TL Bài 1. Mở đầu về cân bằng 3 3 1 6 1 2,5đ hóa học Bài 2. Sự điện Cân li, thuyết Br 3 3 0 0,75đ bằng nsted – Lowry
hóa học về acid – base Bài 3. pH của dung dịch – 1 3 4 0 1đ chuẩn độ acid và base Bài 4. Đơn 3 2 1 5 1 2,25đ chất nitrogen Nitrogen Bài 5. Mộ và t số hợp chất quan sulfur 6 4 1 10 1 3,5đ trọng của nitrogen Tổng số câu TN/TL 16 0 12 0 0 2 0 1 28 3 Điểm số
4đ 0đ 3đ 0đ 0đ 2đ 0đ 1đ 7đ 3đ 10
4 điểm 3 điểm 2 điểm 1 điểm 10 điểm Tổng số điểm điểm 40% 30% 20% 10% 100 %
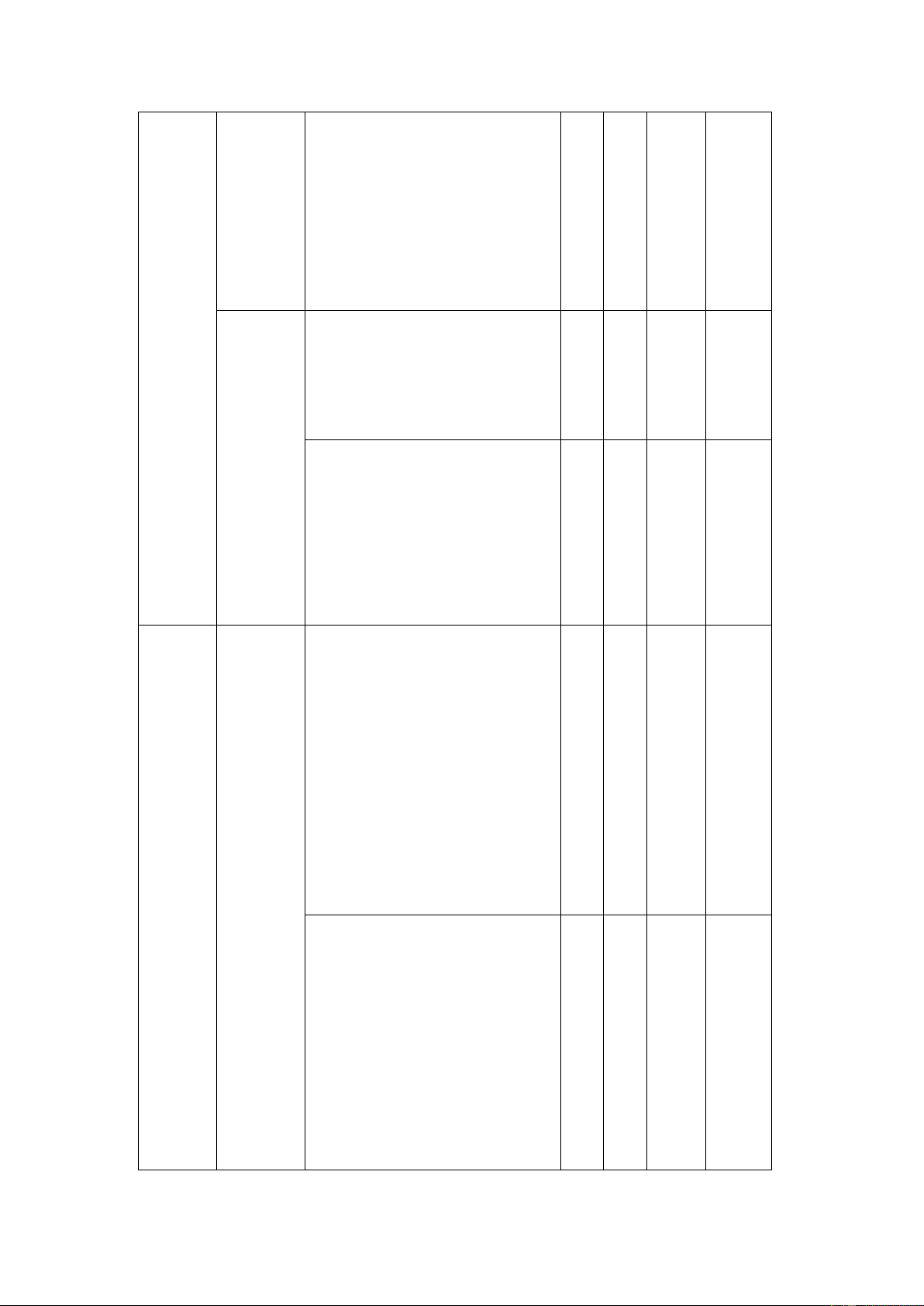
BẢN ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA GIỮA HỌC KÌ 1 (2023 – 2024)
MÔN: HÓA HỌC 11 – CÁNH DIỀU Số ý TL/ Nội Đơn vị Câu hỏi
Mức độ, yêu cầu cần đạt Số câu dung kiến thức hỏi TN TL TN TL TN Nhận biết:
- Trình bày được khái niệm
phản ứng thuận nghịch và Câu 1 2
trạng thái cân bằng của phản Câu 2 ứng thuận nghịch. 1 Câu 3
- Viết được biểu thức hằng số
Bài 1. Mở cân bằng (KC) của phản ứng đầu về Cân thuận nghịch cân bằng bằng Thông hiểu: hóa họ Câu 17 c hóa học
- Xác được yếu tố ảnh hưởng 3 Câu 18
đến trạng thái cân bằng hóa học Câu 19 Vận dụng: 1 Câu 1
- Tính nồng độ, hằng số cân bằng của phản ứng
Bài 2. Sự Nhận biết: 2 Câu 4 điện li,
thuyết Br - Xác định được chất điện li, 1 Câu 5 nsted – chất không điện li Câu 6 Lowry về
- Xác định được chất nào là acid – bas
acid dựa theo thuyết Br nsted – Lowry Nhận biết: Bài 3. pH 1 Câu 7
- Biết cách sử dụng chất chỉ thị
của dung phổ biến để xác định pH dịch – Thông hiểu: Câu 22 chuẩn độ 1 acid và
- Nêu được ý nghĩa của pH Câu 20 base trong thực tiễn 2 Câu 21
- Tính được pH của dung dịch Nhận biết:
- Phát biểu được trạng thái tự Câu 8
nhiên của nguyên tố nitrogen 1 Câu 9
- Trình bày được sự hoạt động 2
của đơn chất nitrogen ở nhiệt Câu 10
Nitrogen Bài 4.
độ cao đối với hydrogen, và Đơn chất oxygen sulfur
nitrogen Thông hiểu:
- Giải thích được tính trơ của đơn chấ 1 Câu 23 t nitrogen trong sản
xuất, trong hoạt động nghiên 1 Câu 24 cứu.
- Trình bày được đặc điểm tính chất của nitrogen Vận dụng:
- Viết được phương trình hóa 1 Câu 2
học minh họa quá trình hình
thành đạm nitrate trong tự
nhiên xuất phát từ nitrogen Nhận biết:
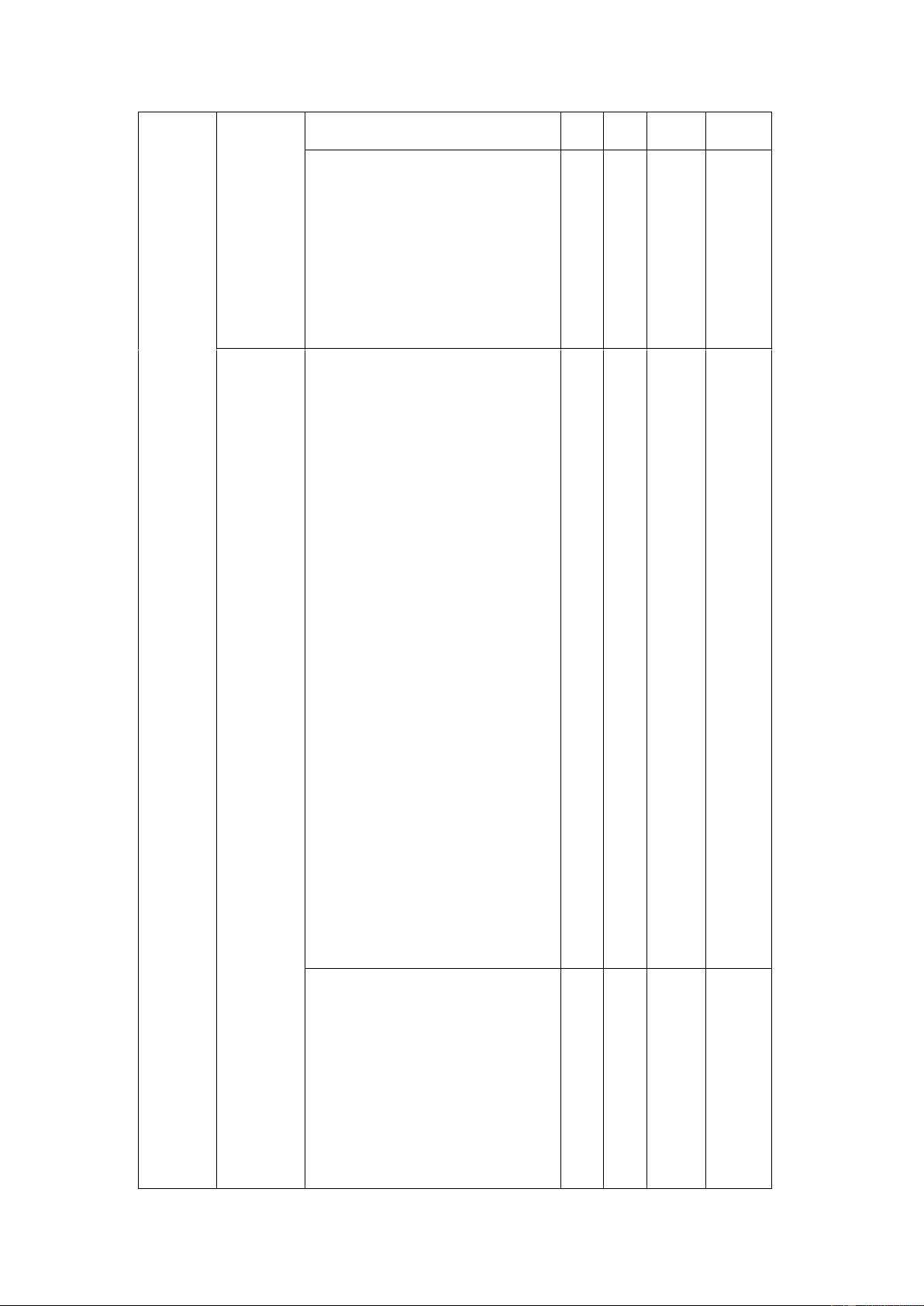
- Giải thích được tính chất vật lý (tính tan) của ammonia
- Nhận biết được vai trò của 1 Câu 12 ammonia trong phản ứng. 1 Câu 11
- Nhận biết được tính chất hóa 1 Câu 13 học của ammonia. Câu 14 Bài 5. Mộ 1
t - Phân tích được nguồn gốc số hợp
các oxide của nitrogen trong 1 Câu 15
chất quan không khí và nguyên nhân gây
trọng của hiện tượng mưa acid. 1 Câu 16 nitrogen
- Gọi tên được các oxide.
- Nêu được đặc điểm cấu tạo nitric acid. Thông hiểu: Câu 25 2
- Nhận biết được muối Câu 26 ammonium. 1 Câu 27
- Giải thích được nguyên nhân, 1
hệ quả của hiện tượng phú Câu 28 dưỡng
- Nêu được tính acid, tính oxi
hóa của HNO3 trong một số
ứng dụng thực tiễn quan trọng của nitric acid. Vận dụng cao:
- Vận dụng giải bài tập liên 1 Câu 3
quan đến tổng hợp ammonia từ nitrogen và hydrogen.