




Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KIỂM TRA HỌC KỲ I NĂM HỌC 2019-2020 QUẢNG NAM
Môn: HÓA HỌC – Lớp 9
Thời gian: 45 phút (không kể thời gian giao đề) ĐỀ CHÍNH THỨC MÃ ĐỀ: A
A. TRẮC NGHIỆM: (5,0 điểm)
Chọn phương án trả lời đúng rồi ghi ra giấy thi: Ví dụ: 1 - A, 2 - B, …
Câu 1. Phản ứng giữa H2SO4 và NaOH thuộc loại phản ứng A. thế. B. phân hủy. C. hóa hợp. D. trung hòa.
Câu 2. Đá vôi là nguyên liệu để sản xuất vôi sống trong công nghiệp. Thành phần hóa học chính của đá vôi là A. CaO. B. CaCO3. C. Ca(OH)2. D. CaSO3.
Câu 3. Điện phân dung dịch muối ăn bão hòa (có màng ngăn) thu được sản phẩm là
A. dung dịch NaOH và khí Cl2, O2.
B. Na2O và khí H2, Cl2.
C. dung dịch NaOH và khí H2, Cl2.
D. dung dịch NaOH và khí Cl2.
Câu 4. Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch? A. K2CO3, Ba(OH)2. B. NaCl, Al(NO3)3. C. HCl, AgNO3.
D. H2SO4, BaCl2.
Câu 5. Tất cả các chất trong dãy nào sau đây tác dụng với HCl tạo thành muối và nước? A. Mg, KOH, ZnO. B. Fe, Cu, Na2O.
C. Cu(OH)2, Al2O3, NaOH. D. Zn, Mg(OH)2, CuO.
Câu 6. Phân bón nào sau đây thuộc loại phân bón đơn?
A. NPK. B. (NH4)2HPO4.
C. CO(NH2)2. D. KNO3.
Câu 7. Khí clo có màu A. nâu đỏ.
B. trắng xanh.
C. lục nhạt.
D. vàng lục.
Câu 8. Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm lượng cacbon chiếm A. trên 2%. B. dưới 2%. C. từ 2% đến 5%. D. trên 5%.
Câu 9. Oxit nào sau đây tác dụng được với nước tạo thành dung dịch làm quì tím hóa xanh? A. Fe2O3. B. Na2O. C. P2O5. D. SO3.
Câu 10. Kim loại nào sau đây phản ứng được với dung dịch NaOH? A. Ag. B. Fe. C. Al. D. Cu.
Câu 11. Dãy nào sau đây gồm các kim loại được sắp xếp theo chiều giảm dần khả năng hoạt động hóa học? A. Na, Mg, Zn, Cu, Ag. B. Al, Zn, Na, Fe, Cu. C. Mg, Al, Na, Fe, Cu.
D. Pb, Al, Mg, Na, K.
Câu 12. Chất nào sau đây tác dụng với dung dịch H2SO4 tạo kết tủa trắng? A. KOH. B. Al2O3. C. Ba(OH)2. D. Fe. Trang 1
Câu 13. Để tinh chế dung dịch ZnSO4 có lẫn tạp chất CuSO4, có thể dùng lượng dư kim loại A. Zn. B. Fe. C. Cu. D. Al.
Câu 14. Dẫn từ từ hỗn hợp khí gồm CO2, CO, SO2 qua dung dịch Ca(OH)2 dư đến khi phản ứng
xảy ra hoàn toàn, khí thoát ra là A. CO. B. CO2. C. SO2. D. CO2 và SO2.
Câu 15. Chất nào sau đây có tính axit?
A. Na2SO4. B. K2O. C. Ba(OH)2. D. H3PO4.
B. TỰ LUẬN: (5,0 điểm)
Câu 1. (2,0 điểm) Viết các phương trình hóa học thực hiện dãy chuyển hóa sau, ghi rõ điều kiện
phản ứng (nếu có). Fe → (1) FeCl (2) (3) (4)
3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
Câu 2. (2,0 điểm) Hòa tan 25,95 gam hỗn hợp X gồm Zn và ZnO trong dung dịch HCl 12% vừa
đủ. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí (đktc).
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp X.
c. Tính khối lượng dung dịch HCl 12% đã dùng.
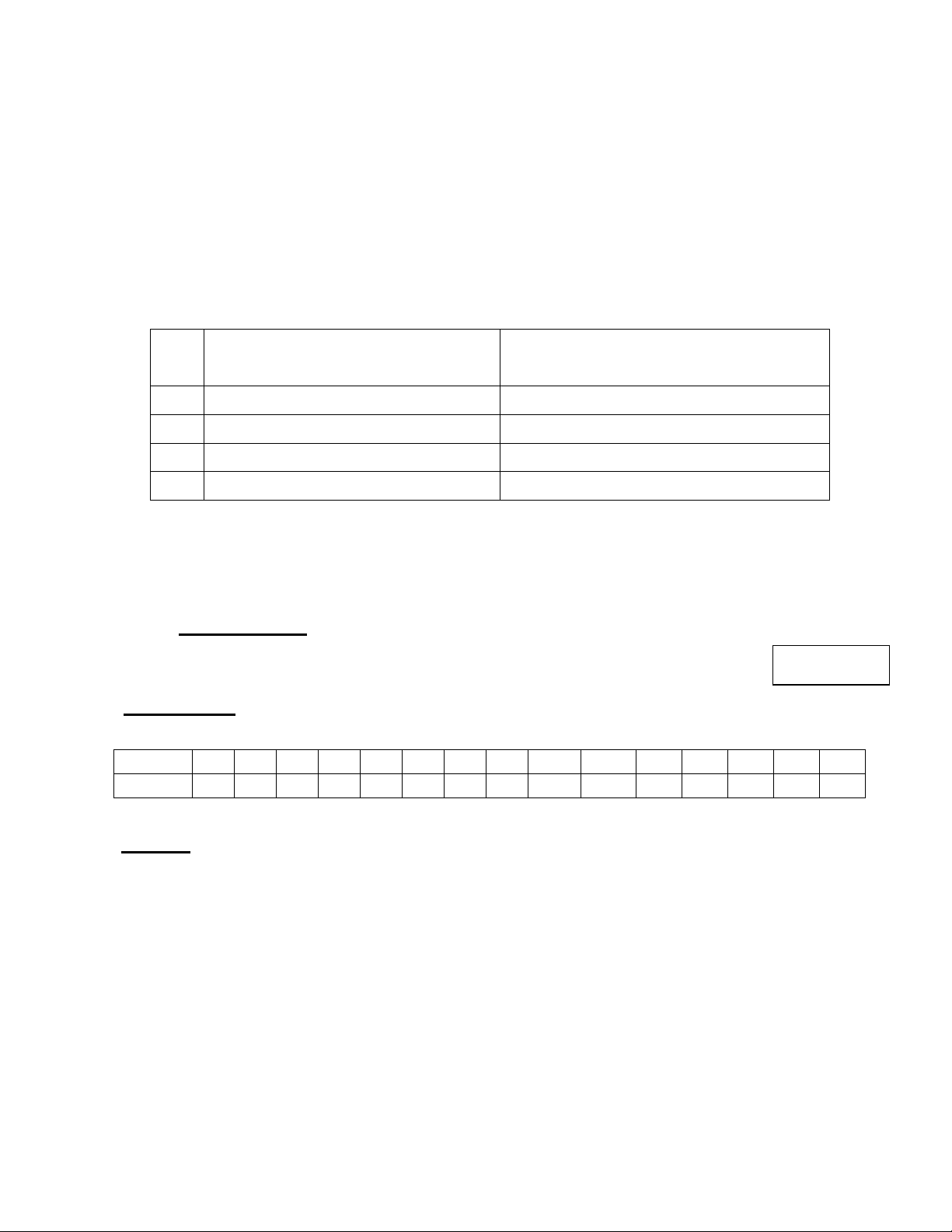
Câu 3. (1,0 điểm) Lập bảng và điền thông tin vào ô trống tương ứng với các ứng dụng của nhôm:
Các tính chất chủ yếu tương ứng TT Ứng dụng của nhôm 1
Làm khung cửa sổ, cửa ra vào 2
Làm nồi, xoong, chảo, ... 3
Làm dây dẫn điện cao thế 4 Làm lon chứa bia
(Biết: Zn = 65; O = 16; Cl = 35,5; H=1)
--------- Hết---------
SỞ GIÁO DỤC VÀ ĐÀO TẠO HƯỚNG DẪN CHẤM
QUẢNG NAM KIỂM TRA KÌ I NĂM HỌC 2019 - 2020 Môn: Hóa học – Lớp 9 MÃ ĐỀ: A
A. Trắc nghiệm (5 điểm): 03 câu đúng được 1,0 điểm (nếu đúng thêm 01 câu cộng 0,3 điểm;
đúng thêm 02 câu cộng 0,7 điểm) Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Trả lời D B C B C C D B B C A C A A D
B. Tự luận (5 điểm )
Câu 1: (2,0 điểm) Các phương trình hóa học: (1) 2Fe + 3Cl to 2 → 2FeCl3. (0,5 điểm) Trang 2
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (0,5 điểm) to
(3) 2Fe(OH)3 → Fe2O3 + 3H2O. (0,5 điểm)
(4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O. (0,5 điểm)
Mỗi phương trình hóa học viết đúng được 0,5 điểm, cân bằng sai hoặc thiếu điều kiện
phản ứng trừ 0,25 điểm/1 PTHH, ghi sai CTHH không cho điểm (học sinh làm theo cách khác
nếu đúng vẫn cho điểm tối đa). Câu 2: (2,0 điểm)
a) Viết đúng các phương trình hóa học: Zn + 2HCl → ZnCl2 + H2 (1) (0,25 điểm)
ZnO + 2HCl → ZnCl2 + H2O (2) (0,25 điểm)
b) Tính đúng % khối lượng của Zn và ZnO trong hỗn hợp (0,75 điểm) Số mol của H2: 0,15 mol Số mol của Zn: 0,15 mol
Khối lượng của Zn: 9,75 gam % Zn: 37,57% % ZnO: 62,43%
c) Tính đúng khối lượng dung dịch HCl cần dùng (0,75 điểm)
Khối lượng ZnO: 16,2 gam Số mol ZnO: 0,2 mol
Số mol HCl (1) và (2): 0,7 mol
Khối lượng HCl: 25,55 gam
Khối lượng dung dịch HCl 12%: 212,92 gam
Câu 3: (1,0 điểm)
Các tính chất chủ yếu tương ứng Điểm TT Ứng dụng của nhôm 1
Làm khung cửa sổ, cửa ra vào Bền, trắng sáng 0,25 2
Làm nồi, xoong, chảo, ... Dẫn nhiệt tốt 0,25 3
Làm dây dẫn điện cao thế Nhẹ, dẫn điện tốt 0,25 4 Làm lon chứa bia Nhẹ, bền, trắng sáng 0,25
* Học sinh phải ghi đủ ý ở mỗi mục mới cho điểm. = = = = =/// = = = = = =
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KIỂM TRA HỌC KỲ I NĂM HỌC 2019-2020 QUẢNG NAM
Môn: HÓA HỌC – Lớp 9
Thời gian: 45 phút (không kể thời gian giao đề) ĐỀ CHÍNH THỨC MÃ ĐỀ: B
A. TRẮC NGHIỆM: (5,0 điểm)
Chọn phương án trả lời đúng rồi ghi ra giấy thi: Ví dụ: 1 - A, 2 - B, …
Câu 1. Tất cả các chất trong dãy nào sau đây tác dụng với HCl tạo thành muối và nước? Trang 3 A. Mg(OH)2, KOH, ZnO. B. Fe2O3, Zn, AgNO3. C. CuO, Al, KOH. D. Zn(OH)2, Fe, Al.
Câu 2. Khí clo có màu A. nâu đỏ. B. vàng lục.
C. lục nhạt.
D. trắng xanh.
Câu 3. Oxit nào sau đây tác dụng được với nước tạo thành dung dịch làm quì tím hóa đỏ? A. CuO. B. Na2O. C. SO3. D. K2O.
Câu 4. Điện phân dung dịch muối ăn bão hòa (có màng ngăn) thu được khí
A. H2, Cl2 và O2. B. O2 và Cl2. C. HCl và Cl2. D. H2 và Cl2.
Câu 5. Kim loại nào sau đây phản ứng được với dung dịch NaOH? A. Ag. B. Fe. C. Al. D. Cu.
Câu 6. Phân bón nào sau đây thuộc loại phân bón kép?
A. Ca3(PO4)2. B. (NH4)2HPO4.
C. CO(NH2)2. D. K2SO4.
Câu 7. Dãy nào sau đây gồm các kim loại được sắp xếp theo chiều giảm dần khả năng hoạt động hóa học? A. K, Na, Al, Pb, Ag. B. Ag, Cu, Al, Na, K. C. Al, Mg, Na, K, Ag. D. Mg, Al, Pb, K, Na.
Câu 8. Phản ứng giữa Zn và CuSO4 thuộc loại phản ứng A. thế. B. trung hòa. C. trao đổi.
D. phân hủy.
Câu 9. Dung dịch chất nào sau đây tác dụng với dung dịch BaCl2 tạo kết tủa trắng? A. NaOH. B. H2SO4. C. HCl. D. Cu(NO3)2.
Câu 10. Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn,
S, …, trong đó hàm lượng cacbon chiếm A. dưới 2%. B. từ 2% đến 8%. C. từ 2% đến 5%. D. trên 8%.
Câu 11. Để tinh chế dung dịch Cu(NO3)2 có lẫn tạp chất AgNO3, có thể dùng lượng dư kim loại A. Zn. B. Ag. C. Cu. D. Mg.
Câu 12. Khí SO2 có thể được điều chế bằng phản ứng giữa A. K2SO3 và KOH. .
B. H2SO4 đặc, nguội và Al. C. Na2SO4 và H2SO4. D. Na2SO3 và HCl.
Câu 13. Chất nào sau đây có tính bazơ?
A. HCl. B. KNO3. C. P2O5. D. Cu(OH)2.
Câu 14. Để loại bỏ khí SO2 có lẫn trong hỗn hợp với O2, có thể sục hỗn hợp qua lượng dư dung dịch của A. HCl. B. Ca(OH)2. C. Na2SO4. D. KCl.
Câu 15. Cặp chất nào sau đây không tồn tại trong cùng một dung dịch? A. K2CO3, NaOH. B. KCl, Mg(NO3)2. C. HCl, AgNO3.
D. H2SO4, CuCl2.
B. TỰ LUẬN: (5,0 điểm) Trang 4
Câu 1. (2,0 điểm) Viết các phương trình hóa học thực hiện dãy chuyển hóa sau, ghi rõ điều kiện
phản ứng (nếu có). Al → (1) AlCl (2) (3) (4)
3 → Al(OH)3 → Al2(SO4)3 → AlCl3
Câu 2. (2,0 điểm) Hòa tan 10,8 gam hỗn hợp X gồm Mg và MgO trong dung dịch H2SO4 20%
vừa đủ. Sau khi phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí (đktc).
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp X.
c. Tính khối lượng dung dịch H2SO4 20% đã dùng.
Câu 3. (1,0 điểm) Lập bảng và điền thông tin vào ô trống tương ứng với các ứng dụng của nhôm:
Các tính chất chủ yếu tương ứng TT Ứng dụng của nhôm 1
Làm dây dẫn điện cao thế 2
Làm nồi, xoong, chảo, ... 3
Làm xô, chậu chứa nước 4 Làm lon chứa bia
(Biết: Mg = 24; O = 16; S = 32; H=1)
--------- Hết---------
SỞ GIÁO DỤC VÀ ĐÀO TẠO HƯỚNG DẪN CHẤM
QUẢNG NAM KIỂM TRA KÌ I NĂM HỌC 2019 - 2020
Môn: Hóa học – Lớp 9 MÃ ĐỀ: B
A. Trắc nghiệm (5 điểm): 03 câu đúng được 1,0 điểm (nếu đúng thêm 01 câu cộng 0,3 điểm;
đúng thêm 02 câu cộng 0,7 điểm) Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Trả lời A B C D C B A A B C C D D B C
B. Tự luận ( 5 điểm )
Câu 1: (2,0 điểm) Các phương trình hóa học:
(1) 2Al + 6HCl → 2AlCl3 + 3H2. (0,5 điểm)
(2) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl. (0,5 điểm)
(3) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O. (0,5 điểm)
(4) Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4. (0,5 điểm)
Mỗi phương trình hóa học viết đúng được 0,5 điểm, cân bằng sai hoặc thiếu điều kiện
phản ứng trừ 0,25 điểm/1 PTHH, ghi sai CTHH không cho điểm (học sinh làm theo cách khác
nếu đúng vẫn cho điểm tối đa). Câu 2: (2,0 điểm)
a) Viết đúng các phương trình hóa học: Mg + H2SO4 → MgSO4 + H2 (1) (0,25 điểm)
MgO + H2SO4 → MgSO4 + H2O (2) (0,25 điểm) Trang 5
b) Tính đúng % khối lượng của Mg và MgO trong hỗn hợp (0,75 điểm) Số mol của H2: 0,2 mol Số mol của Mg: 0,2 mol
Khối lượng của Mg: 4,8 gam % Mg: 44,44% % MgO: 55,56%
c) Tính đúng khối lượng dung dịch H2SO4 cần dùng (0,75 điểm) Khối lượng MgO: 6 gam Số mol MgO: 0,15 mol
Số mol H2SO4 (1) và (2): 0,35 mol
Khối lượng H2SO4: 34,3 gam
Khối lượng dung dịch H2SO4 20%: 171,5 gam Câu 3: (1,0 điểm)
Các tính chất chủ yếu tương ứng Điểm TT Ứng dụng của nhôm 1
Làm dây dẫn điện cao thế Nhẹ, dẫn điện tốt 0,25 2
Làm nồi, xoong, chảo, ... Dẫn nhiệt tốt 0,25 3
Làm xô, chậu chứa nước Nhẹ, bền, trắng sáng 0,25 4 Làm lon chứa bia Nhẹ, bền, trắng sáng 0,25
* Học sinh phải ghi đủ ý ở mỗi mục mới cho điểm. = = = = =/// = = = = = = Trang 6




