




Preview text:
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG NĂM HỌC 2021-2022 Môn: Hóa Học 12
Thời gian làm bài: 180 phút Câu 1:(5 điểm)
1. Nguyên tử của nguyên tố M thuộc nhóm A, có khả năng tạo được cation M3+ có tổng số hạt
cơ bản ( e, p,n ) là 37. Tìm nguyên tố M và xác định vị trí của nó trong bảng tuần hoàn.
2. Cho một lượng Cu2S tác dụng hoàn toàn với dung dịch HNO3 đun nóng, thu được dung dịch
A1 và giải phóng khí A2 không màu, bị hóa nâu trong không khí. Chia A1 thành 2 phần.
- Thêm dung dịch BaCl2 vào phần 1 thấy tạo thành kết tủa trắng A3 thực tế không tan trong axit dư.
- Thêm lượng dư NH3 vào phần 2, đồng thời khuấy đều, thu được dung dịch A4 có màu xanh lam đậm.
a. Xác định A1, A2, A3, A4.
b. Viết phương trình hóa học của các phản ứng trong thí nghiệm trên.
3. Hoàn thành các phương trình hoá học theo sơ đồ chuyển hoá sau (ghi rõ điều kiện phản ứng,
các chất viết ở dạng công thức cấu tạo thu gọn).
C8H14O4 + NaOH→ X1 + X2 + H2O X1 + H2SO4 → X3 + Na2SO4 X3 + X4 → nilon-6,6 + H2O
X2 + X3 → X5 + H2O (tỷ lệ số mol X2: số mol X3 = 2:1) Câu 2:(4 điểm)
1. Cho 20,8 gam hỗn hợp Fe, FeS, FeS2, S tác dụng với dung dịch HNO3 đặc nóng dư thu được
V lít khí NO2 (là sản phẩm khử duy nhất, đo ở đktc) và dung dịch A. Cho A tác dụng với dung
dịch Ba(OH)2 dư thu được 91,3 gam kết tủa. Tính V?
2. Cho 2,16 gam hỗn hợp gồm Al và Mg tan hết trong dung dịch HNO3 loãng, đun nóng nhẹ
tạo ra dung dịch A và 448 ml (đktc) hỗn hợp khí B khô gồm 2 khí không màu, không đổi màu
trong không khí.Tỉ khối của B so với oxi bằng 1,125. Làm khan A một cách cẩn thận thu được
chất rắn D, nung D đến khối lượng không đổi thu được 3,84 gam chất rắn E. Tính lượng chất D và
% khối lượng mỗi chất ban đầu.
Câu 3: (4 điểm)
1. Cho 0,76 gam hỗn hợp X gồm hai amin đơn chức, có số mol bằng nhau, phản ứng hoàn toàn
với dung dịch HCl dư, thu được 1,49 gam muối. Xác định công thức cấu tạo của 2 amin.
2. Cho 0,7 mol hỗn hợp T gồm hai peptit mạch hở X (x mol) và Y (y mol), đều tạo bởi glyxin
và alanin. Đun nóng 0,7 mol T trong lượng dư dung dịch NaOH thì có 3,8 mol NaOH phản ứng và
thu được dung dịch chứa m gam muối. Mặt khác, nếu đốt cháy hoàn toàn x mol X hoặc y mol Y
thì đều thu được cùng số mol CO2. Biết tổng số nguyên tử oxi trong hai phân tử X và Y là 13,
trong X và Y đều có số liên kết peptit không nhỏ hơn 4. Tính giá trị của m. Câu 4: (3 điểm)
A là hiđrocacbon không làm mất màu dung dịch brom. Đốt cháy hoàn toàn 0,02 mol A và hấp
thụ sản phẩm cháy vào dung dịch chứa 0,15 mol Ca(OH)2 thu được kết tủa và khối lượng bình Trang 1
tăng lên 11,32 gam. Cho dung dịch Ba(OH)2 dư vào dung dịch thu được kết tủa lại tăng lên, tổng
khối lượng kết tủa 2 lần là 24,85 gam. A không tác dụng với dung dịch KMnO4/H2SO4 nóng, còn
khi monoclo hóa trong điều kiện chiếu sáng thì chỉ tạo một sản phẩm duy nhất.
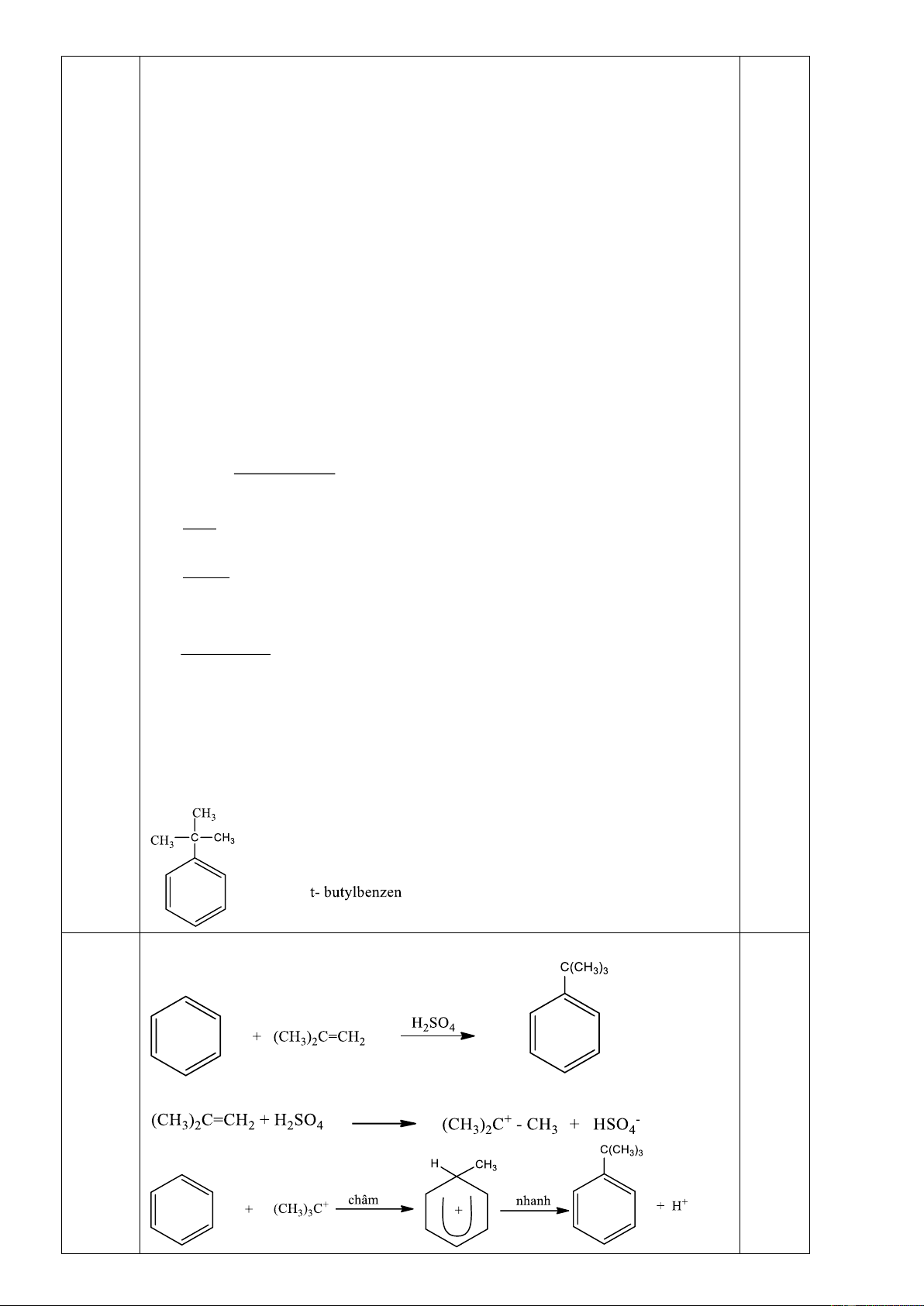
1. Xác định công thức cấu tạo và gọi tên A.
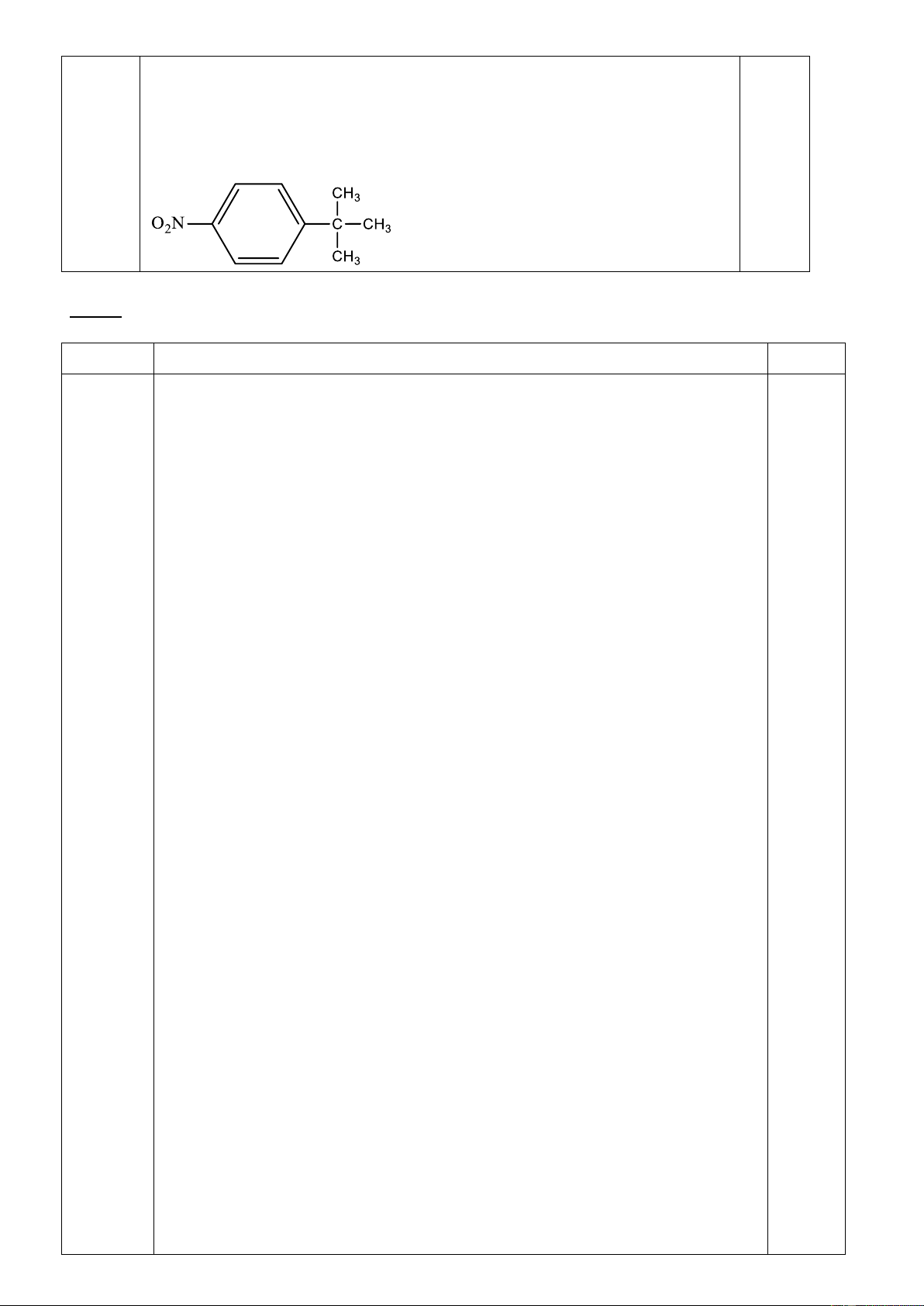
2. Người ta có thể điều chế A từ phản ứng giữa benzen và anken tương ứng trong axit sunfuric.
Dùng cơ chế phản ứng để giải thích phản ứng này.
3. Mononitro hóa A bằng cách cho phản ứng với axit nitric (có mặt axit sunfuric đặc) thì sản
phẩm chính thu được là gì? Tại sao? Câu 5:(4 điểm)
Cho hỗn hợp X gồm bốn este mạch hở, trong đó có một este đơn chức và ba este hai chức là
đồng phân của nhau. Đốt cháy hoàn toàn 11,88 gam X cần 14,784 lít O2 (đktc), thu được 25,08
gam CO2. Đun nóng 11,88 gam X với 310 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản
ứng thu được m gam chất rắn Y và phần hơi chỉ chứa một ancol đơn chức Z. Lấy toàn bộ Z cho
vào bình đựng Na dư, sau khi phản ứng xảy ra hoàn toàn thấy khối lượng bình đựng Na tăng 5,85
gam. Trộn m gam Y với CaO rồi nung trong điều kiện không có không khí, thu được 2,016 lít (ở
đktc) một hidrocacbon duy nhất.Các phản ứng xảy ra hoàn toàn. Xác định công thức phân tử và
viết công thức cấu tạo của các este trong hỗn hợp X.
-----------------Hết----------------
Lưu ý: Học sinh được sử dụng bảng HTTH các nguyên tố hóa học.
ĐÁP ÁN ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG Câu 1.( 5 điểm) Câu 1 Đáp án Điểm 1.
M thuộc nhóm A và M → M3+ +3e suy ra M phải là kim loại thuộc 2 điểm nhóm IIIA 0,5 P + E + N = 37 +3 =40
Mà P = E = Z 2Z +N = 40 (1) 0,5 N 1 1,5 (2) Z
Từ (1) và (2) Z = 12 hoặc Z = 13 0,5
Z=12 : 1s22s22p63s2 M thuộc nhóm IIA loại
Z=13 : 1s22s22p63s23p1 M thuộc nhóm IIIA M là Al
Vị trí của M; ô thứ 13, chu kì 3, nhóm III 0,5 2. Dung dòch A goà m: Cu NO , H SO , HNO dö 0,25 1 3 2 4 3 2 điể 2 m A laø khí NO 2 0,25 A laø BaSO 3 4 0,25 0,25 A laø dung dòch chöù a ion phöù c CuNH 2+ 4 3 4
b. Các phương trình hóa học Trang 2 3Cu S 2 2HNO 6Cu 2 3 NO3 3H SO 10NO 8H O 2 2 4 2 2N O O 2NO 0,25 2 2 0,25 khoân m g a ø u maø n u a âu
H SO BaCl BaSO 2HCl 2 4 2 4 0,25
CuNO3 2NH 2H O Cu 2 3 2 OH 2NH NO 2 4 3 CuOH 4NH 0,25 2 3 CuNH3 2 2OH 4 3 HOOC - [CH2]4-COOC2H5 + 2NaOH 0t 1 điểm
NaOOC- [CH2]4-COONa + C2H5OH + H2O 0,25 (X1) (X2)
NaOOC- [CH2]4-COONa + H2SO4 → HOOC- [CH2]4-COOH + Na2SO4 0,25 (X1) (X3) nHOOC- [CH 0t
2]4-COOH + nH2N - [CH2]6 - NH2 (X3) (X4) [-NH- [CH 0,25
2]6 - NH-CO-[CH2]4-CO-]n + 2nH2O (nilon -6,6) 0 H SO đăc,t 2C 2 4 2H5OH + HOOC- [CH2]4-COOH (X2) (X3) 0,25
C2H5OOC- [CH2]4-COOC2H5 + 2H2O (X5)
Câu 2 (4 điểm) Đáp án Điểm 1.
Do sản phẩm cuối cùng khi cho hỗn hợp tác dụng với HNO3 đặc nóng có 1 điể 2- m
Fe3+, SO4 nên có thể coi hỗn hợp ban đầu là Fe và S. Gọi x và y là số mol
của Fe và S, số mol của NO2 là a Fe Fe+3 + 3e x x 3x 0,5 S S+6 + 6e y y 6y N+5 + e N+4 0,5 a a a A tác dụng với Ba(OH)2 Fe3+ + 3OH- Fe(OH)3 Ba2+ + SO 2- 4 BaSO4 0,5
Ta có hệ phương trình 56x + 32 y = 20,8 Giải ra x=0,2 107x + 233y = 91,3 y=0,3
Theo định luật bảo toàn electron 0,5
: 3x + 6y = a = 3.0,2 + 6.0,3 = 2,4
V = 2,4.22,4 = 53,76 (lít) Trang 3 2. Hoã n hôïp khí B goà m N vaø N O 2 2 988 .0,448 760 n = = 0,02mol B 22,4 .354,9 273 M B = 36 n = n = 0,01 mol N N O 0,25 2 2 Chaá t raé n D goà m MgNO , Al NO , coù theå coù NH NO 0,25 3 3 4 3 2 3 Khi nung D xaû y ra caù c phaû n öù ng sau o t 1
Mg(NO ) MgO + NO O 3 2 2 2 2 x x o t 3 2Al(NO ) Al O + 6NO O 3 3 2 3 2 2 2 y y 2 0 NH NO t N O 2 H O 0,25 4 3 2 2 Chaá t raé n E goà m MgO vaø Al O 2 3 Ñaë t soá mol cuû a Mg vaø Al laà n löôït laø x, y 24x + 27y = 2,16 Ta coù y 40x + 102 = 3,84 2 0,25 x = 0,045, y = 0, 4 0 Ñaë t a laø soá mol cuû a NH NO 4 3 +5 o N +10e N 2+ 2 Mg Mg + 2e 0,1 0,01 0,045 0,09 +5 +1 3+ Al Al + 3e 2N +8e 2N 0,04 0,12 0,08 0,02 +5 -3 N +8e N (NH NO ) 0,25 4 3 8a a 0,25 n n e nhöôø ng e nhaä n
0,09 + 0,12 = 0,1 + 0,08 + 8a 0,25 a = 0,00375 Trang 4
Al(NO ) = 8,52g; Mg(NO ) = 6,66g; NH NO = 0,3g 0,25 3 3 3 2 4 3 m = 15,48g D 0,045.24 %m .100% = 50% Mg 2,16 %m = 50% Al
Câu 3. (4 điểm) Đáp án Điểm 1.
Gọi 2 amin là A và B (với MA < MB) 0,5
Vì amin đơn chức , tăng giảm khối lượng => nHCl = 0,02 mol 0,5
Do đó, nA = nB = 0,01 mol => 0,01.MA + 0,01.MB = 0,76 => MA + MB = 76 0,5 0,76 M= =38 => 0,02
M =31 CH NH M =45 CH CH NH 0,5 A 3 2 B 3 2 2 2.
Số chỉ liên kết peptit trung bình=3,8:0,7=38:7=5,4286 0,5
X,Y đều có số liên kết peptit>=4 0,5
=>có 1 chất có 4 liên kết peptit (pentapeptit=>6 oxi)
tổng O=13=>chất còn lại có 7 oxi=>hexapeptit
x + y =0,7 và 5x + 6y = 3.8 x = 0,4 và y = 0,3 0,5
X : GlyaAla5-a (0,4 mol); Y : GlybAla6-b (0,3 mol)
0,4.(2a+3.(5-a))=0,3.(2b+3(6-b))=>6-0,4a=5,4-0,3b=>4a-3b=6=>a=3,b=2 0,5
=>m=(0,4.3+0,3.2).97+(0,4.2+0,3.4).111=396,6 Câu 4. ( 3 điểm) Đáp án Điểm
Đặt công thức của A là CaHb b b C H +(a + ) O a CO + H O a b 2 2 2 4 2 Dung dịch Ca(OH)
2 hấp thụ sản phẩm cháy của A là CO2 và H2O Cho dung dịch Ba(OH)
2 dư vào dung dịch thu được kết tủa tăng lên chứng tỏ
xảy ra phản ứng (1) và (2) 0,25 Trang 5 CO + Ca(OH) CaCO H O 1 2 2 3 2 x x x 2CO + Ca(OH) Ca HCO 2 2 2 3 2 0,5 2y y y CaHCO + Ba OH CaCO + BaCO + H O 3 3 3 3 2 2 2 y y y
Đặt số mol CaCO3 ở phản ứng (1) là x, số mol Ca(HCO3)2 ở phản ứng (2) là y
x y 0,15 Ta co ù1 00(x+y) +197y = 24,85 0,25 x = 0,1; y = 0,05 n = x + 2y = 0,2mol CO2 0,25 khoá i löôïng bình taê ng: m + m =11,32g H O CO 2 2 11,32-0,2.44 n = = 0,14 mol H O 2 18 0,2 x = = 10 0,02 2.0,14 y = = 14 0,02 0,25 CTPT cuû a A laø C H 10 14 2.10 2 14 4 2
Vì A không làm mất màu dung dịch Brom (cấu trúc thơm), không tác dụng với dung dịch KMnO 0,25
4/H2SO4 và monoclo hóa (ánh sáng) chỉ tạo một sản
phẩm duy nhất chứng tỏ A có một nhóm thế và có tính đối xứng cao nên cấu tạo của A là 0,25 2 Phản ứng Cơ chế phản ứng 0,25 0,25 Trang 6 3.
Nhóm ankyl định hướng thế vào các vị trí ortho- và para-. Tuy nhiên, do
nhóm t-butyl có kích thước lớn gây án ngữ không gian nên sản phẩm chính là sản phẩm para- 0,5 Câu 5. ( 4 điểm) Đáp án Điểm Theo giả thiết ta có n 0,66mol n 0,57mol O CO 2 2 0,25 BTKL m 7,92 g n 0,44mol H O H O 2 2 BTNT( ) O n mol n mol 0,25 O X 0,26 0,13 COO
Gọi công thức của ancol Z là ROH suy ra công thức chung của 4 este là R’(COOR)n ' R ' COOR + nNaOH R COO Na R n OH n n 0,25 n n 0,13mol ROH NaOH n NaOH d 0,18 u 0,25
ROH Na RO a N + 0,5H 2 0,25
BTKL suy ra khối lượng của ROH =5,85+0,065.2=5,98 gam
Từ đó ta có R+17=46 suy ra R=29 = C2H5 0,25 ' R COON ' a CaO nNaOH
RH nNa CO n 2 3 n 0,25
Theo phương trình và giả thiết ta có R’(COONa)n = R’Hn =0,09 mol 0,25
( NaOH còn dư và R’(COONa)n hết vì n<2 )
Gọi công thức của este đơn chức là CnHm+1COOC2H5 (y mol) Suy ra 3 este hai chức là C
nHm(COOC2H5)2 (x mol) (vì muối tạo ra khi phản
ứng với NaOH đun nóng chỉ tạo một hiđrocacbon duy nhất) 0,25
Tổng số mol este là x+y=0,09 (1)
Tổng số nhóm COO là 2x+y =0,13 (2) Suy ra x=0,04 ; y=0,05 0,25
Số nguyên tử cacbon: C = 0,04(n+6) + 0,05(n+3) = 0,57 suy ra n=2
Số nguyên tử H : H =0,04(m+10) +0,05(m+6)=0,88 suy ra m=2 0,25
Vậy công thức của este đơn chức là C5H8O2, cấu tạo là 0,25 CH 2=CH-COOCH2-CH3
Công thức phân tử của 3 este hai chức là C 0,25 8H12O4 Công thức cấu tạo 0,25 CH2=CH (COOC2H5)2 Trang 7 0,25 0,25 0,25 Trang 8




