
Preview text:
Mở đầu trang 27 Bài 4 KHTN 8: Nếu yêu cầu đếm số lượng viên gạch
để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây
bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được? Vì sao?
Với những vật thể có kích thước và khối lượng đáng kể như viên gạch,
quả táo,…, người ta dễ dàng xác định số lượng, khối lượng và thể tích của
chúng bằng cách đếm, cân, đo,… Nhưng với những hạt có kích thước vô
cùng nhỏ bé như nguyên tử, phân tử rất khó có thể cân và đếm được chúng.
Vậy làm thế nào để có thể xác định một cách thuận lợi số nguyên tử, phân
tử và khối lượng, thể tích của chúng khi tham gia và tạo thành trong các phản ứng hóa học? Trả lời:
- Yêu cầu đếm số lượng viên gạch có thể thực hiện được do viên gạch có
kích thước cụ thể và đáng kể, có thể dễ dàng xác định được số lượng.
- Để xác định một cách thuận lợi số nguyên tử, phân tử và khối lượng, thể
tích của chúng khi tham gia và tạo thành trong các phản ứng hoá học ta dùng khái niệm mol. I. Khái niệm mol
Câu hỏi 1 trang 27 KHTN 8: Xác định số nguyên tử có trong:
a) 2 mol nguyên tử nhôm (aluminium).
b) 1,5 mol nguyên tử carbon. Trả lời:
Áp dụng: Mol là lượng chất có chứa 6,022 × 1023 hạt vi mô (nguyên tử,
phân tử, …) của chất đó.
a) Số nguyên tử có trong 2 mol nguyên tử nhôm (aluminium):
2 × 6,022 × 1023 = 1,2044 × 1024 (nguyên tử).
b) Số nguyên tử có trong 1,5 mol nguyên tử carbon:
1,5 × 6,022 × 1023 = 9,033 × 1023 (nguyên tử).
Luyện tập 1 trang 28 KHTN 8: Tính số phân tử nước và số nguyên tử
của mỗi nguyên tố có trong 3 mol phân tử nước. Trả lời:
- 3 mol phân tử nước chứa số phân tử nước là:
3 × 6,022 × 1023 = 1,8066 × 1024 (phân tử).
- Cứ 1 phân tử nước chứa 2 nguyên tử hydrogen và 1 nguyên tử oxygen.
Vậy 3 mol phân tử nước chứa:
+ Số nguyên tử hydrogen là: 2 × 1,8066 × 1024 = 3,6132 × 1024 (nguyên tử).
+ Số nguyên tử oxygen là: 1 × 1,8066 × 1024 = 1,8066 × 1024 (nguyên tử).
II. Khối lượng mol
Câu hỏi 2 trang 28 KHTN 8: Quan sát hình 4.3, cho biết khối lượng 1
mol nguyên tử đồng và khối lượng 1 mol phân tử sodium chloride. Trả lời:
- Khối lượng của 1 mol nguyên tử đồng là 64 gam.
- Khối lượng 1 mol phân tử sodium chloride là 58,5 gam.
Câu hỏi 3 trang 28 KHTN 8: Dựa vào bảng tuần hoàn các nguyên tố hóa
học, cho biết khối lượng mol nguyên tử hydrogen, nitơ (nitrogen) và magnesium. Trả lời:
Dựa vào bảng tuần hoàn:
- Khối lượng mol nguyên tử hydrogen là: 1,008 gam/ mol.
- Khối lượng mol nguyên tử nitơ (nitrogen) là: 14,01 gam/ mol.
- Khối lượng mol nguyên tử magnesium là: 24,31 gam/ mol.
Luyện tập 2 trang 28 KHTN 8: Tính khối lượng mol phân tử khí oxygen và khí carbon dioxide. Trả lời:
Áp dụng: Khối lượng mol phân tử của một chất có cùng trị số với khối
lượng phân tử chất đó tính theo đơn vị amu. Vậy:
Khối lượng mol phân tử khí oxygen là: 16 × 2 = 32 (gam/ mol).
Khối lượng mol phân tử khí carbon dioxide là: 12 + 16 × 2 = 44 (gam/ mol).
Tìm hiểu thêm trang 28 KHTN 8: Giải thích vì sao khối lượng mol
nguyên tử hay phân tử của một chất có cùng trị số với khối lượng nguyên
tử hay phân tử chất đó tính theo đơn vị amu. Trả lời:
Ta có: 1 amu = 1,6605 × 10-24 gam.
Với một nguyên tử/ phân tử có khối lượng là M (amu), ta có khối lượng
mol nguyên tử/ phân tử đó là: M × 1,6605 × 10-24 × 6,022 × 1023 ≈ M (gam/ mol).
Vậy ta có điều cần chứng minh.
III. Chuyển đổi giữa số mol chất và khối lượng Giải KHTN 8 trang 29
Luyện tập 3 trang 29 KHTN 8: Hoàn thành những thông tin còn thiếu trong bảng sau:
Số mol Khối lượng mol (M) Khối lượng Chất Cách tính
(n) (mol) (g/mol) (m) (gam) mAl = 0,2 × 27 = Nhôm 0,2 27 5,4 5,4 (gam) Nước 2 ? ? ? Khí oxygen ? ? 16 ? Khí nitơ ? ? 28 ? Sodium 0,4 ? ? ? chloride Magnesium ? ? 12 ? Trả lời: Áp dụng công thức: Khối lượng Số mol Khối lượng Chất mol (M) Cách tính (n) (mol) (m) (gam) (g/mol) Nhôm 0,2 27 5,4 mAl = 0,2 × 27 = 5,4 (gam) MH2O=1×2+16=18(g/mol) Nước 2 18 36 mH2O=2×18=36(gam) MO2=2×16=32(g/mol) Khí oxygen 0,5 32 16 Khí nitơ 1 28 28 MN2=2×14=28(g/mol) MNaCl = 23 + 35,5 = 58,5 Sodium (g/mol) 0,4 58,5 23,4 chloride mNaCl = 0,4 × 58,5 = 23,4 (gam) MMg = 24 (gam/ mol) Magnesium 0,5 24 12
IV. Thể tích mol của chất khí
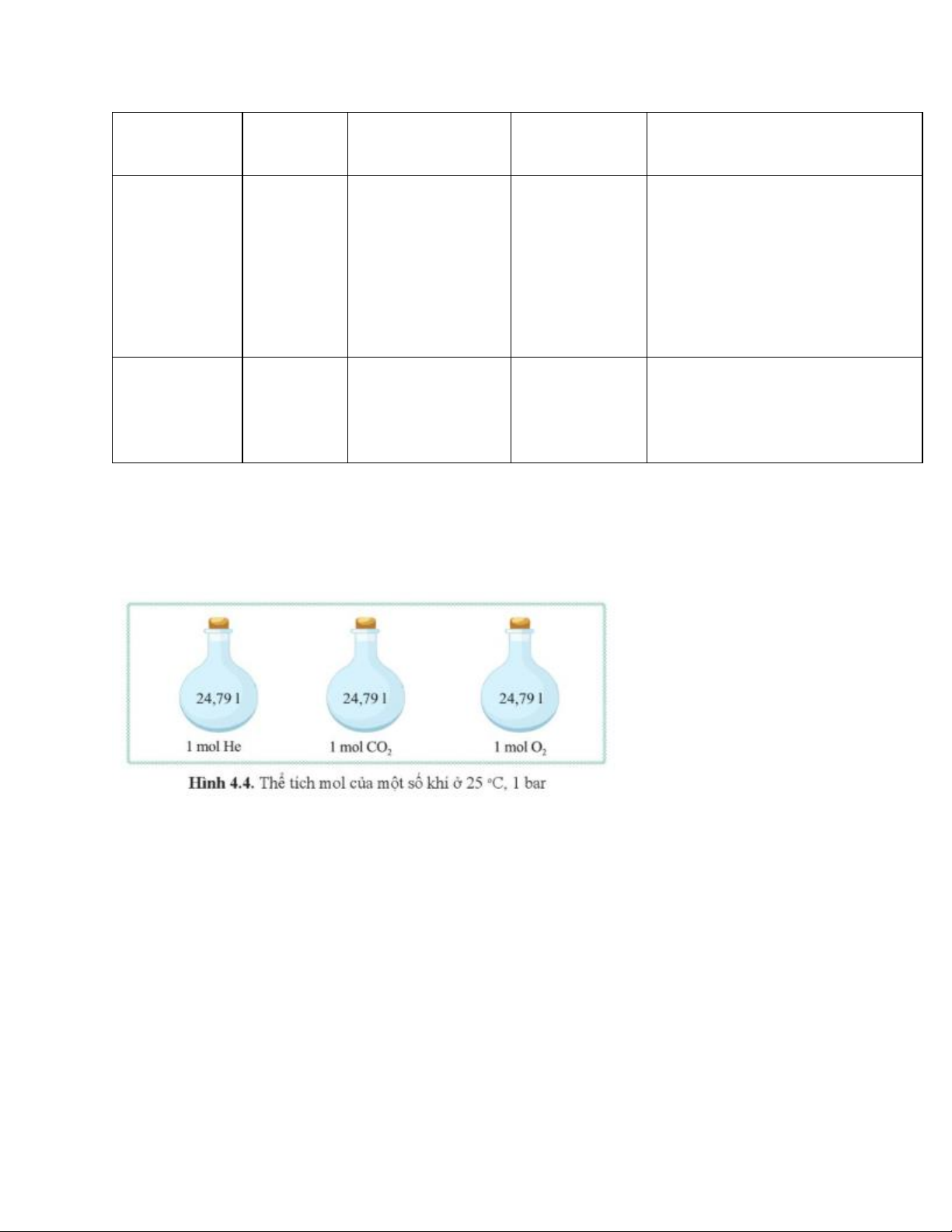
Câu hỏi 4 trang 29 KHTN 8: Quan sát hình 4.4, cho biết ở điều kiện
chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là bao nhiêu? Trả lời:
Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25 oC), thể tích 1 mol khí là 24,79 lít.
V. Chuyển đổi giữa lượng chất và thể tích chất khí
Luyện tập 4 trang 30 KHTN 8: Hoàn thành những thông tin còn thiếu trong bảng sau:
Các đại lượng đơn vị Chất M (g/mol) n (mol) m (g) V (l) (đktc) CO2 ? ? 17,6 ? N2 ? ? ? 4,958 H2 ? 0,5 ? ? Trả lời: Áp dụng các công thức:
Các đại lượng đơn vị Chất M (g/mol) n (mol) m (g) V (l) (đktc) CO2 44 0,4 17,6 9,916 N2 28 0,3 5,6 4,958 H2 2 0,5 1 12,395
VI. Tỉ khối của chất khí
Câu hỏi 5 trang 30 KHTN 8: Nếu không dùng cân, làm thế nào có thể
biết được 24,79 lít khí N2 nặng hơn 24,79 lít khí H2 bao nhiêu lần (ở cùng
điều kiện nhiệt độ, áp suất)? Trả lời:
Để so sánh khí N2 nặng hơn khí H2 bao nhiêu lần (ở cùng điều kiện nhiệt
độ, áp suất) mà không dùng cân người ta so sánh khối lượng mol của hai khí đó. Cụ thể:
. Vậy ở điều kiện chuẩn khí N2 nặng hơn khí H2 là 14 lần.
Câu hỏi 6 trang 30 KHTN 8: Làm thế nào để biết khí A nặng hay nhẹ hơn khí B? Trả lời:
Để so sánh khí A nặng hay nhẹ hơn khí B, người ta so sánh khối lượng
của cùng một thể tích khí A và khí B trong dùng điều kiện nhiệt độ và áp suất.
Luyện tập 5 trang 31 KHTN 8: Có ba quả bóng bay giống nhau về kích
thước và khối lượng. Lần lượt bơm cùng thể tích mỗi khí H2, CO2, O2 vào
từng quả bóng bay trên. Điều gì sẽ xảy ra khi thả ba quả bóng bay đó trong không khí? Trả lời:
Khi thả ba quả bóng bay vào không khí chỉ có quả bóng bay chứa khí H2 là
bay được lên, còn quả bóng chứa khí O2 và quả bóng chứa khí CO2 đều
rơi xuống mặt đất. Do khí H2 nhẹ hơn không khí còn khí O2 và khí CO2đều nặng hơn không khí.