



Preview text:
Ôn tập chủ đề 1
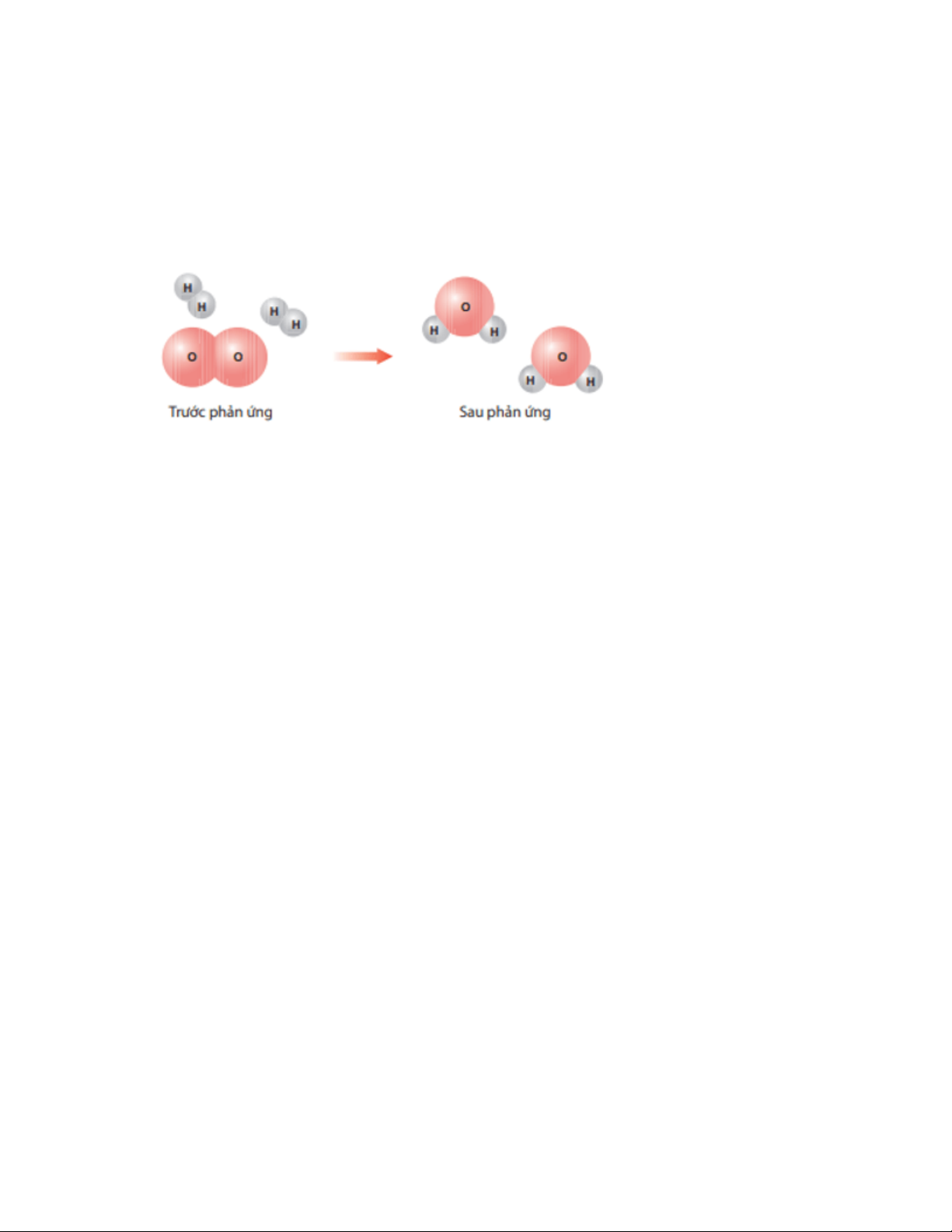
Bài 1 trang 44 Khoa học tự nhiên 8: Hình dưới đây là sơ đồ minh hoạ phản ứng giữa
các phân tử hydrogen (H2) và oxygen (O2) tạo ra nước (H2O).
a) Trong quá trình phản ứng, các liên kết trong phân tử các chất tham gia thay đổi như thế nào?
b) Phân tử nào được sinh ra sau phản ứng?
c) Nhận xét số lượng các nguyên tử trước và sau phản ứng. Trả lời:
a) Trước phản ứng O liên kết với O; H liên kết với H. Sau phản ứng O liên kết với H.
b) Phân tử được sinh ra sau phản ứng là nước (H2O).
c) Số lượng các nguyên tử trước và sau phản ứng là không thay đổi.
Bài 2 trang 44 Khoa học tự nhiên 8: Một học sinh làm thí nghiệm như sau:
Chuẩn bị: 1 quả trứng gà (hay trứng vịt), 1 cốc thuỷ tinh, lọ giấm ăn (dung dịch acetic acid 2 – 5%).
Tiến hành thí nghiệm: Cho quả trứng vào cốc, rót từ từ giấm vào cốc cho đến khi ngập
hẳn quả trứng, thấy sủi bọt khí trên bề mặt lớp vỏ trứng. Biết rằng acetic acid đã tác dụng
với calcium carbonate (thành phần của vỏ trứng) tạo ra calcium acetate, nước và khí carbon dioxide.
a) Hãy chỉ ra dấu hiệu để nhận biết có phản ứng xảy ra.
b) Xác định chất tham gia và sản phẩm tạo thành của thí nghiệm trên. Trả lời:
a) Dấu hiệu để nhận biết có phản ứng xảy ra: sủi bọt khí trên bề mặt lớp vỏ trứng.
b) Chất tham gia: acetic acid; calcium carbonate (thành phần của vỏ trứng).
Sản phẩm tạo thành: calcium acetate, nước và khí carbon dioxide.
Bài 3 trang 44 Khoa học tự nhiên 8: Một bạn học sinh tiến hành thí nghiệm sau:
Cho đinh sắt (Fe) tác dụng với dung dịch hydrochloric acid (HCl) trong ống nghiệm. Sau
khi phản ứng kết thúc, bạn đem cân ống nghiệm chứa đinh sắt và dung dịch thì thấy khối
lượng nhỏ hơn tổng khối lượng của đinh sắt và dung dịch trước khi phản ứng. Theo em,
điều này có phù hợp với định luật bảo toàn khối lượng hay không. Vì sao? Trả lời:
Theo em điều này có phù hợp với định luật bảo toàn khối lượng.
Theo định luật bảo toàn khối lượng: mchất tham gia = mchất sản phẩm
Hay m đinh sắt + mdd trước = mđinh sắt + mdd sau + mkhí hydrogen
⇒ mđinh sắt + mdd sau = m đinh sắt + mdd trước - mkhí hydrogen
Hay (mđinh sắt + mdd sau) < (m đinh sắt + mdd trước).
Bài 4 trang 45 Khoa học tự nhiên 8: Isoamyl acetate (C7H14O2) là hợp chất tạo mùi
thơm của quả chuối chín. Điều thú vị là ong có thể tiết ra khoảng 1 μg (bằng 1 × 10-6
gam) hợp chất này khi chúng đốt các sinh vật. Mùi hương sẽ thu hút những con ong khác
tham gia cuộc tấn công. Hãy xác định trong vết ong đốt:
a) có bao nhiêu phân tử isoamyl acetate được giải phóng?
b) có bao nhiêu nguyên tử carbon? Trả lời:
Số mol isoamyl acetate (C7H14O2) có trong 1 μg (bằng 1 × 10-6 gam) là: Trong một vết ong đốt:
a) Số phân tử isoamyl acetate được giải phóng là:
7,69 × 10-9 × 6,022 × 1023 = 4,63 × 1015 (phân tử).
b) Số nguyên tử carbon là: 7 × 4,63 × 1015 = 3,241 × 1016 (nguyên tử).
Bài 5 trang 45 Khoa học tự nhiên 8: Để điều chế khí oxygen trong phòng thí nghiệm,
người ta nung 4,9 gam potassium chlorate (KClO3) có xúc tác MnO2, thu được 2,5 gam
potassium chloride (KCl) và một lượng khí oxygen.
a) Lập phương trình hoá học xảy ra của thí nghiệm trên.
b) Phản ứng trên có xảy ra hoàn toàn không? Tính hiệu suất phản ứng. Trả lời:
a) Lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố:
+ Ta làm chẵn số nguyên tử O ở vế trái bằng cách thêm hệ số 2 trước KClO3:
+ Để số nguyên tử O vế phải bằng với vế trái ta thêm hệ số 3 trước O2:
+ Để số nguyên tử K và số nguyên tử Cl ở 2 vế bằng nhau ta thêm hệ số 2 trước KCl:
Bước 3: Phương trình hóa học hoàn chỉnh:
b) Phương trình hoá học:
Tỉ lệ các chất: 2 : 2 : 3 Số mol KClO3 đem nung là:
Theo tỉ lệ trong phương trình hoá học ta có:
nKCl lý thuyết = nKClO3 = 0,04(mol);
⇒ mKCl lý thuyết = 0,04 × 74,5 = 2,98 (gam).
Có khối lượng KCl lý thuyết lớn hơn khối lượng KCl thu được thực tế nên phản ứng xảy ra không hoàn toàn.
Hiệu suất của phản ứng là:
Bài 6 trang 45 Khoa học tự nhiên 8: Cho 2 gam hạt kẽm vào một cốc đựng dung dịch
H2SO4 2M (dư) ở nhiệt độ phòng. Nếu giữ nguyên các điều kiện khác, chỉ tác động vào
một trong các điều kiện sau đây thì tốc độ phản ứng biến đổi như thế nào (tăng lên, giảm
xuống hay không đổi)? Giải thích.
a) Thay 2 gam hạt kẽm bằng 2 gam bột kẽm.
b) Thay dung dịch H2SO4 2,0 M bằng dung dịch H2SO4 1,0 M.
c) Thực hiện phản ứng ở 60oC.
d) Dùng thể tích dung dịch H2SO4 2,0 M lên gấp đôi ban đầu. Trả lời:
a) Thay 2 gam hạt kẽm bằng 2 gam bột kẽm tốc độ phản ứng tăng do tăng diện tích tiếp
xúc giữa các chất tham gia.
b) Thay dung dịch H2SO4 2,0 M bằng dung dịch H2SO4 1,0 M tốc độ phản ứng giảm do
giảm nồng độ của chất tham gia.
c) Thực hiện phản ứng ở 60oC tốc độ phản ứng tăng do tăng nhiệt độ.
d) Dùng thể tích dung dịch H2SO4 2,0 M lên gấp đôi ban đầu tốc độ phản ứng không thay đổi.



