





Preview text:
Bài 15: Tính chất chung của kim loại
I. Tính chất vật lí của kim loại II. Tính chất hóa học
III. Sự khác biệt về tính chất của một số kim loại
Mở đầu trang 77 Bài 15 KHTN 9: Kim loại có vai trò quan trọng trong lịch sử phát
triển của nhân loại. Từ khi được phát hiện, kim loại đã được khai thác và ứng dụng
trong mọi mặt của cuộc sống.
Hãy quan sát và tìm hiểu tính chất của một số vật dụng được làm từ vật liệu kim loại xung quanh em. Trả lời:
Xung quanh em có rất nhiều vật dụng được làm từ vật liệu kim loại. Ví dụ:
+ Con dao, cái liềm, cái kéo …. làm từ kim loại sắt.
+ Móc quần áo, cái nồi, hộp đựng thức ăn … làm từ kim loại nhôm.
+ Vòng tay, vòng cổ, nhẫn … được làm từ kim loại bạc và kim loại vàng …
Các kim loại khác nhau nhưng đều có một số tính chất vật lí chung như: tính dẻo,
tính dẫn điện, dẫn nhiệt, tính ánh kim …
Ngoài ra, một số kim loại còn có các tính chất hoá học như: tác dụng với oxygen, tác
dụng với phi kim khác, tác dụng với acid, tác dụng với muối …
I. Tính chất vật lí của kim loại
Câu hỏi 1 trang 77 KHTN 9: Các vật dụng trong hình 15.1 được chế tạo dựa trên
tính chất vật lí nào của kim loại? Trả lời:
Các vật dụng trong hình 15.1 được chế tạo dựa trên tính dẻo của kim loại.
Cụ thể: Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. Dựa
trên tính chất này, kim loại được dùng để tạo nên các đồ vật khác nhau như hộp
đựng thức ăn bằng nhôm, giấy nhôm bọc thực phẩm, dây đồng, …
Câu hỏi 2 trang 78 KHTN 9: Quan sát hình 15.2 nêu hiện tượng trước và sau khi
chạm hai đầu dây dẫn A và B vào mẩu kim loại. Giải thích. Trả lời: Hiện tượng:
- Trước khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn không sáng.
- Sau khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn sáng.
Giải thích: Do kim loại có tính dẫn điện.
Luyện tập 1 trang 78 KHTN 9: Dự đoán khả năng dẫn nhiệt của các kim loại Cu, Al,
Fe và Ag theo chiều giảm dần. Trả lời:
Kim loại dẫn điện tốt thường cũng dẫn nhiệt tốt.
Khả năng dẫn điện của các kim loại giảm dần theo thứ tự: Ag, Cu, Al, Fe.
Dự đoán khả năng dẫn nhiệt của các kim loại cũng giảm dần theo thứ tự: Ag, Cu, Al, Fe.
Câu hỏi 3 trang 79 KHTN 9: Quan sát đồ trang sức được làm bằng vàng, bạc (hình
15.5), em hãy cho biết màu sắc và vẻ sáng của chúng Trả lời:
Vòng tay được làm bằng vàng có màu vàng, trên bề mặt có vẻ sáng lấp lánh.
Vòng tay được làm bằng bạc có màu trắng, trên bền mặt có vẻ sáng lấp lánh.
II. Tính chất hóa học
Câu hỏi 4 trang 80 KHTN 9: Viết các phương trình hóa học minh hoạ một số tính
chất hoá học của kim loại mà em đã biết. Trả lời:
Một số tính chất hoá học của kim loại mà em đã biết:
- Nhiều kim loại tác dụng với oxygen tạo thành oxide. Ví dụ: 3Fe + 2O2 Fe3O4
- Nhiều kim loại tác dụng với phi kim tạo thành muối. Ví dụ: 2Fe + 3Cl2 2FeCl3
- Nhiều kim loại tác dụng với acid (HCl, H2SO4 loãng …) tạo thành muối và giải
phóng khí hydrogen. Ví dụ: Fe + 2HCl → FeCl2 + H2
- Một số kim loại đẩy được kim loại đứng sau ra khỏi muối. Ví dụ: Fe + CuSO4→ FeSO4 + Cu
- Một số kim loại tác dụng được với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen. Ví dụ: 2Na + 2H2O → 2NaOH + H2
Câu hỏi 5 trang 80 KHTN 9: Quan sát hình 15.6 và cho biết khả năng phản ứng của
natri với khí chlorine (b) như thế nào. Trả lời:
Natri (sodium) nóng chảy phản ứng mãnh liệt với khí chlorine để tạo thành muối. 2Na + Cl2 2NaCl
Luyện tập 2 trang 80 KHTN 9: Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may
nhiệt kế thủy ngân bị vỡ thì có thể dùng bột lưu huỳnh rắc lên thuỷ ngân vì thuỷ
ngân tác dụng với lưu huỳnh tạo thành chất mới không bay hơi và dễ thu gom hơn.
Viết phương trình hoá học của phản ứng xảy ra. Trả lời: Phương trình hoá học: Hg + S → HgS
Câu hỏi 6 trang 81 KHTN 9: Quan sát hình 15.7, cho biết trước, trong và sau một
thời gian phản ứng, màu của dung dịch CuSO4 và đinh sắt thay đổi như thế nào. Giải thích. Trả lời: Trước Trong phản ứng Sau phản ứng phản ứng
Dung dịch Màu xanh Màu xanh nhạt dần Màu xanh nhạt CuSO4 Đinh sắt
Màu xám Có lớp kim loại màu đỏ Có lớp kim loại màu đỏ bám trắng
bám dần vào bề mặt ngoài bề mặt đinh sắt (phần đinh sắt nhúng vào dung dịch)
Giải thích: Fe tác dụng với dung dịch CuSO4 tạo thành muối FeSO4 (làm dung dịch
nhạt màu so với ban đầu) và Cu (bám ngoài đinh sắt). Fe + CuSO4 → FeSO4 + Cu
Luyện tập 3 trang 81 KHTN 9: Viết phương trình hoá học của phản ứng xảy ra khi
cho Zn tác dụng với O2, dung dịch H2SO4 loãng và dung dịch muối CuSO4 Trả lời: Phương trình hoá học: 2Zn + O2 → 2ZnO
Zn + H2SO4loãng → ZnSO4 + H2 Zn + CuSO4 → ZnSO4 + Cu
Luyện tập 4 trang 81 KHTN 9: Giải thích vì sao thực phẩm có vị chua không nên
đựng trong đồ dùng bằng kim loại mà nên đựng trong đồ dùng bằng thuỷ tinh, sành hoặc sứ. Trả lời:
Vị chua của thực phẩm thường được gây ra bởi các acid. Không nên đựng thực
phẩm có vị chua trong đồ dùng bằng kim loại do acid trong thực phẩm có thể tác
dụng với kim loại trong vật đựng làm thực phẩm nhiễm độc kim loại, ảnh hưởng đến
sức khoẻ người sử dụng.
III. Sự khác biệt về tính chất của một số kim loại
Câu hỏi 7 trang 82 KHTN 9: So sánh sự khác biệt về tính chất vật lí, tính chất hoá
học và một số ứng dụng quan trọng của nhôm, sắt, vàng. Trả lời:
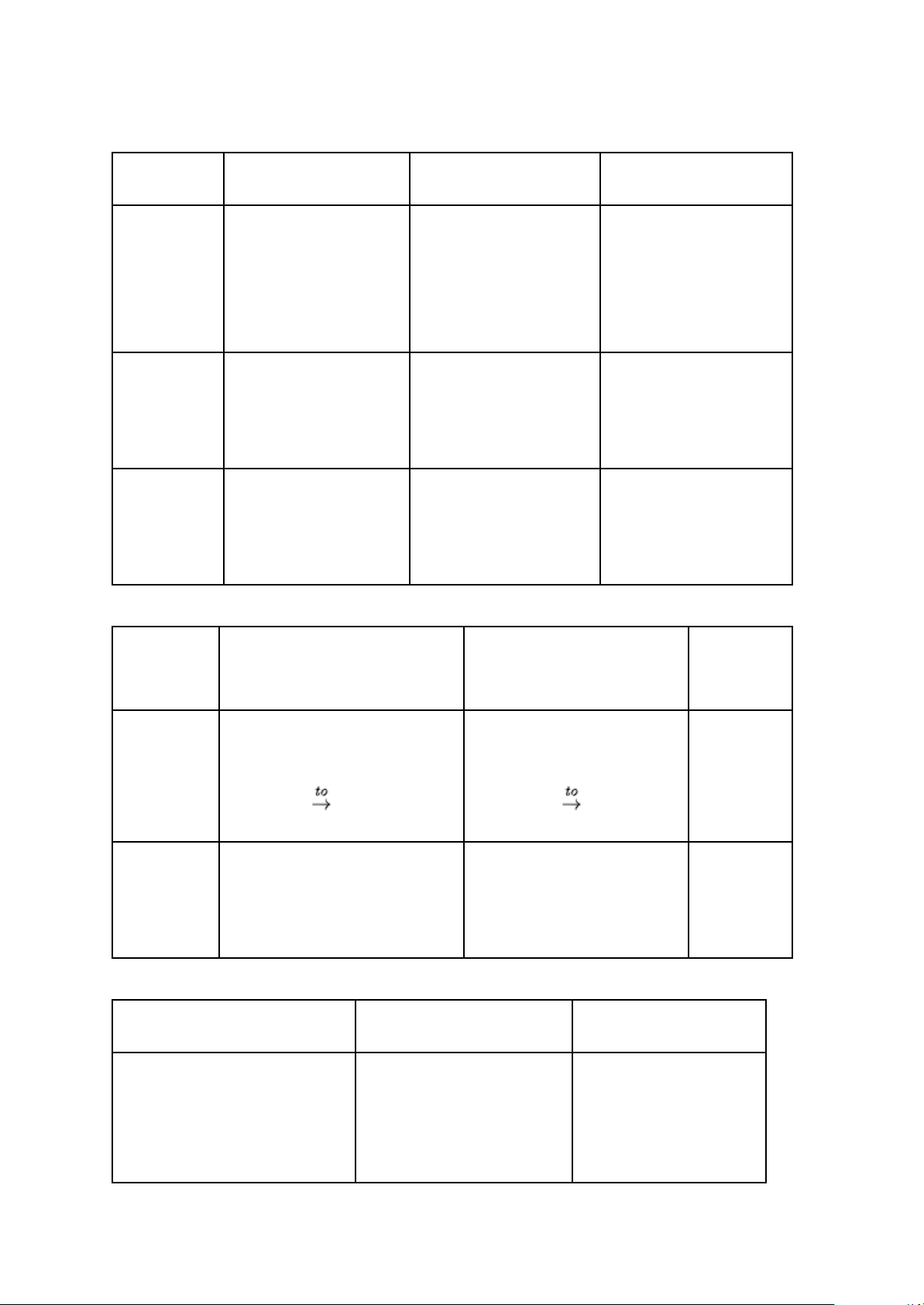
- Khác biệt trong tính chất vật lí: Kim loại Al Kim loại Fe Kim loại Au Tính
chất - Là kim loại có màu - Có màu trắng hơi - Là kim loại có tính vật
lí trắng bạc, khá mềm, xám, có tính dẻo, có dẻo, tính dẫn điện, chung
dẫn nhiệt, dẫn điện độ cứng cao và có dẫn nhiệt tốt, có màu tốt và nhẹ. tính nhiễm từ. vàng lấp lánh. Khối lượng 2,70 7,87 19,29 riêng (g/cm3) Nhiệt độ 660 1 535 1 065 nóng chảy (oC)
- Khác biệt trong tính chất hoá học: Kim loại Al Kim loại Fe Kim loại Au
Tác dụng Phản ứng tạo thành oxide Phản ứng tạo thành oxide Không với O2
kim loại (oxide lưỡng tính). kim loại (oxide base). phản ứng 4Al + 3O2 2Al2O3 3Fe + 2O2 Fe3O4
Tác dụng Phản ứng tạo thành muối và Phản ứng tạo thành muối Không với HCl giải phóng H2. và giải phóng H2. phản ứng 2Al + 6HCl → 2AlCl3 + 3H2 Fe + 2HCl → FeCl2 + H2 - Ứng dụng quan trọng: Kim loại Al Kim loại Fe Kim loại Au
Nhôm thường được sử Sắt có nhiều ứng dụng Vàng được sử dụng
dụng làm dây dẫn điện và là trong đời sống và sản làm đồ trang sức, một
nguyên liệu để sản xuất các
vật dụng như khung cửa, xuất, là thành phần chủ số chi tiết của vi mạch vách ngăn, khung máy, …
yếu trong gang và thép. điện tử,..
Tìm hiểu thêm trang 82 KHTN 9: Vào khoảng thiên niên kỉ thứ IV trước Công
nguyên, người nguyên thuỷ đã phát hiện ra một loại vật liệu mới để chế tạo công cụ
và vũ khí thay thế cho đồ đá, đó là đồng.
Em hãy tìm hiểu quá trình con người phát hiện ra đồng. Trả lời:
Học sinh tham khảo thông tin sau:
- Khu vực và thời gian phát minh ra đồng vẫn còn là chủ đề tranh cãi. Điều kiện cần
thiết để người xưa phát hiện ra đồng là các mỏ đồng lộ thiên có hàm lượng đủ cao
(có thể có kèm đồng nguyên sinh) nằm ở sườn hoặc hang núi thuận lợi cho trú ẩn.
Người nguyên thủy đã cư trú ở đó, lấy các cây gỗ đốt lửa sưởi, tạo ra nhiệt độ cao
làm than củi khử đồng khỏi quặng. Lúc đầu họ có thể sợ hãi thứ "đá lạ" đọng lại ở
nền hang, nhưng rồi qua vài thế hệ sau người ta thấy "đá lạ" đó không đáng sợ mà
còn dùng rất tốt cho chế tác công cụ.
- Khoảng 3500 năm TCN, cư dân Tây Á và Ai cập đã biết sử dụng đồng đỏ để chế tác công cụ lao động.
- Khoảng 2000 năm TCN, cư dân ở nhiều khu vực trên thế giới đã biết sử dụng đồng thau.




