
























Preview text:
Bài 8 – ACID NỘI DUNG BÀI HỌC Mở đầu
Tìm hiểu về khái niệm acid
Tìm hiểu về tính chất hóa học của acid
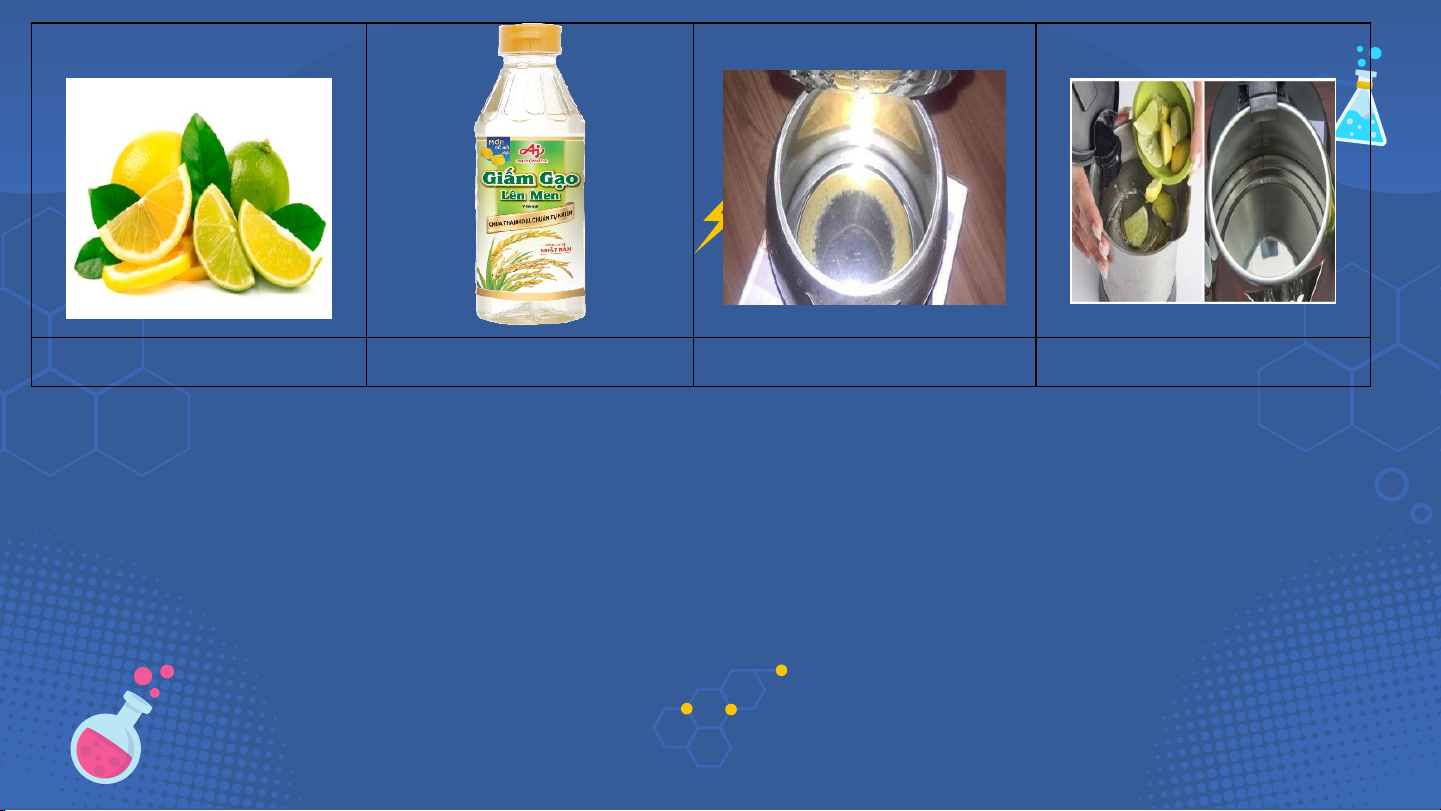
Tìm hiểu về một số acid thông dụng Luyện tập Vận dụng KHỞI ĐỘNG Hình 1 Hình 2 Hình 3 Hình 4
Tại sao nước quả chanh, giấm ăn (như giấm gạo) …
đều có vị chua và được dùng để loại bỏ cặn trong dụng cụ đun nước? Phiếu học tập số 1
1. Tại sao nước quả chanh, giấm ăn
2. Tại sao nước quả chanh, giấm ăn
(như giấm gạo) … đều có vị chua?
(như giấm gạo) được dùng để loại
bỏ cặn trong dụng cụ đun nước?
Hãy đánh dấu X vào ô vuông để nêu rõ Hãy đánh dấu X vào ô vuông để nêu
nhận định của em về câu hỏi 1:
rõ nhận định của em về câu hỏi 2: - Em chưa biết - Em chưa biết - Em đã biết - Em đã biết
Nếu em đã biết, hãy giải thích câu hỏi 1? Nếu em đã biết, hãy giải thích câu hỏi 2?
Để giải thích được các câu hỏi đó, chúng ta cùng
tìm hiểu về loại hợp chất Acid, nội dung thứ nhất
là khái niệm về acid. 01. khái niệm acid H+ S Cl- 𝑵𝑶− H+ 𝟑 H+ H+ Hydroch loric acid - HCl Sulfuric acid – H SO Nitric acid – HNO 2 4 3
Các acid tan trong nước tạo ra các ion.
QS hình và b8.1, thảo luận nhóm các yêu cầu vào bảng nhóm:
1. Công thức hóa học của các acid có đặc điểm gì giống nhau?
2. Dạng tồn tại của các acid trong dung dịch có đặc điểm gì chung?
3. Đề xuất khái niệm acid. H+ S Cl- 𝑵𝑶− H+ 𝟑 H+ H+ Hydrochlo
ric acid - HCl Sulfuric acid – H SO Nitric acid – HNO 2 4 3
Các acid tan trong nước tạo ra các ion.
1. Công thức hóa học của các acid có đặc điểm giống nhau: trong phân
tử đều có nguyên tử H liên kết với gốc acid.
2. Dạng tồn tại của các acid trong dung dịch có đặc điểm chung: đều chứa cation H+ và anion.
3. Đề xuất khái niệm acid: Acid là những hợp chất mà phân tử đều có
nguyên tử H liên kết với gốc acid, khi các acid tan trong tạo ra ion H+.
Kết luận: Acid là những hợp chất mà phân tử đều
có nguyên tử H liên kết với gốc acid, khi các acid tan trong tạo ra ion H+. Tên gọi của acid - Acid chứa oxygen Tính chất hóa 02 học của acid .
HS nộp lại các phiếu học tập, giao nhiệm vụ cho
HS hệ thống các kiến thức đã thực hiện các nhiệm
vụ ở phiếu học tập và rút ra kết luận về tính chất
hóa học của acid bằng sơ đồ tư duy ở nhà, nộp lại
và trình bày vào tiết sau
kết luận: Dung dịch acid làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và khí hydrogen.
kết luận: Dung dịch acid làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và khí hydrogen.
kết luận: Dung dịch acid làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và khí hydrogen. Một số acid 03 thông dụng .
Chia HS thành 4 nhóm (4-6 HS), mời đại diện các nhóm lên
bốc thăm 1 nội dung trong 4 nội dung:
1. Hãy tìm hiểu nhu cầu sử dụng và ứng dụng của sulfuric acid.
2. Hãy tìm hiểu nhu cầu sử dụng và ứng dụng của hydrochloric acid.
3. Hãy tìm hiểu nhu cầu sử dụng và ứng dụng của acetic acid.
4. Việc sử dụng acid không đúng cách sẽ gây ô nhiễm môi
trường đất, nước, không khí. Em hãy tìm hiểu về các tác hại này.
HS tìm hiểu thông tin để trình bày 4 nội dung trên,
trình bày bằng bài trình chiếu powerpoint hoặc
trên bảng nhóm (giấy roki). LUYỆN TẬP 04.
HS nộp lại các phiếu học tập, giao nhiệm vụ cho
HS hệ thống các kiến thức đã thực hiện các nhiệm
vụ ở phiếu học tập và rút ra kết luận về tính chất
hóa học của acid bằng sơ đồ tư duy ở nhà, nộp lại
và trình bày vào tiết sau Câu 1:
Dãy chất gồm công thức hóa học của acid là: Ca(OH) , KOH, Ba(OH) , 2 2 A. B. CaCO , HCl. Cu(OH) . 3 2 H SO , HNO , CaCO , C. 2 4 3 3 D. HCl. ZnO, SO .2 Đáp án: C
Câu 2: Khi nhỏ dung dịch H SO vào giấy quỳ 2 4
tím thì giấy quỳ tím sẽ: A. Hóa đỏ B. Hóa xanh Không C. Hóa đen D. đổi màu Đáp án: A
Câu 3: Dãy gồm các kim loại phản ứng được với dung dịch HCl là: A. Cu, Mg, Na. B. Fe, Zn, Mg. Fe, Cu, C. Al, Fe, Ag. D. Ba Đáp án: B
Câu 4: 13 gam một kim loại hóa trị II phản ứng vừa
đủ với 200 ml dd H SO 1M. Kim loại đó là? 2 4 A. Zn B. Ca C. Fe D. Mg Đáp án: A
Câu 5: Acid nào là hóa chất tiêu thụ nhiều nhất trên thế giới? A. Hydrochloric acid B. Acetic acid C. Sulfuric acid D. Citric acid Đáp án: C
Câu 6: Hydrochloric acid, acetic acid, sulfuric acid
đều có tính chất chung nào sau đây?
A. Đều là chất khí không màu, đều làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và H .2
B. Đều là chất lỏng không màu, đều làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và H .2
C. Đều là chất lỏng không màu, đều làm quỳ tím hóa xanh, tác
dụng với một số kim loại tạo muối và H .2
D. Đều là chất khí không màu, đều làm quỳ tím hóa xanh, tác
dụng với một số kim loại tạo muối và H .2 Đáp án: B
Câu 7: Acid nào có trong dạ dày của người? A. Hydrochloric acid B. Acetic acid C. Sulfuric acid D. Maleic acid Đáp án: A
Câu 8: Trong giấm ăn có chứa acetic acid với nồng độ bao nhiêu? A. 1-2% B. 1-3% C. 2-4% D. 2 – 5% Đáp án: D Phiếu học tập số 1
Bài 1: Viết phương trình hóa học khi cho dd HCl, dd H SO loãng 2 4
lần lượt tác dụng với: a) Magnesium b) Zinc
Bài 2: Cho một khối lượng mạt sắt dư vào 50ml dung dịch
sulfuric acid loãng. Phản ứng xong, thu được 3,36 lít khí hydrogen (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch sulfuric acid đã dùng. VẬN DỤNG 05. Phiếu học tập số 2
Thực hiện các yêu cầu sau:
1. Trong một số loại thực phẩm (giấm ăn, đồ uống, trái cây …)
có chứa acid. Em hãy làm chất chỉ thị màu từ bắp cải tím, sau
đó thử tính chất acid của giấm ăn và một số loại trái cây có vị
chua (như cam, chanh…). Quay video quá trình thực hiện và
nộp sản phẩm qua mail hoặc zalo của GV.
* Hướng dẫn làm chất chỉ thị màu từ bắp cải tím: Chuẩn bị quả
bắp cải tím, xắt nhỏ và cho vào máy xay sinh tố, xay nhuyễn,
lọc lấy phần nước lọc. Dùng dung dịch nước lọc làm chất chỉ thị màu.
2. Em hãy tiến hành loại bỏ cặn ấm đun nước nhà em bằng
chanh hoặc giấm. Quay video và nêu rõ các bước thực hiện. THANKS !
CREDITS: This presentation template was
created by Slidesgo, including icons by
Flaticon, infographics & images by Freepik
Document Outline
- Slide 1
- NỘI DUNG BÀI HỌC
- KHỞI ĐỘNG
- Slide 4
- Slide 5
- Slide 6
- 01.
- Slide 8
- Slide 9
- Slide 10
- Tên gọi của acid
- 02.
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- 03.
- Slide 19
- Slide 20
- 04.
- Slide 22
- D.
- D.
- D.
- D.
- D.
- Slide 28
- D.
- D.
- Slide 31
- 05.
- Slide 33
- THANKS!