




Preview text:
HÓA HỌC 10 BÀI 1: THÀNH PHẦN NGUYÊN TỬ
I. Tóm tắt trọng tâm lý thuyết Hóa 10 bài 1
1. Thành phần cấu tạo của nguyên tử
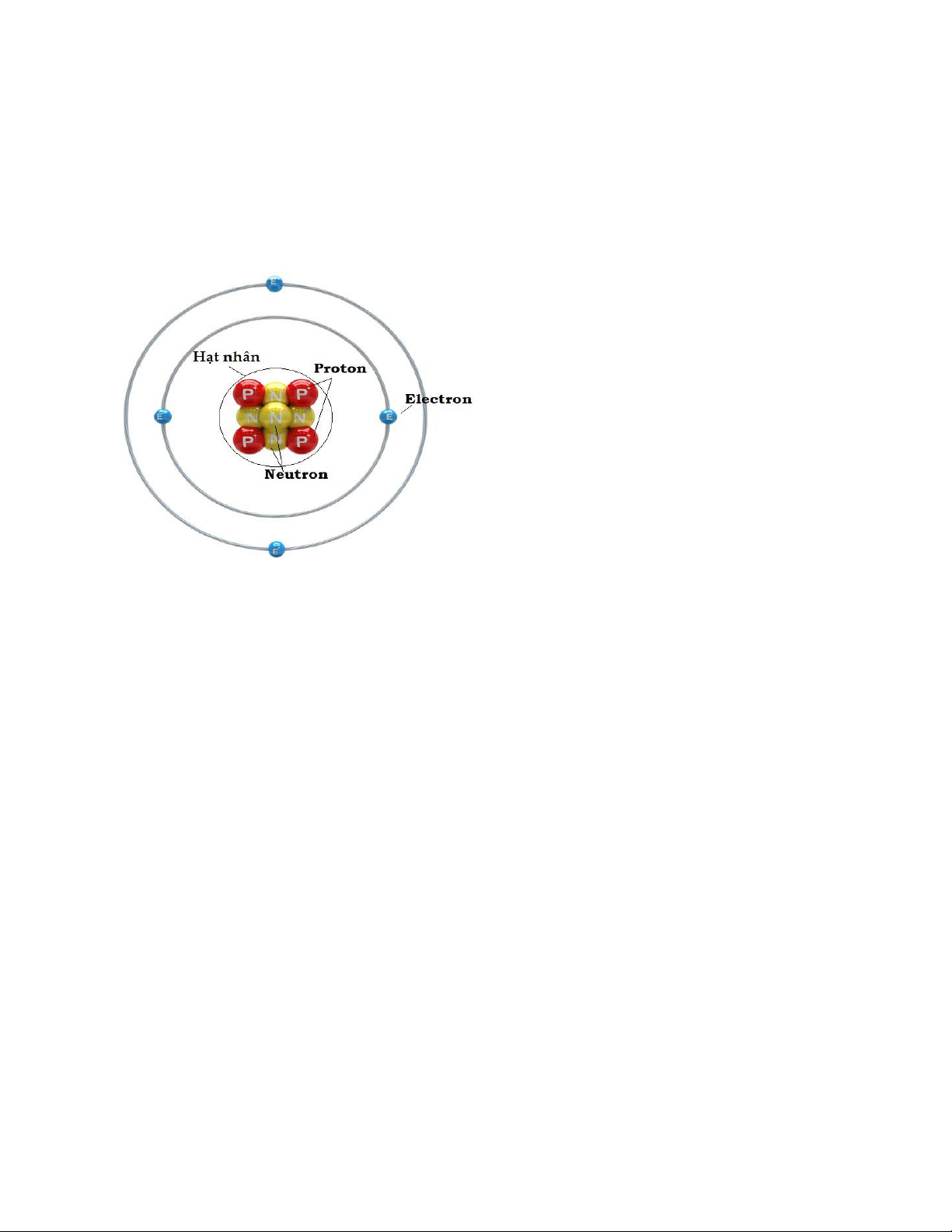
Từ các kết quả thực nghiệm, các nhà khoa học đã xác định được thành phần cấu tạo
của nguyên tử gồm có hạt nhân và lớp vỏ electron. Trong đó:
+ Hạt nhân nằm ở tâm nguyên tử, hầu hết được tạo bởi các hạt proton và notron
(trừ nguyên tử 1H trong hạt nhân không có nơtron
+ Vỏ nguyên tử gồm các electron chuyển động trong không gian xung quanh hạt nhân.
=> Nguyên tử được cấu tạo từ 3 loại hạt cơ bản là: electron, proton và nơtron.
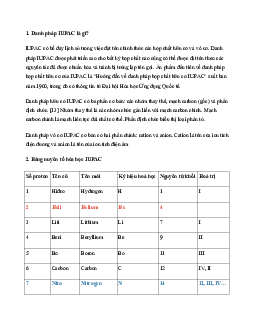
Đặc điểm các loại hạt cấu tạo nên nguyên tử Kí Quan hệ Loại hạt Điện tích (q) Khối lượng (m) hiệu giữa các hạt mp 1đvC Nhân qp= 1,602.10-19C Proton p Số p = số e hay qp= 1+ mp 1,6726 .10-27 mn 1đvC Nơtron n qn = 0 mn 1,6748 .10-27 q m e = -1,602.10-19C e 0,000549 đvC Vỏ Electron e hay qe= 1- me 9,1094.10-31kg
2. Kích thước và khối lượng nguyên tử a. Kích thước
Để biểu thị kích thước nguyên tử người ta dùng đơn vị nanomet (nm) hay o angstrom A o o
1nm = 10-9 m; 1 A = 10-10 m; 1 nm = 10 A
- Nguyên tử nhỏ nhất là nguyên tử hidro có bán kính khoảng 0,053 nm
- Đường kính của hạt nhân nguyên tử còn nhỏ hơn, vào khoảng 10-5 nm
- Đường kính của electron và proton còn nhỏ hơn nhiều (vào khoảng 10-8 nm)
b. Khối lượng nguyên tử
- Vì khối lượng của electron rất nhỏ bé (0,00055u) so với khối lượng của proton và
nơtron (1u) do đó một cách gần đúng có thể coi khối lượng của nguyên tử là khối của hạt nhân
- 1u = 1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12 = 1,6605.10-27
Nguyên tử = mp + mn (bỏ qua e)
II. Bài tập vận dụng mở rộng nâng cao
Câu 1. Hạt nhân của hầu hết các nguyên tử do những hạt nào cấu tạo nên A. Proton và electron B. Electron và nơtron C. Proton và nơtron D. Electron
Câu 2. Nguyên từ được cấu tạo từ mấy loại hạt cơ bản A. 1 B. 3 C. 2 D. 4
Câu 3. Trong nguyên tử hạt nào sau đây mang điện tích dương A. Proton B. Electron C. Nơtron D. Electron và nơtron
Câu 4. Cho phát biểu sau về Y:
(1) Y có 29 nơtron trong hạt nhân.
(2) X có 29 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là 29+.
(4) Khối lượng nguyên tử X là 29u.
Trong các phát biểu trên, số phát biểu đúng là A. 2 B. 1 C. 3 D. 4
Câu 5. Ta có nguyên tử Kẽm có 30 electron ở vỏ nguyên tử. Điện tích hạt nhân của nguyên tử kẽm là A. - 30 B. + 30 C. - 4,806.10-18C D. + 4,806.10-18C
Câu 6. Một nguyên tử (X) có 12 proton trong hạt nhân. Khối lượng của proton
trong hạt nhân nguyên tử X là: A. 2,007.10-26 B. 2,007.10-28 C. 12 gam D. 12 đvC
Câu 7. Tổng số nguyên tử trong 0,02 mol KClO3 là A. 6,023.1023 B. 3,6138.1022 C. 3,6138.1023 D. 6,023.1022 o
Câu 8. Nguyên tử Au có bán kính và khối lượng mol nguyên tử lần lượt là 1,44 A
và 197 g/mol. Biết khối lượng riêng của Au là 19,36 g/cm3 . Hỏi các nguyên tử Au
chiếm bao nhiêu % trong tinh thể A. 56,86 % B. 73,95% C. 75, 57 % D. 65,87 % o
Câu 9. Bán kính của nguyên tử và khối lượng mol nguyên tử Fe lần lượt là 1,28 A
và 56g/mol. Tính khối lượng riêng của Fe, biết rằng trong tinh thể, các nguyên tử
chiếm 74% thể tích, phần còn lại là rỗng. A. 7,84 g/cm3 B. 6,84 g/cm3 C. 5,48 g/cm3 D. 7,48 g/cm3
Câu 10. Kim loại Crom có cấu trúc tinh thể, với phần rỗng chiếm 32%. Khối lượng
riêng của crom là d = 7,19 g/cm3. Bán kính nguyên tử của crom là: (Cho biết Cr: 52 g/mol) o o A. 1,52 A B. 1,25nm C. 1,52 nm D. 1,25 A
III. Đáp án hướng dẫn giải bài tập 1C 2B 3A 4A 5D 6A 7D 8B 9A 10D Câu 6.
mp = 12.1,6726.10-27 = 2,007.10-26 Câu 7.
Số nguyên tử của phân tử KClO3 = 6.023.1023 (0,02 + 0,02 + 0,02.3) = 6,023.1022 Câu 8. o
Đổi 1,44 A = 1,44.10-8 cm
Khối lượng 1 nguyên tử Au = m = 197/(6,023.1023) gam
Thể tích 1 nguyên tử Au = V = 4/3.πr3 = 4/3.π.(1,44.10-8)3 cm3
Ta có D = m/V = 26,15 gam/cm3
Gọi x là phần trăm thể tích nguyên tử Au chiếm chỗ, khối lượng riêng của Au = 19,36 g/cm3
x = 19,36/26,15 .100% = 73,95% Câu 9. o
Đổi 1,28 A = 1,28.10-8 cm
Khối lượng 1 nguyên tử Fe = m = 56/(6,02.1023) gam
Thể tích 1 nguyên tử Fe = V = 4/3.πr3 = 4/3.π.(1,28.10-8)3 cm3 D = m/V = 10,59 gam
Vì Fe chỉ chiếm 74% thể tích tinh thể nên khối lượng riêng thật của Fe = 10,59. 0,74 = 7,84 g/cm3 Câu 10.
1 mol nguyên tử Cr chứa 6,023.1023 nguyên tử Cr
Vtinh thể = 52/7,19 = 7,23 (cm3)
Vnguyên tử Cr = 0,68.7,23/6,023.1023 = 8,16.10-24 cm3 = 4/3πr3 o
R = 1,25.10-8 cm = 1,25 A