



Preview text:
Giải 10 Bài 4: Ôn tập chương 1 Câu 1
Số proton, neutron và electron của lần lượt là A. 19, 20, 39 B. 20, 19, 39 C. 19, 20, 19 D. 19, 19, 20 Gợi ý đáp án Nguyên tử cho biết:
Số hiệu nguyên tử = số proton = số electron = 19
Số khối = 39 => Số neutron = 39 – 19 = 20
=> Số proton, neutron và electron của lần lượt là 19, 20, 19 Câu 2
Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng Gợi ý đáp án Đáp án C có Z = 11
Cấu hình electron: 1s22s22p63s1
=> Có 1 electron ở lớp ngoài cùng có Z = 7
Cấu hình electron: 1s22s22p3
=> Có 5 electron ở lớp ngoài cùng có Z = 13
Cấu hình electron: 1s22s22p63s23p1
=> Có 3 electron ở lớp ngoài cùng có Z = 6
Cấu hình electron: 1s22s22p2
=> Có 4 electron ở lớp ngoài cùn Câu 3
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là A. 8 B. 9 C. 11 D. 10 Gợi ý đáp án
Nguyên tử potassium có 19 electron
=> Cấu hình electron: 1s22s22p63s23p64s1
Potassium có 10 orbital chứa electron. Đáp án D Câu 4
Nguyên tử của nguyên tố sodium (natri) (Z = 11) có cấu hình electron là A. 1s22s22p63s2 B. 1s22s22p6 C. 1s22s22p63s1 D. 1s22s22p53s2 Gợi ý đáp án
Cấu hình electron: 1s22s22p63s1 Đáp án C Câu 5
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn
số hạt không mang điện là 18. X là A. Cl B. Ca C. K D. S Gợi ý đáp án
Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n Ta có:
Nguyên tử X có tổng số hạt proton, neutron và electron là 58:
=> p + e + n = 58 <=> 2p +n = 58 (vì p = e) (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 18:
=> p + e – n = 18 <=> 2p - n = 18 (2)
Giải phương trình (1), (2) p = e = 19 và n = 20 => X là Kali Đáp án C Câu 6
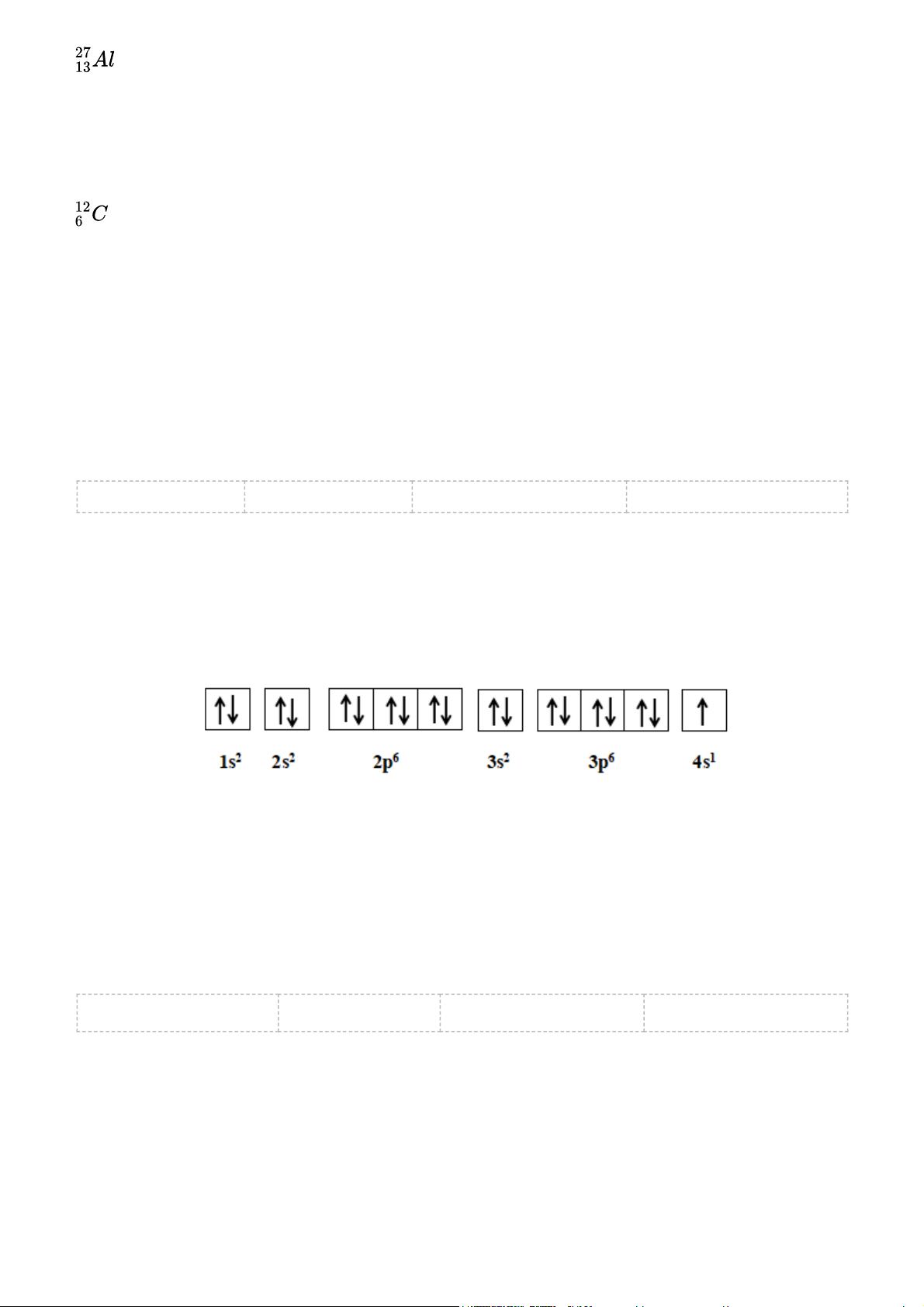
Nguyên tố chlorine có Z = 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng,
số electron độc thân của nguyên tử chlorine Gợi ý đáp án
Nguyên tố chlorine có Z = 17
Cấu hình electron: 1s22s22p63s23p5
Cấu hình chlorine theo ô orbital
+ Số lớp electron của Chlorine: 3
+ Số electron của Chlorine thuộc lớp ngoài cùng: 7
+ Số electron của Chlorine độc thân: 1 Câu 7
Nguyên tử khối trung bình của vanadium (V) là 50.9975. Nguyên tố V có 2 đồng vị trong đó đồng vị
chiếm 0.25%. Tính số khối của đồng vị còn lại Gợi ý đáp án
Gọi số khối đồng vị còn lại là a. Ta có: => a = 51
Vậy số khối đồng vị còn lại củaVanadi là 51 Câu 8 Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1
- Nguyên tử Y: 1s22s22p63s23p4
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm? Gợi ý đáp án a) Nguyên tử X có 19 electron Nguyên tử X có 16 electron b)
Nguyên tử X có 19 electron => Nguyên tử X có số hiệu nguyên tử ZX = 19
Nguyên tử Y có 16 electron => Nguyên tử Y có số hiệu nguyên tử ZY = 16 c)
Trong nguyên tử X lớp electron ở mức năng lượng cao nhất là lớp N (n= 4)
Trong nguyên tử Y lớp electron ở mức năng lượng cao nhất là lớp M (n= 3) d) Nguyên tử X có:
+ 4 lớp electron (n = 1, 2, 3, 4)
+ 6 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p, 4s) Nguyên tử Y có:
+ 3 lớp electron (n= 1, 2, 3)
+ 5 phân lớp electron (gồm 1s, 2s, 2p, 3s, 3p) e)
Nguyên tử X có 1 e lớp ngoài cùng (4s1)
=> X là nguyên tố kim loại.
Nguyên tử Y có 6 e lớp ngoài cùng (3s23p4)
=> Y là nguyên tố phi kim. Câu 9
Nguyên tố X được dùng để chế tạo hợp kim nhẹ, bền, dùng trong nhiều lĩnh vực: hàng không,
ô tô, xây dựng, hàng tiêu dùng,… Nguyên tố Y ở dạng YO 3-
4 , đóng vai trò quan trọng trong các
phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng YO 3- 4 để vận chuyển năng
lượng. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1. Nguyên tử
nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3. Viết cấu hình electron nguyên tử của
X và Y. Tính số electron trong các nguyên tử X và Y. Nguyên tố X và Y có tính kim loại hay phi kim? Gợi ý đáp án
Nguyên tử nguyên tố X có electron cuối cùng điền vào phân lớp 3p1
Cấu hình electron của X là: 1s22s22p63s23p1
=> X có 13 e và X là nguyên tố kim loại (vì có 3 e lớp ngoài cùng)
Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3
Cấu hình electron của Y là: 1s22s22p63s23p3
=> Y có 15 e và Y là nguyên tố phi kim (vì có 5 e lớp ngoài cùng). Câu 10
Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 49, trong đó số
hạt không mang điện bằng 53,125% số hạt mang điện. Xác định điện tích hạt nhận, số proton,
số electron, số neutron và số khối của X? Gợi ý đáp án
Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là P, E, N (Z = P = E) Ta có theo đầu bài:
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49: => 2Z + N = 49 (1)
Lại có, số hạt không mang điện bằng 53,125% số hạt mang điện: => N = 2Z .53,125/100 (2)
Giải phương trình (1) và (2) ta được: => Z = 16 = P = E N =17
Số khối của nguyên tử X là: Z + N = 16 + 17 = 33
Vậy nguyên tử nguyên tố X có: điện tích hạt nhân là 16+, 16 proton, 16 electron, 17 neutron và có số khối là 33.