





Preview text:
Chương. VI: PHƯƠNG PHÁP PHÂN TÍCH KHỐI LƯỢNG 6.1 Giới thiệu
Phương pháp phân tích khối lượng dựa trên việc đo khối lượng là tín hiệu cho biết thành phần chất nghiên cứu.
Phương pháp phân tích khối lượng, điện khối lượng và một vài dạng phân tích nhiệt liên quan
đến quá trình tạo ra và cân một hợp chất hay nguyên tố ở dạng tinh khiết sau khi quá trình xử
lý nhiệt được thực hiện với mẫu phân tích.
Phương pháp phân tích khối lượng truyền thống liên quan đến quá trình chuyển nguyên tố, ion
hay gốc cần phân tích thành hợp chất ổn định, tinh khiết, hợp chất mà thích hợp cho việc cân
trực tiếp hay chuyển sang một dạng hóa học mà có thể dễ dàng định lượng.
Khối lượng của nguyên tố, ion hay các dạng hóa học khác có thể dễ dàng tính toán từ công
thức của dạng cân và mối liên hệ của khối lượng nguyên tử của các nguyên tố hợp thành.
Ví dụ, xác định Ca2+ trong nước tự nhiên, sử dụng lượng dư H2C2O4. Ca2+ 2-
(dd) + C2O4 (dd) → CaC2O4↓(rắn) (6-1)
Kết tủa sau đó được lọc, rửa, sấy và nung ở ngọn lửa đỏ. Quá trình này chuyển toàn bộ kết tủa
sang oxit canxi. Phản ứng ở đây là:
CaC2O4↓(rắn) → CaO(rắn) + CO(k) + CO2(k) (6-2)
Chén nung kết tủa sau đó được làm nguội trong bình hút ẩm và cân. Từ lượng cân chúng ta suy
ra được hàm lượng Ca2+ trong mẫu.
Một ví dụ rất quen thuộc trong phương pháp phân tích khối lượng là xác định Cl- bằng cách kết tủa với Ag+
Ag+(dd) + Cl-(dd) → AgCl↓(rắn) (6-3)
Kết tủa AgCl sau đó được lọc, rửa, sấy, nung và cân. Từ khối lượng của AgCl sẽ chỉ cho chúng
ta nồng độ Cl- có mặt ở trong mẫu là bao nhiêu. 1
Ví dụ: 10,00 ml dung dịch chứa Cl- được kết tủa với một lượng dư AgNO3, khối lượng kết tủa
AgCl thu được là 0,4368g. Tính nồng độ mol/l của dung dịch Cl- ban đầu. ! [Cl-]= !"#$(#) = +,-./0# = 0,3048M %!"#$& " '.)(*) 1-.,.21& " '∗+,+1+++* %&$ %&$ 6.2 Sự kết tủa
Dạng kết tủa lý tưởng trong phương pháp phân tích khối lượng là nó phải không tan, dễ dàng
lọc và có độ tinh khiết cao, và tất nhiên thành phần hóa học của nó theo một hệ số tỉ lượng đã
biết trước. Mặc dù có một vài kết tủa có thể thõa mãn các yêu cầu này, song các kỹ thuật thích
hợp có thể giúp việc tối ưu hóa các tính chất của kết tủa trong phương pháp phân tích khối
lượng. Ví dụ như, độ tan của kết tủa thường sẽ giảm khi làm nguội dung dịch.
Kích thước của hạt kết tủa không được quá nhỏ để làm tắc nghẽn hay chui qua giấy lọc. Kích
thước hạt kết tủa lớn hơn sẽ dẫn đến bề mặt kết tủa nhỏ hơn. Điều này làm giảm sự tấn công
bề mặt của các hạt không có trong thành phần kết tủa. Ở một thái cực khác là trạng thái huyền
phù của các hạt keo, những hạt có kích thước trong phạm vi 1-100 nm và nó chui qua hầu hết
các loại giấy lọc. Đây là một vấn đề cần quan tâm để điều chỉnh các điều kiện kết tủa.
6.2.1 Sự phát triển hạt tinh thể
Sự kết tinh xảy ra theo hai xu hướng: tạo mầm và phát triển mầm. Trong quá trình tạo mầm,
các phân tử trong dung dịch tập hợp lại một cách ngẫu nhiên và tạo ra mầm tinh thể. Sự phát
triển của các hạt liên quan đến quá trình thêm các phân tử tới các mầm và tạo ra một tinh thể.
Khi một dung dịch chứa chất lượng chất tan lớn hơn khi cân bằng, dung dịch này được gọi là quá bão hòa.
Khi quá trình tạo mầm nhanh hơn và chiếm ưu thế so với quá trình phát triển mầm trong dung
dịch có độ quá bão hòa cao. Kết quả là tạo ra các hạt nhỏ, thậm chí tệ hơn chỉ là các hạt keo.
Trong dung dịch có độ quá bão hòa kém hơn, quá trình tạo mầm chậm và các mầm tinh thể có
cơ hội phát triển, tạo ra các hạt lớn và sắp xếp có trật tự hơn.
Các kỹ thuật để tăng sự phát triển hạt:
- Tăng nhiệt độ để tăng độ tan và do đó giảm sự quá bão hòa
- Thêm thuốc thử chậm, đồng thời với sự khuấy trộn đều tránh sự bão hòa cục bộ
- Giữ thể tích dung dịch lớn để nồng độ chất phân tích và thuốc thử là thấp 2
6.2.2 Kết tủa trạng thái keo
Keo là những hạt có đường kính từ 1-100 nm. Nó lớn hơn kích thước phân tử nhưng quá nhỏ
để kết tủa. Nó giữ lại trong dung dịch, lơ lửng nhờ chuyển động Brownian. Trạng thái keo gây
ra khó lọc rửa bởi vì giấy lọc thông thường chỉ giữ lại những hạt có kích thước ≥10nm. Quá
trình biến đổi các hạt keo thành chất rắn có thể lọc được gọi là sự đông tụ hay sự kết bông.
6.2.3 Kết tủa đồng thể
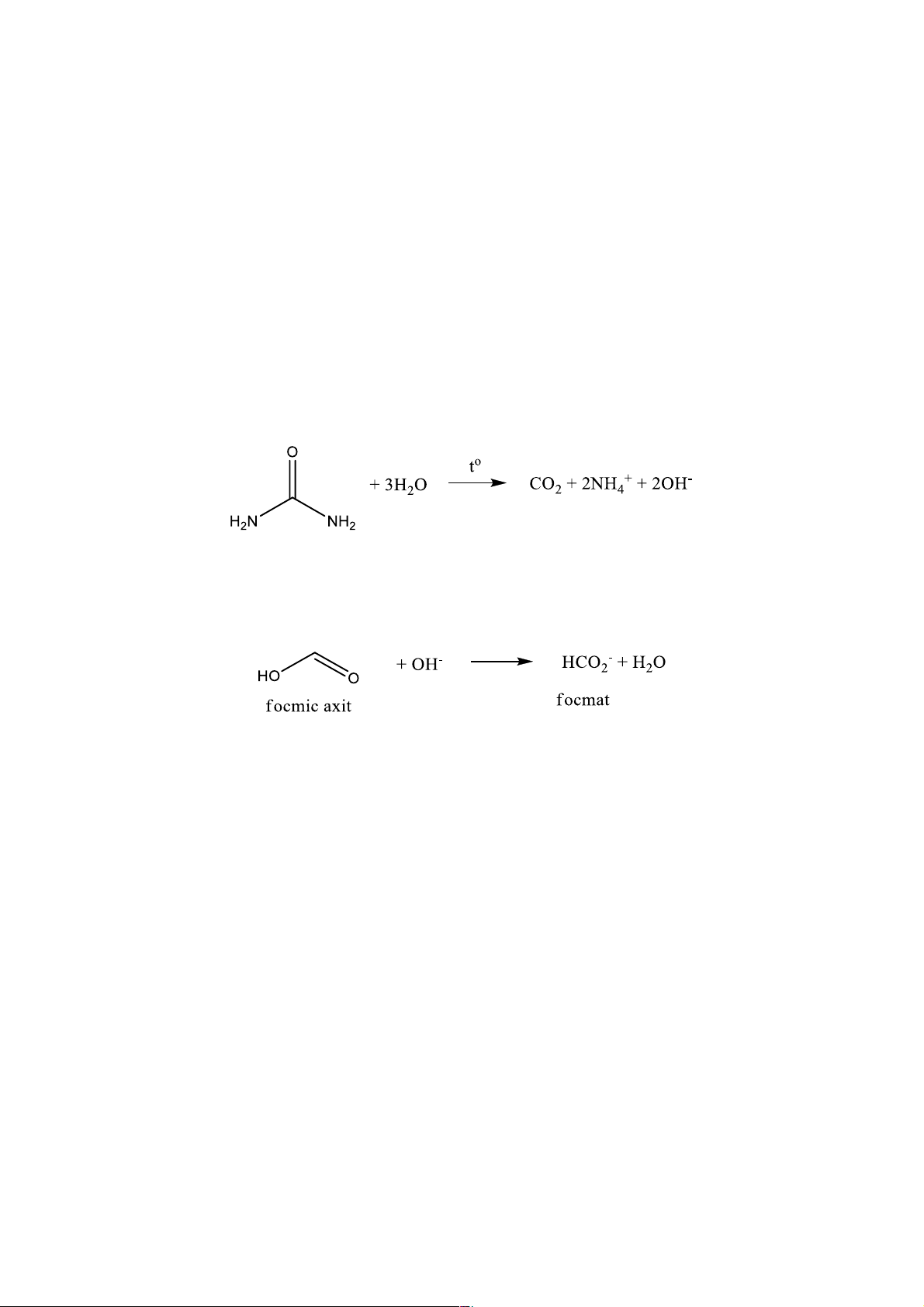
Trong kết tủa đồng thể, thuốc thử được tạo ra chậm bằng một phản ứng hóa học. Ví dụ, sự phân
hủy urê trong nước nóng tạo ra 𝑂𝐻4:
Bằng cách này, pH của dung dịch tăng lên một cách từ từ, sự tạo thành 𝑂𝐻4 một cách từ từ
giúp thu được kết tủa có kích thước lớn hơn của focmat sắt III. 3𝐻𝐶𝑂4
2 + Fe3+ → Fe(HCO2)3.nH2O↓ Focmat sắt III
6.2.4 Kết tủa có mặt chất điện ly mạnh
Các ion thường được kết tủa với sự có mặt của chất điện ly. Để hiểu lý do tại sao, chúng ta sẽ
thảo luận về các tinh thể nhỏ đông tụ thế nào (tạo ra các hạt có kích thước lớn hơn). Để minh
họa chúng ta sẽ lấy ví dụ cho trường hợp AgCl, nó được tạo ra trong môi trường HNO3 0,1M. 3
Hình 6.1: Sơ đồ hạt keo AgCl lớn lên trong dung dịch chứa lượng dư Ag+, H+ và 𝑁𝑂(
' . Hạt keo tích điện dương
do hấp phụ Ag+. Vùng xung quanh được gọi là bầu ion, nó tích điện âm bởi vì các hạt kết tủa hút các anion và đẩy các cation.
Hình 6.1. minh họa các hạt keo của AgCl phát triển trong dung dịch chứa lượng dư Ag+, H+ và
𝑁𝑂4.. Bề mặt của hạt kết tủa có điện tích dương do sự hấp phụ các ion Ag+ dư (sự hấp phụ là
sự tấn công bề mặt). Ngược lại, sự hấp thụ là sự đột nhập xa hơn, sâu hơn, xuyên thấu vào bên
trong). Các điện tích dương trên bề mặt sẽ hấp dẫn các anion và đẩy các cation từ bầu ion xung
quanh hạt (hình 6.1). Điện tích dương của hạt và bầu ion xung quanh hạt mang điện tích âm tạo ra lớp điện kép.
Các hạt keo phải va chạm với nhau để kết hợp lại. Tuy nhiên, điện tích âm ở bầu ion xung
quanh hạt sẽ đẩy nhau ra. Các hạt, bởi vậy nhất thiết phải có năng lượng động học đủ để vượt
qua lực tĩnh điện trước khi chúng có thể kết hợp.
Đun nóng dung dịch có thể nâng cao sự đông tụ nhờ tăng được năng lượng động học của hạt.
Tăng nồng độ chất điện ly mạnh (ví dụ như HNO3 cho AgCl) làm giảm điện tích của bầu ion
xung quanh hạt và cho phép các hạt tiến gần nhau hơn trước khi lực tĩnh điện có hiệu quả. Vì
lý do này hầu hết quá trình kết tủa được thực hiện với sự có mặt của chất điện ly mạnh.
6.2.5 Quá trình làm muồi kết tủa
Sau khi kết tủa xong, thường với quá trình kết tủa tinh thể, người ta thực hiện quá trình làm
muồi kết tủa. Đó là quá trình trong đó kết tủa được đun nóng trong 1h hay lâu hơn trong dung
dịch mà nó được tạo thành (dung dịch mẹ). Với sự xử lý này, nâng cao sự sắp xếp, định hướng
lại tinh thể. Kích thước hạt tăng lên, các chất nhiễm bẩn có xu hướng đẩy ra khỏi tinh thể. 4
6.2.6 Sự nhiễm bẩn kết tủa
6.2.6.1. Sự hấp phụ bề mặt
Sự hấp phụ bề mặt xảy ra trong quá trình tạo kết tủa. Ngoài các ion tham gia kết tủa trên bề
mặt, kết tủa còn ưu tiên hấp phụ các ion trong dung dịch. Sự hấp phụ này phụ thuộc vào:
- Bản chất của chất bị hấp phụ (ưu tiên hấp phụ ion nào)
- Diện tích bề mặt kết tủa: diện tích bề mặt càng lớn, hấp phụ càng mạnh (kết tủa vô định
hình thường có kích thước nhỏ, diện tích bề mặt lớn, hấp phụ mạnh. Sự đông tụ keo
không phải là dấu hiệu để giảm sự hấp phụ bởi vì chất rắn đông tụ vẫn còn chứa một
bề mặt bên trong lớn. Các hạt rắn đông tụ bao gồm các ion hấp phụ lên bề mặt trước khi đông tụ.
- Nhiệt độ: nhiệt độ tăng, hấp phụ giảm (nhả hấp phụ tăng)
6.2.6.2. Sự cộng kết
Sự cộng kết là sự cùng kết tủa. Ví dụ, nếu cho 𝐶 24
2𝑂- vào Mg2+ thì không tạo kết tủa nhưng nếu có Ca2+ thì sẽ tạo kết tủa: Ca2+ + 𝐶 24 2𝑂- → CaC2O4↓ Mg2+ + 𝐶 24 2𝑂- → MgC2O4↓
Người ta nói Mg2+ đã cộng kết với Ca2+ Các loại cộng kết:
+ Tạo hợp chất hóa học: Ví dụ: Ba2+ + 𝑆𝑂24 - → BaSO4↓ (trắng) Nếu có Fe3+ Ba2+ + 𝐹𝑒(𝑆𝑂 4
-)2 = Ba[Fe(SO4)2]2 (màu nâu nhạt) + Cộng kết đồng hình
Những ion có bán kính xấp xỉ nhau có thể thay thế nhau trong mạng lưới tinh thể gọi là đồng hình. Ví dụ: 𝑀𝑛𝑂4 24 24
- có kích thước gần giống 𝑆𝑂- có thể thay thế vị trí của 𝑆𝑂- trong mạng lưới
tinh thể. Khi kết tủa 𝑆𝑂24
- có lẫn KMnO4 thì kết tủa thu được có màu hơi tím trong khi BaSO4
tinh khiết có màu trắng. 5 + Cộng kết sau:
Nếu kết tủa xong không lọc ngay có thể có hiện tượng cộng kết sau.
Ví dụ, H2S + Cu2+ → CuS↓ + H+
Muốn có kết tủa CuS thì tích số nồng độ [Cu2+][S2-]>TCuS. Sau khi kết tủa CuS nếu vẫn được
ngâm trong dung dịch mẹ (H2S), S2- sẽ hấp phụ lên bề mặt của CuS và làm cho nồng độ của
S2- ở trên bề mặt của kết tủa lớn lên. Nếu trong dung dịch có các ion khác, ví dụ như Zn2+, khi
điều kiện tích số tan [Zn2+][S2-]>TZnS được thỏa mãn do sự tăng nồng độ của S2- trên bề mặt thì sẽ có kết tủa ZnS.
6.2.6.3. Sự nhiễm bẩn kết tủa
Một trong những nguyên nhân quan trọng của sự nhiễm bẩn là hiện tượng cộng kết, đặc biệt là
sự cộng kết đồng hình, nội cộng kết, do tạo hợp chất. Như vậy làm sạch bằng phương pháp rửa
là khó. Có thể khắc phục bằng cách kết tủa lại.
Hiện tượng nhiễm bẩn do cộng kết bề mặt hay gặp xọng có thể rửa kết tủa.
6.3 Một số điều kiện thực nghiệm
6.4.1. Đối với kết tủa tinh thể
+ Tạo được kết tủa lớn hạt: muốn vậy phải tiến hành từ dung dịch và thuốc thử loãng, quá trình
them thuốc thử chậm, khuấy đều. Tiến hành kết tủa từ dung dịch nóng (mục đích làm tăng độ
tan), hạt bé tan ra, hạt lớn tiếp tục lớn. Đôi khi them H+ vào dung dịch để tăng độ tan kết tủa.
Kết tủa xong hạ nhiệt độ, trung hòa H+.
Ví dụ: kết tủa CaC2O4 trong môi trường axit yếu, kết tủa xong, them NH3 để giảm độ axit tới
mức đủ thấp để CaC2O4 được kết tủa hoàn toàn.
+ Sau khi kết tủa xong thực hiện quá trình làm muồi kết tủa.
6.4.2. Đối với kết tủa vô định hình
+ Tiến hành kết tủa từ dung dịch và thuốc thử tương đối đặc, mục đích tạo kết tủa chắc (không xốp).
+ Quá trình thêm thuốc thử nhanh, khuấy đều, kết tủa từ dung dịch nóng để giảm quá trình hấp
phụ tạp chất, tăng cường sự đông tụ.
+ Tiến hành kết tủa có mặt chất điện ly mạnh (đông tụ kết tủa) 6
+ Sau khi kết tủa xong, phải pha loãng bằng nước và lọc ngay (quá trình hấp phụ phụ thuộc
nồng độ tạp chất), không ngâm lâu tránh hiện tượng cộng kết sau.
6.4 Yêu cầu đối với dạng cân
+ Ứng với công thức hóa học đã định trước (công thức hóa học của sản phẩm phụ thuộc vào
nhiệt độ và quá trình gia nhiệt).
+ Dạng cân phải bền với môi trường bên ngoài
+ Chọn thành phần nguyên tố trong dạng cân càng ít càng tốt (sai số bé). 7


