










Preview text:
BÀI 6: XÚC TÁC
1. MỘT SỐ KHÁI NIỆM CƠ BẢN
2. PHÂN LOẠI XÚC TÁC
3. XÚC TÁC ĐỒNG THỂ 4. XÚC TÁC DỊ THỂ 5. XÚC TÁC MEN 1
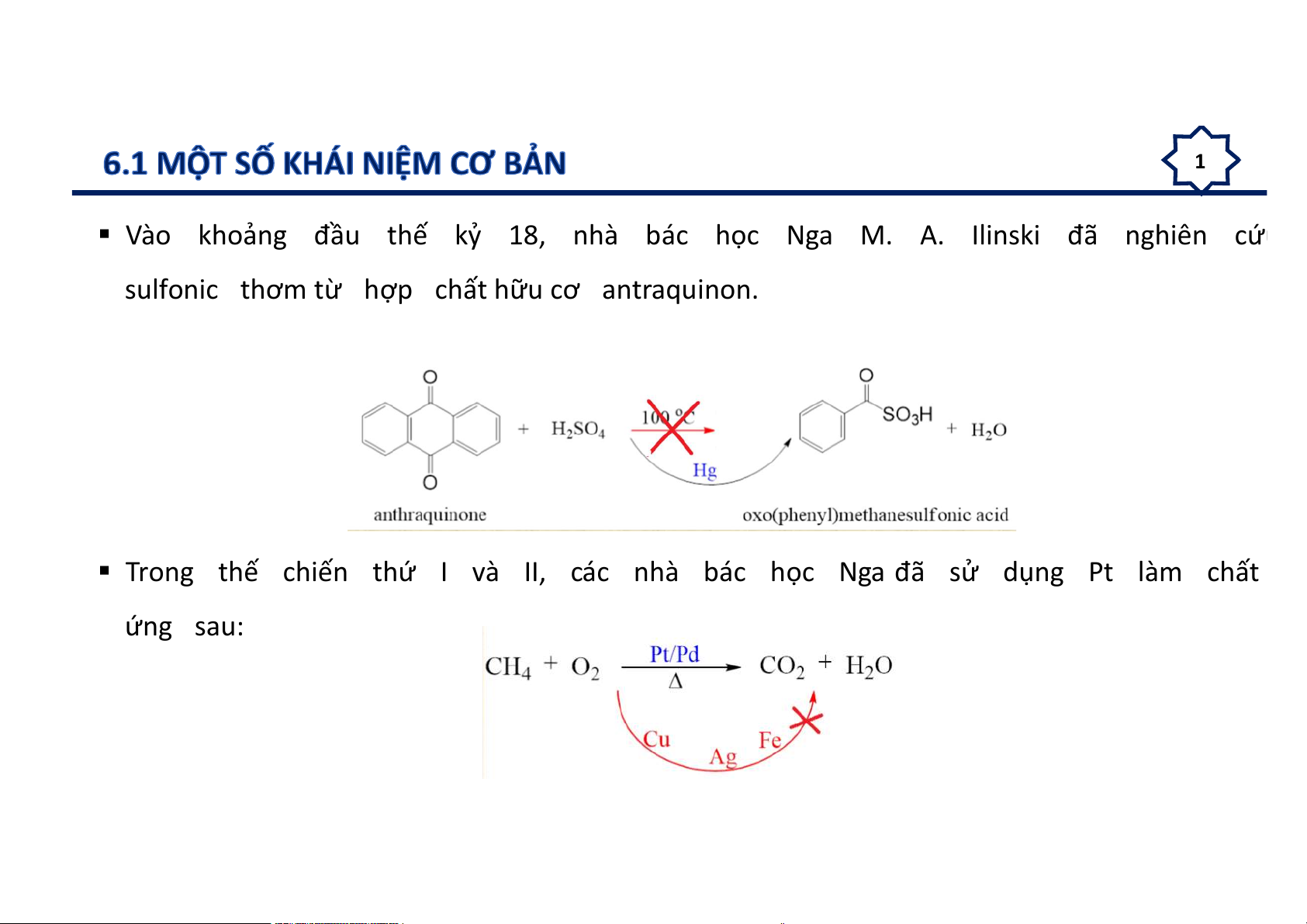
Vào khoảng đầu thế kỷ 18, nhà bác học Nga M. A. Ilinski đã nghiên cứu
sulfonic thơm từ hợp chất hữu cơ antraquinon.
Trong thế chiến thứ I và II, các nhà bác học Nga đã sử dụng Pt làm chất ứng sau: 2
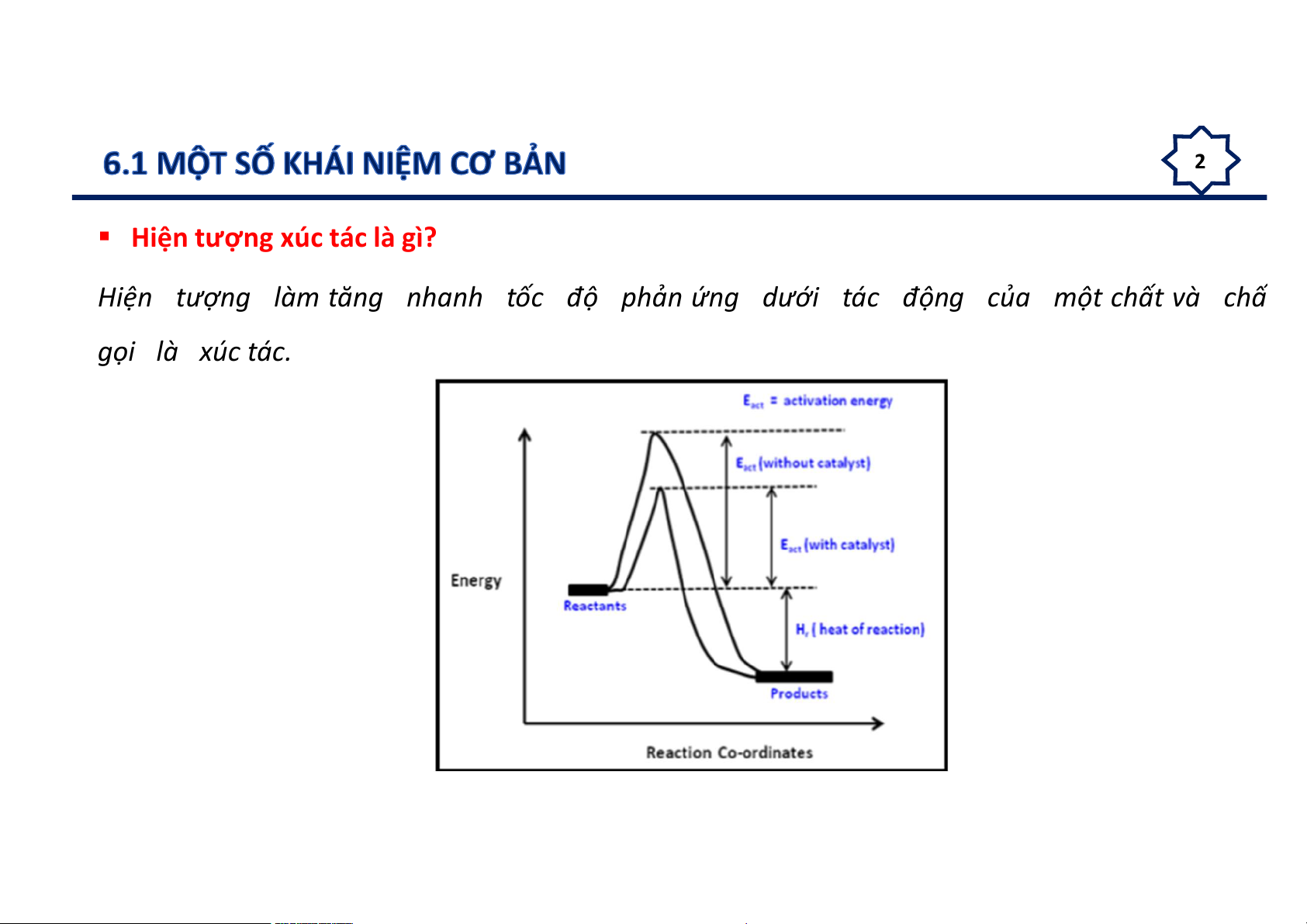
Hiện tượng xúc tác là gì?
Hiện tượng làm tăng nhanh tốc độ phản ứng dưới tác động của một chất và chấ gọi là xúc tác. 3
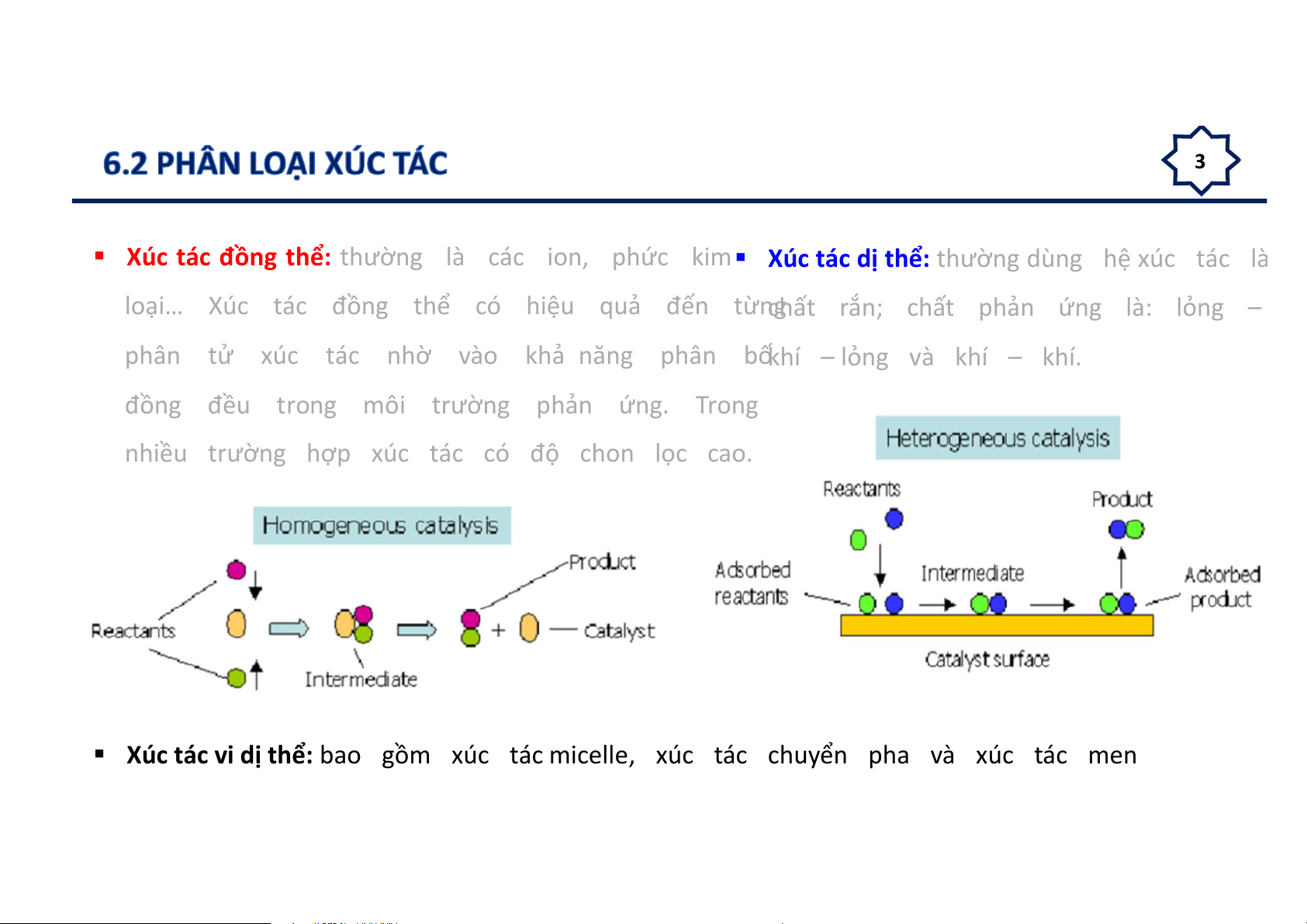
Xúc tác đồng thể: thường là các ion, phức kim Xúc tác dị thể: thường dùng hệ xúc tác là
loại… Xúc tác đồng thể có hiệu quả đến từng
chất rắn; chất phản ứng là: lỏng –
phân tử xúc tác nhờ vào khả năng phân bốkhí – lỏng và khí – khí.
đồng đều trong môi trường phản ứng. Trong
nhiều trường hợp xúc tác có độ chon lọc cao.
Xúc tác vi dị thể: bao gồm xúc tác micelle, xúc tác chuyển pha và xúc tác men 4
Hiện tượng xúc tác thường đi kèm với các hiện tượng: ức chế, đầu độc … và c
các hiện tượng tự xúc tác và phản ứng kèm nhau.
Chất xúc tác có thể là: một phân tử trong xúc tác men, xúc tác đồng thể
nguyên tử/phân tử trong xúc tác kim loại 5
6.2.1 HIỆN TƯỢNG ỨC CHẾ
Hiện tượng một chất làm chậm phản ứng được gọi là sự làm chậm hay hiện tượng ức
chế. Chất gây ra hiện tượng này gọi là chất ức chế 6 6.2.2 TỰ XÚC TÁC
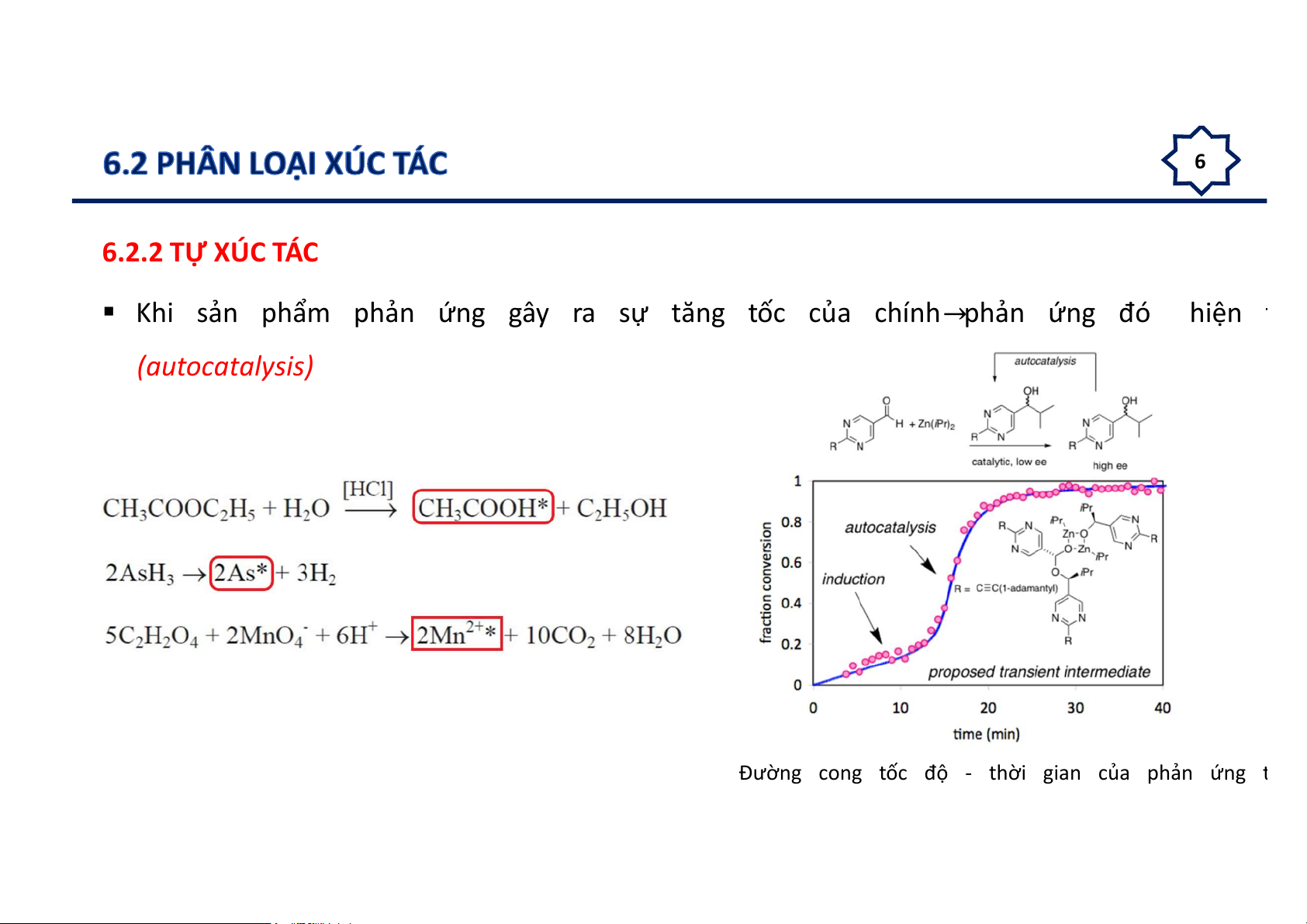
Khi sản phẩm phản ứng gây ra sự tăng tốc của chính phản ứng đó hiện t (autocatalysis)
Đường cong tốc độ - thời gian của phản ứng t 7
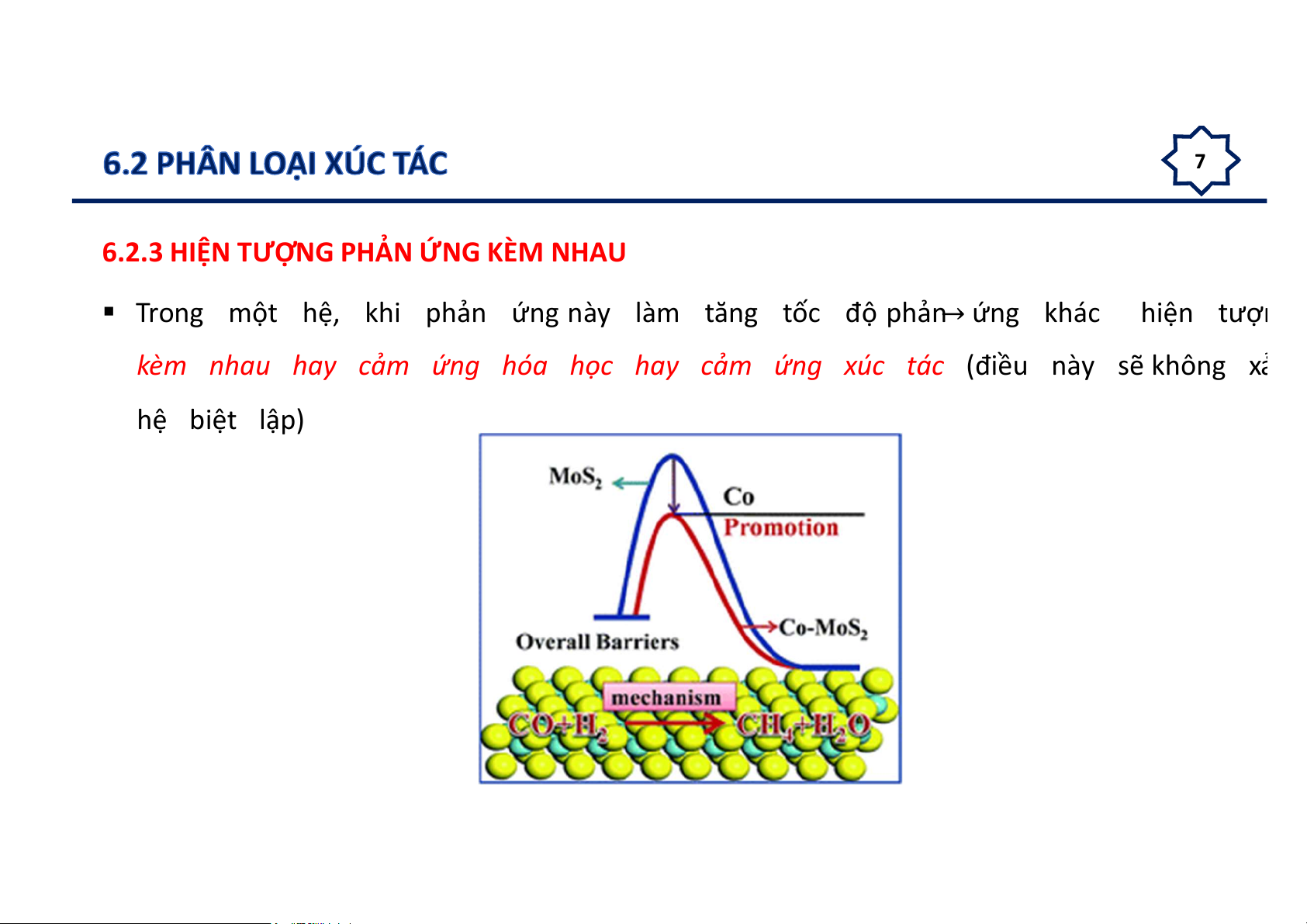
6.2.3 HIỆN TƯỢNG PHẢN ỨNG KÈM NHAU
Trong một hệ, khi phản ứng này làm tăng tốc độ phản ứng khác hiện tượn
kèm nhau hay cảm ứng hóa học hay cảm ứng xúc tác (điều này sẽ không xả hệ biệt lập) 8
6.2.5 HIỆN TƯỢNG ĐẦU ĐỘC VÀ CHẤT ĐỘC
Xúc tác bị giảm hoạt tính khi có sự xuất hiện của một chất nào đó (chất này thư
chất trong hỗn hợp phản ứng)
xúc tác bị đầu độc và chất gây ra hiện tượng này l độc. Ví dụ: 9
ĐỘNG HỌC CỦA PHẢN ỨNG VỚI XÚC TÁC ACID - BAZ
Xét phản ứng tổng quát:
Khi xúc tác thể hiện tính acid:
Khi xúc tác thể hiện tính baz:
Phản ứng không xúc tác:
Tốc độ chung của quá trình: vc = = k
𝐇 + 𝐎𝐇 + 𝐨 xt.[S] 10
ĐỘNG HỌC CỦA PHẢN ỨNG VỚI XÚC TÁC ACID - BAZ
Trường hợp xúc tác là acid mạnh: k >> k và k có thể bỏ qua k và k 2 1 3 1 3 Khi đó: suy ra: 11
ĐỘNG HỌC CỦA PHẢN ỨNG VỚI XÚC TÁC ACID - BAZ
Trường hợp xúc tác là baz mạnh: k >> k và k có thể bỏ qua k và k 3 1 2 2 1 Khi đó: = Suy ra: 12
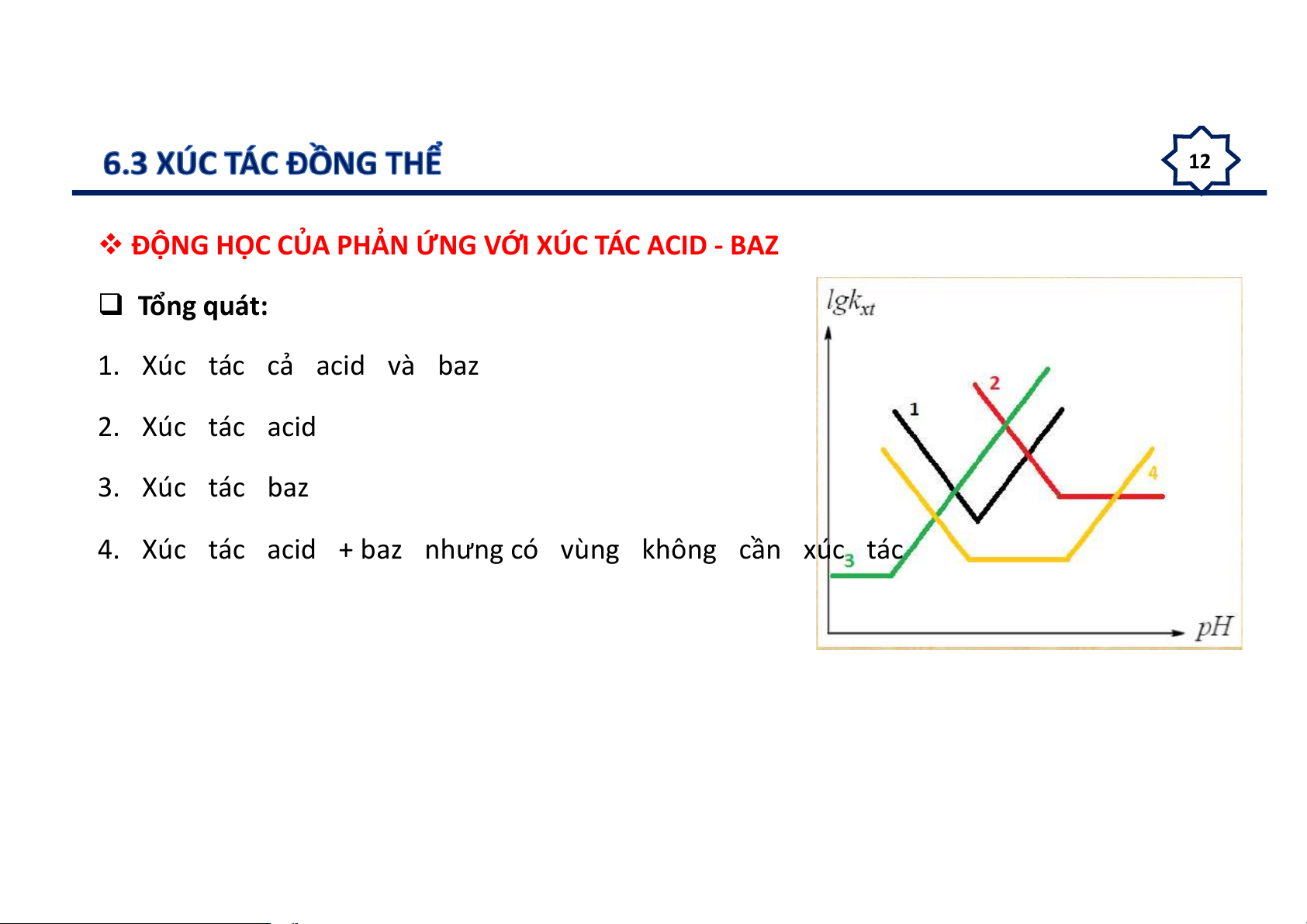
ĐỘNG HỌC CỦA PHẢN ỨNG VỚI XÚC TÁC ACID - BAZ Tổng quát: 1. Xúc tác cả acid và baz 2. Xúc tác acid 3. Xúc tác baz
4. Xúc tác acid + baz nhưng có vùng không cần xúc tác 13 6.4.1 KHÁI NIỆM
Ưu điểm của phản ứng xúc tác dị thể:
Công nghệ xúc tác dị thể có thể tiến hành liên tục năng suất thiết bị ca
Có thể tự động hóa được công nghệ
Tách xúc tác ra khỏi sản phẩm dễ dàng
Năng lượng hoạt hóa của phản ứng xúc tác dị thể thường nhỏ
Trong công nghiệp, xúc tác acid – baz dần dần được thay thế bằng
xúc tác rắn (xúc tác dị thể) 14 15
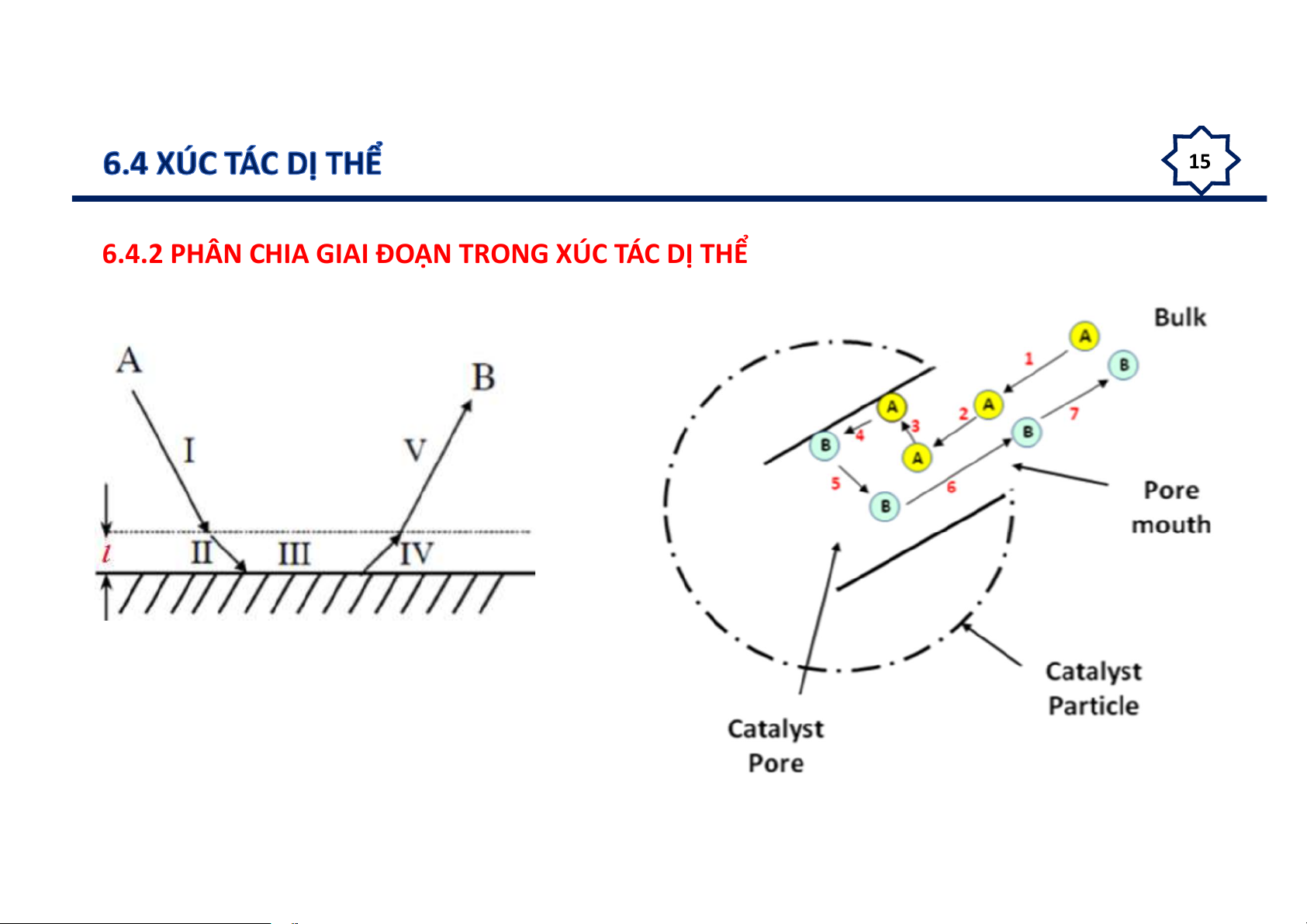
6.4.2 PHÂN CHIA GIAI ĐOẠN TRONG XÚC TÁC DỊ THỂ 16
6.4.3 PHÂN CHIA THEO LỚP
Balandin đã chia phản ứng xảy ra trên bề mặt xúc tác thành 5 lớp:
Lớp I: lớp khuếch tán
Lớp II: lớp quá độ
Lớp III: lớp phân tử phản ứng hoạt động
Lớp IV: lớp trung tâm hoạt động của xúc tác
Lớp V: lớp chất mang xúc tác
Xúc tác chỉ có một phần rất mỏng trên bề mặt. Vì
vậy, đối với kim loại quý người ta thường cho mang
lên trên chất mang
tăng bề mặt xúc tác 17
6.4.4 PHƯƠNG TRÌNH ĐỘNG HỌC
Xét phản ứng đơn phân tử S
P: xuất hiện 2 tốc độ phản ứng tiến hành s Tốc độ khuếch tán Tốc độ động học
Tốc độ khuếch tán:
Tốc độ động học:
Từ định luật Fick: dq/dt = -D.σ.dC
Từ PTĐH chung nhất: v = k .C n ĐH 1 S Với: Với: -
k : hằng số tốc độ động học 1
- dq: lượng chất khuếch tán qua bề mặt, σ (với -
C : nồng độ chất phản ứng S trên b S
sự chênh lệch nồng độ dC trong thời gian dt) - n: bậc của phản ứng
- D: hệ số khuếch tán 18
6.4.4 PHƯƠNG TRÌNH ĐỘNG HỌC
Ví dụ: một chất A ở môi trường khuếch tán có nồng độ C được khuếch tán x
tác với khoảng cách dl (trên bề mặt xúc tác có nồng độ là C ) s 𝑑𝑥 Ta có: 𝐶 𝑑𝐶 = − = − − 𝐶 𝑑𝑙 𝑑𝑙 𝐶 Theo Fick:
𝑑𝑞 = −𝐷. 𝜎. − 𝐶. 𝑑𝑡 𝑑𝑙
Nếu tính cho một đơn vị thể tíc 𝑑 h 𝑞 V: 𝐶
= −𝐷. 𝜎. − 𝐶. 𝑑𝑡 𝑉 𝑉. 𝑑𝑙
Mà dC = dq/V (sự thay đổi trong một đơn vị thể tích)
Suy ra tốc độ khuếch tán: 19
6.4.4 PHƯƠNG TRÌNH ĐỘNG HỌC Mặt khác: V
= β(C - C ) _ với β là hằng số tốc độ khuếch tán KT S X
Ở trong vùng quá độ ta có: V ≈ V k .C = β(C - C ) KT ĐH 1 S S X Và V = V = V KT ĐH




