





Preview text:
Câu hỏi ôn tập
Phân tích bằng công cụ, CH3323, học kỳ 20211
1. Trình bày định luật Lambert-Beer, định luật cơ bản về hấp thụ bức xạ điện từ, trong phương
pháp phổ hấp thụ phân tử UV-VIS. (Nêu biểu thức toán học, ý nghĩa vật lý của độ hấp thụ mol,
nêu điều kiện để hệ thức của định luật đúng)
2. Nêu biểu thức toán học định luật Lambert- Beer trong phương pháp phổ hấp thụ phân tử UV-
VIS. Phổ UV-VIS là kỹ thuật phổ được áp dụng khi phân tích các hợp chất có nồng độ thấp, ở đó
môi tương quan giữa tín hiệu đo được và nồng độ của chất phân tích là mối quan hệ tuyến tính.
Hãy nêu cách sử dụng kỹ thuật này cho phân tích định lượng (phương pháp đường chuẩn, thêm
chuẩn và phương pháp tính, vẽ đồ thị minh họa).
3. Thế nào là phổ hấp thụ? Tại sao trong phân tích đo quang người ta thường chọn λmax là bước sóng tia tới?
4. Nêu tính chất cộng tính của độ hấp thụ. Nêu vai trò của dung dịch trống trong phân tích đo quang?
5. Trình bày cấu tạo và cơ chế hoạt động của detector ống quang. Các yêu cầu của bộ chuyển đổi
tín hiệu bức xạ điện từ.
9. Trình bày phương trình Lambert-Beer phát biều cường độ vạch phổ hấp thụ nguyên tử phụ
thuộc vào nồng độ chất phân tích.
10. Trình bày các phương pháp phân tích định lượng trong phương pháp phổ hấp thụ nguyên tử.
11. Trình bày cấu tạo và cơ chế hoạt động của đèn catot rỗng HCL khi đóng vai trò bức xạ đơn
sắc của phổ hấp thụ nguyên tử.
12. Tại sao phương pháp AES lại có độ nhạy cao hơn khi thay đổi nhiệt độ của ngọn lửa so với phương pháp AAS?
17. Tại sao khi xác định nồng độ ion F– bằng phương pháp đo điện thế sử dụng điện cực màng
rắn chọn lọc ion, người ta thường dùng dung dịch đệm có lực ion lớn chứa axetic axit, natri citrat,
NaCl và NaOH để pha loãng và điều chỉnh pH đến 5,5?
18. Nguyên nhân nào làm xuất hiện thế tiếp xúc trong phương pháp đo điện thế? Giá trị điện thế
tiếp xúc ảnh hưởng như thế nào đến việc phân tích? Làm thế nào để làm giảm điện thế tiếp xúc?
19. Viết hệ thức Nernst cho điện cực màng thủy tinh? Tại sao phải chuẩn hóa điện cực thủy tinh
trước khi đo pH. Hãy giải thích các sai số gây ra khi sử dụng điện cực thủy tinh trong môi trường pH quá cao và quá thấp.
20. Ý nghĩa khi sự phản hồi điện cực chỉ thị tuân theo hệ thức Nernst là gì?
21. Nêu định nghĩa điện cực chỉ thị, điện cực so sánh, điện cực kim loại. Lấy ví dụ cho mỗi loại
điện cực và nêu yêu cầu đòi hỏi với các điện cực này. 1
22. Với điện cực bạc-bạc clorua, chúng ta có E° = 0,222V, E(KCl bão hòa) = 0,197V. Hãy dự
đoán giá trị E của điện cực calomen nếu E° của nó là E° = 0,268V.
23. Sử dụng các giá trị điện thế cho dưới đây tính hoạt độ của Cl− trong KCl 1M
E° (điện cực calomen) = 0,268 V, E (điện cực calomen, KCl 1M) = 0,280V
24. Hãy giải thích sự hình thành sóng cực phổ của một ion kim loại trên điện cực giọt Hg
25. Trình bày phương trình Inkovich biểu diễn sự phụ thuộc cường độ dòng khuếch tán vào nồng độ chất phân tích.
26. Tại sao phải đuổi oxy khi phân tích bằng phương pháp cực phổ?
27. Nêu định nghĩa dòng Faraday và dòng dịch chuyển trong phương pháp cực phổ (vẽ hình minh
họa). Tại sao người ta chọn thời điểm đo dòng ở giai đoạn cuối của chu kỳ giọt thủy ngân?
28. Chất nền cực phổ là gì? Nêu vai trò của chất nền cực phổ.
29. Trình bày cơ sở phân tích định tính và định lượng bằng phương pháp cực phổ. Trình bày thủ
tục đường chuẩn và thêm tiêu chuẩn trong phân tích định lượng bằng phương pháp cực phổ.
30. Hãy giải thích những ưu điểm vượt trội của cực phổ xung vuông so với cực phổ xung thường
về cường độ tín hiệu, giới hạn phát hiện, độ phân giải và thời gian quét thế (vẽ hình minh họa)
31. Trình bày nguyên tắc của phương pháp vôn-ampe hòa tan (von-ampe ngược). Tính ưu việt
của phương pháp này so với phương pháp cực phổ xung thường.
34. Hãy giải thích tại sao chất mang trong pha tĩnh thường được silica hóa?
37. Mn được sử dụng như một chất nội chuẩn trong xác định Fe bằng phương pháp phổ hấp thụ
nguyên tử. Một hỗn hợp chuẩn chứa 2,00 μg Mn/ml và 2,50 μg Fe/ml cho tỉ số tín hiệu (Tín hiệu
Fe /tín hiệu Mn) = 1,05/1,00. Một hỗn hợp với thể tích là 6,00 mL được chuẩn bị bằng cách trộn
5,00 ml dung dịch phân tích chứa Fe với 1.00 ml chứa 13,5 μg Mn/ml. Độ hấp thụ của hỗn hợp ở
bước sóng của Mn là 0,128, và độ hấp thụ ở bước sóng của Fe là 0,185. Tính nồng độ mol/l của
dung dịch Fe cần phân tích. ĐS: 8,33×10-5 M
38. Một dung dịch được chuẩn bị bằng cách trộn 10,00 ml dung dịch cần phân tích (X) với 5,00
ml dung dịch chuẩn (S) chứa 8,24 μg S/ml và pha loãng hỗn hợp này tới thể tích bằng 50,0 ml.
Tỉ số tín hiệu đo được là (tín hiệu X/ tín hiệu S) = 1,690/1,000.
(a) Nếu làm một thí nghiệm riêng lẻ với nồng độ X và Y là bằng nhau, tỉ số tín hiệu đo được là
(tín hiệu X/ tín hiệu S) = 0,930/1,000. Hãy xác định nồng độ của X
(b) Hãy xác định nồng độ của X nếu làm một thí nghiệm riêng khác với nồng độ của X lớn hơn
nồng độ của S là 3,42 lần, tỉ số tín hiệu đo được là (tín hiệu X/ tín hiệu S) = 0,930/1,000.
ĐS: (a) 7,49 μg X/ml; (b) 25,6 μg X/ml 2
39. Độ hấp thụ A của dung dịch X và Y nguyên chất và hỗn hợp X+Y với cuvet có bề dày 1,00
cm tại hai bước sóng 400 nm và 565 nm có các giá trị như ở bảng dưới đây Chất Nồng độ
A (tại 400 nm) A(tại 565 nm) X 1,50×10-4M 0,942 0,201 Y 3,00×10-4M 0,226 1,162 X+Y (Cx+Cy) 0,680 0,858
Tính nồng độ X và Y trong hỗn hợp
ĐS. X= 8,85×10-5M; Y = 1,93×10-4M;
42. Một pin gồm điện cực so sánh calomen và điện cực chọn lọc ion Pb2+ có điện thế –0,4706V
khi nhúng vào 50,00 ml dung dịch mẫu kiểm tra. Khi thêm 5,00 ml dung dịch chuẩn Pb2+ 0,015M
thế của dung dịch thay đổi thành – 0,4490 V. Tính nồng độ Pb2+ trong mẫu kiểm tra. Giả sử rằng
hoạt độ của Pb2+ xấp xỉ bằng nồng độ của nó. ĐS. 3,05×10-4M
43. Một dung dịch được chuẩn bị bằng cách trộn 25,0 mL KI 0,200M với 25,0 mL NaCl
0,200M và được chuẩn độ điện thế với dung dịch AgNO3 0,100 M:
Điện cực so sánh calomel bão hòa||dung dịch chuẩn độ|điện cực Ag
Cho biết tích số tan của AgI và AgCl: TAgI = 8,3.10–17; TAgCl = 1,82.10–10
(a) Hãy tính nồng độ [Ag+] khi thêm được 25,0 mL AgNO3 0,100 M
(b) Hãy tính nồng độ [Ag+] khi thêm được 75,0 mL AgNO3 0,100 M
(c) Viết phương trình thể hiện mối quan hệ giữa Epin và [Ag+]
44. Tính thế catot (vs. SCE) cần thiết để khử Co(II) tới 1,0 μM trong các dung dịch cho dưới
đây. Trong mỗi trường hợp, Co là sản phẩm của phản ứng. (a) HClO4 0,10 M
Co2+ + 2e– ⇋ Co(rắn) E° = –0,282 V E (S.C.E) = 0,241 V (a) 𝐶 2− 2𝑂4 0,10 M Co(𝐶 2− 2−
2𝑂4)2 + 2e– ⇋ Co(rắn) + 2𝐶2𝑂4 E° = –0,474 V
Ở câu hỏi này, yêu cầu tính thế ở đó [Co(𝐶 2− 2𝑂4)2 ] sẽ là 1,0 μM (b) EDTA 0,10 M ở pH = 7,00 3
45. Axit butanoic có hằng số phân bố giữa pha nước và benzen là 3,0 (Kpb = 3,0). Tính nồng độ
của axit này ở trong benzen khi 100 ml dung dịch axit butanoic 0,10M được chiết với 25 ml
benzen ở pH bằng 4,00 và 10,00. Ka = 1,52×10-5 (pKa = 4,818) ĐS. 0,16M và 2.10-6M
46. Độ hấp thụ mol của một đơn axit yếu HInd (Ka = 1.42×10–5) và bazơ yếu liên hợp của nó là
Ind– ở bước sóng 430 và 570 nm được xác định bằng cách đo trong môi trường axit mạnh và bazơ
mạnh (ở đó toàn bộ chất chỉ thị tương ứng ở dạng HInd và Ind–). Kết quả thu được cho ở bảng dưới đây: ε430 (M–1cm–1) ε570 (M–1cm–1) HInd 6,30×102 7,12×103 Ind- 2,06×104 9,61×102
Một dung dịch (không được đệm để giữ ổn định pH) có tổng nồng độ chất chỉ thị là: 2×10–5 M.
Hãy tính nồng độ mol/l của [HInd], [Ind–] và độ hấp thụ A430, A570.
ĐS. [Ind–] = 1,12×10–5 M; [Hind] = 0,88×10–5 M; A430 = 0,236; A570 = 0,073
47. Độ hấp thụ mol của hợp chất X và Y được đo với các mẫu dung dịch đơn chất cho kết quả ở bảng sau: ε (M – 1cm– 1) λ (nm) X Y 272 16400 3870 327 3990 6420
Hỗn hợp chứa hai chất X và Y với cuvet 1,000 cm có độ hấp thụ lần lượt là 0,957 ở 272 nm và
0,559 ở 327 nm. Hãy xác định nồng độ của X và Y trong hỗn hợp.
48. Cd2+ được sử dụng như một chất nội chuẩn trong phân tích Pb2+ bằng phương pháp von-ampe
xung vuông, Cd2+ bị khử ở –0,60(±0,02)V và Pb2+ bị khử ở –0,40(±0,02)V. Xác nhận rằng tỷ lệ
của chiều cao pic là tỷ lệ thuận với tỷ lệ nồng độ trên toàn bộ phạm vi nồng độ sử dụng trong thí
nghiệm. Dưới đây là kết quả cho hỗn hợp đã biết nồng độ và hỗn hợp (cần xác định nồng độ + chất nội chuẩn): Chất phân tích Nồng độ, M Dòng (µA) Đã biết nồng độ Cd2+ 3,23(±0,01)×10 – 5 1,64(±0,03) Pb2+ 4,18(±0,01)×10 – 5 1,58(±0,03) Chưa biết nồng độ + chất nội chuẩn Cd2+ ? 2,00(±0,03) Pb2+ ? 3,00(±0,03) 4
Dung dịch cần xác định nồng độ được chuẩn bị bằng cách trộn 25,00(±0,05) ml dung dịch cần
xác định nồng độ và 10,00(±0,05) ml dung dịch Cd2+ 3,23(±0,01)×10 – 5M và pha loãng đến 50,00(±0,05) ml.
Bỏ qua độ không đảm bảo, hãy xác định nồng độ Pb2+ trong dung dịch chưa pha loãng ĐS. 2,60×10 – 5M
53. Một hỗn hợp gồm 1,06 mmol 1-pentanol và 1,53 mmol của 1-hexanol được tách bằng phương
pháp sắc ký khí cho tín hiệu diện tích pic tương đối là 922 và 1570 đơn vị. Khi 0,57 mmol
pentanol được thêm vào dung dịch hexanol chưa biết nồng độ, tỉ lệ diện tích pic tương đối là 843
và 816 (pentanol:hexanol). Xác định số mmol hexanol trong dung dịch cần xác định. ĐS. 0,47 mmol
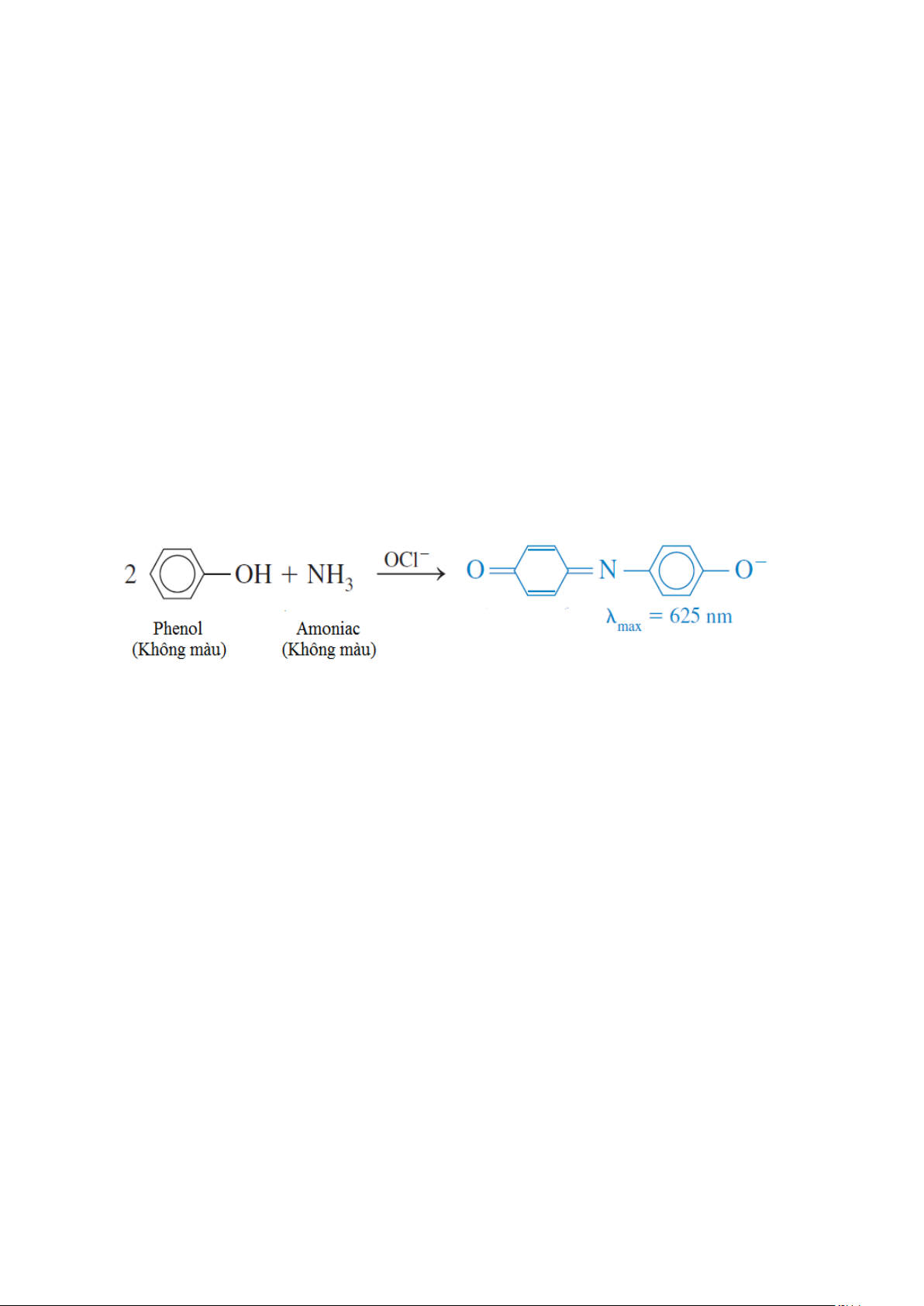
54. Ammoniac có thể được xác định bằng phương pháp đo quang bằng cách cho phản ứng với
phenol có mặt hypochlorua (OCl–)
Một mẫu chứa 4,37 mg protein được chuyển hóa hóa học để chuyển đổi nitơ thành amoniac và
sau đó pha loãng thành 100,0 ml. Sau đó lấy 10,0 ml dung dịch cho vào một bình định mức 50
ml, thêm 5 ml dung dịch phenol cộng với 2 ml natri hypoclorua. Mẫu được pha loãng thành 50,0
ml bằng nước cất. Độ hấp thụ đo ở 625 nm sử dụng cuvet 1,00 cm sau 30 phút. Để so sánh, một
dung dịch chuẩn đã được chuẩn bị từ 0,010 0 g NH4Cl (M = 53,49 g/mol) hòa tan trong 1.00 lít
nước. Sau đó lấy 10,0 ml của dung dịch chuẩn này cho vào bình định mức thể tích 50 ml và phân
tích trong cùng một cách thức như dung dịch cần xác định. Mẫu trống được sử dụng là nước cất.
Độ hấp thụ ở 625 nm Mẫu trống 0,140 Mẫu chuẩn 0,308
Mẫu phân tích 0,592
(a). Tính độ hấp thụ mol của sản phẩm phản ứng giữa phenol và amoniac (sản phẩm xanh)
(b). Tính phần trăm khối lượng của nitơ trong protein
ĐS. (a) ε = 4,49 ×103 M–1cm–1; (b) %N = 16,1%
55. Cu+ phản ứng với neocuproine để tạo thành phức hợp màu (neocuproine)2Cu+, với cực đại
hấp thụ ở 454 nm. Neocuproine đặc biệt hữu ích vì nó phản ứng với các kim loại khác. Phức đồng
hòa tan trong 3-methyl-1-butanol (rượu isoamyl). Đây là một dung môi hữu cơ không hòa tan
đáng kể trong nước. Nói cách khác, khi rượu isoamyl được thêm vào nước, hỗn hợp rượu nước
được phân ra làm hai lớp, với lớp nước có tỉ trọng lớn hơn ở phía dưới. Nếu (neocuproine)2Cu+ có 5
mặt, nó hầu như đi hết vào pha hữu cơ. Giả sử rằng rượu isoamyl không hòa tan trong nước và tất
cả phức màu sẽ đi vào pha hữu cơ. Giả sử rằng thủ tục sau đây được thực hiện:
1, Một tảng đá có chứa đồng được nghiền thành bột, và tất cả các kim loại được chiết tách ra với
axit mạnh. Dung dịch axit được trung hòa với bazơ và pha loãng đến 250,0 ml trong bình định mức A.
2, Tiếp theo, 10,00 ml dung dịch A được chuyển vào bình B, thêm 10,00 ml dung dịch chất khử
để khử tất cả Cu2+ về Cu+. Sau đó thêm 10.00 mL dung dịch đệm để mang lại độ pH thích hợp
cho sự hình thành phức Cu+ với neocuproine.
3, Sau đó, 15,00 ml dung dịch này được lấy ra cho vào bình C. Thêm vào 10,00 ml dung dịch
chứa neocuproine và 20,00 ml rượu isoamyl vào bình C. Sau khi hỗn hợp đã được lắc đều, các
pha được tách ra khỏi nhau, tất cả (neocuproine)2Cu+ trong pha hữu cơ.
4, Một vài ml lớp trên được lấy ra. Đo độ hấp thụ ở 454 nm sử dụng cuvet có bề dày 1,00 cm.
Mẫu trống thực hiện thông qua các thủ tục tương tự cho một hấp thụ là 0.056.
(a) Giả sử rằng đá chứa 1,00 mg Cu. Nồng độ của Cu (mol/l) trong rượu isoamyl là bao nhiêu?
(b) Nếu hấp thụ phân tử của (neocuproine)2Cu+ là 7,90 ×103 M–1cm–1. Độ hấp thụ đo được sẽ là
bao nhiêu? Lưu ý rằng một trống thực hiện thông qua các thủ tục tương tự đã đưa ra một hấp thụ là 0,056.
(c) Một tảng đá được phân tích và đo được độ hấp thụ là 0.874 (chưa được hiệu chỉnh với dung
dịch trống). Hãy xác định có bao nhiêu mg Cu là trong đá?
ĐS. (a) C = 1,57 ×10–5 M; (b) A = 0,180; (c) 6,60 mg Cu;
56. Tính thế catot cần thiết để khử 99,99% Cu2+ 0,1M thành Cu. Có thể tách hoàn toàn Cu2+ 0.1M
và Sn2+ 0.1M hay không? Cho biết: Cu2+ + 2e– ⇋ Cu↓ E° = 0,339V Sn2+ + 2e– ⇋ Sn↓ E° = –0,141V
ĐS. Ecatot = 0,19V; Quá trình khử Sn2+ là không xảy ra
57. Một dung dịch chuẩn chứa 6,3×10–8M iotoaxeton và p cloro benzen 2,0×10–7M (một chất nội
chuẩn) cho diện tích pic tương ứng là 395 và 787 khi sử dụng phương pháp sắc ký khí. Hỗn hợp
gồm 3,00 ml dung dịch iotoaxeton chưa biết nồng độ và 0,100 ml 1,6×10–5M p cloro benzen được
pha loãng đến 10,00 ml. Phương pháp sắc ký cho diện tích pic 622 và 520 tương ứng với
iotoaxeton và p cloro benzen. Tính nồng độ của iotoaxeton trong 3,00 ml dung dịch iotoaxeton chưa biết nồng độ. 6
54. Một dung dịch chuẩn chứa 6,3×10–8M iotoaxeton và p cloro benzen 2,0×10–7M (một chất nội
chuẩn) cho diện tích pic tương ứng là 395 và 787 khi sử dụng phương pháp sắc ký khí. Hỗn hợp
gồm 3,00 ml dung dịch iotoaxeton chưa biết nồng độ và 0,100 ml 1,6×10–5M p cloro benzen được
pha loãng đến 10,00 ml. Phương pháp sắc ký cho diện tích pic 622 và 520 tương ứng với
iotoaxeton và p cloro benzen. Tính nồng độ của iotoaxeton trong 3,00 ml dung dịch iotoaxeton chưa biết nồng độ. ĐS. 0,41 µM
42. Một pin gồm điện cực so sánh calomen và điện cực chọn lọc ion Pb2+ có điện thế –0,4706V khi nhúng vào
50,00 ml dung dịch mẫu kiểm tra. Khi thêm 5,00 ml dung dịch chuẩn Pb2+ 0,015M thế của dung dịch thay đổi
thành – 0,4490 V. Tính nồng độ Pb2+ trong mẫu kiểm tra. Giả sử rằng hoạt độ của Pb2+ xấp xỉ bằng nồng độ của nó. ĐS. 3,05 ×10–4M
52. Cd2+ được sử dụng như một chất nội chuẩn trong phân tích Pb2+ bằng phương pháp von-ampe xung vuông, Cd2+ bị khử ở –0,60(±0,02)V
và Pb2+ bị khử ở –0,40(±0,02)V. Xác nhận rằng tỷ lệ của chiều cao pic là tỷ lệ thuận với tỷ lệ nồng độ trên toàn bộ phạm vi nồng độ sử dụng
trong thí nghiệm. Dưới đây là kết quả cho hỗn hợp đã biết nồng độ và hỗn hợp (cần xác định nồng độ + chất nội chuẩn): Chất phân tích Nồng độ, M Dòng (µA) Đã biết nồng độ Cd2+ 3,23(±0,01)×10 – 5 1,64(±0,03) Pb2+ 4,18(±0,01)×10 – 5 1,58(±0,03) Chưa biết nồng độ + chất nội chuẩn Cd2+ ? 2,00(±0,03) Pb2+ ? 3,00(±0,03)
Dung dịch cần xác định nồng độ được chuẩn bị bằng cách trộn 25,00(±0,05) ml dung dịch cần xác định nồng độ và 10,00(±0,05) ml dung
dịch Cd2+ 3,23(±0,01)×10 – 5M và pha loãng đến 50,00(±0,05) ml.
Bỏ qua độ không đảm bảo, hãy xác định nồng độ Pb2+ trong dung dịch chưa pha loãng ĐS. 2,60×10 – 5M 7



