































Preview text:
Chuyên đề Kim loại
MÔN HOÁ HỌC – MÃ CHẤM: H10a Chuyên đề
MỘT SỐ DẠNG BÀI TẬP BỒI DƯỠNG HỌC SINH GIỎI PHẦN KIM LOẠI CHUYỂN TIẾP PHẦN A: MỞ ĐẦU
I. Lí do chọn đề tài
Trong sự nghiệp đổi mới toàn diện của đất nước ta, đổi mới nền giáo dục là một trong
những trọng tâm của sự phát triển. Công cuộc đổi mới này đòi hỏi nhà trường phải tạo ra
những con người lao động tự chủ, năng động và sáng tạo. Luật Giáo dục 2005 của nước
ta đã khẳng định: “Phát triển giáo dục là quốc sách hàng đầu nhằm nâng cao dân trí, đào
tạo nhân lực, bồi dưỡng nhân tài”. Trong nhiệm vụ nâng cao dân trí, đào tạo nhân lực, bồi
dưỡng nhân tài, ngành giáo dục đào tạo đóng vai trò chủ đạo.
Việc bồi dưỡng học sinh giỏi về Hóa học ở trường phổ thông chuyên góp phần rất
lớn trong việc giải quyết nhiệm vụ phát hiện, đào tạo nhân tài mà trong công cuộc đổi
mới đất nước hiện nay.
Khi phân tích nội dung kiến thức hóa học trong các kì thi học sinh giỏi chúng tôi
thấy rằng phần kiến thức về kim loại là một trong những nội dung thường được đề cập
tới, với mức độ từ dễ đến khó, kiến thức rộng với hệ thống phương trình hóa học, chuyên
sâu như các phần tinh thể, phức chất… gây khó khăn cho HS. Do đó theo chúng tôi giảng
dạy về phần hóa kim loại có ý nghĩa quan trọng trong việc bồi dưỡng học sinh giỏi.
Tuy nhiên, để đạt hiệu quả như mong muốn cũng còn nhiều khó khăn trong quá
trình giảng dạy, vì đây là phần kiến thức khá sơ sài trong sách giáo khoa cũng như tài liệu
giáo khoa chuyên, đòi hỏi nhiều kĩ năng tính toán, hệ thống kiến thức chuyên sâu nhiều
và phức tạp trong khi nội dung chương trình của Tài liệu giáo khoa chuyên Hóa học hiện
nay hệ thống bài tập vận dụng chưa nhiều.
Vì vậy việc sưu tầm, xây dựng hệ thống các dạng bài tập về MỘT SỐ DẠNG BÀI TẬP
BỒI DƯỠNG HỌC SINH GIỎI PHẦN KIM LOẠI CHUYỂN TIẾP phù hợp và hiệu
quả để phục vụ cho việc bồi dưỡng học sinh giỏi là rất cần thiết để từ đó củng cố, mở
rộng kiến thức, tăng khả năng vận dụng, phát triển tư duy sáng tạo cho học sinh. 1 Chuyên đề Kim loại
II. Mục đích nghiên cứu
Đúc rút và tổng kết kinh nghiệm trong rất nhiều năm giảng dạy đội tuyển hoá học
quốc gia, chúng tôi đã hoàn thành chuyên đề “MỘT SỐ DẠNG BÀI TẬP BỒI
DƯỠNG HỌC SINH GIỎI PHẦN KIM LOẠI CHUYỂN TIẾP” để làm tài liệu phục
vụ cho giáo viên trường chuyên giảng dạy, ôn luyện, bồi dưỡng học sinh giỏi các cấp và
làm tài liệu học tập cho học sinh chuyên hoá. Ngoài ra còn là tài liệu tham khảo cho giáo
viên môn hóa học và học sinh yêu thích môn hóa học nói chung.
III. Nhiệm vụ
1- Nghiên cứu chương trình hóa học phổ thông nâng cao và chuyên hóa học, phân tích
các đề thi học sinh giỏi cấp tỉnh, khu vực, cấp quốc gia, quốc tế và đi sâu về nội dung liên
quan đến vấn đề kim loại chuyển tiếp.
2- Sưu tầm, lựa chọn trong tài liệu giáo khoa, sách bài tập cho học sinh, trong các tài liệu
tham khảo. Các đề thi học sinh giỏi các cấp có nội dung liên quan; phân loại, xây dựng
các bài tập lí thuyết và tính toán.
3- Đề xuất phương pháp xây dựng và sử dụng hệ thống bài tập dùng cho việc giảng dạy,
bồi dưỡng học sinh giỏi các cấp ở trường THPT chuyên.
IV. Giả thuyết khoa học
Nếu giáo viên giúp học sinh nắm vững vấn đề lí thuyết và xây dựng được hệ thống
bài tập chất lượng, đa dạng, phong phú đồng thời có phương pháp sử dụng chúng một
cách thích hợp thì sẽ nâng cao được hiệu quả quá trình dạy- học và bồi dưỡng học sinh giỏi, chuyên hóa học.
V. Phương pháp nghiên cứu
- Nghiên cứu thực tiễn dạy học và bồi dưỡng học sinh giỏi hóa học ở trường THPT chuyên.
- Nghiên cứu các tài liệu về phương pháp dạy học hóa học, các tài liệu về bồi dưỡng học
sinh giỏi, các đề thi học sinh giỏi, . . .
- Thu thập tài liệu và truy cập thông tin trên internet có liên quan đến đề tài.
- Đọc, nghiên cứu và xử lý các tài liệu. 2 Chuyên đề Kim loại
VI. Điểm mới của chuyên đề
- Chuyên đề đã xây dựng được hệ thống hệ thống lí thuyết cơ bản có mở rộng và nâng
cao một cách hợp lí và hệ thống bài tập, phân loại rõ ràng các dạng bài tập về kim loại
chuyển tiếp để làm tài liệu phục vụ cho học sinh và giáo viên trường chuyên học tập.
giảng dạy, ôn luyện, bồi dưỡng trong các kì thi học sinh giỏi các cấp. Ngoài ra còn là tài
liệu tham khảo mở rộng và nâng cao cho giáo viên môn hóa học và học sinh yêu thích môn hóa học nói chung.
- Đề xuất phương pháp xây dựng và sử dụng có hiệu quả hệ thống bài tập hóa học.
PHẦN B: MỘT SỐ DẠNG BÀI TẬP BỒI DƯỠNG HỌC SINH GIỎI PHẦN KIM LOẠI CHUYỂN TIẾP
I. BÀI TẬP TINH THỂ KIM LOẠI VÀ HỢP KIM
Trong chương trình phổ thông chuyên và đề thi HSG các cấp, phần hoá học tinh thể
kim loại là một phần khá lí thú, trừu tượng và hay gặp. Khi học về phần này, nếu chỉ sử
dụng sách giáo khoa và một số sách tham khảo thì học sinh khó hình dung và khó áp
dụng các kiến thức vào giải các BTHH có liên quan. Do đó, để giúp hoc sinh tiếp cận
kiến thức về cấu trúc tinh thể kim loại một cách cụ thể và biết áp dụng vào giải các bài
tập liên quan, chúng tôi đưa ra chuyên đề về cấu trúc tinh thể kim loại. A. LÝ THUYẾT 1. Tinh thể: 1.1. Khái niệm
Tinh thể là những chất có sự sắp xếp tuần hoàn, đều đặn các yếu tố cấu tạo (các
nguyên tử, các ion, các phân tử) dẫn đến sự tồn tại các mặt và các góc xác định giữa các mặt đó.
Ví dụ: Oxit kim loại: FeO ( Fe2+; O2- ) được cấu tạo từ ion Fe2+ và O2-
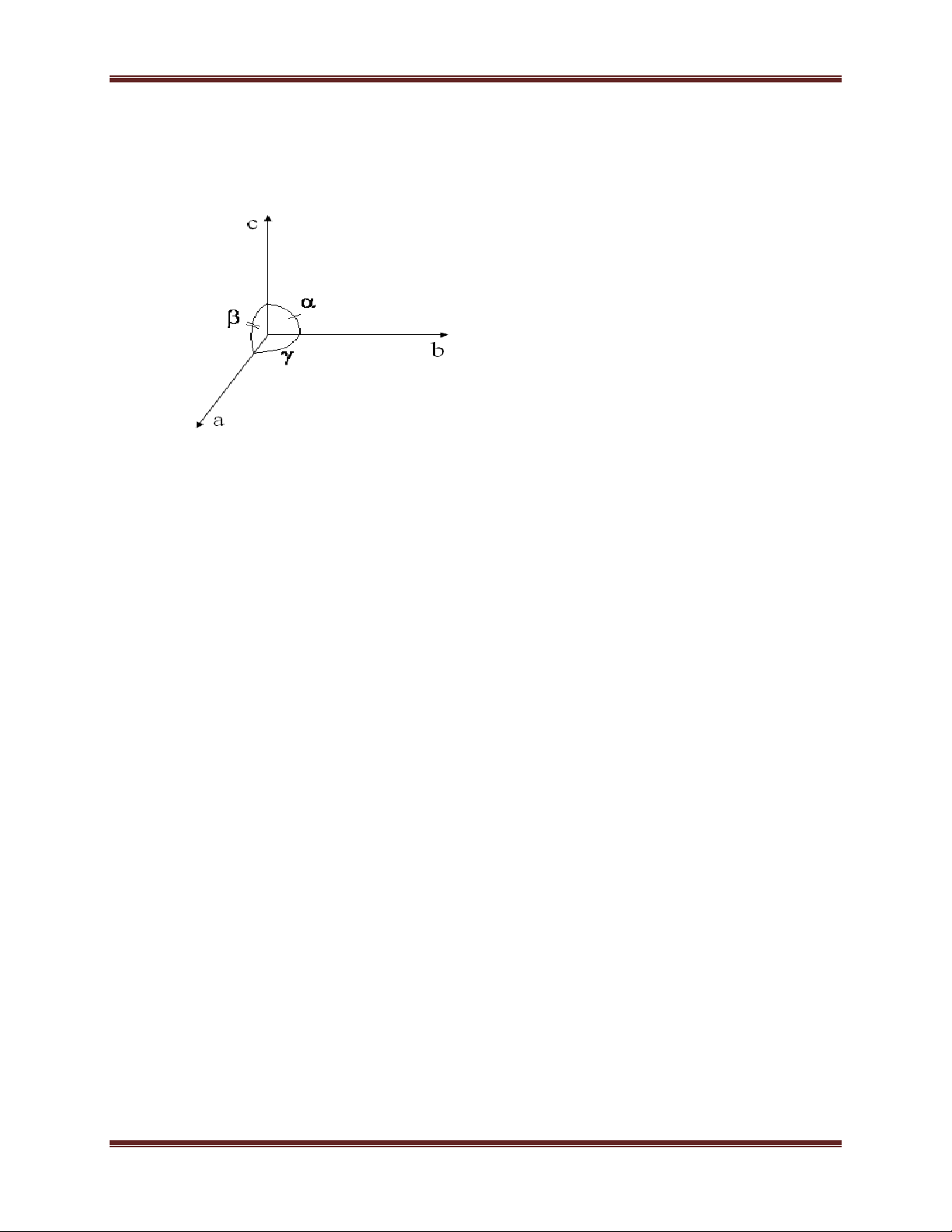
1.2. Ô mạng đơn vị, mạng tinh thể, ba trục tinh thể học
- Một hình khối không gian nhỏ nhất, có đối xứng cao nhất, có số góc vuông nhiều
nhất, có thể tích bé nhất được gọi là ô mạng đơn vị. 3 Chuyên đề Kim loại
- Sự sắp xếp không gian theo quy luật các ô mạng đơn vị sẽ tạo ra mạng tinh thể tương ứng.
- Một mạng lưới không gian có thể xem như những hình hộp tạo thành bởi các véctơ tịnh tiến.
- Trong mạng lưới không gian, các hạt chiếm giữ các điểm mạng được gọi là nút lưới.
- Thông thường trong tinh thể học, người ta chọn hệ tọa độ mà cả ba trục đi qua một
điểm mạng trùng với phương của các cạnh hình hộp. Một hình hộp cơ sở được gọi là
một tế bào cơ bản ( tế bào cơ sở).
* Cấu trúc tinh thể: Mạng lưới tinh thể (cấu trúc tinh thể) là mạng lới không gian ba
chiều trong đó các nút mạng là các đơn vị cấu trúc (nguyên tử , ion, phân tử ...).
- Tinh thể kim loại - Tinh thể ion
- Tinh thể nguyên tử (Hay tinh thể cộng hoá trị) - Tinh thể phân tử
* Khái niệm về ô cơ sở:
Là mạng tinh thể nhỏ nhất mà bằng cách tịnh tiến nó theo hướng của ba trục tinh thể ta
có thể thu được toàn bộ tinh thể.
Mỗi ô cơ sở được đặc trưng bởi các thông số:
- Hằng số mạng: a, b, c, , ,
- Số đơn vị cấu trúc : n - Số phối trí 4 Chuyên đề Kim loại
- Độ đặc khít: Là tỷ số của thể tích chiếm bởi một quả cầu (V ) trên thể tích của toàn bộ C tế bào cơ bản đó (V TB): V C P N. VTB
N: số quả cầu trong một đơn vị cấu trúc.
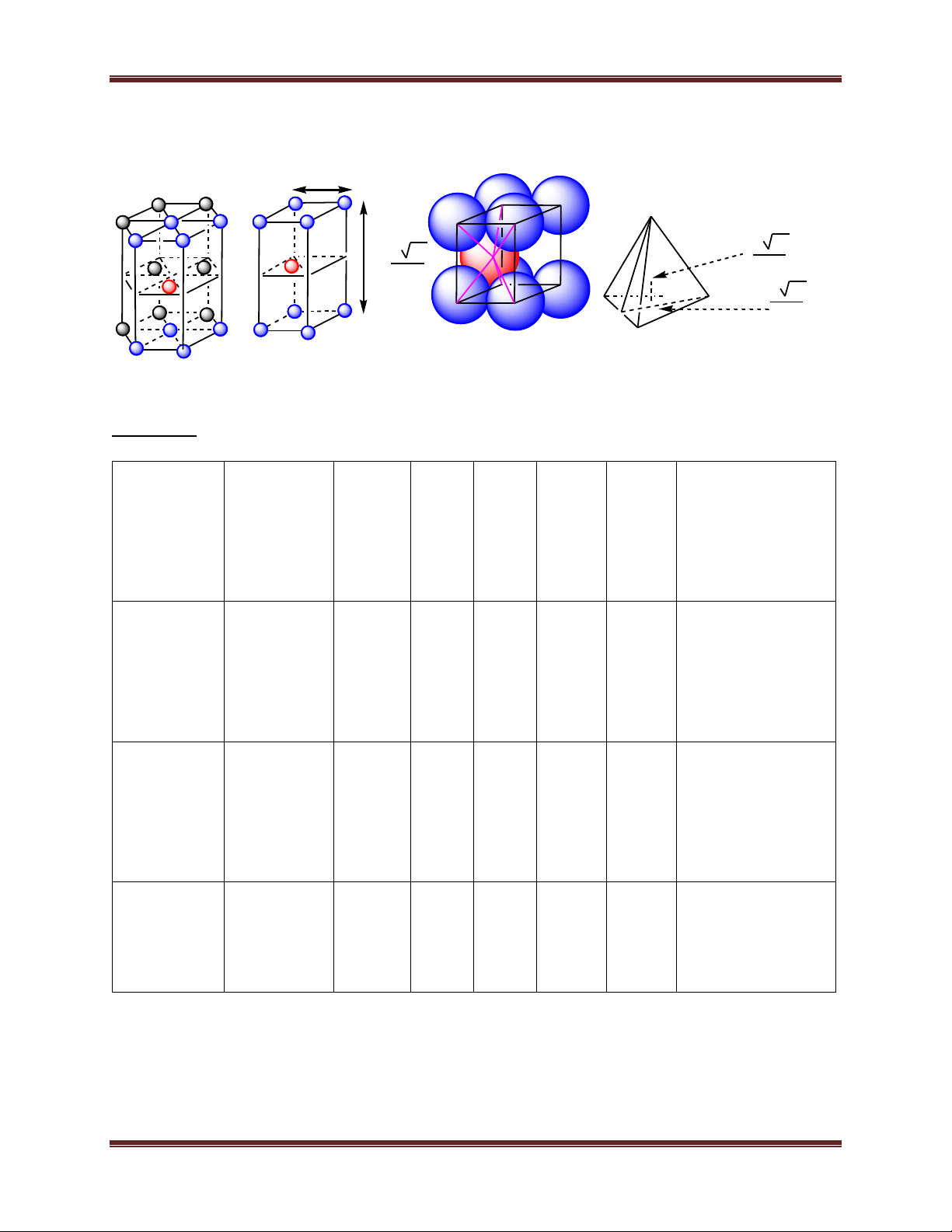
2. Mạng tinh thể kim loại:
1. Một số kiểu mạng tinh thể kim loại.
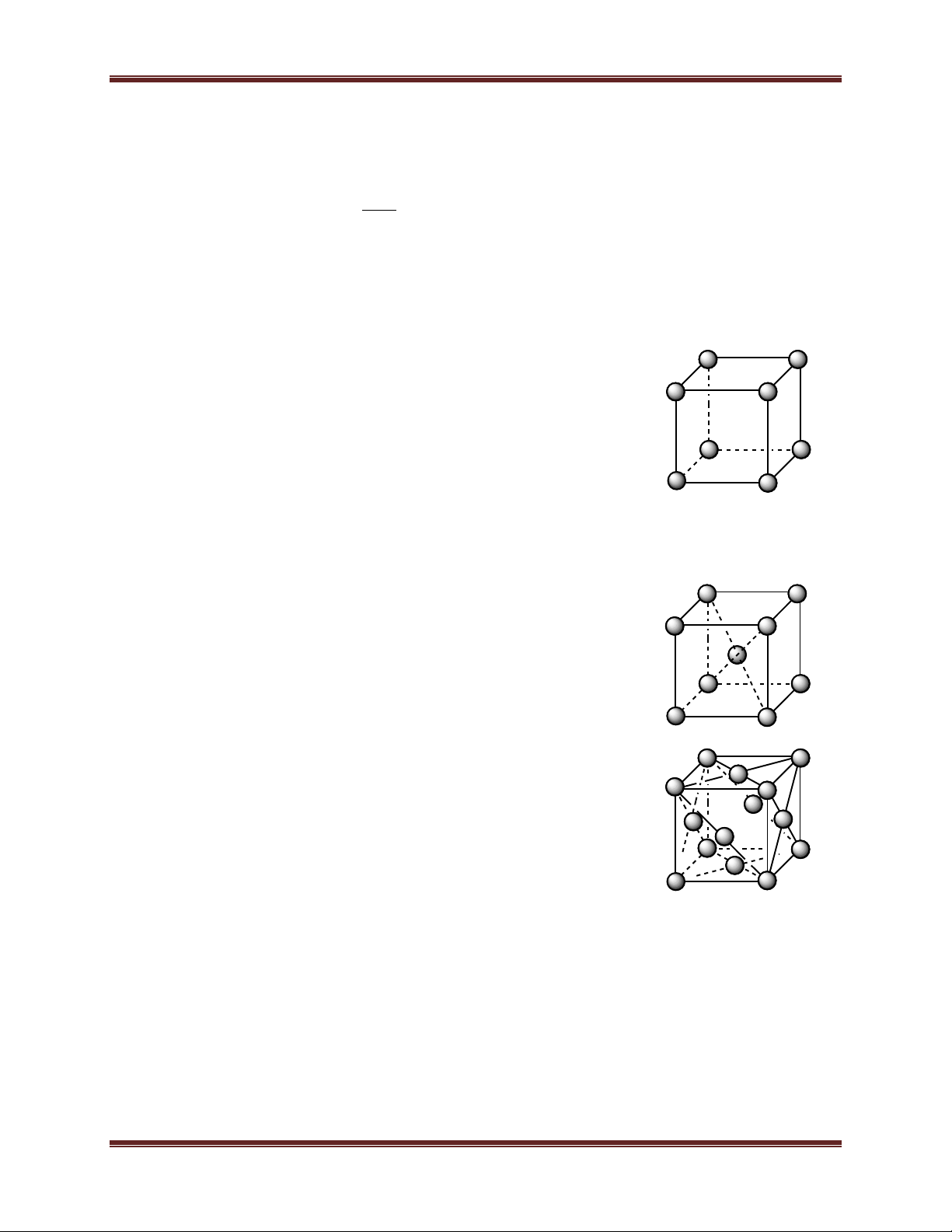
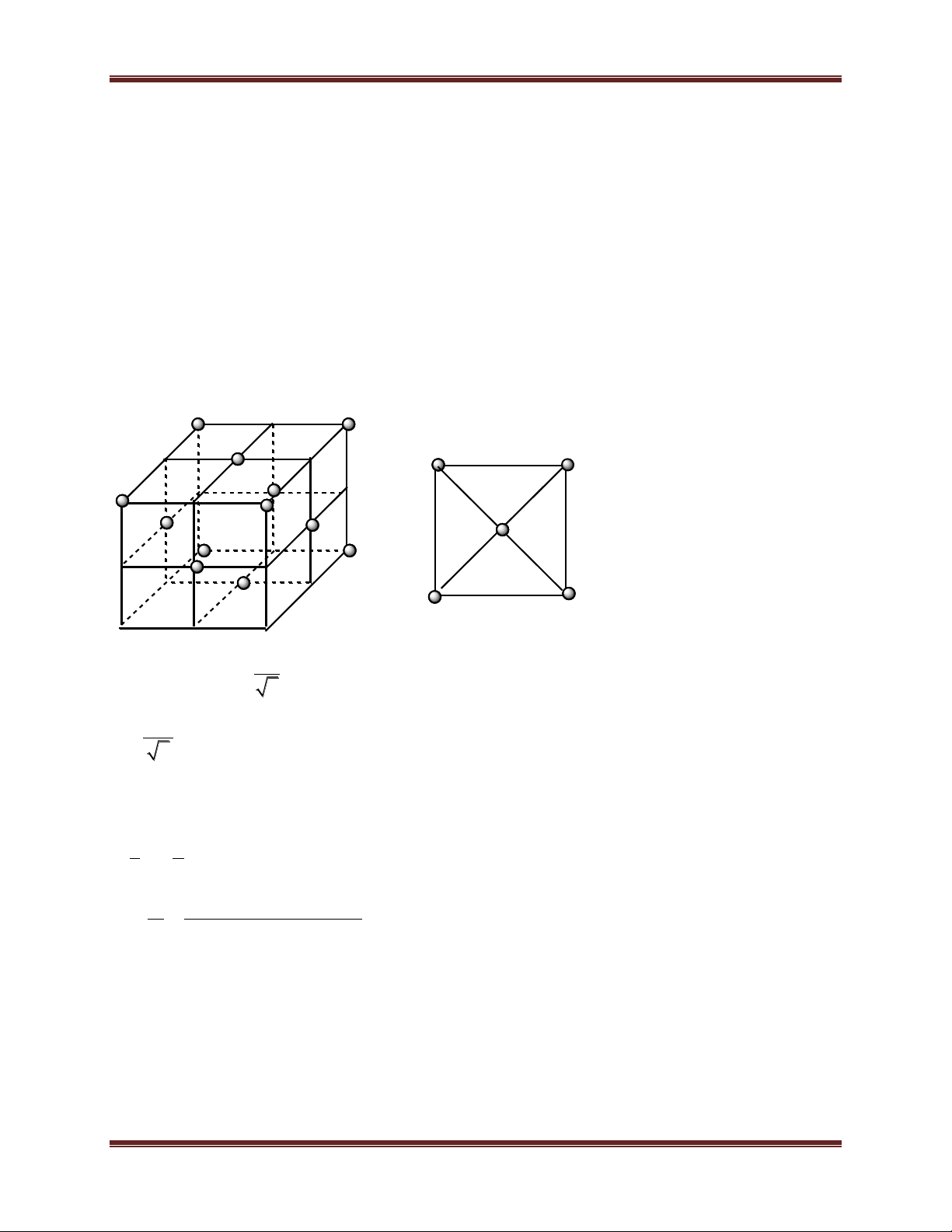
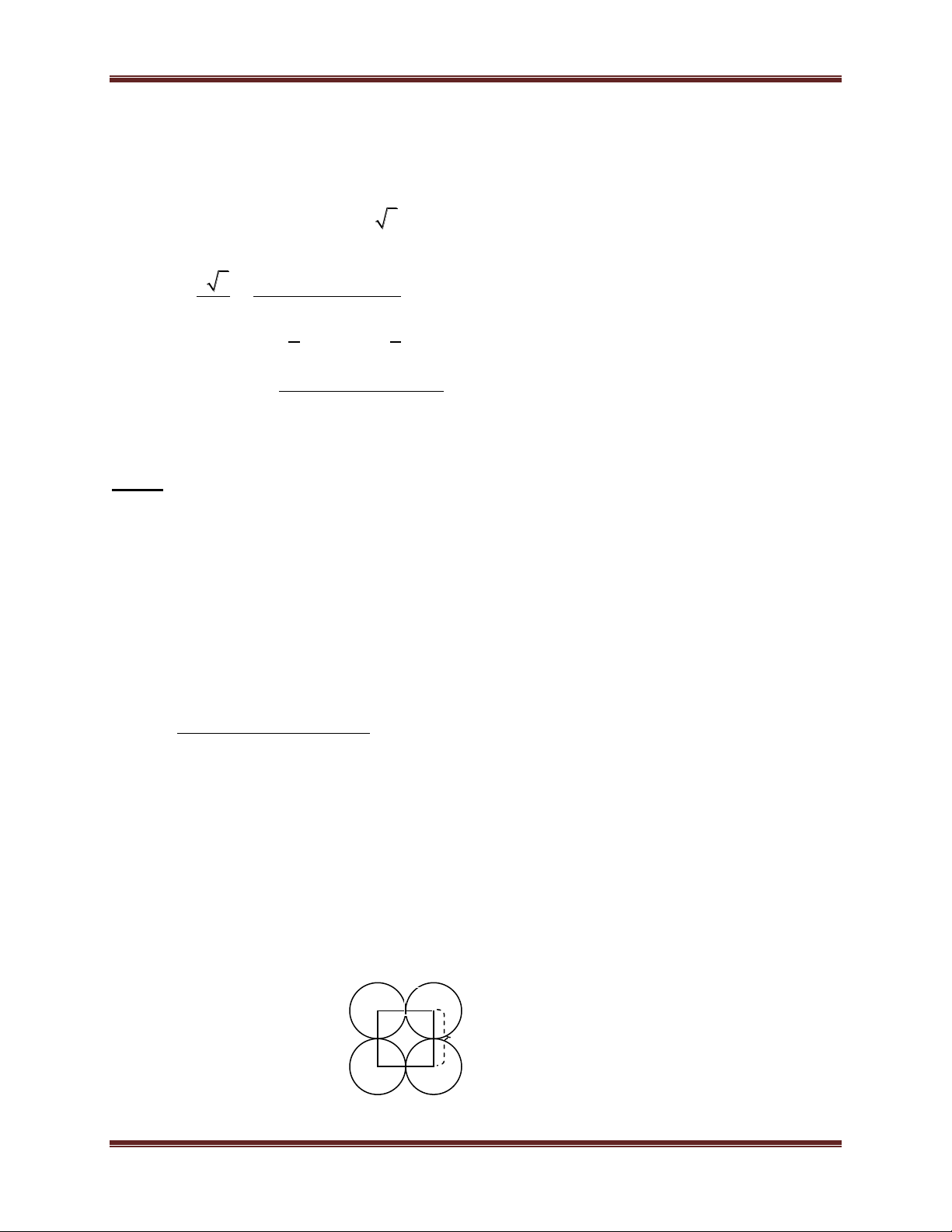
1.1. Mạng lập phương đơn giản:
- Đỉnh là các nguyên tử kim loại hay ion dương kim loại. - Số phối trí = 6.
- Số đơn vị cấu trúc: 1
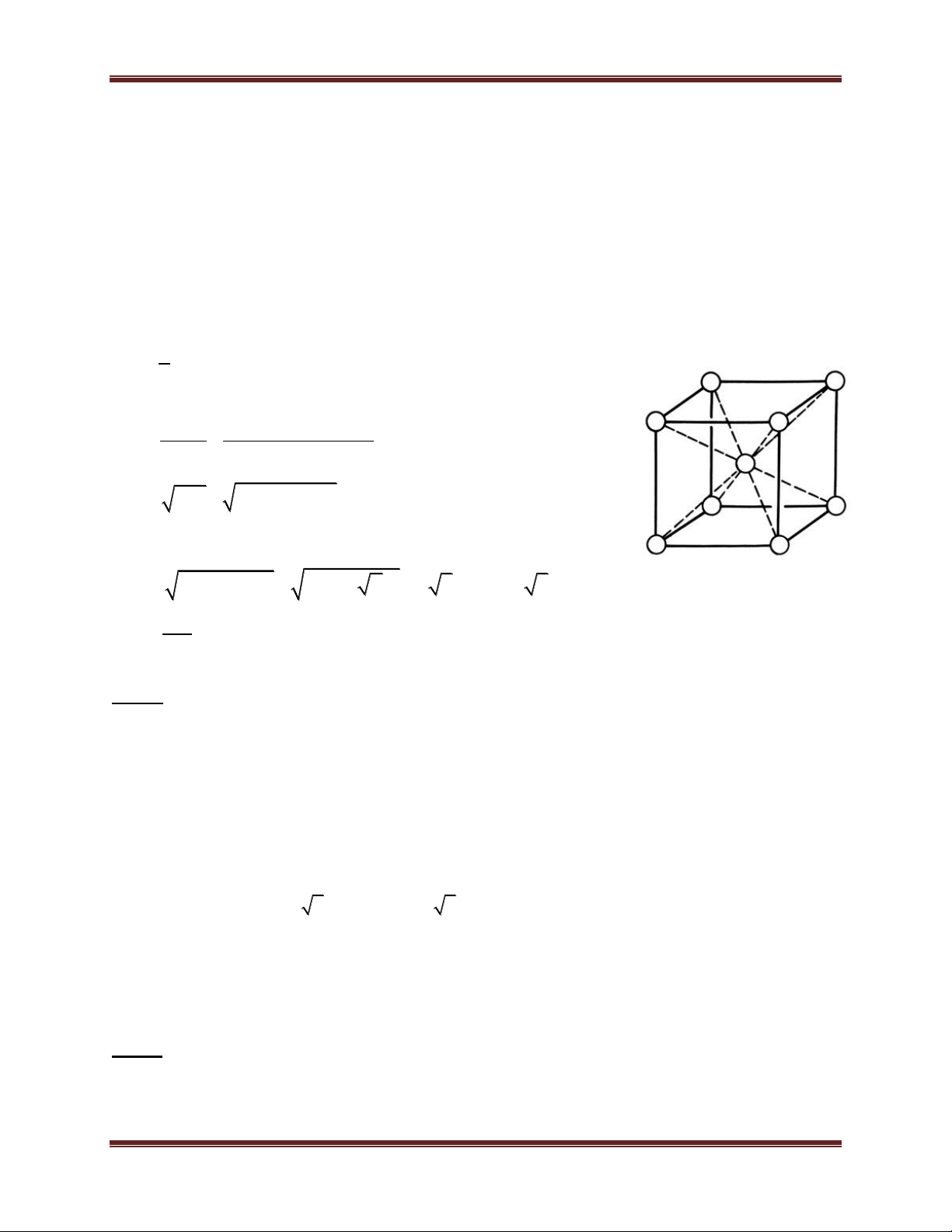
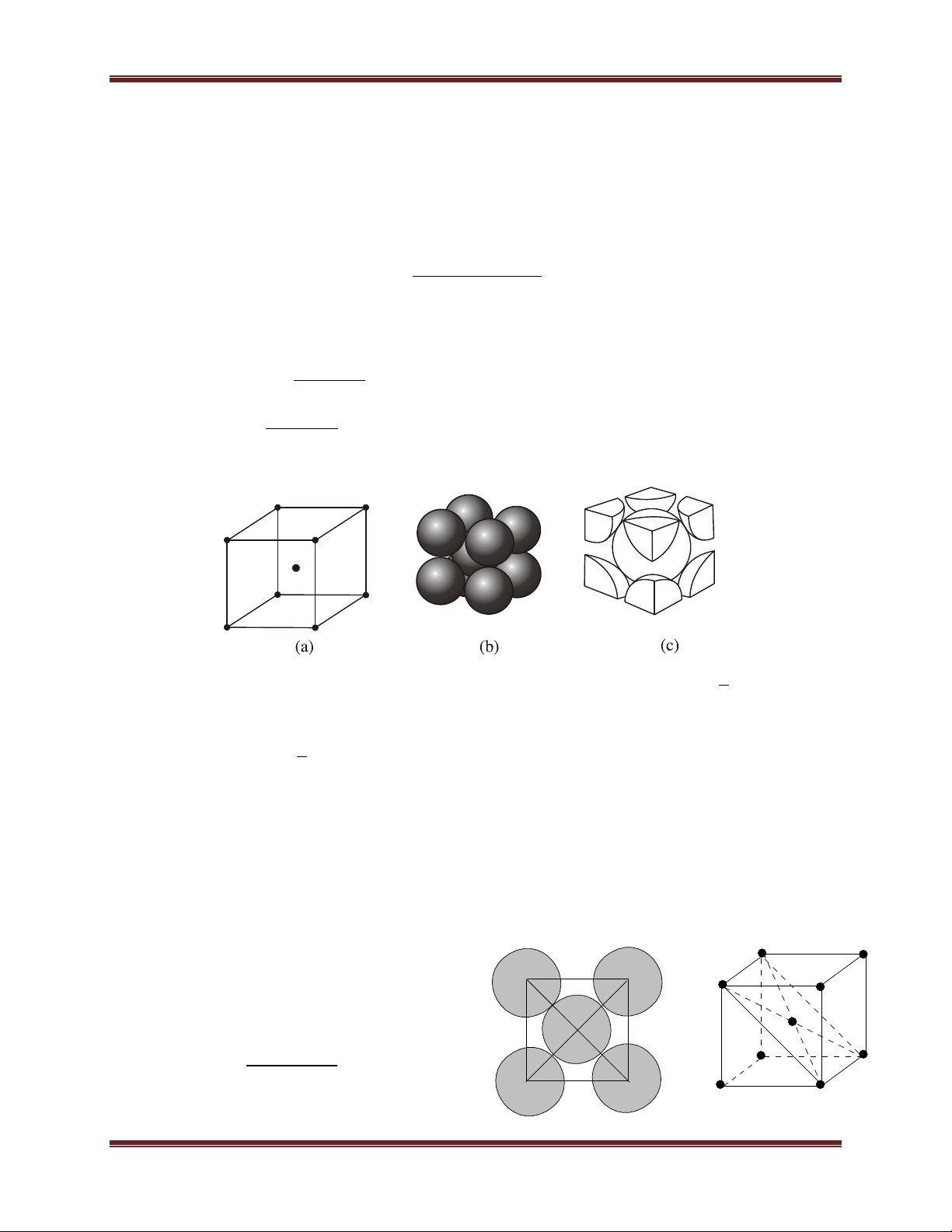
1.2. Mạng lập phương tâm khối:
- Đỉnh và tâm khối hộp lập phương là nguyên tử hay ion dương kim loại. - Số phối trí = 8.
- Số đơn vị cấu trúc: 2
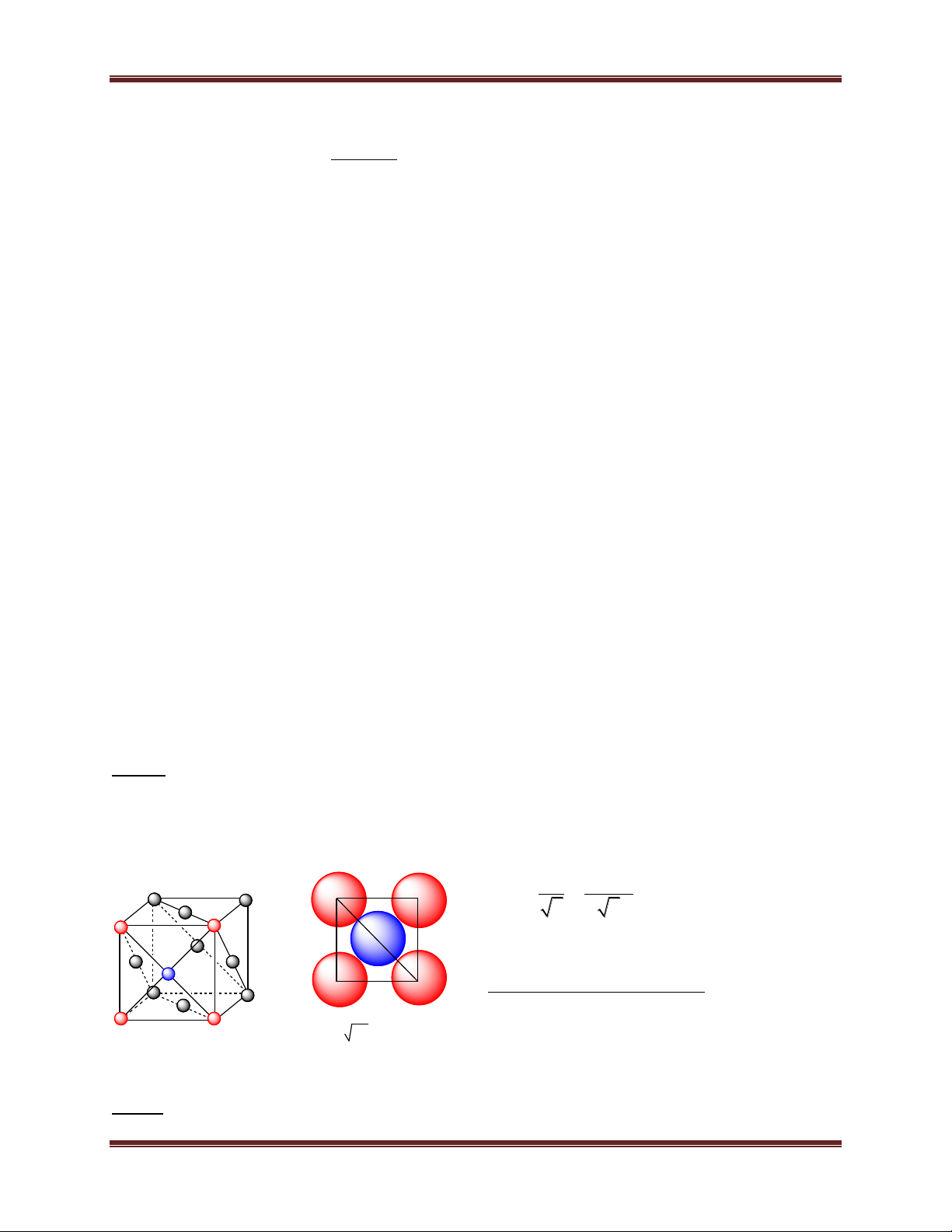
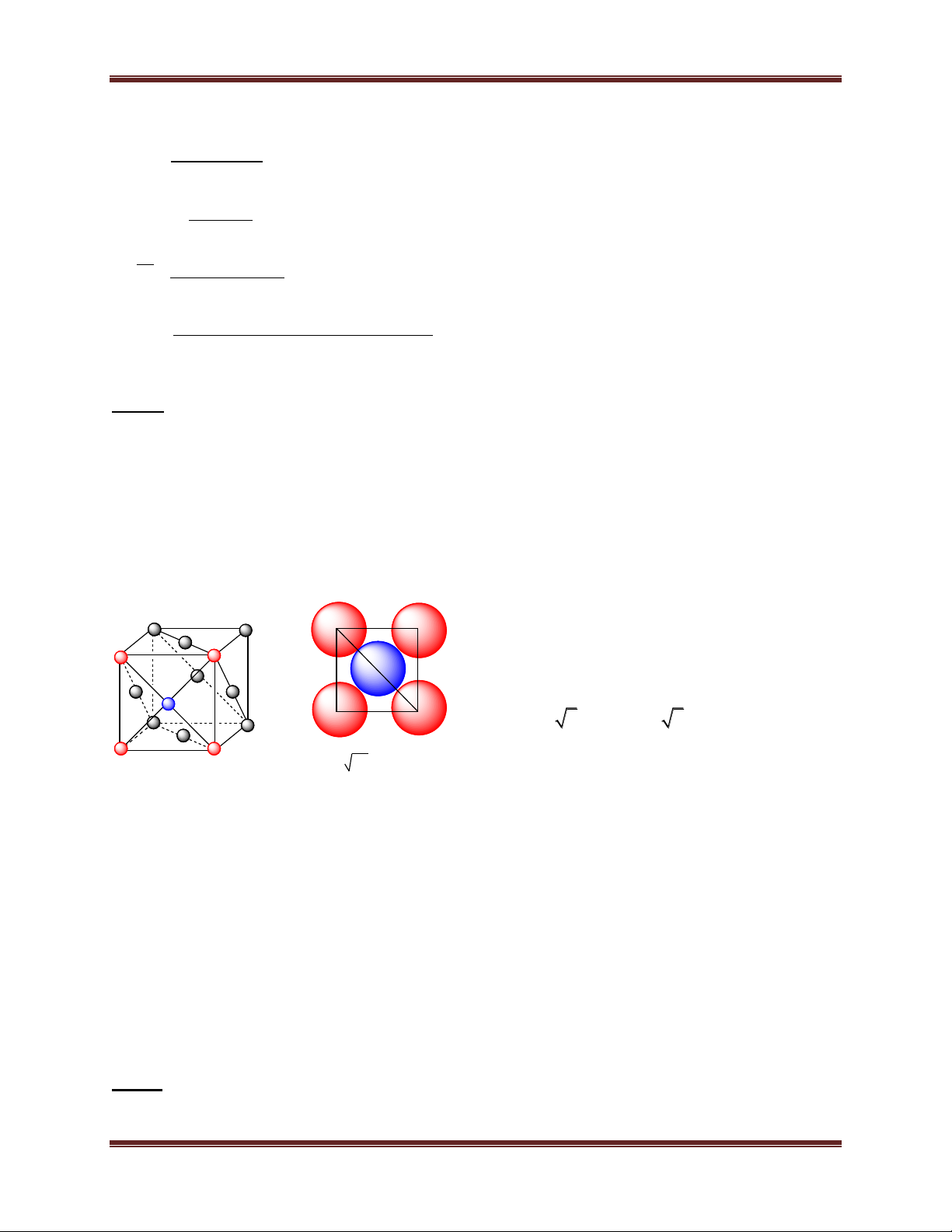
1.3. Mạng lập phương tâm diện
- Đỉnh và tâm các mặt của khối hộp lập phương là các
nguyên tử hoặc ion dương kim loại. - Số phối trí = 12.
- Số đơn vị cấu trúc:4
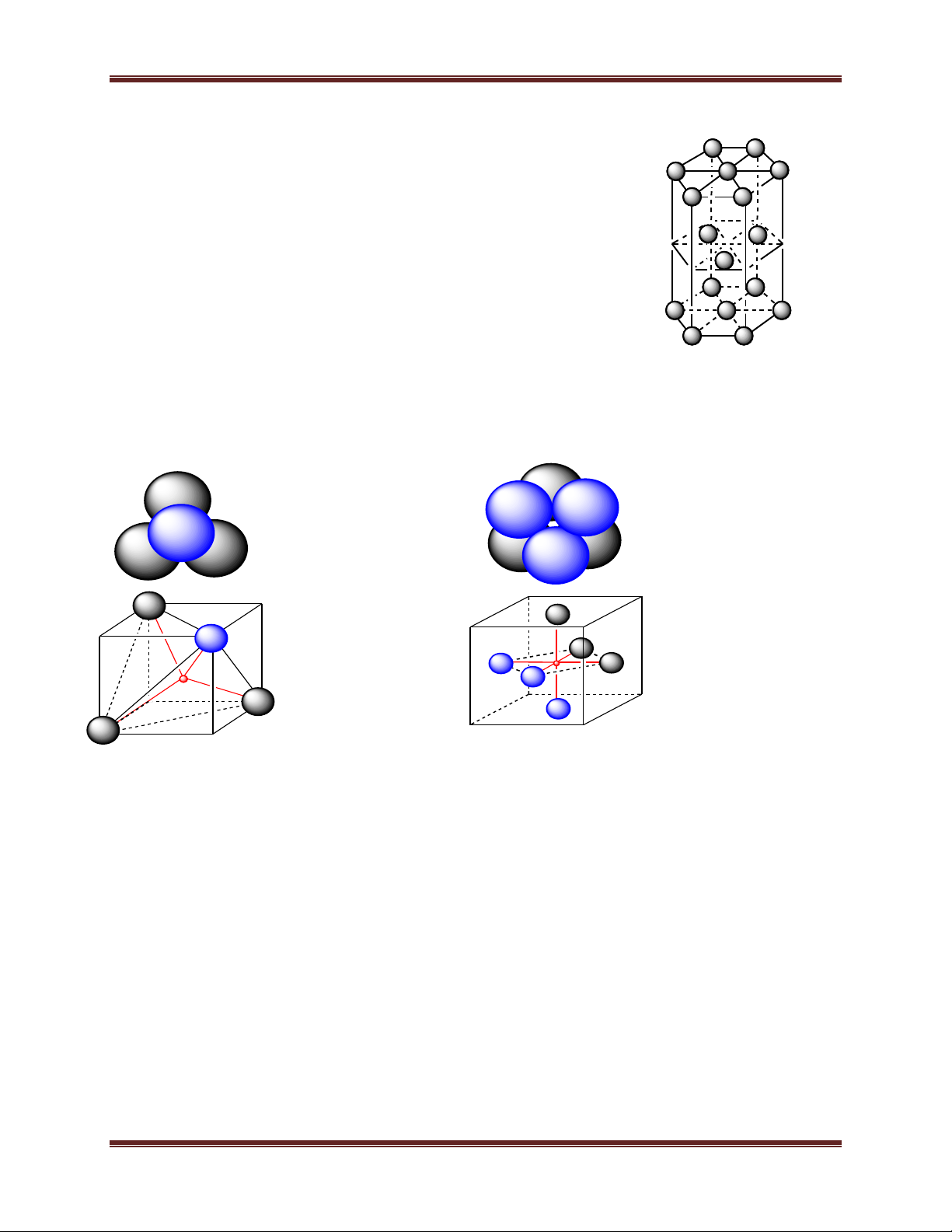
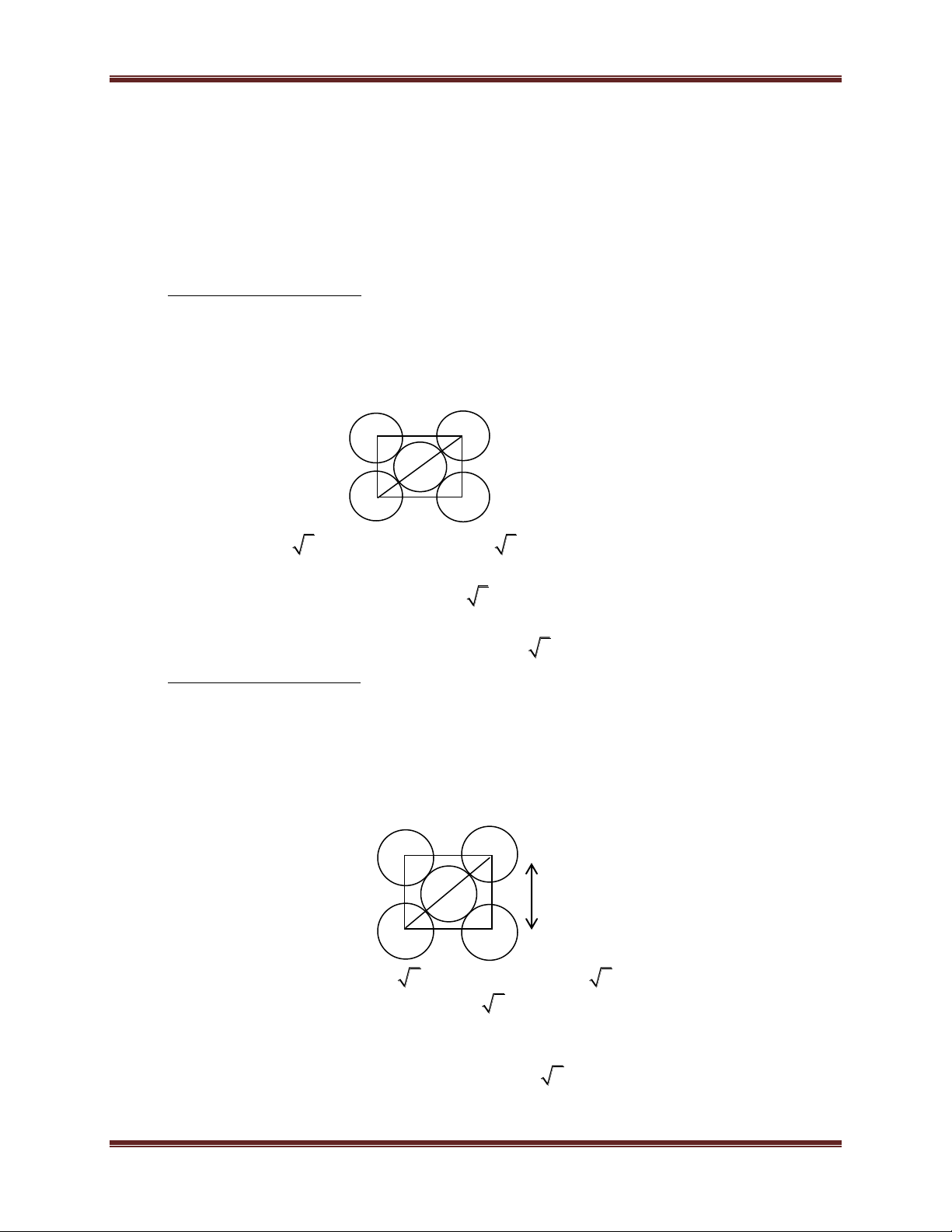
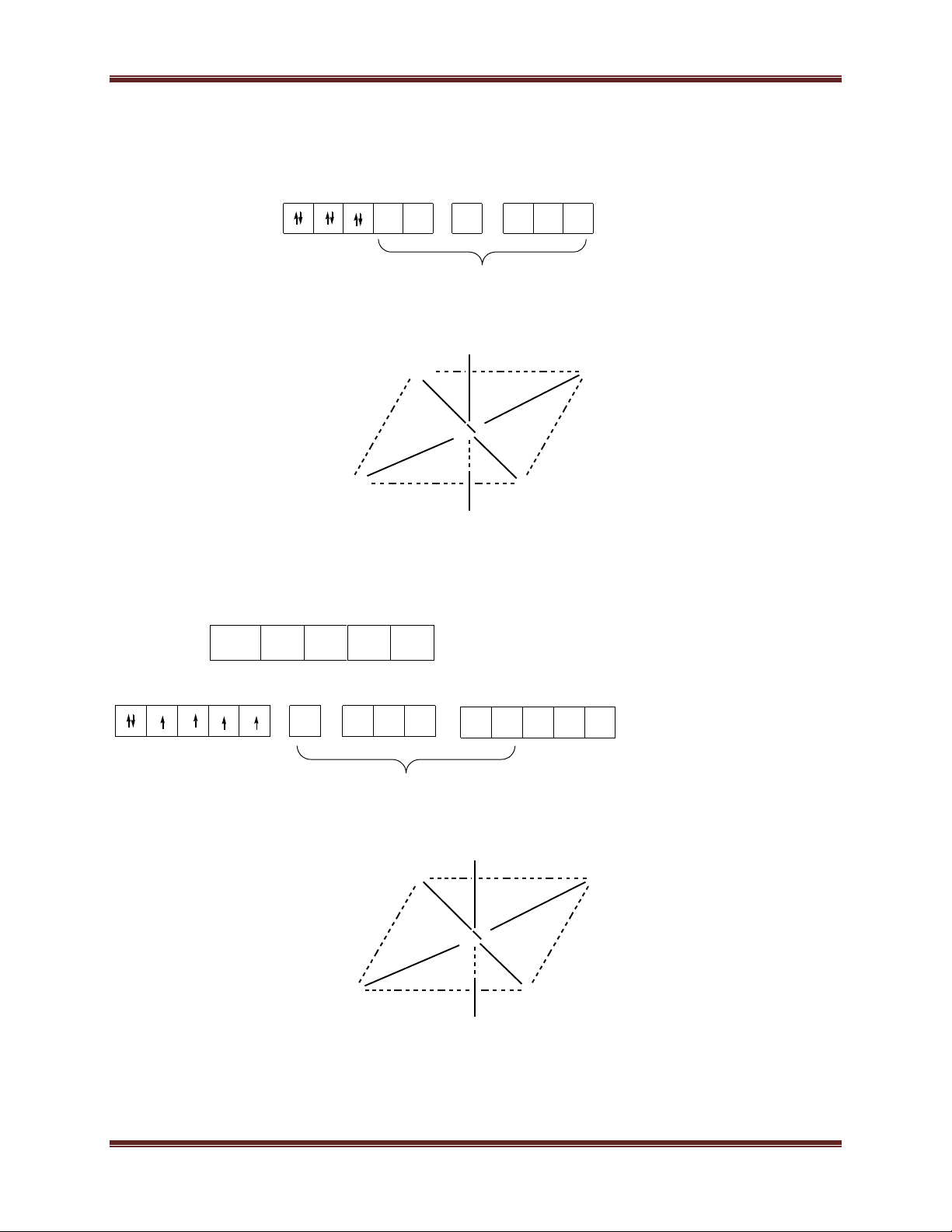
1.4. Mạng sáu phương đặc khít (mạng lục phương):
- Khối lăng trụ lục giác gồm 3 ô mạng cơ sở. Mỗi ô mạng
cơ sở là một khối hộp hình thoi. Các đỉnh và tâm khối hộp hình
thoi là nguyên tử hay ion kim loại. - Số phối trí = 12.
- Số đơn vị cấu trúc: 2 5 Chuyên đề Kim loại
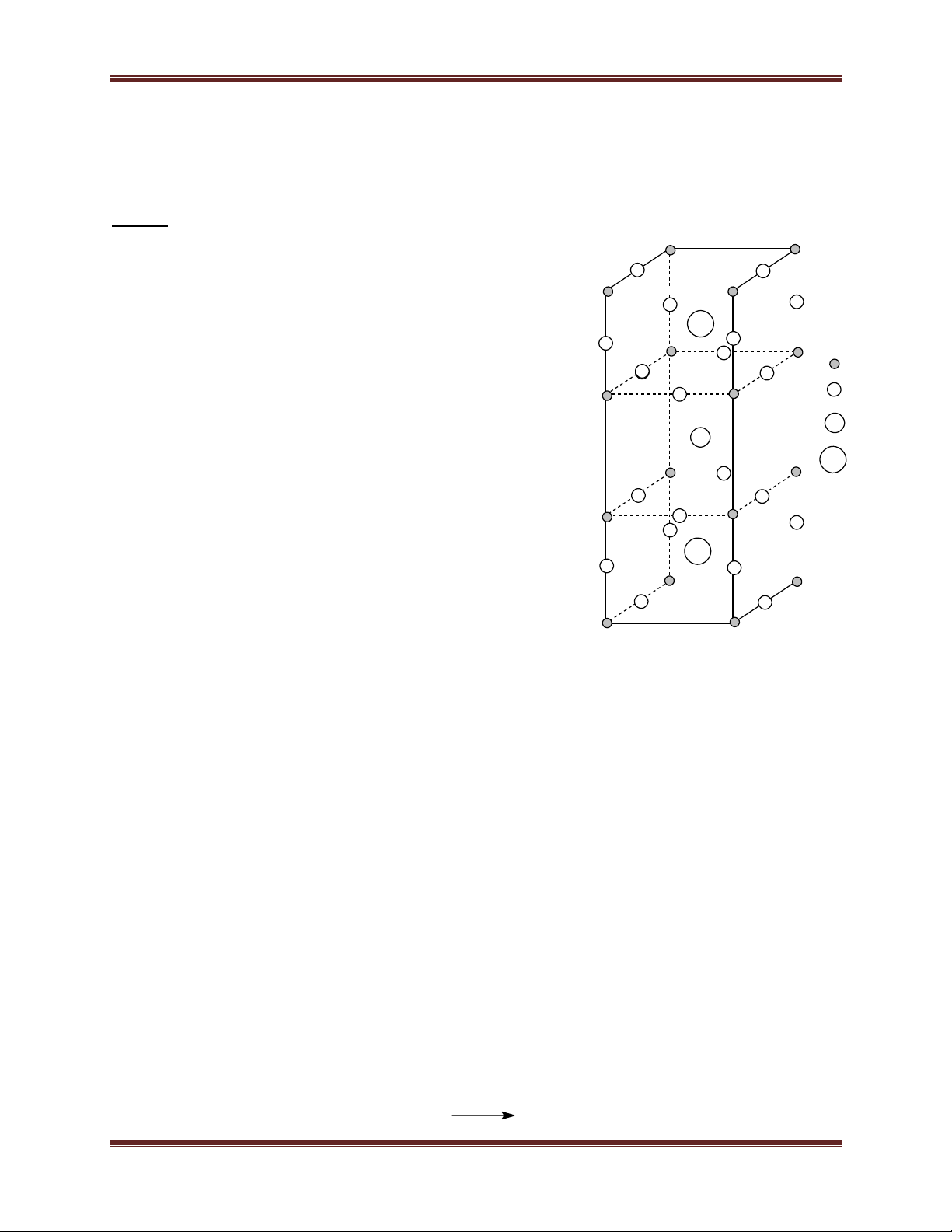
2. Hốc tứ diện, hốc bát diện, độ đặc khít của các loại mạng tinh thể, khối lượng riêng của kim loại
2.1. Hốc tứ diện và hốc bát diện Hèc b¸t diÖn Hèc tø diÖn
a) Mạng lập phương tâm mặt: - Hốc tứ diện là 8
- Hốc bát diện là: 1 + 12.1/4 = 4
b) Mạng lục phương chặt khít: - Hốc tứ diện là 4
- Hốc bát diện là: 1 + 12.1/4 = 2
2.2. Độ đặc khít của mạng tinh thể
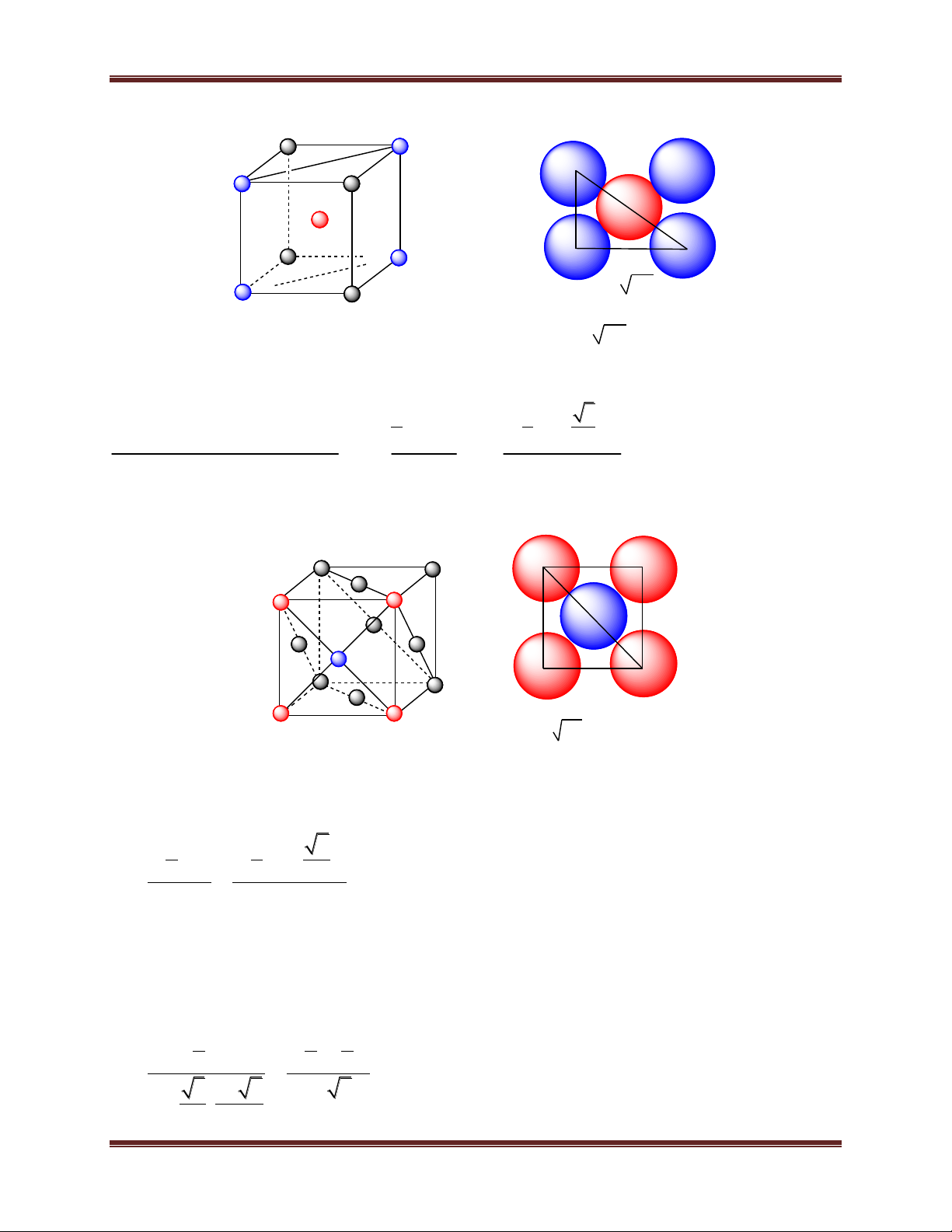
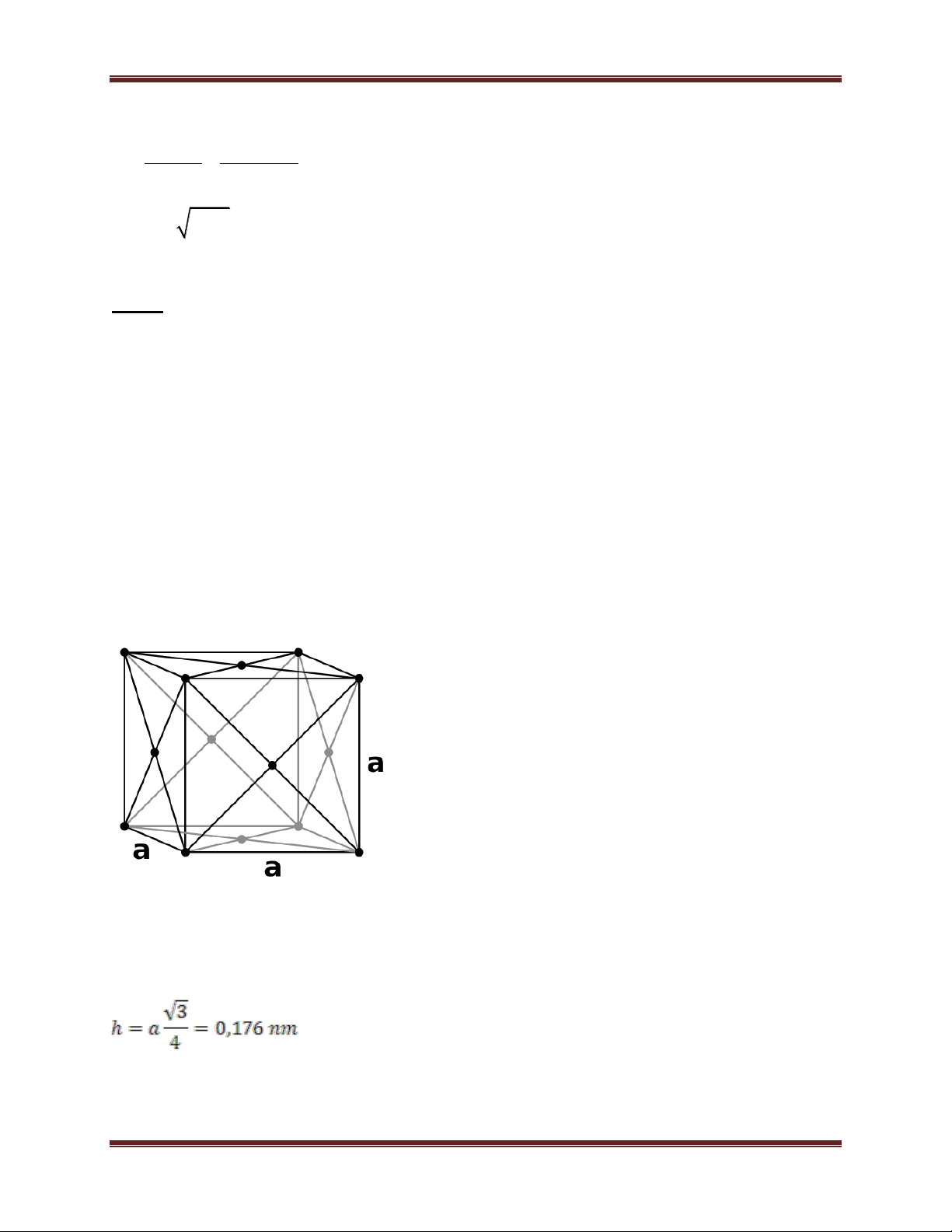
a) Mạng tinh thể lập phương tâm khối 6 Chuyên đề Kim loại a a 2 a 3 = 4r
Số quả cầu trong một ô cơ sở : 1 + 8. 1/8 = 2
Tổng thể tích quả cầu 4 4 3 3 2. .r 3 2. .(a ) 3 3 4 = = = 68%
Thể tích của một ô cơ sở a3 a3
b) Mạng tinh thể lập phương tâm diện a a a 2 = 4.r
Số quả cầu trong một ô cơ sở : 6. 1/2 + 8. 1/8 = 4
Tổng thể tích quả cầu 4 4 2 3 3 2. r 2. ( . a ) 3 3 4 74% 3 3 a a
Thể tích của một ô cơ sở
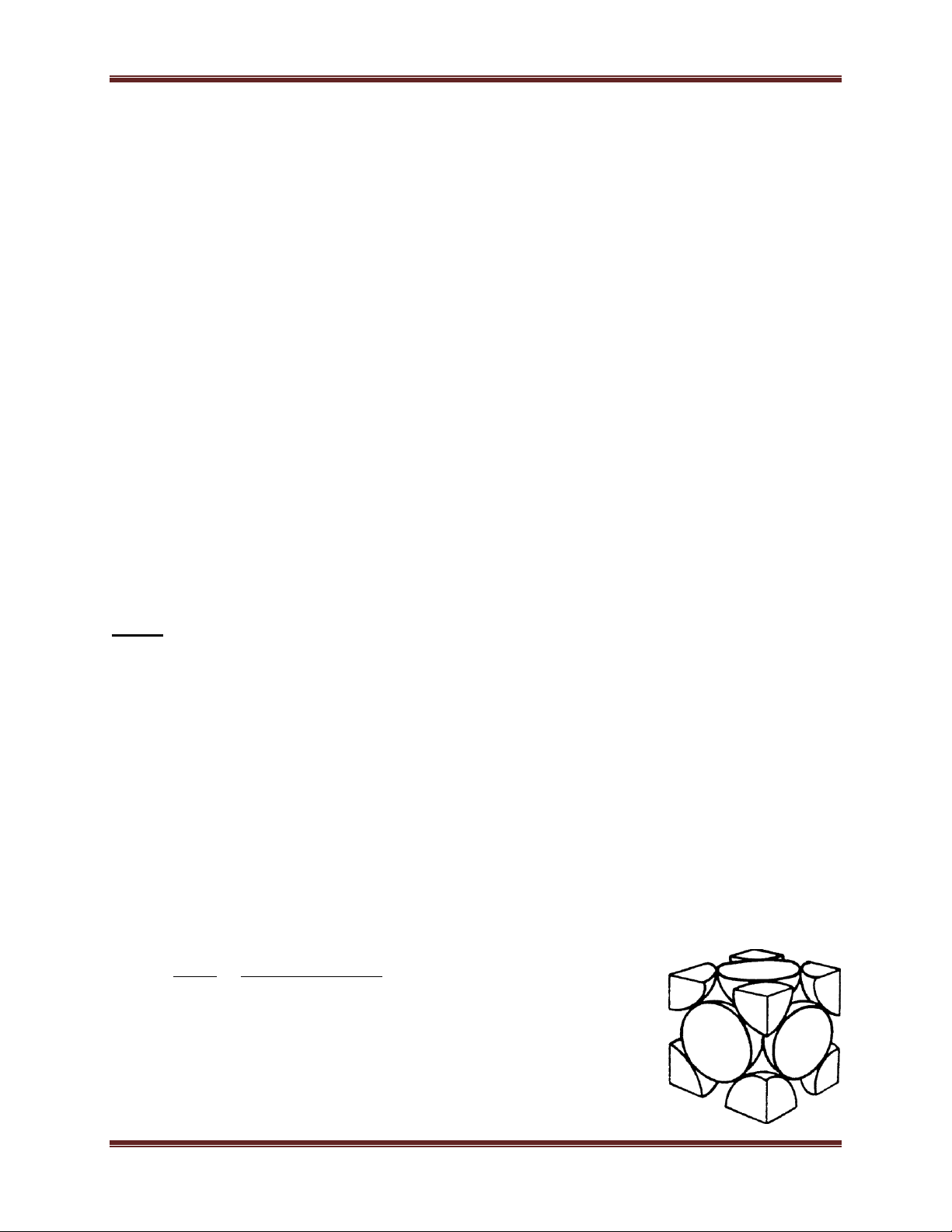
c) Mạng tinh thể lục phương chặt khít
Số quả cầu trong một ô cơ sở: 4. 1/6 + 4. 1/12 + 1 = 2. Tổng thể tích quả cầu 4 4 a 3 3 2. r 2. ( ) 3 3 2 74% 3 3 2a 6 a . 2 . a . a . 2 2 7 Chuyên đề Kim loại
Thể tích của một ô cơ sở a a 6 2a 6 a a b= 3 3 a 3 a 2 a a ¤ c¬ së a = 2.r
Nhận xét: Bảng tổng quát các đặc điểm của các mạng tinh thể kim loại Cấu trúc Hằng số Số đv Số Số Số Độ Kim loại mạng cấu phối hốc hốc O đặc trúc (n) trí T khít (%) Lập ===90o 2 8 - - 68 Kim loại kiềm, phương a=b=c Ba, Fe, V, Cr, tâm khối … (lptk:bcc) Lập ===90o 4 12 8 4 74 Au, Ag, Cu, Ni, phương a=b=c Pb, Pd, Pt, … tâm diện (lptd: fcc) Lục == 90o 2 12 4 2 74 Be, Mg, Zn, Tl, phương đặc =120o Ti, … khít (hpc) a≠b≠c
2.3. Khối lượng riêng của kim loại
Công thức tính khối lượng riêng của kim loại 8 Chuyên đề Kim loại 3.M .P D = 3
(*) hoặc D = (n.M) / (NA.V1 ô ) 4 r .N A
M : Khối lượng kim loại (g) ; N : Số Avogađro, n: số nguyên tử trong 1 ô cơ sở. A
P : Độ đặc khít (mạng lập phương tâm khối P = 68%; mạng lập phương tâm diện,
lục phương chặt khít P = 74%)
r : Bán kính nguyên tử (cm), V
: thể tích của 1 ô mạng. 1 ô
3. Nghiên cứu cấu trúc tinh thể bằng tia X
- Nhiễu xạ tia X là phương pháp xác định cấu trúc tinh thể.
- Sự nhiễu xạ là hiện tượng giao thoa giữa của các tia phóng xạ tới các mặt phẳng nút của tế bào. - Phương trình Bragg: 2.d.sin θ n.λ
d: khoảng cách giữa 2 mặt phẳng song song
n: bậc nhiễu xạ (1, 2, 3 ... )
θ : góc tạo bởi tia tới với mặt phẳng tinh thể λ : bước sóng
B. BÀI TẬP ÁP DỤNG
1. Bài tập cơ bản
Bài 1: Tính khối lượng riêng của tinh thể Ni, biết Ni kết tinh theo mạng tinh thể lập 0
phương tâm mặt và bán kính của Ni là 1,24 A . Hướng dẫn giải: 0 4r 4.1, 24 a = 3,507( ) A ; P = 0,74 2 2 a
Khối lượng riêng của Ni: 3.58, 7.0, 74 a =9,04 (g/cm3) 8 3 23 4.3,14.(1, 24.10 ) .6, 02.10 a 2 = 4.r
Bài 2: Người ta biết nguyên tố vonfram (W) có dạng tinh thể lập phương tâm khối. Hãy: 9 Chuyên đề Kim loại
1) Vẽ mạng lưới tế bào cơ sở của tinh thể này và cho biết số nguyên tử W trong ô mạng. o
2) Xác định bán kính nguyên tử W theo A biết rằng khối lượng riêng của W là 19,30 g/cm3 Hướng dẫn giải:
1) Số nguyên tử trong ô mạng là: 1 A
n .81 2 ( nguyên tử) 8
2) Thể tích tế bào cơ sở là: n .M 2 x183,9 2 3 3 V 3,164x10 (cm ) C TB 23 N .d 6,023 x 10 x19,3 a A o 2 3 8 3 3
a V 3,164x10 3,163x10 cm3,163 A TB D B Độ dài cạnh AB là: o 2 2 2 2 AB D A D B
a +(a 2) a 3 3,163. 3 5,748(A) o AB r 1 ,37A 4
Bài 3: Đồng kết tinh theo kiểu lập phương tâm diện.
a) Tính cạnh của hình lập phương của mạng tinh thể và khoảng cách ngắn nhất giữa hai
tâm của hai nguyên tử đồng trong mạng, biết nguyên tử đồng có bán kính bằng 1,28A0.
b) Tính khối lượng riêng của đồng theo g/ cm3. Cho Cu = 64. Hướng dẫn giải:
Bán kính nguyên tử Cu là: r = 1,28.10-8 cm.
Từ công thức: 4.r = a 2 a= 4.r / 2 = (4.1,28.10-8 )/1,41 = 3,63.10-8 cm.
Khoảng cách ngắn nhất giữa 2 tâm của hai nguyên tử đồng trong mạng. 2.r = 2,56.10-8 cm.
Khối lượng riêng: D = (n.M) / (NA.V1 ô ) = 8,896 g/cm3.
Bài 4: Vàng (Au) kết tinh ở dạng lập phương tâm mặt có cạnh của ô mạng cơ sở a = 407 pm (1pm = 10-12 m).
a) Tính khoảng cách nhỏ nhất giữa hạt nhân của 2 nguyên tử Au? 10 Chuyên đề Kim loại
b) Xác định số phối trí của nguyên tử Au.
c) Tính khối lượng riêng của tinh thể Au.
d) Tính độ khít của tinh thể Au.
Biết Au = 196,97 ; N = 6,022.1023. Hướng dẫn giải:
Cấu trúc tinh thể 1 ô mạng cơ sở của Au:
a) Tính khoảng cách ngắn nhất giữa 2 hạt nhân Au: Mặt ô mạng: AO = 2R = d A a B a O C D a 2 2 2d a d 2 407 d
287,79 (pm) = 2,8779.10-8 (cm) 2
b) Số phối thể của nguyên tử Au là 12
c) Trong 1 ô mạng cơ sở có số nguyên tử Au: 1 1 8. 6. 4 nguyên tử 8 2 m 4.196,97 D (g/cm3) V 6, 022.10 .4,07.10 19, 4 3 23 8 d) 8 d 2R 2,8779.10 (cm) 8 R 1, 43895.10 (cm)
Độ đặc khít của tinh thể 11 Chuyên đề Kim loại 3 4 4. .3,14. 8 1, 43895.10 3 Au 4,07.10 .100% 74% 3 8
độ khít của tinh thể Au = 74%
Bài 5: Từ nhiệt độ phòng đến 1185K sắt tồn tại ở dạng Fe với cấu trúc lập phương
tâm khối, từ 1185K đến 1667K ở dạng Fe với cấu trúc lập phương tâm diện. ở 293K sắt
có khối lượng riêng d = 7,874g/cm3.
a) Hãy tính bán kính của nguyên tử Fe.
b) Tính khối lượng riêng của sắt ở 1250K (bỏ qua ảnh hưởng không đáng kể do sự dãn nở nhiệt).
Thép là hợp kim của sắt và cacbon, trong đó một số khoảng trống giữa các nguyên
tử sắt bị chiếm bởi nguyên tử cacbon. Trong lò luyện thép (lò thổi) sắt dễ nóng chảy khi
chứa 4,3% cacbon về khối lượng. Nếu được làm lạnh nhanh thì các nguyên tử cacbon vẫn
được phân tán trong mạng lưới lập phương nội tâm, hợp kim được gọi là martensite cứng
và dòn. Kích thước của tế bào sơ đẳng của Fe không đổi.
c) Hãy tính số nguyên tử trung bình của C trong mỗi tế bào sơ đẳng của Fe với hàm lượng của C là 4,3%.
d) Hãy tính khối lượng riêng của martensite. (cho Fe = 55,847; C = 12,011; số N = 6,022. 1023 ) Hướng dẫn giải:
a) Số nguyên tử Fe trong một mạng cơ sở lập phương tâm khối là: 2 0 m 2.55,847 2.55,847 8 d a 3
2,87.10 cm 2,87 A Fe 23 3 23 V 6, 022.10 .a 6, 022.10 .7,874 0 a 3
a 3 4r r 1,24 A 4
b) ở nhiệt độ 1250 sắt tồn tại dạng Fe với cấu trúc mạng lập phương tâm diện. 0 4.55,847g
Ta có: a 2 2.r 2 2.1, 24 3,51 A ; 3 d 8,58g / cm Fe 23 8 3 6, 022.10 .(3,51.10 ) cm 12 Chuyên đề Kim loại
c) Số nguyên tử trung bình của C trong mỗi tế bào sơ đẳng của Fe là: m %C.m 4,3.2.55,847 C Fe 0,418 12, 011 % . Fe 12, 011 95, 7.12, 011
d) Khối lượng riêng của martensite: (2.55,847 0,418.12,011)g 3 8,20g / cm 23 8 3 6, 022.10 .(2,87.10 ) cm
Bài 6: Crom có cấu tạo mạng lập phương tâm khối. Bán kính nguyên tử Crom là 126pm.
Khối lượng mol nguyên tử crom là 52 g/mol. Xác định khối lượng riêng của crom và
độ đặc khít của mạng tinh thể trên. Hướng dẫn giải:
Số nguyên tử crom trong mạng tinh thể = 1 + 8. 1 = 2 nguyên tử 8
Mạng lập phương tâm khối: 4r = a r
3 → a = 4 = 2,90985.10-8 (cm) 3
Khối lượng riêng của Crom: m 2.MCr d
d = 7,011763842 (g/cm3) 3 V N .a A 4 4 3 3 2. r 2. r
Độ đặc khít mạng lập phương tâm khối = V 3 2nt 3 3 3 V a 4 3 8 mang ( r) 3
Độ đặc khít mạng lập phương tâm khối = 68,01750117% 68%
2. Một số bài tập nâng cao
Bài 1: Một hợp kim vàng - bạc tương ứng với một thành phần đặc biệt ( dung dịch rắn)
và kết tinh dưới dạng lập phương tâm diện với hằng số mạng thu được bằng phương pháp o
nhiễu xạ tia X là 4,08 A . Biết trong hợp kim, vàng chiếm 0,1 phần khối lượng.
a) Tính hàm lượng phần trăm của vàng trong hợp kim
b) Xác định khối lượng riêng của hợp kim khảo sát
Cho: H = 1; Au = 197; Ag = 108; NA = 6,02.1023mol-1 Hướng dẫn giải:
a) Xét với 1 mol Au: Đặt n x mol ( x > 0) Ag n 1+ x (mol) hh 13 Chuyên đề Kim loại 197 Ta có: 0,1 x 1 6,4 ( mol) 197 108x 1 % Au .100% 5,74% 116, 4 197 108.16, 4 b) M 113,12( g/mol) 16, 41 4 . 113,12g/mol 3 d 1 1,07g/cm 23 -1 8 3 6,02.10 .mol .( 4,08 . 10 )
Bài 2: (HSG QG 2007) Thực nghiệm cho biết ở pha rắn, vàng ( Au) có khối lượng riêng
là 19,4 g/cm3 và có mạng lưới lập phương tâm diện. Độ dài cạnh của ô mạng đơn vị là
4,070.10-10 m. Khối lượng mol nguyên tử của vàng là: 196,97 g/cm3.
a) Tính phần trăm thể tích không gian trống trong mạng lưới tinh thể của vàng.
b) Xác định trị số của số Avogadro. Hướng dẫn giải:
- Số nguyên tử trong 1 ô cơ sở: 8.1/8 + 6.1/2 = 4. a - Bán kính nguyên tử Au: a
4.r = a 2 r= a 2 /4= 1,435.10-8 cm a 2 = 4.r
Thể tích bị chiếm bởi các nguyên tử:
Vnguyên tử= 4/3..r3 = 4.4/3.3,14.(1,435.10-8 )3 = 5.10-23 cm3. Thể tích 1 ô đơn vị:
V1ô = a3 = (4,070.10-8 )3 = 6,742.10-23 cm3.
Phần trăm thể tích không gian trống:
(V1ô - Vnguyên tử).100 / Vnguyên tử = 26%.
Trị số của số Avogadro: NA = (n.M)/ ( D.Vô) = 6,02.1023.
Bài 3: (HSG QG 2009) Máu trong cơ thể người có màu đỏ vì chứa hemoglobin ( chất vận
chuyển oxi chứa sắt). Máu của một số động vật nhuyễn thể không có màu đỏ mà cá màu 14 Chuyên đề Kim loại
khác vì chứa kim loại khác ( X). Tế bào đơn vị ( ô mạng cơ sở) lập phương tâm diện của
tinh thể X có cạnh bằng 6,62.10-8 cm. Khối lượng riêng của nguyên tố này là 8920 kg/m3.
a) Tính thể tích của các nguyên tử trong một tế bào và phần trăm thể tích của tế bào bị
chiếm bởi các nguyên tử.
b) Xác định nguyên tố X. Hướng dẫn giải:
Số nguyên tử trong một tế bào: 8.1/8 + 6.1/2 = 4.
Tính bán kính nguyên tử: r = 1,276.10-8 cm.
Thể tích bị chiếm bởi các nguyên tử V nguyên tử = 4.4/3..r3 = 3,48.10-23 cm3.
Thể tích 1 ô mạng cơ sở V 1ô = a3 = 4,7.10-23 cm3.
Phần trăm thể tích tế bào bị chiếm bởi các nguyên tử: 74%.
Khối lượng mol phân tử: M = 63,1 g/mol. Vậy X là đồng.
Bài 4: Khi kết tinh Fe ( ) có dạng tinh thể lập phương tâm khối. o
a) Xác định hằng số mạng a ( A ), biết khối lượng riêng của sắt là 7,95.103 kg/m3
b) So sánh kết quả này với phương pháp nhiễu xạ tia X khi ta chiếu chùm tia o
electron có bước sóng 2 A , nhiễu xạ bậc 1 vào mạng lưới (110) làm sao để tạo thành một góc o θ30 . Cho Fe = 56. Hướng dẫn giải: a) n.M 2, 56g / mol Fe 2 3 3 V 2,34.10 cm TB Fe 23 1 3 N .d
6,023.10 mol .7,95g / cm A o 2 3 3 8 3
r 2,34.10 cm 2,86.10 cm2,86A Fe 2 a
b) Fe ( )có dạng tinh thể lập phương tâm khối nên ta có: 2 d hkl 2 2 2 h k l 2 a Mạng lưới (110) 2 2 d a 2d . 110 2
Theo phương trình Bragg, lại có: 15 Chuyên đề Kim loại n. 1. 2 d 2 o 2.sin θ 2.sin30 o 2
a 2.2 2,83 (A) o
Vậy 2 kết quả này xấp xỉ bằng nhau (chênh lệch 0,03 A )
Bài 5: Bạc kim loại có cấu trúc chặt khít nhất sắp xếp theo kiểu ABCABC....
a) Vẽ tế bào đơn vị của tinh thể bạc. Tìm khối lượng riêng (g/cm3) của Ag.
b) Tính khoảng cách (nm) giữa 2 lớp A-B cạnh nhau trong tinh thể Ag.
c) Một loại hợp kim kiểu thay thế của Ag-Au trong đó Au chiếm 10% về khối
lượng. Tính khối lượng riêng của loại hợp kim đó. Giả thiết rằng hằng số mạng không thay đổi.
Cho: Bán kính nguyên tử Ag trong tinh thể: 0,144 nm. Ag = 107,87; Au = 196,97. Hướng dẫn giải:
1. a. Cấu trúc chặt khít nhất sắp xếp theo kiểu ABCABC.... chính là kiểu lập phương tâm
mặt → Ô mạng đơn vị:
Sự tiếp xúc xảy ra trên đường chéo mặt → a = 0,407 nm = 4,07 × 10-8 cm
Khối lượng riêng: d = 10,60 g/cm3.
b. Khoảng cách giữa hai mặt A-B chính bằng 1/4 đường chéo ô mạng đơn vị 16 Chuyên đề Kim loại
c. Vì thông số ô mạng không đổi nên thể tích ô mạng không đổi.
Vì Au chiếm 10% về khối lượng
→ dễ thấy tỉ lệ số lượng : 0,0574 Au và 0,9426 Ag
→ Khối lượng ô mạng của hợp kim:
4 × (0,9426 ×107,87+0,0574 ×196,97) = 451,94 g/mol
Khối lượng riêng của hợp kim = 11,10 g/cm3.
Bài 6: Vàng có cấu trúc tinh thể lập phương tâm mặt. Một đơn tinh thể vàng hình lập
phương với độ dài mỗi cạnh a = 1,000 cm. Khi chiếu xạ bằng tia XCuK1 ( = 154,05
pm) dưới một góc = 10,89o, nó tạo ra một mô hình nhiễu xạ bậc 1 rõ rệt. Khối lượng
nguyên tử của vàng là 196,97 gam.mol1.
a) Có bao nhiêu nguyên tử vàng trong đơn tinh thể vàng nói trên.
b) Khối lượng của một ô (mạng) đơn vị của vàng.
c) Tỉ trọng của vàng là bao nhiêu.
Hướng dẫn giải:
a) Định luật Bragg, n = 2asin, cho phép xác định hằng số mạng của Au theo công thức: n 12 1 154, 05 10 a =
= 4,07710 10 m = 4,07710 8 2sin = o 2sin(10, 89 ) cm
Dung tích đơn vị tinh thể (ô mạng đơn vị) của Au bằng:
V = a3 = (4,07710 10)3 = 6,77710 29 m3 = 6,77710 23 17 Chuyên đề Kim loại cm3.
Số đơn vị tinh thể Au trong 1000 cm3 bằng: 1000 N = = 1,4761022 . 23 6, 777 10
Số nguyên tử Au trong một ô mạng đơn vị lập phương tâm mặt = 4
Số nguyên tử Au trong khối lập phương 1000 cm3 bằng
NAu = Nn = 1,4761022 4 = 5,9041022.
b) Trọng lượng của một nguyên tử Au bằng: M 196, 97 m 22 Au = Au = = 3,27110 gam N 23 Au 6, 022 10
Khối lượng của ô mạng đơn vị bằng: M 22 21
u = nu mAu = 4 3,27110 = 1,30810 gam.
c) Như vậy tỉ trọng của Au là trọng lượng của khối lập phương 1000 cm3 và bằng: d 21 3
Au = N mAu = 1,4761022 1,30810 = 19,31 g.cm .
Bài 7: Một lớp vàng mỏng được kết tạo trên một miếng mica hình vuông có cạnh a =
1,000 cm. Lớp vàng tạo thành một cấu trúc bề mặt lí tưởng (100). Lớp vàng này và
một dây vàng được nhúng vào 10,000 ml dung dịch nước chứa CuSO4 nồng độ 0,100
mM và Na2SO4 nồng độ 0,100 mM (giữa hai cực có một điện thế không đổi). Lớp
vàng đóng vai trò catot còn dây vàng đóng vai trò anot. Lớp đồng có 100 lớp đơn
nguyên tử được kết tạo trên nền vàng (Au) cũng có cấu trúc bề mặt lí tưởng (100).
Vàng có cấu trúc tinh thể lập phương tâm mặt với hằng
số mạng của nó là 4,07710 8
cm. Tính nồng độ CuSO trong dung dịch sau khi kết tạo lớp đồng nói trên? 4 Hướng dẫn giải:
a) Định luật Bragg, n = 2asin, cho phép xác định hằng số mạng của Au theo công thức:
* Xác định số nguyên tử Au trong hình vuông có cạnh 1,000 cm với cấu trúc bề mặt (100):
Diện tích bề mặt của Au = a 2 8 15 Au = (4,07710 cm)2 = 1,62210 cm2. 18 Chuyên đề Kim loại
Có hai nguyên tử Au trên một ô mạng đơn vị bề mặt, những nguyên tử ở trong các
góc thuộc về 4 ô mạng đơn vị nên chỉ ¼ mỗi nguyên tử góc thuộc về ô mạng đơn vị
bề mặt (100) và nguyên tử ở chính giữa ô mạng thuộc về ô mạng đơn vị bề mặt (100): 1 (4 + 1 = 2) 4 2
Số nguyên tử Au trong 1,000 cm2 bề mặt (100) = = 1,2031015 cm 2 15 1,662 10
* Xác định số nguyên tử Cu trong lớp kết tạo trên nền Au (100) có cấu trúc giống với
nền, do vậy số nguyên tử Cu trong một lớp đơn = 1,2031015 và số nguyên tử Cu
trong lớp kết tạo trên nền Au (100) = 100 1,2031015 = 1,2031017 17 1,203 10 Số mol Cu = = 1,99910 7. 23 6,022 10
* Xác định nồng độ CuSO4 trong dung dịch sau khi kết tạo lớp đồng: Số mol CuSO 3 3 7 4 ban đầu = 0,10010
10,000 10 = 10,000 10
Số mol CuSO4 tạo Cu kết tạo trên nền Au = số mol Cu kết tạo trên nền Au
Số mol CuSO4 còn lại trong dung dịch sau khi kết tạo lớp đồng:
10,000 10 7 1,99910 7 = 8,001 10 7. 7 8,001 10 Nồng độ CuSO4 = = 0,0800 mM 3 10,000 10
Bài 7: Vanadi (V) có khối lượng riêng là 5,96 g/cm3, kết tinh theo cấu trúc mạng lập
phương với cạnh của ô mạng cơ sở là 307 pm. Biết khối lượng mol nguyên tử của Vanadi là 50,94.
a) Vanadi kết tinh theo kiểu mạng lập phương nào ?
b) Số phối trí của Vanadi trong cấu trúc này là bao nhiêu? Giải thích.
c) Tính thể tích không gian trống trong ô mạng cơ sở của Vanadi? Hướng dẫn giải:
a) Thể tích của ô cơ sở của Vanadi là :
v = (307 pm)3 = (3,0710 8 cm) 3 = 28,9344 24 3 10 cm
Khối lượng của ô cơ sở là : 19 Chuyên đề Kim loại m = 28,9344 24 10
cm3 5,96 g/cm3 = 172,4493 24 10 gam.
Vì chưa biết Vanadi kết tinh theo kiểu mạng lập phương nào nên gọi n là số nguyên tử
Vanadi trong một ô cơ sở thì khối lượng một nguyên tử Vanadi là : 24 172, 4493 10 m V (gam) n
Biết rằng khối lượng mol nguyên tử của Vanadi (AV) là 50,94 gam Theo: AV = mV o N ( o N là số Avogađro) 172, 4493 50,94 = 24 23 10 6,022 10 n 103, 8489 50,94 =
n = 2,0386 n 2. n
Trong mỗi ô cơ sở của mạng tinh thể Vanadi chứa 2 nguyên tử.
Mỗi ô cơ sở của mạng lập phương tâm khối có : 8 đỉnh, mỗi đỉnh chứa 1 nguyên tử, 1 8
tâm của khối lập phương chứa 1 nguyên tử. Tổng số : 8 đỉnh 1
nguyên tử mỗi đỉnh + 1 nguyên tử ở tâm = 2 nguyên tử 8
Vậy, Vanadi kết tinh theo kiểu mạng tinh thể lập phương tâm khối.
b) Trong cấu trúc này, nguyên tử nằm ở tâm có 8 láng giềng gần chiếm những đỉnh ở
khoảng cách d. Cũng như vậy, một nguyên tử ở đỉnh thuộc về 8 ô mạng khác nhau, có
8 láng giềng, một ở tâm của mỗi ô mạng.
Do đó, số phối trí = 8. B
c) Mặt chéo mạng tế bào cơ sở của V (hình A B A vẽ) E E a V Độ đặc khít = 2 nguyªn tö C « V m¹ng c¬ së D C a D 20 Chuyên đề Kim loại
Từ hình vẽ, ta có: AD2 = a2 + a2= 2a2
xét mặt ABCD: AC2 = a2 + AD2 = 3a2
mặt khác, ta thấy AC = 4r = a 3 8 a 3 3,07 10 1,732 r = = = 1,329310 8 cm 4 4 V 8 24
2 nguyên tử = 2 4 r3 = 2 4 (3,1416)( 1,329310 )3 = 19,678310 cm3. 3 3 2 4 3 19,6783 10 cm Độ đặc khít = = 0,68 hay 68% 2 4 3 28,9344 10 cm
Thể tích không gian trống trong ô mạng cơ sở của Vanadi = 32%
Bài 8: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2007)
Hãy chứng minh rằng phần thể tích bị chiếm bởi các đơn vị cấu trúc (các nguyên tử)
trong mạng tinh thể kim loại thuộc các hệ lập phương đơn giản, lập phương tâm khối, lập
phương tâm diện tăng theo tỉ lệ 1 : 1,31 : 1,42. Hướng dẫn giải:
Phần thể tích bị chiếm bởi các nguyên tử trong mạng tinh thể cũng chính là phần
thể tích mà các nguyên tử chiếm trong một tế bào đơn vị (ô mạng cơ sở).
- Đối với mạng đơn giản:
+ Số nguyên tử trong 1 tế bào: n = 8 x 1/8 = 1
+ Gọi r là bán kính của nguyên tử kim loại, thể tích V1 của 1 nguyên tử kim loại là: V1 = 4/3 x r3 (1)
+ Gọi a là cạnh của tế bào, thể tích của tế bào là: V2 = a3 (2)
Trong tế bào mạng đơn giản, tương quan giữa r và a được thể hiện trên hình sau: r a 21 Chuyên đề Kim loại hay a = 2r (3).
Thay (3) vào (2) ta có: V2 = a3 = 8r3 (4)
Phần thể tích bị chiếm bởi các nguyên tử trong tế bào là:
V1/V2 = 4/3 r3 : 8r3 = /6 = 0,5236
- Đối với mạng tâm khối:
+ Số nguyên tử trong 1 tế bào: n = 8 x 1/8 + 1 = 2. Do đó V1 = 2x(4/3) r3 .
+ Trong tế bào mạng tâm khối quan hệ giữa r và a được thể hiện trên hình sau:
Do đó: d = a 3 = 4r. Suy ra a = 4r/ 3 Thể tích của tế bào: V2 = a3 = 64r3/ 3 3
Do đó phần thể tích bị chiếm bởi các nguyên tử trong tế bào là:
V1 : V2 = 8/3 r3 : 64r3/3 3 = 0,68
- Đối với mạng tâm diện:
+ Số nguyên tử trong 1 tế bào: n = 8 x 1/8 + 6 x 1/2 = 4. Do đó thể tích của các
nguyên tử trong tế bào là: V1 = 4 x 4/3 r3
+ Trong tế bào mạng tâm diện quan hệ giữa bán kính nguyên tử r và cạnh a của tế bào
được biểu diễn trên hình sau: d a
Từ dó ta có: d = a 2 = 4r, do đó a = 4r/ 2
Thể tích của tế bào: V2 = a3 = 64r3/2 2
Phần thể tích bị các nguyên tử chiếm trong tế bào là:
V1/V2 = 16/3 r3: 64r3/ 2 2 = 0,74 22 Chuyên đề Kim loại
Như vậy tỉ lệ phần thể tích bị chiếm bởi các nguyên tử trong 1 tế bào của các mạng
đơn giản, tâm khối và tâm diện tỉ lệ với nhau như 0,52 : 0,68 : 0,74 = 1 : 1,31 : 1,42.
Bài 9: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2012)
Vật liệu siêu dẫn A là oxit hỗn hợp của Cu, Ba và
Y (ytri, nguyên tố thuộc phân nhóm IIIB, chu kì 5 trong
bảng hệ thống tuần hoàn). Bằng nhiễu xạ tia X, người ta Ba
xác định được cấu trúc tinh thể của A. Có thể coi ô mạng Cu
cơ sở của A (hình bên) gồm hai hộp chữ nhật giống nhau O
trong đó: Cu chiểm vị trí các đỉnh, Ba ở tâm hình hộp còn Y Y Y
O ở trung điểm các cạnh nhưng bị khuyết hai vị trí (vị trí Ba Ba
thực của O và Ba hơi lệch so với vị trí mô tả). Hai hình
hộp này đối xứng với nhau qua Y nằm ở tâm của ô mạng Ba cơ sở.
a) Hãy xác định công thức hóa học của A.
b) Tinh thể A được điều chế bằng cách nung nóng hỗn
hợp bột mịn của BaCO3, Y2O3 và CuO (theo tỉ lệ thích hợp) ở 1000oC trong không khí,
rồi làm nguội thật chậm đến nhiệt độ phòng. Hãy viết phương trình phản ứng điều chế A.
c) Một trong những lí giải tính siêu dẫn của A là dựa trên sự có mặt đồng thời Cu+2 và
Cu+3 trong tinh thể. Hãy chỉ rõ nguyên tử Cu ở vị trí nào trong ô mạng cơ sở có số oxi
hóa +2, +3. Cho rằng các nguyên tố Y, Ba và O có số oxi hóa lần lượt là +3, +2 và -2.
d) Tùy thuộc vào điều kiện tổng hợp, công thức thực nghiệm của loại vật liệu này có thể
khác với công thức xác định được ở mục a) chỉ về số nguyên tử oxi.
Để tìm công thức thực nghiệm của một mẫu vật liệu, người ta tiến hành thí nghiệm
như sau: Hòa tan 0,3315 gam mẫu vào dung dịch HCl loãng chứa sẵn lượng dư KI.
Lượng I2 sinh ra tác dụng vừa đủ với 18,00 mL dung dịch Na2S2O3 0,1000M. Hãy xác
định công thức thực nghiệm của mẫu nghiên cứu này. Hướng dẫn giải: a) Công thức YBa2Cu3O7
b) 1/2 Y2O3 + 2BaCO3 + 3CuO + 1/4 O2 YBa2Cu3O7 + 2CO2 23 Chuyên đề Kim loại
Chú ý: - Sản phẩm là CO không được điểm vì CO sẽ khử A
- H/s có thể viết dưới dạng hỗn hợp oxit, hoặc cân bằng với hệ số nguyên, hoặc
viết phản ứng qua nhiều giai đoạn..
c) Số oxi hóa trung bình của Cu = +7/3 trong đó có hai loại ion Cu khác nhau, +2 và +3.
Có 1 nguyên tử Cu ở đỉnh ô mạng cở sở có số phối trí 4, vuông phẳng (số oxi hóa n)
Có 2 nguyên tử Cu (hoàn toàn giống nhau) ở trên cạnh ô mạng cở sở có số phối trí 5,
chóp đáy vuông (số oxi hóa m)
Số oxi hóa trung bình (n + 2m)/3 = 7/3. n =3, m=2 là phù hợp.
Vậy có một Cu+3 nằm ở đỉnh (cấu hình d8 phù hợp với cấu trúc vuông phẳng)
Có hai Cu+2 nằm ở trên các cạnh ô mạng cở sở.
Chú ý: Học sinh không chỉ ra được đặc điểm khác nhau giữa hai loại Cu, mà chỉ dựa vào
ví trí của nó, không được điểm.
d) Đặt công thức YBa2Cu3Ox, MA = 554,2 + 16x
số oxi hóa trung bình của Cu = n = (x-3,5).2/3 = (2x-7)/3 Phản ứng oxi hóa KI: – Cu+n + (n–1)e + I CuI – (n-1)I – (n–1)e (n–1)/2 I2 – Cu+n + nI CuI + (n–1)/2 I2 Số mol I n 1 0,3315 2x 10 0,3315 2 = .
.3 thay giá trị của n => Số mol I2 = . 2 554, 2 16x 2 554, 2 16x Phản ứng chuẩn độ: – I 2– 2– 2 + 2S2O3 2I + S4O6 , Số mol của S 2– 0,3315.(2x 10) 2O3 = 2 x nI2 = = 0,018 . 0,1 = 0,0018 mol 554, 2 16x
1,913 x = 13,009 => x = 6,8 => công thức thực nghiệm: YBa2Cu3O6,8
II. BÀI TẬP PHỨC CHẤT KIM LOẠI CHUYỂN TIẾP
Kim loại chuyển tiếp có khả năng tạo phức với nhiều phối tử. Đây là phần kiến
thức phức tạp và trừu tượng và gây nhiều khó khăn cho học sinh để hiểu và vận dụng
thành thạo. Mặt khác đây lại là phần hay xuất hiện trong đề thi Học sinh giỏi Quốc gia
và vòng loại Olympic Quốc tế. Ở đây chúng tôi chỉ tổng hợp những kiến thức cơ bản
và hệ thống bài tập áp dụng để có thể làm tài liệu tham khảo cho thầy cô và các em học sinh. A. LÝ THUYẾT I. KHÁI NIỆM: 1. Khái niệm: 24 Chuyên đề Kim loại
* Phức chất: là hợp chất phức tạp được tạo thành từ ion phức và ion trái dấu (hoặc các phân tử trung hoà).
* Ion phức: thường được hình thành bởi cation kim loại (thường là các ion kim loại
chuyển tiếp) liên kết với các ion trái dấu hoặc phân tử có cực. Trong phức chất ion phức
được đặt trong dấu []. Vd: [Ag(NH ]Cl; ion phức là [Ag(NH 3)2 3)2]+ 2. Thành phần:
* Cầu nội: là ion phức được tạo bởi:
+ Ion (nguyên tử) trung tâm: là ion kim loại tạo phức
+ Phối tử: các ion trái dấu và phân tử phân cực liên kết trực tiếp với ion trung tâm
+ Số phối trí: số lượng phối tử liên kết trực tiếp với ion trung tâm
* Cầu ngoại: là phần ion trái dấu liên kết với ion phức:
Vd: phức chất [Ag(NH3)2]Cl có cầu nội: [Ag(NH3)2]+ ion trung tâm là: Ag+ phối tử là: NH3
số phối trí của Ag+ là: 2 cầu ngoại: Cl- II. DANH PHÁP:
* số phối tử:
- Phối tử 1 càng dung tiếp đầu ngữ: đi, tri, tetra; penta, hexa…tương ứng với 2, 3, 4, 5, 6…
- Phối tử nhiều càng dung tiếp đầu ngữ: bis; tris; tetrakis; pentakis; hexakis…tương ứng với 2, 3, 4, 5, 6…
* Tên phối tử:
- Nếu phối tử là anion: tên anion + “o” F- floro S 2- 2O3 tiosunfato Cl- cloro C 2- 2O4 oxalato Br- bromo CO 2- 3 cacbonato I- iođo HO- hiđroxo NO - 2 nitro CN- xiano ONO- nitrito SCN- tioxianato 25 Chuyên đề Kim loại 2- SO3 sunfito NCS- isotioxianato
- Nếu phối tử là phân tử trung hoà: tên của phân tử đó: C N: pyriđin; : metylamin… 2H4: etylen; C5H5 CH3NH2
- Một số phân tử trung hoà có tên riêng: H2O: aqua; NH3: ammin; CO: cacbonyl; NO: nitrozyl
Chú ý: tên phối tử trong phức: gọi tên theo trình tự chữ cái của anion rồi đến phối tử trung hoà.
1. Cation phức: phức chất với cầu nội là ion dương:
Số phối trí + tên phối tử + tên ion trung tâm (hoá trị) + tên cầu ngoại Vd: [Ag(NH ]Cl: điamminbạc(I) clorua 3)2 [Cu(NH
: bisetylenđiamin đồng (II) sunfat 2CH2CH2NH2)2]SO4
[Co(H2O)5Cl]Cl2: cloropentaaquacoban(III) clorua
2. Anion phức: phức chất với cầu nội là anion:
Tên cầu ngoại + số phối tử + tên phối tử + tên ion trung tâm“at” (hoá trị) (tên latinh)
K3[Fe(CN)6]: Kali hexaxianoferat (III)
Na[Al(OH) ]: Natri tetrahiđroxoalumi 4 nat (III) 3. Phức trung hoà:
Gọi tương tự như cation phức nhưng tên ion trung tâm thì gọi theo tên latinh: [Pt(NH ] điclođiamminplatin (II) 3)2Cl2 [Co(H ] điclotetraaquacobant (II) 2O)4Cl2 III. ĐỒNG PHÂN:
1. Đồng phân hiđrat hóa: là những chất có cùng thành phần nhưng khác nhau về chức
năng (đặc điểm liên kết) của các phân tử nước trong thành phần của phức chất. Vd: [Cr(H
: xanh hơi tím, tạo kết tủa với AgNO 2O)6]Cl3 3 theo tỉ lệ số mol 1:3 [Cr(H
: màu lục, tạo kết tủa với AgNO 2O)5Cl]Cl2 3 theo tỉ lệ số mol 1:2 [Cr(H
]Cl: màu lục, tạo kết tủa với AgNO 2O)4Cl2 3 theo tỉ lệ số mol 1:1
2. Metame ion hoá: là những chất có cùng thành phần nhưng trong nước phân li thành các ion khác. Vd: [Co(NH 2-
3)5Br]SO4 [Co(NH3)5Br]2+ + SO4
[Co(NH3)5 SO4]Br [Co(NH3)5SO4]+ + Br- 26 Chuyên đề Kim loại
3. Đồng phân muối: là các chất có cùng thành phần nhưng phối tử của chúng là đồng phân vô cơ của nhau. Vd: [Co(NH
]X: xanto màu vàng, không bị thuỷ phân trong môi trường axit 3)5NO2
[Co(NH3)5ONO]X: isoxanto màu nâu tươi, thuỷ phân khi tác dụng với axit gp NO2
4. Đồng phân phối trí: là những chất có cùng khối lượng phân tử nhưng có sự phân bố
khác nhau của các phối tử trong thành phần của các ion phức tạo nên phân tử hợp chất.
[Co(NH3)6]Cl3 + K3[Cr(CN)6] 3KCl + [Co(NH3)6] [Cr(CN)6]
[Cr(NH3)6]Cl3 + K3[Co(CN)6] 3KCl + [Cr(NH3)6] [Co(CN)6]
5. Đồng phân hình học: là những hợp chất có cùng công thức phân tử nhưng có sự
phân bố khác nhau của các phối tử xung quanh ion trung tâm: Vd: [Pt(NH
] tồn tại hai đồng phân cis – 3)2Cl2 trans: H3N Cl- Cl- NH3 Pt2+ Pt2+ H3N Cl- H3N Cl-
Cis điclorođiammin platin (II)
Trans điclorođiammin platin (II) (da cam) (vàng nhạt)
6. Đồng phân quang học: là những chất có cùng khối lượng phân tử, các phân tử của
chúng không có tâm đối xứng và không có mặt phẳng đối xứng. Do đó chúng có khả
năng làm quay mặt phẳng phân cực của ánh sang Vd: Cl Cl N Cl Cl N Co Co N NH3 H3N N NH3 NH3
III. GIẢI THÍCH LIÊN KẾT TRONG PHỨC CHẤT:
* Thuyết liên kết hoá trị: 1. Luận điểm: 27 Chuyên đề Kim loại
Liên kết hoá học hình thành trong phức chất được thực hiện bởi sự xen phủ giữa
AO chứa cặp e riêng của phối tử với AO lai hoá trống có định hướng không gian thích hợp của hạt trung tâm.
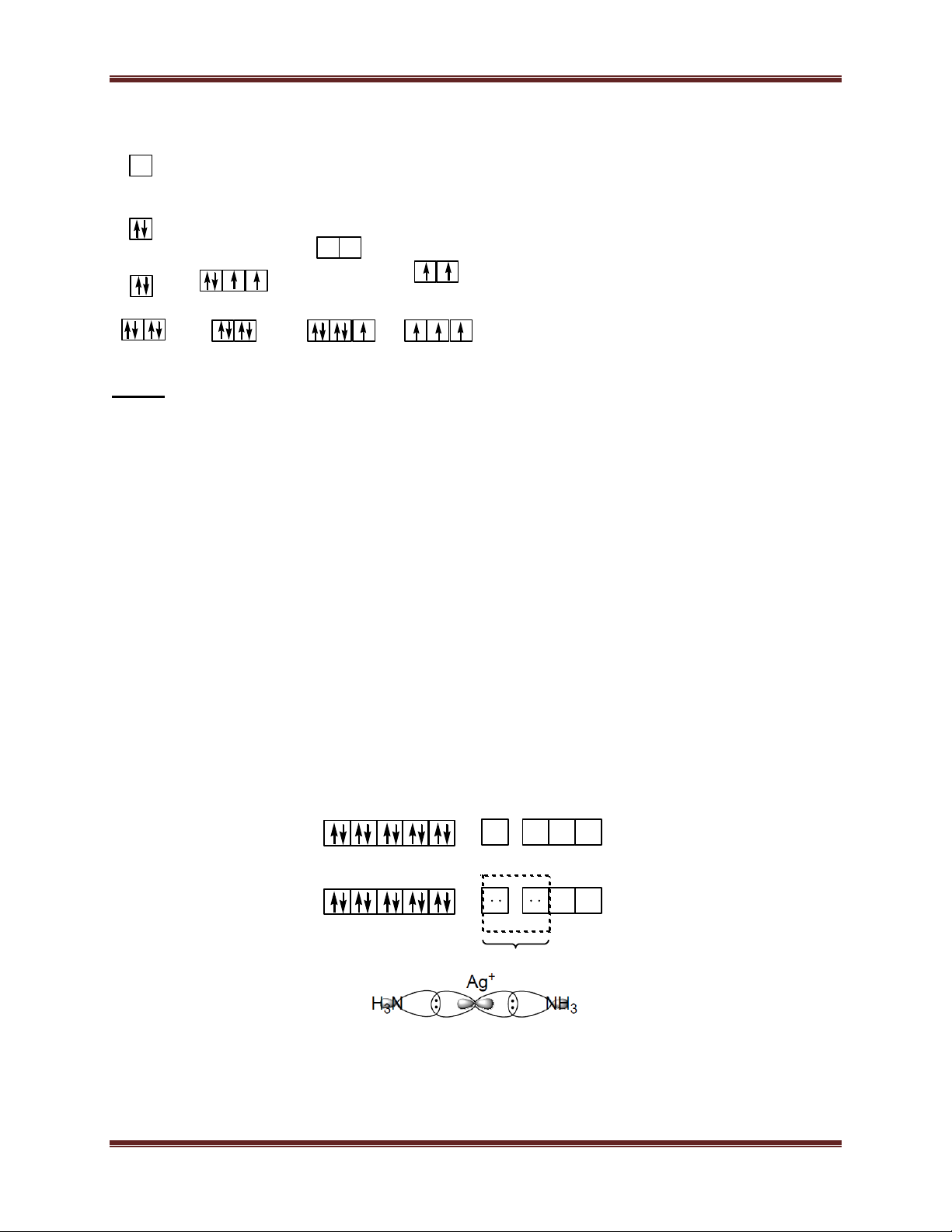
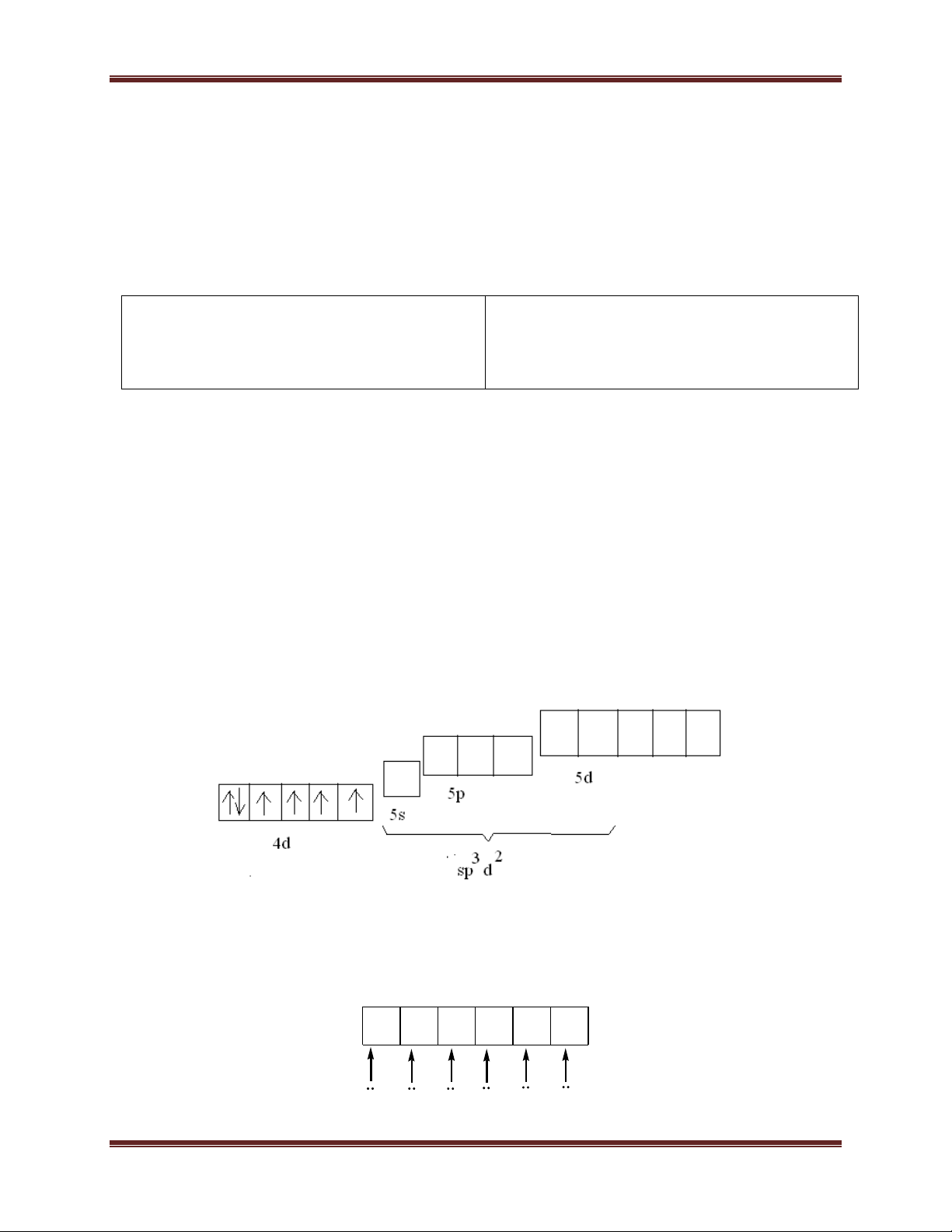
2. Một số trường hợp lai hoá: Dạng lai hoá Dạng hình học Một số ion trung tâm sp đường thẳng Ag+; Cu+… sp3 tứ diện Fe3+; Al3+; Zn2+; Co2+; Ti3+… dsp2 vuông phẳng Pt2+; Pd2+; Cu2+; Ni2+; Au3+… d2sp3 hoặc bát diện Cr3+; Co3+; Fe3+; Pt4+; sp3d2 Rh3+…
3. Cường độ của phối tử:
- Các phối tử có tương tác khác nhau đến ion trung tâm, nó ảnh hưởng đến trạng thái lai
hoá của ion trung tâm và từ tính của phức. Khả năng tương tác của các phối tử được xếp theo trình tự sau: I-2-
2O4 2 - Dãy phối tử được gọi là dãy quang phổ hoá học, những phối tử đứng trước có trường yếu
hơn phối tử đứng sau. Thường những phối tử đứng trước NH3 gây trường yếu, đứng sau NH3 gây trường mạnh.
4. Các bước xác định cấu trúc ion phức:
Bước 1: Xác định cấu hình của ion trung tâm
Bước 2: Dựa vào đặc điểm của phối tử (mạnh hay yếu) để xác định lai hoá của ion trung tâm.
Bước 3: Viết giản đồ lai hoá AO của ion trung tâm và sự phân bố e của ion phức
Bước 4: Trên cơ sở cấu hình e của phức, xác định các tính chất của phức theo VB.
- Từ tính: thuận từ có e độc thân; nghịch từ e đã ghép đôi
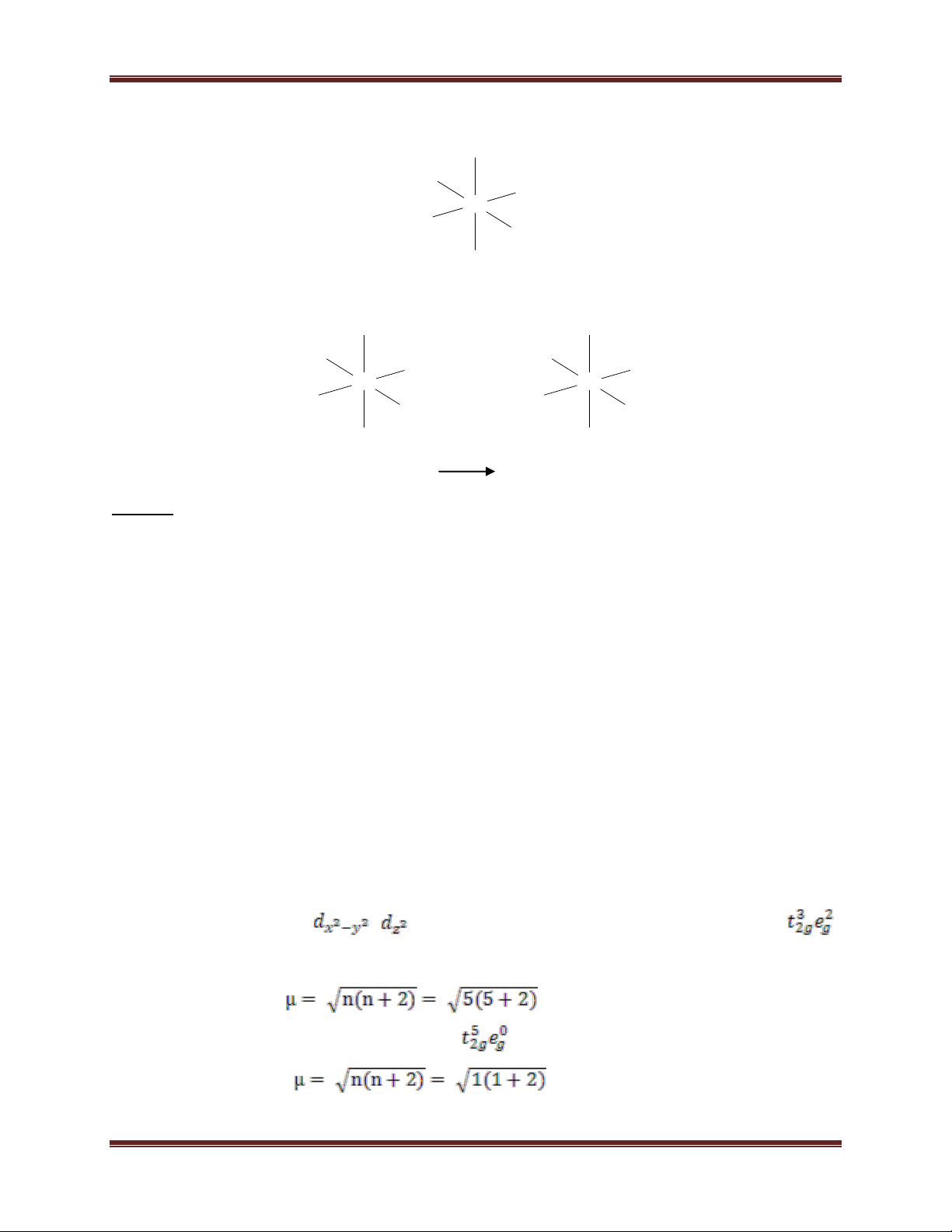
- Quang phổ của phức: màu của phức chất Vd: [Co(CN)6]3- Ion Co3+: 28 Chuyên đề Kim loại
CN- là phối tử trường mạnh nên có sự dồn electron. Ion Co3+ ở trạng thái lai hoá d2sp3 d2sp3
Dạng hình học của ion phức: CN- CN- CN- Co3+ CN- CN- CN-
Ion phức không còn electron độc thân nên có tính nghịch từ Vd 2: [CoF6]3- Ion Co3+:
F- là phối tử trường yếu không có hiện tượng dồn e. Ion Co3+ ở trạng thái lai hóa sp3d2 sp3d2
Dạng hình học của ion phức: F- F- F- Co3+ F- F- F-
Ion phức còn electron độc thân nên có tính thuận từ
5. Ưu điểm và hạn chế: 29 Chuyên đề Kim loại - Ưu điểm:
+ Giải thích đơn giản liên kết hình thành và dạng hình học của phức chất
+ Giải thích được từ tính của phức chất - Nhược điểm:
+ Không giải thích được màu của phức chất
B. BÀI TẬP ÁP DỤNG
1. Bài tập cơ bản
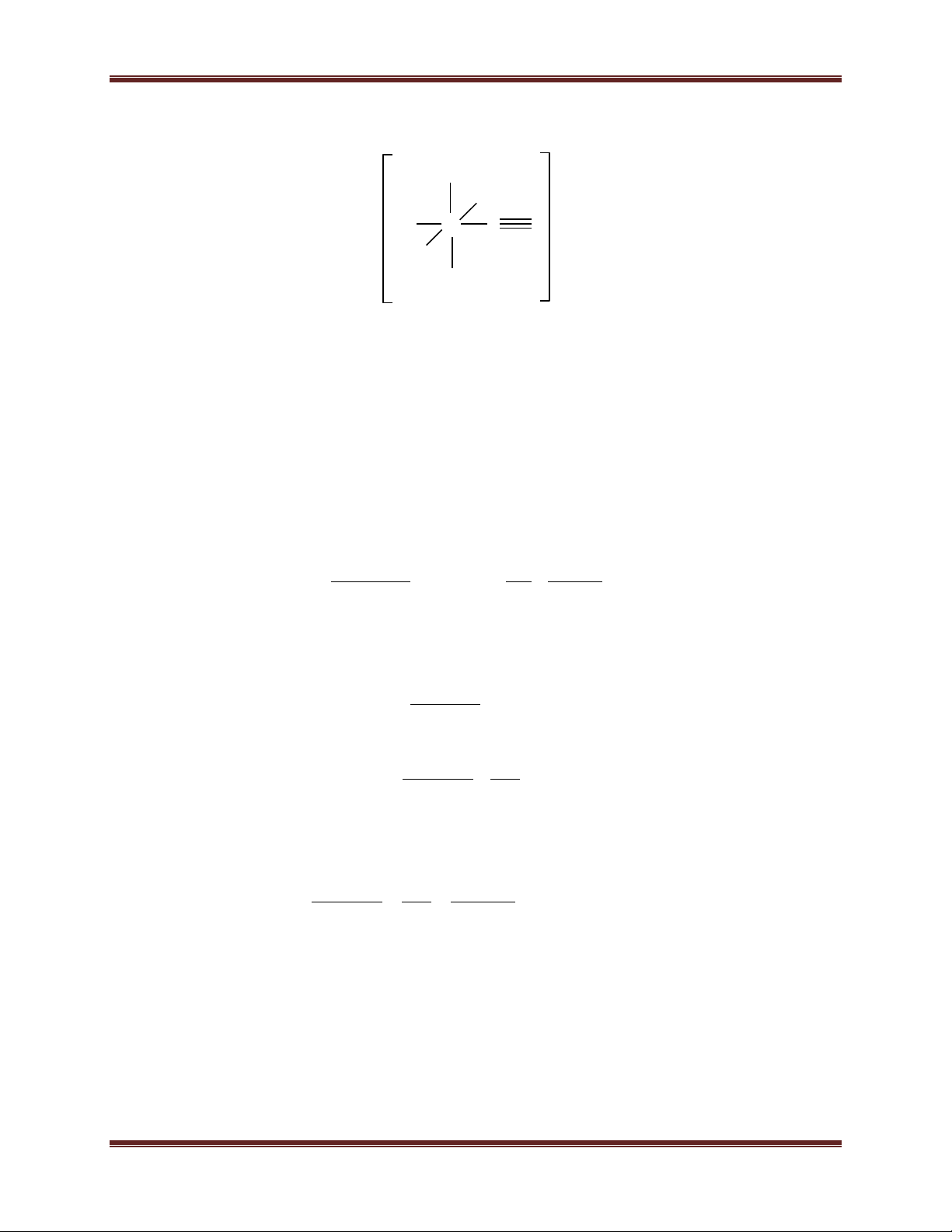
Bài 1: Hãy giải thích sự hình thành phức AuCl - 4 theo thuyết VB. Hướng dẫn giải: dsp2 [AuCl4]- 5d 6s 6p 4 Cl-
Bài 2: Hãy giải thích tại sao các ion phức [Fe(CN)6]3- và [Fe(H2O)6]2+ là thuận từ trong
khi phức [Fe(CN)6]4- lại là nghịch từ? Hướng dẫn giải: d2sp3 [Fe(CN)6]3- 6CN- sp3d2 [Fe(H2O)6]2+ 6 H2O d2sp3 [Fe(CN)6]4- 6CN-
Bài 3: Ion [Mn(CN)6]3- có 2 electron độc thân, ion [MnBr4]2- có 5 electron độc thân, ion
[Ni(CN)4]2- không có electron độc thân. Dựa vào thuyết liên kết hoá trị (thuyết VB), hãy
viết cấu hình electron (dưới dạng ô lượng tử) của các ion phức trên, cho biết kiểu lai hoá
và cấu trúc hình học của chúng. Hướng dẫn giải:
[Mn(CN)6]3-: d2sp3, bát diện 30 Chuyên đề Kim loại d2sp3 [Mn(CN)6]3- 6CN- [MnBr4]2-: sp3, tứ diện
[Ni(CN)4]2-: dsp2, vuông phẳng dsp2 [Ni(CN)4]2- 4CN-
2. Một số bài tập nâng cao
Bài 1: a) Hãy giải thích sự hình thành các phức [Cu(NCCH3)4]+ (A) và [Cu(NCCH3)2]+ (B) theo thuyết VB.
b) Liên kết Cu-N trong B (1,84 Å) ngắn hơn đáng kể so với trong A (1,99 Å). Hãy giải thích? Hướng dẫn giải:
a) A: lai hóa sp3, tứ diện, nghịch từ.
B: lai hóa sp, đường thẳng, nghịch từ.
b) Bán kính của obitan lai hóa sp ngắn hơn của obitan lai hóa sp3
Bài 2: (Taiwan 2009) Niken (II) có cấu hình electron là 3d8. [Ni(CN)4]2- là phức nghịch
từ còn [NiCl4]2- là phức thuận từ với hai electron độc thân. Sắt (III) có cấu hình electron
là 3d5. Phức [Fe(CN)6]3- có một electron độc thân, còn phức [Fe(H2O)6]3+ có năm electron độc thân.
a) Hãy giải thích các hiện tượng trên theo thuyết VB.
b) Hãy giải thích các hiện tượng trên theo thuyết trường tinh thể. Hướng dẫn giải:
a) [Ni(CN)4]2-: dsp2, không có electron độc thân, nghịch từ.
[NiCl4]2-: sp3, có 2 electron độc thân, thuận từ.
Fe(CN)6]3-: d2sp3, có 1 electron độc thân, thuận từ.
[Fe(H2O)6]3+: sp3d2, có 5 electron độc thân, thuận từ. b) 31 Chuyên đề Kim loại dx2-y2 dxy dz2 dx2-y2 d d d z2 dx2-y2 xy dxz yz dz2 d d xz d d d d yz z2 x2-y2 xy dxz dyz xy dxz dyz [Ni(CN)4]2- [NiCl4]2- [Fe(H2O)6]3+ [Fe(CN)6]3+ )
Bài 3: (QG 2013) Các chất AgCl và Cr(OH)3 không tan trong nước, nhưng trong dung
dịch amoniac lại tạo ra những hợp chất tan. Dựa vào thuyết liên kết hoá trị (thuyết VB),
hãy giải thích sự tạo thành liên kết giữa ion Ag+, Cr3+ và các phân tử amoniac trong các hợp chất tan đó. Hướng dẫn giải:
AgCl và Cr(OH)3 không tan trong nước, nhưng tan trong dung dịch amoniac do tạo
thành các phức chất theo phản ứng sau:
AgCl + 2 NH3 [Ag(NH3)2]+ + Cl-
Cr(OH)3 + 6 NH3 [Cr(NH3)6]3+ + 3 OH-
Trong phức chất [Ag(NH3)2]+, ion Ag+ lai hoá sp. Mỗi obitan lai hoá sp của Ag+
(không có electron) xen phủ với obitan lai hoá sp3 có cặp electron chưa tham gia liên kết
của N trong NH , tạo ra liên kết cho nhận giữa NH 3 3 và Ag+. 4d 5s 5p Ag+ sp [Ag(NH3)2]+ 2NH3
Trong phức chất [Cr(NH3)6]3+, ion Cr3+ lai hoá d2sp3. Mỗi obitan lai hoá của Cr3+
(không có electron) xen phủ với obitan lai hoá sp3 có cặp electron chưa tham gia liên kết
của N trong NH , tạo ra liên kết cho nhận giữa NH 3
3 và Cr3+. Phức thuận từ. 32 Chuyên đề Kim loại 3d 4s 4p d2sp3 [Cr(NH3)6]3+ 6 NH3
Bài 4: (QG 2011 Vòng 2) [Ru(SCN)2(CN)4]4– là ion phức của ruteni, được kí hiệu là P.
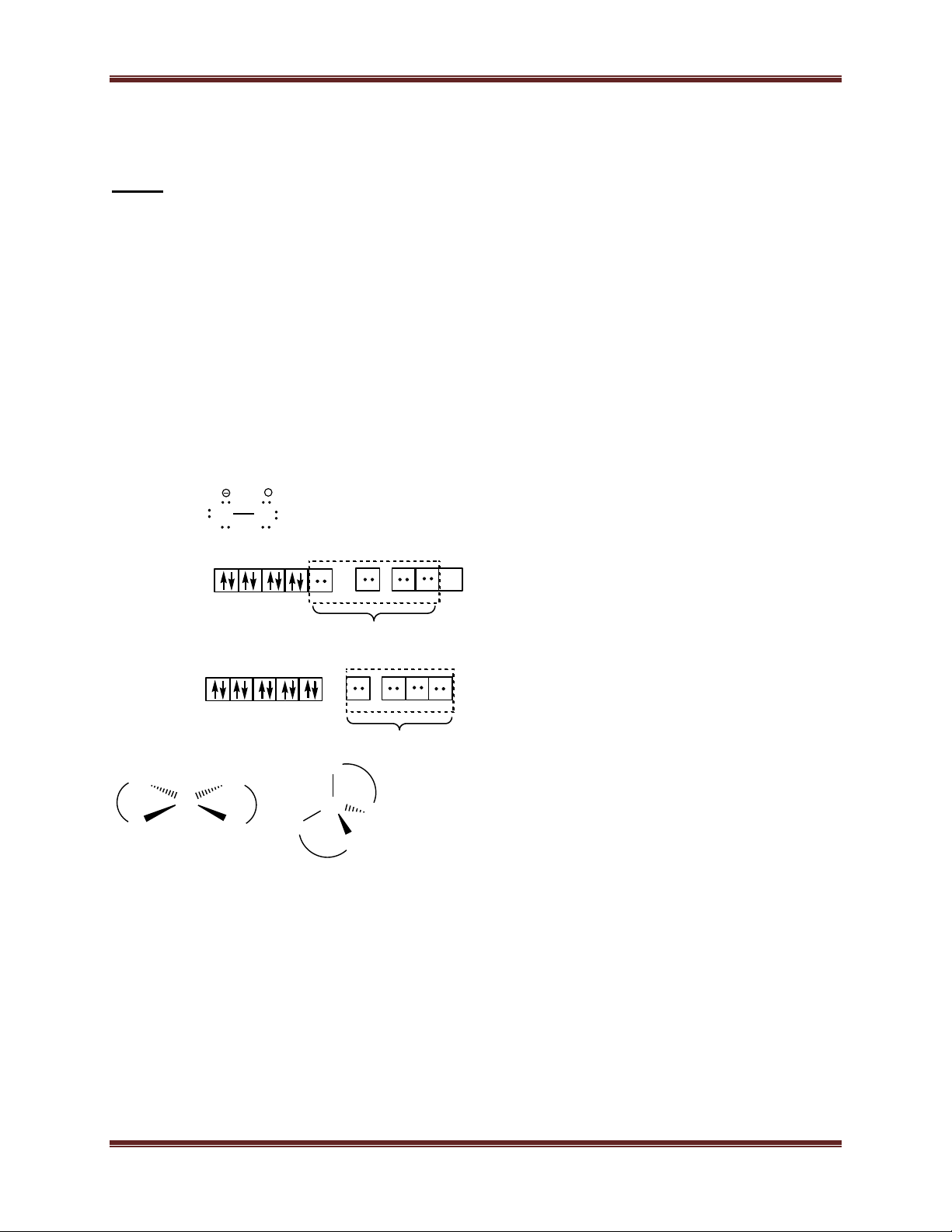
a) Viết công thức Lewis của phối tử thioxianat SCN–.
b) Cho biết dạng lai hóa của Ru trong P. Mô tả sự hình thành ion phức theo thuyết VB
(Valence Bond). Giải thích tại sao trong P, liên kết được hình thành giữa Ru và N của
phối tử SCN– mà không phải là giữa Ru và S. Cho biết phức có tính thuận từ hay nghịch từ, vì sao? Hướng dẫn giải: a) S C N S C N bÒn
b) Ru2+ có cấu hình electron [Kr]4d65s05p0. Kiểu lai hóa d2sp3 (do CN- là phối tử trường
mạnh, Ru thuộc dãy thứ hai của kim loại chuyển tiếp), không có electron độc thân, nghịch từ. d2sp3 [Ru(SCN)2(CN)4]4- 2 SCN- + 4CN-
So với S, N có độ âm điện lớn hơn và bán kính nguyên tử nhỏ hơn, do đó mật độ điện
tích âm trên nguyên tử N sẽ lớn hơn, ái lực phản ứng với ion dương Ru2+ lớn hơn, vì vậy
trong phức chất P, liên kết phức được hình thành giữa Ru và N mà không phải là giữa Ru và S. 33 Chuyên đề Kim loại
Hoặc: Ru2+ là axit cứng, N là bazơ cứng)
Bài 5: (QG 2007 Vòng 2)
a) Người ta đã tổng hợp được [NiSe4]2-, [ZnSe4]2- và xác định được rằng phức chất của
Ni có hình vuông phẳng, của Zn có hình tứ diện đều. Hãy giải thích sự hình thành hai
phức trên theo thuyết VB. b) Phức chất [PtCl
] được xác định là đồng phân trans. Nó phản ứng chậm với 2(NH3)2 Ag O cho phức chất [PtCl 2
2(NH3)2(OH2)2]2+ (kí hiệu là X). Phức chất X không phản ứng
được với etylenđiamin (en) khi tỉ lệ mol phức chất X : en = 1 : 1. Hãy giải thích các sự
kiện trên và vẽ cấu trúc của phức chất X. Hướng dẫn giải: a) Phối tử: Se Se dsp2 [NiSe4]2- 2 Se 2- 2 sp3 [ZnSe4]2- 2 Se 2- 2 Se Se Se Ni Zn Se Se Se Se Se
b) [PtCl2(NH3)2] + Ag2O + 3 H2O [PtCl2(NH3)2(H2O)2]2+ + 2 OH- + 2 Ag
Etylenđiamin là phối tử hai càng mạch ngắn. Khi phối trí với các ion kim loại nó chỉ
có thể chiếm hai vị trí phối trí cạnh nhau (vị trí cis). Hiện tượng en không thể phản ứng
với X chứng tỏ rằng hai phân tử H O nằm ở hai vị trí trans đối với nhau. Như vậy cấu 2 trúc của phức X là: 34 Chuyên đề Kim loại OH2 2+ Cl NH3 Pt H3N Cl OH2
Bài 6: (Taiwan 2009) Hãy vẽ các đồng phân có thể có của các phức sau: a) [Pt(NH3)2Cl2].
b) [Co(en)2Cl2]+,(en là phối tử etylen diamin). Hướng dẫn giải:
a) 2 đồng phân: cis, trans. b)
Bài 7: (QG 2008) Viết tất cả các đồng phân của phức chất [Co(bipy)2Cl2]+ với bipy: N N Hướng dẫn giải:
Quy ước biểu diễn bipy bằng một cung lồi. a) Đồng phân cis, trans: Cl Cl Co Cl Co Cis Cl Trans b) Đồng phân quang học: Cl Cl Co Cl Cl Co
Bài 8: (QG 2014) 35 Chuyên đề Kim loại
1. Chất A là hợp chất có thành phần chỉ gồm nitơ và hiđro. Chất A được sử dụng làm
nhiên liệu cho tên lửa. Ở cùng điều kiện về nhiệt độ và áp suất, một thể tích hơi của A có
khối lượng bằng khối lượng của cùng một thể tích khí oxi.
a) Xác định công thức phân tử, công thức cấu tạo của A và cho biết trạng thái lai hóa của nitơ trong A.
b) Dựa vào đặc điểm cấu tạo, hãy so sánh tính bazơ và tính khử của A với NH . Giải 3 thích.
c) Người ta thực hiện thí nghiệm sau: cho 25,00 mL dung dịch A nồng độ 0,025M vào
dung dịch Fe2(SO4)3 dư, đun nóng, thu được dung dịch B và một chất khí X. Chuẩn độ
1/2 dung dịch B trong môi trường axit, cần vừa đủ 12,40 mL dung dịch KMnO . Biết 4
rằng chuẩn độ 10,00 mL dung dịch H ) cần
2C2O4 0,05M (trong môi trường axit H2SO4
vừa đủ 9,95 mL dung dịch KMnO4 ở trên. Xác định chất X.
2. Năm 1965, các nhà khoa học đã tìm ra phương pháp cố định nitơ ở nhiệt độ phòng
bằng cách dẫn khí nitơ đi qua dung dịch pentaaminoaquơruteni(II) (A ). Khi đó, nitơ sẽ 1
thay thế nước trong cầu nội của A . Phức chất
1 tạo phức chất mới A2
A2 có tính thuận từ.
a) Viết phương trình phản ứng xảy ra.
b) Áp dụng thuyết liên kết hóa trị (VB), hãy mô tả liên kết trong phức A2 và dự đoán cấu
trúc hình học của nó. Xác định hóa trị và số oxi hóa của ruteni trong phức chất A2.
3. Trong dung dịch OH- 1,0M của [Co(NH3)5Cl]2+ tồn tại cân bằng:
[Co(NH3)5Cl]2+ + OH- [Co(NH3)4(NH2)Cl]+ + H2O.
Ở 25oC, tại thời điểm cân bằng xác định được rằng ít nhất 95% phức chất tồn tại ở dạng
axit [Co(NH3)5Cl]2+. Chứng minh [Co(NH3)5Cl]2+ là một axit rất yếu có K 5,26.10-16. a
4. NH3 có khả năng phản ứng với nhiều ion kim loại chuyển tiếp. Alfred Werner (được
giải Nobel hóa học năm 1913) đã phân lập thành công một số phức chất giữa CoCl3 và
NH , trong đó có phức chất bát diện với công thức phân tử là CoCl . Tùy thuộc vào 3 34NH3
điều kiện tổng hợp, phức chất này có màu tím hoặc màu xanh. Khi cho lượng dư dung
dịch AgNO3 tác dụng với dung dịch chứa 1 mol phức chất này đều thu được 1 mol AgCl
kết tủa. Hãy xác định các công thức có thể có của phức chất nêu trên. Hướng dẫn giải: 36 Chuyên đề Kim loại
1. a) Gọi công thức của chất A là N xHy.
Ở cùng điều kiện về nhiệt độ và áp suất, một thể tích khí A có khối lượng bằng khối
lượng của cùng một thể tích khí oxi M = M = 32 A O2
14x + y.1 = 32 x= 2, y= 4 chất A là N2H4 ( hiđrazin)
Công thức cấu tạo của N2H4: Trong N
, cả hai nguyên tử N đều ở trạng thái lai hóa sp3, phân tử N 2H4 2H4 có thể coi là
sản phẩm thế một nguyên tử H trong NH3 bằng nhóm NH2
b) Dựa vào đặc điểm cấu tạo, so sánh tính bazơ, tính khử của N2H4 và NH3:
- Tính bazơ của NH3 lớn hơn N2H4 do phân tử N2H4 có thể coi là sản phẩm thế một
nguyên tử H trong NH3 bằng nhóm NH2, nguyên tử N có độ âm điện lớn, nhóm NH2 hút
electron làm giảm mật độ electron trên nguyên tử nitơ của N hơn so với của NH 2H4 3
tính bazơ của N2H4 yếu hơn NH3.
- Tính khử của N2H4 mạnh hơn NH3 vì do trong phân tử N2H4 có liên kết N-N kém bền (
do lực đẩy giữa 2 cặp electron chưa liên kết trên 2 nguyên tử N) phân tử N2H4 kém
bền nên thể hiện tính khử mạnh hơn NH3.
Do N2H4 có tính khử mạnh, phản ứng đốt cháy N2H4 tỏa ra một nhiệt lượng lớn
nên hiđrazin được sử dụng làm nhiên liệu cho tên lửa.
c) Tính nồng độ của dung dịch KMnO4:
- phản ứng chuẩn độ: 5 2- C O + 2 - MnO + 16 H+ → 10 CO 2 4 4 2 + 2 Mn2+ + 8 H2O 10 . 0, 05 . 2 C = 0,0201 (M) M(dd KMnO ) 4 5 . 9,95
N2H4 + Fe2(SO4)3 dung dịch B + chất khí X
Do N2H4 có tính khử, Fe3+ bị khử về Fe2+ dung dịch B có chứa Fe2+, chất khí X là một
hợp chất chứa N với số oxi hóa là x.
Phản ứng của dung dịch B với KMnO4: 5 Fe2+ + -
MnO + 8 H+ → 5Fe3+ + Mn2+ + 4 H 4 2O 37 Chuyên đề Kim loại
- Số mol Fe2+ trong dung dịch B là: 3 n 12, 40.10
. 0, 0201 . 5. 2 = 2,492.10-3 (mol) 2+ e F
Số mol N2H4 = 25.10-3. 0,025= 0,625.10-3 (mol)
Trong phản ứng N2H4 + Fe2(SO4)3 dung dịch B + chất khí X
Quá trình nhận electron Quá trình nhường electron Fe3+ + 1e Fe2+ 2N-2 2Nx + 2. (2+x) e
2,492.10-3 mol 2,492.10-3 mol
2.0,625.10-3mol 2.0,625.10-3 .(2+x) mol
Áp dụng bảo toàn electron: trong phản ứng oxi hóa khử số mol e nhận = số mol e nhường
2,492.10-3 = 2.0,625.10-3 .(2+x) 2+ x 2 x= 0
N-2 N0 + 2e vậy chất khí X là N2.
2) a) Pentaaminoaquơruteni(II) - [Ru(NH3)5H2O]2+ phản ứng với nitơ:
[Ru(NH3)5H2O]2+ + N2 = [Ru(NH3)5(N2)]2+ + H2O. b) Ru: [Kr]4d75s1 Ru – 2e → Ru2+ 4d75s1 4d6
Vì phức chất thuận từ, nên sự phân bố e trong AO 4d của Ru là:
AO 5s, các AO 5p và 2 AO 5d của Ru2+ tham gia lai hóa sp3d2.
Trên mỗi nguyên tử N trong năm phân tử NH và phân tử N 3
2 đều có cặp e tự do, tham gia
hình thành liên kết cho nhận với Ru2+. Các AO sp3d2: NH3 NH3 NH3 NH3 NH3 N2
Cấu trúc hình học của A2: 38 Chuyên đề Kim loại 2+ NH3 NH3 H Ru 3N N N NH3 NH3
Phức chất A2 có dạng bát diện.
Ruteni có hóa trị 6 và số oxi hóa là +2.
3. [Co(NH3)5Cl]2+ (kí hiệu A) và [Co(NH3)4(NH2)Cl]+ (kí hiệu B) là axit và bazơ liên hợp:
[Co(NH3)5Cl]2+ + H2O [Co(NH3)4(NH2)Cl]+ + H3O+. + [B][H O ] [B] K 3 K = (1) → a = (2) a [A] + [A] [H O ] 3
[Co(NH3)5Cl]2+ + OH- [Co(NH3)4(NH2)Cl]+ + H2O (*) [B] K = (3) - [A][OH ]
Thế (2) vào (3) nhận được: [B] K a K = = (4) - [A][OH ] KW
Theo giả thiết, với cân bằng (*) ở [OH-] = 1,0M có ít nhất 95% phức tồn tại dạng axit, do vậy có: [B] K 0, 05 a K = → K 5,26.10-16. - [A][OH ] K 0,95.1, 0 a W
4. Vì 1 mol phức CoCl3.4NH3 tác dụng dung dịch AgNO3 (dư) tạo 1 mol AgCl → chỉ có
1 Cl- ở cầu ngoại trong phân tử phức: [Co(NH3)4Cl2]Cl.
Do phức [Co(NH3)4Cl2]+ có cấu trúc bát diện nên có 2 đồng phân: 39 Chuyên đề Kim loại NH3 Cl Cl NH3 H3N NH3 Co Co Cl NH3 H3N NH3 NH3 Cl Dạng cis Dạng trans
Hai đồng phân này có màu sắc khác nhau (xanh và tím).
Bài 9: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2006)
Coban t¹o ra ®-îc c¸c ion phøc: CoCl (NH ) + (A), Co(CN) 3- (B), 2 3 4 6 CoCl (CN) 3- (C), 3 3
1. ViÕt tªn cña (A), (B), (C).
2. Theo thuyÕt liªn kÕt ho¸ trÞ, c¸c nguyªn tö trong B ë tr¹ng th¸i lai ho¸ nµo?
3. C¸c ion phøc trªn cã thÓ cã bao nhiªu ®ång ph©n lËp thÓ? VÏ cÊu tróc cña chóng.
4. ViÕt ph-¬ng tr×nh ph¶n øng cña (A) víi ion s¾t (II) trong m«i tr-êng axit. H-íng dÉn gi¶i: 1. Tªn cña c¸c ion phøc:
(A) §iclorotetraammincoban(III); (B) Hexaxianocobantat(III);
(C) Triclorotrixianocobantat(III).
2. Co(CN) 3-. Co : d2sp3 ; C : sp ; N : kh«ng ë vµo tr¹ng th¸i lai ho¸ hoÆc ë tr¹ng th¸i 6 lai ho¸ sp.
3. a. Ion phức (A) cã 2 ®ång ph©n: Cl Cl H3N H3N NH3 Cl Co Co H3N H3N NH3 NH3 Cl NH3
b. Ion phức (B) kh«ng cã ®ång ph©n: 40 Chuyên đề Kim loại CN NC CN Co NC CN CN
c. Ion phức (C) cã 2 ®ång ph©n: Cl CN NC NC CN Cl Co Co Cl Cl Cl Cl CN CN 4.
CoCl (NH ) + + Fe2+ + 4 H+ Co2+ + Fe3+ + 2 Cl- + 4 NH + 2 3 4 4
Bài 10: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2014)
a) Momen từ của dung dịch (nước) Fe(III) giảm từ ~6,0 BM (Bohr magneton) xuống ~1,8
BM , khi thêm lượng dư CN- vào dung dịch Fe(III). Hãy giải thích sự thay đổi momen từ
nói trên theo thuyết trường phối tử (hay thuyết trường tinh thể).
b) Cả Fe(II) và Fe(III) đều tạo thành phức chất bát diện bền với CN-. Bằng phương pháp
phổ, người ta đã xác định được độ dài liên kết Fe-C trong [Fe(CN)6]4- là 192 pm và trong
[Fe(CN)6]3- là 193 pm. Hãy giải thích sự khác biệt về độ dài liên kết đó theo thuyết obitan phân tử. H-íng dÉn gi¶i:
a) Trong dung dịch nước, Fe(III) tạo phức bát diện [Fe(OH2)6]3+. Khi thêm CN- với lượng
dư sẽ tạo thành [Fe(CN)6]3- do phức này rất bền. Theo thuyết trường phối tử (thuyết
trường tinh thể), trong trường bát diện, mức năng lượng d bị tách thành 2 mức: t2g (gồm dxy, dxz, dyz) và eg (gồm ,
). [Fe(H2O)6]3+ là phức spin cao, có cấu hình , có 5e độc thân: = 5,9 ≈ 6 BM.
[Fe(CN)6]3- là phức spin thấp, có cấu hình
, có 1e độc thân và có: = 1,73 (BM).
b) Giản đồ các mức năng lượng các MO của CN-: 41 Chuyên đề Kim loại AO - N- AO - C MO - CN- * σ z * π * x π y 2p 2p σ z π π x y * σ s 2s 2s σ s Cấu hình electron:
Trong phức [Fe(CN)6]3-, phối tử CN-, ngoài tạo liên kết σ với nguyên tử trung tâm kiểu L
→ M, còn có các MO-π* trống, có năng lượng tương đối cao, có thể tạo liên kết π với các
obitan có tính đối xứng π là và
của nguyên tử trung tâm theo kiểu M → L (liên
kết cho nhận ngược). Nói cách khác, CN- có MO trống có năng lượng tương đối cao nên
nó là phối tử π nhận (tạo thành liên kết π cho).
Liên kết π có tác dụng tương hỗ với liên kết σ làm cho phức rất bền. Do Fe3+ có mật độ
điện tích dương lớn hơn Fe2+ nên sự chuyển electron theo kiểu M → L của Fe3+ yếu hơn
Fe2+, làm cho liên kết M → L trong phức này của Fe(III) kém bền hơn trong phức của 42 Chuyên đề Kim loại
Fe(II). Do vậy, liên kết Fe-C trong phức chất [Fe(CN)
6]4- có độ dài ngắn hơn trong phức chất [Fe(CN)6]3-.
Bài 11: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2014)
a) Phức chất A là phức chất của Pt(II), có cấu trúc vuông phẳng, chứa Pt, NH3 và Cl
với % khối lượng lần lượt là 65,00%; 11,33% và 23,67%. Viết công thức cấu trúc của
phức chất thỏa mãn điều kiện trên, biết phân tử khối của A nhỏ hơn 1000.
b) Khi cho phức chất cis-[Pt(NH
] (cấu trúc vuông phẳng) tương tác với 3)2Cl2
tetrametylen điamin (tetraen) người ta tách ra được một phức chất 2 nhân B của Pt(II) có
công thức [Pt2Cl4(NH3)2(tetraen)] (B). Kết quả thử nghiệm cho thấy chất B có khả năng
kháng tế bào ung thư cao. Viết công thức cấu tạo, mô tả sự hình thành liên kết (theo
thuyết VB) trong phức chất B.
c) Khi nghiên cứu cơ chế phản ứng thế phối tử trong phức chất vuông phẳng người ta
nhận thấy rằng tốc độ thay thế phối tử X bởi một phối tử Y chịu ảnh hưởng của phối tử Z
(Z nằm ở vị trí trans so với X). Nếu Z càng hoạt động về ảnh hưởng trans thì X càng linh
động và càng dễ bị thế. Z L Z L Pt + Y Pt + X L X L Y Từ K
], viết sơ đồ điều chế phức chất 2[PtCl4
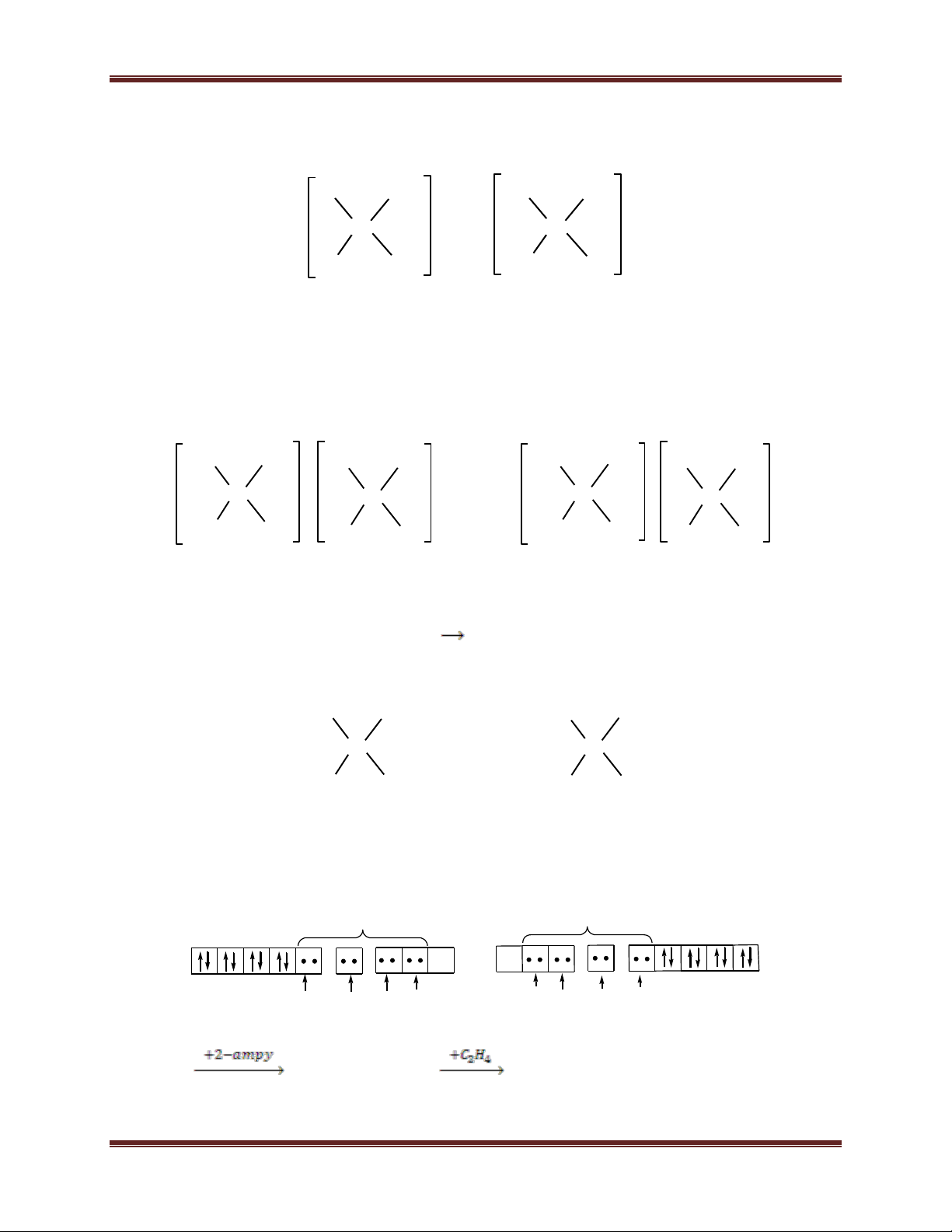
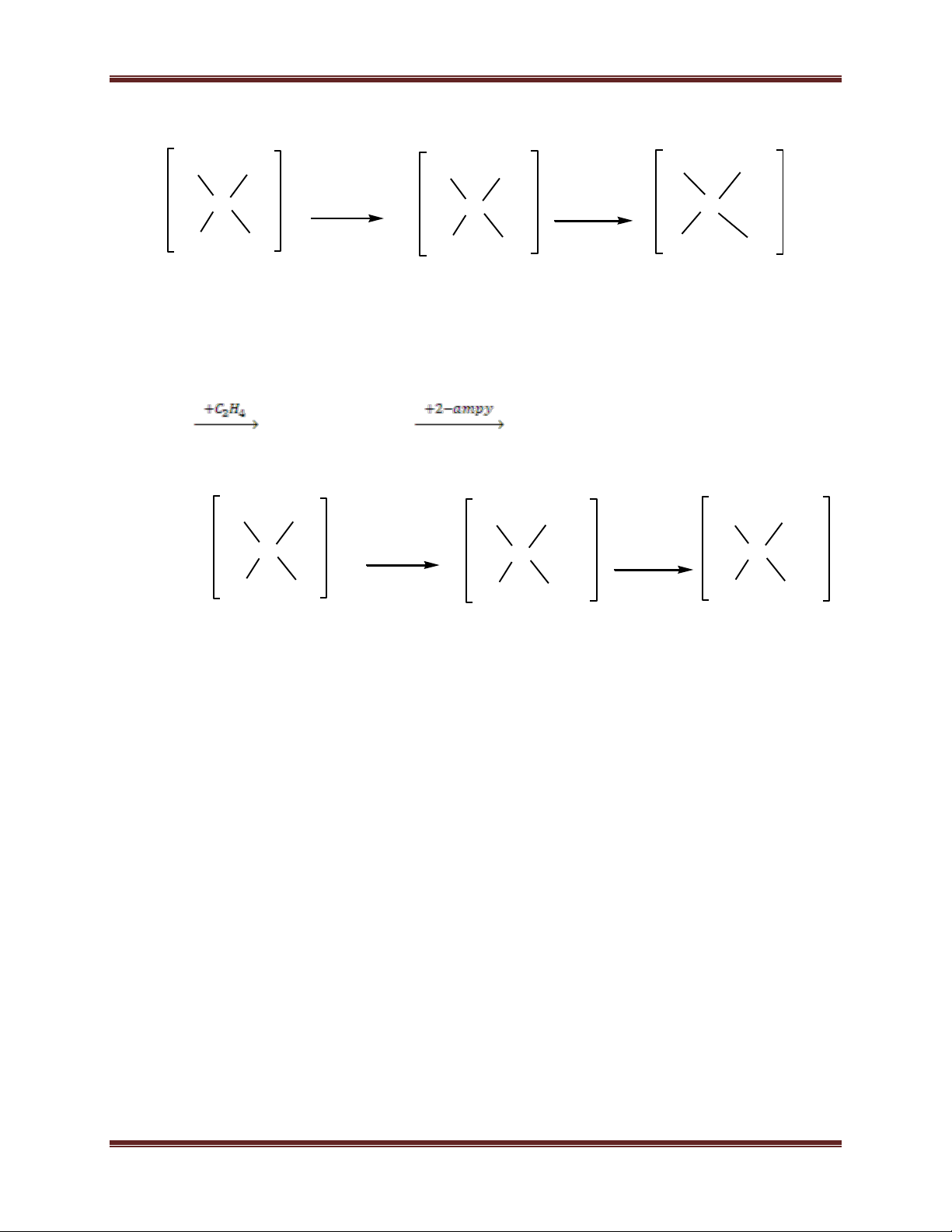
cis và phức chất trans-[Pt(C2H4)(2-ampy)Cl2]
(trong đó 2-ampy là 2-aminopiriđin). Biết thứ tự ảnh hưởng trans của các phối tử: C2H4 >
Cl- > 2-ampy. Trong phức chất trên, nguyên tử kim loại trung tâm Pt liên kết với phối tử
2-aminopiriđin qua nguyên tử nitơ nào? Giải thích.
Cho biết: Cấu hình electron của Pt: [Xe]4f145d96s1 H-íng dÉn gi¶i:
a) Tỉ lệ Pt : NH3 : Cl =
Các phức chất A có công thức phân tử là [Pt(NH3)2Cl2]n. (M = 300n)
Vì khối lượng phân tử của phức chất này nhỏ hơn 1000 u nên n = 1 hoặc n = 2 hoặc n = 3. 43 Chuyên đề Kim loại
- Nếu n = 1: công thức phân tử là [Pt(NH
], có 2 đồng phân cis và trans. 3)2Cl2 Cl NH Cl NH 3 3 Pt Pt Cl NH H 3 3N Cl cis trans
- Nếu n = 2: công thức phân tử là Pt , có 2 đồng phân: [Pt(NH 2(NH3)4Cl4 3)4][PtCl4]; [Pt(NH3)3Cl][PtCl3(NH3)]. 2+ 2- + - H NH H Cl 3N 3 Cl Cl 3N Cl NH3 Pt Pt ; Pt Pt H3N NH H 3 Cl Cl 3N NH3 Cl Cl
- Nếu n = 3: công thức phân tử là Pt : có 2 đồng phân: 3Cl6(NH3)6 [Pt(NH
]. (vẽ tương tự như trên).
3)4][PtCl3(NH3)]2; [Pt(NH3)3Cl]2[PtCl4
b) cis-[Pt(NH3)2Cl2] + H2N-(CH2)4-NH2
[Pt2Cl4(NH3)2(tetraen)] (B)
Cấu trúc bền của B: Cl NH3 H Cl 3N Pt Pt Cl NH2-CH2CH2CH2CH2-H2N Cl
-Vì chất đầu có cấu hình cis nên trong phức chất B, 2 nguyên tử Cl cũng ở vị trí cis, phân
tử tetrametilen điamin làm cầu nối giữa 2 nguyên tử trung tâm Pt.
-Mô tả sự hình thành liên kết (theo thuyết VB) trong phức chất B: Pt2+ [Xe]5d8. lai hóa dsp2 lai hóa dsp2 5d 6s 6p 6p 6s 5d Cl- Cl- NH NH 3 2-CH2-CH2-CH2-CH2-NH2 Cl- Cl- NH3
c) Sơ đồ phản ứng điều chế phức chất cis: K2[PtCl4] K[Pt(2-ampy)Cl3]
cis-[Pt(C2H4)(2-ampy)Cl2] 44 Chuyên đề Kim loại 2- - Cl Cl Cl C2H4 Cl Cl Pt + 2-ampy Pt + C2H4 Pt Cl Cl Cl Am Cl Am
Vì Cl- có ảnh hưởng trans mạnh hơn 2-ampy nên nguyên tử Cl ở vị trí trans với Am khó
bị thế, phản ứng thế tiếp theo C2H4 thế vào nguyên tử Cl ở vị trí cis so với Am tạo ra đồng phân cis.
- Sơ đồ phản ứng điều chế phức chất trans: K2[PtCl4] K[Pt(2-ampy)Cl3]
trans-[Pt(C2H4)(2-ampy)Cl2] 2- - Cl Cl Cl Cl Am Cl Pt + C2H4 Pt + 2-ampy Pt Cl Cl Cl C Cl C 2H4 2H4
Vì C2H4 có ảnh hưởng trans mạnh hơn Cl- nên nguyên tử Cl ở vị trí trans so với C2H4
dễ bị thế, phản ứng thế tiếp theo 2-ampy thế vào nguyên tử Cl ở vị trí trans so với C2H4
tạo ra đồng phân trans.
Trong phức chất trên, nguyên tử kim loại trung tâm Pt liên kết với phối tử 2-
aminopiriđin qua nguyên tử N của vòng piriđin mà không liên kết qua nguyên tử N của
nhóm NH2 vì cặp electron chưa liên kết trên nguyên tử N của nhóm NH2 đã bị vòng
piriđin hút nên mật độ electron giảm, khó có khả năng tạo phức. Còn cặp electron chưa
liên kết trên nguyên tử N của vòng piriđin (nằm trên obitan lai hóa sp2), mật độ electron
lớn hơn nên dễ tạo liên kết phối trí với nguyên tử kim loại trung tâm.
III. BÀI TẬP XÁC ĐỊNH KIM LOẠI CHUYỂN TIẾP DỰA VÀO HIỆN TƯỢNG PHẢN ỨNG
Kiến thức về tính chất vật lí và các phương trình hóa học về tính chất hóa học, điều
chế của kim loại chuyển tiếp rất đa dạng và phong phú. Do đó việc tổng hợp lí thuyết về
kim loại chuyển tiếp rất khó khăn. Trong chuyên đề này chúng tôi không trình bày hệ 45 Chuyên đề Kim loại
thống lí thuyết cụ thể về từng kim loại mà chỉ tổng hợp hệ thống bài tập về xác định kim
loại chuyển tiếp thông qua dữ kiện của đề bài.
1. Bài tập cơ bản
Bài 1: A là chất bột màu lục không tan trong axit và kiềm loãng. Khi nấu chảy A với
KOH có mặt không khí chuyển thành chất B có màu vàng, dễ tan trong H2O. Chất B tác
dụng với dd H2SO4 tạo thành chất C có màu da cam. Chất C bị S khử thành chất A và có
thể oxi hóa axit clohiđric thành khí Clo. Viết các phương trình phản ứng xảy ra. Hướng dẫn giải:
Các phương trình phản ứng:
2Cr2O3 + 3O2 + 8KOH 4K2CrO4 + 4H2O
2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O o S + K t 2Cr2O7 Cr2O3 + K2SO4
14HCl + K2Cr2O7 3 Cl2 + 2CrCl3 + 2KCl + 7H2O
Bài 2: Viết phương trình hoá học cho mỗi trường hợp sau:
a) Cho khí amoniac (dư) tác dụng với CuSO4.5H2 O.
b) Trong môi trường bazơ, H2O2 oxi hoá Mn2+ thành MnO2.
c) Trong môi trường axit, H khử MnO - 2O2 4 thành Mn2+. Hướng dẫn giải: a) Có thể viết CuSO O ở dạng [Cu(H
O. Do đó khi phản ứng xảy ra, 4.5H2 2O)4] SO4.H2 NH O ở cầu nội:
3 sẽ thế các phân tử H2
[Cu(H2O)4] SO4.H2O + 4 NH 3 [Cu(NH3)4] SO4.H2O + 4 H2O b) H2O2 + 2 e 2 OH Sự khử Mn2+ + 4 OH 2 e MnO + 2 H O Sự oxi hóa 2 2 Mn2+ + H O + 2 OH MnO + 2 H O 2 2 2 2 c) 2 MnO + 8 H O+ + 5 e Mn2+ + 12 H O Sự khử 4 3 2 46 Chuyên đề Kim loại 5 H 2O2 + 2 H2O 2 e O2 + 2 H3O+ Sự oxi hoá 2MnO - + 5 H O + 6 H O+ 2 Mn2+ + 5 O + 14 H O 4 2 2 3 2 2
Bài 3: (QG 2006) Một hỗn hợp rắn A gồm kim loại M và một oxit của kim loại đó.
Người ta lấy ra 3 phần, mỗi phần có 59,08 gam A. Phần thứ nhất hoà tan vào dung dịch
HCl thu được 4,48 lít khí hiđro; phần thứ hai hoà tan vào dung dịch của hỗn hợ p NaNO3 và H
thu được 4,48 lít khí NO; phần thứ ba đem nung nóng rồi cho tác dụng với khí 2SO4
hiđro dư cho đến khi được một chất rắn duy nhất, hoà tan hết chất rắn đó bằng nước
cường toan thì có 17,92 lít khí NO thoát ra. Các thể tích khí đo ở điều kiện tiêu chuẩn.
Hãy tính khối lượng nguyên tử, cho biết tên của kim loại M và công thức oxit trong hỗn hợp A. Hướng dẫn giải:
Kí hiệu số mol kim loại M có trong 59,08 gam hỗn hợp A là x (x > 0).
Giả thiết a): M có duy nhất một mức (hay số) oxi hoá là n+ :
Khi hoà tan 59,08 gam hỗn hợp A vào dung dịch HCl thu được khí hiđro theo phương trình:
M + n HCl → MCln + 0,5 n H2 (1) x mol 0,5 nx mol
Khi hoà tan 59,08 gam hỗn hợp A vào dung dịch của hỗn hợp (cũng NaNO3 và H2SO4
chính là dung dịch HNO ) ta thu được khí NO: 3 –
3 M + n NO3 + 4n H+ → 3 Mn+ + n NO (k) + 2n H2O (2) x mol (nx : 3) mol NO
Theo đề bài có số mol H2 bằng số mol NO (đều bằng 4,48 : 22,4 = 0,2 (mol)).
Theo lập luận trên lại có 0,5 nx mol H2 khác với (nx : 3) mol NO.
Vậy giả thiết a) này không phù hợp.
Giả thiết b): Xét M có hai mức (số) oxi hoá khác nhau:
*) Trong phản ứng (1), M có mức oxi hoá n+.
Từ liên hệ trên, ta thu được 0,5 nx mol H2 (a)
*) Trong phản ứng (2), M có mức oxi hoá m+. Ta có: 47 Chuyên đề Kim loại -
3 M + m NO3 + 4 m H+ → 3 Mm+ + m NO (k) + 2m H2O (2) x mol (mx : 3) mol
Số mol NO thu được là mx/3 mol (b)
Theo đề bài có số mol H2 bằng số mol NO. Vậy từ ( a ) và ( b ) ta có:
(1/2) nx = (1/3) mx (c). Từ đây ta có: n/m = 2/3 = 4/6 = 6/9 = . . . (d)
Ta đã biết các kim loại có số oxi hoá n hay m không vượt quá 4+.
Vậy kim loại M được xét ở đây có đồng thời n = 2 và m = 3. Giả thiết b) là hợp lí.
c) Xác định M và oxit của nó:
c.1) Xét trường hợp M có số oxi hoá m = 3 trong oxít: hỗn hợp A gồm M và M2O3. Với phản ứng M → 2O3 + 3 H2 2 M + 3H2O (3)
ta cũng thu được kim loại M. Vậy chất rắn duy nhất là kim loại M.
Khi tác dụng với nước cường toan (là chất oxi hoá rất mạnh) M chuyển thành M3+ trong
phản ứng M + 3 HCl + HNO3 → MCl3 + NO (k) + 2 H2O (4)
Theo (1) có 0,5 nx = 0,2 mà n = 2 vậy x = 0,2
Theo (4) tổng số mol M trong 59,08 g hỗn hợp A là:
nM = nNO = 17,92/22,4 = 0,8 (mol)
Biết số mol M ban đầu có trong 59,08 g A là x = 0,2. Vậy số mol M do phản ứng
(3) tạo ra là 0,8 - 0,2 = 0,6 (mol). Theo công thức M2O3 thì 0,6 mol này tương ứng với số
mol oxit là 0,6 : 2 = 0,3 (mol).
Kí hiệu khối lượng mol phân tử M là X, ta có phương trình:
0,2 X + (2 X + 16 x 3) x 0,3 = 59,08. Vậy X = 55,85 (g/mol).
Suy ra nguyên tử khối của M là 55,85 ~ 56. Do đó M là Fe và oxit là Fe 2O3.
c.2) Vấn đề được đặt ra tiếp theo là: Trong hỗn hợp A có oxit nào khác chứ không phải
Fe2O3? Có một số cách trả lời câu hỏi này. Ta xét cách sau đây:
Kí hiệu số oxi hoá của Fe trong oxit này là z. Vậy công thức oxit là Fe2Oz.
Theo kết quả tính ở trên, trong 59,08 gam hỗn hợp A có 0,2 mol Fe nên số gam
Fe2Oz là 59,08 - 0,2.55,85 = 47,91 (g) tương ứng với số mol được kí hiệu u.
Số mol NO do Fe từ Fe2Oz tác dụng với nước cường toan tạo ra là 48 Chuyên đề Kim loại 2 u = 0,6 → u = 0,3 (5)
Đưa kết quả này vào liên hệ về số gam Fe2Oz , ta có:
0,3.(55,85 . 2 + 16z) = 47,91 → z = 3 (6) Vậy Fe2Oz là Fe2O3
Kết luận: Hỗn hợp A gồm M là Fe, oxit chính là Fe (không thể là oxit khác). 2O3
2. Một số bài tập nâng cao
Bài 1: (QG 2009) Trong thư ̣c tế thành phần của quặng cromit có thể biểu diễn qua hàm
lươ ̣ng của các oxit . Một quặng cromit chứa: 45,60% Cr2O3, 16,12% MgO và 7,98%
Fe2O3. Nếu biểu diễn dưới da ̣ng các cromit thì các cấu tử của quặng này là : Fe(CrO2)2, Mg(CrO2)2, MgCO3 và CaSiO3.
1. Xác định thành phần của quặng qua hàm lươ ̣ng của Fe (CrO2)2, Mg(CrO2)2, MgCO3 và CaSiO3.
2. Nếu viết công thức của quặng dưới da ̣ng xFe (CrO2)2.yMg(CrO2)2.zMgCO3.dCaSiO3
(x, y, z và d là các số nguyên) thì x, y, z và d bằng bao nhiêu?
3. Khi cho một mẫu quặng này tác dụng với axit HCl thì chỉ có các chất không chứa crom
mới tham gia phản ứng. Viết các phương trình phản ứng ở dạng phân tử và dạng ion đầy đủ. Hướng dẫn giải:
1. Giả sử có 100g mẫu quặng: m(Fe O ) × 2 × M(Fe) 7,89 × 111,70 2 3 m(Fe) = = 5,52(g) M(Fe O ) 159,70 2 3 Mẫu quặng chứa: M(Fe(CrO ) ) × m(Fe) 223,85 × 5,52 2 2 m(Fe(CrO ) ) = = = 22,12(g) 2 2 M(Fe) 55,85 22,12% Fe(CrO2)2.
Khối lượng Cr trong Fe(CrO2)2: m(Fe(CrO ) ) × 2 × M(Cr) 22,12 × 104,0 2 2 m (Cr) = = 10, 28(g) 1 M(Fe(CrO ) ) 223,85 2 2
Khối lượng Cr trong mẫu quặng là: m(Cr O ) × 2 × M(Cr) 45,60 × 104 2 3 m (Cr) = = = 31,20(g) 2 M(Cr O ) 152,0 2 3 49 Chuyên đề Kim loại
Khối lượng Cr trong Mg(CrO 2)2:
m (Cr) = m (Cr) - m (Cr) = 31,20 - 10,28 = 20,92 (g) 3 2 1 Mẫu quặng chứa: M(Mg(CrO ) ) × m (Cr) 192,31 × 20,92 2 2 3 m(Mg(CrO ) ) = = = 38,68(g) 2 2 2 × M(Cr) 104 38,68 % Mg(CrO2)2.
Khối lượng Mg trong Mg(CrO2)2: m(Mg(CrO ) ) × M(Mg) 38,68 × 24,31 2 2 m (Mg) = = = 4,89(g) 1 M(Mg(CrO ) ) 192,31 2 2
Khối lượng Mg trong mẫu quặng là: m(MgO) × M(Mg) 16,12 × 24,31 m (Mg) = = = 9,72(g) 2 M(MgO) 40.31
Khối lượng Mg trong MgCO3:
m (Mg) = m (Mg) - m (Mg) = 9,72 - 4,89 = 4,83(g) 3 2 1
Khối lượng MgCO trong mẫu quặng là: 3 M(MgCO ) × m (Mg) 84,32 × 4,83 3 3 m(MgCO ) = = = 16,75(g) 16,75% MgCO 3 3 M(Mg) 24,31
Khối lượng CaSiO trong mẫu quặng là: 3
m(CaSiO ) = 100 - (m(Fe(CrO ) ) + m(Mg(CrO ) ) + m(MgCO )) = 3 2 2 2 2 3
= 100 - (22,12 + 38,68 + 16,75) = 100 - 77,55 = 22,45g 22,45% CaSiO3
2. Tỉ lệ mol của các chất:
n (Fe(CrO ) ) : n(Mg(CrO ) ): n(MgCO ) : n(CaSiO ) 2 2 2 2 3 3
m(Fe(CrO ) ) m(Mg(CrO ) ) m(MgCO ) m(CaSiO ) 2 2 2 2 3 3 : : :
M(Fe(CrO ) ) M(Mg(CrO ) ) M(MgCO ) M(CaSiO ) 2 2 2 2 3 3 22,12 38, 68 16, 75 22, 45 : : :
0,10 : 0, 20 : 0, 20 : 0,19 1: 2 : 2 : 2 223,85 192, 31 84, 32 116,17 3. MgCO3 + 2HCl MgCl2 + CO2 + H2O MgCO ↑ + H 3 + 2H+ + 2Cl- Mg2+ + 2Cl- + CO2 2O CaSiO3 + 2HCl CaCl2 + SiO2 + H2O CaSiO ↓ + H 3 + 2H+ + 2Cl- Ca2+ + 2Cl- + SiO2 2O
Bài 2: (QG 2012)
a) Tại sao crom có khả năng thể hiện nhiều trạng thái oxi hoá? Cho biết những số oxi hóa phổ biến của crom? 50 Chuyên đề Kim loại
b) Nêu và nhận xét sự biến đổi tính chất axit – bazơ trong dãy oxit: CrO, Cr 2O3, CrO3.
Viết phương trình hoá học của các phản ứng để minh họa.
c) Viết phương trình ion của các phản ứng điều chế Al2O3 và Cr2O3 từ dung dịch gồm
kali cromit và kali aluminat. Hướng dẫn giải:
a) Cấu hình electron của crom là [Ar]3d54s1 nên không chỉ có electron ở phân lớp 4s
mà có cả các electron ở phân lớp 3d tham gia phản ứng hóa học. Do đó trong các hợp
chất, crom có số oxi hóa thay đổi từ +1 đến + 6, nhưng trong đó phổ biến nhất là những số oxi hóa +2, +3, +6
b) Do crom có nhiều trạng thái oxi hóa nên tính chất axit-bazơ của các oxit của crom
cũng thay đổi trong khoảng rộng:
- Ở mức oxi hóa thấp, oxit của crom (CrO) thể hiện tính chất bazơ: CrO + 2 H+ Cr2+ + 2 H2O
- Ở mức oxi hóa trung gian (+3), Cr2O3 thể hiện tính chất lưỡng tính:
Cr2O3 + 6 H+ 2 Cr3+ + 3 H2O Cr 2O3 + 2 OH- 2 CrO + H 2 2O
- Ở mức oxi hóa cao (+6), CrO3 thể hiện tính chất axit: CrO3 + H2O H2CrO4 2 CrO3 + H2O H2Cr2O7 c) Điều chế Al từ dung dịch gồm KCrO 2O3 và Cr2O3 2 và KAlO2:
Thêm HCl vào dung dịch hỗn hợp: - CrO + 4 H+ Cr3+ 2 + 2 H2O - AlO + 4 H+ Al3+ 2 + 2 H2O Oxi hóa Cr3+ thành 2- Cr O : 2 7 2 Cr3+ + 3 ClO- + 4 H - 2O 3 Cl- + 2 Cr O + 8 H+ 2 7
Thêm NH3 (dư) vào dung dịch để kết tủa Al3+ dưới dạng Al(OH)3: Al3+ + 3 NH 3 + 3 H2O Al(OH)3 + 3 NH 4
Tách Al(OH)3 để điều chế Al2O3: 2 Al(OH)3 t Al2O3 + 3 H2O Khử 2- Cr O về Cr3+: 2 7 2-
Cr O + 9 I- + 14 H+ 2 Cr3+ + 3 - I + 7 H 2 7 3 2O
Kết tủa, tách Cr(OH) để điều chế Cr 3 2O3: 51 Chuyên đề Kim loại Cr3+ + 3 OH- Cr(OH)3 2 Cr(OH)3 t Cr2O3 + 3H2O
Bài 3: (QG 2012)
1. Hoà tan hoàn toàn 0,8120 gam một mẫu quặng sắt gồm FeO, Fe2O3 và 35% tạp chất trơ
trong dung dịch HCl (dư), thu được dung dịch X. Sục khí SO2 vào dung dịch X, thu được
dung dịch Y. Dung dịch Y phản ứng vừa đủ với 22,21 ml dung dịch KMnO4 0,10 M. Mặt
khác, hoà tan hết 1,2180 gam mẫu quặng trên trong dung dịch HCl (dư) rồi thêm ngay
dung dịch KMnO4 0,10 M vào dung dịch thu được cho đến khi phản ứng xảy ra hoàn toàn,
thì hết 15,26 ml dung dịch KMnO4 0,10 M.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính thể tích SO (ở điều kiện tiêu chuẩn) đã dùng và thành phần phần trăm theo khối 2
lượng của FeO, Fe2O3 có trong mẫu quặng. Hướng dẫn giải: 1. a) FeO + 2 HCl FeCl2 + H2O (1)
Fe2O3 + 6 HCl 2 FeCl3 + 3 H2O (2) 2 FeCl 3 + 2 H2O + SO2 2 FeCl2 + H2SO4 + 2 HCl (3)
5 FeCl2 + KMnO4 + 8 HCl 5 FeCl3 + MnCl2 + KCl + 4 H2O (4)
5 SO2 + 2 KMnO4 + 2 H2O 2 H2SO4 + 2 MnSO4 + K2SO4 (5)
(Lượng HCl dùng để hòa tan quặng không được cho quá dư, chỉ đủ để làm môi trường cho phản ứng (4)) b) Từ (1) và (4) ta có:
nFeO (trong 1,2180 gam mẫu) = n n 2 = 5.
= 5 . 0,10 . 15,26.10-3 = 7,63.10-3 Fe MnO4 (mol) 3 - 7,63.10 . 0,8120
nFeO (trong 0,8120 gam mẫu) = = 5,087.10-3 (mol) 1,2180
mFeO (trong 0,8120 gam mẫu) = 72 . 5,087.10-3 = 0,3663 (g)
và mFe (trong 0,8120 gam mẫu) = 0,8120 . 0,65 – 0,3663 = 0,1615 (g) 2 3 O 0,1615 n 1,01.10-3 (mol) Fe (trong 0,8120 gam mẫu) = 2 3 O 160
Tương tự, từ (3) và (5) ta có: n n n SO SO (3) SO (5) 2 2 2 Trong đó: 1 n = . n = n SO (3) FeCl (trong 0,8120 gam mẫu)
Fe O (trong 0,8120 gam mẫu) = 1,01.10-3 (mol) 2 3 2 2 3 52 Chuyên đề Kim loại 5 5 1 n n = (n n ) - SO (5) - 2 2 MnO (5) MnO Fe 4 2 4 2 5 với: n = n + 2.n 2 FeO (trong 0,8120 gam mẫu) (trong 0,8120 gam mẫu) Fe Fe2 3 O 5 1 n = (n (n + 2.n SO - (trong 0,8120 gam mẫu) (trong 0,8120 gam mẫu)) 2 (5) FeO MnO Fe O 4 2 5 2 3 5 1 3 - 3 - 3 - n =
0,10 . 22,21.10 - (5,087.10 + 2 . 1,01.10 ) 2.10-3 (mol). SO 2 (5) 2 5
Vậy: n 3,01.10-3 (mol) V = 22,4 . 3,01.10-3 = 0,0674 (lit) SO SO 2 2 0,3663 % FeO = .100 = 45,11 % 0,8120
% Fe2O3 = 65 % – 45,11 % = 19,89 %
Bài 4: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2005)
1. Hoà tan sản phẩm rắn của quá trình nấu chảy hỗn hợp gồm bột của một khoáng vật
màu đen, kali hiđroxit và kali clorat, thu được dung dịch có màu lục đậm. Khi để trong
không khí, màu lục của dung dịch chuyển dần thành màu tím. Quá trình chuyển đó còn
xảy ra nhanh hơn nếu sục khí clo vào dung dịch hay khi điện phân dung dịch.
a. Hãy cho biết khoáng vật màu đen là chất gì.
b. Viết phương trình của tất cả các phản ứng xảy ra trong quá trình thí nghiệm.
2. Nung hỗn hợp A gồm sắt và lưu huỳnh sau một thời gian được hỗn hợp rắn B. Cho
B tác dụng với dung dịch HCl dư, thu được V1 lít hỗn hợp khí C. Tỉ khối của C so với
hiđro bằng 10,6. Nếu đốt cháy hoàn toàn B thành Fe2O3 và SO2 cần V2 lít khí oxi.
a. Tìm tương quan giá trị V1 và V2 (đo ở cùng điều kiện).
b. Tính hàm lượng phần trăm các chất trong B theo V1 và V2.
c. Hiệu suất thấp nhất của phản ứng nung trên là bao nhiêu phần trăm.
d. Nếu hiệu suất của phản ứng nung trên là 75%, tính hàm lượng phần trăm các chất trong hỗn hợp B.
Cho biết S = 32; Fe = 56; O = 16. Hướng dẫn giải:
1. Khoáng vật màu đen là MnO2.
Dung dịch màu lục đậm chuyển dần thành màu tím khi để trong không khí chỉ có thể là dung dịch MnO 2-
4 vậy phản ứng xảy ra khi nấu chảy hỗn hợp là 53 Chuyên đề Kim loại 3MnO
2 + 6KOH + 6KlO3 3K2MnO4 + 3H2O + KCl (1)
3K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH (2) 2KOH + CO2 K2CO3 + H2O (3)
Phản ứng này làm cân bằng (2) chuyển dịch dần sang phải
2K2MnO4 + Cl2 2KMnO4 + 2KCl 2K2MnO4 + 2H2O dd dp 2KMnO4 + 2KOH + H2 to 2. Fe + S FeS.
Thành phần B gồm có FeS, Fe và có thể có S. FeS + 2HCl FeCl2 + H2S Fe + 2HCl FeCl2 + H2.
Vậy trong C có H2S và H2 . Gọi x là % của H2 trong hỗn hợp C .
(2x+34(100-x))/100 = 10,6.2 = 21,2 x = 40%
Vậy trong C, H2 = 40% theo số mol ; H2S = 60%. a) Đốt cháy B : o 4FeS + 7O t 2 2Fe2O3 + 4SO2 4Fe + 3O2 2Fe2O3 S + O2 SO2 .
Thể tích O2 đốt cháy FeS là: (3V1/5) . (7/4) = 21V1/20.
Thể tích O2 đốt cháy Fe là: (2V1/5) . (3/4) = 6V1/20.
Tổng thể tích O2 đốt cháy FeS và Fe là: 21V1/20 + 6V1/20 = 27V1/20. Thể tích O . Vậy V
2 đốt cháy S là: V2- (27V1/20) = V2 - 1,35 V1 2 ≥ 1,35 V1 3V1 88 x 100 x 5280V 165V b) 5 % 1 1 FeS % 3V 2V 1 1 , 75 2V ( 32 V 35 , 1 V ) V V 88 x x56 ( 32 V 35 , 1 V ) 1 2 1 2 1 5 5 2 1 2V1 x56 100 x 70 5 V % 1 Fe % ( 32 V V ) V V 2 1 2 1 ( 32 V 35 , 1 V ) 100 x 100V 135V ) % 2 1 2 1 S % ( 32 V V ) V V 2 1 2 1 54 Chuyên đề Kim loại
c) Nếu dư S so với Fe thì tính hiệu suất phản ứng theo Fe. Trường hợp này H = 60%. Nếu
dư Fe so với S tính hiệu suất phản ứng theo S. Trường hợp này H > 60% Vậy hiệu suất
thấp nhất của phản ứng nung trên là 60%.
d) Nếu H = 75% có nghĩa là n /5 Vậy n
FeS = 3ns dư. nFeS tỷ lệ 3V1 S tỷ lệ với V1/5. 5280V 5280V % 1 1 FeS % 7 , 64 32V1 6 , 81 V , 75 2 1 V 1 5 2240V % 1 Fe , 27 % 45 6 , 81 V1
%S = 100 - (64,7+27,45) = 7,85%
Bài 5: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2010) Cho s¬ ®å c¸c ph¶n øng: FeSO4 B kÕt tña tr¾ng
Fe2(SO4)3 ®Æc C kÕt tña xanh ®Ëm FeCl KCN ®Æc, d- 2 (dd) A (dd) AgNO3 D kÕt tña tr¾ng FeCl2 G kÕt tña xanh KMnO4, H+ E (dd)
Pb(OH)2, KOH A + F kÕt tña n©u
1. Viết phương trình ion của các phản ứng xảy ra theo sơ đồ trên.
2. Hãy cho biết từ tính của hợp chất A, dùng thuyết lai hóa để giải thích. Hướng dẫn giải:
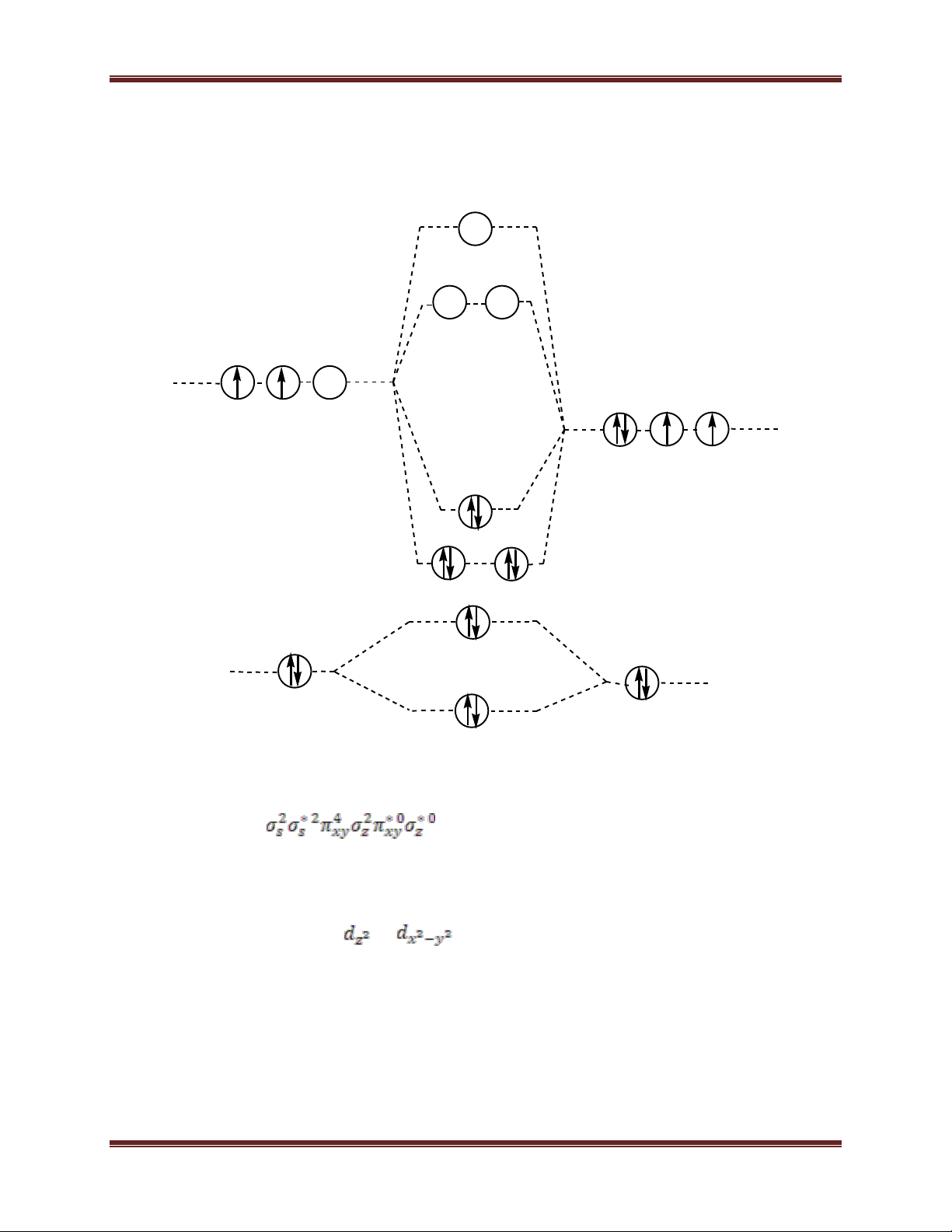
1. Các phương trình phản ứng: Fe2+ + 6 CN- 4- [Fe(CN) ] (A) 6 4- [Fe(CN) ] + 2 Fe2+ Fe 6 2[Fe(CN)6] trắng (B) 3 4- [Fe(CN) ] + 4 Fe3+ Fe xanh đậm (C) 6 4[Fe(CN)6]3 4- [Fe(CN) ] + 4 Ag+ Ag 6 4[Fe(CN)6] trắng (D) 5 4- [Fe(CN) ] + - MnO + 8 H+ Mn2+ + 4 H [Fe(CN) ] (E) 6 4 2O + 5 3- 6 2 3- [Fe(CN) ] + 3 Fe2+ Fe xanh (G) 6 3[Fe(CN)6]2 Hoặc K+ + 3-
[Fe(CN) ] + Fe2+ KFe[Fe(CN) xanh 6 6] 2 3-
[Fe(CN) ] + Pb(OH) + 2 OH- 2 4- [Fe(CN) ] + 2 H (F) 6 2 6 2O + PbO 2 nâu
2. Cấu hình electron của Fe2+ là [Ar]3d64s04p04d0 55 Chuyên đề Kim loại 3d6 4s0 4p0 4d0
Vì CN- là phối tử trường mạnh, do đó khi tạo phức với Fe2+, 4 electron độc thân trên
4 obitan 3d của Fe(II) bị ghép đôi, giải phóng 2 obitan 3d trống. Hai obitan này lai hóa
với 1 obitan 4s và 3 obitan 4p, tạo thành 6 obitan lai hóa d2sp3 hướng về 6 đỉnh của hình
bát diện đều. Mỗi obitan lai hóa này xen phủ với một obitan tự do có hai electron của CN-
, tạo ra 6 liên kết cho nhận, hình thành phức 4-
[Fe(CN) ] lai hóa trong, có cấu trúc bát diện. 6
Phức này nghịch từ vì có tổng spin bằng không: CN- CN- CN- CN- CN- CN- ↓ ↓ ↓ ↓ ↓ ↓ d2sp3
Bài 6: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2012)
1. Tính hằng số cân bằng K ở 250C của phản ứng: Pb2+ (dd) + HCO - 3 (dd) PbCO3 + H+(dd)
Cho biết ở 250C: T(PbCO3) = 7,4.10-14; pKa2(H2CO3) = 10,33.
2. PbCO3 và ZnO thường được sử dụng làm bột tạo màu trắng. H2S trong không khí có
thể làm hư hại các bột màu này do các phản ứng sau: PbCO3 (r) + H2S (k) PbS (r) + CO2 (k) + H2O (h) (1) ZnO (r) + H2S (k) ZnS (r) + H2O (h) (2)
a) Tính hằng số cân bằng của các phản ứng (1) và (2).
b) Cần khống chế nồng độ tối đa của H S trong không khí bằng bao nhiêu g/m3 2 để các
bột màu nói trên không bị hư hại?
c) Trong 2 chất màu nói trên, chất nào ưu thế hơn khi môi trường có H S, tại sao? 2
d) Bằng cách xử lí với dung dịch H
, có thể làm trắng lại các mảng bị đổi màu do sự 2O2
hình thành PbS. Viết phương trình của phản ứng xảy ra trong cách xử lí này.
e) Hãy chứng tỏ rằng, về mặt nhiệt động học, oxi của không khí có thể thay thế H2O2
trong phương pháp xử lí trên. 56 Chuyên đề Kim loại
g) Trong thực tế, ngay cả khi không khí chưa bị ô nhiễm nặng, chẳng hạn p(H 2S) =
5,1.10-9 atm, mầu trắng của PbCO3 để lâu trong không khí vẫn bị xám dần đi do sự hình
thành PbS. Hiện tượng này có thể giải thích như thế nào?
Để tính toán có thể sử dụng các dữ kiện và bảng sau: T= 298K; áp suất khí quyển p = 1,000 atm;
% thể tích của các khí và hơi trong không khí: N2 77,90; O2 20,70; CO2 0,026; H2O (h) 0,40; các khí khác: 1,03. PbCO3(r H2S(k PbS(r ZnO(r ZnS(r CO2(k H2O(h PbSO4(r H2O2(l ) ) ) ) ) ) ) ) )
ΔfG°298 - 626,0 - 33,0 - 92,6 - 318,0 - 184,8 - 394,2 - 228,5 - 811,5 120,4 kJ/mol Màu trắng đen trắng trắng trắng Hướng dẫn giải: + + 2- [H ] [H ][CO ] K 1. 3 a2 K = 632 2+ - 2+ - 2- [Pb ][HCO ] [Pb ][HCO ][CO ] T 3 3 3
2. a) Đối với phản ứng (1)
ΔG°(1) = (-92.6 – 394.2 – 228.5 + 626.0 + 33.0) kJ/mol = -56,3 kJ/mol
K(1) = e- ΔG°(1)/RT = e56300/8,314.298 = 7,4.109. Đối với phản ứng (2)
ΔG°(2)=(-184.8 -228.5 + 318.0 + 33.0) kJ/mol = - 62,3 kJ/mol
K(2) = e- ΔG°(2)/RT = e62300/8,314.298 = 8,3.1010
b) Đối với phản ứng (1) 4 3 ΔG(1)= 2.6 10 4 10 -RTlnK(1)+ RT.ln pH S 2
Điều kiện để (1) ưu thế theo chiều thuận: 4 3 2.6 10 4 10 ΔG(1) =-RTlnK(1) + RT.ln < 0 (a) pH S 2 4 3 → p 2.6 10 4 10 H2S > = 1,4.10-16 bar (b) 9 7, 4.10
Để bảo vệ được mầu trắng PbCO
S được phép trong không khí tối đa là: 3 thì nồng độ H2 57 Chuyên đề Kim loại
34.(1,4.10-16.1000 L)/(0,082 L.bar.mol-1.K-1.298K) = 1,9.10-13 g/m3 Đối với phản ứng (2) 3 4 10 ΔG(2) = - RTlnK(2) + RT.ln pH S 2
Điều kiện để (2) ưu thế theo chiều thuận: 3 4 10 ΔG(2) = - RTlnK(2) + RT.ln < 0 (c) pH S 2 3 → p 4 10 H2S > = 4,8.10-14 bar 10 8, 3.10
Để bảo vệ được mầu trắng ZnO thì nồng độ H S được phép trong không khí tối đa là: 2
34.(4,8.10-14.1000 L)/(0,082 L.bar.mol-1.K-1.298K) = 6,7.10-11 g/m3 c) ZnO ưu thế hơn vì:
- Phản ứng (1) Tự diễn biến ở những nồng độ H S nhỏ hơn; 2
- Sản phẩm của (1) là PbS có mầu đen còn sản phẩm của (2) là ZnS vẫn còn là mầu trắng.
d) PbS + 4H2O2 PbSO4 + H2O (3) e) PbS + 2 O2 PbSO4 (4)
ΔG° = -811.5 kJ/mol + 92.6 kJ/mol = - 718.9 kJ/mol 1 ΔG = - 718.9 kJ/mol + RT.ln = - 711,1 kJ/mol 2 207 . 0
Phản ứng (4) có thể tự diển ra trong không khí ở nhiệt độ 298 K. Oxi của không khí có
thể tái tạo màu trắng bằng cách oxi hóa PbS PbSO4.
g) Với p(H2S) = 5.1.10-9 bar thì 4 3 ΔG(1) = 2.6 10 4 10 -56,3 kJ/mol + RT∙ln -43 kJ/mol. 9 5,1.10
Trong không khí xảy ra đồng thời 2 quá trình: tạo ra và làm mất PbS. k PbCO 1 ... 3 (r) + H2S (k) PbS + O2 PbSO4 k2
Xét về phương diện nhiệt động học thì sự oxi hóa PbS bởi oxi không khí thuận lợi hơn rất
nhiều. Sự đổi màu của PbCO3 có thể là do phản ứng oxi hóa PbS bởi oxi không khí bị cản trở động học. 58 Chuyên đề Kim loại
Bài 7: (Đề thi chọn đội tuyển thi Olympic Quốc tế năm 2014)
Để xác định hàm lượng của Pb2O3 và Pb3O4 trong một mẫu phân tích, người ta
tiến hành 2 thí nghiệm như sau:
Thí nghiệm 1: Hòa tan hoàn toàn 0,3750 gam mẫu bằng tác nhân thích hợp để chuyển hóa
toàn bộ lượng chì thành Pb2+. Kết tủa hết lượng Pb2+ thu được dưới dạng PbCrO , sau đó 4
hòa tan kết tủa trong axit khi có KI dư. Chuẩn độ ngay giải phóng ra hết 21,90 mL dung dịch Na2S2O3 0,200 M.
Thí nghiệm 2: Cho 0,3750 gam mẫu tác dụng với HCl đặc. Hấp thụ hoàn toàn lượng khí
Cl2 thoát ra bằng dung dịch KI dư. Chuẩn độ ngay
giải phóng ra hết 6,24 mL dung dịch Na2S2O3 0,200 M.
a) Viết phương trình ion của các phản ứng xảy ra trong 2 thí nghiệm trên.
b) Tính % khối lượng của Pb2O3 và Pb3O4 trong mẫu phân tích. Hướng dẫn giải:
a) Phương trình phản ứng: Thí nghiệm 1: Pb2O3 ⟶ 2Pb2+ (1) Pb3O4 ⟶ 3Pb2+ (2) Pb2+ + CrO 2- 4 ⟶ PbCrO4↓ (3) 2PbCrO 2-
4 + 2H+ ⟶ 2Pb2+ + Cr2O7 + H2O (4) Cr 2- -
2O7 + 9I- + 14H+ ⟶ 2Cr3+ + 3I3 + 7H2O (5) I - 2- 2- 3 + 2S2O3 ⟶ S4O6 + 3I- (6)
Thí nghiệm 2 (PbO2 sẽ bị khử bởi HCl đặc): PbO.PbO ↓ + Cl ↑ + 3H 2 + 6H+ + 6Cl- ⟶ 2PbCl2 2 2O (7) (PbO) ↓ + Cl ↑ + 4H 2.PbO2 + 8H+ + 8Cl- ⟶ 3PbCl2 2 2O (8) Cl - 2 + 3I- ⟶ 2Cl- + I3 (9) I - 2- 2- 3 + 2S2O3 ⟶ S4O6 + 3I- (10)
b) Đặt khối lượng của Pb2O3 và Pb3O4 có trong mẫu lần lượt là a (gam) và b (gam); n là
số mol. Từ các phương trình trong thí nghiệm 1, ta có: 59 Chuyên đề Kim loại Từ thí nghiệm 2:
Từ (11) và (12) ⟶ b = 0,1452 g và a = 0,1903 g. Vậy %Pb2O3 = 50,75%; %Pb3O4 = 38,72%. PHẦN C: KẾT LUẬN I. KẾT LUẬN
Sau mô ̣t quá trình nghiên cứu chuyên đề chúng tôi đã chúng tôi đã thực hiện các nhiệm
vụ nghiên cứu và đạt được mục đích đề ra của chuyên đề. Cụ thể:
1. Xây dựng được một số vấn đề lí thuyết cơ bản và nâng cao về kim loại chuyển tiếp cho
học sinh chuyên hoá nhằm giúp các em vận dụng để giải được các dạng bài tập về kim
loại chuyển tiếp trong các kì thi học sinh giỏi khu vực và quốc gia…
2. Tiến hành xây dựng được hệ thống bài tập từ cơ bản đến nâng cao có kèm theo hướng
dẫn giải về kim loại chuyển tiếp học giúp cho việc giảng dạy ở trường chuyên và bồi
dưỡng học sinh giỏi thi Quốc gia, Quốc tế.
Thứ nhất: Các bài tập cơ bản. Những dạng bài này tương đối đơn giản, ngắn gọn
chủ yếu áp dụng trực tiếp kiến thức cơ bản để giải bài tập.
Thứ hai: Bài tập nhằm mục đích rèn kỹ năng học sinh. 60 Chuyên đề Kim loại
Thứ ba: bài tập mang tính chất tổng hợp trong đề thi HSG các năm. Giúp HS có
thể tự nghiên cứu lí thuyết và giải các bài tập nâng cao.
3. Đã áp dụng giảng dạy chuyên đề này trong quá trình ôn luyện đội tuyển thi Học sinh giỏi các cấp.
Kim loại chuyển tiếp và các dạng bài tập về mảng kim loại chuyển tiếp là một
trong các thành phần phức tạp trong mảng kiến thức về hoá học vô cơ do nội dung kiến
thức phức tạp và rộng, trong khi yêu cầu về kiến thức đối với đề thi cũng cao hơn nhiều
so với nội dung trong sách giáo khoa chuyên hóa học. Từ thực tế này, chúng tôi mong
muốn được góp phần vào việc làm phong phú hơn các nội dung kiến thức của phần kim
loại chuyển tiếp, nhằm đưa các kiến thức đến gần hơn với học sinh chuyên và HSG dự thi
học sinh giỏi Quốc gia.
D. DANH MỤC TÀI LIỆU THAM KHẢO
1. PGS – TS Lê Kim Long, Đại học Quốc gia Hà Nội, Chuyên đề: Một số vấn đề về tinh thể.
2. Nguyễn Văn Đức, Trường THPT Chuyên Hùng Vương, Phú Thọ, Chuyên đề: Phức chất.
3. Tuyển tập đề thi HSG Quốc gia và đề thi chọn đội tuyển thi Olympic Quốc tế các năm. 61




